向50 mL稀H 2 SO 4 与稀HNO 3 的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)
 东奔西走991682022-10-04 11:39:541条回答
东奔西走991682022-10-04 11:39:541条回答| 向50 mL稀H 2 SO 4 与稀HNO 3 的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如下图所示,且每一段只对应一个反应。下列说法正确的是() 
|

已提交,审核后显示!提交回复
共1条回复
 兵工厂看守 共回答了14个问题
兵工厂看守 共回答了14个问题 |采纳率92.9%- D OA段:Fe+4H + +NO 3 - =Fe 3 + +NO↑+2H 2 OAB段:2Fe 3 + +Fe=3Fe 2 + B以后:2H + +Fe=H 2 ↑+Fe 2 + A项错,B项错。C项,c(HNO 3 )=c(NO)= =1 mol·L -1 ,错误;D项,由...
- 1年前
相关推荐
- 以下关于铜跟浓、稀HNO 3 反应的说法中错误的是( ) A.1mol浓HNO 3 被还原转移1mol电子,而1mol
以下关于铜跟浓、稀HNO 3 反应的说法中错误的是( ) A.1mol浓HNO 3 被还原转移1mol电子,而1mol稀HNO 3 被还原3mol电子,故氧化性稀HNO 3 强于浓HNO 3 B.Cu与浓HNO 3 反应剧烈,故氧化性浓HNO 3 强于稀HNO 3 C.Cu与浓、稀HNO 3 反应都不需加热 D.生成等量的Cu(NO 3 ) 2 ,消耗浓HNO 3 的量多  hycjain1年前1
hycjain1年前1 -
 lfl-mm 共回答了17个问题
lfl-mm 共回答了17个问题 |采纳率94.1%A.浓硝酸与铜反应生成二氧化氮,稀硝酸与铜反应生成一氧化氮.硝酸的氧化性与其浓度有关,而与硝酸被还原成的价态无关,生成物的价态只反映生成了什么物质,故A错误.
B.因浓硝酸的氧化性比稀硝酸的氧化性强,故浓硝酸与铜反应比稀硝酸与铜反应剧烈,即浓硝酸比稀硝酸更容易与铜发生反应,故B正确.
C.Cu与浓、稀HNO 3 反应都可以不加热,而能在常温就能进行,故C正确.
D.根据Cu+4HNO 3 (浓)═Cu(NO 3 ) 2 +NO 2 ↑+2H 2 O和3Cu+8HNO 3 ═3Cu(NO 3 ) 2 +2NO↑+4H 2 O可知,生成3molCu(NO 3 ) 2 时,需要12mol浓硝酸,只需要8mol稀硝酸,即生成等量的Cu(NO 3 ) 2 ,消耗浓HNO 3 的量多.故D正确.
故选A.1年前查看全部
- 已知Mg与稀HNO 3 反应,还原产物是N 2 O;若HNO 3 极稀,则还原产物为NH 3 ,并与过量HNO 3 反应
已知Mg与稀HNO 3 反应,还原产物是N 2 O;若HNO 3 极稀,则还原产物为NH 3 ,并与过量HNO 3 反应生成NH 4 NO 3 ,现在9.6g Mg与1L1.1mol/LHNO 3 (过量)充分反应后收集到amL气体(标准状况.),同时测得c(NH 4 + )=0.08mol/L(设反应前后溶液体积不变),求:
(1)a=______mL.
(2)有______molHNO 3 被还原
(3)反应后溶液的c(H + )=______mol/L. hucijun1年前1
hucijun1年前1 -
 新的开始2004 共回答了15个问题
新的开始2004 共回答了15个问题 |采纳率80%(1)9.6g Mg的物质的量=
9.6g
24g/mol =0.4mol,n(NH 4 + )=0.08mol/L×1L=0.08mol,
根据电子转移守恒,n(N 2 O)×2×(5-1)+0.08mol×[5-(-3)]=0.4mol×2,解得n(N 2 O)=0.02mol,
故生成气体的体积=0.02mol×22.4L/mol=0.448L=448mL,即a=448,
故答案为:448;
(2)被还原的硝酸生成N 2 O、NH 4 + ,根据N原子守恒可知,被还有的硝酸的物质的量=0.02mol×2+0.08mol=0.12mol,
故答案为:0.12;
(3)原硝酸溶液中n(HNO 3 )=1.1mol/L×1L=1.1mol,反应后溶液中n(NH 4 + )=0.08mol,生成n(N 2 O)=0.02mol,根据氮原子守恒可知,反应后溶液中n(NO 3 - )=1.1mol-0.08mol-0.02mol×2=0.98mol,
根据电荷守恒可知,反应反应中n(H + )=0.98mol-0.08mol-0.4mol×2=0.1mol,
故反应后溶液中c(H + )=
0.1mol
1L 0.1mol/L,
故答案为:0.1.1年前查看全部
- 磁性氧化铁与稀HNO 3 发生反应:3Fe 3 O 4 +28HNO 3 =9Fe(NO 3 ) x +NO↑+14H
磁性氧化铁与稀HNO 3 发生反应:3Fe 3 O 4 +28HNO 3 =9Fe(NO 3 ) x +NO↑+14H 2 O。下列判断合理的是 [ ]A.Fe(NO 3 ) x 中的x为2
B.反应中每生成0.2mol还原产物,就有0.6mol电子转移
C.稀HNO 3 在反应中只作氧化剂
D.磁性氧化铁中的所有铁元素全部被氧化 宇文空明1年前1
宇文空明1年前1 -
 豹吻 共回答了17个问题
豹吻 共回答了17个问题 |采纳率100%B1年前查看全部
- 向某盐溶液中通入过量Cl 2 无明显现象,滴加Ba(NO 3 ) 2 溶液和稀HNO 3 后,有白色沉淀生成,则原溶液可
向某盐溶液中通入过量Cl 2 无明显现象,滴加Ba(NO 3 ) 2 溶液和稀HNO 3 后,有白色沉淀生成,则原溶液可能是( )
A.AgNO 3 溶液 B.CaCl 2 溶液 C.Na 2 SO 3 溶液 D.Na 2 CO 3 溶液  zzxian801年前1
zzxian801年前1 -
 paopaochristina 共回答了21个问题
paopaochristina 共回答了21个问题 |采纳率90.5%C
A错。硝酸银溶液中能入氯气有氯化银白色沉淀生成;B错,均无现旬;C正确,有硫酸钡沉淀产生;D错,通入过量氯气有气体生成,再滴加硝酸钡溶液无沉淀生成;1年前查看全部
- 某溶液中加入BaCl 2 溶液,生成白色沉淀,滴加稀HNO 3 ,沉淀不溶解,则该溶液中( ) A.只含有SO 4 2
某溶液中加入BaCl 2 溶液,生成白色沉淀,滴加稀HNO 3 ,沉淀不溶解,则该溶液中( ) A.只含有SO 4 2- B.只有Ag + C.可能含有SO 4 2- 或Ag + D.一定是SO 4 2- 和Ag +  春意阑珊雨1年前1
春意阑珊雨1年前1 -
 秦枫 共回答了17个问题
秦枫 共回答了17个问题 |采纳率88.2%向某溶液中加入BaCl 2 溶液,生成不溶于稀HNO 3 的白色沉淀,白色沉淀可能是硫酸钡或氯化银,如Na 2 SO 4 +BaCl 2 =BaSO 4 ↓+2NaCl;也可能为BaCl 2 +2AgNO 3 =Ba(NO 3 ) 2 +2AgCl↓;
故选C.1年前查看全部
- (12分)某学习小组为证明并观察铜与稀HNO 3 反应的产物是NO,设计了如下图所示的实验装置。请你根据他们的思路,回答
(12分)某学习小组为证明并观察铜与稀HNO 3 反应的产物是NO,设计了如下图所示的实验装置。请你根据他们的思路,回答有关的问题。

(一)实验仪器:大试管、玻璃导管、橡皮塞、烧杯、棉花、注射器。
(二)实验药品:铜丝、稀硝酸、碳酸钙颗粒、烧碱溶液。
(三)实验原理:
铜与稀硝酸反应的离子反应方程式 ① 。
(四)实验步骤:
1、按右图所示连接好装置,检验装置的 ② ;
2、向试管中加入一定量的固体药品(填化学式) ③ ,然后向试管中倒入过量的稀硝酸,并迅速塞紧带铜丝和导管的橡皮塞;
3、让试管中的反应进行一段时间后,用蘸有NaOH溶液的棉花团封住导管口;
4、将铜丝向下移动插入试管液体中,使之与稀硝酸反应;
5、把注射器的针孔插入试管口的橡皮塞中,缓慢向试管内推入空气。
(五)实验讨论:
1、实验步骤②的目的是(写出反应的离子方程式,结合文字说明)
④ ;
2、实验步骤⑤的目的是(写出反应的化学方程式,结合文字说明)
⑤ 。
(六)实验评价:
该装置的优点是(任写一个即可) ⑥ ;
有同学提出:增加右图所示装置,在步骤②完成后,当有明显现象再撤去该装置,并继续步骤③的“用蘸有NaOH溶液的棉花团封住导管口”。请评价他的做法 ⑦ 。
 红樱桃儿1年前1
红樱桃儿1年前1 -
 littlemonkey929 共回答了12个问题
littlemonkey929 共回答了12个问题 |采纳率75%① 3Cu + 8H + + 2NO 3 - = 3Cu 2+ + 2NO↑+ 4H 2 O(2分)②气密性(1分) ③CaCO 3 (1分)
④ CaCO 3 + 2H + = Ca 2+ + CO 2 ↑+ H 2 O (2分),利用CO 2 排出试管中的空气,防止O 2 与NO反应(1分)
⑤ 2NO + O 2 = 2NO 2 (1分),气体由无色变红棕色证明Cu与稀硝酸反应生成NO(1分)
⑥使用可抽动的铜丝能随时控制反应的开始和结束,节约药品用量,减少污染气体的产生。(或使用蘸有NaOH溶液的棉花团封住导管口,可防止NO和NO 2 气体逸出污染大气。)(2分)
⑦通过石灰水变浑浊的现象准确判断试管内无空气后,才进行步骤④,使得出的结论更科学。(1分)
①硝酸是氧化性酸,能和铜发生氧化还原反应,方程式为3Cu + 8H + + 2NO 3 - = 3Cu 2+ + 2NO↑+ 4H 2 O。
②制气装置连接好后,首先检验装置的气密性。
③由于装置中含有空气,会氧化生成的NO,从而干扰实验,所以需要先排尽装置中的空气。可以利用硝酸和碳酸钙反应生成的CO 2 来实现,即加入的固体药品是碳酸钙,反应的方程式为CaCO 3 + 2H + = Ca 2+ + CO 2 ↑+ H 2 O。
⑤由于NO极易被氧化生成红棕色NO 2 ,所以目的是证明Cu与稀硝酸反应生成NO的,方程式为2NO + O 2 = 2NO 2 。
⑥评价实验可以从操作的难易程度、尾气的处理、实验现象等考虑。根据装置及实验过程可知,优点是使用可抽动的铜丝能随时控制反应的开始和结束,节约药品用量,减少污染气体的产生。(或使用蘸有NaOH溶液的棉花团封住导管口,可防止NO和NO 2 气体逸出污染大气。)
⑦由于在排空气时,无法判断是否完全排尽,所以通过石灰水变浑浊的现象,来准确判断试管内无空气后,才进行步骤④,使得出的结论更科学。1年前查看全部
- 欲证明某种无色溶液中含有SO 4 2- 离子,应该选择的试剂是( ) A.石蕊试液 B.BaCl 2 和稀HNO 3
欲证明某种无色溶液中含有SO 4 2- 离子,应该选择的试剂是( ) A.石蕊试液 B.BaCl 2 和稀HNO 3 C.Ba(NO 3 ) 2 和稀HNO 3 D.KNO 3  swclfy1年前1
swclfy1年前1 -
 419821012 共回答了14个问题
419821012 共回答了14个问题 |采纳率85.7%A、石蕊试液是检验溶液酸碱性的,并不能检验是否含有SO 4 2- 离子.故A错误;
B、加入BaCl 2 和稀HNO 3 后,如果某种无色溶液中含有银离子,也会出现不溶于稀硝酸的白色沉淀.故B错误;
C、加入Ba(NO 3 ) 2 和稀HNO 3 后,产生不溶于稀硝酸的白色沉淀,则证明某种无色溶液中含有SO 4 2- 离子.故C正确;
D、KNO 3 与SO 4 2- 离子不反应,没有现象.故D错误;
故选C.1年前查看全部
- 某学习小组为证明并观察铜与稀HNO 3 反应的产物是NO,设计了如下图所示的实验装置。请你根据他们的思路,完成下述的实验
某学习小组为证明并观察铜与稀HNO 3 反应的产物是NO,设计了如下图所示的实验装置。请你根据他们的思路,完成下述的实验报告。

(1)实验仪器:试管、导管、烧杯、棉花、注射器。
(2)实验药品:铜丝、稀硝酸、烧碱溶液、铁粉、CaCO 3 颗粒。
(3)实验原理:
铜与稀硝酸的离子反应方程式 。
(4)实验步骤:
①实验开始时,必须进行的第一步操作是检验装置的 ;
②向试管中加入一定量的固体药品 ,然后向试管中倒入过量的稀硝酸,并迅速塞紧带铜丝和导管的橡皮塞;
③反应一段时间后,用蘸有NaOH溶液的棉花团封住导管口;
④将铜丝向下移动插入试管液体中,使之与硝酸反应;
⑤将注射器插入试管口的橡皮塞中,向试管内推入空气。
(5)实验讨论:
①实验步骤②的目的是 ;
②实验步骤③的目的是 ;
③实验步骤⑤观察到的现象是 。
(6)实验评价:
该装置的优点是(只填一个优点即可) 。 54ant1年前1
54ant1年前1 -
 小雨点在沧海 共回答了15个问题
小雨点在沧海 共回答了15个问题 |采纳率86.7%(12分)(3)3Cu+8H + + 2NO 3 - =3Cu 2+ + 2NO↑+ 4H 2 O(2分)
(4)①气密性;(1分)②CaCO 3 颗粒(1分)
(5)①排出试管中的空气,防止与NO反应(2分);②使用NaOH溶液吸收产生的NO和NO 2 气体,防止逸出污染空气(2分);③气体由无色变红棕色(2分)
(6)使用可抽动的铜丝能随时控制反应的开始和结束,节约药品用量,减少污染气体的产生。(2分)(或使用蘸有NaOH溶液的棉花团封住导管口,可防止NO和NO 2 气体逸出污染大气。)
1年前查看全部
- 下列说法中正确的是( ) A.向某溶液中滴加AgNO 3 溶液和稀HNO 3 ,产生白色沉淀.该溶液一定是稀盐酸 B.
下列说法中正确的是( ) A.向某溶液中滴加AgNO 3 溶液和稀HNO 3 ,产生白色沉淀.该溶液一定是稀盐酸 B.可用适量的硝酸钡溶液,除去氯化钠溶液中混有的碳酸钠,得到纯净的氯化钠 C.要除去铜粉中混有的少量炭粉,可采用在空气中充分灼烧混合物的方法 D.有盐和水生成的反应不一定是中合反应  teamtech1年前1
teamtech1年前1 -
 一直在路上zs 共回答了17个问题
一直在路上zs 共回答了17个问题 |采纳率82.4%A、向溶液中加入AgNO 3 溶液和稀HNO 3 ,产生白色沉淀,证明溶液中含有氯离子,不能证明一定是盐酸,故A错误;
B、加入适量硝酸钡溶液,硝酸钡和碳酸钠反应生成碳酸钡和硝酸钠,除去了碳酸钠,引入了新的杂质硝酸钠,得不到纯净的氯化钠,故B错误;
C、除去铜粉中混有的少量炭粉,在空气中充分灼烧炭粉和氧气生成二氧化碳除去,但铜和氧气反应生成了氧化铜,故C错误;
D、中和反应为酸和碱反应生成盐和水的反应,但有盐和水生成的反应不一定是中和反应,如氢氧化钠和碳酸氢钠反应生成盐和水,不是中和反应,故D正确.
故选D.1年前查看全部
- 有一混合溶液由稀HNO 3 、K 2 CO 3 、H 2 SO 4 、CuCl 2 四种物质中的二种混合而成.向该混合溶
有一混合溶液由稀HNO 3 、K 2 CO 3 、H 2 SO 4 、CuCl 2 四种物质中的二种混合而成.向该混合溶液中滴入Ba(OH) 2 溶液,产生沉淀的质量与加入Ba(OH) 2 溶液体积的关系如图所示.判断:该混合物是由______组成. 
 追夜1年前1
追夜1年前1 -
 siyan0323 共回答了22个问题
siyan0323 共回答了22个问题 |采纳率86.4%根据图象分析可知,加入20mL氢氧化钡溶液,没有沉淀出现,说明混合溶液中有硝酸.因为硝酸和碳酸钾不能同时存在,所以溶液中没有碳酸钾.因为硫酸钡不会被硝酸溶解,所以溶液中没有硫酸.因为氢氧化铜可以被硝酸溶解,所以溶液中有氯化铜.总上所述,溶液中的两种溶质是硝酸和氯化铜,故答案为:HNO 3 ,CuCl 21年前查看全部
- 下列物质在常温下相互混合后,能产生氢气的是 [ ] A.Fe与稀HNO
下列物质在常温下相互混合后,能产生氢气的是 [ ]A.Fe与稀HNO 3 溶液
B.Na 2 O 2 与CO 2 气体
C.Al与浓NaOH溶液
D.SiO 2 固体与浓NaOH溶液 青头儿萝卜丝丝1年前1
青头儿萝卜丝丝1年前1 -
 123xl 共回答了19个问题
123xl 共回答了19个问题 |采纳率94.7%C1年前查看全部
- Cu 2 S和稀HNO 3 反应生成Cu(NO 3 ) 2 、H 2 SO 4 、NO和H 2 O,试解答下列各题
Cu 2 S和稀HNO 3 反应生成Cu(NO 3 ) 2 、H 2 SO 4 、NO和H 2 O,试解答下列各题
(1)配平上述反应方程式并标出电子转移的方向和总数________________________
(2)当产生0.1mol NO时,转移电子总数为________,被还原的物质为_________mol,共耗HNO 3 ______mol。
(3)被1mol Cu 2 S中+1价亚铜离子还原的HNO 3 的物质的量是_______mol fhby11年前1
fhby11年前1 -
 sammiiy 共回答了7个问题
sammiiy 共回答了7个问题 |采纳率85.7%1年前查看全部
- 在下列反应中,其离子方程式不能用H + +OH - =H 2 O表示的是( ) A.Ba(OH) 2 溶液与稀HNO
在下列反应中,其离子方程式不能用H + +OH - =H 2 O表示的是( ) A.Ba(OH) 2 溶液与稀HNO 3 B.Cu(OH) 2 与稀HNO 3 C.NaOH溶液与NaHSO 4 溶液 D.KOH溶液与盐酸溶液  wangyay1年前1
wangyay1年前1 -
 yoyoyang 共回答了21个问题
yoyoyang 共回答了21个问题 |采纳率95.2%A.Ba(OH) 2 溶液与稀HNO 3 反应生成硝酸钡和水,可用H + +OH - =H 2 O表示,故A不选;
B.Cu(OH) 2 为不溶于水的弱碱,在离子反应中应保留化学式,则Cu(OH) 2 与稀HNO 3 不能用H + +OH - =H 2 O表示,故B选;
C.NaOH溶液与NaHSO 4 溶液反应生成硫酸钠和水,则可用H + +OH - =H 2 O表示,故C不选;
D.KOH溶液与盐酸溶液反应生成氯化钾和水,则可用H + +OH - =H 2 O表示,故D不选;
故选B.1年前查看全部
- (8分)某学习小组为证明并观察铜与稀HNO 3 反应的产物是NO,设计了如下图所示的实验装置。请你根据他们的思路,选择下
(8分)某学习小组为证明并观察铜与稀HNO 3 反应的产物是NO,设计了如下图所示的实验装置。请你根据他们的思路,选择下列药品完成实验,填写实验步骤并回答问题。
供选择的药品:铜丝、稀硝酸、烧碱溶液、铁粉、CaCO 3 颗粒。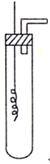
(一)实验步骤:
(1)实验开始时,必须进行的第一步操作是检验装置的 ;
(2)向试管中加入一定量的固体药品 ,其目的是 ;然后向试管中倒入过量的稀硝酸,并迅速塞紧带铜丝和导管的橡皮塞;
(3)反应一段时间后,用蘸有NaOH溶液的棉花团封住导管口;
(4)将铜丝 向下移动插入试管液体中,使之与硝酸反应,反应的离子方程式是 ;
向下移动插入试管液体中,使之与硝酸反应,反应的离子方程式是 ;
(5)将注射器插入试管口的橡皮塞中,向试管内推入空气,现象是
;
(二)问题探究:分别将等质量的铜片与等体积过量的浓、稀硝酸反应,所得溶液前者
呈绿色、后者呈蓝色,某同学认为可能是Cu 2+ 浓度的差异引起的,你认为是否正确?
(填“正确”或“不正确”),理由是

 wangyagang1年前1
wangyagang1年前1 -
 puchangyu 共回答了16个问题
puchangyu 共回答了16个问题 |采纳率100%1年前查看全部
大家在问
- 1下列属于高雅生活情趣的是 [ ] ①小明喜欢弹琴,经常在闲暇时练琴
- 2what kind of the movie Harry Potter?
- 3They are -- brothers,but they look different
- 4Toat me fait penser a toi怎么翻译?
- 5在文言文中,如何区别“而”字的意思?
- 6This is( )desk.应该怎么回答
- 7《夏感》最后一段作者写道夏季“总是浸在苦涩的汗水里”,结尾处又“想大声赞美……黄金的夏季”.
- 8英语翻译应该翻译成“在...的两边”还是“在...的一边”啊?
- 9用4个6和4个0组成符合下面要求的八位数.
- 10设i是曲线y=x²+3在点(1,4)处的切线,求由该曲线,切线l及y轴围成的平面图形的面积
- 11求英语高手翻译一个标题.逝者的尊严—由死亡委婉语折射的中西葬礼文化差异. 毕业论文标题,能翻译的贴上答案,谢谢了.
- 12in silently怎么造句 和happen 和 take place
- 13将以下单词组合成一个句子car,is,of,new,sharing,transportation,beginning,a
- 14到了高中怎么补上去?我属于偏科生 初中的英语成绩比较差 到了高中怎么补上去?这个暑假怎么利用? 刚中考玩 120
- 15一个圆锥形铁块的体积是180立方厘米,比与它等底等高的圆柱的体积少多少


