三酸两碱为什么要被称为三酸两碱?
 sunspider2022-10-04 11:39:541条回答
sunspider2022-10-04 11:39:541条回答我的意思是他们有什么相似之处或者与其他的有什么不同之处吗
为什么要给出这样一个特殊的名称来称呼这五个呢

已提交,审核后显示!提交回复
共1条回复
 轩轩语 共回答了15个问题
轩轩语 共回答了15个问题 |采纳率80%- 三酸:盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)
两碱:烧碱(氢氧化钠NaOH)、纯碱(碳酸钠Na2CO3).
三酸,是工业上最常用的3种强酸.
两碱,实际上是两种碱性物质,因为Na2CO3属于盐,不是碱,但Na2CO3水溶液为碱性.
因为他们很常用,简称叫起来方便 - 1年前
相关推荐
- (2004•扬州)“三酸两碱”是几种重要的化工原料.下图是九种化合物相互间的反应关系.
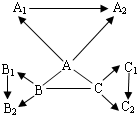 (2004•扬州)“三酸两碱”是几种重要的化工原料.下图是九种化合物相互间的反应关系.
(2004•扬州)“三酸两碱”是几种重要的化工原料.下图是九种化合物相互间的反应关系.
已知①A、A1、A2是工业上三大常见的强酸,B、B1、B2是正盐,C、C1、C2是碱.
②B2是食盐的主要成分,且B、B1、B2、C1中含有相同的金属阳离子.
③A+B→CO2↑,
B+C→难溶于水的白色沉淀
沉淀完全溶解,并产生二氧化碳,+A2
A+C→难溶于水的白色沉淀
沉淀不溶解+A2
请回答:(1)有关物质的化学式:B2______,C1______.
(2)有关反应的化学方程式:
A+B:______;
B+C:______;
A+C:______.
(3)C2可能的化学式(写两个):______、______. lfz00431年前1
lfz00431年前1 -
 bobwin 共回答了14个问题
bobwin 共回答了14个问题 |采纳率85.7%解题思路:根据A、A1、A2是工业上三大常见的强酸,所以A、A1、A2是盐酸、硫酸、硝酸,B2是食盐的主要成分,且B、B1、B2、C1中含有相同的金属阳离子,所以B2是氯化钠,B、B1、B2、C1中含有钠离子,B、B1、B2是正盐,B会转化成B1、氯化钠,B1会转化成氯化钠,+B→CO2↑,所以B是碳酸钠,B1是硫酸钠,C1是氢氧化钠,A、C、碳酸钠会相互反应,+C→难溶于水的白色沉淀
沉淀完全溶解,并产生二氧化碳,A+C→难溶于水的白色沉淀+A2
沉淀不溶解,所以A是硫酸,A1是盐酸,A2是硝酸,硫酸和C会生成不溶于硝酸的白色沉淀,所以C是氢氧化钡,氢氧化钡和氢氧化钠会转化成C2,所以C2是不溶性碱,将推出的物质验证即可;+A2
根据推出的物质解答下面的问题.(1)A、A1、A2是工业上三大常见的强酸,所以A、A1、A2是盐酸、硫酸、硝酸,B2是食盐的主要成分,且B、B1、B2、C1中含有相同的金属阳离子,所以B2是氯化钠,B、B1、B2、C1中含有钠离子,B、B1、B2是正盐,B会转化成B1、氯化钠,B1会转化成氯化钠,+B→CO2↑,所以B是碳酸钠,B1是硫酸钠,C1是氢氧化钠,A、C、碳酸钠会相互反应,+C→难溶于水的白色沉淀
+A2
沉淀完全溶解,并产生二氧化碳,A+C→难溶于水的白色沉淀
+A2
沉淀不溶解,所以A是硫酸,A1是盐酸,A2是硝酸,硫酸和C会生成不溶于硝酸的白色沉淀,所以C是氢氧化钡,氢氧化钡和氢氧化钠会转化成C2,所以C2是不溶性碱,经过验证,各种物质都满足转化关系,故答案为:NaCl,NaOH;
(2)硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳,故答案为:H2SO4+Na2CO3=Na2SO4+H2O+CO2↑;
碳酸钠和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,故答案为:Na2CO3+Ba(OH)2=BaCO3↓+2NaOH;
硫酸和氢氧化钡反应生成硫酸钡沉淀和水,故答案为:H2SO4+Ba(OH)2=BaSO4↓+2H2O.
(3)氢氧化钡和氢氧化钠会转化成C2,所以C2是不溶性碱,故答案为:Cu(OH)2,Mg(OH)2.点评:
本题考点: 酸、碱、盐的鉴别;物质的鉴别、推断;书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质题中的转换关系推导剩余的物质,最后进行验证即可.1年前查看全部
- (2009•常州二模)工业上的常说“三酸两碱”是重要的化工原料.实验室桌面上的五个试剂瓶内(如下图)分别装有属于工业上“
(2009•常州二模)工业上的常说“三酸两碱”是重要的化工原料.实验室桌面上的五个试剂瓶内(如下图)分别装有属于工业上“三酸两碱”中的“三种浓酸”和“两碱固体”.
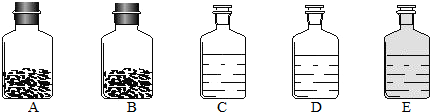
(1)小袁同学没有利用任何试剂就鉴定出了C、D、E三瓶中的三种浓酸.他的做法是:①直接观察试剂瓶颜色,棕色试剂瓶E内的是______(填名称);②分别打开C、D瓶的瓶塞,观察到______,说明C瓶内的是浓盐酸,D瓶内的是浓硫酸.
(2)小白同学在查阅A、B瓶内的“两碱”的制备方法时,根据收集的信息,绘制了一个框图.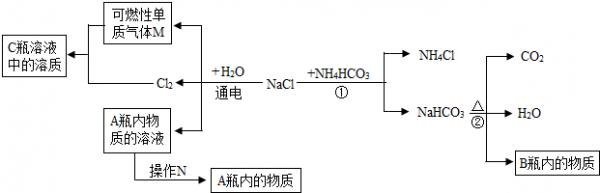
注:整个框图中每个化学反应涉及的物质已全部给出.
根据框图,依据化学反应前后元素种类守恒的相关知识,回答下列问题.
Ⅰ.写出下列物质化学式:B瓶内的物质:______.
Ⅱ.框图中的①反应所属的反应类型是______,操作N的名称是______.
Ⅲ.请选用一种物理方法鉴别A、B瓶内的物质:______.
(3)小顾同学想利用D瓶内溶质质量分数为98%的浓硫酸来配制10%的稀硫酸196g,他应取浓硫酸______g,还需要水(密度约为1g/cm3)______mL.配制时应注意______. klder1年前1
klder1年前1 -
 sunhongyujing 共回答了16个问题
sunhongyujing 共回答了16个问题 |采纳率81.3%解题思路:(1)根据浓硝酸和浓盐酸易挥发进行分析,
(2)氯化钠和水通电后生成了氯气,和可燃性的气体单质M,根据质量守恒定律可知,M是氢气,A是氢氧化钠,
I、碳酸氢钠受热后生成了水、二氧化碳和B,根据质量守恒定律可知,B是碳酸钠,
II、根据反应①中的反应物和生成物的特点进行分析,
根据操作N可以将固体从液体分离来分析,
III、根据氢氧化钠溶于水有明显的温度变化进行分析,
(3)根据稀释前后溶液中的溶质质量不变进行分析,
根据浓硫酸稀释时的注意事项进行分析.(1)浓硝酸有强烈的挥发性,浓硝酸因溶解由分解产生的NO2而呈黄色,常将浓硝酸盛放在棕色试剂瓶中,浓盐酸会发出的氯化氢气体和空气中的水蒸气结合形成的盐酸小液滴,在瓶口形成白雾,
故答案为:浓硝酸; C瓶的瓶口冒白雾
(2)Ⅰ.根据质量守恒定律可知,碳酸氢钠在受热后分解成碳酸钠、水和二氧化碳,故答案为:Na2CO3,
Ⅱ.①反应是两种化合物反应生成了两种化合物的反应,满足复分解反应的条件,故答案为:复分解反应
蒸发是使固体从液体之后析出的一种操作方法,A瓶内物质的溶液经过操作N分离出了固体,故答案为:蒸发
Ⅲ.氢氧化钠在水中溶解时会放出大量的热,故答案为:分别从两瓶内取少量固体溶于水,明显放热的为NaOH,否则为Na2CO3
(3)设应取浓硫酸X克,
X×98%=196×10%
X=20克
(196-20)÷1=176
故答案为:20; 176
浓硫酸溶于水会放出大量的热,故答案为:要将浓硫酸慢慢注入水中,并用玻璃棒不断搅拌.点评:
本题考点: 酸、碱、盐的鉴别;一定溶质质量分数的溶液的配制;有关溶质质量分数的简单计算;酸的物理性质及用途;碱的化学性质;碳酸钠、碳酸氢钠与碳酸钙.
考点点评: 在做此类题时,首先要知道需要鉴别的物质的有哪些特性,然后根据这些性质设计实验进行验证.1年前查看全部
- "三酸两碱"是指哪些物质?
 无赖小侃1年前2
无赖小侃1年前2 -
 越野的心 共回答了17个问题
越野的心 共回答了17个问题 |采纳率88.2%盐酸、硫酸、硝酸.
烧碱(氢氧化钠),纯碱(碳酸钠)1年前查看全部
- 化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱.
化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱.
(1)从物质的分类角度看,名不符实的一种物质是______.
(2)“三酸”与“两碱”之间均可反应,若用化学方程式表示有六个(酸过量时),若用离子方程式表示却只有两个,请写出这两个离子方程式(酸过量时):______;______.
(3)“三酸”常用于溶解金属和金属氧化物.下列块状金属在常温时能全部溶于足量浓硝酸的是______(填序号)
A.Ag B.CuC.AlD.Fe
(4)烧碱、纯碱溶液均可吸收CO2,当含0.2mol NaOH的溶液吸收一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况,分别是:①______;②Na2CO3;③______;④NaHCO3.
将得到的固体重新溶解于水,在溶液中加过量的盐酸,使其充分反应后,得到溶液所含溶质的质量为______g. 466070701年前1
466070701年前1 -
 nellresponsible 共回答了12个问题
nellresponsible 共回答了12个问题 |采纳率100%解题思路:(1)纯碱是碳酸钠,属于盐;
(2)硝酸、硫酸和盐酸与烧碱反应本质是氢离子与氢氧根离子反应生成水;
过量的硝酸、硫酸和盐酸与碳酸钠反应本质是氢离子与碳酸根反应生成二氧化碳与水;
(3)浓硝酸具有强氧化性,可以溶解除金外的大多数常见金属金属,但Al、Fe在浓硝酸中发生钝化现象;
(4)0.2mol NaOH的溶液吸收一定量CO2后,根据吸收二氧化碳的量,溶液中溶质可能为:NaOH、Na2CO3或 Na2CO3或Na2CO3、NaHCO3或NaHCO3;
NaOH、Na2CO3、NaHCO3都与盐酸反应生成NaCl,根据钠离子守恒n(NaCl)=n(NaOH),根据m=nM计算氯化钠的质量.(1)硝酸、硫酸和盐酸属于酸,烧碱是氢氧化钠,属于碱,纯碱是碳酸钠,属于盐,
故答案为:纯碱;
(2)硝酸、硫酸和盐酸与烧碱反应本质是氢离子与氢氧根离子反应生成水,反应离子方程式为:H++OH-=H2O;
过量的硝酸、硫酸和盐酸与碳酸钠反应本质是氢离子与碳酸根反应生成二氧化碳与水,反应离子方程式为:2H++CO32-=CO2+H2O,
故答案为:H++OH-=H2O;2H++CO32-=CO2+H2O;
(3)浓硝酸具有强氧化性,可以溶解Ag、Cu,但Al、Fe在浓硝酸中发生钝化现象,不能溶解Al、Fe,
故答案为:AB;
(4)0.2mol NaOH的溶液吸收一定量CO2后,根据吸收二氧化碳的量,溶液中溶质可能为:NaOH、Na2CO3或 Na2CO3或Na2CO3、NaHCO3或NaHCO3,故溶液低温蒸干得到固体的组成为:NaOH、Na2CO3或 Na2CO3或Na2CO3、NaHCO3或NaHCO3,
NaOH、Na2CO3、NaHCO3都与盐酸反应生成NaCl,根据钠离子守恒n(NaCl)=n(NaOH)=0.2mol,gu 氯化钠的质量=0.2mol×58.5g/mol=11.7g,
故答案为:NaOH、Na2CO3;Na2CO3、NaHCO3;11.7.点评:
本题考点: 酸、碱、盐、氧化物的概念及其相互联系.
考点点评: 本题考查物质分类、硝酸性质、氢氧化钠的性质与计算等,比较基础,注意对基础知识的理解掌握.1年前查看全部
- 化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱.(1)从物质的分类角度来看,不恰当的一
化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱.
(1)从物质的分类角度来看,不恰当的一种物质是________.
(2)“三酸”与“两碱”之间均可反应,酸过量时若用化学方程式表示有六个,若用离子方程式表示却只有两个,请写出这两个离子方程式________________________________________________________________________________________________________________________________________________,
这六个反应反应类型属________.
(3)“三酸”常用于溶解金属和金属氧化物.下列块状金属在常温时能全部溶于足量浓硝酸的是________.
A.Ag B.Cu
C.Al D.Fe
(4)烧碱、纯碱均可吸收CO2,当含0.1 mol NaOH的溶液吸收一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况,分别是:①________;②Na2CO3;③________;④NaHCO3.
 9211yuer1年前1
9211yuer1年前1 -
 cfj18837 共回答了15个问题
cfj18837 共回答了15个问题 |采纳率100%(1)纯碱(2)CO32-+2H+===CO2↑+H2O、H++OH-===H2O 复分解反应(3)AB (4)①NaOH和Na2CO3 ③Na2CO3和NaHCO31年前查看全部
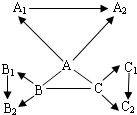
- “三酸两碱”是几种重要的化工原料.下图是九种化合物相互间的反应关系.
“三酸两碱”是几种重要的化工原料.下图是九种化合物相互间的反应关系.
已知①A、A 1 、A 2 是工业上三大常见的强酸,B、B 1 、B 2 是正盐,C、C 1 、C 2 是碱.
②B 2 是食盐的主要成分,且B、B 1 、B 2 、C 1 中含有相同的金属阳离子.
③A+B→CO 2 ↑,
B+C→难溶于水的白色沉淀
沉淀完全溶解,并产生二氧化碳,+ A 2
A+C→难溶于水的白色沉淀
沉淀不溶解+ A 2
请回答:(1)有关物质的化学式:B 2 ______,C 1 ______.
(2)有关反应的化学方程式:
A+B:______;
B+C:______;
A+C:______.
(3)C 2 可能的化学式(写两个):______、______.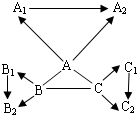
 sissi2121年前1
sissi2121年前1 -
 jg2lxf 共回答了22个问题
jg2lxf 共回答了22个问题 |采纳率81.8%(1)A、A 1 、A 2 是工业上三大常见的强酸,所以A、A 1 、A 2 是盐酸、硫酸、硝酸,B 2 是食盐的主要成分,且B、B 1 、B 2 、C 1 中含有相同的金属阳离子,所以B 2 是氯化钠,B、B 1 、B 2 、C 1 中含有钠离子,B、B 1 、B 2 是正盐,B会转化成B 1 、氯化钠,B 1 会转化成氯化钠,+B→CO 2 ↑,所以B是碳酸钠,B 1 是硫酸钠,C 1 是氢氧化钠,A、C、碳酸钠会相互反应,+C→难溶于水的白色沉淀
+ A 2
沉淀完全溶解,并产生二氧化碳,A+C→难溶于水的白色沉淀
+ A 2
沉淀不溶解,所以A是硫酸,A 1 是盐酸,A 2 是硝酸,硫酸和C会生成不溶于硝酸的白色沉淀,所以C是氢氧化钡,氢氧化钡和氢氧化钠会转化成C 2 ,所以C 2 是不溶性碱,经过验证,各种物质都满足转化关系,故答案为:NaCl,NaOH;
(2)硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳,故答案为:H 2 SO 4 +Na 2 CO 3 =Na 2 SO 4 +H 2 O+CO 2 ↑;
碳酸钠和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,故答案为:Na 2 CO 3 +Ba(OH) 2 =BaCO 3 ↓+2NaOH;
硫酸和氢氧化钡反应生成硫酸钡沉淀和水,故答案为:H 2 SO 4 +Ba(OH) 2 =BaSO 4 ↓+2H 2 O.
(3)氢氧化钡和氢氧化钠会转化成C 2 ,所以C 2 是不溶性碱,故答案为:Cu(OH) 2 ,Mg(OH) 2 .1年前查看全部
- (2012•镇江一模)工业上的常说“三酸两碱”是重要的化工原料.实验室桌面上的五个试剂瓶内(如图)分别装有属于工业上“三
(2012•镇江一模)工业上的常说“三酸两碱”是重要的化工原料.实验室桌面上的五个试剂瓶内(如图)分别装有属于工业上“三酸两碱”中的“三种浓酸”和“两碱固体”.

(1)小袁同学没有利用任何试剂就鉴定出了C、D、E三瓶中的三种浓酸.他的做法是:①直接观察试剂瓶颜色,棕色试剂瓶E内的是______(填名称);②分别打开C、D瓶的瓶塞,观察到______,说明C瓶内的是浓盐酸,则D瓶内的是浓硫酸.
(2)小白同学在查阅A、B瓶内的“两碱”的制备方法时,根据收集的信息,绘制了如下一个框图.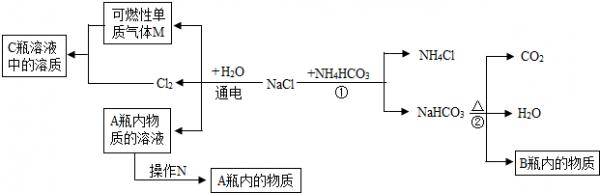
注:整个框图中每个化学反应涉及的物质已全部给出.
根据框图,依据化学反应前后元素种类守恒的相关知识,回答下列问题.
写出下列物质化学式:A瓶内的物质:______.
小袁同学认为工业生产中原料不能完全转化为产品,所以A瓶内的物质中一定含有杂质.请你帮助他设计出检验该杂质的实验方案(写出操作、现象和结论):______
(3)小军对A瓶放置一段时间后白色粉末的成分进行探究.成分的确定作出以下的猜想:①可能是NaOH;②可能是Na2CO3;③可能是NaOH与Na2CO3的混合物.做出②③猜想的依据是______(用化学方程式表示)为了验证①②③猜想,他分别做了下面的实验.A.取少量白色粉末于试管中,再滴加稀HCl,有气泡产生,由此可推出白色粉末中一定含有,肯定猜想______(填序号)是错误的.B.小军又取少量白色粉末溶于水,向所得溶液中滴加酚酞试液,溶液变为红色.于是认为猜想3成立,请提出你的看法,并说出理由:______.C.为探究猜想③是正确的,小红设计了如下实验方案: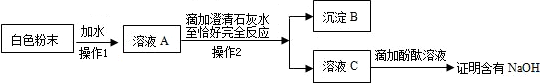
沉淀B的化学式为______.你若认为小红的这个方案有问题,稍加改进,就可以证明粉末中还含有NaOH,则改进的方法是______.
(4)过氧化钠(Na2O2)是一种白色固体,这种物质在与水或二氧化碳作用时可得到上述的“两碱”,在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验装置中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来.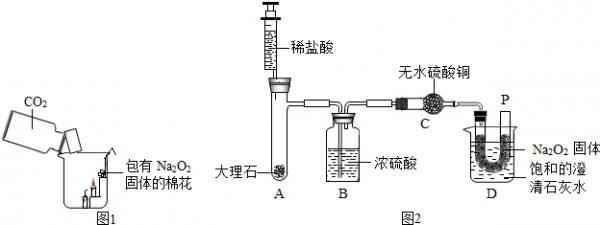
a.棉花为什么会燃烧呢?小组同学认为棉花要燃烧,除了满足“棉花是可燃物”这一条件,还另需满足
a:______、b______条件.
【提出问题】在上述实验中如何给棉花提供a和b这两个燃烧条件呢?
【查阅资料】1、在常温下Na2O2能和CO2发生化学反应.
2、在常温下Na2O2能和水发生反应:2Na2O2+2H2O═4NaOH+O2↑
3、浓硫酸具有强吸水性.无水硫酸铜为白色固体,吸水后变为蓝色.
【设计实验】经过讨论后,小组同学设计了如下图2的实验进行探究.
【实验步骤】①检查整套装置的气密性;②把相关的试剂放入对应的仪器内(D装置的U型管内放有一定量的Na2O2固体,烧杯内盛有饱和的澄清石灰水),并按图2组装整套实验仪器;③用力推动针管的活塞,把稀盐酸注入试管内;④一段时候后,在P处放置一根带火星的小木条,观察现象.
注:整个实验中不考虑稀盐酸的挥发和空气对实验的影响.
【实验现象】①无水硫酸铜没有变蓝色;②带火星的小木条复燃;③饱和澄清石灰水变浑浊.
【实验分析】①C装置无水硫酸铜的作用是______
②D装置的烧杯内饱和的澄清石灰水的作用是______
(5)现要对放置一段时间的B瓶中的固体物质进行成分的定量测定:电子天平共同作了以下测定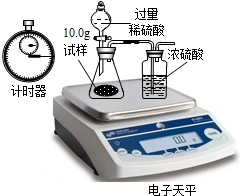
实验数据记录如下:
试通过分析表中数据计算出图2B瓶中纯碳酸钠的质量分数.(写出计算过程)称量项目 称量时 间 质量(g) 试样 10.00 装置+稀硫酸质量 241.30 装置+稀硫酸质量+试样 反应开始后15秒 249.20 装置+稀硫酸质量+试样 反应开始后35秒 248.20 装置+稀硫酸质量+试样 反应开始后55秒 248.00
实验反思:
有同学提出按上述实验所测得试样中Na2CO3质量分数会偏小,该同学的理由是(实验操作均正确):______. xlredwolf1年前1
xlredwolf1年前1 -
 就一是 共回答了23个问题
就一是 共回答了23个问题 |采纳率87%解题思路:(1)根据酸的性质可知,浓硝酸见光易分解,则应保存在棕色试剂瓶,利用浓盐酸易挥发,而浓硫酸不挥发来区分.
(2)根据框图中的反应和利用元素守恒的方法来确定物质及相关的问题:氯化钠与水通电生成氢氧化钠与氢气、氯气;检验氯离子的方法是加入硝酸银,观察是否有白色沉淀;
(3)由于久置的氢氧化钠可能与空气中的二氧化碳反应生成碳酸钠和水,根据碳酸钠能够和盐酸反应产生气泡,碳酸钠溶液显碱性,也能够使酚酞试液变成红色及要排除碳酸钠碱性对氢氧化钠的干扰进行分析;
(4)根据燃烧的条件分析;根据实验的目的证明二氧化碳与过氧化钠反应能够满足棉花燃烧的条件进行分析;
(5)根据表格的质量差计算二氧化碳的质量,根据二氧化碳的质量计算碳酸钠及碳酸钠的质量分数;根据二氧化碳的密度分析误差.(1)因浓硝酸易见光分解,应该保存在棕色瓶内;浓盐酸易挥发,看到C瓶的瓶口冒白雾,D瓶的瓶口无现象,说明C瓶内的是浓盐酸,D瓶内的是浓硫酸.
故答案为:浓硝酸;C瓶口产生白雾;
(2)根据框图中的反应和利用元素守恒的方法:氯化钠与水通电生成氢氧化钠与氢气、氯气;则A为NaOH的溶液,将溶液蒸发可得到固体物质NaOH,则A中的物质为氢氧化钠NaOH;小袁同学认为工业生产中原料不能完全转化为产品,所以A瓶内的物质中一定含有杂质氯化钠,检验氯离子时要排除氢氧根离子的干扰,检验的方法是:取适量样品溶于水滴加酚酞,再加硝酸至红色消失,再滴入硝酸银溶液,若有白色沉淀生成,说明有氯化钠;
故答案为:NaOH;取适量样品溶于水滴加酚酞,再加硝酸至红色消失,再滴入硝酸银溶液,若有白色沉淀生成,说明有氯化钠;
(3)氢氧化钠易于与空气中的二氧化碳反应产生碳酸钠和水,反应的方程式为:CO2+2NaOH=Na2CO3+H2O;因为碳酸钠能够和盐酸反应产生二氧化碳,而氢氧化钠与盐酸反应不能产生气泡,因此可以排除假设①;因为碳酸钠溶液也显碱性,也能够使酚酞试液变成红色,因此次观点是错误的;碳酸钠和氢氧化钙反应产生碳酸钙沉淀,因此沉淀是碳酸钙;由于碳酸钠和氢氧化钙反应产生碳酸钙沉淀的同时,又产生氢氧化钠,因此无法证明氢氧化钠的存在,若把石灰水换成氯化钙溶液,就能够证明氢氧化钠的存在;
故答案为:CO2+2NaOH=Na2CO3+H2O;①;错误,因为碳酸钠溶液也显碱性;CaCO3;将石灰水换成氯化钙溶液;
(4)可燃物燃烧需要与氧气充分接触,温度达到可燃物的着火点;C装置可以检验水蒸气是否被除尽,保证与过氧化钠反应的是二氧化碳而不是水蒸气;通过饱和的石灰水温度升高,溶解度减小,从而有固体析出,证明反应放出热量;
故答案为:与氧气充分接触;温度达到棉花的着火点;检验水蒸气是否被浓硫酸吸干净;证明二氧化碳与过氧化钠反应放出热量;
(5)分析框图可知反应前后的质量差为产生二氧化碳的质量,因此二氧化碳的质量为10g+241.3g-248g=3.3g
设参加反应的碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 3.3g
[106/x]=[44/3.3g] x=7.95g
碳酸钠的质量分数为:[7.95g/10g]×100%=79.5%
答:B瓶中纯碳酸钠的质量分数为79.5%
因为二氧化碳的密度比空气大,会有二氧化碳残留在装置内,使质量差变小,使测得试样中Na2CO3质量分数会偏小.
故答案为:因为二氧化碳的密度比空气大,会有二氧化碳残留在装置内,使质量差变小,使测得试样中Na2CO3质量分数会偏小.点评:
本题考点: 物质的鉴别、推断;实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;酸的物理性质及用途;物质的相互转化和制备;根据化学反应方程式的计算;燃烧与燃烧的条件.
考点点评: 本题考查知识点多,熟练掌握常见的三酸和两碱的性质及燃烧的条件是解题的关键.1年前查看全部
- (10分)化工生产中常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(10分)化工生产中常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1) 从物质的分类角度看,不恰当的一种物质是________。(填写化学式)
(2) "三酸”的稀溶液均能作为nh 3 的吸收剂广三酸”中的任意“一酸”与kh 3 反应的离子方程式是________________________________
(3) 纯碱生产工艺是沿用化学家侯德榜***国外的纯碱生产工艺,其生产流程可简要表示如下: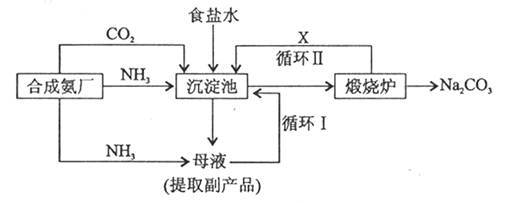
①沉淀池中发生的化学反应方程式是________________
②使原料氯化钠的利用率从70%提高到90%以上,主要是设计了循环________ (填“ i ”或“ii”)。
(4) 若将1mol/l盐酸逐滴加入0.5mol/l烧碱溶液至恰好完全中和,所得溶液中的离子浓度大小顺序是________________________ 长区一第区社涯天1年前1
长区一第区社涯天1年前1 -
 wdccwdcc 共回答了20个问题
wdccwdcc 共回答了20个问题 |采纳率85%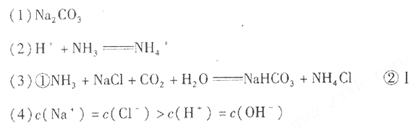
(1) 从物质的分类角度看,不恰当的一种物质是Na 2 CO 3 ,因为是Na 2 CO 3 盐,不是碱。
(2)“三酸”中的任意“一酸”都是强酸,全部电离,酸与NH 3 反应的离子方程式是:H + +NH 3 =NH 4 + 。
(3)①沉淀池中发生的化学反应方程式是:NH 3 +NaCl+CO 2 +H 2 O=NaHCO 3 ↓+NH 4 Cl
②使原料氯化钠的利用率从70%提高到90%以上,主要是设计了循环I.
(4)若将1mol/L盐酸逐滴加入0.5mol/L烧碱溶液至恰好完全中和,会得到NaCl溶液,Na + 与Cl - 都不水解离子浓度相等,大于水电离出的H + 与OH - ,溶液显中性+的浓度等于-的浓度,故离子浓度的大小顺序为:c(Na + )=c(Cl - )>c(H + )=c(OH - )1年前查看全部
- 工业上的常说“三酸两碱”是重要的化工原料,也是重要的化工产品.如图是实验室桌面上的五个试剂瓶内分别装有属于工业上“三酸两
工业上的常说“三酸两碱”是重要的化工原料,也是重要的化工产品.如图是实验室桌面上的五个试剂瓶内分别装有属于工业上“三酸两碱”中的“三种浓酸”和“两碱固体”.
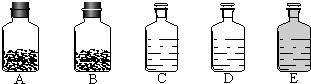
(1)小袁同学没有利用任何试剂就鉴定出了C、D、E三瓶中的三种浓酸.他的做法是:①直接观察试剂瓶颜色,棕色试剂瓶E内的是______(填名称);②分别打开C、D瓶的瓶塞,______,说明C瓶内的是______(填名称),D瓶内的是浓硫酸.
(2)小顾同学想利用D瓶内98%的浓硫酸来配制196g、10%的稀硫酸,他应取浓硫酸______g.如图是小顾同学的配制方法,请指出他的两处错误:①______.②______.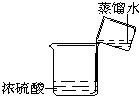
(3)小白同学在查阅A、B瓶内的“两碱”的制备方法时,根据收集的信息,绘制了如下一个框图.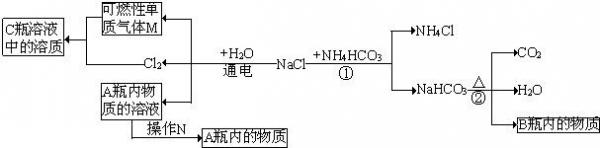
注:整个框图中每个化学反应涉及的物质已全部给出.根据框图,回答下列问题.
[1]写出下列物质化学式:A瓶内的物质:______;可燃性单质气体M:______.
[2]框图中的①反应所属的反应类型是______;操作N是______.
[3]请写出物质转化的化学方程式A瓶内的物质→B瓶内的物质:______. 千共婵1年前1
千共婵1年前1 -
 天哦地哦 共回答了18个问题
天哦地哦 共回答了18个问题 |采纳率83.3%解题思路:(1)根据酸的性质可知,浓硝酸见光易分解,则应保存在棕色试剂瓶,利用浓盐酸易挥发,而浓硫酸不挥发来区分.
(2)利用稀释前后硫酸的质量不变来计算,在稀释时应注意使产生的热量及时散失.
(3)根据框图中的反应和利用元素守恒的方法来确定物质及相关的问题.(1)因浓硝酸易见光分解,浓盐酸易挥发.
故答案为:浓硝酸;看到C瓶的瓶口冒白雾,D瓶的瓶口无现象(写冒白烟错误);浓盐酸.
(2)用98%的浓硫酸来配制196g、10%的稀硫酸,设浓硫酸的质量为X克,则X×98%=196×10%,解得X═20,稀释时应将密度大的倒入到密度小的液体中易混合均匀,并用玻璃棒搅拌及时散热.
故答案为:20;将水倒入浓硫酸中;没有用玻璃棒搅拌(写没有用玻璃棒、没有用玻璃棒引流错误).
(3)根据反应②知B为碳酸钠,C中是盐酸,则M为氢气,根据氯化钠和水通电发生的反应,则A为NaOH的溶液,将溶液蒸发可得到固体物质NaOH,则A中的物质为NaOH,反应①是化合物与化合物相互交换成分生成化合物与化合物,则属于复分解反应,A瓶内的物质→B瓶内的物质,可与二氧化碳或碳酸氢钠反应得到,
故答案为:[1]NaOH;H2
[2]复分解反应;蒸发
[3]2NaOH+CO2=Na2CO3+H2O(或NaOH+NaHCO3=Na2CO3+H2O)点评:
本题考点: 物质的鉴别、推断;浓硫酸的性质及浓硫酸的稀释;蒸发与蒸馏操作;有关溶质质量分数的简单计算;酸的物理性质及用途;化学式的书写及意义;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查知识点多,利用的方法是常用的方法,通过本题应掌握物质的区分和转化,能根据稀释过程来计算等.1年前查看全部
- 化工生产常用到“三酸两碱”,“三酸”指硝酸、盐酸和硫酸,“两碱”指烧碱和纯碱
化工生产常用到“三酸两碱”,“三酸”指硝酸、盐酸和硫酸,“两碱”指烧碱和纯碱
(3)三酸 常用于溶解金属和金属氧化物.下列块状金属在常温时能全部溶于足量浓硝酸的是__________.(说明理由)
A.Ag B.Cu C.Al D.Fe 米米1年前1
米米1年前1 -
 没rr吃亏 共回答了19个问题
没rr吃亏 共回答了19个问题 |采纳率94.7%选择AB
Ag+2HNO3(浓)===AgNO3+NO2↑+H2O
Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑ + 2H2O
Al、Fe在浓硝酸中钝化
Ag是能溶于浓硝酸的1年前查看全部
- 工业上的“三酸两碱”是指硫酸、硝酸、盐酸、纯碱和烧碱,氨气与这些工业原料的生产有密切关系。如氨气是生成硝酸、纯碱的原料,
工业上的“三酸两碱”是指硫酸、硝酸、盐酸、纯碱和烧碱,氨气与这些工业原料的生产有密切关系。如氨气是生成硝酸、纯碱的原料,其水溶液是硫酸工业中尾气的吸收剂。部分生成工艺流程图或装置图如下:
材料一候氏制纯碱工艺流程图
气体A的饱和溶液 A和食盐的饱和溶液
A和食盐的饱和溶液 悬浊液
悬浊液 晶体
晶体 纯碱
纯碱
材料二阳离子交换膜法电解饱和食盐水原理示意图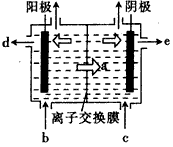
材料三某化工厂为了综合利用生产过程中的副产品CaSO 4 ,与相邻的合成氨厂联合设计了以下制备
(NH 4 ) 2 SO 4 的工艺流程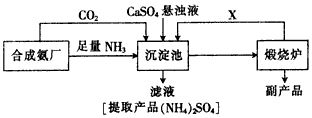
根据以上材料,回答下列问题
(1)第Ⅳ步操作名称_______,为什么先通入A气体再通B气体?______________。
(2)材料二中精制的食盐水通过离子交换膜电解槽电解,透过阳离子交换膜的离子a是______;b入口通入的溶液是______________,电解饱和食盐水的离子方程式是_____________________。
(3)工业上除用电解法制烧碱外,还可用石灰--纯碱法来生产,写出有关反应方程式:_____________。
(4)材料三中的沉淀池内发生的主要反应方程是______________,从绿色化学和资源综合利用的角度说明上述流程的主要优点是__________________。 HOK6691年前1
HOK6691年前1 -
 星夜麦田 共回答了18个问题
星夜麦田 共回答了18个问题 |采纳率100%1年前查看全部
- (2004•扬州)“三酸两碱”是几种重要的化工原料.下图是九种化合物相互间的反应关系.
 (2004•扬州)“三酸两碱”是几种重要的化工原料.下图是九种化合物相互间的反应关系.
(2004•扬州)“三酸两碱”是几种重要的化工原料.下图是九种化合物相互间的反应关系.
已知①A、A1、A2是工业上三大常见的强酸,B、B1、B2是正盐,C、C1、C2是碱.
②B2是食盐的主要成分,且B、B1、B2、C1中含有相同的金属阳离子.
③A+B→CO2↑,
B+C→难溶于水的白色沉淀
沉淀完全溶解,并产生二氧化碳,+A2
A+C→难溶于水的白色沉淀
沉淀不溶解+A2
请回答:(1)有关物质的化学式:B2NaClNaCl,C1NaOHNaOH.
(2)有关反应的化学方程式:
A+B:H2SO4+Na2CO3=Na2SO4+H2O+CO2↑;H2SO4+Na2CO3=Na2SO4+H2O+CO2↑;;
B+C:Na2CO3+Ba(OH)2=BaCO3↓+2NaOH;Na2CO3+Ba(OH)2=BaCO3↓+2NaOH;;
A+C:H2SO4+Ba(OH)2=BaSO4↓+2H2OH2SO4+Ba(OH)2=BaSO4↓+2H2O.
(3)C2可能的化学式(写两个):Cu(OH)2Cu(OH)2、Mg(OH)2Mg(OH)2. 寒露kmi1年前1
寒露kmi1年前1 -
 豆豆龙6 共回答了22个问题
豆豆龙6 共回答了22个问题 |采纳率77.3%(1)A、A1、A2是工业上三大常见的强酸,所以A、A1、A2是盐酸、硫酸、硝酸,B2是食盐的主要成分,且B、B1、B2、C1中含有相同的金属阳离子,所以B2是氯化钠,B、B1、B2、C1中含有钠离子,B、B1、B2是正盐,B会转化成B1、氯化钠,B1会转化成氯化钠,+B→CO2↑,所以B是碳酸钠,B1是硫酸钠,C1是氢氧化钠,A、C、碳酸钠会相互反应,+C→难溶于水的白色沉淀
+A2
沉淀完全溶解,并产生二氧化碳,A+C→难溶于水的白色沉淀
+A2
沉淀不溶解,所以A是硫酸,A1是盐酸,A2是硝酸,硫酸和C会生成不溶于硝酸的白色沉淀,所以C是氢氧化钡,氢氧化钡和氢氧化钠会转化成C2,所以C2是不溶性碱,经过验证,各种物质都满足转化关系,故答案为:NaCl,NaOH;
(2)硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳,故答案为:H2SO4+Na2CO3=Na2SO4+H2O+CO2↑;
碳酸钠和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,故答案为:Na2CO3+Ba(OH)2=BaCO3↓+2NaOH;
硫酸和氢氧化钡反应生成硫酸钡沉淀和水,故答案为:H2SO4+Ba(OH)2=BaSO4↓+2H2O.
(3)氢氧化钡和氢氧化钠会转化成C2,所以C2是不溶性碱,故答案为:Cu(OH)2,Mg(OH)2.1年前查看全部
- “三酸两碱”是几种重要的化工原料。下图是九种化合物相互间的反应关系。
“三酸两碱”是几种重要的化工原料。下图是九种化合物相互间的反应关系。
已知①A、A 1 、A 2 是工业上三大常见的强酸,B、B 1 、B 2 是盐,C、C 1 、C 2 是碱。
②B 2 是食盐的主要成分,且B、B 1 、B 2 、C 1 中含有相同的金属阳离子。
③A+B→CO 2 ↑,B+C→难溶于水的白色沉淀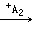 沉淀完全溶解,并产生二氧化碳,A+C→难溶于水的白色沉淀
沉淀完全溶解,并产生二氧化碳,A+C→难溶于水的白色沉淀 沉淀不溶解
沉淀不溶解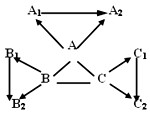
请回答:
(1)有关物质的化学式:B 2 _______,C 1 ________。
(2)有关反应的化学方程式:A+B:_____________;B+C:_____________;A+C:______________。
(3)C 2 可能的化学式(写两个):____________、__________。 未选择的路1年前1
未选择的路1年前1 -
 童蛋儿 共回答了18个问题
童蛋儿 共回答了18个问题 |采纳率100%(1)NaCl;NaOH
(2)A+B:H 2 SO 4 +Na 2 CO 3 ==Na 2 SO 4 +H 2 O+CO 2 ↑;
B+C:Na 2 CO 3 +Ba(OH) 2 ==BaCO 3 ↓+2NaOH;
A+C:H 2 SO 4 +Ba(OH) 2 ==BaSO 4 ↓+2H 2 O
(3)Cu(OH) 2 、Mg(OH) 2 (其他如:Fe(OH) 3 等不溶碱均可)1年前查看全部
- (2013•南昌二模)化工生产中通常所说的“三酸两碱”,“三酸”是指硝酸、硫酸和盐酸,“两碱”是指烧碱和纯碱.
(2013•南昌二模)化工生产中通常所说的“三酸两碱”,“三酸”是指硝酸、硫酸和盐酸,“两碱”是指烧碱和纯碱.
(1)从物质分类的角度分析,上述说法中不恰当的一种物质是______(填化学式).
(2)向盐酸中加入浓H2SO4时,会有白雾生成.下列叙述不属于导致产生该现象的原因的是______.
A.浓H2SO4具有脱水性 B.浓H2SO4具有吸水性
C.盐酸具有挥发性 D.气体溶质的溶解度随温度升高而降低
(3)在中学化学常见气体的实验室制法中,常用浓硫酸制备的气体的化学式是______(填两种)
(4)①“三酸”常用于溶解金属和金属氧化物.下列块状金属在常温下能够全部溶于足量的浓硝酸的是______.
A.AuB.AgC.AlD.Fe
②金属铜投入稀硫酸中不发生反应,但再加入H2O2溶液后铜开始溶解,溶液逐渐变为蓝色,请写出该反应的离子方程式:______.
(5)烧碱、纯碱溶液均可吸收CO2气体.当含0.1mol NaOH的溶液吸收一定量CO2后,将溶液低温小心蒸干,称得固体质量为8克.则所得固体是______ (填化学式);若将所得到的固体重新溶解于水,向其中加入1mol/L的盐酸120mL,充分反应后再将溶液蒸干,最终得到固体的质量为______ g. 华丽丽的宝蓝色1年前1
华丽丽的宝蓝色1年前1 -
 aa又失败 共回答了16个问题
aa又失败 共回答了16个问题 |采纳率87.5%解题思路:(1)依据酸碱盐的概念和物质组成分析判断,纯碱是盐;
(2)盐酸滴入浓硫酸溶液温度升高,气体氯化氢溶解度减小,挥发到空气中遇水蒸气形成盐酸小液滴分析判断;
(3)依据实验室气体制备原理分析,二氧化硫、氯化氢、氟化氢、乙烯等气体都利用了浓硫酸的性质制备;
(4)①金属与浓硝酸反应时,常温下铁铝发生钝化现象,阻止反应进行;金、铂不和浓硝酸反应;
②过氧化氢在酸性溶液中具有氧化性;
(5)含0.1mol NaOH的溶液吸收一定量CO2后,发生2NaOH+CO2=Na2CO3+H2O、NaOH+CO2=NaHCO3,得到的固体重新溶解于水,向其中加入盐酸,依据盐酸溶质物质的量和固体物质的量分析,溶质为NaCl,结合钠原子守恒计算.(1)碱为电离出的阴离子全部是氢氧根离子的化合物,纯碱的主要成分是Na2CO3,碳酸钠电离出钠离子和碳酸根离子,属于盐,
故答案为:Na2CO3;
(2)向盐酸中加入浓H2SO4时,会有白雾生成.是因为浓硫酸溶解过程中放热使溶液温度升高,氯化氢挥发在空气中遇到水蒸气形成盐酸小液滴;
A、浓H2SO4具有脱水性不是产生现象的原因,故A选;
B、浓硫酸具有吸水性,溶解过程中放热,气体溶质的溶解度随温度升高而降低,氯化氢挥发,故B不选;
C、产生雾是因为盐酸具有挥发性,挥发出的氯化氢形成,故C不选;
D、浓硫酸溶于水可放出大量的热,氯化氢挥发在空气中遇到水蒸气形成盐酸小液滴,故D不选;
故选:A;
(3)二氧化硫利用浓硫酸和亚硫酸钠反应生成,氯化氢利用固体氯化钠和浓硫酸加热反应生成,氟化氢是利用氟化钙和浓硫酸反应制得,乙烯是利用乙醇和浓硫酸加热反应制备;
故答案为:SO2、C2H4 (或HCl、HF);
(4)①金属在常温下能够全部溶于足量的浓硝酸的是银,金不反应,铁和铝常温下发生钝化现象反应不再继续,故选:B;
②金属铜投入稀硫酸中不发生反应,但再加入H2O2溶液后铜开始溶解,溶液逐渐变为蓝色,说明过氧化氢在酸性溶液中具有氧化性溶解铜,离子方程式为:Cu+H2O2+2H+=Cu2++2H2O;
故答案为:Cu+H2O2+2H+=Cu2++2H2O;
(5)含0.1mol NaOH的溶液吸收一定量CO2后,发生2NaOH+CO2=Na2CO3+H2O、NaOH+CO2=NaHCO3,若二者的物质的量比大于2:1,二氧化碳不足,则小心蒸干得到固体为Na2CO3和NaOH,等于2:1时溶质为Na2CO3,1:1时溶质为NaHCO3,介于2:2与2:1之间时溶质为Na2CO3和NaHCO3,若是碳酸钠则依据钠元素守恒计算可知质量=0.1mol×[1/2]×106g/mol=5.3g,若为碳酸氢钠质量=0.1g×84g/mol=8.4g,将溶液低温小心蒸干,称得固体质量为8克,说明固体为碳酸钠和碳酸氢钠混合物,将所得到的固体重新溶解于水,向其中加入1mol/L的盐酸120mL,若溶解的是碳酸钠,需要氯化氢0.1mol,若溶解的是碳酸氢钠,需要氯化氢物质的量为0.1.mol,说明盐酸过量,充分反应后再将溶液蒸干,得到溶质固体NaCl,依据钠原子守恒计算得到固体质量=0.1mol×58.5g/mol=5.85g;
故答案为:Na2CO3、NaHCO3,5.85.点评:
本题考点: 酸、碱、盐、氧化物的概念及其相互联系;氯、溴、碘及其化合物的综合应用;浓硫酸的性质;钠的重要化合物.
考点点评: 本题考查了化学反应现象分析和物质性质的应用,注意二氧化碳和氢氧化钠溶液反应产物的判断计算应用,掌握基础是关键,题目难度中等.1年前查看全部
- 纯碱算不算碱?老师说,纯碱不是碱,是盐;那么,为什么“三酸两碱”中有纯碱这一出?
 loverossi1年前1
loverossi1年前1 -
 rui88578 共回答了22个问题
rui88578 共回答了22个问题 |采纳率90.9%纯碱不是碱,是盐没错 纯碱的水溶液呈碱性.等你学了化学反应原理后,在水解那部分你就知道为什么呈碱性.
这里简单的告诉你,盐本来是中性,但是纯碱电离出co3 2-离子会水解放出OH-所以呈碱性1年前查看全部
- (2011•吴中区二模)化学工业上常说的“三酸两碱”中的“两碱”是指( )
(2011•吴中区二模)化学工业上常说的“三酸两碱”中的“两碱”是指( )
A.NaOH和Ca(OH)2
B.NaOH和氨水
C.NaOH和Na2CO3
D.NaOH和KOH seasqq1年前1
seasqq1年前1 -
 peiwind 共回答了15个问题
peiwind 共回答了15个问题 |采纳率93.3%解题思路:酸是指电离出的阳离子全部为H+的一类化合物,生产生活中使用的酸有很多种,我们把酸性很强且常用的三种酸合称为“三酸”;而“二碱”是指在生产生活中广泛使用的两种俗名为某碱的两种物质.盐酸、硫酸、硝酸是化学实验室的三大强酸,它们是化工生产的原料,被合称为“三酸”;在碱类物质中,烧碱氢氧化钠作为工业原料在化工生产中大量使用的一种碱;而碳酸钠因其溶液呈碱性又在生产生活中广泛使用,所以人们俗称其为纯碱,但它属于盐类.纯碱与烧碱合称为“二碱”.
故选:C.点评:
本题考点: 常见碱的特性和用途;碳酸钠、碳酸氢钠与碳酸钙.
考点点评: 氢氧化钠俗称火碱、烧碱、苛性钠;碳酸钠俗称纯碱、苏打.二者被称为工业上的“两碱”,注意纯碱不是碱而属于盐类.1年前查看全部
- (15分)烧碱(NaOH)和纯碱(Na 2 CO 3 )与硫酸、盐酸和硝酸并称为工业上的“三酸两碱”。按要求回答下列问题
(15分)烧碱(NaOH)和纯碱(Na 2 CO 3 )与硫酸、盐酸和硝酸并称为工业上的“三酸两碱”。按要求回答下列问题:
(1)完成下列有关NaOH溶液参加反应的离子方程式
①向NaOH溶液中加入铝片:_______________________;
②向NaOH溶液中滴加少量氯化铝溶液___________________;
③二氧化氮与NaOH溶液发生氧化还原反应:___________________;
④用热的NaOH溶液洗涤沾有硫单质的试管:___________________;
(2)下列是碳酸钠和碳酸氢钠的性质比较,用“>”“<”“=”填空:
①热稳定性:Na 2 CO 3 _______NaHCO 3 ;
②与稀盐酸反应快慢:Na 2 CO 3 _______NaHCO 3 ;
③物质的量相同时,消耗盐酸的物质的量:Na 2 CO 3 _______NaHCO 3 。
(3)在10 mL 1 mol/L的纯碱溶液中,不断搅拌并逐滴加入10 mL 1.5 mol/L盐酸,完全反应后,在标准状况下生成二氧化碳的体积为____________L。
(4)碳酸钠在工业上具有广泛的作用,碳酸钠可以用作下列工业生产主要原料的是_____(填编号)
a.玻璃 b.水泥 c.造纸 d.海水提取镁 hmily_rain1年前0
hmily_rain1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 工业上的常说“三酸两碱”是重要的化工原料.实验室桌面上的五个试剂瓶内(如图)分别装有属于工业上“三酸两碱”中的“三种浓酸
工业上的常说“三酸两碱”是重要的化工原料.实验室桌面上的五个试剂瓶内(如图)分别装有属于工业上“三酸两碱”中的“三种浓酸”和“两碱固体”. 
(1)小袁同学没有利用任何试剂就鉴定出了C、D、E三瓶中的三种浓酸.他的做法是:①直接观察试剂瓶颜色,棕色试剂瓶E内的是______(填名称);②分别打开C、D瓶的瓶塞,观察到______,说明C瓶内的是浓盐酸,D瓶内的是浓硫酸.
(2)小白同学在查阅A、B瓶内的“两碱”的制备方法时,根据收集的信息,绘制了如下一个框图.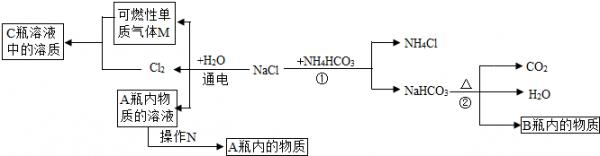
注:整个框图中每个化学反应涉及的物质已全部给出.
根据框图,依据化学反应前后元素种类守恒的相关知识,回答下列问题.
Ⅰ.写出下列物质化学式:A瓶内的物质:______.小袁同学认为工业生产中原料不能完全转化为产品,所以A瓶内的物质中一定含有杂质.请你帮助他设计出检验该杂质的实验方案(写出操作、现象和结论):______.
Ⅱ.框图中的①反应所属的反应类型是______.请根据下表写出①反应能够发生的理由:______
NaCl、NH 4 HCO 3 、NaHCO 3 、NH 4 Cl在30℃时的溶解度如下表所示:
.请选用一种物理方法鉴别A、B瓶内的物质:______.温度 NH 4 Cl NH 4 HCO 3 NaHCO 3 NaCl 30℃ 41.1g 27.0g 11.1g 36.3g
(3)小顾同学想利用D瓶内溶质质量分数为98%的浓硫酸来配制10%的稀硫酸196g,配制时应注意______. phelps20081年前1
phelps20081年前1 -
 anhu7458 共回答了22个问题
anhu7458 共回答了22个问题 |采纳率90.9%(1)因浓硝酸易见光分解,浓盐酸易挥发.故答案为:浓硝酸;看到C瓶的瓶口冒白雾,D瓶的瓶口无现象(写冒白烟错误);说明C瓶内的是浓盐酸,D瓶内的是浓硫酸.
(2)Ⅰ.根据框图中的反应和利用元素守恒的方法:氯化钠与水通电生成氢氧化钠与氢气、氯气;则A为NaOH的溶液,将溶液蒸发可得到固体物质NaOH,则A中的物质为氢氧化钠NaOH;小袁同学认为工业生产中原料不能完全转化为产品,所以A瓶内的物质中一定含有杂质.请你帮助他设计出检验该杂质的实验方案(写出操作、现象和结论):加入硝酸银,观察是否有白色沉淀,无沉淀,则无氯离子;
Ⅱ.反应①是化合物与化合物相互交换成分生成化合物与化合物,则属于复分解反应,请根据下表写出①反应能够发生的理由:NaHCO 3 之所以沉淀是因为溶解度较小,可以以晶体形式析出;
Ⅲ.请选用一种物理方法鉴别A为氢氧化钠、B瓶内为碳酸钠:将固体的NaOH和Na 2 CO 3 分别加水溶解,NaOH溶于水会放出大量的热;
(3)用98%的浓硫酸来配制196g、10%的稀硫酸,设浓硫酸的质量为X克,则X×98%=196×10%,解得X=20,用水:196-20=176克,所以稀释浓硫酸时,沿烧杯内壁将浓硫酸缓缓加入176克水中,边加边搅拌及时散热.
故答案为:(1)浓硝酸;看到C瓶的瓶口冒白雾,D瓶的瓶口无现象(写冒白烟错误);
(2)Ⅰ.NaOH,加入硝酸银,观察是否有白色沉淀,无沉淀,则无氯离子;
Ⅱ.复分解反应;NaHCO 3 之所以沉淀是因为溶解度较小,可以以晶体形式析出;
Ⅲ.将固体的NaOH和Na 2 CO 3 分别加水溶解,NaOH溶于水会放出大量的热;
(3)稀释浓硫酸时,沿烧杯内壁将浓硫酸缓缓加入176克水中,边加边搅拌及时散热.1年前查看全部
大家在问
- 1帮我回封信?原文:hi john,im fine here.i'm doing best my activity and
- 2有关极地地区的叙述正确的是( ) A.北极是陆地,南极是海洋 B.北极比南极更寒冷 C.南极地地区特有的鸟类是企鹅 D
- 324.6除以一个数与3.5的和,商是4.1,这个数是多少?
- 4(2008•黄浦区二模)如图为2008年北京奥运会吉祥物--福娃,图中表示力能使物体的运动状态发生改变的是图______
- 5英语中许多词带有像第几声似的符号是什么意思
- 6(2011•徐州)某大学组织学生在某地区进行野外考察活动,当地的地形特点如图所示,请根据此图回答问题.
- 7李刚看一本课外读物,第一天看了全书的6分之一,第二天看了第一天的4分之1还多95页,正好看完.
- 8动物细胞糖类物质由什么细胞器合成
- 9图是某学生设计的一种有洗气、贮气等用途的装置。
- 10马来西亚语tiga tujuh berusaha怎么读 现场等!急用!
- 11急求一道六年级奥数应用题的答案.学校早晨6:00开门,晚上6:40关校门,下午有一个学生问老师现在时间,老师说
- 12(2012•德化县模拟)如图,O是△ABC的重心,AN、CM相交于点O,若△MON的面积为3,则△AOC的面积的是___
- 13___ he come late,give him the message.
- 14Feed the monkeys in the zoo.(改为否定句) ______ ______the monkeys
- 15"_______,_______"我们要养成今日事今日毕的好习惯.(填古诗名句或俗语)

