起始默认值为零英语怎么翻译
 毒22022-10-04 11:39:543条回答
毒22022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 kqw123 共回答了20个问题
kqw123 共回答了20个问题 |采纳率100%- Initiation default value is zero
起始默认值 Initiation default value - 1年前
 sdfhorse 共回答了1个问题
sdfhorse 共回答了1个问题 |采纳率- Enlightenment of the default value is zero
- 1年前
 nnxs 共回答了17个问题
nnxs 共回答了17个问题 |采纳率76.5%- Starting the default value is zero
- 1年前
相关推荐
- 一条射线绕着它的端点从起始位置旋转到终止位置所成的图形也叫做( ), 射线的起始位置叫做( ),终止位置
一条射线绕着它的端点从起始位置旋转到终止位置所成的图形也叫做( ), 射线的起始位置叫做( ),终止位置叫做( )。  黑客新手1年前1
黑客新手1年前1 -
 yeye8002001 共回答了17个问题
yeye8002001 共回答了17个问题 |采纳率100%角;角的始边;角的终边1年前查看全部
- 纬度和经度的起始线是什么?
 huahuahudie1年前4
huahuahudie1年前4 -
 nrbfyj 共回答了17个问题
nrbfyj 共回答了17个问题 |采纳率100%纬度的起始线是赤道(0度纬线),经度的起始线是本初子午线(0度经线)1年前查看全部
- We can follow them back home.(起始句)
 l3ageekd1年前2
l3ageekd1年前2 -
 由由1314 共回答了27个问题
由由1314 共回答了27个问题 |采纳率88.9%Follow them back home.1年前查看全部
- 如图为一个圆盘,别平均分成12个小扇形,指针从起始位置L开始顺时针旋转,第一次旋转停在了A位置,第二次旋转停在了B位置…
如图为一个圆盘,别平均分成12个小扇形,指针从起始位置L开始顺时针旋转,第一次旋转停在了A位置,第二次旋转停在了B位置……记从L顺时针旋转到指针所在位置的角为α(0°≤α≤360°).观察位置,填写小表:经过第一次旋转后,指针共旋转了30°,α为30°,经过第二次旋转后,指针共旋转了30°+2*30=90°α为90°……经过第五次旋转后,指针共旋转了300°+5*30=450°α为90°.
(1)经过第五次旋转后,指针共旋转了-----------α为------;
(2)经过第N次旋转后,指针共旋转了------------;则经过第50次旋转后,α为-----° 31452a563c0231bf1年前1
31452a563c0231bf1年前1 -
 西西望 共回答了13个问题
西西望 共回答了13个问题 |采纳率92.3%旋转了450°,a=90°啊
注意,经过N次旋转,an-an-1=30n度
即an=15(n^2+n) 对吧 ,an是指转过的角度
所以经过50次an=15(50^2+50)=38250,可以算出α是90°
然后用周期考虑阿尔法也行,第一次 30°
第二次90°,第三次180°,第四次 300°,第五次30°.
周期就是4,所以50/4余数是2,即第二次,答案是90°1年前查看全部
- 温度压强一定,在催化剂铁触媒作用下,向一密闭容器充入N 2 、H 2 和NH 3 .若起始时n(N 2 )=x mol、
温度压强一定,在催化剂铁触媒作用下,向一密闭容器充入N 2 、H 2 和NH 3 .若起始时n(N 2 )=x mol、n(H 2 )=y mol、n(NH 3 )=z mol (x、y、z均不为0 ),平衡时n(N 2 )=0.1mol、n(H 2 )=0.3mol、n(NH 3 )=0.08mol.下列有关判断不合理的是( ) A.N 2 、H 2 的转化率不相等 B.平衡时,H 2 与NH 3 的生成速率之比为3:2 C.x:y=1:3 D.x的取值范围为0<x<0.14  蓝精灵041年前1
蓝精灵041年前1 -
 yuyan5719 共回答了13个问题
yuyan5719 共回答了13个问题 |采纳率76.9%A、题干中平衡时氮气和氢气物质的量之比为1:3,转化量是依据化学方程式计量数的计算剩余转化量氮气和氢气物质的量之比等于1:3,根据平衡起始量-变化量=平衡量,可知,氮气和氢气转化率相同,故A错误;
B、反应过程中和平衡状态下化学反应中 物质反应速率之比等于化学方程式的计量数之比,平衡时,H 2 与NH 3 的生成速率之比为3:2,故B正确;
C、依据A选项分析可知,反应物的起始量之比为1:3,即x:y=1:3,故C正确;
D、依据极值转化始转平,平转始,得到氮气的物质的量取值范围,假设反应正向进行
N 2 +3H 2 ⇌2NH 3
起始量(mol) x y z
变化量(mol) x-0.1 y-0.3 0.08-z
平衡量(mol) 0.1 0.3 0.08
若正向进行彻底,氮气物质的量全部转化,物质的量为0;若反应逆向进行彻底,氮气物质的量为0.14mol,氨气为0,但反应是可逆反应不可能进行彻底,得到氮气的物质的量为
0<n(N 2 )<0.14mol,故D正确;
故选A.1年前查看全部
- 如果把钟表的时针在任一时刻作为起始位置,那么时针旋转一个平角及一个周角,至少各需多长时间?
 zqs2003021年前1
zqs2003021年前1 -
 不填还不成吗 共回答了14个问题
不填还不成吗 共回答了14个问题 |采纳率92.9%旋转一个平角当然是6个小时了,你可以想象从12点走到6点不是6个小时,旋转一个周交就是回到原位,当然是12小时1年前查看全部
- 问:1路公交车每隔10分钟发一次,5路公交车每隔15分钟发一次,现在两路车同时从起始发车, 答:30分钟 公式
问:1路公交车每隔10分钟发一次,5路公交车每隔15分钟发一次,现在两路车同时从起始发车, 答:30分钟 公式
1路公交车每隔10分钟发一次,5路公交车每隔15分钟发一次,现在两路车同时从起始发车,至少经过多少分钟后这两路车又同时发车?
 r4001年前1
r4001年前1 -
 爱得很深出不来了 共回答了19个问题
爱得很深出不来了 共回答了19个问题 |采纳率89.5%10和15的最小公倍数即答案
最小公倍数计算公式:
假设两个数,X,Y.X、Y的最小公约数为a,则X、Y的最小公倍数= (X/a)*Y
10和15的最大公约数是5
10=2*5 ; 15=3*5.
那么最小公倍数是(10/2)*15=301年前查看全部
- 一个有10字的数据区,起始地址12ABH:00ABH,请给出最后一个字单元的物理地址
 圆中成咏星1年前1
圆中成咏星1年前1 -
 萨满si 共回答了23个问题
萨满si 共回答了23个问题 |采纳率78.3%12AB0H+00ABH+(10-1)*2=12B5BH+12H=12B6DH1年前查看全部
- 在容积相同且固定不变的四个密闭容器中,进行同样的可逆反应:2A(g)+B(g)⇌3C(g)+2D(g),起始时四个容器所
在容积相同且固定不变的四个密闭容器中,进行同样的可逆反应:2A(g)+B(g)⇌3C(g)+2D(g),起始时四个容器所盛A、B的量分别为:甲:2mol A,1mol B;乙:1mol A,1mol B;丙:2mol A,2mol B;丁:1mol A,2mol B.在相同温度下建立平衡时,A、B的转化率大小关系正确的是( )
A.A的转化率:甲<丙<乙<丁
B.A的转化率:甲<乙<丙<丁
C.A的转化率:甲<乙=丙<丁
D.B的转化率:甲>丙>乙>丁 rich_blue1年前1
rich_blue1年前1 -
 水瓶座懒虫 共回答了18个问题
水瓶座懒虫 共回答了18个问题 |采纳率94.4%解题思路:甲相当于在乙的基础上再增加A的物质的量,所以甲中B的转化率大于乙中B的转化率,但A的转化率要小于乙中A的转化率;
丁相当于在乙的基础上再增加B的物质的量,所以丁中A的转化率大于乙中A的转化率,但B的转化率要小于乙中B的转化率;
丙和乙相比,相当于在增大压强,平衡向逆反应方向移动,所以转化率均降低;
丙和甲相比,相当于在甲的基础上再增加B的物质的量,所以丙中A的转化率大于甲中A的转化率,但B的转化率要小于甲中B的转化率;
丙和丁相比,相当于在丁的基础上再增加A的物质的量,所以丙中B的转化率大于丁中B的转化率,但A的转化率要小于丁中A的转化率.将起始时情况作如下排列:
2A(g)+B(g)⇌3C(g)+2D(g)
甲 2 mol 1 mol
乙 1 mol 1 mol
丙 2 mol 2 mol
丁 1 mol 2 mol
A越少B越多,A的转化率越高,则A转化率最高的为丁,最低的为甲;乙与丙相比较,丙相当于在乙的基础上再分别增加1 mol A和1 mol B,因是恒容为加压,平衡逆向移动使A的转化率减小,故A的转化率甲<丙<乙<丁,同理得B的转化率:丁<丙<乙<甲.
故选A.点评:
本题考点: 化学平衡建立的过程.
考点点评: 本题考查影响化学平衡移动的因素,题目难度中等,注意对比四种容器内各物质的物质的量关系,结合影响平衡移动的因素解答.1年前查看全部
- 在用铜跟稀硝酸进行化学反应时,能使反应的起始速率明显增大的是
在用铜跟稀硝酸进行化学反应时,能使反应的起始速率明显增大的是
如题
A.升高反应温度
B.加入铜的质量增大一倍
C.加入硝酸的量增大一倍
D.加入硝酸的量减半,但浓度增大一倍
为什么 解释清楚点, zch030076931年前4
zch030076931年前4 -
 清新淡然 共回答了23个问题
清新淡然 共回答了23个问题 |采纳率91.3%AD.升高温度反应速率加快.A.
增大反应物的浓度,反应速率加快,与量无关.D
铜是固体,无浓度.1年前查看全部
- 谁能告诉我人教版小学英语第11册(一年级起始)的课文啊
 张小杰贴身字板儿1年前1
张小杰贴身字板儿1年前1 -
 AL0766 共回答了21个问题
AL0766 共回答了21个问题 |采纳率100%哪有第十一册- -汗1年前查看全部
- 斜板沉淀池产泥量如何计算只要求处理ss和cod ,起始分别为500/200mg/l,要求处理后为60/70mg/l,先用
斜板沉淀池产泥量如何计算
只要求处理ss和cod ,起始分别为500/200mg/l,要求处理后为60/70mg/l,先用混凝反应池(加PAC/PAM),接着用斜板沉淀池处理,不知道怎么计算产泥量,没有生物处理是不是单纯的计算处理前后的差就行?
图
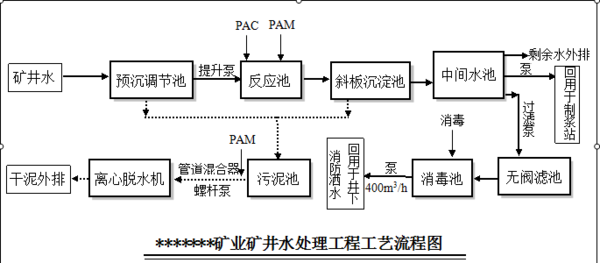
 ohyeah2031年前1
ohyeah2031年前1 -
 laqyx6 共回答了18个问题
laqyx6 共回答了18个问题 |采纳率77.8%Q(C1-C2)*24*T*100/[K*容重*(100-含水率)*n]1年前查看全部
- 一定条件下,对于反应a(s)+b(g),已知b的起始浓度为0.1
 新moon1年前1
新moon1年前1 -
 bblq1985 共回答了24个问题
bblq1985 共回答了24个问题 |采纳率83.3%参考:在一定条件下,可逆反应A2(g)+B2(g)===2C(g)达到平衡时,各物质的平衡浓度为c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L.若用a、b、c表示A2、B2、C的起始浓度,则:a的取值范围是;a、b应满足的关系是
a=b+0.4mol/L
a的范围是0.4-1.3mol/L
假设A物质的变化的浓度为X则由方程式可得
A2(g)+B2(g)====2C(g)
初值 a b c
变化量 X X 2X
终值 0.5 0.1 1.6
根据比例求出a-X=0.5 b-X=0.1
算出a=b+0.4mol/L
所以a大于0.4MOL/L
再利用极值转化,假设C完全转化,即C得最终浓度为0.求出A此时的浓度,即为a最大值1.3
故 0.4mol/L1年前查看全部
- EXCELL中如何将A列起始时间和B列结束时间的时间段分别计算到每个时间段中.
EXCELL中如何将A列起始时间和B列结束时间的时间段分别计算到每个时间段中.
比如:x05
开车时间x05停车时间x05 峰期x05 平期x05 谷期
x05x0519:00-23:00 x0511:00-19:00x0519:-07:00
7:00-11:00
13:35:00 x0521:10:00x05x05x05
23:10:00 08:25:00
12:00 18:00
根据前面时间段对应后面的峰、平、谷期分别计算到相应的时期内,
如入开始时间是12:00,结束时间是18:00,就把它计算在平期那个单元格中.
比如13:35是平期,21:10又是谷期,这个时间段有个跨越. 导弹已上膛1年前1
导弹已上膛1年前1 -
 jtfgddjgfdj 共回答了19个问题
jtfgddjgfdj 共回答了19个问题 |采纳率94.7%可能性太多,要VBA
弄了个VBA自定义函数,测试过了,可以解决问题,费了不少脑筋.
函数名tj(t1,t2,n),参数:t1-开始时间(直接引用单元格),t2-结束时间,n-1、2、3(代表峰平谷的时间段)
Function Tj(t1, t2, n As Integer)
Dim f(2) As Integer, Ti(2), arr(2, 1) As Date
n = n - 1
arr(0, 0) = TimeValue("7:00:00")
arr(0, 1) = TimeValue("4:00:00")
arr(1, 0) = TimeValue("11:00:00")
arr(1, 1) = TimeValue("8:00:00")
arr(2, 0) = TimeValue("19:00:00")
arr(2, 1) = TimeValue("12:00:00")
s = t2 - t1 '总时长
If s < 0 Then
s = TimeValue("23:59:59") + s + TimeValue("00:00:01")
End If
'------------开始时间属于哪一时间段
Select Case t1
Case arr(0, 0) To arr(1, 0) - TimeValue("00:00:01")
f(0) = 0 'f用于记录时间段顺序
f(1) = 1
f(2) = 2
t1_ = arr(0, 1) - (t1 - arr(0, 0))
Case arr(1, 0) To arr(2, 0) - TimeValue("00:00:01")
f(0) = 1
f(1) = 2
f(2) = 0
t1_ = arr(1, 1) - (t1 - arr(1, 0))
Case Else
f(0) = 2
f(1) = 0
f(2) = 1
If t1 > arr(2, 0) Then
t1_ = arr(2, 1) - (t1 - arr(2, 0))
Else
t1_ = arr(2, 0) - arr(2, 1) - t1
End If
End Select
'-------------计算各时间段实际时长
arr(f(0), 1) = t1_
i = 0
While (s > 0 And i < 3)
Ti(f(i)) = WorksheetFunction.Min(arr(f(i), 1), s)
s = s - Ti(f(i))
i = i + 1
Wend
Ti(f(0)) = Ti(f(0)) + s
Tj = Ti(n) '返回指定时间段时长
If Tj = TimeValue("00:00:00") Then
Tj = ""
End If
End Function1年前查看全部
- 自变量随函数变化质点A固定,质点B仅在引力的作用下向A前进(起始速度为0),求速度与时间的函数?第一个时间,距离带来加速
自变量随函数变化
质点A固定,质点B仅在引力的作用下向A前进(起始速度为0),求速度与时间的函数?
第一个时间,距离带来加速度,速度带来新的距离,新的距离又带来新的加速度, 平倭灭奴1年前1
平倭灭奴1年前1 -
 彩虹米奇 共回答了24个问题
彩虹米奇 共回答了24个问题 |采纳率91.7%建以为坐标系 A为原点 质量为M,B的位置为x 质量为m
受力:F=ma=m(dv/dt)=GMm/(x^2)
又有v=dx/dt
设初始AB距离为x0
因为dv/dt=GM/(x^2)(*)
dv/dt=(dv/dx)(dx/dt)=vdv/dx=GM/(x^2)
两边积分 (v^2)/2=-GM/x+GM/x0
得1/x=1/x0-(v^2)/2GM 代入(*)式中
有 dv/dt=GM*[1/x0-(v^2)/2GM]^2
解微分方程可得
t=v^5/(20G^3*M^3)+v^3/(3G^2*M^2*x0)+v/(GM*x0^2)1年前查看全部
- (3)某同学以铁锈为起始反应物,设计实验流程如下(部分反应条件已省略).
(3)某同学以铁锈为起始反应物,设计实验流程如下(部分反应条件已省略).

① F的化学式是 ; ② B与C反应的化学方程式是 ; ③ A-H中,能使紫色石蕊溶液变成红色的物质是 (填化学式).
 zhangxuejing011年前2
zhangxuejing011年前2 -
 白脸惨笑 共回答了24个问题
白脸惨笑 共回答了24个问题 |采纳率91.7%铁锈加热分解为水合Fe2O3,所以A是水,B是Fe2O3
气体C是CO,D是CO2,E是Fe
F是H2,H是FeSO4,G是H2CO3
F的化学式是H2
Fe2O3 + 3 CO = 3 CO2 + 2 Fe
H2CO3、H2SO4(G H 都是酸)1年前查看全部
- 请问基因5’上游的第一个ATG是转录起始点吗?
 wyxxiang1年前1
wyxxiang1年前1 -
 dffg 共回答了18个问题
dffg 共回答了18个问题 |采纳率83.3%转录时需要T7 promoter,在T7 promoter 下游逐个识别,直到第一个ATG(转录起始点)开始转录!1年前查看全部
- 化学平衡与速率1、两容器A和B,A恒压,B恒容,容积相等,起始时分别向AB通入体积比2:1的等量的SO2和O2,并达到平
化学平衡与速率
1、两容器A和B,A恒压,B恒容,容积相等,起始时分别向AB通入体积比2:1的等量的SO2和O2,并达到平衡.问起始时两容器中的反应速率___较大;反应过程中的反应速率___较大.(说明原因)
2、某温度下,在容积固定的密闭容器中发生可逆反应:A(g)+2B(g)===2Q(g).平衡时,各物质的浓度比为A:B:C=1:1:2,保持温度不变,以1:1:2的体积比再充入A、B、Q,则下列说法正确的是:
A、刚充入的反应速率V正减少,V逆增大
B、达到新的平衡时,反应混合物中AB的物质的量分数增加
C、达到新的平衡时,ABQ浓度之比仍为1:1:2
D、达到新的平衡过程中,体系压强先增大,后逐渐减小
3、将镁带投入盛放在敞口容器的盐酸里,产生H2的速率与时间的关系如图(可惜不能显示出来),在下列因素中:
1.盐酸的浓度 2.镁带的表面积 3.溶液的浓度 4.氢气的压强 5.氯离子浓度
影响反应速率的因素有_________
解释图中速率增大段AB形成的原因_________
解释图中速率到达最大值后速率逐渐减小段的原因_________
 Nancylu83161年前1
Nancylu83161年前1 -
 chenyigirl 共回答了20个问题
chenyigirl 共回答了20个问题 |采纳率95%1.起始时速率相等.因所有条件都一样,速率也一样.反应过程中恒压容器中速率快.因这是一个等体积气体反应,恒压时体积会减小,浓度相对恒容的要大,所以速率快.
2.D.
A.速率都增大
B.此操作相当于加压,平衡向正反应移动.Q体积分数增大.
C.因平衡发生移动,比值变化.若是恒压,平衡不移动,则不变.
D.刚充入时,压强增大,因平衡向右移动,分子数减少,压强减小.
3.影响因素:123
AB增大是因为该反应放热,温度上升,速率增大.
过B后是因为盐酸浓度减小太多,浓度的影响超过了温度的影响,所以速率减小.1年前查看全部
- 封闭容器中发生可逆反应x2+y2=2z 起始时浓度分别为0.1; 0.3; 0.2 mol/l 反应在一定条件下到达平衡
封闭容器中发生可逆反应
x2+y2=2z
起始时浓度分别为0.1; 0.3; 0.2 mol/l 反应在一定条件下到达平衡.各物质量浓度可能是.
(c)x2=0.2 y2=0.35 y2=0.2 z=0.4
答案为什么是0.35 zo44441年前1
zo44441年前1 -
 长生不dd 共回答了21个问题
长生不dd 共回答了21个问题 |采纳率85.7%用极限转化的思想,加入X2,Y2全转化成了Z,那么X不剩了,Y还剩下0.2MOL,Z为0.4MOL,但这是不可能的,因为可逆反应都不能彻底反应,所以Z=0.4,Y2=0.2错误.
再考虑Z全部转化为X2,Y2,那么X有0.2MOL,Y有0.4MOL,Z不剩了,这也是不可能的,所以X2=0.2也错误,就只有Y2=0.35是有可能的了1年前查看全部
- 求解 一个分页的计算公式已知数据30条,每页显示5条当前读取的起始行数为10求当前页显示的是第几页分页要公式1:5,2:
求解 一个分页的计算公式
已知数据30条,每页显示5条
当前读取的起始行数为10
求当前页显示的是第几页分页
要公式
1:5,2:10,3:15,4:20,5:25,6:30
下面说的比较清楚===========
1=1,2,3,4,5
2=6,7,8,9,10
3=11,12,13,14
4=15
共15 当前读取到13条 每页显示5 求当前页面是第几页 bfangxiong1年前1
bfangxiong1年前1 -
 珊瑚礁1996 共回答了20个问题
珊瑚礁1996 共回答了20个问题 |采纳率95%currentPage = (currentNum + 5 - 1)/51年前查看全部
- 下列有关人的个体发育过程的叙述,不正确的是( ) A.个体发育起始于受精卵 B.胎儿通过胎盘与母体进行物质交换 C.进
下列有关人的个体发育过程的叙述,不正确的是( ) A.个体发育起始于受精卵 B.胎儿通过胎盘与母体进行物质交换 C.进入青春期后,神经系统的结构和功能没有明显变化 D.进入青春期后,愿意与异性接近是正常的心理变化  雨点0081年前1
雨点0081年前1 -
 yxiao87 共回答了19个问题
yxiao87 共回答了19个问题 |采纳率100%A、生物个体发育的起点是受精卵这一个细胞,由这一个细胞分裂构成的生物体许许多多子细胞,必须经过分化才能形成不同的组织,进而组成各种器官(对于动物体,还要由不同的器官再组成各个系统),来构成复杂的生物体.
B、胎儿生活在子宫内半透明的羊水中,通过胎盘、脐带与母体进行物质交换;怀孕到40周左右,胎儿发育成熟,成熟的胎儿和胎盘一起从母体的阴道排出,即分娩.
C、青春期是一个生长和发育发生重要变化的时期,其中身高突增是青春期的一个显著特点,其次是体重增加,另外,神经系统和心、肺等器官的功能也显著增强,青春期是人一生中身体发育和智力发展的黄金时期.
D、性发育和性成熟也是青春期的重要特征.进入青春期以后,男孩和女孩的性器官都迅速发育,男性的睾丸和女性的卵巢都重量增加,并能够产生生殖细胞和分泌性激素,性激素能促进第二性征的出现,愿意与异性接近,这是正常的心理变化.
故选:C1年前查看全部
- 以知道4A(g)+B(g)=2C(g) 他们的(末)是 0.5 0.4 0.2.怎么求转化和起始浓.
以知道4A(g)+B(g)=2C(g) 他们的(末)是 0.5 0.4 0.2.怎么求转化和起始浓.
4A(g)+B(g)=2C(g) 0 0.2 0.5 0.4 0.2 求有公式的,那样我容易理解.
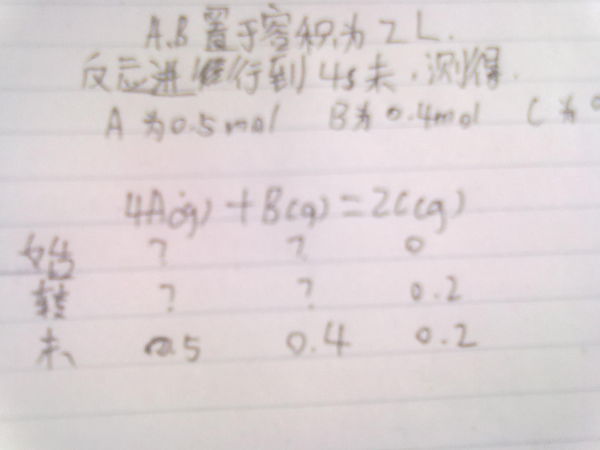
 tombond0081年前1
tombond0081年前1 -
 巧手生花 共回答了12个问题
巧手生花 共回答了12个问题 |采纳率66.7%c的开始浓度是0,说明开始的时候没有c,只有A和B,且4秒后生成0.2mol的C,按照比例关系可知A转化了0.4mol,B转化了0.1mol,所以A在开始时有0.9mol,B在开始时有0.5mol,分别除以总体积便是浓度1年前查看全部
- 假设某种细菌的起始数量为M,理想状态下,每20分钟繁殖一代,T小时后该种群数量为( )
假设某种细菌的起始数量为M,理想状态下,每20分钟繁殖一代,T小时后该种群数量为( )
A. M×20T
B. M×23T
C. 2×MT
D. 2×M20 白水曰泉1年前1
白水曰泉1年前1 -
 芊芊小小贝 共回答了17个问题
芊芊小小贝 共回答了17个问题 |采纳率94.1%解题思路:种群增长的变化曲线分两种:
(1)理想条件下的“J”型增长曲线,增长率一直不变始终为λ.
(2)自然条件下的“S”型增长曲线,增长速率先增大后减小,[K/2]时达到最大.1小时=60分钟,60÷20=3,则T小时细菌繁殖了3T代,理想状态下,种群呈“J”型曲线增长,根据种群“J”型增长的数学模型为:Nt=N0λt,N0为该种群的起始数量,t为时间,Nt表示t时后该种群的数量,λ表示该种群数量是20分钟前种群数量的倍数,将题干所给数据代入可知,T小时后细菌的数量为M×23T.
故选:B.点评:
本题考点: 种群的数量变动.
考点点评: 本题考查种群数量变化的“J”型曲线,结合数学模型学习法中的模型构建,运用具体实例,意在考查学生获取信息,联系基础知识解决问题的能力.1年前查看全部
- 可逆反应x(g)+2Y(g)→3z(g) xyz起始浓度分别c1c2c3,达到平衡时分别为0.1 0.2 0.06 xy
可逆反应x(g)+2Y(g)→3z(g) xyz起始浓度分别c1c2c3,达到平衡时分别为0.1 0.2 0.06 xy的转化率为什么相等?
 gyf117ty1年前1
gyf117ty1年前1 -
 duhuang 共回答了9个问题
duhuang 共回答了9个问题 |采纳率88.9%这个当然相等啊!平衡浓度X Y的比还是1:2,说明转化时X Y是按照1:2转化的,所以 Z Y的转化率就相等啦1年前查看全部
- 在做“测定匀变速直线运动的加速度”的实验 中,取下一段纸带研究其运动情况,如图所示.设0点为计数的起始点,两计数点之间的
 在做“测定匀变速直线运动的加速度”的实验 中,取下一段纸带研究其运动情况,如图所示.设0点为计数的起始点,两计数点之间的时间间隔为0.1秒,则第一个计数点与起始点的距离S1为______cm,打第一个计数点时物体的瞬时速度为______ m/s,物体的加速度为______m/s2.
在做“测定匀变速直线运动的加速度”的实验 中,取下一段纸带研究其运动情况,如图所示.设0点为计数的起始点,两计数点之间的时间间隔为0.1秒,则第一个计数点与起始点的距离S1为______cm,打第一个计数点时物体的瞬时速度为______ m/s,物体的加速度为______m/s2.  szmeilu1年前1
szmeilu1年前1 -
 szjdd2zd 共回答了23个问题
szjdd2zd 共回答了23个问题 |采纳率87%解题思路:由于匀变速直线运动在连续相等的时间内位移之差为常数,可以求出S1大小,根据匀变速直线运动的推论公式△x=aT2可以求出加速度的大小,根据匀变速直线运动中时间中点的速度等于该过程中的平均速度,可以求出打纸带上1点时小车的瞬时速度大小.由于匀变速直线运动在连续相等的时间内位移之差为常数,即x3-x2=(15-9)-(9-s1)=x2-x1=(9-s1)-s1,
解得:S1=4.00cm
根据匀变速直线运动中时间中点的速度等于该过程中的平均速度,
得:v1=
x02
2T=[0.09/0.2]m/s=0.450m/s
根据匀变速直线运动的推论公式△x=aT2可以求出加速度的大小,
得:△x=x2-x1=x3-x2=1cm=aT2,
解得:a=1.00m/s2
故答案为:4.00,0.450,1.00点评:
本题考点: 测定匀变速直线运动的加速度.
考点点评: 要提高应用匀变速直线的规律以及推论解答实验问题的能力,在平时练习中要加强基础知识的理解与应用.1年前查看全部
- 两个极易导热的密闭容器A和B,容器A容积恒定,容器B容积可变,在温度、压强和起始体积相同的条件下往A和B中分别充入等物质
两个极易导热的密闭容器A和B,容器A容积恒定,容器B容积可变,在温度、压强和起始体积相同的条件下往A和B中分别充入等物质的量的NO2,发生反应2NO2⇌N2O4△H<0,以下说法正确的是( )
A. 反应起始时,两容器中的反应速率关系是v(A)<v(B)
B. 反应过程中,两容器内的反应速率关系为v(A)<v(B)
C. 两容器内的反应达到平衡所需时间一定相同
D. 反应达到平衡时,两容器内的压强关系是p(A)>p(B) 小铃儿11年前1
小铃儿11年前1 -
 shrovetide 共回答了19个问题
shrovetide 共回答了19个问题 |采纳率84.2%解题思路:A、反应起始时,二氧化氮的浓度相同、温度相同、压强相同,反应速率相同;
B、容器A体积不变,随反应进行,反应混合气体的物质的量减小,容器A中压强降低,容器B体积可变,压强不变,压强越大,反应速率越快;
C、速率越快,到达平衡的时间越短;
D、容器A体积不变,随反应进行,反应混合气体的物质的量减小,容器A中压强降低,容器B体积可变,压强不变.A、反应起始时,二氧化氮的浓度相同、温度相同、压强相同,反应速率相同,故A错误;
B、容器A中压强降低,容器B体压强不变,压强越大,反应速率越快,故v(A)<v(B),故B正确;
C、速率越快,到达平衡的时间越短,故容器B到达平衡所以时间少,故C错误;
D、容器A体积不变,随反应进行,反应混合气体的物质的量减小,容器A中压强降低,容器B体积可变,压强不变,故反应达到平衡时,两容器内的压强关系是p(A)<p(B),故D错误;
故选B.点评:
本题考点: 化学反应速率的影响因素;化学平衡的影响因素.
考点点评: 本题考查影响化学反应速率的有关因素,难度不大,注意题目实际为恒温条件.1年前查看全部
- 如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂
如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下
 cyffff1年前1
cyffff1年前1 -
 野年糕 共回答了13个问题
野年糕 共回答了13个问题 |采纳率100%A、起始VA=VB=aL,B中的物质的量大于A中的物质的量,即B装置中的浓度大于A装置中的浓度,所以反应开始时,B反应速率大于A反应速率,故正确.
B、等压、等温条件下,气体的体积之比大于气体的物质的量之比,达到平衡时,VA=1.2a L,所以平衡后混合气体的物质的量是2.4mol.
设A物质反应了mmol.
X(g)+Y(g)⇌2Z(g)+W(g) 物质的量增多
1mol 1mol
mmol (2.4-2)mol
m=0.4
所以X物质的转化率=
0.4mol
1mol
×100%=40%;
B装置是在等容条件下,反应向正反应方向移动时,混合气体的物质的量增大,导致容器内气体压强增大,增大压强能抑制X的转化率,故B正确.
C、当打开K时,整个装置是在等温、等压条件下反应.
向将K打开,使整个装置中气体的压强与A装置中的初始压强相同时,A和B的体积之和为3aL,其中B占aL,则A占2aL;当等温等压条件下反应达到平衡状态时,混合气体的体积是用来的1.2倍,即混合气体的体积是3.6aL,其中B是aL,所以A是2.6aL,故C错误.
D、该反应是一个反应前后气体体积增大的吸热反应,升高温度,平衡向正反应方向移动,混合气体的物质的量增大,导致A容器的体积增大,故D正确.
故选C.1年前查看全部
- 对于恒温恒容的容器,改变起始时加入物质的物质的量,通过可逆反应的化学计量数换算成方程式同一边的物质的物质的量与原平横时相
对于恒温恒容的容器,改变起始时加入物质的物质的量,通过可逆反应的化学计量数换算成方程式同一边的物质的物质的量与原平横时相同,则两平衡等效
请问怎么换算?
比如对于这个反应:2SO2+O2=2SO3,设各物质初始的物质的量为A.B.C
为什么AC,AB满足的关系是a+c=2 2b+c=2?
原题:在一定温度下,把2molSO2和1molO2通入一个一定容积的密闭容器里,发生如下反应:2SO2+O2 2SO3,当此反应进行到一定程度时,反应混合物就处于化学平衡状态。现在该容器中,维持温度不变,令a.b.c分别代表初始加入的SO2,O2和SO3的物质的量(mol)。如果a.b.c取不同的数值,他们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同。请填写下列空白:
(1)若a=0,则C=______。
(2)若a=0.5则b=_______,c=_______。
(3)a、b、c必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,另一个只含b和c:______ ID间测了么1年前4
ID间测了么1年前4 -
 arimawj 共回答了21个问题
arimawj 共回答了21个问题 |采纳率90.5%1、意思是起始时不管各物质的量怎么变化(可以三个都有,可以只有某两个或者只有其中一个),反应达到平衡的时候各物质的浓度时相同的.就叫等效平衡.就像从不同的地方都可以到北京一样,过程和轨迹不同,但最后结果都是到了北京.
2、做等效平衡的题目的时候,你先将化学变化看做不可逆反应,将题目中的物质都,变成同一物质,看要是不同的反应形式的物质多少是相同的那么他们就是等效平衡.
3、如上面的题,我不知道为什么!是不是你没有把题目说清楚?
(1)若a=0,则C=2----.
(2)若a=0.5则b=------0.25,c=------1.5.
(3)a、b、c必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,另一个只含b和c:a+c=2 2b+c=21年前查看全部
- (他0上0•茂名二模)在一定条件下,合成塔中氮气和氢气的起始浓度分别为amo8•8-上和下
(他0上0•茂名二模)在一定条件下,合成塔中氮气和氢气的起始浓度分别为amo8•8-上和下mo8•8-上,反应为:a他+你1他→他a1你,氨气的浓度随时间变化如图上所示.

(上)反应到5mia时,氢气反应速率______.
(他)在上0mia时采取的措施是______,A的平衡常数为上他 (α-他)(下-他)你 ,点A的平衡常数K______(填“<”、“>”或“=”)下点的平衡常数.上他 (α-他)(下-他)你
(你)若合成塔内生成上7g氨气放出我5.5kJ热量,在图他坐标上画出该合成氨反应过程中能量随时间的变化示意图.
(我)-50°C时,液氨存在如下电离:他a1你⇌a1我++a1-他,k=他×上0-他,液氨的电离达到平衡时,各微粒的浓度大小关系为______,加入a1我C8固体,K______他×上0-上他(填“<”、“>”或“=”) lwlyuan1年前1
lwlyuan1年前1 -
 desfbnh 共回答了15个问题
desfbnh 共回答了15个问题 |采纳率86.7%解题思路:(1)由反应速率为单位时间内浓度的变化量来计算氨气的反应速率,再利用反应速率之比等于化学计量数之比计算氢气的反应速率;
(2)由图可知10min时氨气的浓度瞬间减小,平衡常数为生成物浓度幂之比与反应物浓度幂之比的比,温度不变,则化学平衡K不变;
(3)生成17g氨气放出46.6kJ热量,即生成1molNH3放出热量46.6kJ,反应物的能量高,生成物的能量低;
(4)电离的程度不大,由电离方程式可知,c(NH+4)=c(NH-2),温度不变,电离平衡常数不变.(4)a人in时氨气的浓度为4人ol/L,则氨气的反应速率为[4人ol/L/a人in]=0.四人ol•L-4•人in-4,
由反应速率之比等于化学计量数之比可知,氢气的反应速率为0.四人ol•L-4•人in-4×[3/4]=4.4人ol•L-4•人in-4,
故答案为:4.4人ol•L-4•人in-4;
(4)由图可知40人in时氨气的浓度瞬间减小,则采取的措施为移去部分氨气,
由N4+3H4→4NH3,
开始a b 0
转化4 6 4
平衡a-4 b-6 4
则K=
46
(α-4)(b-6)3,
因A和B点的温度相对,则化学平衡常数K相等,故答案为:移去部分氨气;
46
(α-4)(b-6)3;=;
(3)由题意可知生成4人olNH3放出热量46.6k四,反应物的能量高,生成物的能量低,如图 ,
,
故答案为: ;
;
(4)因电离的程度不r,由电离方程式可知,c(NH+4)=c(NH-4),则c(NH3)>c(NH+4)=c(NH-4),又温度不变,电离平衡常数K不变,
故答案为:c(NH3)>c(NH+4)=c(NH-4);=.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学平衡常数的含义;化学平衡的影响因素;化学平衡的计算.
考点点评: 本题考查化学反应速率、化学平衡移动、平衡常数、电离等知识,明确图象及图象的分析是解答本题的关键,难度较大.1年前查看全部
- 在一定温度下,有A,B两个容器,A是恒容密闭容器,B是恒压密闭容器.两容器起始状态完全相同,其中都充有NO2气体,如果只
在一定温度下,有A,B两个容器,A是恒容密闭容器,B是恒压密闭容器.两容器起始状态完全相同,其中都充有NO2气体,如果只考虑发生下列可逆反应:2NO2=N2O4,分别经过一段时间后,A,B都达到平衡.下列有关叙述正确的是( )
A.平衡反应速率:A>B B.平衡时NO2物质的量:B>A C.平衡时NO2的转化率:A>B D.平衡时N2O4物质的量:B>A ho3211231年前2
ho3211231年前2 -
 上只角小开 共回答了15个问题
上只角小开 共回答了15个问题 |采纳率100%D
A是恒容密闭容器,-----即容器体积不变,随反应进行,容器中压强会减小
B是恒压密闭容器----即有活塞,而且会向内运动,即容器的体积会减小
A.平衡反应速率:A>B -----错,平衡时A的体积大,相当于压强小,因此速率小
B.平衡时NO2物质的量:B>A ----错,B容器体积变小,相当于加压,平衡正向移动,生成的N2O4多,NO2则少
C.平衡时NO2的转化率:A>B ----错,B中的转化率大
D.平衡时N2O4物质的量:B>A----对1年前查看全部
- 1路、2路公共汽车早上7时同时从起始站发车,1路车隔7分发一辆车,2路车每隔8分发一辆车.列表这两辆车发车
 adrurt1年前1
adrurt1年前1 -
 暗黑吟游诗人 共回答了20个问题
暗黑吟游诗人 共回答了20个问题 |采纳率90%它们每隔7*8=56分同时发一次车
第一次 7:00同时发车
第二次 7:56同时发车
第三次 8:52同时发车
''''''1年前查看全部
- 一定条件下,可逆反应X(g)+3Y(g)⇌2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时
一定条件下,可逆反应X(g)+3Y(g)⇌2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
A. c1:c2=1:3
B. 平衡时,Y和Z的生成速率之比为3:2
C. 达平衡过程中,X、Y浓度减小
D. c1的取值范围为0<c1<0.14 mo/L oO妖惜罗Oo1年前4
oO妖惜罗Oo1年前4 -
 我_男女男 共回答了15个问题
我_男女男 共回答了15个问题 |采纳率86.7%解题思路:A、平衡时X、Y的浓度之比为1:3,X、Y按1:3反应,故X、Y起始浓度之比为1:3;
B、平衡时,不同物质表示的正、逆速率之比等于化学计量数之比,据此判断;
C、不能确定反应向哪个方向到达的平衡状态,可能向左反应到达的平衡;
D、若向右到达的平衡c1的值最大,若向左到达的平衡c1的值最小,据此计算判断.A、平衡时X、Y的浓度之比为1:3,X、Y按1:3反应,故X、Y起始浓度之比为1:3,故A正确;
B、平衡时,不同物质表示的正、逆速率之比等于化学计量数之比,Y的生成速率表示逆反应少量,Z的生成速率表示正反应速率,Y和Z的生成速率之比为3:2,等于化学计量数之比,处于平衡状态,故B正确;
C、若反应向左进行到达平衡,X、Y浓度增大,故C错误;
D、若向右到达的平衡c1的值最大,平衡时Z的浓度为0.08mol/L,由于Z的浓度开始不是0,故Z的浓度变化小于0.08mol/L,由方程式可知,X的浓度变化量小于0.04mol/L,故c1<0.14 mo/L,若向左到达的平衡c1的值最小,平衡时X、Y的浓度为1:3,等于化学计量数,可以是Z分解生成,由于X的起始浓度大于0,故0<c1<0.14 mo/L,故D正确;
故选C.点评:
本题考点: 化学平衡的计算.
考点点评: 考查化学平衡的有关计算,难度中等,D选项中利用极限法判断取值反应,注意X、Y平衡浓度不等于化学计量数之比的情况.1年前查看全部
- 在密闭容器中进行反应x(g)+y(g)[可逆反应符号]2z(g),已知x、y、z的起始浓度分别为0.1(mol乘以L的负
在密闭容器中进行反应x(g)+y(g)[可逆反应符号]2z(g),已知x、y、z的起始浓度分别为0.1(mol乘以L的负一次幂)、0.3(mol乘以L的负一次幂)、0.2(mol乘以L的负一次幂),在一定条件下当反应达到平衡时各物质的浓度有可能是 ( )
1.z为0.3(mol乘以L的负一次幂)2.x为0.2(mol乘以L的负一次幂)
3.y为0.35(mol乘以L的负一次幂)4.z为0.4(mol乘以L的负一次幂)
A1.2.B1.3.C2.4.D1.4. churchillone1年前1
churchillone1年前1 -
 bln001 共回答了12个问题
bln001 共回答了12个问题 |采纳率91.7%B
转化率不可能为100%
故2.,4错1年前查看全部
- 重音符号标在音节起始位置,表示整个音节都重读吗?音节的起始位置一定是铺音字母吗?
 bimengjushou1年前2
bimengjushou1年前2 -
 551360001 共回答了17个问题
551360001 共回答了17个问题 |采纳率82.4%重音符号标在音节起始位置,表示整个音节都重读.一般一个音节只有一个元音,
音节的起始位置不一定是铺音字母,例如 appreciate.1年前查看全部
- 有一条公共汽车的行车路线,除去起始站和终点站外,中途有九个车站,一辆公共汽车从起始站开始上乘客,除终点站外,每一站上车的
有一条公共汽车的行车路线,除去起始站和终点站外,中途有九个车站,一辆公共汽车从起始站开始上乘客,除终点站外,每一站上车的乘客中都恰好有一位乘客从这一站到以后的每一站下,为了使每位乘客都有座位这辆公共汽车至少要有多少个座位
 吖芝吖左391年前1
吖芝吖左391年前1 -
 ddkitty 共回答了10个问题
ddkitty 共回答了10个问题 |采纳率100%起始站后有10个站,即起始站有10人上车,增加10人
第1站后有9站,有9人上车,1人下车,增加8人
第2站后有8站,有8人上车,2人下车,增加6人
第3站后有7站,有7人上车,3人下车,增加4人
第4站后有6站,有6人上车,4人下车,增加2人
第5站后有5站,有5人上车,5人下车,增加0人
第6站后有4站,有4人上车,6人下车
第7站后有3站,有3人上车,7人下车
第8站后有2站,有2人上车,8人下车
第9站后有1站,有1人上车,9人下车
从上述列举中可以看出,从第5站后下车人数开始比上车人数多
所以至少10+8+6+4+2=30个座位1年前查看全部
- 一条公共汽车的行车路线,除去起始站和终点站外,中途有9个车站.一辆公共汽车从起始站开始上乘客,每一站上车人数都是前一站的
一条公共汽车的行车路线,除去起始站和终点站外,中途有9个车站.一辆公共汽车从起始站开始上乘客,每一站上车人数都是前一站的一半,为了使每位乘客都有座位,这辆车至少要有几个座位?
 蓝乔一线1年前1
蓝乔一线1年前1 -
 虎张张 共回答了14个问题
虎张张 共回答了14个问题 |采纳率85.7%1023个座位.
从起始站开始上车,终点站是没有人上车的,那就是说有10站是有人要上车的.
把起始站设为第一站,那么终点站的前一站就是第十站.
每一站都有人上车,且人数都是前一站的一半,也就是说每一站上车的人数是后一站的两倍,那么假设第十站上来1个人,第九站:2个人,第八站:4个人,第七站:8个人,第六站:16个人,第五站:32个人,第四站:64个人,第三站:128个人,第二站:256个人,第一站:512个人.加在一起应该是1023个座位.1年前查看全部
- 在标准状况下,往 100 mL 的氢气和氮气的混合气体中通入100 mL 氧气并点燃,反应完成后让气体恢复到起始状态,测
在标准状况下,往 100 mL 的氢气和氮气的混合气体中通入100 mL 氧气并点燃,反应完成后让气体恢复到起始状态,测得体积为 125 mL ,其中氧气占60%,则原有氢气和氮气的混合气体中,氮气所占的体积应为( )
A.60 mL B.50 mL C.30 mL D.25 mL  流泪的鱼1191年前0
流泪的鱼1191年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在听磁带式录音机的录音时,经过20分钟,带轴上带卷的半径会减少[1/3].那么,从此刻到带卷的半径变成起始半径的一半时,
在听磁带式录音机的录音时,经过20分钟,带轴上带卷的半径会减少[1/3].那么,从此刻到带卷的半径变成起始半径的一半时,经过的时间为( )
A.8分钟
B.7分钟
C.6分钟
D.5分钟 sea-blue1年前1
sea-blue1年前1 -
 水月lina 共回答了24个问题
水月lina 共回答了24个问题 |采纳率83.3%解题思路:录音机工作过程中,磁带转动速度是一定的,根据带轴直径和磁带厚度一定,利用带卷半径变化关系和所用时间成正比得到后半段需要的时间.听磁带式录音机的录音时,带卷线速度大小不变,设磁带厚度为d,初始带轴上带卷的半径为R.
经过20min,带轴上带卷的半径减少[1/3],为[2/3]R,磁带长度为L1=
1
3R
d×2π×[5/6]R;
设从此刻到带卷半径变为起始的一半时,经过的时间为t,
磁带长度为L2=
1
6R
d×2π×[7/12]R,
由
L2
t=
L1
20min,
解得t=7min.
故选B.点评:
本题考点: 速度公式及其应用.
考点点评: 此题考查的是速度计算公式的应用,根据带卷半径一定和磁带厚度一定,得到两种情况下磁带长度的表达式,是解决此题的关键.1年前查看全部
- 用智慧LOGO画圆.要用递归,要用到变量,要命令.起始边长(半径)是10,边长每次增加1,最长边长是200
 ss斗1年前1
ss斗1年前1 -
 4501458 共回答了25个问题
4501458 共回答了25个问题 |采纳率96%to yuan:n
if :n>200 then stop
fd :n
yuan :n+1
end
yuan 101年前查看全部
- 在一定温度下、一定体积的密闭容器中有如下平衡:H 2 (g)+I 2 (g) 2HI(g)。已知H 2 和I 2 的起始
在一定温度下、一定体积的密闭容器中有如下平衡:H 2 (g)+I 2 (g)
 2HI(g)。已知H 2 和I 2 的起始浓度均为0.10 mol/L,达到平衡时HI的浓度为0.16 mol/L,若H 2 和I 2 的起始浓度均为0.20 mol/L,则平衡时H 2 的浓度(mol/L)是
2HI(g)。已知H 2 和I 2 的起始浓度均为0.10 mol/L,达到平衡时HI的浓度为0.16 mol/L,若H 2 和I 2 的起始浓度均为0.20 mol/L,则平衡时H 2 的浓度(mol/L)是A.0.32 B.0.16 C.0.08 D.0.04  logical12241年前1
logical12241年前1 -
 aytzb 共回答了24个问题
aytzb 共回答了24个问题 |采纳率95.8%D
由于反应前后体积不变,所以两次的平衡是等效的,则第二次平衡时氢气的浓度是第一次的2倍,即(010mol/L-0.08mol/L)×2=0.04mol/L,答案选D。1年前查看全部
- 在密闭的容器中发生反应,X(g)+3Y(g)[可逆号]2Z(g),若X、Y、Z、的起始浓度分别为0.1,0.3,0.2
在密闭的容器中发生反应,X(g)+3Y(g)[可逆号]2Z(g),若X、Y、Z、的起始浓度分别为0.1,0.3,0.2
这是一道题目,我知道怎样解,但是为什么这还没有平行,它们的浓度都已经于方程式的比例一样了(以上浓度单位都是mol/L) 131763886681年前2
131763886681年前2 -
 丛中飞 共回答了16个问题
丛中飞 共回答了16个问题 |采纳率93.8%建立平衡状态,既可以从正方向开始即只加反应物,也可以从逆方向开始即只加生成物,也可以从正逆两个方向同时开始即开始时反应物生成物都加入了.开始加入的物质的量是任意的,可以与化学计量数成比例,也可以与化学计量数无关.但各物质变化的物质的量之比一定等于对应化学计量数之比1年前查看全部
- 1.某车站是三条线路公共汽车的起始站,1路车每6分钟发一辆车,2路车每5分钟发一辆车,3路车每8分钟发一辆车,早晨6时三
1.某车站是三条线路公共汽车的起始站,1路车每6分钟发一辆车,2路车每5分钟发一辆车,3路车每8分钟发一辆车,早晨6时三路车同时发第一辆车,问最早到几时几分三条线路的车再次同时发车.(要算式)
2.把下面的分数约分,是假分数的化成带分数或整数.
32分之6 80分之150 78分之14 12分之240
3.通分,并比较每组数的大小.
11分之3和5分之2 12分之7和9分之5 3分之2,7分之4和9分之5
4.求下面每组数的最大公因数和最小公倍数.
32和16 12和30 7和15 benson_ye1年前1
benson_ye1年前1 -
 ysql 共回答了20个问题
ysql 共回答了20个问题 |采纳率95%1 求6、5、8的最小公倍数,即120,意思就是120分钟后再次同时发车,即8时
2
6/32=3/16 150/80=15/8=1又7/8 14/78=7/39 240/12=20
3
3/11=15/55小于2/5=22/55 7/12=21/36大于5/9=20/36
2/3=42/63大于4/7=36/63大于5/9=35/63
4
32和16 最大公因数16 最小公倍数32
12和30 最大公因数6 最小公倍数60
7和15 最大公因数1最小公倍数1051年前查看全部
- 在一定温度下,有A、B两个容器,A是恒容密闭容器,B是恒压密闭容器.两容器起始状态完全相同,其中都充有NO(2写在右下角
在一定温度下,有A、B两个容器,A是恒容密闭容器,B是恒压密闭容器.两容器起始状态完全相同,其中都充有NO(2写在右下角)气体,如果只考虑发生下列可逆反应:2NO(2写在右下角)【可逆符号】N(2写右下角)O(4写右下角),分别经过一段时间后,A、B都达到平衡,下列有关叙述正确的是(CD )
A 平均反应速率A>B
B 平衡时NO(2写右下角)的物质的量B>A
C平衡时NO(2写右下角)的转化率B>A
D平衡时N(2写右下角)O(4写右下角)的物质的量B>A
【注:已经知道答案选CD,我要问的是有关这道题的一个解题知识点:(我们班老师总结的):同一反应在不同的容器中,恒温恒压相当于在恒温恒容的基础上增大压强.这个规律是在任何情况下都成立吗?即如果正反应是体积增大的反应的时候还是成立的吗?这块小生不大明白, 情报局1年前1
情报局1年前1 -
 2005jie11 共回答了15个问题
2005jie11 共回答了15个问题 |采纳率86.7%你可以这样考虑:
此反应:2NO2 → N2 +2O2 由2体积的NO2 生成1体积氮气和2体积氧气,由2体积气体一共生成3体积气体,是气体体积增加的反应;记住压强增加,可逆反应的平衡向气体体积减小的方向移动.
A: 恒容就是体积不变,但是压强会变.B: 恒压就是压强不变.
而此反应是气体体积增加的反应,也就是反应进行中若容器容积不变则压强会变大.所以,A恒容增压,反应向逆反应方向移动,生成的氮气和氧气的体积比B小,反应速率也小.
但是,同一反应在不同的容器中,恒温恒压相当于在恒温恒容的基础上增大压强.这不对吧.应该是同一体积增大的反应在不同的容器中,恒容相当于在恒压的基础上增大压强.而体积增大的反应,恒容相当于在恒压的基础上增大压强.1年前查看全部
- 向盛有12.6克碳酸氢钠固体的烧杯中,加入100.5克硫酸溶液恰好反应.烧杯连同药品的起始质量为200克,当碳酸氢钠与硫
向盛有12.6克碳酸氢钠固体的烧杯中,加入100.5克硫酸溶液恰好反应.烧杯连同药品的起始质量为200克,当碳酸氢钠与硫酸溶液恰好完全反应,烧杯连同药品的质量为193.4克.反应方程式为2NaHCO3+H2SO4=Na2SO4+2CO2+2H2O 1.当碳酸氢钠与硫酸溶液完全反应,所产生的二氧化碳的质量为多少 2.反应后,所得硫酸钠溶液中的溶质的质量分数是多少
 gogpolice1年前1
gogpolice1年前1 -
 好好18 共回答了18个问题
好好18 共回答了18个问题 |采纳率100%1.设生成二氧化碳的质量为x ,反应后烧杯连同药品的质量的减少的值就是产生的二氧化碳的质量x = 200 - 193.4 = 6.6g2.2NaHCO3+H2SO4=Na2SO4+2CO2+2H2O 142 88y 6.6gy = 10.65g10.65÷(12.6+100.5-6.6)×100% = 10...1年前查看全部
- 在一真空容器中,冲入10molN2和30molH2 发生反应,N2的转化率是25%,若相同条件下,统一容器,起始时指向其
在一真空容器中,冲入10molN2和30molH2 发生反应,N2的转化率是25%,若相同条件下,统一容器,起始时指向其中加入NH3 于是平衡时,与上述反应等效,则nh3加多少,转化率是多少?
 黑色等待微笑1年前1
黑色等待微笑1年前1 -
 hanh2005 共回答了20个问题
hanh2005 共回答了20个问题 |采纳率75%由于反应N2+3H22NH3中气体体积数发生改变,所以要在同一容器中形成等效平衡,所加的量必须和原平衡完全一致,10molN2和30molH2 代入方程式可得,相当于20mol氨气,所以要加20molNH3,正向转化25%即逆向转化75%,所以NH3转化率是75%1年前查看全部
- 跟起始扭矩有关的.原题:Which of the following motors usually produces t
跟起始扭矩有关的.
原题:Which of the following motors usually produces the largest starting torque?
大概意思就是:下面那个发动机能产生最大的起始扭矩.
选项:
series-wound 串联的
permanent-magnet 永久磁铁
shunt-wound 并联的
compound 混合的 冬天可乐1年前1
冬天可乐1年前1 -
 心语love 共回答了21个问题
心语love 共回答了21个问题 |采纳率90.5%对于直流电机来说,串励的启动转矩最大.其次应该是永磁,然后是复励,最后是并励.1年前查看全部
- 化学等效平衡很难的题两容器,起始体积相同,一个恒压,一个恒容.一个充3摩尔A,1摩尔B,另一个充a摩尔A,b摩尔B,c摩
化学等效平衡很难的题
两容器,起始体积相同,一个恒压,一个恒容.
一个充3摩尔A,1摩尔B,另一个充a摩尔A,b摩尔B,c摩尔C,达平衡时两容器压强相等,C的体积分数相等,则a,b,c的关系式如何?
反应式:3A+B=2C,为放热反应 wgh16333331年前1
wgh16333331年前1 -
 总会有情天 共回答了16个问题
总会有情天 共回答了16个问题 |采纳率87.5%答案:a=3b,c大于等于0.
由于“达平衡时两容器压强相等,C的体积分数相等”,可知这两个反应是等效的.
反应方程式:3A+B=2C,可知反应前后系数不等,所以,这种类型的反应要想达到等效平衡,必须满足:对应的反应物的量与对应的系数都成一定的比例.已知“充3摩尔A,1摩尔B”与“充a摩尔A,b摩尔B,c摩尔C”是等效的,可列:
3A+B==2C
3----1
a----b---c(可将cmolC看成1.5cmol的A和0.5cmol的B)
(a+1.5c)----(b+0.5c)----0
要想达到平衡,必须满足:
(a+1.5c)/3=(b+0.5c)/1
可解得:a=3b,与c的量无关,但同时要说明c大于等于零.1年前查看全部
- 已知AUG,GUG为起始密码,UAA,UGA,UAG为终止密码.某mRNA的碱基排列顺序如下;AUUGGAUGAC...
已知AUG,GUG为起始密码,
UAA,UGA,UAG为终止密码.某mRNA的碱基排列顺序如下;AUUGGAUGAC...(40个碱基)...UCUAGAUCU.此mRNA控制合成的蛋白质所含氨基酸的数目为多少.答案为16个 garden1211年前1
garden1211年前1 -
 天使玩具 共回答了23个问题
天使玩具 共回答了23个问题 |采纳率91.3%AUG开始UAG结束
3+2+40+2=47 47/3
你因该是少打了一个,应该是48/3=16
三个碱基构成一个密码子合成一个蛋白质,所以除以三1年前查看全部
- 1.25摄氏度时,醋酸的起始浓度是0.010mol/L,则平衡时的溶液的ph是多少?(电离平衡常数1.76乘以10的负五
1.25摄氏度时,醋酸的起始浓度是0.010mol/L,则平衡时的溶液的ph是多少?(电离平衡常数1.76乘以10的负五次方).
2.浓度都是0.1mol/L的溶液①氨水②盐酸③氯化铵溶液,为什么铵根离子的浓度是③>①?答案说氨水是弱电解质,氯化铵是强电解质,但是氯化铵不是会水解么?我怎么知道哪个浓度高啊?还有,①③的混合溶液为什么是碱性的啊
3.25摄氏度时,在氢氧化镁悬浊液中加入氟化钠溶液,氢氧化镁不可能转化成氟化镁,已知氢氧化镁溶度积常数是5.61乘以10的负12次方,氟化镁的溶度积常数是7.42乘以10的负11次方.为什么这句话是错的 clearfeng1年前1
clearfeng1年前1 -
 不乖girl 共回答了11个问题
不乖girl 共回答了11个问题 |采纳率90.9%(1)pH=3.38 公式 C(H+)=(CHAc*KHAc)1/2
(2)氯化铵数强电解质,在水溶液中会把铵根离子全部解离出来,而电离和水解的程度都是很小的,所以氯化铵大于氨水,混合后会显碱性.
(3)当氟化钠的浓度大到一定程度时,氢氧化镁会转化为氟化镁.(工业上就是用碳酸钠的饱和溶液开溶解硫酸钡的).1年前查看全部
大家在问
- 1写近、反义词写近义词精湛~宏伟~古朴~寓意~珍贵~严厉~热闹~疲惫~藐视~焦急~寒冷~舒适~奇怪~以前~写反义词美好~寒
- 2请高手指点,twining,twin在晶体科学领域如何翻译.
- 3谢谢你给我的温暖作文,600字,有细节描写
- 4太阳有多大?人类目前发现最大的是什么星球?
- 5求椭圆,双曲线,各个各个公式^ω^
- 6汽车从距A站300千米的B站,以每小时60千米的速度开向A站,写出汽车离B站S(千米)与开出的时间t(时)之间的函数关系
- 7计算 ( x-2y )^4 ÷ ( 2y-x )^ 2 ÷ ( x-2y )
- 8如图所示,质量为M的木板静置在光滑的水平面上,在M上放置一质量为m的物块,物块与木板的接触面粗糙.当物块以初速度v0向右
- 9已知y=ax^2+bx+c与y轴交与点A(0,3),与x轴分别交与B(1,0),C(5,0)两点.
- 10请分析有关植物光合作用的资料:在一定浓度的CO2和适宜的温度条件下,测定A植物和B植物在不同光照条件下的光合速率,结果如
- 11求关于x的不等式ax^2-ax+1>0恒成立的充要条件
- 12BD,CE分别是AC,AB边上的高,连接DE.是说明三角形ADE相似于三角形ABC
- 13书面表达 假如这是你的全家福照片。一天Miss Wang到你家家访,请
- 14请你展开想象,以老渔翁和小鱼儿作为故事中的主人公,编一个动人的童话故事.
- 15月亮不围绕地球上课时听老师说,有一个科学家最新的观点认为,地球并不是月亮运行轨道的焦点,能把这种说法的详细资料说一下吗?
