取50.0mLNa2CO3和Na2SO4的混合溶液,加入过量BaCi2溶液后得到14.51g白色沉淀,用过量稀硝酸处理后
 紫药水2022-10-04 11:39:542条回答
紫药水2022-10-04 11:39:542条回答试计算:
(1)原混合液中Na2CO3的物质的量.
(2)原混合液中Na2SO4的物质的量浓度.
(3)产生的气体在标准状况下的体积.

已提交,审核后显示!提交回复
共2条回复
 s_rdpe67_pb5_c67 共回答了14个问题
s_rdpe67_pb5_c67 共回答了14个问题 |采纳率92.9%- 解析:生成的14.51g白色沉淀就是BaSO4和BaCO3的质量,4.66g就是BaSO4的质量,所以
m(BaCO3)=14.51- 4.66=9.85g
(1) Na2CO3---------------BaCO3
1 197
n(Na2CO3) 9.85 n(Na2CO3)=0.05(mol)
(2) Na2SO4------------------ BaSO4
1 233
n(Na2SO4) 4.66 n(Na2SO4)=0.02(mol)
C(Na2SO4)=n/V=0.02/0.05=0.4(mol/L)
(3) Na2CO3---------------CO2
1 22.4
0.05 V(CO2) V(CO2)=1.12(L)
答:略 - 1年前
 tinycheng 共回答了2139个问题
tinycheng 共回答了2139个问题 |采纳率- BaCO3的质量 = 14.51 g - 4.66 g = 9.85 g
BaCO3的物质的量 = 9.85 g ÷ 197 g/mol = 0.05 mol
Na2CO3的物质的量= BaCO3的物质的量 = 0.05 mol
BaSO4的物质的量为:4.66 g ÷ 233 g/mol = 0.02 mol
Na2SO4的物质的量浓度为:0.... - 1年前
相关推荐
- 若以0.10m盐酸滴定50.0ml之氨水,达当量点时溶液之ph值约为何?
 cwt2581年前4
cwt2581年前4 -
 myuk 共回答了16个问题
myuk 共回答了16个问题 |采纳率100%滴定终点pH要看你用什么指示剂,一般都在7左右1年前查看全部
- 如图是一套电解装置,两U型管中均盛有50.0mL电解质溶液,a、b、c、d为 Pt电极.通电一段时间,d电极上
 如图是一套电解装置,两U型管中均盛有50.0mL电解质溶液,a、b、c、d为 Pt电极.通电一段时间,d电极上析出金属Ag 2.16g,没有气体产生.同时在b、c两极收集到标准状况下相同体积的气体.请回答:
如图是一套电解装置,两U型管中均盛有50.0mL电解质溶液,a、b、c、d为 Pt电极.通电一段时间,d电极上析出金属Ag 2.16g,没有气体产生.同时在b、c两极收集到标准状况下相同体积的气体.请回答:
(1)c为______极,写出c电极上的电极反应式:______,c极收集到的气体体积在标准状况下为______L.
(2)b为______极,写出b电极上的电极反应式:
开始时是______、后来是______.
(3)原CuCl2溶液中溶质的物质的量浓度为______mol/L. harlow9111年前1
harlow9111年前1 -
 自己人青 共回答了26个问题
自己人青 共回答了26个问题 |采纳率80.8%解题思路:电解池阳极连接电源的正极,阴极连接电源的负极,由此可知a为阳极、b为阴极,c为阳极,d为阴极,电解池工作时阳极发生氧化反应,阴极发生还原反应,结合电解质溶液的类型以及离子的放电顺序书写电极方程式,以此解答该题.电解池阳极连接电源的正极,阴极连接电源的负极,由此可知a为阳极、b为阴极,c为阳极,d为阴极,
(1)c连接电源正极,为电解池的阳极,发生氧化反应,电极方程式为4OH--4e-=2H2O+O2↑,
n(Ag)=[2.16g/108g/mol]=0.02mol,阴极电极反应式为Ag++e-=Ag,可知转移0.02mol电子,则生成0.005molO2,体积为0.005mol×22.4L/mol=0.112L,
故答案为:阳;4OH--4e-=2H2O+O2↑;0.112;
(2)b连接电源负极,为电解池阴极,由于放电顺序为Cu2+>H+,题中给出信息“b、c两极收集到标准状况下相同体积的气体”,则说明b极先后发生Cu2++2e-=Cu、2H++2e-=H2↑,
故答案为:阴;Cu2++2e-=Cu;2H++2e-=H2↑;
(3)由(1)可知c极生成0.005molO2,体积为0.005mol×22.4L/mol=0.112L,转移0.02mol电子,
则b极生成0.005molH2,消耗n(H+)=0.01mol,由串联电路转移电子数目相等可知2n(Cu2+)+n(H+)=0.02mol,
则n(Cu2+)=0.005mol,
c(Cu2+)=[0.005mol/0.05L]=0.10mol/L,
故答案为:0.10.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题以电解池原理为载体考查了物质的量的有关计算、原电池正负极的判断等知识点,明确发生的电极反应及电子守恒是解答本题的关键,难度不大.1年前查看全部
- 取50.0mlNa2CO3和和Na2SO4的混合溶液加入过量BaCl2溶液后得到14.51g白色沉淀化学方程式是什么
 倚狮观月1年前3
倚狮观月1年前3 -
 sperm1234 共回答了22个问题
sperm1234 共回答了22个问题 |采纳率95.5%BaCl2+Na2CO3=BaCO3 沉淀 +2NaCl
BaCl2+Na2SO4=BaSO4 沉淀 +2NaCl1年前查看全部
- 常温下将12.5gCuSO4•5H2O溶解于水配制成50.0mL溶液,求:
常温下将12.5gCuSO4•5H2O溶解于水配制成50.0mL溶液,求:
(1)该溶液中阴阳离子的总物质的量.
(2)该溶液中CuSO4的物质的量浓度.
(3)取出20.0mL该溶液配成浓度为0.0500mol/L的稀溶液,则稀释后溶液的体积是多少毫升? 魔鬼爱天使1年前1
魔鬼爱天使1年前1 -
 11界3中yy 共回答了21个问题
11界3中yy 共回答了21个问题 |采纳率100%解题思路:(1)根据n=[m/M]计算12.5g CuSO4•5H2O的物质的量,在溶液中CuSO4=Cu2++SO42-,溶质电离出的阴阳离子的总物质的量为硫酸铜的2倍;
(2)根据c=[n/V]计算溶液中CuSO4的物质的量浓度;
(3)根据稀释定律,稀释前后溶质硫酸铜的物质的量不变,据此计算.(1)12.5g CuSO4•5H2O的物质的量为[12.5g/250g/mol]=0.05mol,故n(CuSO4)=0.05mol,在溶液中 CuSO4=Cu2++SO42-,溶质电离出的阴阳离子的总物质的量为硫酸铜的2倍,即为0.05mol×2=0.1mol,
答:溶质电离出的阴阳离子的总物质的量为0.1mol;
(2)n(CuSO4)=0.05mol,溶液体积为50mL,故该溶液中CuSO4的物质的量浓度为:[0.05mol/0.05L]=1mol/L,
答:该溶液中CuSO4的物质的量浓度为1mol/L;
(3)令稀释后溶液的体积为V,根据稀释定律,稀释前后溶质硫酸铜的物质的量不变,则:
20.0mL×1mol/L=V×0.0500mol/L,
解得:V=400mL,
答:稀释后溶液的体积是400mL.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查物质的量浓度的有关计算,比较基础,注意对公式的理解与灵活运用,(3)中利用稀释定律比利用定义法计算,为高频考点,有利于培养学生的良好的科学素养,提高学生学习的积极性,难度不大.1年前查看全部
- 纳氏试剂比色法测定某水样中的氨氮水样时,取10.0ml水样于50.0ml比色管中,加水至标线,加1ml酒石酸钾纳溶液和1
纳氏试剂比色法测定某水样中的氨氮水样时,取10.0ml水样于50.0ml比色管中,加水至标线,加1ml酒石酸钾纳溶液和1ml纳氏试剂,比色测定,从校准曲线上查的氨氮量0.0180mg.试求水样中氨氮的含量(mg/l)?
 wangyingxianzi1年前1
wangyingxianzi1年前1 -
 wojiaoten 共回答了17个问题
wojiaoten 共回答了17个问题 |采纳率82.4%答:水样中氨氮的含量(mg/L) = 0.0180mg /0.01L = 1.81年前查看全部
- 常温下将12.5gCuSO4•5H2O溶解于水配制成50.0mL溶液,求:
常温下将12.5gCuSO4•5H2O溶解于水配制成50.0mL溶液,求:
(1)该溶液中阴阳离子的总物质的量.
(2)该溶液中CuSO4的物质的量浓度.
(3)取出20.0mL该溶液配成浓度为0.0500mol/L的稀溶液,则稀释后溶液的体积是多少毫升? 双双表昧1年前1
双双表昧1年前1 -
 hlg198110 共回答了20个问题
hlg198110 共回答了20个问题 |采纳率85%解题思路:(1)根据n=[m/M]计算12.5g CuSO4•5H2O的物质的量,在溶液中CuSO4=Cu2++SO42-,溶质电离出的阴阳离子的总物质的量为硫酸铜的2倍;
(2)根据c=[n/V]计算溶液中CuSO4的物质的量浓度;
(3)根据稀释定律,稀释前后溶质硫酸铜的物质的量不变,据此计算.(1)12.5g CuSO4•5H2O的物质的量为[12.5g/250g/mol]=0.05mol,故n(CuSO4)=0.05mol,在溶液中 CuSO4=Cu2++SO42-,溶质电离出的阴阳离子的总物质的量为硫酸铜的2倍,即为0.05mol×2=0.1mol,
答:溶质电离出的阴阳离子的总物质的量为0.1mol;
(2)n(CuSO4)=0.05mol,溶液体积为50mL,故该溶液中CuSO4的物质的量浓度为:[0.05mol/0.05L]=1mol/L,
答:该溶液中CuSO4的物质的量浓度为1mol/L;
(3)令稀释后溶液的体积为V,根据稀释定律,稀释前后溶质硫酸铜的物质的量不变,则:
20.0mL×1mol/L=V×0.0500mol/L,
解得:V=400mL,
答:稀释后溶液的体积是400mL.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查物质的量浓度的有关计算,比较基础,注意对公式的理解与灵活运用,(3)中利用稀释定律比利用定义法计算,为高频考点,有利于培养学生的良好的科学素养,提高学生学习的积极性,难度不大.1年前查看全部
- 物质的量的浓度的一道题 取50.0mLNa2CO3 和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白
物质的量的浓度的一道题
取50.0mLNa2CO3 和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀质量减少到4.66g,并有气体放出.试计算:
(1)原混合溶液中Na2CO3和Na2SO4的物质的量浓度.(2)产生的气体在标准状况下的体积.
说明:好的+分.多多指教哈、、! hongying661年前1
hongying661年前1 -
 sydcnpc 共回答了15个问题
sydcnpc 共回答了15个问题 |采纳率80%解
(1)
m(BaSO4)=4.66g
所以n(SO4 2-)=4.66/233=0.02mol即n(Na2SO4)=0.02mol
c(Na2SO4)=0.02/0.05=0.4mol/L
m(BaCO3)=14.51-4.66=9.85g
所以n(CO3 2-)=9.85/197=0.05mol即n(Na2CO3)=0.05mol
c(Na2CO3)=0.05/0.05=1mol/L
(2)
n(CO2)=n(CO3 2-)=0.05mol
所以V(CO2)=0.05*22.4=1.12L1年前查看全部
- 高一化学有关硫酸的计算有0.15L浓硫酸,加入铜片后加热,使铜片全部溶解,冷却至室温后加水稀释至1L.取出50.0mL,
高一化学有关硫酸的计算
有0.15L浓硫酸,加入铜片后加热,使铜片全部溶解,冷却至室温后加水稀释至1L.取出50.0mL,加入还原铁粉7g,充分反应后生成气体1.68L(标准状况下),溶液中留有3.04g残渣,所得溶液为硫酸亚铁溶液.求原硫酸溶液的物质的量浓度. ryokoko1年前1
ryokoko1年前1 -
 2guns 共回答了26个问题
2guns 共回答了26个问题 |采纳率92.3%加入铁粉反应方程式:
1.Fe+H2SO4——FeSO4+H2
2.Fe+CuSO4——FeSO4+Cu
因此生成1.68L气体为氢气.
生成氢气为1.68/22.4=0.075mol,故与硫酸反应的铁粉为0.075mol.其余的铁粉为7/56-0.075=0.05mol.
假设残渣全是铁粉,残渣质量应该是56*0.05=2.8g
而残渣全是铜,残渣质量应该是64*0.05=3.2g
利用差量法
Fe 2.8 0.16
3.04
Cu 3.2 0.24
因此残渣中铁与铜的摩尔比为0.16:0.24,即2:3
故残渣中铁粉摩尔数为0.05mol*2/5=0.02mol,即质量为56*0.02=1.12g
残渣中铜摩尔数为0.05*3/5=0.03mol,即质量为64*0.03=1.92g
所以所取的50ml溶液中含硫酸根离子摩尔数为生成氢气的摩尔数与置换出铜的摩尔数之和,即0.075+0.03=0.105mol,也就表示含硫酸0.105mol
故1L溶液中含硫酸0.105mol*1L/0.05L=2.1mol
因此远硫酸溶液物质的量浓度为2.1mol/0.15L=14mol/L1年前查看全部
- (2013•庐江县模拟)如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0m
 (2013•庐江县模拟)如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0gNaOH固体搅拌并使其溶解后,回答下列问题:
(2013•庐江县模拟)如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0gNaOH固体搅拌并使其溶解后,回答下列问题:
(1)烧杯A中温度______ (填“升高”、“降低”或“不变”);
(2)已知:2NO2(g)⇌N2O4(g)△H<0,从上面实验可知,D烧瓶内混合气体颜色将______(填“变浅”、“变深”或“不变”);
(3)若实验测得B烧杯中酸碱中和反应放热1.4325kJ,则NaOH溶液和HCl溶液发生中和反应的热化学方程式为______;
(4)若起始时在D烧瓶中充入m g N2O4,此时测得烧瓶中压强为1.01×105Pa,当可逆反应:N2O4(g)⇌2NO2(g)达到化学平衡状态时压强变为1.515×105Pa(保持温度不变),则平衡时,N2O4的转化率α=______. 4529259161年前1
4529259161年前1 -
 流水悠悠似侬情 共回答了14个问题
流水悠悠似侬情 共回答了14个问题 |采纳率92.9%解题思路:(1)硝酸铵溶解时吸收热量;
(2)酸碱中和时放出热量,导致溶液的温度升高,升高温度平衡向吸热方向移动;
(3)据HCl和NaOH的物质的量,计算生成1mol水时放热多少,再书写热化学方程式;
(4)体积不变的容器中,气体的压强之比等于物质的量之比,求算反应掉的N2O4物质的量,再求算转化率.(1)硝酸铵溶解时吸收热量导致溶液温度降低,故答案为:降低;
(2)加入氢氧化钠会和盐酸之间发生中和反应时放出热量,导致溶液的温度升高,反应2NO2(g)⇌N2O4(g)是放热反应,升高温度,平衡向逆反应方向移动,二氧化氮气体浓度增大,气体颜色加深,故答案为:变深;
(3)n(HCl)=0.50mol/L×0.05L=0.025mol,n(NaOH)=[2g/40g/mol]=0.05mol,0.025molHCl与0.05molNaOH反应,生成0.025mol水时放热1.4325KJ,则生成1mol水时放热57.3KJ,所以热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(2)△H=-57.3kJ/mol,
故答案为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O△H=-57.3kJ/mol;
(4)体积不变的容器中,气体的压强之比等于物质的量之比,设反应后的四氧化二氮有nmol,则生成的二氧化氮又2nmol,有
mg
92g/mol
nmol+2nmol=
1.01×105Pa
1.515×105Pa,
解得n=[m/184]mol,所以α(N2O4)=
m
184mol
m
96mol×100%=50%,
故答案为:50%.点评:
本题考点: 化学平衡的影响因素;化学平衡的计算.
考点点评: 本题考查了平衡移动、热化学方程式书写、转化率的求算,题目难度中等.1年前查看全部
- 3.25g锌与50.0ml的稀盐酸恰好完全反应,试计算
3.25g锌与50.0ml的稀盐酸恰好完全反应,试计算
(1)生成标准状况下氢气的体积
(2)盐酸溶液的物质的量的浓度
(3)若该盐酸溶液的密度是1.08g.cm3,则其质量分数是多少? godfam1年前1
godfam1年前1 -
 浙江女孩1 共回答了18个问题
浙江女孩1 共回答了18个问题 |采纳率94.4%3.25g锌的物质的量n(Zn)=3.25g/(65g/mol)=0.05mol
设生成氢气的物质的量为a,盐酸的物质的量为b
Zn + 2HCl = ZnCl2 + H2↑
1.2.1
0.05mol.b.a
a=1x0.05mol/1=0.05mol
b=2x0.05mol/1=0.1mol
标准状况下0.05mol氢气体积V(H2)=0.05molx22.4L/mol=1.12L
盐酸溶液的物质的量的浓度c(HCl)=0.1mol/0.05mol=2mol/L
50.0ml盐酸溶液的质量m(盐酸溶液)=50mlx1.08g/ml=54g
0.1mol盐酸的质量m(HCl)=0.1molx36.5g/mol=3.65g
盐酸溶液中盐酸的质量分数=3.65g/54gx100%=6.76%
答:
(1)生成标准状况下氢气的体积为1.12L
(2)盐酸溶液的物质的量的浓度为2mol/L
(3)若该盐酸溶液的密度是1.08g.cm3,则其质量分数是6.76%1年前查看全部
- 将50.0ml0.1mol/l(nh4)2so4溶液,加入到50.0ml 0.2mol/l nh3·h2o 【Kb(nh
将50.0ml0.1mol/l(nh4)2so4溶液,加入到50.0ml 0.2mol/l nh3·h2o 【Kb(nh3·h2o)=1.8×10﹣5]溶液中,得到的缓冲溶液ph是
 yaok20011年前1
yaok20011年前1 -
 dave75 共回答了12个问题
dave75 共回答了12个问题 |采纳率91.7%50.0ml0.1mol/l(nh4)2so4溶液中
n(NH4+)=50mL*0.1mol/L*2 =10mmol
50.0ml 0.2mol/l nh3·h2o 中
n(NH3)=50mL*0.2mol/L =10mmol
显然是缓冲溶液
NH3 +H2ONH4+ =OH-
Kb(NH3)=[OH-]*[NH4+]/[NH3]
=约=[OH-]*c(NH4+)/c(NH3)
==[OH-]*n(NH4+)/n(NH3)
=[OH]*10/10
因此[OH]=KbNH3=1.8×10﹣5
[H+]=Kw/[OH-]=10^-14 /1.8×10﹣5=5.6*10^-10
pH=-lg5.6*10^-10=9.251年前查看全部
- 将一定质量的金属钠投入到盛有50.0mL水的烧杯中,反应完全后冷却,称量所得溶液的质量为52.2g,试求:
将一定质量的金属钠投入到盛有50.0mL水的烧杯中,反应完全后冷却,称量所得溶液的质量为52.2g,试求:
(1)加入金属钠的质量;
(2)所得溶液中NaOH的质量分数. girlhh1年前1
girlhh1年前1 -
 铁血轩心 共回答了21个问题
铁血轩心 共回答了21个问题 |采纳率90.5%解题思路:50.0mL水的质量是50.0g,已知反应前后烧杯中所盛物质的质量,可知反应前后溶液的质量差,利用差量法求解计算Na的质量、生成NaOH的质量,进而计算所得溶液质量分数.50.0mL水的质量是50.0g,已知反应前后烧杯中所盛物质的质量,可知反应前后溶液的质量差,利用差量法求解,则:
2Na+2H2O═2NaOH+H2↑△m
4680 44
m(Na)m(NaOH)52.2g-50.0g=2.2g
(1)m(Na)=[46×2.2g/44]=2.3g,答:钠的质量为2.3g;
(2)m(NaOH)=[80×2.2g/44]=4.0g,故w(NaOH)=[4.0g/52.2g]×100%=7.7%,答:所得溶液质量分数为7.7%.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式有关计算,难度不大,注意利用溶液质量差量法计算.1年前查看全部
- 分别计算下列各混合溶液的PH值1)50.0ml HCl(0.2mol/L)+25.0ml NaOH(0.2mol/L)答
分别计算下列各混合溶液的PH值
1)50.0ml HCl(0.2mol/L)+25.0ml NaOH(0.2mol/L)答案:PH=1.17
(2)50.0ml NH4Cl(0.2mol/L)+50.0ml NaOH(0.2mol/L)答案:PH=11.12
(3)50.0ml NH4Cl(0.2mol/L)+25.0ml NaOH(0.2mol/L)答案:PH=9.25
(4)25.0ml NH4Cl(0.2mol/L)+50.0ml NaOH(0.2mol/L)答案:PH=12.83
(5)50.0ml HAc(0.2mol/L)+50.0ml NH3·H2O(0.2mol/L)答案:PH=7
(1)C(HCl)=0.067mol/L PH=1.17
(2) NH4+ + OH- → NH3 + H2O
C(NH3)=0.1mol/L
[OH-]=√KbC= √1.76×10-5×0.1=1.33×10-3 PH=11.12
(3)NH4+ + OH- →NH3 + H2O
C(NH3)=25×0.2/75=0.067mol/L
C(NH4+) =0.067mol/L
[H3O+]=Ka(NH4+) · C(NH4+) / C(NH3) PH=9.25
(4) NH4+ + OH- → NH3 + H2O
C(OH-)=25×0.2/75=0.067mol/L PH=12.83
(5)
PH=1/2[PKa(NH4+)+PKa(HAc)]=7 不见你不散1年前1
不见你不散1年前1 -
 五月花成人型 共回答了16个问题
五月花成人型 共回答了16个问题 |采纳率93.8%(1)C(H+)=(0.2mol/L*50.0ml-0.2mol/L*25.0ml)/(25.0ml+50.0ml)=0.067mol/L pH=-lgH+=-lg0.067=1.17
2 3 4 5无法计算,条件不足.2 3 4 NH3H2O的碱式电离平衡常数Kb,5不仅需要 NH3H2O的Kb还需要醋酸的Ka.1年前查看全部
- (2013•庐江县模拟)如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0m
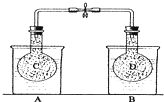 (2013•庐江县模拟)如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0gNaOH固体搅拌并使其溶解后,回答下列问题:
(2013•庐江县模拟)如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0gNaOH固体搅拌并使其溶解后,回答下列问题:
(1)烧杯A中温度降低降低 (填“升高”、“降低”或“不变”);
(2)已知:2NO2(g)⇌N2O4(g)△H<0,从上面实验可知,D烧瓶内混合气体颜色将变深变深(填“变浅”、“变深”或“不变”);
(3)若实验测得B烧杯中酸碱中和反应放热1.4325kJ,则NaOH溶液和HCl溶液发生中和反应的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O△H=-57.3kJ/molNaOH(aq)+HCl(aq)=NaCl(aq)+H2O△H=-57.3kJ/mol;
(4)若起始时在D烧瓶中充入m g N2O4,此时测得烧瓶中压强为1.01×105Pa,当可逆反应:N2O4(g)⇌2NO2(g)达到化学平衡状态时压强变为1.515×105Pa(保持温度不变),则平衡时,N2O4的转化率α=50%50%. 玉面达魔1年前1
玉面达魔1年前1 -
 仁者无敌之飞歌 共回答了17个问题
仁者无敌之飞歌 共回答了17个问题 |采纳率94.1%(1)硝酸铵溶解时吸收热量导致溶液温度降低,故答案为:降低;
(2)加入氢氧化钠会和盐酸之间发生中和反应时放出热量,导致溶液的温度升高,反应2NO2(g)⇌N2O4(g)是放热反应,升高温度,平衡向逆反应方向移动,二氧化氮气体浓度增大,气体颜色加深,故答案为:变深;
(3)n(HCl)=0.50mol/L×0.05L=0.025mol,n(NaOH)=
2g
40g/mol=0.05mol,0.025molHCl与0.05molNaOH反应,生成0.025mol水时放热1.4325KJ,则生成1mol水时放热57.3KJ,所以热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(2)△H=-57.3kJ/mol,
故答案为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O△H=-57.3kJ/mol;
(4)体积不变的容器中,气体的压强之比等于物质的量之比,设反应后的四氧化二氮有nmol,则生成的二氧化氮又2nmol,有
mg
92g/mol
nmol+2nmol=
1.01×105Pa
1.515×105Pa,
解得n=
m
184mol,所以α(N2O4)=
m
184mol
m
96mol×100%=50%,
故答案为:50%.1年前查看全部
- 取50.0mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量稀硝酸处理后
取50.0mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66g,并有气体放出.试计算
(1)原混合溶液中Na2CO3和Na2SO4的物质的量浓度
(2)产生气体在标准状况下的体积
(1)原混合溶液中Na2CO3和Na2SO4的物质的量浓度
求的是“╰┯┈物质的量浓度╰┯┈” shadowclh1年前2
shadowclh1年前2 -
 劲歌狂舞 共回答了16个问题
劲歌狂舞 共回答了16个问题 |采纳率93.8%解
(1)
m(BaSO4)=4.66g
所以n(SO4 2-)=4.66/233=0.02mol即n(Na2SO4)=0.02mol
c(Na2SO4)=0.02/0.05=0.4mol/L
m(BaCO3)=14.51-4.66=9.85g
所以n(CO3 2-)=9.85/197=0.05mol即n(Na2CO3)=0.05mol
c(Na2CO3)=0.05/0.05=1mol/L
(2)
n(CO2)=n(CO3 2-)=0.05mol
所以V(CO2)=0.05*22.4=1.12L1年前查看全部
- 去50.0ml碳酸钠和硫酸钠的混合溶液,加入过量的BaCl2溶液,得到沉淀14.51克,将沉淀用过量的稀盐酸处理后,沉淀
去50.0ml碳酸钠和硫酸钠的混合溶液,加入过量的BaCl2溶液,得到沉淀14.51克,将沉淀用过量的稀盐酸处理后,沉淀减少到4.66克,并有气体放出.计算
(1)原溶液中的碳酸钠和硫酸钠的物质的量溶度.
(2)产生的气体在标准状况下的体积 warwickwang1年前1
warwickwang1年前1 -
 给我你的温度 共回答了19个问题
给我你的温度 共回答了19个问题 |采纳率94.7%1.Na2CO3的浓度是1mol/L,Na2SO4的浓度是0.4mol/L.
2.产生的气体在标准状况下的体积是1.12L.
最后的4.66g沉淀是BaSO4,BaSO4的物质的量是n=m/M=4.66/233=0.02mol
BaCO3的质量是14.51-4.66=9.85g,物质的量是n=m/M=9.85/197=0.05mol
BaCl2+Na2SO4=BaSO4↓+2NaCl
1 1
x 0.02mol
BaCl2+Na2CO3=BaCO3↓+2NaCl
1 1
y 0.05mol
x=0.02mol
y=0.05mol
Na2SO4的浓度是c=n/V=0.02/0.05=0.4mol/L
Na2CO3的浓度是c=n/V=0.05/0.05=1mol/L
BaCO3+2HCl=BaCl2+H2O+CO2↑
1 1
0.05mol z
z=0.05mol
CO2气体在标准状况下的体积是V=n*Vm=0.05*22.4=1.12L1年前查看全部
- 27、白色粉末A是NaHCO3和KHCO3的混合物,取甲、乙、丙三份质量不同的A样品分别与50.0mL相同浓度的盐酸充分
27、白色粉末A是NaHCO3和KHCO3的混合物,取甲、乙、丙三份质量不同的A样品分别与50.0mL相同浓度的盐酸充分反应,得到气体的体积(标况)与A的质量关系如下表所示:
求:(1)盐酸的物质的量浓度?
(2)混合物中NaHCO3的质量分数?
实验组别 甲 乙 丙
盐酸体积(mL) 50.0 50.0 50.0
A的质量(g) 2.84 5.25 7.00
气体体积(L) 0.672 0.896 0.896
特别是第2问
第1问是0.8
第2问是29.6% huangxia57111年前1
huangxia57111年前1 -
 yziy 共回答了17个问题
yziy 共回答了17个问题 |采纳率100%1.有丙可知最多产生气体量为0.896L,生成的气体为CO2,
因为反应物为HCO3-,所以H+与CO2的物质的量相同(一个H+可生成一个CO2)
n(H+)=0.896L/22.4L=0.04=n(HCl);c(HCl)=0.04mol/0.05L=0.8mol/L
2.已知2.84g的A反应可以生成0.672L的气体.
即2.84gA中含有HCO3- 0.03mol
设:n平均=2.84g/0.03mol=x
|M(KHCO3)-x|/|M(NaHCO3)-x|=n(NaCO3)/n(KHCO3)=1/2(我们叫它龟法!)
NaCO3质量分数=84*1/(100*2+84*1)=0.2961年前查看全部
- 将一定质量的金属钠投入到盛有50.0mL水的烧杯中,反应完全后冷却,称量所得溶液的质量为52.2g,试求:
将一定质量的金属钠投入到盛有50.0mL水的烧杯中,反应完全后冷却,称量所得溶液的质量为52.2g,试求:
(1)加入金属钠的质量;
(2)所得溶液中NaOH的质量分数. 变质的橙汁1年前1
变质的橙汁1年前1 -
 martineding 共回答了16个问题
martineding 共回答了16个问题 |采纳率62.5%解题思路:50.0mL水的质量是50.0g,已知反应前后烧杯中所盛物质的质量,可知反应前后溶液的质量差,利用差量法求解计算Na的质量、生成NaOH的质量,进而计算所得溶液质量分数.50.0mL水的质量是50.0g,已知反应前后烧杯中所盛物质的质量,可知反应前后溶液的质量差,利用差量法求解,则:
2Na+2H2O═2NaOH+H2↑△m
4680 44
m(Na)m(NaOH)52.2g-50.0g=2.2g
(1)m(Na)=[46×2.2g/44]=2.3g,答:钠的质量为2.3g;
(2)m(NaOH)=[80×2.2g/44]=4.0g,故w(NaOH)=[4.0g/52.2g]×100%=7.7%,答:所得溶液质量分数为7.7%.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式有关计算,难度不大,注意利用溶液质量差量法计算.1年前查看全部
- 取50.0mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51 g的白色沉淀,用过量稀硝酸
取50.0mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51 g的白色沉淀,用过量稀硝酸
(1)原混合溶液中Na2CO3和Na2SO4的物质的量浓度
(2)产生的气体在标准状况下的体积.
取50.0mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51 g的白色沉淀,用过量稀硝酸
补充:处理后沉淀量减少到4.66g,并有气体放出。试计算: alancc1年前3
alancc1年前3 -
 猫小朵 共回答了17个问题
猫小朵 共回答了17个问题 |采纳率82.4%剩余沉淀为BaSO4,Na2SO4的物质的量等同于BaSO4
所以Na2SO4的物质的量为:4.66/233=0.02mol
所以Na2SO4物质的量的浓度为0.02/0.05=0.4mol/L
减少的沉淀质量为BaCO3,Na2CO3的物质的量等同于BaCO3
所以Na2CO3的物质的量为:(14.51-4.66)/197=0.05mol
所以Na2CO3的物质的量浓度为0.05/0.05=1mol/L
所产生气体体积为0.05*22.4=1.12L1年前查看全部
- 取50.0mlNaCO3和NaSO4的混合溶液,加入过量氯化钡溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀量减
取50.0mlNaCO3和NaSO4的混合溶液,加入过量氯化钡溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66g,并有气体放出,试计算:
1.原混合溶液中碳酸钠和硫酸钠的物质的量浓度
2.产生的气体在标准状况下的体积
订:Na2SO4 liufenglly1年前4
liufenglly1年前4 -
 notme2 共回答了22个问题
notme2 共回答了22个问题 |采纳率100%m(BACO3)=14.51-4.66=9.85g
n(BaCO3)=9.85/(137+12+16*3)=0.05mol=n(Na2CO3)
m(BaSO4)=4.66/(137+32+16*4)=0.02mol=n(Na2SO4)
C(Na2CO3)=0.05*1000/50=1mol/L
C(Na2SO4)=0.02*1000/50=0.4mol/L
V(CO2)=0.05*22.4=1.12L1年前查看全部
- 一道无机及分析化学题将0℃和98.0kPa下的2.00ml N2和60℃ 53.0kPa下的50.0ml O2,在0℃混
一道无机及分析化学题
将0℃和98.0kPa下的2.00ml N2和60℃ 53.0kPa下的50.0ml O2,在0℃混合于一个50.0ml容器中.问此混合物的总压力是多少? 拭qq1年前0
拭qq1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
大家在问
- 1已给绳子长25M,第一次用去五分之三M,再用去多少米真好身下这根绳子的二分之一
- 2如图为“某地区水循环示意图”,读图回答31~32题.
- 3she may______(go) to the fashion show on Sunday
- 444名少先队员去旅游,共租面包车和轿车7辆,面包车每辆可坐8人,轿车每辆可坐5人,若每辆车都坐满,各租几
- 5如图是一块长方形铁皮,利用图中阴影部分刚好能做成一个油桶,请问:这个油桶的容积是多少?(接头处忽略不计,π取3.14)
- 6压路机的前轮是圆柱形的,一台压路机前轮的直径是1.2米,宽是1.8米,压路机的前轮转动一周,可压路多少平方米?如果每分钟
- 7一个无盖的长方体铁箱,底面是边长为3dm的正方形,铁箱高5dm.做20个这样的铁箱用铁皮多少平方分米?
- 8(2013•漳州模拟)如图a所示为“研究加速度与质量关系”的实验装置.小车和车上砝码的总质量M,保持吊盘和盘中物块的总质
- 9寿字的偏旁!除了涛!急 对了就追加10财副
- 10化简tan83°+tan37°-根号3tan83°tan37°
- 11分辨,沉思的反义词是什么
- 12在下面各图中,涂色表示他下面的百分数
- 13有关英语的题目4一. 根据汉语完成句子 1你应该按时睡觉 You ____ ____ ____go to bed on
- 14一个长方形中有个半圆,长方形周长60cm,求半圆面积
- 15比喻目标相同,方向相反的成语?
