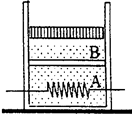
用隔板将一绝热容器隔成A和B两部分,A中盛有一定质量的理想气体,B为真空(如图①),现把隔板抽去,A中的气体自动充满整个
 偷吃大米的小老鼠2022-10-04 11:39:541条回答
偷吃大米的小老鼠2022-10-04 11:39:541条回答 A. 自由膨胀过程中,气体分子只做定向运动
A. 自由膨胀过程中,气体分子只做定向运动B. 自由膨胀前后,气体的压强不变
C. 自由膨胀前后,气体的温度不变
D. 容器中的气体在足够长的时间内,还能全部自动回到A部分

已提交,审核后显示!提交回复
共1条回复
 你烦恼暖 共回答了15个问题
你烦恼暖 共回答了15个问题 |采纳率93.3%- 解题思路:正确解答本题要掌握:气体分子做无规则热运动,不可能只做定向运动;气体自由膨胀过程中不受阻力,因此不做功;自然界中的宏观过程具有方向性,是不可逆的,注意热力学第二定律的应用.
A、分子时刻在做无规则的热运动,故A错误;
B、自由膨胀后,温度不变,体积变大,由气态方程可知,压强变小,故B错误;
C、自由膨胀过程中由于不受阻力作用,因此气体不做功,由于容器绝热,因此Q=0,由△U=W+Q可知,气体内能不变,因此温度也不变,故C正确;
D、根据热力学第二定律可知,气体向真空的自由膨胀是不可逆的,故D错误.
故选C.点评:
本题考点: 热力学第二定律;气体的体积、温度、压强之间的关系.
考点点评: 正确利用热力学第二定律解释一些物理现象,在利用热力学第一定律△U=W+Q时注意公式中各个物理量的含义,尤其注意各个物理量的正负问题. - 1年前
相关推荐
- 如图所示,气缸和活塞与外界均无热交换,中间有一个固定的导热性良好的隔板,封闭着两部分气体A和B,活塞处于静止平衡状态。现
如图所示,气缸和活塞与外界均无热交换,中间有一个固定的导热性良好的隔板,封闭着两部分气体A和B,活塞处于静止平衡状态。现通过电热丝对气体A加热一段时间,后来活塞达到新的平衡,不计气体分子势能,不计活塞与气缸壁间的摩擦,大气压强保持不变,则下列判断正确的是_______.
E.气体B分子单位时间内对器壁单位面积碰撞总次数减少A.气体A吸热,内能增加 B.气体B吸热,对外做功,内能不变 C.气体A分子的平均动能增大 D.气体A和气体B内每个分子的动能都增大  柳絮的季节1年前1
柳絮的季节1年前1 -
 自信的执着者 共回答了19个问题
自信的执着者 共回答了19个问题 |采纳率94.7%解题思路:气体
A 进行等容变化,则W=0 ,根据△U=W+Q 可知气体A 吸收热量,内能增加,温度升高,气体A 分子的平均动能变大,但是不是每个分子的动能都是增加的,选项AC 正确,D 错误;因为中间是导热隔板,所以气体B 吸收热量,温度升高,内能增加;由因为压强不变,故体积变大,气体对外做功,选项B 错误;气体B 的压强不变,但是体积增大,所以气体B 分子单位时间内对器壁单位面积的碰撞次数减少,选项E 正确。ACE
1年前查看全部
- 如图1所示容器中间用隔板分成左右两部分,隔板上有一圆孔用薄膜封闭.
 如图1所示容器中间用隔板分成左右两部分,隔板上有一圆孔用薄膜封闭.
如图1所示容器中间用隔板分成左右两部分,隔板上有一圆孔用薄膜封闭.
(1)若容器左右两部分分别注入密度相同的液体,右侧的液面比左侧的液面高,薄膜向左突起,由此说明液体的压强与______因素有关.
(2)若容器左右两部分分别注入密度不同的液体,右侧的液面与左侧的液面等高,薄膜发生形变,由此说明液体压强与______因素有关.
(3)如图2所示,一个密封的满瓶矿泉水放在水平桌面上,若在B点打一个小孔,则矿泉水______(填“会”“不会”)流出来;若在A点再打一个小孔,则水从______(填“A点”“B点”或“A和B两点”)流出来.此现象还能说明______. 小老粗1年前1
小老粗1年前1 -
 不是娇男 共回答了18个问题
不是娇男 共回答了18个问题 |采纳率94.4%解题思路:(1)(2)在观察薄膜变化的同时,要注意到两侧液体的密度与深度的变化应该是依次进行探究的,也就是说每次实验必须控制其中一个量,探究另一个量.
(3)应用液体压强公式,以及大气压强的内容解决问题.(1)若容器左右两部分分别注入密度相同的液体,右侧的液面比左侧的液面高,薄膜向左突起,由此说明液体的压强与 液体的深度因素有关.
(2)若容器左右两部分分别注入密度不同的液体,右侧的液面与左侧的液面等高,薄膜发生形变,由此说明液体压强与 液体的密度因素有关.
(3)在B点打一小孔,由于大气压的存在,矿泉水不会流出来;若在A点再打一小孔,此时瓶内液体与大气相通,内外气压平衡,由于液体内部存在压强所以B点此时有水流出,因为,B点开在侧壁,因此也能证明液体对容器侧壁有压强.
故答案为:(1)液体的深度;(2)液体的密度;
(3)不会;B点;液体对容器侧壁有压强.点评:
本题考点: 液体的压强的特点.
考点点评: 在本实验的分析中,控制变量法的运用依然是我们应该特别注意的.1年前查看全部
- 如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应: A(g) + 2B(g) xC(g)ΔH=-1
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应: A(g) + 2B(g)  xC(g)ΔH=-192kJ·mol -1 。向M、N中都通入1molA和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是
xC(g)ΔH=-192kJ·mol -1 。向M、N中都通入1molA和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是  [ ]
[ ]A.若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B.若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C.若x<3,C的平衡浓度关系为:c(M)>c(N)
D.x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等 3gsa211年前1
3gsa211年前1 -
 爱情矿泉水 共回答了16个问题
爱情矿泉水 共回答了16个问题 |采纳率87.5%D1年前查看全部
- 用实验模拟某一天气系统(见图):在塑料合中间插一隔板,两侧分别流域入同体积红色暖水(代表暖空气)与蓝色冷盐水(代表冷空气
 用实验模拟某一天气系统(见图):在塑料合中间插一隔板,两侧分别流域入同体积红色暖水(代表暖空气)与蓝色冷盐水(代表冷空气).回答14-16题.
用实验模拟某一天气系统(见图):在塑料合中间插一隔板,两侧分别流域入同体积红色暖水(代表暖空气)与蓝色冷盐水(代表冷空气).回答14-16题.
该实验模拟的天气系统是( )
A.气旋
B.锋
C.高气压
D.低气压 John_SQ1年前1
John_SQ1年前1 -
 2iln1rn 共回答了17个问题
2iln1rn 共回答了17个问题 |采纳率94.1%解题思路:冷气团与暖气团的交界面叫锋面,在该试验中红色暖水代表暖空气,蓝色冷盐水代表冷空气,当中间挡板拿开后,红色暖水和冷盐水会相遇形成倾斜的面,很明显该实验模拟的是锋面.冷暖水相遇会形成倾斜的面,该实验模拟的是天气系统中的锋面,其中暖水代表暖气团,冷水代表冷气团.
故选:B点评:
本题考点: 锋面系统与天气.
考点点评: 本题难度不大,以实验的形式考查了锋面的概念,属于一般知识性考查.1年前查看全部
- 问一个很简单的物理思考题一个隔板把容器分为上下两层,下层装水,上层装水银.现在把隔板抽去,会有什么现象呢?
 Koy沧海1年前2
Koy沧海1年前2 -
 yuxemag 共回答了25个问题
yuxemag 共回答了25个问题 |采纳率92%水银会下降,不久又会变为两层,下层是水银.1年前查看全部
- (2005•深圳二模)如图所示,某容器内部有被隔板隔开的A、B两部分气体,A的密度小,B的密度大,抽出隔板并加热气体,使
 (2005•深圳二模)如图所示,某容器内部有被隔板隔开的A、B两部分气体,A的密度小,B的密度大,抽出隔板并加热气体,使两气体混合均匀,设在此过程A、B两部分气体吸热Q,内能增量为△E,则( )
(2005•深圳二模)如图所示,某容器内部有被隔板隔开的A、B两部分气体,A的密度小,B的密度大,抽出隔板并加热气体,使两气体混合均匀,设在此过程A、B两部分气体吸热Q,内能增量为△E,则( )
A.△E<Q
B.△E=Q
C.△E>Q
D.无法比较 一一点1年前1
一一点1年前1 -
 无奈一生 共回答了26个问题
无奈一生 共回答了26个问题 |采纳率80.8%解题思路:由题意,A的密度小,B的密度大,两气体混合均匀后重心下降,重力势能减小,根据能量守恒定律进行分析.据题意,A的密度小,B的密度大,两气体混合均匀后整体的重心下降,重力势能减小转化为内能,吸热也转化为气体的内能,根据能量守恒定律:△E>Q.
故C正确.
故选C点评:
本题考点: 热力学第一定律.
考点点评: 本题关键要抓住气体的重心下降,重力势能减小,根据能量守恒定律进行分析.1年前查看全部
- 书柜书架的隔板至少要多厚
 wcsnzy1年前1
wcsnzy1年前1 -
 飞翔小雪 共回答了21个问题
飞翔小雪 共回答了21个问题 |采纳率100%要看你的层板长度,60公分内2公分基本上没什么问题,超过60公分最好是加到2.5公分或更多!1年前查看全部
- (2014•洛阳模拟)如图所示,气缸和活塞与外界均无热交换,中间有一个固定的导热性良好的隔板,封闭着两部分气体A和B,活
 (2014•洛阳模拟)如图所示,气缸和活塞与外界均无热交换,中间有一个固定的导热性良好的隔板,封闭着两部分气体A和B,活塞处于静止平衡状态,现通过电热丝对气体A加热一段时间,后来活塞达到新的平衡,不计气体分子势能,不计活塞与气缸壁间的摩擦,大气压强保持不变,则下列判断正确的是______.
(2014•洛阳模拟)如图所示,气缸和活塞与外界均无热交换,中间有一个固定的导热性良好的隔板,封闭着两部分气体A和B,活塞处于静止平衡状态,现通过电热丝对气体A加热一段时间,后来活塞达到新的平衡,不计气体分子势能,不计活塞与气缸壁间的摩擦,大气压强保持不变,则下列判断正确的是______.
A.气体A吸热,内能增加
B.气体B吸热,对外做功,内能不变
C.气体A分子的平均动能增大
D.气体A和气体B内每个分子的动能都增大
E.气体B分子单位时间内对器壁单位面积碰撞总次数减少. sdlgdx01231年前1
sdlgdx01231年前1 -
 jjeng 共回答了24个问题
jjeng 共回答了24个问题 |采纳率91.7%解题思路:隔板导热良好,因此加热过程气体的温度增加,由此可知内能的变化和气体分子平均动能的变化情况;由气体B做等压变化的规律可知气体体积的变化,则可得出做功情情况,根据热力学第一定律进一步判断气体吸放热情况;根据被封闭气体压强的微观解释可以判断气体分子单位时间内对器壁单位面积碰撞情况.A、气体A等容变化W=0,温度升高,内能增加,根据△U=W+Q,可知气体A吸热,故A正确;
B、气体B做等压变化,温度升高,则体积增大,气体对外做功,W<0,温度升高,内能增加,根据△U=W+Q,可知气体B吸热,故B错误;
C、气体A温度升高,气体分子的平均动能增大.故C正确.
D、温度升高,分子的平均动能增大,不一定每个分子的动能都增大,D错误;
E、气体B温度升高,分子平均动能增加,压强不变,所以单位时间撞击单位面积器壁的气体分子数减小,故E正确.
故选:ACE点评:
本题考点: 热力学第一定律;封闭气体压强.
考点点评: 本题考查热力学第一定律及理想气体的实验定律;应重点掌握决定内能的因素及正确应用热力学第一定律.1年前查看全部
- 风压风阻计算,如图,左侧进风,右侧出风,管道中间有个隔板.已知:左侧进口处到隔板距离为1米 &
风压风阻计算,
如图,左侧进风,右侧出风,管道中间有个隔板.
已知:左侧进口处到隔板距离为1米
管道内壁尺寸为3X3米(长X宽),隔板开孔尺寸为1.5X1.5米(长X宽)
隔板有一定厚度,风量恒定为110000立方米每小时,流体为空气.
空气及环境按标准状态.
问:1.空气从入口到隔板处(隔板厚度中间)的沿程阻力损失和局部阻力损失?
2.空气从入口到隔板处(隔板厚度中间)的静态压降?
3.左侧为正压?右侧为负压? 丫丫2797716441年前1
丫丫2797716441年前1 -
 angel_du 共回答了17个问题
angel_du 共回答了17个问题 |采纳率94.1%流体从左到右,正压?负压?看你流体的动能产生是用什么了?左高压侧、右低压侧.
个人认为隔板压降,可参考差压式流量计检定规程.1年前查看全部
- 在一带活塞的绝热容器中有一绝热隔板,隔板的两侧分别为2mol,0度的单原子理想气体A及5mol,100度的双原子理想气体
在一带活塞的绝热容器中有一绝热隔板,隔板的两侧分别为2mol,0度的单原子理想气体A及5mol,100度的双原子理想气体B,两气体的压力均为100kPa.活塞外的压力维持在100kPa不变.今将容器内的隔板撤去,是两种气体混合达到平衡态.求末态的温度T及过程的W,增量U.
 麻辣姬斯1年前0
麻辣姬斯1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 如图所示容器中间用隔板分成左右两部分,隔板上有一圆孔用薄膜封闭.
如图所示容器中间用隔板分成左右两部分,隔板上有一圆孔用薄膜封闭.

(1)若容器左右两部分分别注入密度相同的液体,右侧的液面比左侧的液面高,薄膜向左突起,由此说明液体的压强与______有关.
(2)若容器左右两部分分别注入密度不同的液体,右侧的液面与左侧的液面等高,薄膜发生形变,由此说明液体压强与______有关. 享受100年1年前3
享受100年1年前3 -
 Hensiny 共回答了20个问题
Hensiny 共回答了20个问题 |采纳率90%解题思路:在观察薄膜变化的同时,要注意到两侧液体的密度与深度的变化应该是依次进行探究的,也就是说每次实验必须控制其中一个量,探究另一个量.(1)由题意得,液体密度相同的情况下,说明液体压强与深度有关;
(2)由题意得,在液体深度相同的情况下,说明液体压强与密度有关.
故答案为:(1)深度;(2)密度.点评:
本题考点: 液体的压强的特点.
考点点评: 在本实验的分析中,控制变量法的运用依然是我们应该特别注意的.1年前查看全部
- (2014•顺德区模拟)如图,一绝热容器被隔板K 隔开a、b两部分.已知a内有一定量的稀薄气体,b内为真空.抽
 (2014•顺德区模拟)如图,一绝热容器被隔板K 隔开a、b两部分.已知a内有一定量的稀薄气体,b内为真空.抽开隔板K后,a内气体进入b,最终达到平衡状态.在此过程中( )
(2014•顺德区模拟)如图,一绝热容器被隔板K 隔开a、b两部分.已知a内有一定量的稀薄气体,b内为真空.抽开隔板K后,a内气体进入b,最终达到平衡状态.在此过程中( )
A.气体对外界做功,内能减少
B.气体不做功,内能不变
C.气体压强变小,温度降低
D.气体压强变小,温度不变 00147021年前1
00147021年前1 -
 彭嘉欣 共回答了15个问题
彭嘉欣 共回答了15个问题 |采纳率100%解题思路:绝热过程,自由扩散,体积变大,故内能不变,由理想气体状态方程可以直接求解.A、绝热容器内的稀薄气体与外界没有热传递,Q=0,因而A错误;
B、稀薄气体向真空扩散没有做功,W=0,因而B正确;
C、根据热力学第一定律稀薄气体的内能不变,则温度不变,因而C错误;
D、稀薄气体扩散体积增大,压强必然减小,D正确;
故选BD.点评:
本题考点: 热力学第一定律;理想气体的状态方程.
考点点评: 本题主要考查热力学第一定律的应用及运用理想气体状态方程对气体的温度、压强和体积的判断.1年前查看全部
- 如图,一绝热容器被隔板K隔开成a、b两部分.已知a内有一定量的稀薄气体,b内为真空.抽开隔板K后,a内气体
如图,一绝热容器被隔板K隔开成a、b两部分.已知a内有一定量的稀薄气体,b内为真空.抽开隔板K后,a内气体
进入b,最终达到平衡状态.
A气体对外界做功,内能减少
B气体不做功,内能不变
C气体强变小,温度降低
D气体压强变小.温度不变
求详解.
2010年理综题啊~没人理么~ 维多利亚的爱1年前2
维多利亚的爱1年前2 -
 honlang464 共回答了18个问题
honlang464 共回答了18个问题 |采纳率94.4%因为b内是真空、所以a在膨胀的过程中不对外做功、
因为是绝热容器、因此系统不从外界吸收热量、所以内能不变、温度不变、
根据克拉伯龙方程PV=nRT、V变大T不变、那么P一定变小、
所以BD对、AC错、1年前查看全部
- 下图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中有一个可左右滑动的隔板(其质量和摩擦力均忽略不计)。其中能表
下图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中有一个可左右滑动的隔板(其质量和摩擦力均忽略不计)。其中能表示在相同条件下,等质量的氢气与氦气的是
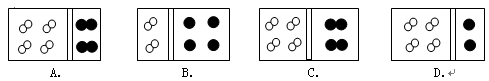
 hometown_lz1年前1
hometown_lz1年前1 -
 娃哈哈5xda 共回答了19个问题
娃哈哈5xda 共回答了19个问题 |采纳率89.5%D
氢气为双原子分子,氦为单原子分子,质量相等,分子数与摩尔质量成反比。故答案为D正确。1年前查看全部
- 真空中有一足够高的绝热筒状汽缸,如图,最初活塞A由支架固定住,其下容积为10L,由隔板B均分为两部分:上半部分真空,下半
真空中有一足够高的绝热筒状汽缸,如图,最初活塞A由支架固定住,其下容积为10L,由隔板B均分为两部分:上半部分真空,下半部分有1mol的氧气,温度为27°C。抽开B,气体充满A的上半部分,平衡后,气体对A的压力刚好与A的重力平衡。再用电阻丝R给气体加热,使气体等压膨胀到20L,下列说法正确的是 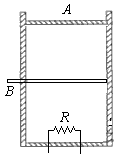
[ ]
A.抽开B,平衡后气体的内能不变
B.抽开B,平衡后气体的温度为300K
C.用电阻丝R给气体加热使气体等压膨胀到20L时,气体的温度为300K
D.用电阻丝R给气体加热使气体等压膨胀到20L时,气体的温度为600K konglongyi1年前1
konglongyi1年前1 -
 maweiwei123 共回答了21个问题
maweiwei123 共回答了21个问题 |采纳率90.5%ABD1年前查看全部
- 大学基础物理:气体动理论 一容器被中间的隔板分成相等的两部分,一部分装有氦气,温度为300K;另一部分...
大学基础物理:气体动理论 一容器被中间的隔板分成相等的两部分,一部分装有氦气,温度为300K;另一部分...
大学基础物理:气体动理论 一容器被中间的隔板分成相等的两部分,一部分装有氦气,温度为300K;另一部分装有氧气,温度为310K,两部分压强相等.求去掉隔板,两种气体混合后的温度
Y 花不语Z西西1年前1
花不语Z西西1年前1 -
 暮滴子 共回答了16个问题
暮滴子 共回答了16个问题 |采纳率87.5%1年前查看全部
- (三)用实验模拟某一天气系统(如图):在塑料合中间插一隔板,两侧分别注入同体积红色暖水(代表暖空气)与蓝色冷盐水(代表冷
(三)用实验模拟某一天气系统(如图):在塑料合中间插一隔板,两侧分别注入同体积红色暖水(代表暖空气)与蓝色冷盐水(代表冷空气).
该实验模拟在天气系统是( )
A.气旋
B.锋
C.高气压
D.低气压 jaywhj1年前1
jaywhj1年前1 -
 未名飞 共回答了16个问题
未名飞 共回答了16个问题 |采纳率87.5%解题思路:主要考查了锋面系统与天气,用实验模拟某一天气系统,两侧分别注入同体积红色暖水(代表暖空气)与蓝色冷盐水(代表冷空气),由此判断该实验模拟的天气系统.冷暖水相遇形成倾斜的面,利用实验模拟的是天气系统的锋面,冷水相当于冷空气,暖水相当于暖空气.
故选:B.点评:
本题考点: 锋面系统与天气.
考点点评: 本题难度较小,属于基础题,解题的关键是掌握锋面系统与天气.1年前查看全部
- 电瓶是用那些材料做成的汽车启动电瓶里面的极板和隔板分别是用什么材料做成的,正极板和负极板在制作上有什么区别,隔板套在正极
电瓶是用那些材料做成的
汽车启动电瓶里面的极板和隔板分别是用什么材料做成的,正极板和负极板在制作上有什么区别,隔板套在正极上是什么效果,套在负极上是什么效果,硫酸和蒸馏水的比例是多少.为什么新的电瓶使用后渐渐电能会降低导致最后无法使用,望知道者详细说明一下, 清涩苦咖1年前1
清涩苦咖1年前1 -
 小黎很重要 共回答了11个问题
小黎很重要 共回答了11个问题 |采纳率90.9%蓄电池[1]是电池中的一种,它的作用是能把有限的电能储存起来,在合适的地方使用.它的工作原理就是把化学能转化为电能.它用填满海绵状铅的铅板作负极,填满二氧化铅的铅板作正极,并用1.28%的稀硫酸作电解质.在充电时,电能转化为化学能,放电时化学能又转化为电能.电池在放电时,金属铅是负极,发生氧化反应,被氧化为硫酸铅;二氧化铅是正极,发生还原反应,被还原为硫酸铅.电池在用直流电充电时,两极分别生成铅和二氧化铅.移去电源后,它又恢复到放电前的状态,组成化学电池.铅蓄电池是能反复充电、放电的电池,叫做二次电池.它的电压是2V,通常把三个铅蓄电池串联起来使用,电压是6V.汽车上用的是6个[2]铅蓄电池串联成12V的电池组.铅蓄电池在使用一段时间后要补充蒸馏水,使电解质保持含有22~28%的稀硫酸.放电时,电极反应为:PbO2 + 4H+ + SO42- + 2e- = PbSO4 + 2H2O 负极反应:Pb + SO42- - 2e- = PbSO4 总反应:PbO2 + Pb + 2H2SO4 === 2PbSO4 + 2H2O (向右反应是放电,向左反应是充电)1年前查看全部
- 阅读下面材料,按要求作文:一个客人在机场坐上一辆出租车,这辆车地板上铺上了羊毛地毯,地毯边上缀着鲜艳的花边,玻璃隔板上镶
阅读下面材料,按要求作文:
一个客人在机场坐上一辆出租车,这辆车地板上铺上了羊毛地毯,地毯边上缀着鲜艳的花边,玻璃隔板上镶着名画的复制品,车窗一尘不染。客人惊讶地对司机说:“没搭过这样漂亮的出租车。”
“谢谢你的夸奖。”司机笑着回答。
“你是怎样想到装饰你的出租车的?”客人问到。
“车不是我的,”他说,“是公司的。多年前我本来在公司做清洁工,每辆出租车晚上回来时都象垃圾堆。地板上净是烟蒂和垃圾,座位和车门把手上甚至有花生酱、口香糖之类的东西,如果有一辆保持清洁的车给乘客坐,乘客也许会为别人着想一点。领到出租车牌照后,我就按照自己的想法把车收拾成了这样。每位乘客下车后,我都要查看一下,一定替下一位乘客把车收拾得十分整洁。我的出租车回到公司时仍然是一尘不染。从开车到现在,客人从来没让我失望过。没有一个烟蒂要我拾捡,也没有花生酱或冰淇淋蛋筒,更没有一点垃圾。先生,我觉得,人人都欣赏美的东西。如果我们的城市多种些花草树木,把建筑物弄得漂亮点,我敢打赌,一定会有更多的人愿意把垃圾送进垃圾箱。”
审读上述材料,把握其主旨,写一篇不少于800字的文章。 深圳xx狂八神1年前1
深圳xx狂八神1年前1 -
 wyfzhgl 共回答了20个问题
wyfzhgl 共回答了20个问题 |采纳率100%无
改变别人是事倍功半,改变自己是事半功倍,一味地要求别人倒不如反躬自问。近朱者赤,近墨者黑。尊重自己必能得到别人的尊重。当我们不再将眼睛盯着别人,回到自己的心灵世界,将尘埃打扫干净,你会发现自己愉快了,别人也会跟着愉快。这便是材料的主旨所在。明白了主旨,构思行文也就不难了。1年前查看全部
- (2005•南汇区二模)如图所示,一个开口向上的圆筒气缸直立于地面上,距缸底2L处固定一个中心开孔的隔板a,在小孔处装有
 (2005•南汇区二模)如图所示,一个开口向上的圆筒气缸直立于地面上,距缸底2L处固定一个中心开孔的隔板a,在小孔处装有一个能向下开启的单向阀门b,只有当上部压强大于下部压强时,阀门才开启.C为一质量与摩擦均不计的活塞,开始时隔板以下封闭气体压强为1.2P0(P0为大气压强);隔板以上由活塞c封闭的气体压强为P0,活塞c与隔板距离为L.现对活塞c施加一个竖直向下缓慢增大的力F,设气体温度保持不变,已知F增大到F0时,可产生向下的压强为0.2P0,活塞与隔板厚度均可不计,求:
(2005•南汇区二模)如图所示,一个开口向上的圆筒气缸直立于地面上,距缸底2L处固定一个中心开孔的隔板a,在小孔处装有一个能向下开启的单向阀门b,只有当上部压强大于下部压强时,阀门才开启.C为一质量与摩擦均不计的活塞,开始时隔板以下封闭气体压强为1.2P0(P0为大气压强);隔板以上由活塞c封闭的气体压强为P0,活塞c与隔板距离为L.现对活塞c施加一个竖直向下缓慢增大的力F,设气体温度保持不变,已知F增大到F0时,可产生向下的压强为0.2P0,活塞与隔板厚度均可不计,求:
(1)当力缓慢增大到2F0时,活塞c距缸底高度是多少?
(2)当力缓慢增大到4F0时,缸内各部分气体压强是多少? guibing200001年前1
guibing200001年前1 -
 urcnfrd 共回答了18个问题
urcnfrd 共回答了18个问题 |采纳率94.4%(1)对上面气体,到b开启时,P0•L=1.2P0•L1,L1=[5/6]L
对全部气体,当力为2Fo时,气体的总长度为L1+2L=[17/6L
由玻意耳定律得:1.2P0•
17
6]L=1.4P0•L2,
解得,L2=
17
7L
(2)当力为4Fo时,P=1.8P0,
由1.4P0•[17/7L=1.8P0•L3,得L3=
17
9L<2 L,
全部气体都在隔板a之下,最后气体高度应为L4=2L,设压强为P4
则:1.4P0•
17
7L=P4•L4,
P4=1.7P0
答:
(1)当力缓慢增大到2F0时,活塞c距缸底高度是
17
7]L.
(2)当力缓慢增大到4F0时,缸内各部分气体压强是1.7P0.1年前查看全部
- 高二物理气体热现象的微观意义用一导热的可自由滑动的轻隔板把一圆柱形容器分隔成A,B两部分,如图所示,A.B中分别装有质量
高二物理气体热现象的微观意义
用一导热的可自由滑动的轻隔板把一圆柱形容器分隔成A,B两部分,如图所示,A.B中分别装有质量相等的氮气和氧气,均可视为理想气体,则可知两部分气体处于热平衡时()
A 分子的平均动能和平均速率都相等
B 分子平均动能相等
C 分子平均速率相等
D 分子数相等 小小仔仔1年前2
小小仔仔1年前2 -
 冷鸥 共回答了19个问题
冷鸥 共回答了19个问题 |采纳率94.7%两部分气体处于热平衡时温度一定相等.
正确答案 B
温度相同分子的平均动能相等 B正确
氮气分子量小于氧气 ,分子平均速率 氮气大于氧气 分子数 氮气大于氧气 A CD 错1年前查看全部
- 下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板 (其质量可忽略不
下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板 (其质量可忽略不计)。其中能表示等质量的氢气与氦气的是 [ ]A. 
B.
C.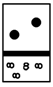
D.
 dream89981年前1
dream89981年前1 -
 阿义的选择 共回答了13个问题
阿义的选择 共回答了13个问题 |采纳率92.3%A1年前查看全部
- (2013•福州模拟)Ⅰ.如下图所示,甲、乙之间的隔板K和活塞F都可左右自由移动,甲充入2molA和1molB,乙中充入
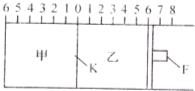 (2013•福州模拟)Ⅰ.如下图所示,甲、乙之间的隔板K和活塞F都可左右自由移动,甲充入2molA和1molB,乙中充入2molC和1molHe,只有A为有色气体,此时K停在O处.在一定条件下发生逆反应:2A(g)+B(g)⇌2C(g)△H<0;反应达到平衡后,再恢复至原温度.回答下列问题:
(2013•福州模拟)Ⅰ.如下图所示,甲、乙之间的隔板K和活塞F都可左右自由移动,甲充入2molA和1molB,乙中充入2molC和1molHe,只有A为有色气体,此时K停在O处.在一定条件下发生逆反应:2A(g)+B(g)⇌2C(g)△H<0;反应达到平衡后,再恢复至原温度.回答下列问题:
(1)该反应的平衡常数表达式为K=______,若升高温度,平衡常数K将______(填“增大”、“减小”或“不变”).
(2)可根据______现象来判断甲、乙都已达到平衡.
(3)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范是______.
(4)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为______mol.
Ⅱ.接上题,若一开始就将K、F同定,其他条件均与Ⅰ相同,请完成下列问题:
(1)当甲中的下列物理量不再变化时,能表明甲中反应已达平衡的是______
A.混合气体的压强
B.混合气体的密度
C.B的物质的量浓度
D.气体的总物质的量
(2)达到平衡时,甲、乙中C的物质的量的关系是______(填“甲>乙”或“甲<乙”或“甲=乙”):若平衡时测得甲中A的转化率为b,则乙中C的转化率为______. lerain1年前1
lerain1年前1 -
 600721 共回答了21个问题
600721 共回答了21个问题 |采纳率95.2%解题思路:Ⅰ.(1)根据化学平衡常数表达式的概念,结合条件中给出的可逆反应方程式解答;根据温度对化学平衡、化学平常数的影响解决,故答案为:减小.
(2)根据化学平衡状态的概念,结合题中的条件解决,故答案为:K、F不再移动或甲中的颜色不再发生变化.
(3)根据等效平衡的原理及可逆反应的特点,结合化学平衡的计算,采用极端假设的方法解决.
(4)根据(3)中的解析,将a的值换成1,进行计算即可.
Ⅱ• (1)根据化学平衡状态的判断标准来判断.
A• 2A(g)+B(g)⇌2C(g)△H<0是一个反应前后气体计量系数不相等的可逆反应,压强的变化可以作为平衡的标准.故答案A正确.
B• 根据混合气体的密度等于混合气体的质量与混合气体的比值,即密度的概念判断.故答案B错.
C• 根据化学平衡状态与浓度的关系判断.故答案C正确.
D• 根据物质的量与压强的关系,压强与化学平衡状态的关系判断.故答案D正确.
(2)根据影响化学平衡的条件解决,恒温、恒容条件下,通入“惰气”对平衡无影响;根据化学平衡计算,结合转化率的概念解决.Ⅰ.(1)根据化学平常数表达式的概念,生成物浓度计量系数次方的乘积与反应物浓度计量系数次方的乘积的比值解决,故答案为
c2(C)
c2(A)•c(B).
(2)根据化学平衡状态的判断条件,可逆反应达到平衡时,各物质的浓度保持不变,甲、乙两装置中到达平衡时,气体A的浓度保持不变,因此甲中的颜色保持不变,同时甲、乙中气体的量保持不变,因此K、F不再发生移动.故答案为:K、F不再移动或甲中气体的颜色不再发生变化.
(3)当乙中没有He气时,甲中充入2molA、1molB,与乙中充入2molC到达平衡状态时,为等效的,即两边气体的物质的量相等,隔板应位于中间0处,此后向乙中再充入1molHe气,会使乙中气体压强增大,隔板向甲的方向移动,会使甲中的反应向正向移动,再次到达平衡时,隔板位于a处,通过观察,当反应未开始时隔板位于0处,每一个格相当于0.5mol气体.隔板在a处时,甲中的气体为0.5×(6-a)mol.
设甲中反应到达平衡时,有xmolB发生反应,
2A(g)+B(g)⇌2C(g)
开始(mol)2 1 0
转化(mol) 2x x 2x
平衡(mol) (2-2x) (1-x) 2x
(2-2x)+(1-x)=(6-a)×0.5
0.5a=x
当B完全反应时,x=1,a取最大,即a=2
故答案为:0<a<2
(4)根据题中的条件,当到达平衡时,隔板位于左侧1处,则说明乙端的相当有7个格,即乙中平衡时气体的物质的量为3.5mol,其中He为1mol.
设乙中到达平衡时有ymolC反应
2C(g)⇌2A(g)+B(g)
开始(mol)2 0 0
转化(mol)yy[1/2]y
平衡(mol) (2-y)y [1/2]y
(2-y)+y+[1/2]y=2.5
y=1
故答案为:1
Ⅱ•(1)化学平衡状态的判断,在概念的基础上,延伸为,只要是物理量由变量到定量,即可作为判断平衡状态的依据,反应到达平衡状态.在恒温恒容的条件下,进行分析,甲中:
A• 反应开始前,物质的量为3mol,反应开始后,平衡右移,气体减少,压强降低,当压强不变时即到达平衡状态,故A正确.
B• 应为容器的体积不变,充入的气体的量固定,根据气体密度的关系式ρ=[m/V],混合气体的密度是一个定值,不能作为判断平衡状态的标准,故B不正确
C• 由于甲的体积固定,当反应开始后,气体的物质的量减小,浓度降低,当浓度不变时,即到达平衡状态.故答案C正确
D• 由于甲的体积不变,反应开始,气体的物质的量减小,压强降低,当压强不变时,即气体的物质的量不变,到达平衡状态.故答案C正确
故选A、C、D
(2)由于甲、乙两边的体积不变,满足恒温、恒容条件,在乙中通入惰性气体,对平衡无影响,绝对转化后,满足甲、乙两端反应到达平衡后是等效的,即两端到达平衡后,每种组成分的量相同,故答案为:甲=乙,
根据化学平衡的计算、及达到平衡时甲、乙两端的平衡是等效的.
先求甲中达到平衡时,A、B、C的平衡量
2A(g)+B(g)⇌2C(g)
开始(mol)2 1 0
转化(mol) 2b xb 2b
平衡(mol) (2-2b) (1-b) 2b
设乙中到达平衡时C的转化率为ω,则有
2C(g)⇌2A(g)+B(g)
开始(mol)2 0 0
转化(mol)2•ω2•ωω
平衡(mol) (2-2ω)2ωω
则有:2-2ω=2b
ω=1-b
故答案为:ω=1-点评:
本题考点: 化学平衡常数的含义;化学平衡状态的判断.
考点点评: 本题是一个好题,它综合系统的考查了化学平衡的基本知识,平衡状态的判断,化学平衡移动原理的应用,化学平衡的计算等知识,作这类题目,一定要将基本理论掌握的很熟练,同时认真审题,将题目中的条件与基本理论有机的结合在一起,以加强分析解决问题的能力.1年前查看全部
- (2014•宿迁二模)如图所示,一隔板将绝热容器分成容积相等的两部分,左半部分充有理想气体,右半部分是真空.现抽去隔板,
 (2014•宿迁二模)如图所示,一隔板将绝热容器分成容积相等的两部分,左半部分充有理想气体,右半部分是真空.现抽去隔板,左室气体向右室扩散,最终达到平衡.这个过程叫做绝热自由膨胀.膨胀后,气体的压强______ (选填“变大”、“变小”或“不变”),温度______ (选填“变大”、“变小”或“不变”).
(2014•宿迁二模)如图所示,一隔板将绝热容器分成容积相等的两部分,左半部分充有理想气体,右半部分是真空.现抽去隔板,左室气体向右室扩散,最终达到平衡.这个过程叫做绝热自由膨胀.膨胀后,气体的压强______ (选填“变大”、“变小”或“不变”),温度______ (选填“变大”、“变小”或“不变”).  口若悬河2221年前1
口若悬河2221年前1 -
 zhhod 共回答了16个问题
zhhod 共回答了16个问题 |采纳率93.8%解题思路:右侧为真空,气体自由膨胀做功“没有对象”,当然不做功.
根据热力学第一定律△U=W+Q判断气体内能的变化.
理想气体,内能由温度决定,内能不变,温度也就不变的.
对于气体来说,等温度变化,体积增大,压强就减小了.绝热容器右半部分是真空,把隔板抽走让气体自由膨胀过程中,气体不会受到阻力作用,膨胀过程不做功,即W=0,由于气缸绝热,气体与外界不能进行热传递,Q=0,由热力学第一定律:△U=W+Q可知,△U=0,气体内能不变,由于理想气体内能由温度决定,气体内能不变,则温度保持不变;
气体向右扩散过程中,体积V变大,气体温度T不变,由玻意耳定律可知,气体压强变小;
故答案为:变小;不变.点评:
本题考点: 理想气体的状态方程;热力学第一定律.
考点点评: 本题考查了热力学第一定律与玻意耳定律的应用,掌握热力学第一定律与玻意耳定律即可正确解题,解题时要知道理想气体内能的决定因素.1年前查看全部
- (1)在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应.各物质的起始加入量如下:A、B
(1)在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应.各物质的起始加入量如下:A、B和C均为4.0mol、D为6.5mol、F为2.0mol,设E为x mol.当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置.请填写以下空白:

①若x=4.5,则右侧反应在起始时向______(填“正反应“或“逆反应“)方向进行.欲使起始反应维持向该方向进行,则x的最大取值应小于______.
②若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等?______(填“相等“、“不相等“或“不能确定“).其理由是:______.
(2)830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g)⇌CO2(g)+H2(g);△H<0试回答下列问题:
①若起始时c(CO)=2mol•L-1,c(H2O)=3mol•L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=______;
②在相同温度下,若起始时c(CO)=2mol•L-1,c(H2O)=2mol•L-1,反应进行一段时间后,测得H2的浓度为0.5mol•L-1,则此时v(正)______v(逆)(填“大于”“小于”或“等于”),达到平衡时CO的转化率为______;
③若降低温度,该反应的K值将______(填“增大”“减小”或“不变”,下同),该反应的化学反应速率将______. 大迦叶1年前1
大迦叶1年前1 -
 surpass617 共回答了13个问题
surpass617 共回答了13个问题 |采纳率92.3%解题思路:(1)①左右两部分温度、体积、压强相同,平衡时,两反应混合气体的总的物质的量相同,左边反应前后气体体积不变,平衡后混合气体的总的物质的量为4.0mol×3=12mol,所以右边平衡时混合气体的总的物质的量为12mol,由此判断右边反应向哪个方向进行;
令达平衡时E的消耗量为2a摩,求出平衡时各组分的物质的量,利用反应混和物总的物质的量为12mol列出等式,再利用可逆反应反应物不能完全反应列不等式,联立求解.
②这两种情况是在两个不同温度下达到化学平衡的,平衡状态不同,所以A的物质的量也不同;
(2)①根据三段式解题法,求出反应混合物各组分浓度的变化量、平衡时各组分的浓度,代入平衡常数表达式计算平衡常数;
②计算常数的浓度商Qc、平衡常数,与平衡常数比较判断反应进行方向;据①中的平衡常数,利用三段式法计算平衡时各物质浓度,计算转化率,据此解答;
③该反应是放热反应,降低温度,平衡向着正向移动,K值增大,反应速率减小.(1)①左右两部分温度、体积、压强相同,平衡时,两反应混合气体的总的物质的量相同,左边反应前后气体体积不变,平衡后混合气体的总的物质的量为4.0mol×3=12mol,所以右边平衡时混合气体的总的物质的量为12mol,x...
点评:
本题考点: 化学平衡的计算;化学平衡的影响因素.
考点点评: 本题考查化学平衡常数及影响因素、影响化学平衡的因素、化学平衡图象与计算等,难度中等,(2)②中注意分析各物质的浓度变化量关系,确定概念改变的条件.难度中等,关键在于确定右侧反应到达平衡时反应混合物总的物质的量.1年前查看全部
- 隔板原理2014是这样一个数,即它的各位数字之和为7,像这样的数字之和为7的四位数的个数为多少
 浅滩龙1年前1
浅滩龙1年前1 -
 盖盖515 共回答了16个问题
盖盖515 共回答了16个问题 |采纳率87.5%2014
2041
2104
2140
2401
2410
1024
1042
1402
1420
1204
1240
4012
4021
4120
4102
4201
4210
如果不许高位为零的话总共是16个
假如允许高位放零的
0412
0421
0124
0142
0214
0241
那么总共可以24个
问题是否指定只能有2、0、1、4、这4个数字组成?如果是的话就是上述答案1年前查看全部
- 关于热力学的问题?把一容器用隔板分成相等的两部分,左边装1摩尔CO2,右边装2摩尔H2,若两边气体温度相同,隔板与容器无
关于热力学的问题?
把一容器用隔板分成相等的两部分,左边装1摩尔CO2,右边装2摩尔H2,若两边气体温度相同,隔板与容器无摩擦,则隔板最初将如何运动?为什么? 桑树村1年前2
桑树村1年前2 -
 hahaha1 共回答了20个问题
hahaha1 共回答了20个问题 |采纳率90%向左边运动,方式是加速度从最高值递减至0的加速运动,然后是速度减到0,再往回运动,就像阻尼震荡一样.最开始右边的压强是左边的2倍,当然是右边推动板向左运动.相同温度下,相等数量的气体原子占有体积是一样的,你左边装...1年前查看全部
- 长方体水槽内部有30cm高的隔板每分钟以一定量的水通过A、B两个流量不同的龙头注入水槽中,水面的高度y
长方体水槽内部有30cm高的隔板每分钟以一定量的水通过A、B两个流量不同的龙头注入水槽中,水面的高度y
水面的高度y(cm)与时间x(分)的关系如图所示(1)当0≤x≤4时,分别写出A侧、B侧对应的y与x之间的函数关系式(2)当B侧水面高度为20cm时,用时几分钟?(3)从A、B两个水龙头每分钟分别流入多升水?(注:1升=1000cm立方厘米) stylecd1年前1
stylecd1年前1 -
 笑看风云淡如海 共回答了16个问题
笑看风云淡如海 共回答了16个问题 |采纳率93.8%1.左侧水升高教快,在4分钟到达30cm,右侧的水升高较慢,在9分钟到达30cm
2.总体积为1.20x0.80x0.30=0.288,设左侧底面积为x,放水速度为a,右侧为1.2x0.8-x,放水速度为b
0.3x=4a
(0.96-x)0.05=4b
(0.96-x)(0.3-0.05)=5(a+b)
解出a,b,x
3.
0.96h=(a+b)t
h=0.6时t=18
换回CM关系式为即60=18c,c=10/3,所以图像为h=10t/31年前查看全部
- 一道关于分子内能物理题直立容器内部有被隔板隔开的A,B两种气体A的密度较小,抽去隔板,加热气体,使两部分气体均匀混合,设
一道关于分子内能物理题
直立容器内部有被隔板隔开的A,B两种气体A的密度较小,抽去隔板,加热气体,使两部分气体均匀混合,设在此过程中气体吸热为Q,气体内能增加量为E,则E Q(填“>”“ jz_gloria0281年前2
jz_gloria0281年前2 -
 rebornreborn 共回答了17个问题
rebornreborn 共回答了17个问题 |采纳率100%气体A在上方吧?
这样,混和后的气体的重力势能大于之前的气体的重力势能,也就是说这个过程中气体对外做功,W1年前查看全部
- 如图所示,一绝热容器被隔板K隔开成a、b两部分.已知a内有一定量的稀薄气体,b内为真空.抽开隔板K后,a内气体进入b,最
如图所示,一绝热容器被隔板K隔开成a、b两部分.已知a内有一定量的稀薄气体,b内为真空.抽开隔板K后,a内气体进入b,最终达到平衡状态.在此过程中( )
 A. 气体对外界做功,内能减少
A. 气体对外界做功,内能减少
B. 气体不做功,内能不变
C. 气体压强变小,温度降低
D. 气体压强变大,温度不变 tchcy19831年前1
tchcy19831年前1 -
 蓝柯一梦梦非梦 共回答了18个问题
蓝柯一梦梦非梦 共回答了18个问题 |采纳率72.2%解题思路:绝热过程,自由扩散,体积变大,故内能不变,由理想气体状态方程可以直接求解.A、绝热容器内的稀薄气体与外界没有热传递,Q=0,因而A错误;
B、稀薄气体向真空扩散没有做功,W=0,因而B正确;
C、根据热力学第一定律稀薄气体的内能不变,则温度不变,因而C错误;
D、稀薄气体扩散体积增大,压强必然减小,D错误;
故选B.点评:
本题考点: 理想气体的状态方程;气体压强的微观意义.
考点点评: 本题主要考查热力学第一定律的应用及运用理想气体状态方程对气体的温度、压强和体积的判断.1年前查看全部
- .在一个密闭容器中,中间有一可自由滑动的隔板,
.在一个密闭容器中,中间有一可自由滑动的隔板,
将容器分成两部分.当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如右图所示位置(隔板左边为4/5,右边为1/5)(两侧温度相同).则混合气体中CO和CO2的分子个数比为( ) A.1:1 B.1:3 C.2:1 D.3:1 郑郑有词1年前2
郑郑有词1年前2 -
 雨儿爱ERIC 共回答了19个问题
雨儿爱ERIC 共回答了19个问题 |采纳率78.9%相同条件下,体积之比=物质的量之比
1mol占了4/5 要占1/5的体积,物质的量为0.25mol
设xmolCO ymolCO2
x+y=0.5
28x+44y=18
x=0.25 y=0.25
答案A1年前查看全部
- 在线等 高二物理热力学问题如图,水平放置的密封气缸内的气体被一竖直隔板分隔为左右两部分,隔板可在气缸内无摩擦滑动,右侧气
在线等 高二物理热力学问题
如图,水平放置的密封气缸内的气体被一竖直隔板分隔为左右两部分,隔板可在气缸内无摩擦滑动,右侧气体内有一电热丝.气缸壁和隔板均绝热.初始时隔板静止,左右两边气体温度相等.现给电热丝提供一微弱电流,通电一段时间后切断电源.当缸内气体再次达到平衡.
【为什么当电热丝通电后,右的气体温度升高气体膨胀】
 twgogogo1年前3
twgogogo1年前3 -
 戴牙套的纪晓岚 共回答了10个问题
戴牙套的纪晓岚 共回答了10个问题 |采纳率100%右的气体温度升高是因为吸收了电热丝放出的热量.
气体膨胀是因为温度升高了而压强暂时认为不变,所以体积要增大.
PV/T=恒量1年前查看全部
- 一容器被隔板平均分为等体积的两半,一半装氦气,温度为250K;一半装氧气,温度为310K.两部分压强相等.若去掉隔板两种
一容器被隔板平均分为等体积的两半,一半装氦气,温度为250K;一半装氧气,温度为310K.两部分压强相等.若去掉隔板两种气体均匀混合后的温度为多少?
我计算得到的结果是276.7K,可答案是284K,不知道是怎么回事, chenqmm1年前2
chenqmm1年前2 -
 xj1927 共回答了18个问题
xj1927 共回答了18个问题 |采纳率88.9%T=2T1T2/(T1+T2),结果和楼主一样,莫非我们都错的一个地方?1年前查看全部
- 一绝热容器被隔板隔开,左边有稀薄气体,右边真空.抽开隔板达平衡为什么温度不变?分子平均动能减小了啊
 hqbd8azf1年前1
hqbd8azf1年前1 -
 圣诞老人2004 共回答了18个问题
圣诞老人2004 共回答了18个问题 |采纳率83.3%绝热容器说明没热量交换,右边真空,左边气体到达右边时没阻力,即没有外力做功,气体内能不变,当然温度不变啊.1年前查看全部
- 气体温度平衡变化直立绝热的圆桶容器,中间用隔板分成体积相同的两部分,上部充有密度较小的气体,下部有密度较大的气体,两部分
气体温度平衡变化
直立绝热的圆桶容器,中间用隔板分成体积相同的两部分,上部充有密度较小的气体,下部有密度较大的气体,两部分气体的初温相同,且不发生化学反应,设法抽去隔板,经过足够长时间后,则气体温度将怎么变化? lemon_mina1年前3
lemon_mina1年前3 -
 ayarlsj 共回答了22个问题
ayarlsj 共回答了22个问题 |采纳率77.3%平衡后气体重心上升,在中线,重力势能增大,所以内能减小,温度降低1年前查看全部
- 用隔板将一绝热容器隔成A和B两部分,A中盛有一定质量的理想气体,B为真空(如图①)。现把隔板抽去,A中的气体自动充满整个
用隔板将一绝热容器隔成A和B两部分,A中盛有一定质量的理想气体,B为真空(如图①)。现把隔板抽去,A中的气体自动充满整个容器(如图②),这个过程称为气体的自由膨胀。下列说法正确的是  [ ]
[ ]A.自由膨胀过程中,气体分子只作定向运动
B.自由膨胀前后,气体的压强不变
C.自由膨胀前后,气体的温度不变
D.容器中的气体在足够长的时间内,能全部自动回到A部分 tanya5205311年前1
tanya5205311年前1 -
 三瘋子 共回答了14个问题
三瘋子 共回答了14个问题 |采纳率92.9%C1年前查看全部
- 欲在室温和1.01×105Pa条件下测定镁的相对分子质量,请利用下图给定的仪器(盛放镁条的隔板有小孔)组装成一套实验装置
欲在室温和1.01×105Pa条件下测定镁的相对分子质量,请利用下图给定的仪器(盛放镁条的隔板有小孔)组装成一套实验装置(每种仪器只允许用一次).请回答下列问题:
(1)装置A中的分液漏斗中盛放的液体是
水
,其作用是
使A瓶中的气体进入E瓶,增大E瓶中的气压,将稀盐酸压入B装置与Mg发生化学反应;
;
(2)假设气流方向由左向右,则各仪器的接口连接的先后顺序为(填小字母)
a、h、g、b、c、f、e、d
;
(3)连接好仪器后,要进行的操作有以下几步:①待仪器B中的物质恢复到室温时,测得量筒C中水的体积(若假设将测定的体积换算为标准状况下为VmL);②擦掉镁条表面的氧化膜,将其置于天平上称量(假定其质量为mg),并将其投入试管B中;③检查各装置的气密性;④旋开仪器A上分液漏斗的活塞,当镁条完全溶解时再关闭活塞.上述几步操作的先后顺序为
③②④①
;
(4)若未将试管B冷却至室温就测量量筒C中水的体积,这将会使所得镁的相对原子质量数据(选填“偏高”或“偏低”或“无影响”)
偏低
;
(5)若未擦净镁条表面氧化膜就进行实验,这将会使所测镁的相对原子质量数据(选填“偏高”或“偏低”或“无影响”)
偏高
我认为第一题分液漏斗中的物质也可以是氢氧化钠.少杯中的物质是水,氢氧化钠溶解放热,也能使E瓶气压增大~ 我的想法对么?
第五题中没有擦净氧化膜,硫酸与氧化镁反应后仍然可以与镁条反应,那么生成的氢气质量不是不变么?怎么会偏高呢?

. XX爱OO1年前4
XX爱OO1年前4 -
 陈幸福 共回答了23个问题
陈幸福 共回答了23个问题 |采纳率95.7%你的想法是错误的,分液漏斗不可以装固体,
当然会变,MgO与硫酸反应不生成气体.
是偏高,
Mg+H2SO4=MgSO4+H2(?)
MgO+H2SO4=MgSO4+H2O
假如固体有mg,气体有nmol,那理论上是m/n,但因为有MgO,产生的气体会变少,所以是偏高.懂了么?1年前查看全部
- 高手来分析████████假设一个密闭的绝热容器(注意是绝热)这个密闭容器用隔板隔成A、B两个室.假设A室相对很小很小,
高手来分析████████
假设一个密闭的绝热容器(注意是绝热)
这个密闭容器用隔板隔成A、B两个室.假设A室相对很小很小,而B室相对很大很大.
现在在A室中装有30摄氏度的,压力为0.75Mpa的液态R12制冷剂.(R12在压力为0.75M时,沸点为30摄氏度,所以这时为饱和液体)
B室初始状态为绝对真空.
隔板用外力固定.
在B室中理想的假设悬空装一个数字温度感应器.(假设感应不到温度时,无显示)
然后我们迅速的拿掉隔板.
那么问题如下:
(1)因为我们假设这个温度感应器感应不到温度时没有显示,那么初始状态这个温度感应探头应该没有显示.因为B室是真空,而真空是不能传播热量的,所以温度感应探头无显示.——这个说法正确吗?
(2)当我们迅速拿开隔板后,A室里面原来的液体会出现什么变化的过程
(3)B室里面的温度感应探头降出现什么样的变化?
楼下1楼的答案不对.
(1)我们已经假设了是绝热容器,并且隔板也是绝热的.B室又是真空.所以对流、传导、辐射都无法影响B室的温度感应探头
(2)我们已经说了A室是饱和液体,所以拿开隔板后,液体因为压力降低、沸点降低所以会汽化. 南纬37度21年前1
南纬37度21年前1 -
 王家某虫 共回答了14个问题
王家某虫 共回答了14个问题 |采纳率100%1)你的问题应该是温度计感应不到“温度变化”吧!什么是感应不到“温度”啊?到处都有温度.我想你既然说容器是绝热的,那就应该不会有变化.答案是对的.
不过你没有说初始时B与A的温度是不是一样为30度,因为隔板如果不是绝热的(你没说隔板是绝热的),同时初始温度不一样,A是会向B进行热能辐射的.
(2)会先沸腾后停止.有两个过程:1、因为当拿掉隔板,气体体积膨胀,故而压力降低,气压降低会导致液体沸点降低,因此30度正好高于该液体沸点,液体沸腾.2、液体沸腾时汽化并吸收热量,因此会使室内温度降低,同时气压相对升高,使温度回升,最后停止沸腾,部分气体还是会恢复成液体状态,直到饱和状态.
(3)温度感应探头先降低后又恢复 30度1年前查看全部
- (2007•江苏)如图所示,绝热气缸中间用固定栓将可无摩擦移动的导热隔板固定,隔板质量不计,左右两室分别充有一定量的氢气
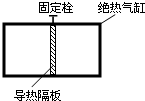 (2007•江苏)如图所示,绝热气缸中间用固定栓将可无摩擦移动的导热隔板固定,隔板质量不计,左右两室分别充有一定量的氢气和氧气(视为理想气体).初始时,两室气体的温度相等,氢气的压强大于氧气的压强,松开固定栓直至系统重新达到平衡,下列说法中正确的是( )
(2007•江苏)如图所示,绝热气缸中间用固定栓将可无摩擦移动的导热隔板固定,隔板质量不计,左右两室分别充有一定量的氢气和氧气(视为理想气体).初始时,两室气体的温度相等,氢气的压强大于氧气的压强,松开固定栓直至系统重新达到平衡,下列说法中正确的是( )
A.初始时氢分子的平均动能大于氧分子的平均动能
B.系统重新达到平衡时,氢气的内能比初始时的小
C.松开固定栓直至系统重新达到平衡的过程中有热量从氧气传递到氢气
D.松开固定栓直至系统重新达到平衡的过程中,氧气的内能先增大后减小 鱼过冬1年前1
鱼过冬1年前1 -
 飘落的栀子花 共回答了22个问题
飘落的栀子花 共回答了22个问题 |采纳率90.9%解题思路:理想气体的内能只与温度有关,则由温度的变化可知内能的变化;由热力学第一定律可知两部分气体间热量的传递方向.温度是分子平均动能的标志,温度相同,分子的平均动能相同,与分子质量无关,两部分气体温度相同,故分子的平均动能相同,故A错误;
松开固定栓至系统达到平衡过程中,先是氢气对氧气做功,内能减少,氧气内能增加,温度升高.由于存在温度差,发生热传递,最后两者温度相同,故氧气内能又减小,等于初始值,所以两种气体的内能与初始时相同.故B错误,CD正确;
故选CD点评:
本题考点: 热力学第一定律;温度是分子平均动能的标志;改变内能的两种方式;理想气体.
考点点评: 本题要注意理想气体分子间距离较大,故不计分子势能,分子内能只与温度有关,温度相同,则内能及分子的平均动能均相同.1年前查看全部
- 如何理解数学排序中隔板插空法,并举例说明.
 随意张狂1年前1
随意张狂1年前1 -
 fy50 共回答了24个问题
fy50 共回答了24个问题 |采纳率95.8%隔板插空法最基本的要求是元素之间没有差别,也就是说元素之间不需要更换位置举个很简单的例子,把是个球放到三个不同的袋子中,问有几种分发.前提:球是一样的,而袋子不一样,可以想象成先用第一个隔板隔出a个球放在第...1年前查看全部
- 一定温度下,将2molSO2和1molO2加入甲容器,将4molSO3加入乙容器中,隔板不动,将甲乙两容器分成1:2
一定温度下,将2molSO2和1molO2加入甲容器,将4molSO3加入乙容器中,隔板不动,将甲乙两容器分成1:2
(1)现使两容器体积相等,达到新平衡时,S03的体积分数为什么是甲小于乙?
(2)若保持乙中压强不变,向甲乙容器中通入等质量的氦气,达到新平衡时,甲和乙中S03的体积分数比较大小?
条件说隔板不动 xxyy1年前1
xxyy1年前1 -
 Wuqilong 共回答了17个问题
Wuqilong 共回答了17个问题 |采纳率100%(1)原题为一个容器,只是中间用隔板隔开,分为甲,乙两个容器.一开始,甲,乙的体积比为1:2.
而现在使两容器体积相等,即甲,乙的容器体积为1:1.
所以只减小了甲容器的压强,乙容器的压强不变.
2SO2+O2==(可逆)2SO3.减小甲容器的压强,根据勒夏特列原理,反应向逆反应方向进行,所以SO3减少.而乙的不变.后面的就不用我废话了.
(2)因为要保持乙中压强不变,向其中通入气体,其体积也要变大,即乙容器体积增大,而甲容器的体积不变.所以甲容器的压强增大,根据勒夏特列原理,反应向正反应方向进行,所以SO3增多.而乙容器虽然体积变大了,但压强不变,所以甲>乙.
(还有不懂的可以问,.)
(改好了.)1年前查看全部
- 下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表
下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是

 InmanandAda1年前1
InmanandAda1年前1 -
 langzi9668 共回答了20个问题
langzi9668 共回答了20个问题 |采纳率90%A
1年前查看全部
- 制取气体中的多空隔板的作用是什么?
 无底心情1年前1
无底心情1年前1 -
 分析信息需 共回答了13个问题
分析信息需 共回答了13个问题 |采纳率92.3%这个隔板的一个作用是固体与液体的化学反应中用来托住固体(隔板的孔要比固体颗粒小).另一个作用是可以控制反应,当反应需要停止时,关闭止水夹,这样试管内的气压增大,液体被压回漏斗中,使液面低于隔板,这样反应就停止,反之,打开止水夹,反应继续.1年前查看全部
- 如图所示为圆柱形气缸,气缸壁绝热,气缸的右端有一小孔与大气相通,大气的压强为P0.用一热容量可忽略的导热隔板N和一绝热活
 如图所示为圆柱形气缸,气缸壁绝热,气缸的右端有一小孔与大气相通,大气的压强为P0.用一热容量可忽略的导热隔板N和一绝热活塞M将气缸分为A、B、C三室,隔板与气缸固连,活塞相对气缸可以无摩擦地移动但不漏气.气缸的左端A室中有一电加热器Ω.已知在A、B室中均盛有1摩尔同种理想气体,电加热器加热前,系统处于平衡状态,A、B两室中气体的温度均为T0,A、B、C三室的体积均为V0.现通过电加热器对A室中气体缓慢加热,若提供的总热量为Q0,试求B室中气体的末态体积和A室中气体的末态温度.(设A、B两室中气体1摩尔的内能为U=[5/2]RT,式中R为普适气体常量,T为绝对温度)
如图所示为圆柱形气缸,气缸壁绝热,气缸的右端有一小孔与大气相通,大气的压强为P0.用一热容量可忽略的导热隔板N和一绝热活塞M将气缸分为A、B、C三室,隔板与气缸固连,活塞相对气缸可以无摩擦地移动但不漏气.气缸的左端A室中有一电加热器Ω.已知在A、B室中均盛有1摩尔同种理想气体,电加热器加热前,系统处于平衡状态,A、B两室中气体的温度均为T0,A、B、C三室的体积均为V0.现通过电加热器对A室中气体缓慢加热,若提供的总热量为Q0,试求B室中气体的末态体积和A室中气体的末态温度.(设A、B两室中气体1摩尔的内能为U=[5/2]RT,式中R为普适气体常量,T为绝对温度)  一张破帆1年前1
一张破帆1年前1 -
 静子_dd 共回答了19个问题
静子_dd 共回答了19个问题 |采纳率89.5%解题思路:在电加热器对A室中气体加热的过程中,由于隔板N是导热的,B室中气体的温度要升高,活塞M将向右移动.当加热停止时,活塞M有可能刚移动气缸右端,也可能尚未移动右端,当然也可能活塞已经到右端,但加热过程还未停止.本题需要分情况讨论.1.设加热恰好能使活塞M移动到气缸最右端,则B室气体末态体积
VB=2V0 (1)
根据题意,活塞M向右移动过程中,B中气体压强不变,用TB表示B室中气体末态的温度,有
V0
T0=
VB
TB(2)
解(1)(2)两式可得
TB=2T0 (3);
由于隔板N是导热的,故A室中气体末态的温度
TA=2T0 (4);
在加热过程中,A室中气体经历的是等容过程,根据热力学第一定律,气体吸收的热量等于其内能的增加量,即
QA=
5
2R(TA−T0) (5);
由(4)(5)两式得
QA=
5
2RT0 (6);
B室中气体经历的是等压过程,在过程中B室气体对外做功为
WB=p0(VB-V0) (7);
由(1)(7)式及理想气体状态方程得
WB=RT0 (8);
内能改变为
△U=
5
2R(TB−T0) (9);
由(4)(9)两式得
△UB=
5
2RT0 (10);
根据热力学第一定律和(8)(10)两式,B室内气体吸收的热量为
QB=△UB+WB=
7
2RT0 (11);
由(6)(11)两式可知电加热器提供的热量为
Qm=QA+QB=6RT0 (12);
若Q0=Qm,B室中气体末态体积为2V0,A室中气体的末态温度2T0.
2.若Q0>Qm,则当加热器供应的热量达到Qm时,活塞刚好到达气缸最右端,但这时加热尚未停止,只是在以后的加热过程中气体的体积不做功,根据热力学第一定律,若A室中气体末态的温度为T'A,有
Q0−Qm=
5
2R(TA′−2T0′)+
5
2R(TA′−2T0) (13);
由(12)(13)两式可求得
TA′=
Q0
5R+
4
5T0 (14);
B中气体的末态的体积
VB'=2V0 (15)
3.若Q0<Qm,则隔板尚未移到气缸最右端,加热停止,故B室中气体末态的体积VB''小于2V0.设AB两室中气体末态温度为TA'',根据热力学第一定律,注意到A室中气体经历的是等容过程,其吸收的热量
QA=
5
2R(TA″−T0) (16)
B室中气体经历的是等压过程,吸收热量
QB=
5
2R(TA″−T0)+p0(VB″−V0) (17)
利用气体状态方程,上式变为
QB=
7
2R(T′′A−T0) (18)
由上可知
Q0=QA+QB=6R(T''A-T0) (19)
所以A室中气体的末态温度
T″A=
Q0
6R+T0 (20)
B室中气体的末态体积
V″B=
V0
T0T′′A=(
Q0
6RT0+1)V0(21)
答:1.若加热停止时,活塞M有刚移动气缸右端,则B室中气体末态体积为2V0,A室中气体的末态温度2T0
2.若活塞刚好到达气缸最右端,但这时加热尚未停止,则B室中气体末态体积为2V0,A室中气体的末态温度TA′=
Q0
5R+
4
5T0;
3.若隔板尚未移到气缸最右端,加热停止,则B室中气体的末态体积V″B=
V0
T0T′′A=(
Q0
6RT0+1)V0,A室中气体的末态温度T″A=
Q0
6R+T0.点评:
本题考点: 理想气体的状态方程.
考点点评: 本题为气体的综合应用题,题中涉及内能的相关知识,难度极大,过程复杂,是极少见的气体模型中的难题中难题.1年前查看全部
- 小孔隔板的原理在化学实验中,经常在试管内放入小孔隔板以控制反应的随时发生和停止,那到底小孔隔板是怎样控制反应的随时发生和
小孔隔板的原理
在化学实验中,经常在试管内放入小孔隔板以控制反应的随时发生和停止,那到底小孔隔板是怎样控制反应的随时发生和停止的呢?请来着详细说明! 沉默的教父1年前1
沉默的教父1年前1 -
 毕业llll 共回答了18个问题
毕业llll 共回答了18个问题 |采纳率88.9%不光是小孔隔板的作用,还配套有止水夹等开关一样的东东.利用了压强原理,隔板只是提供了一段距离,隔板上防止颗粒状固体,使得 固体可以与液体接触也可以分离 这样的实验一般都是产生气体,固体液体接触后就会产生气体,打开开关气体能够顺利导出,反应就一直进行下去.如果关闭开关,气体的压强就会增大,必然会给液体加压 ,并且压到另外的地方,使得固体液体脱离接触 反应就停止了 启普发生器也是这样的原理1年前查看全部
- 欲在室温和1.01×10 5 Pa条件下测定镁的原子量。请利用下图给定的仪器(盛放镁条的隔板有小孔)组成一套实验装置(每
欲在室温和1.01×10 5 Pa条件下测定镁的原子量。请利用下图给定的仪器(盛放镁条的隔板有小孔)组成一套实验装置(每种仪器只允许用一次)。请回答下列问题:
⑴假设气流方向由左向右,则各仪器的接口连接的先后顺序为a→ → →b→c→f→e→d(填写字母)。
⑵装置A中的分液漏斗中盛放的液体是 ,作用是 。
⑶连好仪器后,要进行的操作步骤有以下几步:
① 待仪器B中的物质恢复至室温时,测量量筒C中水的体积(假设将测定的体积换算成标准状况下为VmL);
② 擦掉镁条表面的氧化膜,将其置于天平上称量(假设其质量为mg),并将其投入试管B 中;
③ 检查各装置的气密性;
④ 旋开仪器A上分液漏斗的活塞,当镁条完全溶解时再关闭活塞。
上述几步操作的先后顺序是 。(2分)
⑷若未将试管B冷却至室温就测量量筒C中水的体积,这将会使所测镁的相对原子质量的数据(填偏高、偏低和无影响) 。
⑸若未擦净镁条表面氧化膜就进行实验,这将会使所测镁的相对原子质量的数据(填偏高、偏低和无影响) 。
⑹甲、乙、丙三位同学用下图装置来测定一定质量的镁完全反应后生成氢气的体积:
实验步骤如下:
① 检查装置的气密性;
② 向试管B中加入镁条;
③ 准确操作,记录C中液面刻度(C为带有刻度的量气管,D为可上下移动的水准管);
④ 由A向B中滴加稀盐酸至过量;
⑤ B中不在有气体产生并恢复至室温后,准确操作,记录C中液面刻度,计算得到气体的体积为Vml
Ⅰ、甲同学检查该装置气密性的方法是连接好装置,从D管注水,C、D两管液面形成高度差,做好标记,一段时间后,两边高度差 (填“变大”、“变小”或“不变”),说明气密性良好。为使测得的气体体积更精确,记录C中液面刻度时,除使视线与凹液面的最低处相平、冷至室温外,还应 ;
Ⅱ、甲同学认为镁带在实验前应打磨,目的是 ;
Ⅲ、通常实验前须估算药品用量,如果实验过程中,发现盐酸的量不足,应中途加酸还是重新实验: ;理由是 。
Ⅳ、以上是乙、丙两位同学所用实验装置,在步骤⑤读数时所处的稳定状态图,则将会对实验结果产生的影响是(假设其余步骤完善且操作准确无误):乙 ,丙 (填“偏大”、“偏小”或“无影响”)。 水儿的家1年前1
水儿的家1年前1 -
 忘记密码uu 共回答了16个问题
忘记密码uu 共回答了16个问题 |采纳率100%⑴h、g(1分)水使A瓶中的气体进入E瓶,增大E瓶中的气压,将稀盐酸压入B装置与Mg发生化学反应;
⑶③②④① (2分)⑷偏低 ⑸偏高
⑹不变调节D管,使CD两管中液面相平
Ⅱ、除去表面的氧化层;
Ⅲ、重新实验因为中途加酸,装置中的气体会逸出
Ⅳ、偏小偏大
(1)E图中气体应该从长管进来,否则就会将液体压出去了。
(2)装置A中的分液漏斗中盛放的液体是水,其作用是可以使A瓶中的气体进入E瓶,增大E瓶中的气压,将稀盐酸压入B装置与Mg发生化学反应;
(3)先后顺序为③②④①
(4)若未将试管B冷却至室温,会导致测量的气体偏多,也就会使测得的相对原子质量会偏少,
(5)若未擦净镁条表面氧化膜就进行实验,则所测得气体质量会偏少,也就会使测得的相对原子质量会偏大,
(6)高度差不变,就说明气密性良好。调节D管,使CD两管中液面相平,这样可以消除液体压强的影响。
镁表面有氧化膜,不除掉会影响测量结果。
因为中途加酸,装置中的气体会逸出,就会使测量结果不准确。
乙同学的装置图右边液面高,就会使右边压强比左边大,会使左边测得的气体体积偏小,所以乙同学的测量结果偏小,丙同学的装置左边是密闭的,当盐酸流下后会使左边气压变小,所以最终使测量结果偏高大。1年前查看全部
- 下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中有一个可左右滑动的隔板(其质量和摩擦力均忽略不计)。其
下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中有一个可左右滑动的隔板(其质量和摩擦力均忽略不计)。其中能表示在相同条件下,等质量的氢气与氦气的示意图是 [ ]A. 
B.
C.
D.
 唱者恒强1年前1
唱者恒强1年前1 -
 林杰和 共回答了20个问题
林杰和 共回答了20个问题 |采纳率95%D1年前查看全部
- 某公司建一座长方体仓库,高为5米,占地面积为600平方米(如图所示)中间以隔板隔开成三间,四周的造价为80元/平方米,中
某公司建一座长方体仓库,高为5米,占地面积为600平方米(如图所示)中间以隔板隔开成三间,四周的造价为80元/平方米,中间的两块隔板的造价为40元/平方米,仓库顶的造价为260元/平方米,其它造价,厚度等忽略不计.
(Ⅰ)试设计仓库的长与宽,使总造价最低,并求出最低造价;
(Ⅱ)由于地形限制,该仓库的宽不能超过15米,试设计仓库的长与宽,使总造价最低,并求出最低造价. egoeyre1年前3
egoeyre1年前3 -
 taolq 共回答了26个问题
taolq 共回答了26个问题 |采纳率92.3%解题思路:(Ⅰ)可以设宽为x米,长为600x米,总造价为y,根据题中的等量关系四周的造价为80元/平方米,中间的两块隔板的造价为40元/平方米,仓库顶的造价为260元/平方米,写出y关于x的解析式,然后利用均值不等式进行放缩,求出最小值;(Ⅱ)根据题意由于地形限制,该仓库的宽不能超过15米,x有限制范围,此时可以对y进行求导,利用导数判断其单调性,再求出最小值;(Ⅰ)设宽为x米,长为[600/x]米,总造价为y,
y=2(x+[600/x])×5×80+2x×5×40+260×600
=(3x+[1200/x])×400+156000≥400×2
3x×
1200
x+156000=204000,
当且仅当3x=[1200/x],即x=20时造价最低为:204000元;
(Ⅱ)∵x∈(0,15],y′=400(3-[1200
x2)<0,
∴函数y=(3x+
1200/x])×400+156000在(0,15]上单调递减,
∴x=15时,ymin=206000元;点评:
本题考点: 导数在最大值、最小值问题中的应用;函数模型的选择与应用.
考点点评: 本题主要考查了建立函数解析式,利用基本不等式求函数最值的能力,同时考查了运算求解能力,属于中档题.1年前查看全部
- 一个隔热容器中间一个隔热隔板,左右两边气体一样隔板可以无摩擦滑动
一个隔热容器中间一个隔热隔板,左右两边气体一样隔板可以无摩擦滑动
右边气体有一电热丝通电一小会电气体膨胀了,隔板左移,右边气压强大了小了 rnss1年前1
rnss1年前1 -
 一直记得绝对不忘 共回答了10个问题
一直记得绝对不忘 共回答了10个问题 |采纳率100%隔板无摩擦滑动,当隔板不动时,左右两边压力相等.左边属于绝热系统,外界对气体所做的功等于气体内能增加,温度升高,PV=nRT,体积减小,温度增加,其他参数不变,则左边压力增大,右边压力增大.1年前查看全部
大家在问
- 1i think sally will be an office worker in five y
- 2用两角和与差的余弦公式来合并cosx+sinx
- 3高一小科怎么背呀?
- 4用计算器计算29*(-86)时,用带符号键(-)的计算器,计算的程序是.
- 5绝句的译文江碧鸟逾白,山青花欲然.今春看又过,何日是归年.
- 6Tony bought something in that store yesterday?
- 7如图所示,正方形线框abcd放在光滑绝缘的水平面上,其边长L=0.5m、质量m=0.5kg、电阻R=0.5Ω,M、N分别
- 8晶体熔化时动能几乎不变,势能增大,那水呢?
- 92005年9月,飓风对美国历史名城新奥尔良市进行了毁灭性的袭击。据英国《每日快报》、俄罗斯《真理报》10月1日报道,美国
- 10静以修身,俭以养德。非淡泊无以明志,非宁静无以致远。演变成了哪两个成语
- 11300,20,20,4=280填运算符号或括号急
- 12电磁波的波长为λ、频率f和波速c三者之间的关系式为______,从这个关系式中可以看出电磁波的频率越高,其波长越____
- 13:古典概率 求大神推导一个公式把从n个元素中任取2个元素看成一次实验,如果这2个元素没有顺序,那么这次实验共有n(n-1
- 14帮忙翻译一句话.i wonder whether i have made everything clear since
- 15C12原子的质量怎样算出的?


