制备蒸馏水时,应先接通冷凝水,在点燃酒精灯加热蒸馏烧瓶.这句话对吗?如果不对,错在哪里
 zhxfifa2022-10-04 11:39:541条回答
zhxfifa2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 kongwenzi 共回答了27个问题
kongwenzi 共回答了27个问题 |采纳率100%- 这句话应该这样说:制备蒸馏水时,应先接通冷凝水,再点燃酒精灯加热蒸馏烧瓶.
- 1年前
相关推荐
- 在科学实验中,常用电解水的方法制备纯的氧气,供研究工作使用.试计算电解1KG水,最多可制备的氢气质量是
 heben11781年前1
heben11781年前1 -
 sometimeloveu 共回答了17个问题
sometimeloveu 共回答了17个问题 |采纳率88.2%设制得的质量是X千克
2H2O=2H2↑+O2↑
36 32
1 X
X=0.89千克
氧气的体积:(0.89*1000)/32*22.4=623升1年前查看全部
- 介绍新型绿色环保可食性包装材料的特性,并按其制备来源进行分类,对其现存问题及发展趋势做了概要阐述
 mayrenyu1年前1
mayrenyu1年前1 -
 天啊怎么回事 共回答了16个问题
天啊怎么回事 共回答了16个问题 |采纳率81.3%随着现代食品工业的发展,食品包装不断更新,一类能完善包装材料的环境保护之间矛盾的新型食品包装技术材料——可食性包装脱颖而出.可食性包装材料是指当包装的功能实现后,该材料可转变为一种动物或人可食用的原料,是一种可实现包装材料功能转型的特殊包装材料.可食性包装材料是一种无废弃物的包装,是一种资源型环保型的包装材料.1年前查看全部
- 根据以下叙述制备氯化铜:先将浓盐酸用蒸气加热至80℃左右,慢慢加入含有FeO杂质的CuO粉,充分反应,使其溶解.已知:F
根据以下叙述制备氯化铜:先将浓盐酸用蒸气加热至80℃左右,慢慢加入含有FeO杂质的CuO粉,充分反应,使其溶解.已知:FeS不溶于水,但溶于酸;在除去溶液中的Fe 2+ 时,可采用的方法是( )
溶液中被沉淀离子 Fe 3+ Fe 2+ Cu 2+ 完全生成氢氧化物沉淀时,溶液的pH ≥3.7 ≥9.6 ≥6.4 A.可直接加碱,调整溶液的pH≥9.6 B.加入纯铜粉,将Fe 2+ 还原为Fe C.先将Fe 2+ 氧化成Fe 3+ ,再调整溶液pH至3~4 D.通入H 2 S使Fe 2+ 直接沉淀  一地碎发1年前1
一地碎发1年前1 -
 宇宙猪之ww姐 共回答了18个问题
宇宙猪之ww姐 共回答了18个问题 |采纳率83.3%A、因直接加碱,调整溶液pH≥9.6,Fe 2+ 以Fe(OH) 2 形式完全沉淀,此时的pH≥9.6,同时Cu 2+ 以Cu(OH) 2 的形式完全沉淀,不但除去了Fe 2+ ,也除去了Cu 2+ ,不符合除杂的原则,故A错误;
B、因铜粉的还原性比铁弱,不能将Fe 2+ 还原出来,故B错误;
C、将Fe 2+ 氧化成Fe 3+ ,Fe 3+ 以Fe(OH) 3 形式完全沉淀,pH在3~4,此时Cu 2+ 形成没有沉淀,过滤除去Fe(OH) 3 沉淀,既除去除去了杂质,也没有除去原物质,故C正确;
D、FeS不溶于水,但溶于酸,通入硫化氢,不能除去Fe 2+ ,但使Cu 2+ 形成CuS沉淀,除去了Cu 2+ ,不符合除杂的原则,故D错误;
故选C.1年前查看全部
- 71gCI2制备漂白粉[有效成分Ca(ClO)2]时转移电子数是?
 婉夕1年前2
婉夕1年前2 -
 理科男生 共回答了26个问题
理科男生 共回答了26个问题 |采纳率96.2%工业上将Cl2通入石灰乳中得到漂白粉,反应为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O可知:一份Cl2 可得到一份Ca(ClO)271gCl2 为 1mol,即生成0.5molCa(ClO)2现在问的是转移的电子数那么方程式中化合价变化的只有Cl,C...1年前查看全部
- 某校化学实验兴趣小组为了探究在实验室制备Cl 2 的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了
某校化学实验兴趣小组为了探究在实验室制备cl 2 的过程中有水蒸气和hcl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。

(1)下列方法中,可制得氯气的正确组合是 。
①mno 2 和浓盐酸混合共热
②kmno 4 和浓盐酸混合 ③氯酸钠和浓盐酸混合 ④k 2 cr 2 o 7 和浓盐酸混合
(2)若用含有0.2 mol hcl的浓盐酸与足量的mno 2 反应制取cl 2 ,制得的cl 2 体积(标准状况下)总是小于1.12 l的原因是 。a.①②③ b.①②④ c.①② d.全部可以
(3)①装置b的作用是 ,现象是 。
②装置c和d出现的不同现象说明的问题是 。
③装置e的作用是
目前***饮用水消毒主要用氯——通氯气,加漂白粉或漂白精。
(1) 漂白粉或漂白精长期放置于空气中会变质失效,其化学方程式是__________________。
(2)目前***广泛采用经过干燥空气稀释的氯气,通入填有固体亚氯酸钠(naclo 2 )的柱内
制得clo 2 ,这一反应的化学方程式是:_________________________________________。 凤凰之心1年前1
凤凰之心1年前1 -
 无言的vv 共回答了11个问题
无言的vv 共回答了11个问题 |采纳率90.9%(1)D (2)浓盐酸随着反应的进行浓度逐渐降低,最终变为稀盐酸,反应不再产生氯气
(3)①证明有水蒸气产生 白色固体变蓝色
②氯气无漂白性,氯气与水反应产生的次氯酸有漂白性
③吸收氯气
(1)Ca(ClO) 2 +CO 2 +H 2 O=CaCO 3 ↓+2HClO
(2)Cl 2 +2NaClO 2 =2ClO 2 +2NaCl
1年前查看全部
- 用Grignard试剂与苯甲酸乙酯制备三苯甲醇时,如何避免反应停留在二苯酮阶段、、
 hengrenzhi1年前1
hengrenzhi1年前1 -
 chenwei820605 共回答了21个问题
chenwei820605 共回答了21个问题 |采纳率90.5%适当稍稍加大格氏试剂的浓度,一般来说格氏试剂和物质反应不会停留在酮这个阶段,而是继续反应生成醇,如果你要是觉得苯基位阻太大怕产率不高的话,我建议你用烃基锂,这个可以完全无视位阻直接成醇的.1年前查看全部
- 为什么制备乙酸乙酯用14.3ML冰乙酸,23ML乙醇,7.5ML浓硫酸?怎么计算出来的?
 vevei1年前1
vevei1年前1 -
 kirbyboy 共回答了19个问题
kirbyboy 共回答了19个问题 |采纳率89.5%因为考虑到乙酸乙酯的沸点和乙酸差不多,都在100℃以上,而乙醇为75℃左右,所以为了方便分离,只能让酸完全反应,让醇过量.所以你看到了乙醇跟乙酸不是一比一而是多于乙酸.另外浓硫酸是催化剂,含量是通过实验找到的,多了碳化,溶液变成棕色.少了反应慢,相同时间内产率低.1年前查看全部
- (8分)实验室里迅速制备少量氯气可利用以下反应:
(8分)实验室里迅速制备少量氯气可利用以下反应:
2 KMnO 4 +16 HCl ="==" 2 KCl + 2 MnCl 2 + 5 Cl 2 ↑ + 8 H 2 O
此反应不需要加热,常温下就可以迅速进行,而且对盐酸的浓度要求不高。
(1)用“线桥法”表示出电子转移情况:
2 KMnO 4 +16 HCl ="==" 2 KCl + 2 MnCl 2 + 5 Cl 2 ↑ + 8 H 2 O
(2)该反应中,氧化剂是__________,还原剂是_________。
(3) 当电子转移的数目为6.02×10 23 个时生成的氯气的物质的量为 mol 互连星空互连星空1年前0
互连星空互连星空1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 实验室常用铜片、稀硫酸和浓硝酸来制备五水硫酸铜:Cu+2HNO3+H2SO4=CuSO4+2NO2↑+2H2O分以下几个
实验室常用铜片、稀硫酸和浓硝酸来制备五水硫酸铜:Cu+2HNO3+H2SO4=CuSO4+2NO2↑+2H2O分以下几个步骤:①
实验室常用铜片、稀硫酸和浓硝酸来制备五水硫酸铜:Cu+2HNO3+H2SO4=CuSO4+2NO2↑+2H2O分以下几个步骤:
①将盛有4.5g铜屑的蒸发皿置于酒精灯火焰上,灼烧至表面呈现黑色,冷却;
②加16mL3mol?L-1硫酸,再缓慢、分批加入7mL12mol?L-1硝酸(在通风橱进行);
③待反应缓和后,盖上表面皿,用水浴加热至铜屑全溶;
④倾析法趁热将溶液转移到另一蒸发皿中,并在水浴上浓缩到溶液出现晶膜,冷却,过滤;
…
请回答下列问题:
(1)将铜屑灼烧的目的是______,表面的黑色物质是______.
(2)加入硝酸时,必须缓慢、分批加入的目的是______.
(3)控制硝酸总量尽可能小除了环保和节约原料外,还可能的原因是______.
(4)下图是硫酸铜和硝酸铜的溶解度表(单位:g),请根据表回答:
①步骤④溶液冷却时析出的晶体主要是______.温度/℃ 0 20 40 60 80 100 CuSO4?5H2O 23.1 32.0 44.6 61.8 83.8 114.0 Cu(NO3)2?xH2O 83.5 125.0 163.0 182.0 208.0 247.0
②将五水硫酸铜粗产品提纯,要采取的实验方法是______.
(5)实验中取用蒸发皿的仪器是______,使用蒸发皿时的注意事项是______.(只需写出一项)
(6)如不用水浴加热蒸发,五水硫酸铜晶体可能会因温度高转变为白色的硫酸铜,此过程属于______变化.(填“物理”或“化学”)
 泽曼我心1年前1
泽曼我心1年前1 -
 maimailisa 共回答了20个问题
maimailisa 共回答了20个问题 |采纳率85%(1)因金属表面沾有油污,用加热可除去,同时生成黑色的氧化铜,故答案:除去表面的油污,氧化铜;
(2)硝酸是氧化剂,加快了会有大量气体放出,会夹带溶液,使溶液溢出容器;分批加是为充分利用硝酸,避免未反应的酸在加热时分解.故答案:防止反应剧烈,有液体溅出;避免硝酸分解;
(3)反应时,硝酸加多了,会导致粗产品中含有较多的硝酸铜,致使粗产品呈绿色.故答案:避免引入过多NO3-,影响后面的实验;
(4)①因CuSO4?5H2O的溶解度随温度变化较大,所以先析出,故答案:五水硫酸铜;
②因CuSO4?5H2O含有杂质Cu(NO3)2?xH2O,但Cu(NO3)2?xH2O溶解度随温度变化不大,故可用重结晶法提纯,故答案:重结晶;
(5)蒸发皿在实验中有一定的温度,应用坩埚钳取用,同时蒸发皿蒸发溶液时蒸发皿中溶液的体积不超过它体积的2/3、蒸发溶液时不能蒸干,有大部分晶体析出时停止加热、避免骤冷导致蒸发皿破裂等,故答案:避免骤冷导致蒸发皿破裂或蒸发溶液时蒸发皿中溶液的体积不超过它体积的2/3或蒸发溶液时不能蒸干等;
(6)由于固体由CuSO4?5H2O变成CuSO4,这是两种不同的物质,故答案:化学.1年前查看全部
- 在做乙酸乙酯的制备反应,为什么浓硫酸也做吸水剂呢?为什么要吸水哈?
在做乙酸乙酯的制备反应,为什么浓硫酸也做吸水剂呢?为什么要吸水哈?
还有饱和碳酸钠溶液的作用为什么是减小乙酸乙酯的溶解度哈?为什么要减小哈? fkhc1年前5
fkhc1年前5 -
 kandy20021 共回答了15个问题
kandy20021 共回答了15个问题 |采纳率86.7%1 浓硫酸具有强烈的吸水性 2 该反应为可逆反应 除去水后能使反应向右移动 增加乙酸乙酯的产率 3 由于相似相溶原理乙酸乙酯不易溶在无机溶液里 4减小后乙酸乙酯更易分液 便于制备啊1年前查看全部
- 物理文献翻译(制备zno薄膜)The co-planar evaporated Al electrodes were v
物理文献翻译(制备zno薄膜)
The co-planar evaporated Al electrodes were verified to yield ohmic behaviour.
The spectral dependence of α exhibits two regions: a power law one at high photon energies and an exponential one at lower energies.
第二句 里的spectral dependence是什么?
需要前两句的译文 ll给看看1年前1
ll给看看1年前1 -
 beliada 共回答了21个问题
beliada 共回答了21个问题 |采纳率100%α波的光谱依赖曲线……可能是……ZnO薄膜和这个有什么关系……
可能这么翻译……
经共面蒸发形成的铝电极被证实符合欧姆行为.
α波的光谱依赖曲线表现为两个区域:一个在高光子能量区,符合幂次定律,另一个在较低能量区,符合指数分布.1年前查看全部
- Fe和HCI在试验室中能制备三氯化铁吗
 飞雪恋上火1年前2
飞雪恋上火1年前2 -
 uu香 共回答了20个问题
uu香 共回答了20个问题 |采纳率75%直接反应不能制得,必须经过其他途径将铁单质氧化为高价铁之后再与盐酸反应.
可以将盐酸电解,在阳极上会收集到氯气,然后用氯气和铁反应就可以制得氯化铁1年前查看全部
- 氧化亚锡在常温下溶于氢氟酸吗?我想制备氟化亚锡
氧化亚锡在常温下溶于氢氟酸吗?我想制备氟化亚锡
有助于回答者给出准确的答案 miss5181年前1
miss5181年前1 -
 e5540 共回答了17个问题
e5540 共回答了17个问题 |采纳率94.1%标准制备方法:SnO溶于40%HF,蒸发浓缩得无色SnF2单斜晶体
不过.注意安全啊~1年前查看全部
- 已知Fe(OH)2是白色絮状沉淀,并极易被空气中的氧气氧化成Fe(OH)3红褐色沉淀.右图为Fe(OH)2制备实验的改进
已知Fe(OH)2是白色絮状沉淀,并极易被空气中的氧气氧化成Fe(OH)3红褐色沉淀.右图为Fe(OH)2制备实验的改进装置,使用该装置能在较长时间内观察到生成的Fe(OH)2白色絮状沉淀.
(2)A试管中反应开始时,打开止水夹,B试管中看到的现象是
(3)若要在该装置中得到Fe(OH)2白色絮状沉淀,并在一定时间内放置被氧化成Fe(OH)3红褐色沉淀,下一步的实验操作是
答案是(2)导管口有气泡产生(3)关紧止水夹
分析下
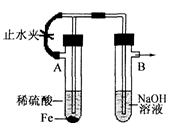
 kuangkuangtang1年前6
kuangkuangtang1年前6 -
 atxdx 共回答了18个问题
atxdx 共回答了18个问题 |采纳率88.9%A试管中反应:Fe+H2SO4=FeSO4+H2,打开止水夹,氢气经左边的支管到B中的溶液中,再从溶液中逸出,赶走了B中的空气
关闭止水夹后,A中氢气在试管A中使得A中压强增大,把FeSO4溶液经中间导管压到B中,与氢氧化钠反应,没有氧气故见到白色沉淀1年前查看全部
- (2011•漳州一模)纳米氧化镁具有特殊的热、光、电、力学和化学等性能,有广泛的应用前景.如图是利用海水制备纳米氧化镁的
(2011•漳州一模)纳米氧化镁具有特殊的热、光、电、力学和化学等性能,有广泛的应用前景.如图是利用海水制备纳米氧化镁的流程图.

回答下列问题:
(1)操作I后得到的母液中镁离子浓度为1.8×10-3 mol•L-1,要使镁离子产生沉淀,溶液的pH最低应为______.(已知:Ksp[MgCO3]=6.8×10-6,Ksp[Mg(OH)2]=1.8×10-11)
(2)利用MgCl2•6H2O制备无水氯化镁,需在干燥的______气流中加热,原因是______.
(3)反应I中CO(NH2)2与H2O反应生成CO2和NH3•H2O,还发生另一主要化学反应的离子方程式为______.
(4)某科研小组研究反应I在温度为378K~398K时的反应时间、反应物配比等因素对制备纳米氧化镁产率的影响.请完成以下实验设计表(表中不要留空格):
(5)如图为反应I的温度对纳米MgO产率(曲线a)和粒径(曲线b)的影响,请你归纳出温度对纳米MgO的制备有何影响的结论(至少写出一条):__________________.实验
编号T/K 反应
时间/h反应物的物质的量配比
n[CO(NH2)2]:n[MgCl2•6H2O]实验目的 ① 378 3 3:1 (Ⅰ)实验①和③探究______
______;
(Ⅱ)实验②和④探究______;
(Ⅲ)实验②和______探究反应时间对产率的影响.② 378 4 4:1 ③ 378 3 ④ 398 4 4:1 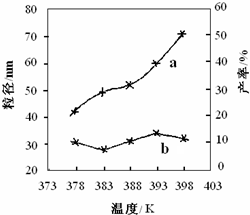
 lzp6_91年前1
lzp6_91年前1 -
 jun65084940 共回答了20个问题
jun65084940 共回答了20个问题 |采纳率85%解题思路:(1)结合Ksp[Mg(OH)2]=c(Mg2+)•c2(OH-)=1.8×10-11计算c(OH-),再利用Kw=c(H+)•c2(OH-)计算c(H+),最后根据pH=-lgc(H+)计算.
(2)MgCl2•6H2O在受热时易发生水解,需要抑制其水解.
(3)由工艺流程转化关系可知,反应I中的目的是制备Mg(OH)2,所以反应I中还发生Mg2+与氨水反应生成Mg (OH)2与NH4+.
(4)实验根据控制变量法进行对比试验,研究温度、反应时间、反应物配比对氧化镁产率,分析对比实验的变量不同进行解答.
(5)由图表中数据可知,在378K~398K,纳米MgO的粒径大小无明显变化,在383K较低温度下有利于形成较小的颗粒,纳米MgO产率产率随温度的升高而增大.(1)由于Ksp[Mg(OH)2]=c(Mg2+)•c2(OH-)=1.8×10-11,当溶液中c(Mg2+)=10-3mol•L-1,开始沉淀需要OH-浓度为c(OH-)=
1.8×10−11
1.8×10−3=10-4 mol•L-1,所以c(H+)=
10−14
10−4=10-10mol•L-1,pH=-lgc(H+)=-log10-10=10.
故答案为;10.
(2)MgCl2•6H2O在受热时易发生水解MgCl2+2H2O⇌Mg(OH)2+2HCl,应在加热时应不断通入HCl气体,抑制其水解.
故答案为:HCl;MgCl2•6H2O在受热时易发生水解,为抑制其水解,在加热时应不断通入HCl气体.
(3)由工艺流程转化关系可知,反应I中的目的是制备Mg(OH)2,所以反应I中还发生Mg2+与氨水反应生成Mg (OH)2与NH4+,反应离子方程式为Mg2++2NH3•H2O=Mg (OH)2↓+2NH4+.
故答案为:Mg2++2NH3•H2O=Mg (OH)2↓+2NH4+.
(4)实验根据控制变量法进行对比试验,研究温度、反应时间、反应物配比对氧化镁产率影响.
(Ⅰ)实验①和③,温度相同,反应时间相同,应研究反应物配比对氧化镁产率的影响,③中反应物配比应为4:1;
(Ⅱ)实验②和④,反应时间相同,反应物配比相同,温度不同,应是探究温度对产率的影响;
(Ⅲ)③中反应物配比应为4:1,实验②和③,温度相同、反应物配比相同,反应时间不同,探究反应时间对产率的影响.
故答案为:
实验
编号 T/K 反应
时间/h 反应物的物质的量配比
n[CO(NH2)2]:n[MgCl2•6H2O] 实验目的
① (Ⅰ)反应物的物质的量配比对产率的影响;
(Ⅱ)温度对产率的影响;
(Ⅲ)③
②
③ 4:1
④ (5)由图表中数据可知,在378K~398K,纳米MgO的粒径大小无明显变化,在383K较低温度下有利于形成较小的颗粒,纳米MgO产率产率随温度的升高而增大.
故答案为:在378K~398K,纳米MgO的粒径大小无明显变化,在383K较低温度下有利于形成较小的颗粒,纳米MgO产率产率随温度的升高而增大.点评:
本题考点: 制备实验方案的设计;化学平衡的影响因素;盐类水解的应用;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 考查溶度积计算、盐类水解、对工艺流程的理解与条件的控制、对实验数据图象的分析、移动题目获取信息能力等,难度中等,需要学生具备扎实的基础与综合运用知识分析问题、解决问题能力.1年前查看全部
- 石灰石制备碳酸钙不要石灰石.生石灰.石灰水.碳酸钙的.
 starww1年前1
starww1年前1 -
 苏有菜 共回答了14个问题
苏有菜 共回答了14个问题 |采纳率92.9%石灰石加盐酸溶解再加入过量的碳酸钠过滤浓缩干燥即可1年前查看全部
- 用正丁醇制备2-甲基-2-己醇的实验原理
用正丁醇制备2-甲基-2-己醇的实验原理
2-甲基-2-己醇的制备 ndpwbdnq1年前1
ndpwbdnq1年前1 -
 踏破铁穴 共回答了15个问题
踏破铁穴 共回答了15个问题 |采纳率93.3%格式反应,先卤化生成卤丁烷,再制成格式试剂与丙酮反应再水解即可1年前查看全部
- 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
(1)冶炼铜的反应为8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2高温 .
若CuFeS2中Fe的化合价为+2,反应中被还原的元素______(填元素符号).
(2)上述冶炼过程中产生大量SO2.下列处理方案合理的是______(填代号).
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3
d.用浓硫酸吸收
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧制得.
据以上信息回答下列问题:
选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸稀硫酸KSCN溶液KMnO4溶液NaOH溶液碘水
所选试剂为______.证明炉渣中含有FeO的实验现象为______. 花生乐橙搞联合1年前1
花生乐橙搞联合1年前1 -
 嘎嘎冷 共回答了16个问题
嘎嘎冷 共回答了16个问题 |采纳率100%解题思路:(1)8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2中,Fe元素的化合价升高,Cu、O元素的化合价降低;高温 .
(2)冶炼过程中产生大量SO2可制备硫酸或利用碱液吸收;
(3)设计实验验证炉渣中含有FeO,利用酸溶液后,根据亚铁离子具有还原性,选氧化剂发生明显的现象来解答.(1)8CuFeS2+21O2
高温
.
8Cu+4FeO+2Fe2O3+16SO2中,Fe元素的化合价升高,Cu、O元素的化合价降低,则Cu、O元素被还原,故答案为:Cu、O;
(2)冶炼过程中产生大量SO2可制备硫酸或利用碱液吸收,与浓硫酸不反应,也不能直接排放,故答案为:bc;
(3)设计实验验证炉渣中含有FeO,利用酸溶液后,根据亚铁离子具有还原性,选氧化剂发生明显的现象即可证明,因盐酸能被高锰酸钾氧化,则选择试剂为稀硫酸、KMnO4溶液,证明炉渣中含有FeO的实验现象为稀硫酸浸取炉渣所得溶液能使KMnO4溶液褪色,
故答案为:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液能使KMnO4溶液褪色.点评:
本题考点: 氧化还原反应;物质的分离、提纯的基本方法选择与应用;物质的检验和鉴别的基本方法选择及应用.
考点点评: 本题考查氧化还原反应及应用,为高频考点,把握物质的性质、反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,(3)中易错选盐酸,题目难度不大.1年前查看全部
- 描述下列实验中观察到的现象并书写有关反应的化学方程式:在盛有少量新制备的氧化铜的试管里,加少量稀硫酸.
 上vv古剑1年前1
上vv古剑1年前1 -
 小子各足处 共回答了21个问题
小子各足处 共回答了21个问题 |采纳率90.5%CuO+2HCl=CuCl2+H2O(=后的2为角码)黑色粉末逐渐消失,溶液显淡蓝色.1年前查看全部
- 某学生用如图所示装置制备氢气,并用制得的氢气还原氧化铜(装置中必要的铁架台、铁夹、加热设备等在图中均已略去).请填写下列
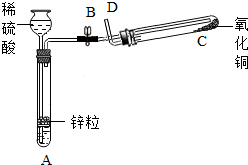 某学生用如图所示装置制备氢气,并用制得的氢气还原氧化铜(装置中必要的铁架台、铁夹、加热设备等在图中均已略去).请填写下列空白:
某学生用如图所示装置制备氢气,并用制得的氢气还原氧化铜(装置中必要的铁架台、铁夹、加热设备等在图中均已略去).请填写下列空白:
(1)实验时,打开B处止水夹,在试管A中,除了液面上升以外,用眼睛还可以观察到的现象是______,过一段时间后,用手触摸试管A的外壁可以感觉到的现象是______,试管A中发生反应的化学方程式为______,其反应类型为______.
(2)在做氢气还原氧化铜实验之前,必须在D出口处______,然后在______处点燃酒精灯加热;实验过程中,在试管C中可以观察到的现象是______;发生反应的化学方程式为H2+CuO
Cu+H2O△ .H2+CuO;实验结束时,______关闭B处止水夹,______停止加热(填“先”或“后”).
Cu+H2O△ .
(3)实验过程中,该同学若想证明氢气具有可燃性,其实验操作是______. 日白小ss1年前1
日白小ss1年前1 -
 飞羽79 共回答了20个问题
飞羽79 共回答了20个问题 |采纳率90%解题思路:(1)根据锌粒和稀硫酸反应的现象、反应原理、反应特点进行解答;
(2)根据氢气还原氧化铜的操作步骤和注意事项及反应原理分析解答;
(3)根据装置特点进行分析.(1)锌粒和稀硫酸反应生成硫酸锌和氢气,放出热量,方程式是Zn+H2SO4═ZnSO4+H2↑,该反应由一种单质和一种化合物生成另一种单质和化合物,属于置换反应;故答案为:有气泡冒出; 发热; Zn+H2SO4═ZnSO4...
点评:
本题考点: 氢气的制取和检验;碳、一氧化碳、氢气还原氧化铜实验;书写化学方程式、文字表达式、电离方程式;氢气的化学性质与燃烧实验.
考点点评: 本题对氢气的制取和性质进行了细致的考查,解题时要根据相关知识并结合实验装置细心分析,才能正确解答.1年前查看全部
- 软锰矿制备高锰酸钾的离子方程式
 队非常的1年前1
队非常的1年前1 -
 重新崛起 共回答了16个问题
重新崛起 共回答了16个问题 |采纳率93.8%3MnO2+6KOH+KClO3=3K2MnO4+KCl+3H2O↑
3MnO42-+4H+=2MnO4-+MnO2↓+2H2O
两式相加得 2MnO2+6OH-+4H+ClO3- = 2MnO4-+5H2O↑+CL-1年前查看全部
- 实验室常利用以下装置完成气体制备及性质实验.请回答:
实验室常利用以下装置完成气体制备及性质实验.请回答:

①以上装置(A-E中)有一处明显的错误,请加以改正______.利用改正后的装置继续完成后面的实验.
②欲使用高锰酸钾制取氧气,应选择的发生装置是______(填字母),若使用C装置收集氧气,实验结束时,应先从水槽中移出导气管,再熄灭酒精灯,原因是______
③将CO2和CO的混合气体通过F装置(液体药品均足量),实验开始时关闭活塞B,打开活塞a,此时从导管c逸出的气体主要是______.一段时间后,再关闭活塞a,打开活塞b,将分液漏斗中的稀盐酸滴入广口瓶中,此时有气体逸出.欲收集该气体,应选择的装置是______(填字母),验满的方法是______.
(2)某化学兴趣小组在课外活动中对某溶液进行了多次检测,其中三次检测结果如下表所示,请回答:
①三次检测结果中第______次检测结果不正确.检测次序 溶液中检测出的物质 第一次 KCl、K2SO4、Na2CO3、NaCl 第二次 KCl、BaCl2、Na2SO4、K2CO3 第三次 Na2SO4、KCl、K2CO3、NaCl
②在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子,先向溶液中加入过量的稀硝酸溶液,检测的离子是______,然后继续加入过量的______溶液(填化学式),其目的是______;过滤
后,再向滤液中加入______溶液(填化学式). Limbonavel1年前1
Limbonavel1年前1 -
 玫瑰酸奶之吻 共回答了14个问题
玫瑰酸奶之吻 共回答了14个问题 |采纳率100%解题思路:A有一处明显的错误,改正为:A装置的导管应该进入橡皮塞少许即可;制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.若使用C装置收集氧气,实验结束时,应先从水槽中移出导气管,再熄灭酒精灯,原因是:防止水倒吸进入试管,使试管炸裂;将CO2和CO的混合气体通过F装置(液体药品均足量),实验开始时关闭活塞B,打开活塞a,此时从导管c逸出的气体主要是一氧化碳,因为二氧化碳被氢氧化钠溶液吸收了;一段时间后,再关闭活塞a,打开活塞b,将分液漏斗中的稀盐酸滴入广口瓶中,此时有二氧化碳气体逸出,二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳的验满方法是:将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了.由题目的信息可知:其中第二次检测结果不正确,因为BaCl2、Na2SO4、K2CO3不能共存,会生成硫酸钡、碳酸钡白色沉淀;先向溶液中加入过量的稀硝酸溶液,检测的离子是碳酸根离子,因为碳酸根离子遇到酸会有大量气泡冒出;然后继续加入过量的硝酸钡溶液,是为了检验并除尽硫酸根离子;过滤后,再向滤液中加入AgNO3溶液,是为了检验氯离子.(1)A有一处明显的错误,改正为:A装置的导管应该进入橡皮塞少许即可;如果用高锰酸钾制氧气就需要加热,若使用C装置收集氧气,实验结束时,应先从水槽中移出导气管,再熄灭酒精灯,原因是:防止水倒吸进入试管,使试管炸裂;将CO2和CO的混合气体通过F装置(液体药品均足量),实验开始时关闭活塞B,打开活塞a,此时从导管c逸出的气体主要是一氧化碳,因为二氧化碳被氢氧化钠溶液吸收了;一段时间后,再关闭活塞a,打开活塞b,将分液漏斗中的稀盐酸滴入广口瓶中,此时有二氧化碳气体逸出,二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳的验满方法是:将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了.故答案为:①A装置的导管应该进入橡皮塞少许即可;②A;防止水倒吸进入试管,使试管炸裂;③CO;E;将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了;
(2)由题目的信息可知:其中第二次检测结果不正确,因为BaCl2、Na2SO4、K2CO3不能共存,会生成硫酸钡、碳酸钡白色沉淀;先向溶液中加入过量的稀硝酸溶液,检测的离子是碳酸根离子,因为碳酸根离子遇到酸会有大量气泡冒出;然后继续加入过量的硝酸钡溶液,是为了检验并除尽硫酸根离子;过滤后,再向滤液中加入AgNO3溶液,是为了检验氯离子;故答案为:①二;②碳酸根离子;Ba(NO3)2;检验并除尽硫酸根离子;AgNO3点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;混合物的分离方法;常见气体的检验与除杂方法;实验室制取氧气的反应原理;制取氧气的操作步骤和注意点;二氧化碳的化学性质;常见离子的检验方法及现象.
考点点评: 本考点主要考查了注意事项、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和常见离子的检验等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.1年前查看全部
- 以铜,石灰石.盐酸为原料,制备氢氧化铜,其它原料自选,写出该原理的方程式.
 wangdoctor1年前1
wangdoctor1年前1 -
 aabacon 共回答了13个问题
aabacon 共回答了13个问题 |采纳率76.9%Cao+2h2o=(高温)Ca(oh)2+h2
Cu+2hcl=Cucl2+h2
Cucl2+Ca(oh)2=Cu(oh)2+Cacl2
这只是一个简单的置换反应1年前查看全部
- 硫酸钡是唯一的无毒的钡盐,工业上以硫酸钡等为原料通过下列流程反应可以制备锌钡白(BaSO4+ZnS)和过氧化氢.(皓矾为
硫酸钡是唯一的无毒的钡盐,工业上以硫酸钡等为原料通过下列流程反应可以制备锌钡白(baso4+zns)和过氧化氢.(皓矾为znso4•7h2o)

(1)上述流程***有7个化学反应,其中有______个属于氧化还原反应.
(2)写出过氧化氢和物质c的电子式:______,______.
(3)写出f、g的化学式:f______、g______.
(4)写出下列化学反应方程式:反应③______.反应⑦______.
(5)取锌钡白固体16.5g溶于100ml 1mol/l的h2so4 溶液中,放出h2s 气体1008ml(已折算成标准状况)
①不计溶液体积变化,所得溶液中氢硫酸的物质的量浓度为______mol/l;
②加热驱尽溶液中h2s 后,为使锌离子刚好完全沉淀,应加入 1mol/l的naoh溶液______ml. fjfcvvf551年前1
fjfcvvf551年前1 -
 didididd 共回答了23个问题
didididd 共回答了23个问题 |采纳率91.3%解题思路:重晶石是BaSO4,黑色单质A通常是碳.由BaSO4和单质碳高温生成气体B,B燃烧生成气体C,可知B是CO,C是CO2.有臭鸡蛋气味的气体E是H2S,而H2S是由D溶于H2O通入CO2所得,则D中含S2-.BaSO4和单质碳高温生成气体CO,同时生成白色固体D,则D是BaS.BaS溶于H2O,与皓矾(ZnSO4•7H2O)反应生成锌钡白(BaSO4和ZnS的混合物).BaS溶于H2O 通入CO2产生H2S,同时生成白色沉淀F,可知F是BaCO3.进一步推出G是BaO,H是BaO2,BaO2与稀H2SO4反应生成BaSO4沉淀和H2O2.
(1)元素化合价在反应前后发生变化的反应属于氧化还原反应;
(2)H2O2属于共价化合物,分子中氧原子与氢原子之间形成1对共用电子对,氧原子之间形成1对共用电子对;
C是CO2,属于共价化合物,分子中碳原子与氧原子之间形成2对共用电子对;
(3)由分析可知,F是BaCO3,G是BaO;
(4)根据上述分析可知各反应中反应物与产物,配平书写方程式;
(5)①锌钡白固体中n(ZnS)=n(BaSO4),计算16.5g锌钡白固体中n(ZnS)=n(BaSO4)=0.05ml,1008mLH2S气体的物质的量为[1.008L/22.4L/mol]=0.045mol,所以溶液中氢硫酸的物质的量为0.05mol-0.045mol=0.005mol,再根据c=[n/V]计算硫化氢的浓度;
②加热驱尽溶液中H2S 后,为使锌离子刚好完全沉淀,形成的溶液为硫酸钠溶液,根据硫酸根守恒可知,n(Na2SO4)=n(H2SO4),由钠离子守恒可知,n(NaOH)=2n(Na2SO4)=2n(H2SO4),再根据V=[n/c]计算.重晶石是BaSO4,黑色单质A通常是碳.由BaSO4和单质碳高温生成气体B,B燃烧生成气体C,可知B是CO,C是CO2.有臭鸡蛋气味的气体E是H2S,而H2S是由D溶于H2O通入CO2所得,则D中含S2-.BaSO4和单质碳高温生成气体CO,同时生成白色固体D,则D是BaS.BaS溶于H2O,与皓矾(ZnSO4•7H2O)反应生成锌钡白(BaSO4和ZnS的混合物).BaS溶于H2O 通入CO2产生H2S,同时生成白色沉淀F,可知F是BaCO3.进一步推出G是BaO,H是BaO2,BaO2与稀H2SO4反应生成BaSO4沉淀和H2O2.
(1)流程中7个化学反应,反应①BaSO4+4C=BaS+4CO↑,碳元素的化合价由0价升高为+2价,硫元素化合价由+6价降低为-2价,属于氧化还原反应;反应②是CO的燃烧,碳元素、氧元素化合价发生变化,属于氧化还原反应;反应③BaS+ZnSO4=ZnS↓+BaSO4↓,各元素化合价未发生变化,属于复分解反应;反应④BaS+H2O+CO2=BaCO3↓+H2S,各元素化合价未发生变化,属于复分解反应;反应⑤为BaCO3
高温
.
Ba+CO2↑,各元素化合价未发生变化,属于分解反应;反应⑥为2BaO+O2
△
.
2BaO2,氧元素化合价发生变化,属于氧化还原反应;反应⑦BaO2+H2SO4=BaSO4↓+H2O2,各元素化合价未发生变化,属于复分解反应.所以7个反应中①②⑥属于氧化还原反应,故答案为:3;
(2)H2O2属于共价化合物,分子中氧原子与氢原子之间形成1对共用电子对,氧原子之间形成1对共用电子对,电子式为 ;
;
C是CO2,属于共价化合物,分子中碳原子与氧原子之间形成2对共用电子对,电子式为 ,
,
故答案为: ;
; ;
;
(3)由分析可知,F是BaCO3,G是BaO,故答案为:BaCO3;BaO;
(4)由分析可知,反应③:BaS+ZnSO4=ZnS↓+BaSO4↓.反应⑦:BaO2+H2SO4=BaSO4↓+H2O2,
故答案为:BaS+ZnSO4=ZnS↓+BaSO4↓;BaO2+H2SO4=BaSO4↓+H2O2;
(5)①由工艺流程,反应③:BaS+ZnSO4=ZnS↓+BaSO4↓可知,锌钡白固体中n(ZnS)=n(BaSO4),所以n(ZnS)×97g/mol+=n(BaSO4)×233g/mol=16.5g,解得n(ZnS)=n(BaSO4)=0.05ml,1008mLH2S气体的物质的量为[1.008L/22.4L/mol]=0.045mol,所以溶液中氢硫酸的物质的量为0.05mol-0.045mol=0.005mol,溶液中氢硫酸的物质的量浓度为[0.005mol/0.1L]=0.05mol/L,
故答案为:0.05;
②加热驱尽溶液中H2S 后,为使锌离子刚好完全沉淀,形成的溶液为硫酸钠溶液,根据硫酸根守恒可知,n(Na2SO4)=n(H2SO4),由钠离子守恒可知,n(NaOH)=2n(Na2SO4)=2n(H2SO4)=2×0.1L×1mol/L=0.2mol,故需要1mol/L的NaOH溶液体积为[0.2mol/1mol/L]=0.2L=200mL,故答案为:200.点评:
本题考点: 制备实验方案的设计;难溶电解质的溶解平衡及沉淀转化的本质;含硫物质的性质及综合应用.
考点点评: 本题以制备锌钡白和过氧化氢为载体,考查物质推断、氧化还原反应、化学用语、化学计算等,难度中等.是对所学知识的综合运用与能力的考查,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力.1年前查看全部
- (15分) 铝土矿(主要成分为Al 2 O 3 ,还含有SiO 2 、Fe 2 O 3 )是工业上制备氧化铝的主要原料。
(15分) 铝土矿(主要成分为Al 2 O 3 ,还含有SiO 2 、Fe 2 O 3 )是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:

① 沉淀 A、B的成分分别是 、 ;步骤②中的试剂a是 ;
② 试写出步骤③中发生反应的离子方式 __________ 、
__________ __________ ;
③试写出步骤③中滤液分解反应的方程式____________________________________.
④简述氯化铝溶液经过结晶得到氯化铝晶体的实验条件是 。 风中怪杰1年前1
风中怪杰1年前1 -
 萝卜英子 共回答了17个问题
萝卜英子 共回答了17个问题 |采纳率82.4%(1) ① SiO 2 Fe(OH) 3 NaOH溶液(各2分)
② CO 2 + OH - =HCO 3 - CO 2 + AlO 2 - + 2H 2 O = Al(OH) 3 ↓+ HCO 3 - (各2分)
③ 2NaHCO 3 Na 2 CO 3 + CO 2 ↑ + H 2 O (各2分)
Na 2 CO 3 + CO 2 ↑ + H 2 O (各2分)
④将溶液在较低温度下加热蒸发析出晶体,同时通入氯化氢气体防止水解。(3分)
(1)二氧化硅和盐酸不反应,所以A是二氧化硅。滤液甲中含有铝离子和铁离子,加入过量的氢氧化钠,则生成氢氧化铁沉淀,即B是氢氧化铁。滤液乙中含有偏铝酸钠,通入CO 2 生成氢氧化铝沉淀。
(2)滤液乙中还含有过量的氢氧化钠,所以方程式为CO 2 + OH - =HCO 3 - 、CO 2 + AlO 2 - + 2H 2 O = Al(OH) 3 ↓+ HCO 3 - 。
(3)碳酸氢钠不稳定,受热易分解,方程式为2NaHCO 3 Na 2 CO 3 + CO 2 ↑ + H 2 O。
Na 2 CO 3 + CO 2 ↑ + H 2 O。
(4)由于氯化铝易水解,所以在蒸发浓缩时必须防止水解,因此方法是将溶液在较低温度下加热蒸发析出晶体,同时通入氯化氢气体防止水解。1年前查看全部
- (2012•郑州一模)Na2FeO4是一种高效多功能水处理剂,应用前景十分看好.一种制备Na2FeO4的方法可用化学方程
(2012•郑州一模)na2feo4是一种高效多功能水处理剂,应用前景十分看好.一种制备na2feo4的方法可用化学方程式表示如下:2feso4+6na2o2═2na2feo4+2na2o+2( )+o2↑.下列对此反应的说法中,不正确的是( )
a.方框中的物质na2so4
b.na2o2既是氧化剂,又是还原剂
c.na2feo4既是氧化产物,又是还原产物
d.2 mol feso4发生反应时,反应***有8 mol电子转移 cony_xue1年前1
cony_xue1年前1 -
 胖毛 共回答了21个问题
胖毛 共回答了21个问题 |采纳率90.5%解题思路:由质量守恒可知反应的方程式为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,反应中O元素化合价既升高又降低,则Na2O2既是氧化剂,又是还原剂,Fe元素化合价升高,被氧化,结合元素化合价的变化解答该题.A.由质量守恒可知反应的方程式为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,则方框中的物质Na2SO4,故A正确;
B.反应中O元素化合价既升高又降低,则Na2O2既是氧化剂,又是还原剂,故B正确;
C.反应中Na2O2为氧化剂,FeSO4在反应中作还原剂,则Na2FeO4既是氧化产物又是还原产物,故C正确;
D.2molFeSO4发生反应时,化合价升高的有Fe和O,其中Fe化合价升高2×(6-2)=8,需要4molNa2O2为氧化剂,另2molNa2O2自身发生氧化还原反应,生成1molO2,转移电子2mol电子,共转移10mol电子,故D错误.
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了氧化还原反应,明确元素化合价变化是解本题关键,易错选项是D,注意该反应中不仅硫酸亚铁失电子,部分过氧化钠还失电子,为易错点.1年前查看全部
- 如图所示,利用菠菜制备等量的叶肉细胞悬浮液(甲)和叶绿体悬浮液(乙、丙)置于最适宜光照条件下,CO2缓冲溶液在实验过程中
如图所示,利用菠菜制备等量的叶肉细胞悬浮液(甲)和叶绿体悬浮液(乙、丙)置于最适宜光照条件下,CO2缓冲溶液在实验过程中能维持试管内CO2相对稳定.三组悬浮液中的叶绿体密度相同,液面均有一薄层液体石蜡,叶肉细胞和叶绿体在实验过程中维持正常活性.下面分析正确的是( )
 A. 适当增强光照,甲试管产生气泡速率基本不变
A. 适当增强光照,甲试管产生气泡速率基本不变
B. 乙、丙试管产生气泡速率基本相同
C. 乙试管在叶绿体外合成蔗糖
D. 乙试管中叶绿体不能进行蛋白质更新 faiger1年前1
faiger1年前1 -
 老曾先生 共回答了13个问题
老曾先生 共回答了13个问题 |采纳率84.6%解题思路:分析题图:甲试管中是叶肉细胞悬浮液,乙、丙试管中叶绿体悬浮液,三组悬浮液的液面均有一薄层液体石蜡,能隔绝空气.甲和乙试管中含有CO2缓冲溶液,能在实验过程中维持试管内CO2相对稳定,而丙试管中没有CO2缓冲溶液,因此甲、乙试管中可进行光合作用,而丙试管中叶肉细胞几乎不能进行光合作用.A、由于实验给的是最适宜的光照强度,所以适当增强光照,甲试管产生气泡速率基本不变,A正确;
B、乙试管中是二氧化碳缓冲液,丙中没有二氧化碳缓冲液,其中的甘露醇只起维持渗透压的作用,所以乙可以进行光合作用,产生气泡,而丙试管几乎不产生气泡,因此两试管产生气泡的速率不相同,B错误;
C、蔗糖不是在叶绿体中合成的,而乙试管中只有叶绿体,没有其他的细胞器,所以乙试管在叶绿体外是不能合成蔗糖的,C错误;
D、叶绿体中含有一定量的DNA,也含有核糖体,所以乙试管中叶绿体自身是可以进行蛋白质更新的,D错误.
故选:A.点评:
本题考点: 光反应、暗反应过程的能量变化和物质变化.
考点点评: 本题结合实验图解,考查光合作用的相关知识,要求考生识记光合作用的过程及影响光合速率的环境因素,能根据题干信息“最适宜光照条件下”及图中信息准确判断各选项,属于考纲识记和理解层次的考查.1年前查看全部
- 制备七水硫酸锌时,锌为什么要过量
 5yan_6se1年前1
5yan_6se1年前1 -
 子寒1247 共回答了18个问题
子寒1247 共回答了18个问题 |采纳率100%不硫酸过量就不纯了1年前查看全部
- 制备单克隆抗体原理?要准确
 萝卜山_hh1年前5
萝卜山_hh1年前5 -
 beijingcgj 共回答了20个问题
beijingcgj 共回答了20个问题 |采纳率95%制备单克隆抗体的原理是杂交瘤细胞,既具有骨髓瘤细胞能无限增殖的特性,又能分泌一种特异性抗体1年前查看全部
- 用乙醇制备3-甲基-3戊醇
 郎骑竹马弄青梅1年前2
郎骑竹马弄青梅1年前2 -
 yuhoucaihong9998 共回答了22个问题
yuhoucaihong9998 共回答了22个问题 |采纳率81.8%先消去反应得到乙烯,总之弄到乙炔形成乙炔钠后和(把乙醇弄成卤乙烷)卤乙烷偶联生成1-丁炔先加成氢气形成1-丁烯,后加成水生成CH3C-OHCH2CH3(根据马氏通则这个是大量产物)氧化成醛后,用格式试剂C2H5MgX(即卤乙烷制格式试剂)生成TM(target molecule目标分子)1年前查看全部
- 谁能告诉我:乙酸制备乙二醇的化学方程式
 gui_78128671年前1
gui_78128671年前1 -
 双休日上网 共回答了22个问题
双休日上网 共回答了22个问题 |采纳率100%CH3COOH+H2=CH2OHCH2OH1年前查看全部
- (2013•南安市一模)氮气是制备含氮化合物的一种重要物质.工业上可在碱性溶液中,通过电解的方法实现由N2制取NH3,反
(2013•南安市一模)氮气是制备含氮化合物的一种重要物质.工业上可在碱性溶液中,通过电解的方法实现由N2制取NH3,反应的化学方程式为:2N2+6H2O
4NH3+3O2.计算生产34t NH3所需N2的质量.通电 . 心自在1年前1
心自在1年前1 -
 zhangxgym 共回答了17个问题
zhangxgym 共回答了17个问题 |采纳率94.1%解题思路:根据生成氨气的质量,由反应的化学方程式计算出产生氮气的质量即可.设生产34tNH3所需N2的质量的为x,
2N2+6H2O
通电
.
4NH3+3O2
56 68
x 34t
[56/68=
x
34t] x=28t.
答:生产34tNH3所需N2的质量为28t.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,解题时要注意解题的规范性.1年前查看全部
- I.图1是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去).请根据下列要求回答问题.
I.图1是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去).请根据下列要求回答问题.

(1)如何检验装置A的气密性______.若烧瓶中盛装锌片,分液漏斗中盛装稀硫酸,则:
①实验目的是验证H2的还原性并检验其氧化产物,请选择上述部分仪器(可以重复使用),组装顺序为A→C→______→______→D,D装置的作用是______.
②为使CuO可被H2充分还原,能采取多种措施,试写出其中的一种______.
(2)若烧瓶中盛装Na2O2固体,分液漏斗中盛装浓氨水,慢慢打开分液漏斗的活塞,则:
①烧瓶内产生的气体主要有(写化学式)______.
②用产生的气体做氨的催化氧化实验,化学反应方程式为4NH3+502
4NO+6H2O催化剂 .△ 4NH3+502.
4NO+6H2O催化剂 .△
II.①以环已醇制备环已烯,环已烯粗品中含有环已醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环已烯在______层(填上或下),分液后用______(填入编号)洗涤.
a.KMnO4溶液
b.稀H2SO4
c.Na2CO3溶液
②再将环乙烯按图2装置,冷却水从______口进入.蒸馏时要加入生石灰,目的是______. 飞起来的鱼1年前1
飞起来的鱼1年前1 -
 yang_695718 共回答了14个问题
yang_695718 共回答了14个问题 |采纳率92.9%解题思路:I.(1)可利用压强差原理检验气密性,常用方法是注水法或加热法;
①装置A中产生的氢气被浓硫酸干燥后通过灼热的氧化铜,由于氢气具有还原性能将氧化铜还原为铜,通过无水硫酸铜验证水的生成,最后连接装置D是为了防止空气中的水蒸气进入盛有无水硫酸铜的装置B中,可见此实验的目的是验证氢气的还原性和检验氧化产物;
②为使CuO可被H2充分还原,通入气体的流速不能过快,且固体能与气体充分接触;
(2)①过氧化钠与水反应生成氢氧化钠和氧气,反应放热,可促进氨气的挥发;
②氨气和氧气在催化剂的作用下反应生成水和一氧化氮;
II.①环己烯的密度比水小,应在水的上层,除去酸,应用能和酸反应的物质洗涤;
②蒸馏时,冷凝水要下进上出,且用生石灰吸水,以增大蒸馏效果.I.(1)检验气密性时,可将A右端用止水夹夹紧,向分液漏斗中注入少量水,打开分液漏斗活塞,有少许水流下后,液面保持不动,则装置气密性良好,
故答案为:将A右端用止水夹夹紧,向分液漏斗中注入少量水,打开分液漏斗活塞,有少许水流下后,液面保持不动,则装置气密性良好;
①当仪器连接顺序为A→C→B→B→D时,两次使用B装置,其中所盛的药品依次是CuO、无水CuSO4粉末,装置A中产生的氢气被浓硫酸干燥后通过灼热的氧化铜,由于氢气具有还原性能将氧化铜还原为铜,通过无水硫酸铜验证水的生成,最后连接装置D是为了防止空气中的水蒸气进入盛有无水硫酸铜的装置B中,
故答案为:B;B;防止空气中的水蒸气进入,干扰验证;
②为使CuO可被H2充分还原,通入气体的流速不能过快,且固体能与气体充分接触,故答案为:缓慢滴加稀硫酸或用石棉绒包裹CuO粉末;
(2)①氧化钠与水反应生成氢氧化钠和氧气,反应放热,可促进氨气的挥发,则烧瓶内产生的气体主要有O2、NH3,故答案为:O2、NH3;
②氨气和氧气在催化剂的作用下反应生成水和一氧化氮,反应的方程式为4NH3+502
催化剂
.
△4NO+6H2O,故答案为:4NH3+502
催化剂
.
△4NO+6H2O;
II.①环己烯的密度比水小,应在水的上层,除去酸,应用能和酸反应的物质洗涤,只有碳酸钠符合,故答案为:上;c;
②蒸馏时,冷凝水要下进上出,且用生石灰吸水,可增大蒸馏效果,
故答案为:g或下;吸收水分.点评:
本题考点: 实验装置综合;物质的分离、提纯的基本方法选择与应用;气体发生装置;气体的收集.
考点点评: 本题以氨气的催化氧化为载体考查物质制备实验,掌握反应原理,理清装置连接,把握实验气体制备、含有杂质的验证和除杂方法和步骤是解题关键,题目难度中等.1年前查看全部
- 下列关于各物质水解应用的说法中不正确的是( ) A.油脂的水解又称为皂化反应,故可用油脂的酸性水解来制备肥皂和甘油 B
下列关于各物质水解应用的说法中不正确的是()
A.油脂的水解又称为皂化反应,故可用油脂的酸性水解来制备肥皂和甘油 B.可以以淀粉、纤维素为原料通过水解制得葡萄糖 C.人体对食物中蛋白质的消化其实就是使蛋白质发生了水解 D.用粮食酿酒与淀粉的水解有着密切的关系  ttftt1年前1
ttftt1年前1 -
 富翁流浪汉 共回答了20个问题
富翁流浪汉 共回答了20个问题 |采纳率95%A
油脂在碱性条件下的水解反应称为皂化反应,A错误;淀粉、纤维素的水解产物都是葡萄糖,B项正确;食物中的蛋白质进入人体后,在酶的作用下发生水解生成氨基酸,才能被人体吸收,C正确;酿酒首先利用的就是多糖水解生成葡萄糖,再由葡萄糖转化成酒精,D项正确。1年前查看全部
- 英语翻译本文采用放电等离子烧结技术(SPS)制备AlN/BN复相陶瓷,同时根据BN含量不同调整烧结助剂Y2O3的添加剂.
英语翻译
本文采用放电等离子烧结技术(SPS)制备AlN/BN复相陶瓷,同时根据BN含量不同调整烧结助剂Y2O3的添加剂.在极大提高烧结效率的同时,提高材料抗弯强度,有效减缓因引入BN对复相陶瓷导热性能的劣化,实现了材料综合性能的统一.研究了晶粒起始尺寸和烧结助剂添加量对AlN陶瓷相组成、显微结构以及性能的影响.重点研究了影响AlN/BN复相陶瓷显微结构和性能的因素.通过烧结工艺和烧结助剂添加量的改变调整AlN/BN的显微结构,提高复相陶瓷的导热性能,使其在提高可加工性的同时,保持较高力学性能和导热性能.
SPS制备单相AlN陶瓷,烧结温度在1800℃,保温时间10min,样品相对密度可达98.5%以上,硬度约11.5Gpa,抗弯强度在300Mpa以上.AlN起始粒径尺寸和烧结助剂添加量,对致密度和力学性能几乎没有影响,但对对材料的显微结构和导热性能有显著影响.起始粒径为1.3μm的AlN粉末添加3wet%Y2O3的试样,热导率达到148W/m∙k.AlN粉末的起始粒径和Y2O3的添加量影响AlN的晶体发育、晶界相的分布以及AlN晶粒之间的接触,从而影响热导率.
AlN/BN复相陶瓷在烧结温度1600-1800℃,保温时间0-10min的工艺条件下可以快速致密,BN含量在5-30vol%范围内,致密度均达到98%以上.材料的硬度则随着BN含量的增加而线性降低,从而改善可加工性,BN含量达到10vol%时,复相陶瓷的硬度已低于硬质合金刀具的硬度,从而可以机械加工.
BN含量在10vol%时,晶粒细化增韧的作用远远大于弱相劣化作用,复相陶瓷的强度较AlN单相陶瓷有较大提高,继续增加含量至25vol%,强度呈下降趋势,但仍比单相陶瓷强度高.
BN含量达到5vol%以上时,复相陶瓷的热导率较单相AlN陶瓷明显降低,在15vol%-25vol%的范围内,热导率表现出相对稳定的变化趋势,下降幅度变缓.第二相BN的起始粒径尺寸对复相陶瓷的显微组织结构和导热性能有显著影响.BN起始颗粒尺寸过小,显微结构中的团聚现象明显,不利于热导率的优化.
进一步研究AlN/BN复相陶瓷热导率的影响因素并对其进行优化.根据BN的具体含量调整烧结助剂Y2O3的添加量,探讨烧结温度和保温时间,可以调控复相陶瓷的显微结构,有效提高复相陶瓷热导率.BN含量为15vol%,Y2O3添加量为8wet%时,烧结温度1800℃,保温时间10min,获得热导率141W/m∙k,可加工性优异的复相陶瓷.
本文采用SPS制备的AlN/BN复相陶瓷所获得的高热导率已远远超过国内外采用热压烧结制备的AlN/BN复相陶瓷的最高水平,而且拥有同样优异的可加工性能和力学强度.而借助SPS可以在实现AlN/BN复相陶瓷快速致密化基础上进行相组成及显微组织的调控.SPS工艺的烧结温度要比热压烧结工艺的烧结温度(1850-1900℃)低100~200℃,SPS的保温时间也较热压烧结的保温时间1-3h大大缩短,极大地提高了烧结效率,这对于AlN/BN可加工复相陶瓷的高性能、高效率制备和应用有重要的意义. yy之王1年前1
yy之王1年前1 -
 慧利 共回答了21个问题
慧利 共回答了21个问题 |采纳率90.5%This paper spark plasma sintering (SPS) of AlN / BN composite ceramics,as the BN in different adjustment sintering additives Y2O3 additives.Significantly improve the efficiency of the sintering and improve flexural strength materials,due to the introduction of effective mitigation BN ceramic thermal conductivity of the composite performance degradation and realizing the reunification of the material properties.On the initial grain size and amount of sintering aids AlN ceramics phase composition,microstructure and properties of.Focused on the impact of AlN / BN composite ceramic microstructure and properties of factors.Through sintering process and the amount of sintering aids change adjustment AlN / BN microstructure of composite ceramics improve the thermal performance to improve machinability in the same time,maintaining a relatively high thermal conductivity and mechanical properties.
Preparation of single-phase SPS AlN ceramics,the sintering temperature in 1800 ℃,soaking time 10 min,the relative density of samples up to more than 98.5 percent,about 11.5 Gpa hardness,bending strength of more than 300 Mpa.AlN initial particle size and amount of sintering aids,density and mechanical properties of almost no impact,but on the material microstructure and thermal conductivity have a significant impact on performance.Initial diameter of 1.3 μ m of AlN powder add 3% Y2O3 wet samples,thermal conductivity to 148 W / m ∙ k.AlN powder particle size and the initial Y2O3 impact of the addition of AlN crystal growth,the distribution of grain boundary phase,as well as the contact between the AlN grains,thus affecting the thermal conductivity.
AlN / BN composite ceramic sintering temperature in the 1600-1800 ℃,and the holding time of 0-10 min under the conditions can quickly compact,vol BN content in the 5-30% range,the density reached more than 98%.With the hardness of the material content of the BN to increase linearly decreased,thereby improving machinability,BN content of 10 vol%,the composite ceramics has been lower than the hardness of the hardness of cemented carbide cutting tools,which can be mechanical processing.
BN content in 10 vol%,the role of grain refinement toughening of deterioration is far greater than the weak,the strength of composite ceramics than single-phase AlN ceramics has improved greatly,and continue to increase the content to 25 vol%,a declining trend strength,but still higher than the single-phase high-strength ceramics.
BN content reaches more than 5 vol%,the composite ceramic thermal conductivity of a single-phase AlN ceramics significantly decreased in 15 vol% 25vol%-within the scope of the thermal conductivity show the trend of changes in relative stability,rate of decline slows.BN second phase of the initial particle size of the ceramic composite microstructure and thermal conductivity properties of the structure has had a notable impact.BN initial particle size too small,microscopic structure of the reunion phenomenon obviously not conducive to optimizing the thermal conductivity.
Further study AlN / BN composite ceramic thermal conductivity factors and the impact of its optimization.BN under the specific content of the adjustment of sintering aids Y2O3 content on the sintering temperature and soaking time can be controlled composite ceramic microstructure,effectively enhance the composite ceramic thermal conductivity.BN content of 15 vol% Y2O3 wet content is 8%,the sintering temperature 1800 ℃,soaking time 10 min,access to thermal conductivity of 141 W / m ∙ k,excellent machinability of composite ceramics.
Preparation of this paper SPS AlN / BN composite ceramics obtained by the high thermal conductivity have been far more than at home and abroad by hot-pressing of the AlN / BN composite ceramics of the highest level,but also has the same excellent processability and mechanical properties of strength .The SPS can help in achieving the AlN / BN composite ceramics rapid densification on the basis of the composition and microstructure of the regulation.SPS process of sintering temperature than hot-pressing process of sintering temperature (1850-1900 ℃) low 100 200 ℃,the SPS holding time than the hot-pressing the holding time 1-3 h significantly reduced,thus greatly enhancing the efficiency of sintered In this regard AlN / BN Machinable Ceramic Composites,high-performance,high efficiency,preparation and application of great importance
软件翻译!仅供参考!1年前查看全部
- 氮气是制备含氮化合物的一种重要物质。工业上可在碱性溶液中,通过电解的方法实现由N 2 制取NH 3 ,反应的化学方程式为
氮气是制备含氮化合物的一种重要物质。工业上可在碱性溶液中,通过电解的方法实现由N 2 制取NH 3 ,反应的化学方程式为:2N 2 +6H 2 O
 4NH 3 +3O 2 。计算生产34t NH 3 所需N 2 的质量。
4NH 3 +3O 2 。计算生产34t NH 3 所需N 2 的质量。 yxl9061年前1
yxl9061年前1 -
 红鱼游来了 共回答了17个问题
红鱼游来了 共回答了17个问题 |采纳率94.1%28t
1年前查看全部
- 下列方法不可用于实验室制备卤化氢气体的是
下列方法不可用于实验室制备卤化氢气体的是
A.NaCl饱和溶液与稀硫酸共热制备HCl
B.NaF固体与浓硫酸共热制备HF
C.KI固体与浓硫酸共热制备HI
D.NaBr固体与稀硫酸共热制备HBr
详细解析!谢~~~~!
说一下为什么,怎么办,会有哪些后果,好的给分! yx_shan1年前1
yx_shan1年前1 -
 漫步憧憬 共回答了13个问题
漫步憧憬 共回答了13个问题 |采纳率92.3%B 是正确答案2NAF+H2SO4=2HF+_NA2SO41年前查看全部
- 化学制备胶体如何制备Fe(OH)3胶体?胶体区别于其他分散系的本质特征是什么?如何鉴别淀粉胶体和NaCl溶液?
 随便了19731年前1
随便了19731年前1 -
 yy87 共回答了18个问题
yy87 共回答了18个问题 |采纳率88.9%将FeCl3滴入沸水中,继续煮沸至溶液呈红褐色澄清液体,即得到Fe(OH)3胶体.
胶体与其他分散系本质的区别是分散质颗粒半径大小胶体在1~100nm
鉴定胶体可以用丁达尔效应(激光照射胶体时,液体中能看见明亮的光路)辨别.1年前查看全部
- ===初三化学===甲、乙两同学在室温时各取50gA物质的溶液,分别做制备晶体实验.
===初三化学===甲、乙两同学在室温时各取50gA物质的溶液,分别做制备晶体实验.
甲、乙两同学在室温时各取50gA物质的溶液,分别做制备晶体实验.甲将溶液蒸发掉10g水后冷却到室温,得到晶体1.2g(晶体不含结晶水),乙将溶液蒸发掉15g水后冷却到室温,得到晶体2.4g.若两人实验结果都正确,问:
(1)室温时A物质的溶解度___________(求计算过程)
(2)A物质原溶液的质量分数___________(求计算过程)
可不可以把过程每一步写的详细一点,鄙人比较笨- . 摆渡fei1年前1
摆渡fei1年前1 -
 cd_xa 共回答了13个问题
cd_xa 共回答了13个问题 |采纳率84.6%1)室温时A物质的溶解度_(2.4g-1.2g)/(15g-10g)*100g=24g_.
(2)A物质原溶液的质量分数.
蒸发掉10g水后冷却至室温,得到晶体1.2g.溶液蒸发掉15g水后冷却至室温,得到晶体2.4g.
则 50gA物质的溶液蒸发5g水刚好饱和,溶质质量为 24g/(24g+100g)*(50g-5g)=8.7g
A物质原溶液的质量分数 8.7g/50g*100%=17.4%
肯定是对的,我有答案,对过了1年前查看全部
- 氧气、氢气、二氧化碳、一氧化碳、分别分别怎么制备,怎么收集(向上排空气还是向下)
氧气、氢气、二氧化碳、一氧化碳、分别分别怎么制备,怎么收集(向上排空气还是向下)
氧气、氢气、二氧化碳、一氧化碳、分别分别怎么制备(化学式和装置),怎么收集(向上排空气还是向下),三大还原剂是什么,有什么用
OK就问这些,明天考科学, 铁公子1年前4
铁公子1年前4 -
 angel_555 共回答了17个问题
angel_555 共回答了17个问题 |采纳率94.1%氧气、二氧化碳可以用向上排空气法收集;氢气可以用向下排空气法收集;一氧化碳,氧气,氢气可以用排水法收集.三大还原剂是:、氢气、一氧化碳,碳.
氧气 中学实验室 高锰酸钾加热/氯酸钾二氧化锰加热/双氧水二氧化锰/
氢气 中学实验室 锌加希盐酸
二氧化碳 中学实验室 碳酸钙(石灰石)加稀盐酸
一氧化碳的实验室制取
1.在250mL蒸馏烧瓶里加入密度为1.84g/cm3的浓硫酸50mL,在分液漏斗里盛放密度为1.2g/cm3的甲酸10mL,装置如图所示.检查装置的气密性.
2.给浓硫酸加热到80--90℃,移去酒精灯.
3.向烧瓶内逐滴加入甲酸,即有一氧化碳产生O2
4.当空气排尽后,用排水法收集一氧化碳,并用橡皮塞塞紧集气瓶口.(第一瓶一氧化碳气体里混有空气,点燃时会发生爆鸣,应注意安全.)1年前查看全部
- 英语翻译以玉米须为原料,采用机械粉碎法将玉米须制备为5mm左右长短,采用热水浸提和乙醇沉淀的方法制备玉米须多糖.在此过程
英语翻译
以玉米须为原料,采用机械粉碎法将玉米须制备为5mm左右长短,采用热水浸提和乙醇沉淀的方法制备玉米须多糖.在此过程中,将玉米须多糖的提取率作为评价指标,采用单因素及正交试验方法优化提取条件,考察提取过程中浸提的温度、浸提的时间、料液比以及乙醇体积比对多糖提取率的影响.结果表明,当水浴温度为90℃、水浴时间为90min、料液比为1:25、乙醇体积比为3.5:1时,玉米须多糖的提取率最优为0.608%.随之研究了三氯乙酸溶液浓度对玉米须多糖除蛋白效果的影响,用单因素实验方法确定最佳工艺条件,将OD280值作为玉米须多糖除蛋白效果的评价指标,结果为,浓度为3%的三氯乙酸溶液对玉米须多糖除蛋白的效果最好,此时OD280为0.107.然后考察了玉米须多糖对大肠杆菌、芽孢杆菌、霉菌、酵母菌和白色葡萄球菌的抑菌作用,结果表明,玉米须多糖对大肠杆菌、白色葡萄球菌、芽孢杆菌的有较显著抑菌效果,对霉菌的抑菌效果一般,对酵母菌的抑菌效果不显著.
在线翻译的就不要回答了, iwalyng1年前1
iwalyng1年前1 -
 ll版活动ll 共回答了16个问题
ll版活动ll 共回答了16个问题 |采纳率81.3%译文:Take the corn must as raw material, uses the machinery smashing law to have to prepare the corn is about 5mm the length, uses the hot water immersion to raise the method preparation corn which precipitates with the ethyl alcohol to have the polysaccharide.In this process, the corn must the polysaccharide extraction rate take the time, the material fluid which the appraisal target, uses the single factor and the orthogonal testing method optimization extraction condition, in the inspection extraction process soaks which proposes the temperature, soaks raises compares as well as the ethyl alcohol volume compares to the polysaccharide extraction rate influence.The result indicated, when the water bath temperature for 90℃, the water bath time is 90min, the material fluid compared to is 1:25, the ethyl alcohol volume compared to is 3.5:1, the corn must the polysaccharide extraction rate most be superior is 0.608%.Studied the trichloroacetic acid solution concentration along with it to have the polysaccharide to eliminate the protein effect to the corn the influence, with the single factor experimental technique determination best technological conditions, had the polysaccharide to eliminate the OD280 value as the corn the protein effect the appraisal target, the result is, the density was 3% trichloroacetic acid solution must the polysaccharide eliminate the protein to the corn the effect to be best, this time OD280 was 0.107.Then inspected the corn to have the polysaccharide to the backwoods coli, the bud spore bacillus, the mold, the saccharomycetes and staphylococcus albus's bacteriostasis function, finally indicated, the corn must the polysaccharide to the backwoods coli, the staphylococcus albus, the bud spore bacillus have the remarkable bacteriostasis effect, was ordinary to mold's bacteriostasis effect, was not remarkable to saccharomycetes' bacteriostasis effect.
(*^__^*) 嘻嘻……1年前查看全部
- 为什么羟烷基淀粉胶黏剂的配方组成和制备方法是什么?
 yifanshifen1年前1
yifanshifen1年前1 -
 柚子蜜 共回答了16个问题
柚子蜜 共回答了16个问题 |采纳率75%羟垸基淀粉是一种醚化淀粉,主要是羟乙基淀粉和羟丙基淀粉,它们是由淀粉在减催化条件下分别与环氧乙烷或环氧丙烷反应而得.羟烷基淀粉属非离子淀粉醚,取代醚键的稳定性高,羟烷基淀粉具有亲水性,这减弱了淀粉颗粒结构内部氢键强度,随着取代度的增高,糊化温度下降,并最终能在冷水中膨胀.羟烷基淀粉易糊化,糊液透明度高,流动性好,凝沉性弱,稳定性高,可在低温存放或冷冻后再融化,重复多次,仍能保持原有胶体结构.另外,羟烷基淀粉的保水性和成膜性好,在纸袋、纸盒、标签、信封等胶黏方面十分有用,有的制品还可作为瓦楞纸及壁纸的胶黏剂1年前查看全部
- 三草酸合铁酸钾制备实验在FeSO4.7H2O溶液中加入H2SO4酸化的目的是什么?酸性太强会产生什么影响?
 godnonland1年前1
godnonland1年前1 -
 雪舞清歌 共回答了13个问题
雪舞清歌 共回答了13个问题 |采纳率76.9%防止水解.最后应该是加热浓缩结晶的过程,酸性太强估计会有浓硫酸氧化草酸跟1年前查看全部
- 硝酸钾的制备实验重结晶时,粗产品与水质量比为什么是2:1
 沙漠枯蛇1年前1
沙漠枯蛇1年前1 -
 fengshanfeng 共回答了17个问题
fengshanfeng 共回答了17个问题 |采纳率94.1%100度时硝酸钾的溶解度为246g,2:1也就是加水123g左右,这样做的目的是保证在沸腾的情况下用最少的溶剂溶解硝酸钾,避免冷却结晶时的溶解损失.1年前查看全部
- 漂白粉的制备原理是什么呢?(用化学方程式表示)
 臭妞1年前1
臭妞1年前1 -
 yiyilovely 共回答了17个问题
yiyilovely 共回答了17个问题 |采纳率94.1%2Cl2 + 2Ca(OH)2==CaCl2 + Ca(ClO)2 +2H2O1年前查看全部
- 在环己烯制备实验中,为什么要控制分妞柱顶温度不超过73
 玉麟麒1年前1
玉麟麒1年前1 -
 我是阿邋 共回答了14个问题
我是阿邋 共回答了14个问题 |采纳率92.9%环己烯的制备
一、实验目的
1、 学习以浓磷酸催化环己醇脱水制取环己烯的原理和方法;
2、 初步掌握分馏和热水浴蒸馏的基本操作技能.
3、 有机物萃取洗涤方法及干燥方法.
二、反应原理
主反应:
副反应:
三、主要化学试剂、产物、副产物的物理和化学性质
名 称
分子量
状 态
熔点
(℃)
沸点
(℃)
密度
d420
折射率
nD20
溶解度
水
醇
醚
环己醇
100.16
无色液体
25.15
161.1
0.9624
1.4641
溶
溶
溶
环己烯
82.15
无色液体,易挥发
-103.5
82.98
0.8102
1.4465
不
∞
∞
四、化学试剂的用量及产物的产量:
名 称
实际用量
理论用量
过量(%)
理论用量
环己醇
10ml(9.6g,0.096mol)
10ml(9.6g,0.096mol)
磷 酸
5.0ml(7.16g,0.073mol)
6.57ml(8.00g,0.096mol)
环己烯
7.89g (0.096mol)
五、仪器装置图
图1 分馏装置 图2 常压蒸馏装置
六、流程图
七、实验记录
在50ml圆底烧瓶中,加入10ml(0.096mol)环己醇及5ml85%磷酸,充分振荡使液体混合均匀,投入少许沸石,安装分馏装置,用25ml 量筒作接收器.
缓慢加热至沸腾,控制分馏柱顶温度不超过73℃.直到无馏出液滴为止.这时烧瓶内出现白雾,停止加热,记下粗产品中油层和水层的体积.
将粗产品放到小锥形瓶中,用滴管吸去水层,加入等体积的饱和食盐水,充分振荡后静置待液体分层.用吸管吸去水层.油层转移到干燥的小锥形瓶中,加入少量无水氯化钙干燥之.将干燥后的粗制环己烯用水浴蒸馏,收集82~85℃的馏分.产量:约4-5g.
纯环己烯为易燃有刺激性气味的无色液体.沸点bp= 82.98℃,折光率 =1.4465.
八、实验记录
时间
操 作 步 骤
现 象
解 释 或 备 注
10:50
按图安装实验装置.用25ml 量筒作接收器.
11:16
加入10.0ml环己醇
5.0ml85%磷酸
加沸石2粒.
为无色液体,略有粘稠.
无色,此时反应液为无色.
11:30
开始缓慢加热.
11:42
沸腾,保持沸腾而不蒸出馏出液20min.
瓶内反应液沸腾,出现回流.
12:05
升高温度,控制加热蒸馏速度使分馏柱顶温度不超过90℃.蒸至无馏出液滴为止.
温度控制在69.0-83.0℃之间,以防环己醇被蒸出
环己烯-水共沸沸点70.8℃;环己醇-环己烯共沸沸点64.9℃;环己醇-水共沸沸点97.8℃.
12:30
烧瓶内出现白雾,停止加热
粗产品中油层:3.2ml
水层:2.5ml
说明环己醇的脱水反应已经结束
12:40
将量桶中的馏出液倒入分液漏斗中进行分液,静置5min.
分层,
水层在下层,无色
有机层在上层,无色
13:00
分出下层水溶液.
用10ml饱和食盐水洗涤有机层.
除去粗产品中的水分,减少有机物的在水中的溶解度,有利于分层.
13:15
分出水层,将有机层倒入一个干燥并且干净的锥形瓶里,加入1.0g无水氯化钙,盖上盖子,振动后,放置30min
有机物中有明显悬浮干燥剂.
氯化钙还可除去原料环己醇.
有悬浮干燥剂存在说明干燥剂用量足够.每10ml液体产品约加入0.5-1.0g干燥剂.
13:45
安装蒸馏装置.
将滤去干燥剂的粗产品加入蒸馏烧瓶中,加2粒沸石.
热水浴加热,蒸馏收集82-85℃之间的馏分.可以将三角烧瓶放在冷水浴中冷却,以防挥发.
馏分为82.0-83.6℃之间的馏分
产品为无色透明液体,略有香味.
整个装置所用仪器均需提前干燥无水.
锥形瓶空重:
65.5g
瓶+产品共重:
70.8g
产 品 重:
5.30g
14:15
停止蒸馏,拆卸装置.
九、产品产率计算
产率=5.30/7.89 ×100% =67.2%1年前查看全部
- 乙酸乙酯的制备后期加氯化钙有什么作用?
 cafebaobao11年前2
cafebaobao11年前2 -
 tingathena 共回答了20个问题
tingathena 共回答了20个问题 |采纳率80%使用饱和氯化钙洗涤的目的是除去过量的乙醇,并且饱和CaCl2可以除去乙醚(形成络合物).之所以使用饱和溶液-目的是为了降低乙酸乙酯的溶解度,减少洗涤过程中乙酸乙酯的损失.
需要注意的是,在使用饱和的碳酸钠溶液和饱和氯化钙溶液洗涤的过程之间,为防止碳酸钙絮状沉淀的产生,应加入饱和氯化钠溶液进行洗涤.1年前查看全部
- 制备烯胺时,为什么要加入甲苯进行共沸脱水?
制备烯胺时,为什么要加入甲苯进行共沸脱水?
加入苯不可以么? 233fs1211年前1
233fs1211年前1 -
 默默陌生 共回答了24个问题
默默陌生 共回答了24个问题 |采纳率91.7%甲苯可以和水形成共沸物,以利于水分蒸出.在工业制备无水乙醇时也是用这个方法.
甲苯和水的混合物有一个恒沸点,在此温度下甲苯混合液上方的水蒸气分压和甲苯蒸汽的分压相同,这两种物质可以被同时蒸出.当然这个温度是低于100度的.具体数据要查表.
之所以要用这个方法,以制备无水乙醇为例:
通常蒸馏的方法只能得到96%的乙醇,这是因为96%乙醇和4%水形成了恒沸物,蒸馏出的馏分里也是这个比例.加入苯,苯和水、乙醇形成一个沸点更低的共沸物(大概60多度左右,记不清了)这样水就会随苯和一部分乙醇一同被馏出,剩下的就是无水酒精了.
烯胺也是同样的原因.1年前查看全部
大家在问
- 1哺育的哺怎么读?
- 2“口”加“甲”怎么读?
- 3人教版一年级语文上册教案,哪里有能下载吗?
- 4常见的芳香烃类化合物
- 5一物体自塔顶自由落下,在着地前最后1s内的下落的高度是塔高的9/25,求塔高
- 6已知AB‖CD,EF交AB于E,交CD于F,∠AEF=68°,FG平分∠EFD,KF⊥FG,求∠KFC的度数.
- 7已知a²-5ab+6b²=0,则(b分之a)+(a分之b)等于多少
- 82011初三石景山一模数学12题详细过程
- 9为什么蒸馏结束时,先熄灭酒精灯,再停止通冷凝水?
- 102011海淀初三一模数学第8题详细过程
- 11求新人教版一年级上册语文教案
- 12effort什么时候加s
- 13五年级珍惜时间的作文300字
- 14零除以任何数都等于零,这句是错是对
- 15求、关于珍惜时间的小短文,300字左右
