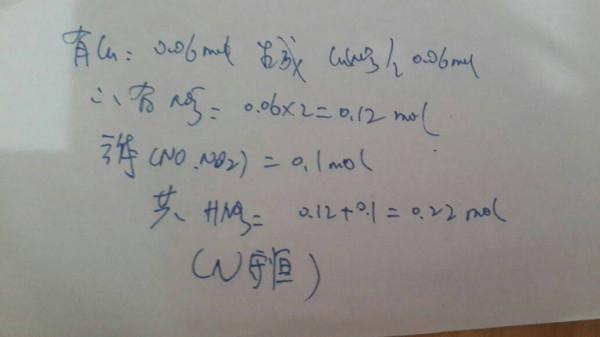将3.84克Fe3O4完全溶解在100毫升1mol/LH2SO4中,然后加入K2Cr2O7溶液25ml,恰好使溶液中Fe
 开心辣子2022-10-04 11:39:541条回答
开心辣子2022-10-04 11:39:541条回答
将3.84克Fe3O4完全溶解在100毫升1mol/LH2SO4中,然后加入K2Cr2O7溶液25ml,恰好使溶液中Fe2+全部转化为Fe3+,(Cr2O7)2-离子全部还原为Cr3+,则K2Cr2O7溶液的物质的量浓度为多少
1mol/L,
1mol/L,

已提交,审核后显示!提交回复
共1条回复
 shzwm723 共回答了18个问题
shzwm723 共回答了18个问题 |采纳率94.4%- 3.48gFe3O4为0.015mol,100ml 1mol/L的硫酸中硫酸的含量为0.1mol
3.48gFe3O4完全反映需要硫酸 0.015mol*4=0.06mol
硫酸足量,所以Fe3O4完全反映
生成Fe2+ 0.015mol Fe3+ 0.03mol
在氧化还原反应中,0.015molFe2+变为Fe3+,电子转移0.015mol.
Cr由原来的+6价降为+3价,所以参加反应的Cr为 0.015/(6-3)=0.005mol
而K2Cr2O7的mol量就应该为0.005mol/2=0.0025mol
质量浓度就是 0.0025mol/25ml=0.1mol/L - 1年前
相关推荐
- 铜和浓硫酸反应生成NO2,当浓硫酸变稀后,则生成NO,3.84克铜和适量浓硫酸反应后,铜全部反应完,
铜和浓硫酸反应生成NO2,当浓硫酸变稀后,则生成NO,3.84克铜和适量浓硫酸反应后,铜全部反应完,
收集到标准状况下NO和NO2混合气体共2.24L,求:①参与反应的HNO3的物质的量.②生成的混合气体中NO的体积 dakenliu1年前2
dakenliu1年前2 -
 aigyjoje 共回答了22个问题
aigyjoje 共回答了22个问题 |采纳率86.4%解析:3.84克Cu(0.06mol)与浓硝酸反应生成Cu(NO3)2 NO NO2 H2O 其中 NO NO2 共0.1mol,① 从上反应中可以看出,N守恒:参与反应的HNO3中的N到了Cu(NO3)2 NO NO2中了,则有:n(HNO3)= 2n[Cu(NO3)2]+ n(NOx)=2n(Cu) + n(NOx...1年前查看全部
- 将一定量氯酸钾与一克二氧化锰混合后充分加热.共生成氧气3.84克,反应后的残余固体质量为多少克?
 了了19861年前2
了了19861年前2 -
 偷偷地乐吧 共回答了16个问题
偷偷地乐吧 共回答了16个问题 |采纳率93.8%2KClO3 =MnO2△= 2KCl + 3O2 ↑
149 96
x 3,84g
149/x=96/3.84g
x=5.96g
反应后的残余固体质量为 5.96g+1g=6.96克1年前查看全部
- 3.84克铜与足量的浓硫酸在加热条件下充分反应.
3.84克铜与足量的浓硫酸在加热条件下充分反应.
(1) 求生成的气体在标准状况下的体积是多少?(2) 求被还原的硫酸的物质的量是多少?(3) 将生成物稀释到500mL,求所得溶液中CuSO4的物质的量浓度是多少? 小么么么1年前2
小么么么1年前2 -
 susu1024 共回答了17个问题
susu1024 共回答了17个问题 |采纳率100%首先你要明确cu和稀硫酸不反应,而与浓硫酸发生反应生成so2.Cu+2H2SO4=CuSO4+SO2!+2H2O1 1 1 1 0.06 0.06 0.06 n(Cu)=3.84/64=0.06mol1)n(SO2)=0.06 那么V(SO2)=0.06*22.4=1.334L2)2个硫酸只有一个发生氧化还原反...1年前查看全部
- 化学两条计算题...(1.3.84克Cu与100ml 2.0mol/L的稀HNO3溶液充分反应,假设反应后的溶液仍然10
化学两条计算题...(
1.3.84克Cu与100ml 2.0mol/L的稀HNO3溶液充分反应,假设反应后的溶液仍然100ml,求反应后溶液中NO3-的物质的量浓度为多少?
2.把盛有48ml的NO,NO2的混合气体的容器倒置於水中(保持同温,同压),液面稳定后,容器内气体体积为24ml.则 :
(1) 原混合气体中,NO,NO2分别为多少ml?
(2) 若在剩余的24ml气体中通入24ml氧气,液面稳定后,容器内气体体积是多少ml?
麻烦大家帮我计一计,.. 遍地梧桐1年前1
遍地梧桐1年前1 -
 zhjmedison 共回答了15个问题
zhjmedison 共回答了15个问题 |采纳率86.7%1、3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
所以,离子方程式为
3Cu + 8H^+ + 2NO3^- = 3Cu^2+ + 2NO + 4H2O
3*64g----8mol-----2mol
3.84g----0.2mol------0.2mol
不足
所以,反应的n(NO3^-)=0.04mol,剩余NO3^-为0.16mol
c(NO3^-)=1.6mol/L
2、(1)剩余的一定是NO
3NO2 + H2O = 2HNO3 + NO-----体积减少
3------------------------1-------------2
V(NO2)---------------------------------------48-24
所以,V(NO2)=36mL,V(NO)=12mL
(2)反应有,2NO + O2 = 2NO2,3NO2 + H2O = 2HNO3 + NO
所以据总方程式
4NO + 3O2 + 2H2O = 4HNO3
4---------3
24mL-------24mL
------------过量
所以,反应的O2为18mL,剩余6mL
即剩余O2为6mL1年前查看全部
- 3.84克铜粉与一定质量的浓硝酸反应,当铜完全作用时,收集到气体2.24L,则所消耗的酸的物质的量是?
 高智商的疯子1年前2
高智商的疯子1年前2 -
 1591111 共回答了22个问题
1591111 共回答了22个问题 |采纳率59.1%1年前查看全部
- 3.84克铜和一定量浓硝酸反应,当铜反应完毕时,共收集到气体的体积为2.24L.试求:(1)反应中消耗的硝酸的总物质量.
3.84克铜和一定量浓硝酸反应,当铜反应完毕时,共收集到气体的体积为2.24L.试求:(1)反应中消耗的硝酸的总物质量.(2)把收集到的气体的集气瓶倒立于盛有水的水槽中,通入多少毫升标准状况下的氧气,可以使集气瓶充满溶液?
 yylcwmy1年前4
yylcwmy1年前4 -
 我心在想 共回答了20个问题
我心在想 共回答了20个问题 |采纳率80%3.84克铜是0.06莫尔 全部转化成二价的 消耗硝酸0.12莫尔 气体应是NO2不考虑N2O4 总共就消耗了0.22莫尔 化学方程式2H2O+4NO2+O2=4HNO3 可知需560毫升 谢我要1年前查看全部
- 将3.84克铁和三氧化二铁的混合物溶于120毫升盐酸 反应完全 生成0.03摩尔氢气 反应后无高铁离子 且溶液
将3.84克铁和三氧化二铁的混合物溶于120毫升盐酸 反应完全 生成0.03摩尔氢气 反应后无高铁离子 且溶液
体积不变 试求
1 原混合物中铁和三氧化二铁的质量分别为多少
2 原氯化氢的物质的量浓度问题补充:
要过程的……………………………… 黑色的可爱1年前1
黑色的可爱1年前1 -
 用微笑把痛苦埋葬 共回答了16个问题
用微笑把痛苦埋葬 共回答了16个问题 |采纳率87.5%与盐酸反应的铁的质量是56×0.03=1.68克
根据2Fe3+ ----Fe物质的量比为2/1,那么三氧化二铁与铁的质量比是160/56
原混合物中铁的质量为1.68+(3.84-1.68)×56/(160+56)=2.24
原混合物中三氧化二铁的质量为3.84-2.24=1.6克
0.03摩尔氢气对应0.03×2=0.06摩尔氯化氢
1.6/160=0.01摩尔三氧化二铁对应0.06摩尔氯化氢
原氯化氢的物质的量浓度为0.06×2/0.12=1.0mol/L.1年前查看全部
- 化学计算题 1 3.84克铜投入足量某浓度HNO3中,将产生的气体通入盛有水的洗气瓶中
化学计算题 1 3.84克铜投入足量某浓度HNO3中,将产生的气体通入盛有水的洗气瓶中
1 3.84克铜投入足量某浓度HNO3中,将产生的气体通入盛有水的洗气瓶中,瓶内增重2.16g,求洗气瓶可收集到多少ml气体(STP)
2 STP由NO2、NH3和H2组成混合气体10L,通入稀HNO3,增重12.5g,气体体积缩小为3.28L,求NO2 NH3 H2的体积
要过程 好的加分 在水端1年前2
在水端1年前2 -
 康晴 共回答了18个问题
康晴 共回答了18个问题 |采纳率88.9%1、因为浓HNO3足量,所以只发生反应
Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
然后通入H2O
3NO2+H2O=2HNO3+NO
每得到3molNO2,最后H2O增重3*46-30=108g
1molNO2增重36g
现在增重2.16g,因此NO2为0.06mol,最后得到NO为0.02mol
2、设NO2 xL,NH3 yL,H2 zL
那么有x+y+z=10
因为NH3能被稀硝酸全部吸收,而NO2反应得到NO
因此有
17*y/22.4+36*x/22.4=12.5
x/3+z=3.28
解得x=6.72,y=2.24,z=1.041年前查看全部
- 铜和浓硝酸反应生成NO2,当浓硝酸变稀后,则生成NO,3.84克铜和适量浓硝酸反应后,铜全部反应完,收集到标准状况下NO
铜和浓硝酸反应生成NO2,当浓硝酸变稀后,则生成NO,3.84克铜和适量浓硝酸反应后,铜全部反应完,收集到标准状况下NO和NO2混合气体共2.24L,求:
(1)参与反应的HNO3的物质的量.
(2)生成的混合气体中NO的体积. 泰坦之刃1年前1
泰坦之刃1年前1 -
 fftt116 共回答了17个问题
fftt116 共回答了17个问题 |采纳率88.2%解题思路:(1)铜与硝酸反应中,硝酸起氧化剂和酸的作用,起氧化剂作用硝酸被还原为NO和NO2,一个气体分子中都含有一个N原子,一个硝酸分子中含有一个N原子,根据N原子守恒可知,气体的物质的量与起氧化剂作用硝酸的物质的量相等.起酸作用的硝酸生成硝酸铜,起酸作用的硝酸的物质的量为铜的物质的量的2倍,据此计算.
(2)令NO、NO2的物质的量的分别为x、y,铜与硝酸反应中,铜失电子作还原剂,硝酸得电子作氧化剂,在氧化还原反应中得失电子数相等,利用电子守恒及体积,列方程组,得出NO、NO2的物质的量.再计算NO的体积.3.84克铜的物质的量为[3.84g/64g/mol]=0.06mol.
(1)铜与硝酸反应中,硝酸起氧化剂和酸的作用.根据N原子守恒可知,气体的物质的量与起氧化剂作用硝酸的物质的量相等,所以起氧化剂作用硝酸的物质的量为[2.24L/22.4L/mol]=0.1mol.
起酸作用的硝酸生成硝酸铜,起酸作用的硝酸的物质的量为铜的物质的量的2倍,所以起酸作用的硝酸的物质的量为
0.06mol×2=0.12mol.
所以参与反应的HNO3的物质的量为0.1mol+0.12mol=0.22mol.
答:参与反应的HNO3的物质的量为0.22mol.
(2)令NO、NO2的物质的量的分别为x、y,
根据电子转移守恒有3x+y=0.06mol×2.
根据标准状况下NO和NO2混合气体共2.24L,有x+y=0.1mol.
联立方程,解得:x=0.01mol,y=0.09mol.
所以混合气体中NO的体积为0.01mol×22.4L/mol=0.224L.
答:生成的混合气体中NO的体积为0.224L.点评:
本题考点: 有关混合物反应的计算;化学方程式的有关计算.
考点点评: 考查根据方程式及混合物的有关计算,难度中等,关键根据氧化还原反应分析硝酸的作用,结合守恒进行计算,注意守恒思想在混合计算中的运用.1年前查看全部
- 1.3.84克Cu和一定量的浓硝酸反应,当铜反应完毕时,共收集到标准状况下的气体2.24升.试求1)反应中小号的HNO3
1.3.84克Cu和一定量的浓硝酸反应,当铜反应完毕时,共收集到标准状况下的气体2.24升.试求1)反应中小号的HNO3的物质的量;2)把收集到气体的集气瓶倒立于盛有水的水槽中,通入多少毫升保准状况下的O2可以使集气瓶充满液体?
2.现有某金属的硝酸盐2.160克,充分加热分解成金属氧化物0.960克和NO2与O2的混合气体0.027mol,将混合气体用水充分吸收后仍有0.004mol气体剩余.问:1)混合气体中NO2,O2各多少摩尔?2.)求该硝酸盐的化学式
3.18.4克NaOH和NaHCO3的固体混合物,在密闭容器中加热约250°C,经充分反映后排出气体,冷却,称得剩余固体质量为16.6克,试计算原混合物中NaOH的质量分数.
4.往100mol,1mol/L的AlCl3溶液中加入2mol/L的NaOH溶液,求:1.)当生成Al(OH)3沉淀最多时,加入的NaOH溶液的体积是多少;2.)当加入350mLNaOH溶液时,产生的沉淀的质量. 乐会后生1年前1
乐会后生1年前1 -
 pitiaowangzi 共回答了17个问题
pitiaowangzi 共回答了17个问题 |采纳率94.1%1.Cu+4HNO3(浓)——Cu(NO3)2+2NO2↑+2H2O
64 2
3.84-y x
3Cu+8HNO3(稀)——3Cu(NO3)2+2NO↑+4H2O
3*64 2
y 0.1-x
(1)反应后消耗的硝酸实际上就是反应后变成NO和NO2的硝酸,所以直接按照气体的总量算就可以,即气体中有多少N,就有多少硝酸被消耗.个人认为,变成硝酸盐的本质上还是在溶液里,不算是消耗,只算是反应.
2.24/22.4=0.1mol
(2)3NO2+H20=2HNO3+NO①
4NO+3O2+2H2O=4HNO3②
要最后全部没有气体,就是要NO2先变成NO,再变成硝酸,所以要算NO2和NO的量,过程见上面.
算出 x=0.09 y=0.96
所以 0.09molNO2代入①式得0.03molNO,加上原来的(0.1-0.09=)0.01mol的NO共计0.04mol,代入②式的需要氧气0.03mol,即672ml
2.(1)NO2(x)和O2(y)共0.027mol,其质量为:(2.16-0.96=)1.2g
x+y=0.027 46x+32y=1.2
算出x=0.024 y=0.003
(2)设金属为M,在硝酸盐中其化合价为x,在金属氧化物中其化合价为y
2aM(NO3)x——aM2Oy + 8NO2 + O2
2a a 8 1
0.006a 0.003a 0.024 0.003
根据质量守恒、电荷守恒列方程:
0.006a×(M+62x)=2.16g
0.003a×(2M+16y)=0.096g
0.006a×(y-x)+0.003mol×4=0.024mol×1
解方程讨论得:a=2 x=2 y=3 M=56
4Fe(NO3)2—— 2Fe2O3 + 8NO2 ↑ + O2↑
3.这道题关键就是NaOH和NaHCO3谁过量的问题,我只是经验的告诉你,反应前固体18.4g,反应后固体16.6g,生成气体则是1.8g,正好是水的摩尔质量的简单倍数,所以反应后只有H2O,不会有CO2
这个你就自己算吧
4.单纯觉得应该是100ml,不是100mol.
少量:AlCl3+3NaOH(少)=Al(OH)3+3NaCl
过量:AlCl3+4NaOH(过)=NaAlO2+3NaCl+H2O
设:加入的 NaOH 溶液的体积xL,
AlCl3+3NaOH=Al(OH)3+3NaCl
1 3
0.1*1 1*x x=0.3(L)
假如350ml时,多出的50ml就会溶解生成的沉淀
Al(OH)3+NaOH=NaAlO2+2H2O
1 1
y 1*0.05 y=0.05(mol)
产生沉淀的质量=(0.1-0.05)*78=3.9(g)1年前查看全部
- 有关铜和硝酸反应的怎么计算啊?求教方法,这有个例题:将3.84克铜粉与一定质量浓硝酸反应,当铜完全作用时,收集到二氧化氮
有关铜和硝酸反应的怎么计算啊?
求教方法,这有个例题:将3.84克铜粉与一定质量浓硝酸反应,当铜完全作用时,收集到二氧化氮和一氧化氮气体2.24升(标况)则所耗酸的物质的量为多少
想求教这类问题的常用解题方法, 子非鱼S1年前1
子非鱼S1年前1 -
 匪帮 共回答了18个问题
匪帮 共回答了18个问题 |采纳率83.3%Cu——2NO3——2HNO3
3.84
0.06mol 0.12mol
NOx——HNO3
2.24
0.1mol 0.1mol
n=0.12+0.1=0.22mol1年前查看全部
- 浓硝酸与铜反应生成二氧化氮,当浓硝酸变稀后,生成一氧化氮,3.84克铜和适量浓硝酸反应,铜全部反应完,收集到标准状况下的
浓硝酸与铜反应生成二氧化氮,当浓硝酸变稀后,生成一氧化氮,3.84克铜和适量浓硝酸反应,铜全部反应完,收集到标准状况下的一氧化氮和二氧化氮混合气体共2.24升,求参加反应的硝酸的物质的量
 幽默大师kk1年前1
幽默大师kk1年前1 -
 Princess_QQ 共回答了22个问题
Princess_QQ 共回答了22个问题 |采纳率95.5%参与反应的硝酸都放出气体,1molHNO3对应1mol气体,共2.24升
n(HNO3)=2.24/22.4mol=0.1mol
硝酸发生氧化还原反应,N降价,降价产物出的都是气体,且每个气体都只含有1个N,所以1molHNO3对应1mol气体1年前查看全部
- 3.84克铜与足量的浓硫酸在加热条件下充分反应
3.84克铜与足量的浓硫酸在加热条件下充分反应
1) 求生成的气体在标准状况下的体积是多少?(2) 求被还原的硫酸的物质的量是多少?(3) 将生成物稀释到500mL,求所得溶液中CuSO4的物质的量浓度是多少? test方_201年前1
test方_201年前1 -
 晚上飞扬跋扈 共回答了15个问题
晚上飞扬跋扈 共回答了15个问题 |采纳率93.3%Cu+2H2SO4==CuSO4+SO2+2H2O
1所以被还原的硫酸和铜的物质的量一样,即0.06mol,生产气体SO2为0.06mol,0.06*22.4=1.344L
2被还原的硫酸的物质的量0.06mol
3 0.06/0.5=0.12mol/L1年前查看全部
- 3.84克铁与氧化铁的混合物溶于过量盐酸中,生成0.03mol氢气,反应后的溶液加入kscn溶液检验,不显红色
3.84克铁与氧化铁的混合物溶于过量盐酸中,生成0.03mol氢气,反应后的溶液加入kscn溶液检验,不显红色
球员混合物中氧化铁的质量 loveqgp1年前3
loveqgp1年前3 -
 yyh4545 共回答了24个问题
yyh4545 共回答了24个问题 |采纳率91.7%设生成0.03molH2需要铁的质量为X,原混合物中含氧化铁的物质的量为YFe + 2HCl =FeCl2 + H2↑ 56 1X 0.03molX=1.68gFe2O3 + 6HCl =2FeCl3 + 3H2O 2FeCl3+Fe=3FeCl2根据氧化剂与多种还原剂反应时,先与氧化性强的反应,再...1年前查看全部
- 3.84克铜投入盛定量浓度HNO3中标准状况下收集到1.68L气体时铜恰全消耗写化学方程式求反应中耗硝酸物质量
3.84克铜投入盛定量浓度HNO3中标准状况下收集到1.68L气体时铜恰全消耗写化学方程式求反应中耗硝酸物质量
能具体点吗
方程式帮我写清楚点好吗
我会非常感谢 moonfetch1年前1
moonfetch1年前1 -
 hst168 共回答了19个问题
hst168 共回答了19个问题 |采纳率89.5%n(Cu)=0.06mol
n气体=0.075mol
所以反应就是8Cu+24HNO3=8Cu(NO3)2+3NO(气体)+5NO2(气体)+12H2O
消耗硝酸物质的量为0.18mol1年前查看全部
- 向200ml18mol/L浓硫酸中加入3.84克的铜,生成的气体在标准状况下的体积为多少毫升
 swangen1年前3
swangen1年前3 -
 tigerwoods16 共回答了15个问题
tigerwoods16 共回答了15个问题 |采纳率93.3%Cu + 2 H2SO4 == CuSO4 + SO2 + 2H2O
1 2 1 2
0.06 mol 3.6 mol 0.06 mol
所以硫酸过量,假设铜是完全反应,消耗0.12 mol硫酸后,
硫酸浓度大约还有17 mol/L,所以还是浓硫酸,故可以认为铜是完全反应
(如果浓硫酸变为稀硫酸,就不能再溶解Cu了,所以这一步是必须的)
所以生成SO2是 0.06 mol ,体积1.344 L1年前查看全部
大家在问
- 1从0到9的数字排列组合从0,1,2,3,4,5,6,7,8,9十个数字中任意选择5个数字相加(可以是重复数字,但是每个数
- 2在一幅条形统计图上,纵轴用2cm长的直条表示20吨,那么()cm长的直条表示35吨
- 3一个半径为1厘米的小圆盘沿着一个半径为4厘米的大圆盘外侧做无滑动的滚动.当小圆盘的中心围绕大圆盘中心
- 4对于植物繁衍后代来说,一朵花中最重要的部分是( )
- 5课文《那片绿绿的爬山虎》前后三次描写了叶老先生家的爬山虎,有什么用意?
- 6人的平均数怎么算
- 7已知三角形的一边和另一个边上的中线长度,求第三边范围
- 8When someone says "1'm sorry"to you,you say"____" A.No probl
- 9比喻把一个事物看得很珍贵的成语
- 10在Rt三角形ABC中,∠C=90°,∠A=30°AC=3,求BC
- 11根据课文内容填空。 Wang Bing is 1._____ an 2.
- 12在rt三角形abc中,角acb=90°,bc>ac,圆o是三角形abc的外接圆,以c为圆心,bc为半径作
- 13英语翻译Although the term may not be very familiar to many manag
- 148分米长的铁丝,围成一个宽1.6分米的长方形,它的长是(),面积是(),如果围成一个正方形它的面积是(
- 15英语翻译We have recently updated payment details on your CAS rec