氯甲烷能否发生消去、水解反应,CH3CL不是卤代烃么?
 天线角2022-10-04 11:39:541条回答
天线角2022-10-04 11:39:541条回答如果不能发生,为什么呢(卤代烃可以发生消去、水解反应)

已提交,审核后显示!提交回复
共1条回复
 Qq_sunfo 共回答了19个问题
Qq_sunfo 共回答了19个问题 |采纳率94.7%- 氯甲烷可以发生水解,即-Cl被-OH取代
氯甲烷不能发生消去.因为卤代烃消去需要一个碳上有-X,相邻碳上有H
氯甲烷只有一个碳和谁消去? - 1年前
相关推荐
- 三氯化磷和甲醇反应方程式三氯化磷和甲醇反应生成亚磷酸二甲酯和氯甲烷 这个化学方程式怎么写啊?十万火急!我需要一个最终平衡
三氯化磷和甲醇反应方程式
三氯化磷和甲醇反应生成亚磷酸二甲酯和氯甲烷 这个化学方程式怎么写啊?十万火急!
我需要一个最终平衡的方程式,可能还有一些副产物生成,我这边没有写出来 太监631年前1
太监631年前1 -
 王会才yy 共回答了15个问题
王会才yy 共回答了15个问题 |采纳率80%3CH3OH+PCL3=====C2H7O3P+CH3CL+2HCL1年前查看全部
- 304不锈钢材料能否在氯气、白炭黑、氯甲烷、300摄氏度的温度条件下不被腐蚀?
304不锈钢材料能否在氯气、白炭黑、氯甲烷、300摄氏度的温度条件下不被腐蚀?
有什么不锈钢在此条件下不受腐蚀 伤心丸子1年前2
伤心丸子1年前2 -
 liu19831228 共回答了19个问题
liu19831228 共回答了19个问题 |采纳率89.5%316L可以1年前查看全部
- 2氟2氯甲烷有几种结构
 gowithcloud1年前3
gowithcloud1年前3 -
 天使之生 共回答了17个问题
天使之生 共回答了17个问题 |采纳率94.1%只有一种结构,因为中心C原子是正四面体1年前查看全部
- (2011•广州模拟)为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化剂作用下,通过下
(2011•广州模拟)为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化剂作用下,通过下列反应:CCl4+H2⇌CHCl3+HCl使CCl4转化为重要的化工原料氯仿(CHCl3).此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等.已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.
(1)在密闭容器中,该反应达到平衡状态后,测得如下数据(假设不考虑副反应).
①此反应的化学平衡常数表达式为实验序号 温度℃ 初始CCl4浓度(mol/L) 初始H2浓度(mol/L) CCl4的平衡转化率 1 110 0.8 1.2 A 2 110 1 1 50% 3 100 1 1 B c(CHCl3)•c(HCl) c(CCl4)•c(H2) ,在110℃时平衡常数为______.c(CHCl3)•c(HCl) c(CCl4)•c(H2)
②实验1中,CCl4的转化率A______50%(填“大于”、“小于”或“等于”).
③实验2中,10h后达到平衡,H2的平均反应速率为______.
④实验3中,B的值______(选填序号).
A.等于50%; B.大于50%
C.小于50%; D.从本题资料无法判断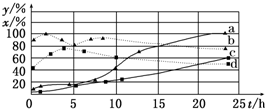
(2)120℃时,在相同条件的密闭容器中,分别进行H2的初始浓度为2mol/L和4mol/L的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线).
①在图中的四条线中,表示H2起始浓度为2mol/L的实验消耗CCl4的百分率变化曲线是______(选填序号).
②根据如图曲线,氢气的起始浓度为______ mol/L时,有利于提高CCl4的平衡转化率和产物中CHCl3的百分含量.你判断的依据是______. Q匠1年前1
Q匠1年前1 -
 托尔斯泰狗 共回答了16个问题
托尔斯泰狗 共回答了16个问题 |采纳率87.5%解题思路:(1)①因CCl4的沸点为77℃,CHCl3的沸点为61.2℃,所以在110℃或100℃反应时各物质均为气态,其平衡常数K=
;110℃时,由实验2可知反应中各物质的平衡浓度均为0.5mol/L,代入表达式计算得平衡常数;c(CHCl3)•c(HCl) c(CCl4)•c(H2)
②实验1和实验2的反应温度相同,所以其平衡常数相同,利用平衡常数相等,可以求出实验1中CCl4的平衡转化率,然后与50%比较;
③根据v=[△c/△t]计算v(H2);
④对于实验3,因温度不同,又不知该反应的热效应,所以无法判断转化率的大小;
(2)氢气浓度越大反应越快,消耗CCl4的百分率变化就越快,相反就比较慢,据此判断;
由图象可知,氢气的浓度为4mol/L,CCl4的平衡转化率和产物中CHCl3的百分含量均得到提高.(1)①因CCl4的沸点为77℃,CHCl3的沸点为61.2℃,所以在110℃或100℃反应时各物质均为气态,其平衡常数K=
c(CHCl3)•c(HCl)
c(CCl4)•c(H2);
110℃时,实验2中,10h后达到平衡,CCl4的转化率为50%,
CCl4(g)+H2(g)⇌CHCl3(g)+HCl(g),
起始(mol/L):1 1 0 0
变化(mol/L):0.5 0.5 0.5 0.5
平衡(mol/L):0.5 0.5 0.5 0.5
则平衡常数k=[0.5×0.5/0.5×0.5]=1,
故答案为:
c(CHCl3)•c(HCl)
c(CCl4)•c(H2);1;
②实验1中,设平衡时四氯化碳的浓度变化量为amol/L,则:
CCl4(g)+H2(g)⇌CHCl3(g)+HCl(g),
起始(mol/L ) 0.8 1.2 0 0
反应(mol/L ) a a a a
平衡(mol/L) 0.8-a 1.2-a a a
则[a×a
(0.8−a)×(1.2−a)=1,解得a=0.48,则CCl4的转化率为
0.48mol/L/0.8mol/L]×100%=60%>50%,故答案为:大于;
③由②中计算可知,平衡时氢气的浓度变化量为0.5mol/L,则v(H2)=[0.5mol/L/10h]=0.05mol/(L•h),故答案为:0.05mol/(L•h);
④对于实验3,因温度不同,又不知该反应的热效应,所以无法判断转化率的大小,故答案为:D;
(2)①由图象可知,氢气浓度越大反应越快,消耗CCl4的百分率变化就越快,相反就比较慢,所以H2起始浓度为2mol/L时,消耗CCl4的百分率变化曲线是c,
故答案为:c;
②由图象可知,a、b表示氢气的浓度为4mol/L的曲线,CCl4的平衡转化率和产物中CHCl3的百分含量均得到提高,
故答案为:4;从图中可见,4mol/L的a、b曲线比2mol/L的c、d曲线CCl4转化率和产物中CHCl3的百分率的数值均高.点评:
本题考点: 化学平衡的计算;物质的量或浓度随时间的变化曲线.
考点点评: 本题考查化学平衡计算、化学反应速率计算、化学平衡常数计算与应用、影响化学平衡的因素,难度中等,注意掌握三段式计算与平衡常数的应用.1年前查看全部
- (2012•长沙模拟)为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏,某化学家在催化条件下,通过反应C
(2012•长沙模拟)为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏,某化学家在催化条件下,通过反应CCl4+H2⇌CHCl3+HCl使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后.测得如表所示数据(不考虑副反应).
(1)实验2中,10h后反应达到平衡,则H2的平均反应速率为______.实验序号 温度℃ 初始c(CCl4)(mol•L-1) 初始c(H2)(mol•L-1) CCl4的平衡转化率 l 110 0.8 1.2 a 2 110 l 1 50% 3 100 l 1 b
(2)实验3中,b的值______ (填序号).
A.等于50%B.大于50%C.小于50%D.从题给信息无法判断
(3)根据题目所给的条件,能否求出a的值?______填(“能”或“不能”). xzm03111年前1
xzm03111年前1 -
 abcijk12 共回答了15个问题
abcijk12 共回答了15个问题 |采纳率93.3%解题思路:(1)根据速率概念和不同温度下的平衡常数来判断;
(2)根据外界条件对化学平衡的影响分析反应热量变化和平衡移动来解答;
(3)依据2计算反应的平衡常数,平衡常数随温度变化,利用化学平衡三段式解释计算平衡浓度,列式计算平衡常数计算消耗的四氯化碳得到转化率.(1)实验2中,10h后达到平衡,CCl4的转化率为50%
CCl4(g)+H2(g)⇌CHCl3(g)+HCl(g),
起始(mol/L ) 1 1 0 0
反应(mol/L ) 0.5 0.5 0.5 0.5
平衡(mol/L) 0.5 0.5 0.50.5
则H2的平均反应速率=[0.5mol/L/10h]=0.05mol/(L•h);
故答案为:0.05mol/(L•h);
(2)CCl4+H2
催化剂
.
△CHCl3+HCl 此反应能自发进行,伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等.已知CCl4的沸点为 77℃,CHCl3的沸点为 61.2℃.反应是熵增加的反应,可知△H-T•△S<0,则反应是放热反应;所以温度110℃降低到 100℃,平衡正向进行,CCl4转化率大于50%,
故选:B;
(3)依据实验2中,10h后达到平衡,CCl4的转化率为50%,列式计算得到平衡常数
CCl4(g)+H2(g)⇌CHCl3(g)+HCl(g),
起始(mol/L ) 1 1 0 0
反应(mol/L ) 0.5 0.5 0.5 0.5
平衡(mol/L) 0.5 0.5 0.5 0.5
则平衡常数为
c(HCl)c(CHCl3)
c(H2)c(CCl4)=[0.5×0.5/0.5×0.5]=1;
实验1中,设四氯化碳转化的浓度为a
CCl4(g)+H2(g)⇌CHCl3(g)+HCl(g),
起始(mol/L ) 0.8 1.2 0 0
反应(mol/L ) a a a a
平衡(mol/L) 0.8-a 1.2-a a a
则平衡常数为
c(HCl)c(CHCl3)
c(H2)c(CCl4)=[a×a
(0.8−a)(1.2−a)=1,
所以a=0.48mol/L,
则CCl4的转化率为
0.48/0.8]×100%=60%,
故答案为:能.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的计算,侧重于化学平衡常数的概念分析和计算应用,化学平衡的三段式计算,反应速率的概念计算应用,题目难度中等.1年前查看全部
- 氯甲烷发生水解的条件是什么氯甲烷在液碱中会很快就会水解掉吗?
 愚乐人1年前3
愚乐人1年前3 -
 瀣鲝齄 共回答了12个问题
瀣鲝齄 共回答了12个问题 |采纳率100%氯甲烷可以发生水解,即-Cl被-OH取代1年前查看全部
大家在问
- 1天净沙秋思描绘了一幅什么样的景象
- 2若方程组3x-2y=3 2x-y=7的解是一个直角三角形的两条直角边的长度值,则这个直角三角形的面积为?
- 3如果使二元一次方程组{3x-2y=3,2x-y=7的解是一个直角三角形的两条直角边的长,那么这个三角形的面积是多少
- 4“启于未发、适时而教、循序而育”,这句话中“启于未发”是什么意思?
- 5教,上所施,下所效也;育,养子使作善也.
- 6抛物线 (5 8:38:39)已知抛物线y=aX的平方和直线y=2x-7都经过【3,b】,求抛物线的函数解析式,并判断点
- 7当物体速度超过光速,时间会倒流吗,有何定理可支持之
- 8氯甲烷发生水解的条件是什么氯甲烷在液碱中会很快就会水解掉吗?
- 9有些物质从液态变为固态时体积变小,而有些物质液态变为固态时体积变大,这种现象我们在日常生活中有时会遇到,请列举出两例.
- 1013.多数物质从液态变为固态时体积变小,而水在结变大,这种现象我们在日常生活中有时会遇到,请列2
- 11根号15除以根号5等于多少本人脑子有点昏了!
- 12设以三为底x的对数=以6为底x的对数,则x的值为?
- 13x=lnp,y=log以5为底2的对数,z=e-1/2,三者比较大小
- 14( )来( )往的词语,至少五个,
- 15试着把握说话的语气用英语怎么说
