150C时将(NH4)2CO3分解,生成的气态混合物的密度是相同条件下氢气密度的
 luyong2022-10-04 11:39:541条回答
luyong2022-10-04 11:39:541条回答A.96倍 B.48倍 C.24倍 D.12倍

已提交,审核后显示!提交回复
共1条回复
 cxy199 共回答了14个问题
cxy199 共回答了14个问题 |采纳率78.6%- (NH4)2CO3=150℃=2NH3+H2O+CO2
150度时都是气体,分子量是2x17+18+44=96
而H2的分子量是2
所以混合物的密度是相同条件下氢气密度的=96/2=48
选B - 1年前
相关推荐
- 离子浓度大小排序等物质量浓度的下列溶液:1、Na2CO3;2、NaHCO3;3、H2CO3;4、(NH4)2CO3;5、
离子浓度大小排序
等物质量浓度的下列溶液:
1、Na2CO3;2、NaHCO3;3、H2CO3;4、(NH4)2CO3;5、NH4HCO3
中,c(CO3 2-)由小到大的排列顺序为 lanman19831年前2
lanman19831年前2 -
 meimei9876 共回答了16个问题
meimei9876 共回答了16个问题 |采纳率62.5%题目没错,很不错的一个题,考察了电离和水解的情况.
1>4>2>5>3
原因:
因为电离和水解都是很微弱的.所以Na2CO3和(NH4)2CO3中的c(CO3 2-)都是很大的,又因为NH4+的水解会促进CO32-的水解,所以1>4
H2CO3和HCO3-都是会电离出CO32-,但是我们知道,H2CO3的第一步电离远远大于第二步电离,所以H2CO3中的CO32-是最小的.
NaHCO3与NH4HCO3的比较,因为NH4+会抑制HCO3-的电离,因此2>51年前查看全部
- (NH4)2Fe(SO4)2,(NH4)SO4,(NH4)2CO3哪个氨根离子浓度高
 hrjin1年前1
hrjin1年前1 -
 Michael_Wong2002 共回答了30个问题
Michael_Wong2002 共回答了30个问题 |采纳率96.7%浓度相同下,(NH4)2Fe(SO4)2的NH4+浓度更高一些.1年前查看全部
- 物质的量浓度相同的下列溶液①H2CO3 ②Na2CO3 ③NaHCO3 ④NH4HCO3 ⑤(NH4)2CO3,碳酸根离
物质的量浓度相同的下列溶液①H2CO3 ②Na2CO3 ③NaHCO3 ④NH4HCO3 ⑤(NH4)2CO3,碳酸根离子浓度由大到小的顺序正确的是
A.②⑤③④① B.⑤②④①③
C.②⑤④③① D.②③⑤①④ 贝西猫1年前3
贝西猫1年前3 -
 千贝 共回答了21个问题
千贝 共回答了21个问题 |采纳率100%选A
要看其它离子对碳酸根离子的影响.
②⑤对比,铵根离子水解促进碳酸根离子水解,故②>⑤;同理③④对比,铵根离子水解促进HCO3-离子的水解,HCO3-的电离相对就弱了;碳酸的第二步电离才产生碳酸根离子,而碳酸的第二步电离很弱,且和③④相比HCO3-浓度小得多,所以①最小.1年前查看全部
- 将NaOH溶液加入到13.2g含有(NH4)2SO4与(NH4)2CO3的固体混合物中,充分反应后,可收集到标准状况下密
将NaOH溶液加入到13.2g含有(NH4)2SO4与(NH4)2CO3的固体混合物中,充分反应后,可收集到标准状况下密度为17g/22.4L的气体,体积不可能是( )
A. 4.68L
B. 4.3 L
C. 6.16L
D. 5.2L huanglei6251年前2
huanglei6251年前2 -
 yifei3018 共回答了28个问题
yifei3018 共回答了28个问题 |采纳率92.9%解题思路:氢氧化钠与(NH4)2SO4与(NH4)2CO3的固体混合物,产生的密度为[17/22.4]g/L的气体为氨气,若13.2g全部为(NH4)2CO3,铵盐全部反应产生的氨气的体积最大,根据n=[m/M]计算13.2g(NH4)2CO3的物质的量,再根据氮元素守恒计算氨气的物质的量,根据V=nVm计算氨气的体积,由于氢氧化钠的量不确定,故生成的氨气的体积体积小于最大值.若13.2g全部为(NH4)2CO3,铵盐全部反应产生的氨气的体积最大,13.2g(NH4)2CO3的物质的量为[13.2g/96g/mol]=[13.2/96]mol,标准状况下生成氨气的体积为[13.2/96]mol×2×22.4L/mol=6.16L,
由于为NH4)2SO4与(NH4)2CO3的固体混合物,且铵盐不一定完全反应,故生成氨气的体积一定小于6.16L,
故选C.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的有关计算,难度不大,注意根据极限法进行解答,注意铵盐不一定完全反应,故氨气的最小体积极值不能根据硫酸铵计算.1年前查看全部
- 物质的量浓度相同的下列溶液①(NH4)2CO3 ②(NH4)2SO4 ③NH4HCO3 ④NH4HSO4 ⑤NH4Cl&
物质的量浓度相同的下列溶液①(NH4)2CO3 ②(NH4)2SO4 ③NH4HCO3 ④NH4HSO4 ⑤NH4Cl ⑥NH3•H2O⑦CH3COONH4;按c(NH4+)由小到大的排列顺序正确的是( )
A.③⑦⑤④⑥①②③
B.⑥③⑦⑤④①②
C.⑥⑦⑤③④①②
D.⑥⑦③⑤④②① uu阿咪1年前1
uu阿咪1年前1 -
 Wizardhd 共回答了21个问题
Wizardhd 共回答了21个问题 |采纳率81%解题思路:物质的量相等的这几种溶液中,NH3•H2O溶液中c(NH4+)小于铵盐的c(NH4+),铵根离子水解程度较小,所以要比较铵根离子浓度大小,先比较盐中铵根离子的系数,系数越大,溶液中铵根离子浓度越大,相同系数的铵盐溶液,再根据溶液中其它离子是促进铵根离子水解还是抑制铵根离子水解判断即可.NH3•H2O溶液中c(NH4+)小于铵盐的c(NH4+),所以一水合氨溶液中铵根离子浓度最小;
③④⑤⑦中铵根离子系数都是1,碳酸氢根离子促进铵根离子水解,氢离子抑制铵根离子水解,醋酸根离子促进铵根离子水解,但醋酸根水解程度小于碳酸氢根离子;
①②中铵根离子系数都是2,其溶液中铵根离子浓度大于其余溶液中铵根离子浓度,碳酸根离子促进铵根离子水解,则溶液中铵根离子浓度从小到大顺序是⑥③⑦⑤④①②,故选B.点评:
本题考点: 盐类水解的应用.
考点点评: 本题考查了铵根离子浓度的比较,先根据强弱电解质进行分离,再根据铵根离子系数进行分类,最后根据其它离子对铵根离子的影响来分类即可,难度中等.1年前查看全部
- 根据(NH4)2CO3(aq)中存在的若干种粒子,试完成下列问题:
根据(NH4)2CO3(aq)中存在的若干种粒子,试完成下列问题:
(2)根据水的电离,写出一个含有[H+]和[OH-]的等式:_______________________.
(3)根据(NH4)2CO3中,C.N 原子个数关系,写出一个含有[NH4+]和[CO32-]的等式:________________________.
(2)[OH-]+[NH3・H2O]=[H+]+[HCO3-]+2[H2CO3]
(3)[NH4+]+[NH3・H2O]=2[CO32-]+2[HCO3-]+2[H2CO3]
为什么(2)中[H2CO3]前的系数是2.还有(3)的答案是怎么来的.
【乐宇仔】:你……(」= =)」……..┻━━┻ laopowode1年前1
laopowode1年前1 -
 gg树下_12 共回答了22个问题
gg树下_12 共回答了22个问题 |采纳率90.9%这题目,首先,电荷守恒最简单,可以写出:[H+]+[NH4+]=[OH-]+2[CO32-]+[HCO3-]
(3)的答案是原子守恒(物料守恒)根据的是碳酸铵中的碳原子和氮原子,水由于没有这两种元素,所以根据C,N守恒得出.
(2)是质子守恒,简单就是电荷守恒减去物料守恒就是啦.1年前查看全部
- (2014•呼伦贝尔二模)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用,目前NH3和(NH4)2CO3
(2014•呼伦贝尔二模)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用,目前NH3和(NH4)2CO3已经被用作工业捕碳剂.
(1)已知CO2与NH3 经过两步反应可生成尿素,两步反应的能量变化示意图如图:
则NH3(g) 与CO2(g) 反应生成尿素的热化学方程式为______.
(2)已知CO2与(NH4)2CO3反应如下:(NH4)2CO3(aq)+H2O(l)+CO2(g)⇌2NH4HCO3(aq)△H<0,该反应在温度为T1时,溶液的pH随时间变化的趋势曲线如图1所示.当时间达到t1时,将该反应体系温度迅速上升到T2,并维持该温度,在t2达到新的平衡.请在图1中画出t1时刻后溶液的pH变化总趋势曲线.在(NH4)2CO3初始浓度不变的情况下,提高CO2吸收量的措施有:______,______(写出2个)
(3)工业上也可用CO2与H2反应生成甲醇,其反应为:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ/mol.在T℃下,将1mol CO2和2mol H2充入0.5L恒容密闭容器中,测得H2的物质的量随时间的变化情况如图2所示.
①按曲线计算反应从0到4min时,v(H2)=______.
②在T℃时,若仅改变某一外界条件时,测得H2的物质的量随时间的变化情况如图2曲线Ⅱ所示,则改变的外界条件为______.反应按曲线Ⅱ进行,计算达到平衡时容器中c(CO2)=______.
③判断该反应达到平衡的依据为______ (填正确选项的字母)
A.混合气体的平均相对分子质量不随时间改变
B.3v(H2)正=v(CH3OH)逆
C.混合气体的压强不随时间改变
D.单位时间内生成CH3OH和H2O的物质的量相同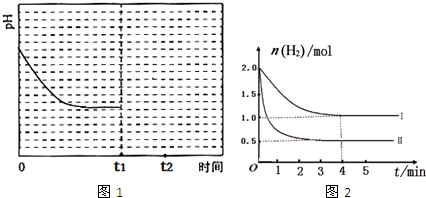
 假行僧CQTV1年前1
假行僧CQTV1年前1 -
 遗忘中成长 共回答了17个问题
遗忘中成长 共回答了17个问题 |采纳率88.2%解题思路:(1)根据盖斯定律,结合图象分析计算得到所需热化学方程式;
(2)反应Ⅲ在温度为T1时建立平衡后(由图2可知:溶液pH不随时间变化而变化),迅速上升到T2并维持温度不变,平衡逆向移动,溶液pH增大,在T2时又建立新的平衡,根据平衡移动原理分析;
(3)①依据图象分析,结合反应速率V=[△c/△t]计算氢气反应速率;
②根据到达平衡的时间减少,氢气也减少,说明改变了二氧化碳的浓度,先计算出曲线 I达到平衡时的平衡常数,根据温度不变,平衡常数不变再计算出曲线II达到平衡时CO2的浓度;
③依据反应平衡标志是正逆反应速率相同,各组分含量不变分析选项.(1)由图示可知,将两个反应相加可得2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-134 kJ/mol;故答案为:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-134 kJ/mol;(2)反应Ⅲ在温度为T1时建立平衡后...
点评:
本题考点: 热化学方程式;化学平衡的影响因素;化学平衡状态的判断;化学平衡的计算.
考点点评: 本题考查了热化学方程式书写方法,化学反应速率、化学平衡状态影响因素分析应用,平衡计算的理解应用,平衡常数计算分析,掌握基础是关键,题目难度中等.1年前查看全部
- 白色固体由(NH4)2CO3和NA2CO3·xH20组成.....
白色固体由(NH4)2CO3和NA2CO3·xH20组成.....
取混合物5.94g容于足量盐酸中生成气体22.4ML(标),另取5.94g与足量CA(OH)2共热,生成气体通入25ML,1MOL/L的H2SO4中,反应后用25ML,0.5MOL/LNAOH恰好中和,求X的值.
题不难,我怎么一直算不对啊,写下过程.30~ halffish1年前1
halffish1年前1 -
 leevago 共回答了17个问题
leevago 共回答了17个问题 |采纳率76.5%(NH4)2CO3:amol;Na2CO3.xH2O:bmol.
96a+(106+18x)b=5.94
a+b=22.4/22.4=1
2a+0.025*0.5=0.025*1*21年前查看全部
- 将一定量的(NH4)2CO3加热至150℃,使之完全分解,产生的混合气体对H2的相对密度为______.
 bjbobo1年前1
bjbobo1年前1 -
 mei1102 共回答了15个问题
mei1102 共回答了15个问题 |采纳率100%解题思路:先根据(NH4)2CO3分解求出混合气体的平均摩尔质量,然后利用密度之比等于摩尔质量之比.因N(NH4)2CO3发生反应:(NH4)2CO3 加热 . 2NH3↑+H2O↑+CO2↑ &nbs...
点评:
本题考点: 铵盐;化学方程式的有关计算.
考点点评: 本题结合铵盐的不稳定性,考查了平均摩尔质量的计算以及平均摩尔质量之比等于密度之比.1年前查看全部
- (2012•长宁区一模)将NaOH溶液加入到13.2g含有(NH4)2SO4与(NH4)2CO3的固体混合物中,充分反应
(2012•长宁区一模)将NaOH溶液加入到13.2g含有(NH4)2SO4与(NH4)2CO3的固体混合物中,充分反应后,可收集到标准状况下密度为17g/22.4L的气体,体积不可能是( )
A.4.68L
B.4.3 L
C.6.16L
D.5.2L lmzhen20021年前1
lmzhen20021年前1 -
 折翅的蚂蚁 共回答了13个问题
折翅的蚂蚁 共回答了13个问题 |采纳率84.6%解题思路:氢氧化钠与(NH4)2SO4与(NH4)2CO3的固体混合物,产生的密度为[17/22.4]g/L的气体为氨气,若13.2g全部为(NH4)2CO3,铵盐全部反应产生的氨气的体积最大,根据n=[m/M]计算13.2g(NH4)2CO3的物质的量,再根据氮元素守恒计算氨气的物质的量,根据V=nVm计算氨气的体积,由于氢氧化钠的量不确定,故生成的氨气的体积体积小于最大值.若13.2g全部为(NH4)2CO3,铵盐全部反应产生的氨气的体积最大,13.2g(NH4)2CO3的物质的量为[13.2g/96g/mol]=[13.2/96]mol,标准状况下生成氨气的体积为[13.2/96]mol×2×22.4L/mol=6.16L,
由于为NH4)2SO4与(NH4)2CO3的固体混合物,且铵盐不一定完全反应,故生成氨气的体积一定小于6.16L,
故选C.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的有关计算,难度不大,注意根据极限法进行解答,注意铵盐不一定完全反应,故氨气的最小体积极值不能根据硫酸铵计算.1年前查看全部
- 现有①Al2O3 ②Na2CO3 ③(NH4)2CO3 ④Al(OH)3四种物质,其中既能
现有①Al2O3 ②Na2CO3 ③(NH4)2CO3 ④Al(OH)3四种物质,其中既能与盐酸反应,又能与NaOH溶液反应的是( )
A.①②
B.②④
C.①②③
D.①③④ qdxxw1年前1
qdxxw1年前1 -
 珊月儿 共回答了21个问题
珊月儿 共回答了21个问题 |采纳率81%解题思路:根据物质间的反应进行判断,中学常见的既能与酸反应又能与碱反应的物质主要有:①两性物质:Al2O3、Al(OH)3、氨基酸、蛋白质等;②多元弱酸的酸式盐;③弱酸的铵盐及其酸式盐;④某些具有两性的金属等,以此解答本题.①Al2O3是两性氧化物,既能和盐酸反应生成盐和水,也能和氢氧化钠溶液反应生成盐和水,故①符合;
②Na2CO3能与盐酸反应得,但不能与NaOH反应,故②不符合;
③(NH4)2CO3属于弱酸的铵盐,既能跟NaOH溶液反应,又能跟盐酸反应,故③符合;
④Al(OH)3属于两性氢氧化物,既能与盐酸反应,又能与NaOH反应,故④符合,
故选D.点评:
本题考点: 两性氧化物和两性氢氧化物.
考点点评: 本题考查元素化合物的性质,掌握物质的性质是解答本题的关键,注意归纳总结中学常见能与酸、碱反应的物质.1年前查看全部
- 将下列物质加入水中写出主要离子方程式:冰醋酸,NaHSO4,Na2CO3,Al2S3,NaHCO3,(NH4)2CO3
 goldwise1年前2
goldwise1年前2 -
 秋天的冷秋 共回答了24个问题
秋天的冷秋 共回答了24个问题 |采纳率79.2%1 CH3COOH = H(+) + CH3COO(-) 可逆
2 NaHSO4 = Na(+) + HSO4(-)
HSO4(-) = H(+) + SO4(2-) 可逆
3 Na2CO3 = 2Na(+) + CO3(2-)
CO3(2-) + H2O = HCO3(-) + OH(-) 可逆
HCO3(-) + H2O = H2CO3 + OH(-) 可逆
4 Al2S3 + 6H2O = 2Al(OH)3(s) + 3H2S(g)
5 NaHCO3 = Na(+) + HCO3(-)
HCO3(-) + H2O = H2CO3 + OH(-) 可逆
HCO3(-) = H(+) + CO3(2-) 可逆
6 (NH4)2CO3 = 2NH4(+) + CO3(2-)
CO3(2-) + H2O = HCO3(-) + OH(-) 可逆
HCO3(-) + H2O = H2CO3 + OH(-) 可逆
NH4(+) + H2O = NH3.H2O + H(+) 可逆1年前查看全部
- 在25℃时,浓度均为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,测得其
在25℃时,浓度均为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,测得其中c(NH4+)分别为a mol/L、b mol/L、c mol/L,则下列判断正确的是( )
A. a>b>c
B. a>c>b
C. b>a>c
D. c>a>b 海浪舞1年前2
海浪舞1年前2 -
 liying464276881 共回答了17个问题
liying464276881 共回答了17个问题 |采纳率100%解题思路:如果不考虑其他离子的影响,每摩尔物质都含有2 molNH4+,但溶液中CO32-的水解促进NH4+的水解,Fe2+的水解抑制NH4+的水解,以此解答该题.(NH4)2CO3溶液中CO32-的水解促进NH4+的水解,(NH4)2Fe(SO4)2溶液中Fe2+的水解抑制NH4+的水解,则等浓度时,c(NH4+)大小顺序应为c>a>b,
故选D.点评:
本题考点: 影响盐类水解程度的主要因素.
考点点评: 本题考查盐类水解的应用,侧重于盐类水解因素的考查,题目难度不大,注意把握影响因素,能正确判断水解平衡的移动方向.1年前查看全部
- (2012•北海)下图中A、B、C、D、E分别是Na2CO3、(NH4)2CO3、BaCl2、H2SO4、NaOH五种溶
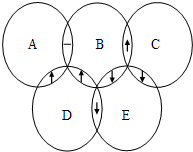 (2012•北海)下图中A、B、C、D、E分别是Na2CO3、(NH4)2CO3、BaCl2、H2SO4、NaOH五种溶液中的一种,两圆的相交部分为两种溶液反应出现的主要实验现象(“↓”表示有沉淀生成、“↑”表示有气体生成、“-”表示无明显现象).请推断:
(2012•北海)下图中A、B、C、D、E分别是Na2CO3、(NH4)2CO3、BaCl2、H2SO4、NaOH五种溶液中的一种,两圆的相交部分为两种溶液反应出现的主要实验现象(“↓”表示有沉淀生成、“↑”表示有气体生成、“-”表示无明显现象).请推断:
(1)B是______溶液;C溶液溶质的俗名:______.
(2)写出D与E反应的化学方程式:______. luluanan1年前1
luluanan1年前1 -
 相信音乐 共回答了17个问题
相信音乐 共回答了17个问题 |采纳率94.1%解题思路:根据题干中的叙述可知:所列物质间的反应是复分解反应,故可以采用复分解反应的发生条件对相关的反应进行分析,而后利用图示中物质反应的现象对应判断即可;依据 Na2CO3、(NH4)2CO3、BaCl2、H2SO4、NaOH五种物质中的相互反应是复分解反应,所以利用复分解反应的发生条件可以对物质间的反应进行判断,依据是否生成气体和沉淀得到如下的反应情况:
Na2CO3 (NH4)2CO3 BaCl2 H2SO4 NaOH
Na2CO3 --- --- ↓ ↑ ---
(NH4)2CO3 --- --- ↓ ↑ ↑
BaCl2 ↓ ↓ --- ↓ ---
H2SO4 ↑ ↑ ↓ --- ---
NaOH -- ↑ --- --- ---对应图中的信息可知:A是氢氧化钠的溶液,B是硫酸溶液,C是碳酸钠溶液,D是碳酸铵,E是氯化钡溶液;
(1)由分析可知B是硫酸的溶液,C溶液溶质是碳酸钠俗名纯碱;
(2)写出D与E反应的化学方程式为:(NH4)2CO3+BaCl2=BaCO3↓+2NH4Cl;
故答案为:(1)硫酸;纯碱;(2)(NH4)2CO3+BaCl2=BaCO3↓+2NH4Cl;点评:
本题考点: 物质的鉴别、推断.
考点点评: 本题考查无机物的推断,题目难度不大,本题注意根据物质的性质结合反应现象进行推断,学习中注意相关基础知识的积累.1年前查看全部
- (2013•镇江)有一包白色固体粉末,可能含有CuSO4、Na2SO4、(NH4)2CO3、BaCl2、NH4Cl、KC
(2013•镇江)有一包白色固体粉末,可能含有CuSO4、Na2SO4、(NH4)2CO3、BaCl2、NH4Cl、KCl中的一种或几种.现做如下实验:
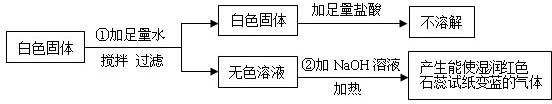
根据上述实验现象判断:
(1)白色固体中一定不含______,一定含有______,可能含有______.
(2)写出①中化学反应方程式______.
(3)写出②中化学反应方程式NaOH+NH4Cl
NaCl+NH3↑+H2O△ .NaOH+NH4Cl.
NaCl+NH3↑+H2O△ . 喻炜1年前1
喻炜1年前1 -
 gaoting1166 共回答了26个问题
gaoting1166 共回答了26个问题 |采纳率88.5%解题思路:根据题目给出的流程图和信息:由步骤①可知,白色固体中一定没有硫酸铜,因为硫酸铜溶于水呈蓝色;过滤得到的白色固体加入足量的盐酸不溶解,因此白色固体中一定有硫酸钡,原物质中一定有了氯化钡和硫酸钠,就一定不能再有碳酸铵了,因为碳酸钡溶于盐酸,此白色固体是硫酸钡,说明原混合物中一定有Na2SO4、BaCl2;由步骤②可知,加入氢氧化钠溶液加热,产生了能使湿润的红色石蕊试纸变蓝的气体,此气体是氨气,因此原白色固体中一定含有氯化铵;KCl可能有也可能没有.硫酸钠和氯化钡反应生成硫酸钡白色沉淀和氯化钠,配平即可;氢氧化钠和氯化铵在加热的条件下反应生成氯化钠和水和二氧化碳.(1)由步骤①可知,白色固体中一定没有硫酸铜,因为硫酸铜溶于水呈蓝色;过滤得到的白色固体加入足量的盐酸不溶解,因此白色固体中一定有硫酸钡,原物质中一定有了氯化钡和硫酸钠,就一定不能再有碳酸铵了,因为碳酸钡溶于盐酸,此白色固体是硫酸钡,说明原混合物中一定有Na2SO4、BaCl2;由步骤②可知,加入氢氧化钠溶液加热,产生了能使湿润的红色石蕊试纸变蓝的气体,此气体是氨气,因此原白色固体中一定含有氯化铵;KCl可能有也可能没有;故答案为:CuSO4、(NH4)2CO3;Na2SO4、BaCl2、NH4Cl;KCl
(2)硫酸钠和氯化钡反应生成硫酸钡白色沉淀和氯化钠,配平即可,故答案为:Na2SO4+BaCl2=BaSO4↓+2NaCl
(3)氢氧化钠和氯化铵在加热的条件下反应生成氯化钠和水和氨气,故答案为:NaOH+NH4Cl
△
.
NaCl+NH3↑+H2O点评:
本题考点: 物质的鉴别、推断;酸的化学性质;碱的化学性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本考点属于物质的推断题,同时也考查了化学式和化学方程式的书写等,是通过对实验方法和过程的探究,在比较鉴别的基础上,得出了正确的实验结论.本考点是中考的重要内容之一,一般有两种类型:一是图框式推断题;二是文字描述型推断题;本题属于第一种类型.不论哪一种类型,都是通过实验现象,从而得出物质的组成.此考点主要出现在填空题和实验题中.1年前查看全部
- 25℃时,在浓度均为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2、三种溶液中,若测
25℃时,在浓度均为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2、三种溶液中,若测得其中c(NH4+)分别为a、b、c(单位为mol/L),则下列判断正确的是( )
A. a=b=c
B. b>a>c
C. c>a>b
D. a>c>b 阿adsl1年前2
阿adsl1年前2 -
 辽宁围脖儿 共回答了13个问题
辽宁围脖儿 共回答了13个问题 |采纳率92.3%解题思路:如果不考虑其他离子的影响,每摩尔物质都含有2 molNH4+,但溶液中CO32-的水解促进NH4+的水解,Fe2+的水解抑制NH4+的水解,以此解答该题.溶液中CO32-的水解促进NH4+的水解,Fe2+的水解抑制NH4+的水解,则等浓度时,c(NH4+)大小顺序应为c>a>b,
故选C.点评:
本题考点: 盐类水解的应用.
考点点评: 本题考查盐类水解的应用,侧重于盐类水解因素的考查,题目难度不大,注意把握影响因素,能正确判断水解平衡的移动方向.1年前查看全部
- 在25℃时,浓度均为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,测得其
在25℃时,浓度均为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,测得其中c(NH4+)分别为a mol/L、b mol/L、c mol/L,则下列判断正确的是( )
A. a>b>c
B. a>c>b
C. b>a>c
D. c>a>b 我是xiao1年前1
我是xiao1年前1 -
 lovehua 共回答了22个问题
lovehua 共回答了22个问题 |采纳率86.4%解题思路:如果不考虑其他离子的影响,每摩尔物质都含有2 molNH4+,但溶液中CO32-的水解促进NH4+的水解,Fe2+的水解抑制NH4+的水解,以此解答该题.(NH4)2CO3溶液中CO32-的水解促进NH4+的水解,(NH4)2Fe(SO4)2溶液中Fe2+的水解抑制NH4+的水解,则等浓度时,c(NH4+)大小顺序应为c>a>b,
故选D.点评:
本题考点: 影响盐类水解程度的主要因素.
考点点评: 本题考查盐类水解的应用,侧重于盐类水解因素的考查,题目难度不大,注意把握影响因素,能正确判断水解平衡的移动方向.1年前查看全部
- 一固体混合物可能含有CaCO3、Na2CO3、(NH4)2CO3、Na2SO4、CuSO4 ,进行下列实验操作时发生以下
一固体混合物可能含有CaCO3、Na2CO3、(NH4)2CO3、Na2SO4、CuSO4 ,进行下列实验操作时发生以下现象:
(1)溶于水得到无色溶液.
(2)溶液中加入BaCl2溶液,得到白色沉淀,再加入盐酸,沉淀溶解.
(3)溶液的焰色反应呈黄色.
根据上述实验事实判断,哪些物质一定存在?哪些物质一定不存在?哪些物质可能存在?说明理由. hcjjy91年前1
hcjjy91年前1 -
 LIGANG1000 共回答了12个问题
LIGANG1000 共回答了12个问题 |采纳率91.7%由(1)得出一定无CaCO3、CuSO4(CaCO3不溶于水,Cu2+溶液为有色)
由(2)得出一定无Na2SO4,(因为BaSO4不溶于水)
由(3)得出一定有Na2CO3,(Na的焰色反应为黄色),可能有(NH4)2CO31年前查看全部
- 有一包白色粉末,可能是CuSO4、CaCO3、BaCl2、NaCl、Na2SO4、(NH4)2CO3中的一种或几种,为证
有一包白色粉末,可能是CuSO4、CaCO3、BaCl2、NaCl、Na2SO4、(NH4)2CO3中的一种或几种,为证明其组成进行如下实验:
(1)取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液,则白色沉淀可能是______,原混合物中一定不含有______;
(2)向实验(1)滤出的白色沉淀中加入足量的盐酸,沉淀部分溶解,并产生无色气体,则原
混合物中一定含有______;
(3)向实验(1)的滤液中加入足量的氢氧化钠溶液,有剌激性气味气体放出,证明实验(1)的白色沉淀一定有______;
(4)向实验(3)后的溶液中加入稀硝酸酸化,再加入足量的硝酸钡,发现没有沉淀产生,然后加入硝酸银溶液,出现了白色沉淀,有人由此得出原混合物中一定含的氯化钠,你认为______(填“正确”“不正确”),理由______.
(5)实验结论是______. myddxx1年前7
myddxx1年前7 -
 asd1023 共回答了14个问题
asd1023 共回答了14个问题 |采纳率100%解题思路:(1)根据碳酸钙不溶于水,钡离子和碳酸根离子、硫酸根离子会生成沉淀进行分析,
根据铜离子在溶液中显蓝色进行分析.
(2)根据碳酸钙和碳酸钡会溶于酸进行分析,
(3)根据混合物中会与碱反应放出刺激性气味的气体进行分析,
(4)根据(2)中的判断,可知混合物中的成分在反应时会引入氯离子进行分析.
(5)根据上面的反应现象确定混合物的成分.(1)碳酸钙不溶于水,钡离子和碳酸根离子、硫酸根离子会生成碳酸钡沉淀和硫酸钡沉淀,所以白色沉淀可能是一种或多种,故答案为:CaCO3、BaCO3、BaSO4,
沉淀是白色、滤液是无色,铜离子在溶液中显蓝色,故答案为:CuSO4,
(2)碳酸钙沉淀和碳酸钡沉淀都会溶于酸,硫酸钡沉淀不溶于酸,白色沉淀中加入足量的盐酸,沉淀部分溶解,并产生无色气体,所以沉淀中一定有硫酸钡(没有溶解的那部分),故答案为:BaCl2、Na2SO4,
(3)混合物中的物质和氢氧化钠反应会生成刺激性气体的,只有碳酸铵,碳酸根离子就会与钡离子生成碳酸钡沉淀,故答案为:BaCO3,
(4)虽然加入硝酸银会生成氯化银沉淀,但是氯离子是原来就有的,还是反应引入的不能确定,故答案为:不正确,因为BaCl2与Na2SO4反应会生成NaCl,
(5)根据(1)中的现象可以确定一定不存在硫酸铜,根据(2)中的现象可以确定一定存在氯化钡和硫酸钠,根据(3)中的现象知道一定存在碳酸铵,(4)中的现象不能确定氯化钠的存在.故答案为:一定有BaCl2、Na2SO4、(NH4)2CO3,一定无CuSO4,可能有NaCl、CaCO3.点评:
本题考点: 酸、碱、盐的鉴别;酸碱盐的溶解性.
考点点评: 在解此类题时,根据题中的现象确定一定存在的物质,和不存在的物质,对于不能判断是否存在的,就是可能存在.1年前查看全部
- 为什么NH4HCO3和(NH4)2CO3不会双水解?
 cbyeah1年前3
cbyeah1年前3 -
 jinhao128 共回答了20个问题
jinhao128 共回答了20个问题 |采纳率90%NH4+水解生成的碱,即NH3·H2O易溶于水,不利于双水解的进行;而像碳酸铝这类物质,生成的碱会沉淀,有利于双水解的正向进行.1年前查看全部
- NH4HCO3与(NH4)2CO3的区别是什么?
 XWDD1年前1
XWDD1年前1 -
 只为永远 共回答了19个问题
只为永远 共回答了19个问题 |采纳率100%最主要的区别就的NH4HCO3较稳定,易得到纯净的碳酸氢铵晶体
但(NH4)2CO3不易得到纯净物,它会分解产生碳酸氢铵、氨基乙酸铵等1年前查看全部
- 常温下,下列叙述正确的是A,同浓度的下列溶液中,1.NH4AL(SO4)2、2.NH4CL、3,(NH4)2CO3、4,
常温下,下列叙述正确的是
A,同浓度的下列溶液中,1.NH4AL(SO4)2、2.NH4CL、3,(NH4)2CO3、4,NH3.H2O由大到小的顺序是1>2>3>4
B,若1ml pH=1的硫酸与100mlNaOH溶液混合后溶液的pH=7,则NaOH溶液pH=11.3
C,常温下将25ml0.2mol/L的盐酸与100ml0.1mol/l的氨水混合,所得溶液中:c(NH4+)>c(Cl-)>c(NH3.H2O)>c(OH-)>c(H+)
D,常温下,向醋酸溶液中加入水稀释后,溶液中c(CH3COO-)/c(CH3COOH).c(OH-)不变 诸葛肚1年前1
诸葛肚1年前1 -
 风筝smile 共回答了16个问题
风筝smile 共回答了16个问题 |采纳率81.3%A、按照H+浓度由大到小是1>2>3>4
B、计算得出PH=11.3
C、c(NH3.H2O)最大
D、由水解方程可以看出比值变小1年前查看全部
- 在(NH4)2CO3中,有一摩尔(NH4)2,请问有多少摩尔的NH4离子?
在(NH4)2CO3中,有一摩尔(NH4)2,请问有多少摩尔的NH4离子?
为什么? 东海白帆巷1年前4
东海白帆巷1年前4 -
 其叶青青 共回答了17个问题
其叶青青 共回答了17个问题 |采纳率88.2%有2摩尔NH4+.1年前查看全部
- 有四种物质:①NaHCO3、②Al(OH)3、③(NH4)2CO3、④,其中既能跟盐酸,又能跟NaOH溶液反应的有(
有四种物质:①NaHCO3、②Al(OH)3、③(NH4)2CO3、④
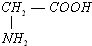 ,其中既能跟盐酸,又能跟NaOH溶液反应的有( )
,其中既能跟盐酸,又能跟NaOH溶液反应的有( )
A.只有②④
B.只有①②
C.只有①②③
D.①②③④ 都拦阻不了1年前1
都拦阻不了1年前1 -
 sunshicheng 共回答了17个问题
sunshicheng 共回答了17个问题 |采纳率88.2%解题思路:根据物质间的反应进行判断,中学常见的既能与酸反应又能与碱反应的物质主要有:①两性物质:Al2O3、ZnO、Al(OH)3、Zn(OH)2、氨基酸、蛋白质等;②多元弱酸的酸式盐:NaHCO3、KHS、KHSO3、NaH2PO4等;③弱酸的铵盐及其酸式盐:(NH4)2S、NH4HS、(NH4)2CO3、NH4HCO3、CH3COONH4等;④某些具有两性的金属:Zn、Al等;⑤某些非金属:Si、S等;⑥其它一些物质.如:a、某些盐类物质既与酸反应,又与碱反应;b、个别酸性氧化物SiO2;c、具有还原性的无氧酸:H2S、HI等与氧化性酸反应、与碱反应;d、具有氧化性酸:浓H2SO4、HNO3等与还原性酸反应、与碱反应.以此解答本题.①NaHCO3属于弱酸酸式盐,能与元素反应生成二氧化碳,与氢氧化钠反应生成碳酸钠,故符合;
②Al(OH)3是两性氢氧化物,与盐酸反应生成氯化铝,与氢氧化钠反应生成偏铝酸钠,故符合;
③(NH4)2CO3属于弱酸的铵盐,与元素反应生成二氧化碳,与氢氧化钠反应生成氨气,故符合;
④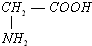 为氨基酸,能与盐酸反应生,与氢氧化钠反应,故符合;
为氨基酸,能与盐酸反应生,与氢氧化钠反应,故符合;
故选D.点评:
本题考点: 两性氧化物和两性氢氧化物;钠的重要化合物;氨基酸、蛋白质的结构和性质特点.
考点点评: 本题考查与酸和碱都能发生反应的物质,常见的物质有铝、氧化铝、氢氧化铝、多元弱酸的酸式盐(如碳酸氢钠、硫氢化钠等)、蛋白质、氨基酸.1年前查看全部
- 用二氧化碳和氨气为原料制碳酸氢铵,是先通CO2进水还是先通氨气.CO2为什么能和(NH4)2CO3反应
 edcrfvtgb11年前2
edcrfvtgb11年前2 -
 awyk81 共回答了12个问题
awyk81 共回答了12个问题 |采纳率100%由于氨气的溶解度(1体积水溶解700体积氨气)比二氧化碳溶解度(1体积水溶解1体积二氧化碳)大得多,所以先通氨气,这样氨气溶解得多,才能与更多的二氧化碳反应,生成碳酸氢铵的产量更高.由于碳酸是二元酸(1个碳酸分子最多可电离2个氢离子),所以碳酸的盐有正盐和酸式盐之分,如碳酸钠Na2CO3为正盐,碳酸氢钠NaHCO3为酸式盐.正盐加酸可以转化为酸式盐:(NH4)2CO3+H2O+CO2=2NH4HCO3.后通二氧化碳也有利于使二氧化碳过量,最终生成酸式盐.1年前查看全部
- 常温下物质的量浓度相等的(NH4)2CO3 (NH4)2SO4 NH4Cl三种溶液,问水的电离程度
常温下物质的量浓度相等的(NH4)2CO3 (NH4)2SO4 NH4Cl三种溶液,问水的电离程度
(NH4)2CO3>(NH4)2SO4>NH4Cl 对不?留下你的答案 啊牙仔1年前4
啊牙仔1年前4 -
 scoripio 共回答了19个问题
scoripio 共回答了19个问题 |采纳率94.7%纯水的电离平衡极其微弱
H20=可逆号=H+ +OH-
1.外加酸(或碱)溶液,抑制水的电离
2.外加强碱弱酸盐(或强酸弱碱盐)(弱酸弱碱盐)由于离子的水解促进水的电离.提高水的电离成都的提高.
水解越强烈对水的电程度提高越明显.
上述题意里:(NH4)2CO3阴、阳离子都水解,因此水的电离度最高.
等浓度的(NH4)2SO4和 NH4Cl相比,前者铵根离子浓度大,水解较剧烈(阴离子不水解),后者溶液里pH较高水解较弱.
所以:你的答案正确
(NH4)2CO3>(NH4)2SO4>NH4Cl1年前查看全部
- 将(NH4)2CO3固体加热,计算在150℃时所得混合气体密度是相同条件下氢气密度的多少倍
 badbird1年前3
badbird1年前3 -
 nancy813 共回答了14个问题
nancy813 共回答了14个问题 |采纳率85.7%(NH4)2CO3=2NH3+H2O+CO2
平均相对分子质量=(17*2+18+44)/4=24
所得混合气体密度是相同条件下氢气密度的24/2=12倍1年前查看全部
- 向一定质量的(NH4)2CO3和(NH4)2SO4的固体混合物中,加入足量的NaOH固体,共热,可得到标准状况下4.48
向一定质量的(NH4)2CO3和(NH4)2SO4的固体混合物中,加入足量的NaOH固体,共热,可得到标准状况下4.48L气体;将反应剩余物溶于足量BaCl2溶液中,过滤,干燥,可得到白色沉淀22.4g,假设涉及各步反应均无损耗.试计算:原混合物中(NH4)2CO3和(NH4)2SO4的物质的量之比.(请写出计算过程)
 夫敢ww攻1年前1
夫敢ww攻1年前1 -
 月影银狼 共回答了19个问题
月影银狼 共回答了19个问题 |采纳率89.5%解题思路:加入足量的NaOH固体,共热,可得到标准状况下4.48L气体为氨气,根据n=
计算氨气的物质的量.反应剩余的固体为碳酸钠、硫酸钠,溶于足量BaCl2溶液中,过滤,干燥,可得到白色沉淀22.4g为碳酸钡、硫酸钡,令原混合物中碳酸铵、硫酸铵的物质的量分别为xmol、ymol,根据氮元素守恒以及碳酸钡、硫酸钡的质量之和列方程,计算x、y的值,据此解答.V Vm 加入足量的NaOH固体,共热,可得到标准状况下4.48L气体为氨气,氨气的物质的量=[4.48L/22.4L/mol]=0.2mol,反应剩余的固体为碳酸钠、硫酸钠,溶于足量BaCl2溶液中,过滤,干燥,可得到白色沉淀22.4g为碳酸钡、硫酸钡,令原混合物中碳酸铵、硫酸铵的物质的量分别为xmol、ymol,则:
2x+2y=0.2
197x+233y=22.4
解得x=0.025,y=0.075,
故原混合物中(NH4)2CO3和(NH4)2SO4的物质的量之比为0.025mol:0.075mol=1:3,
答:原混合物中(NH4)2CO3和(NH4)2SO4的物质的量之比为1:3.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的有关计算、铵盐的性质等,难度中等,注意根据守恒思想进行的计算.1年前查看全部
- 标原子团的化学价.CuSO4 KMnO4 (NH4)2CO3 AgNO3 NaOH
标原子团的化学价.CuSO4 KMnO4 (NH4)2CO3 AgNO3 NaOH
标原子团的化学价.CuSO4 KMnO4 (NH4)2CO3 AgNO3 NaOH 求出KCLO3中的CL元素的化合价 橙色光芒1年前1
橙色光芒1年前1 -
 行云流水520 共回答了21个问题
行云流水520 共回答了21个问题 |采纳率90.5%-2 -1 +1 -2 -1 -1 +51年前查看全部
- 有ABCDEF六瓶未知溶液有A、B、C、D、E、F六瓶未知溶液,他们是MgSO4、BaCl2、(NH4)2CO3、AgN
有ABCDEF六瓶未知溶液
有A、B、C、D、E、F六瓶未知溶液,他们是MgSO4、BaCl2、(NH4)2CO3、AgNO3、HCl和NaOH.为了鉴别,各取少许溶液,进行两两混合实验,结果如下表.表中"↓"表示有沉淀生成或生成微溶性物质;"↑"表示有气体生成;"—"表示观察不到明显现象.
A B C D E F
A ↑ ↓ ↓ ↑ ↓
B ↑ ↓ — — ↓
C ↓ ↓ ↓ — ↓
D ↓ — ↓ — ↓
E ↑ — — — ↓
F ↓ ↓ ↓ ↓ ↓
如何确定F是硝酸银?
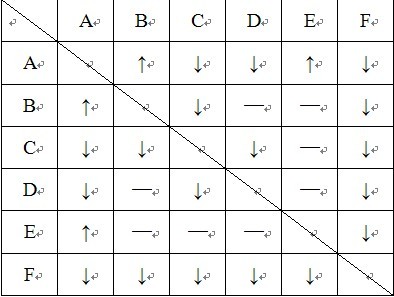
 hjh5116211年前3
hjh5116211年前3 -
 fatcathanhan 共回答了19个问题
fatcathanhan 共回答了19个问题 |采纳率100%看表格时只要看一半就可以了,此类题目要注意每个物质与其它溶液混合时的现象整理.
F与其余5种溶液混合,都有沉淀,------F一定是AgNO3
能产生气体的只有A,且A与B、E生成气体-------所以,A一定是(NH4)2CO3,B、E是HCl、NaOH
B除了与A生成气体,与2个生成沉淀-------B是NaOH
E仅与A生成气体,与F生成沉淀--------E是HCl
C、D是MgSO4、BaCl2
C与B生成沉淀-----------C是MgSO4,所以D是BaCl21年前查看全部
- 下列物质①NaHCO3 ②(NH4)2SO4 ③Al2O3 ④(NH4)2CO3 ⑤Mg(OH)2中,既可以和盐酸反应也
下列物质①NaHCO3 ②(NH4)2SO4 ③Al2O3 ④(NH4)2CO3 ⑤Mg(OH)2中,既可以和盐酸反应也可以和Ba(OH)2溶液反应的是( )
A.①③④
B.①②③④
C.②③④
D.①③④⑤ 黛粉女孩1年前1
黛粉女孩1年前1 -
 与非门xp 共回答了19个问题
与非门xp 共回答了19个问题 |采纳率84.2%解题思路:①NaHCO3可以与盐酸、氢氧化钡发生反应;
②(NH4)2SO4属于铵盐,可以和强碱之间反应,水解显示酸性;
③Al2O3两性氢氧化物,既能和强酸又能和强碱之间反应;
④(NH4)2CO3 属于铵盐,可以和强碱之间反应,也能和酸反应;
⑤Mg(OH)2是碱,能与盐酸反应.①NaHCO3可以与盐酸反应生成氯化钠、水以及二氧化碳,还可以和氢氧化钡反应生成碳酸钡和碳酸钠,故①正确;
②(NH4)2SO4属于铵盐,强碱之间能反应,且水解显示酸性,与盐酸不反应,故②错误;
③Al2O3两性氢氧化物,既能和强酸又能和强碱发生反应,故③正确;
④(NH4)2CO3 属于铵盐,可以和氢氧化钡反应生成碳酸钡、水和氨气,也能和盐酸反应生成氯化铵、水和二氧化碳,故④正确;
⑤Mg(OH)2是碱,能与盐酸反应,与碱不反应,故⑤错误;
故既可以和盐酸反应也可以和Ba(OH)2溶液反应的是:①③④,
故选A.点评:
本题考点: 两性氧化物和两性氢氧化物.
考点点评: 本题考查了物质的性质,难度中等.明确物质的性质是解本题的关键.1年前查看全部
- 下列物质①NaHCO3 ②(NH4)2SO4 ③Al2O3 ④(NH4)2CO3 ⑤Mg(OH)2中
下列物质①NaHCO3 ②(NH4)2SO4 ③Al2O3 ④(NH4)2CO3 ⑤Mg(OH)2中,既可以和盐酸反应也可以和NaOH溶液反应的是( )
A.①③④
B.①②③④
C.②③④
D.①③④⑤ ctsacyl1年前1
ctsacyl1年前1 -
 灵魂飞鸟 共回答了18个问题
灵魂飞鸟 共回答了18个问题 |采纳率94.4%解题思路:根据物质间的反应进行判断,中学常见的既能与酸反应又能与碱反应的物质主要有:
①两性物质:Al2O3、ZnO、Al(OH)3、Zn(OH)2、氨基酸、蛋白质等;
②多元弱酸的酸式盐:NaHCO3、KHS、KHSO3、NaH2PO4等;
③弱酸的铵盐及其酸式盐:(NH4)2S、NH4HS、(NH4)2CO3、NH4HCO3、CH3COONH4等;
④某些具有两性的金属:Zn、Al等;
⑤某些非金属:Si、S等;
⑥其它一些物质.如:a、某些盐类物质既与酸反应,又与碱反应;
b、个别酸性氧化物SiO2;
c、具有还原性的无氧酸:H2S、HI等与氧化性酸反应、与碱反应;
d、具有氧化性酸:浓H2SO4、HNO3等与还原性酸反应、与碱反应.以此解答本题.①NaHCO3属于弱酸的酸式盐,能和盐酸反应生成氯化钠、水和二氧化碳,也能和氢氧化钠溶液反应生成碳酸钠,故正确;
②(NH4)2SO4属于强酸的铵盐,和盐酸不反应,故错误;
③Al2O3属于两性氧化物,既能和盐酸反应生成盐和水,也能和氢氧化钠溶液反应生成盐和水,故正确;
④(NH4)2CO3属于弱酸的铵盐,能和盐酸反应生成氯化铵、二氧化碳和水,也能和氢氧化钠溶液反应生成氨气,故正确;
⑤Mg(OH)2属于碱,中和盐酸反应生成氯化镁,故错误;
故选A.点评:
本题考点: 两性氧化物和两性氢氧化物;钠的重要化合物.
考点点评: 本题考查了物质间的反应,明确物质的性质是解本题关键,能根据物质的性质总结规律,难度中等.1年前查看全部
- 有关溶解平衡的问题将AgCl分别投入下列溶液中:①20ml 0.1mol/L的(NH4)2CO3溶液②40ml 0.03
有关溶解平衡的问题
将AgCl分别投入下列溶液中:
①20ml 0.1mol/L的(NH4)2CO3溶液
②40ml 0.03mol/L的HCl溶液
③50ml 0.03mol/L的AgNO3溶液
④30ml 0.02mol/L的CaCl2溶液
⑤10ml 蒸馏水
⑥30ml 0.2mol/L的NH4NO3溶液
AgCl的溶解度由大到小的顺序是————
①>⑥>⑤>②=③>④ 当没来过1年前1
当没来过1年前1 -
 捍东628 共回答了20个问题
捍东628 共回答了20个问题 |采纳率95%在水中AgCl存在溶解平衡(注:第一个方程式是双向箭头)
AgCl(s)===AgCl(aq)===Ag(+)+Cl(-)
(注:s表示为溶解的固体,aq表示已被溶解,但未电离的AgCl)
当溶液中存在Ag(+)或者Cl(-)时,溶解平衡逆向移动,AgCl的溶解度减小.溶液中Ag(+)和Cl(-)的浓度越大,逆向移动的程度越大,溶解度就越小.
以中性的水为参照,溶解度5>2=3>4
又由于有反应:(注:双向)
Ag(+)+2NH3·H2O===Ag(NH3)2(+)+H2O
NH4(+)+OH(-)===NH3·H2O
说明溶液碱性越强,NH4(+)的浓度越大,银离子越容易被消耗,AgCl的溶解度也越大.由于作为弱酸弱碱盐的(NH4)2CO3的PH值显然大于强酸弱碱盐的NH4NO3,所以与水比较有1>6>5
综上所述:1>6>5>2=3>41年前查看全部
- (2012•徐汇区二模)在25℃时,浓度均为0.5mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(
(2012•徐汇区二模)在25℃时,浓度均为0.5mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的三种溶液,测得各溶液的c(NH4+)分别为a、b、c(单位为mol/L),下列判断正确的是( )
A.a=b=c
B.a>b>c
C.a>c>b
D.c>a>b 漏点1年前1
漏点1年前1 -
 1375100 共回答了26个问题
1375100 共回答了26个问题 |采纳率69.2%解题思路:在三种溶液中铵根离子均会水解,铵根离子水解呈酸性.在(NH4)2CO3溶液中,由于碳酸根离子水解呈碱性,因此碳酸根离子的存在会促进铵根离子的水解,在(NH4)2Fe(SO4)2溶液中,由于亚铁离子水解也呈酸性,因此亚铁离子的存在会抑制铵根离子的水解,以此解答该题.加入与原水解离子的水解性质相同的,对原水解离子有抑制作用;加入与原水解离子的水解性质相反的,对原水解离子有促进作用.三种溶液中均存在下述水解平衡:NH4++H2O⇌NH3•H2O+H+,对于(NH4+)2CO3,因为CO32-+H+⇌HCO3-,使上述平衡向右移动,促进NH4+水解.对于(NH4+)2Fe(SO4)2,因为Fe2++2H2O⇌Fe(OH)2+2H+,因增大了C(H+),上述平衡受到抑制,平衡向左移动,所以c>a>b.
故选D.点评:
本题考点: 影响盐类水解程度的主要因素.
考点点评: 本题考查影响盐类水解的因素,侧重于盐类水解的原理以及影响因素的考查,题目难度不大,注意互促水解的特点.1年前查看全部
- 按根离子浓度相等时,(NH4)2CO3和(NH4)2SO4的浓度哪个大?
按根离子浓度相等时,(NH4)2CO3和(NH4)2SO4的浓度哪个大?
请说明理由 雪佛狼1年前4
雪佛狼1年前4 -
 anlypan 共回答了15个问题
anlypan 共回答了15个问题 |采纳率100%前者大.前者会发生双水解,相同浓度时,它的氨根浓度小1年前查看全部
- 在下列几种物质中①NaHCO3、②Al(OH)3、③(NH4)2CO3、④SiO2、⑤金属铝、⑥Al2O3其中跟HCl溶
在下列几种物质中①NaHCO3、②Al(OH)3、③(NH4)2CO3、④SiO2、⑤金属铝、⑥Al2O3其中跟HCl溶液和NaOH溶液都能发生反应的是( )
A.只有②④⑥
B.只有①⑤⑥
C.只有①②③⑤⑥
D.全部都可以 菊残1年前1
菊残1年前1 -
 c18ee 共回答了22个问题
c18ee 共回答了22个问题 |采纳率81.8%解题思路:根据Al、Al2O3、Al(OH)3、弱酸的酸式盐、弱酸对应的铵盐、蛋白质、氨基酸等既能跟NaOH溶液反应,又能跟盐酸反应来解答.①NaHCO3溶液能与酸反应生成二氧化碳气体,与碱反应生成碳酸钠,故①正确;
②Al(OH)3既能跟NaOH溶液反应,又能跟盐酸反应,故②正确;
③(NH4)2CO3溶液属于弱酸的铵盐溶液,既能跟NaOH溶液反应,又能跟盐酸,故③正确;
④SiO2只能与碱反应,不与酸反应(氢氟酸除外),故④错误;
⑤Al既能跟NaOH溶液反应,又能跟盐酸反应,故⑤正确;
⑥Al2O3既能跟NaOH溶液反应,又能跟盐酸反应,故⑥正确;
故选C.点评:
本题考点: 镁、铝的重要化合物.
考点点评: 本题考查物质的性质,明确物质的组成过构成来判断物质之间的反应是解答本题的关键,并注意在平时的学习中归纳规律来解答.1年前查看全部
- 有A B C D E F六瓶未知溶液,它们是MgSO4、BaCl2、(NH4)2CO3、AGNO3
有A B C D E F六瓶未知溶液,它们是MgSO4、BaCl2、(NH4)2CO3、AGNO3
有A B C D E F六瓶未知溶液,它们是MgSO4、BaCl2、(NH4)2CO3、AGNO3、HCL和NaOH.为了鉴明,各取少许溶液,进行两两混合实验,结果如下表.
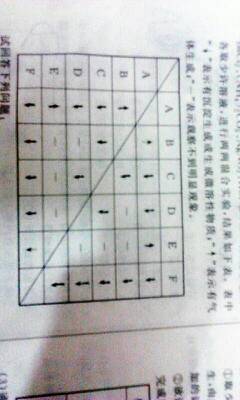
 罗纳尔更多1年前1
罗纳尔更多1年前1 -
 cyllang 共回答了21个问题
cyllang 共回答了21个问题 |采纳率85.7%第一步可以判断F为AgNO3,因为对谁都有沉淀.
第二步可以判断E为HCl
第三步可以判断A为NH4CO3
第四步可判断B为NaOH
C是MgSO4
D是BaCl21年前查看全部
- 在下列几种物质中①NaHCO3 ②Al(OH)3 ③(NH4)2CO3 ④苯酚钠 ⑤氨基乙酸 ⑥蛋白质,其中跟HCl和N
在下列几种物质中①NaHCO3 ②Al(OH)3 ③(NH4)2CO3 ④苯酚钠 ⑤氨基乙酸 ⑥蛋白质,其中跟HCl和NaOH溶液都发生反应的是( )
A.①②④⑥
B.①④⑤⑥
C.①②③④⑥
D.①②③⑤⑥ baker21年前0
baker21年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- .已知(NH4)2CO3=CO2+2NH3+H2O在密闭容器中,放入(NH4)2CO3和NaOH的混合物共a克,将容器加
.
已知(NH4)2CO3=CO2+2NH3+H2O在密闭容器中,放入(NH4)2CO3和NaOH的混合物共a克,将容器加热至200度,经充分反映后,排除其中的气体,冷却,称得剩余固体质量为b克,求容器中NH4)2CO3和NaOH各多少克? alianmylove1年前1
alianmylove1年前1 -
 好渔 共回答了20个问题
好渔 共回答了20个问题 |采纳率75%(NH4)2CO3+2NaOH=Na2CO3+2NH3+2H2O
所以剩余固体中一定有Na2CO3,然后就是哪个过量的问题了:
1,如果(NH4)2CO3过量,则NaOH不足,将会完全反应掉,而多余的(NH4)2CO3将会发生给出的反应:(NH4)2CO3=CO2+2NH3+H2O,生成的全部是气体,所以这种情况下剩余固体只有Na2CO3
2,如果NaOH过量,则(NH4)2CO3不足,而多余的NaOH不会进一步反应,所以这种情况下剩余固体为Na2CO3的NaOH
3,如果恰好完全反应,则剩余固体和第1种情况一样,只有Na2CO3
根据这几种情况,列方程计算即可(情况1,3可以合为一种)1年前查看全部
- 在下列物质 ①NaHCO3 ②MgCl2 ③Na2CO3 ④(NH4)2CO3中,与盐酸
在下列物质 ①NaHCO3②MgCl2 ③Na2CO3 ④(NH4)2CO3中,与盐酸和氢氧化钙溶液均可反应的是( )
A.③④
B.①③④
C.②
D.① yanxilou1年前1
yanxilou1年前1 -
 南山幽鹤 共回答了16个问题
南山幽鹤 共回答了16个问题 |采纳率93.8%解题思路:一般来说,两性化合物可与酸、碱反应,本题中与盐酸和氢氧化钙溶液均可反应的物质,应符合复分解反应条件,生成水、气体或沉淀,结合对应物质的性质解答该题.①NaHCO3是弱酸酸式盐,与酸反应得氢氧化钙反应得到碳酸钙沉淀,与盐酸反应得到氯化钠、二氧化碳与水,故①正确;
②MgCl2与盐酸不反应,故②错误;
③Na2CO3 可与氢氧化钙反应得到碳酸钙沉淀,与盐酸反应得到氯化钠、二氧化碳与水,故③正确;
④(NH4)2CO3可与氢氧化钙反应得到碳酸钙沉淀和氨气,与盐到氯化钠、二氧化碳与水,故④正确.
故选B点评:
本题考点: 钠的重要化合物;铵盐.
考点点评: 本题考查了物质的性质,为高频考点,侧重于双基的考查,难度不大,明确物质的性质是解本题的关键,注意归纳总结既能与酸又能与碱反应的物质.1年前查看全部
- 去除NaCl中的Na2CO3和(NH4)2CO3
去除NaCl中的Na2CO3和(NH4)2CO3
说明理由,去除碳酸氨选择加热或加强碱后再加热 chenxy1681年前1
chenxy1681年前1 -
 gaowen2018 共回答了15个问题
gaowen2018 共回答了15个问题 |采纳率93.3%先加NaOH再加热,生成的氨水挥发掉,然后再加盐酸与碳酸根反应生成二氧化碳,剩下的就是NaCl1年前查看全部
- 一瓶无色溶液其可能还有NaCl,Na2SO3,(NH4)2CO3,K2CO3
一瓶无色溶液其可能还有NaCl,Na2SO3,(NH4)2CO3,K2CO3
一瓶无色溶液其可能含有NaCl,Na2SO4,(NH4)2CO3,K2CO3,设计实验鉴别 清枫茉莉香1年前1
清枫茉莉香1年前1 -
 zaqwsx789 共回答了21个问题
zaqwsx789 共回答了21个问题 |采纳率100%加NaOH,有刺激性气味产生,则有(NH4)2CO3
加适量BaCl2,用稀硝酸酸化,沉淀不全溶解,则有Na2SO4
加适量BaCl2,再加AgNO3,有白色沉淀则有NaCl
做焰色反应,透过蓝色钴玻璃,有浅紫色火焰,则有K2CO31年前查看全部
- NH4+呈强碱还是弱碱性,为什么NH4Cl (NH4)2CO3都呈中性?
 ll_liang_pope1年前5
ll_liang_pope1年前5 -
 2786423 共回答了19个问题
2786423 共回答了19个问题 |采纳率94.7%NH4+水解..呈弱酸性...所以NH4Cl应该呈弱酸性..(NH4)2CO3是不是中性我也不太确定..如果它是中性的话..就是因为NH4+和CO32-的水解程度差不多..所以呈中性..
为什么都说NH4+呈弱碱性吖..搞不明白...1年前查看全部
大家在问
- 1英语翻译the period of notice required for the employee to leave
- 2limx→∞(sinx/x)的极限是0吗?为什么?
- 33头牛,7个羊一天共吃54千克草,5头牛和13个羊一天共吃96千克,一头牛和一个羊一 天共吃多少千克
- 4已知圆台的上下底面半径分别是2、5,且侧面面积等于两底面面积之和,求该圆台的母线长( )
- 5Let's go and look at_____ old hotel next to my house .It's v
- 6同种生物经分化形成不同的细胞,其内的蛋白质的种类和功能不同?正确吗
- 7I didn't know which dictionary was better ,so l took _____ A
- 8方便造句
- 9童年乐趣文中两处破折号的作用是什么
- 10Dennis is aschoolboy from Shanghai.He ——some New Year's reso
- 11某学生书写的下列化学方程式,其中正确的是 [ ]
- 12初中分班考考些什么?英语考吗
- 13一辆汽车从甲地开往乙地,3.4小时行驶了221千米.照这样的速度,又行驶了2.5小时到达乙地.甲乙两地相距多少千米?
- 14设f(1)=a,f(x)=asin(πx+α)+bcos(πx+α)其中abα∈R且a b ≠0,α≠kπ(k∈z)若f
- 15用中心角为120°,半径为6cm的扇形卷成一个圆锥(没有重叠),这个圆锥的表面积是______cm2.
