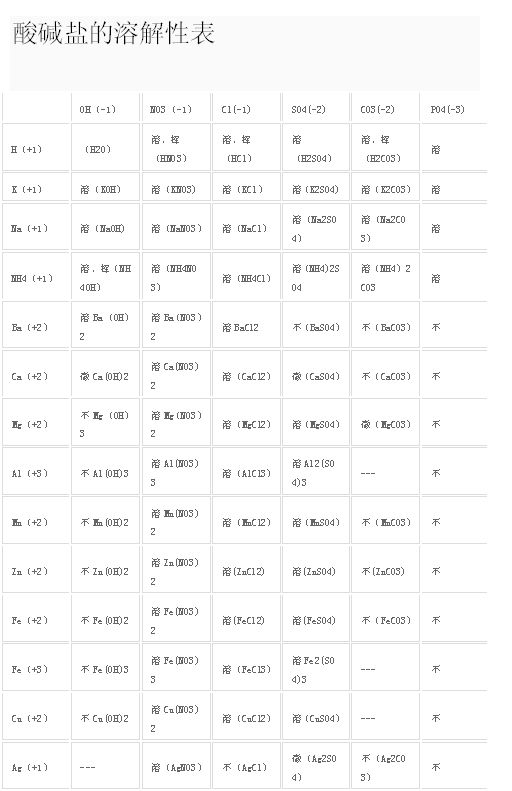
酸碱盐的溶解性表中哪些是盐?OH- NO3- CL- SO4- CO32- 这些里面哪些可以构成盐?
 3iatc4l2022-10-04 11:39:544条回答
3iatc4l2022-10-04 11:39:544条回答
已提交,审核后显示!提交回复
共4条回复
 xiaopohai1801 共回答了10个问题
xiaopohai1801 共回答了10个问题 |采纳率80%- 由金属离子(铵根离子)和酸根离子构成的是盐比如:NaCl,CaCO3,BaCl2等等
- 1年前
 杜新2伟 共回答了3个问题
杜新2伟 共回答了3个问题 |采纳率- 这么记物质是没用的,教你规律啦。盐是由酸根离子和金属离子组成的化合物。如NaCl,CaCO3,NaHCO3.如果不知什么是酸根,就问老师啦
- 1年前
 紫云烟雨梦 共回答了48个问题
紫云烟雨梦 共回答了48个问题 |采纳率- 盐 电离时产生金属离子(或铵根离子)和酸根离子的化合物
除了第一个 - 1年前
 醉心客zuixinke 共回答了875个问题
醉心客zuixinke 共回答了875个问题 |采纳率- 由金属离子(铵根离子)和酸根离子构成的是盐
硫酸盐,是含有硫酸根离子的,比如:Na2SO4,K2SO4,BaSO4等
硝酸盐是含有硝酸根离子的盐,如KNO3,NH4NO3,NaNO3,Ba(NO3)2
铵盐是含有铵根离子的盐,如NH4Cl,NH4NO3,(NH4)2SO4等等 - 1年前
相关推荐
- 酸碱盐的溶解性表是学习化学重要工具
酸碱盐的溶解性表是学习化学重要工具
、(8分)酸碱盐溶解性表是学习化学的重要工具.下表列出了部分酸碱盐在20℃的溶解性.你能利用此表完成下列的任务吗!
OH-
NO3-
Cl-
CO32-
SO42-
H+
--
溶、挥
溶、挥
溶、挥
溶
Na+
溶
溶
溶
溶
溶
Ca2+
微
溶
溶
不
微
Ba2+
溶
溶
溶
不
不
Cu2+
不
溶
溶
不
溶
(1)查:氢氧化钡的溶解性_____________
(2)写化学式:一种酸_________________,一种不溶于水的盐________________.
(3)判断:氯化钠溶液与硝酸钙溶液能否发生化学反应________其理由是_____________________________________________________________________
(4)写化学方程式:一种酸与表中的一种盐反应___________________________________ cnrtw1年前1
cnrtw1年前1 -
 提拉Oo米苏 共回答了16个问题
提拉Oo米苏 共回答了16个问题 |采纳率81.3%(1)查:氢氧化钡的溶解性——易溶于水
(2)写化学式:一种酸——HCl、HNO3,一种不溶于水的盐——AgCl、BaSO4.
(3)判断:氯化钠溶液与硝酸钙溶液能否发生化学反应——不反应
其理由是——不符合复分解反应的条件(或无气体、沉淀、水的生成)
(4)写化学方程式:——2HCl+CaCO3=CaCl2+H2O+CO2(气体符号)
原创回答,希望能帮到你,如帮到了你,希望采纳
【你的10分满意,我们团队的无限动力】1年前查看全部
- 9下书后的部分酸碱盐的溶解性表中的不溶性物质是不是在任何的溶液中是以沉淀的形式出现的.
 roc12352001年前1
roc12352001年前1 -
 nixon2008 共回答了20个问题
nixon2008 共回答了20个问题 |采纳率90%不一定的
不如说CaCO3在酸性条件下就不会是沉淀了
会溶解的1年前查看全部
- 根据酸碱盐的溶解性表,你能找出在溶液中结合生成沉淀的阴阳离子吗?写8个
 henryawo1年前3
henryawo1年前3 -
 石边禾绿 共回答了12个问题
石边禾绿 共回答了12个问题 |采纳率75%记住溶解性表,剩下的就是不溶解的,即沉淀
红褐色絮状沉淀Fe(OH)3 Fe3+ OH-
浅绿色沉淀Fe(OH)2 Fe2+ OH-
蓝色絮状沉淀Cu(OH)2 Ca2+ OH-
淡黄色沉淀(水溶液中)S
浅黄色沉淀AgBr Ag+ Br-
黄色沉淀AgI Ag+ I-
白色沉淀CaCO3,BaCO3,MgCO3,AgCl,BaSO4,
Ca 2+ Ba2+ Mg2+与碳酸根CO32-
BaSO3,Ba2+ SO32-
Mg(OH)2,Mg2+ OH-
Al(OH)3 Al3+ OH-
不懂问1年前查看全部
- (2012•奉贤区二模)下表是部分常见酸碱盐的溶解性表.
(2012•奉贤区二模)下表是部分常见酸碱盐的溶解性表.
(1)若表中物质都是由其对应行与列所表示的两种组分组成的,如物质①所在行为“H”,所在列为“NO3”,则其化学式为HNO3.那么物质③的类别属于______(填“酸”、“碱”、“盐”);OH NO3 Cl SO4 H ① ② 溶 NH4 溶 溶 溶 溶 Na ③ 溶 ④ ⑤ Ba 溶 溶 ⑥ 不 Cu 不 溶 溶 ⑦ Ag 不 溶 ⑧ 微
(2)具有挥发性的物质有______(填编号)
(3)属于物质④的用途的是______
A、配置生理盐水B、作调味料C、融化积雪D、胃酸成分. Geroge_hb1年前1
Geroge_hb1年前1 -
 光之uu 共回答了25个问题
光之uu 共回答了25个问题 |采纳率92%解题思路:能够结合所学对常见酸碱盐的溶解性表中所示的物质性质对题目进行分析即可,(1)依据实例完成;(2)依据数字代表的物质性质进行分析;(3)根据④是氯化钠分析其用途即可.(1)③物质是由钠离子与氢氧根离子构成的氢氧化钠,其类别属与碱类;
(2)常见的挥发性物质有盐酸和硝酸等,所以①②处的硝酸和盐酸即是;
(3)物质④是由钠离子与氯离子构成的氯化钠,该物质可以配置生理盐水、作调味剂融化积雪,但不是胃酸的成分,因为胃酸的主要成分是盐酸;
故答案为:(1)碱;(2)①和②;(3)A、B、C.点评:
本题考点: 酸碱盐的溶解性;常用盐的用途;常见的氧化物、酸、碱和盐的判别.
考点点评: 利用实例结合所学的相关知识是解题的关键所在,属基础性知识考查题.1年前查看全部
- 九下化学酸碱盐的溶解性表中的盐是什么?
九下化学酸碱盐的溶解性表中的盐是什么?
还没学老师就叫背了...看网上那些背诵技巧根本不懂啊,有没有大神愿意教我一下,我会非常感谢的!(p:我会讲广东话和普通话,两种谐音也可以哟...) qsbs1年前1
qsbs1年前1 -
 yyjun32 共回答了12个问题
yyjun32 共回答了12个问题 |采纳率100%碱类只溶铵钾钠钙钡;硝酸盐类都能溶于水;盐酸盐类不溶银亚汞;,硫酸盐类不溶铅和钡;碳酸,磷酸,硫酸,亚硫酸,铵钾钠盐都能溶于水
钾钠铵盐硝酸盐,
都能溶于水中间;
盐酸盐不溶氯化银,
硫酸盐不溶硫酸钡,
碳酸盐溶于钾钠铵,
碱类溶于钾钠铵和钡;
还有四种微溶物:
氢氧化钙、硫酸钙、碳酸镁、硫酸银
我用的第一个,有些不经常考,第一个记着比较方便1年前查看全部
- 如何判定化学反应的沉淀酸碱盐的溶解性表背了后怎么看有没有沉淀?表格上是溶解性,怎么判断有没有沉淀?
 ii致命1年前3
ii致命1年前3 -
 yinpeng_xp 共回答了10个问题
yinpeng_xp 共回答了10个问题 |采纳率90%可溶,一般就没有沉淀了.
微溶,在浓度大的时候会有沉淀,除特殊指出以外都可以看作沉淀.
难溶,基本应该算是沉淀了.
不溶,绝对是沉淀.
初中的化学沉淀,一般可以这样判断,基本不会有问题了.1年前查看全部
- (2009•甘孜州)酸碱盐的溶解性表是学习化学的重要工具.下表为部分酸、碱、盐在水中的溶解性(20℃).请回答:
(2009•甘孜州)酸碱盐的溶解性表是学习化学的重要工具.下表为部分酸、碱、盐在水中的溶解性(20℃).请回答:
(1)请从表中找到一种不溶性碱______(填化学式,下同),一种不溶性的硫酸盐______.OH- NO3- Cl- SO42- CO32- H+ - 溶、挥 溶、挥 溶 溶、挥 Na+ 溶 溶 溶 溶 溶 Ca2+ 溶 溶 溶 微 不 Ba2+ 溶 溶 溶 不 不 Cu2+ 不 溶 溶 溶 不
(2)HCl和Na2SO4两种溶液能否发生反应______(填“能”或“否”),理由是______.
(3)请写出氢氧化铜和硫酸溶液反应的化学方程式______,该反应的基本反应类型为______反应. 浪妖儿1年前1
浪妖儿1年前1 -
 nizainli 共回答了19个问题
nizainli 共回答了19个问题 |采纳率89.5%解题思路:根据已有的知识进行分析,复分解反应的条件是两种化合物交换成分有沉淀、气体或水生成.(1)根据表格可知,氢氧化铜是不溶性碱,硫酸钡是不溶性盐,故填:Cu(OH)2,BaSO4;
(2)HCl和Na2SO4两种相互交换成分,没有气体、沉淀或水生成,不能发生反应,故填:否,没有沉淀、气体或水生成;
(3)氢氧化铜能和硫酸发生分解反应生成硫酸铜和水,故填:Cu(OH)2+H2SO4═CuSO4+2H2O,复分解.点评:
本题考点: 复分解反应及其发生的条件.
考点点评: 本题考查了复分解反应的条件,完成此题,可以依据已有的知识进行.1年前查看全部
- 部分酸碱盐的溶解性表 60个化学反应方程式 争取明天早上 5点之前 315页
部分酸碱盐的溶解性表 60个化学反应方程式 争取明天早上 5点之前 315页
oh no3 cl .......
h+ nightcat21年前3
nightcat21年前3 -
 ywc12196438 共回答了12个问题
ywc12196438 共回答了12个问题 |采纳率91.7%、酸、碱、盐
1、酸的化学性质
(1)酸 + 金属 -------- 盐 + 氢气(见上)
(2)酸 + 金属氧化物-------- 盐 + 水
2. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O
3. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O
4 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O
5. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O
(3)酸 + 碱 -------- 盐 + 水(中和反应)
6.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O
7. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O
8. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O
9. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O
(4)酸 + 盐 -------- 另一种酸 + 另一种盐
10.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
11.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
12.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑
13. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl
2、碱的化学性质
(1) 碱 + 非金属氧化物 -------- 盐 + 水
14.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O
15.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O
16.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O
17.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O
18 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O
(2)碱 + 酸-------- 盐 + 水(中和反应,方程式见上)
(3)碱 + 盐 -------- 另一种碱 + 另一种盐
19 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH
3、盐的化学性质
(1)盐(溶液) + 金属单质------- 另一种金属 + 另一种盐
20 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu
(2)盐 + 酸-------- 另一种酸 + 另一种盐
21.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑
(3)盐 + 碱 -------- 另一种碱 + 另一种盐
22. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH
(4)盐 + 盐 ----- 两种新盐
23.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓ + NaNO3
24.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl
初中化学方程式汇总
一、 氧气的性质:
(1)单质与氧气的反应:(化合反应)
1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO
2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
3. 铜在空气中受热:2Cu + O2 加热 2CuO
4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3
5. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O
6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 点燃 2P2O5
7. 硫粉在空气中燃烧: S + O2 点燃 SO2
8. 碳在氧气中充分燃烧:C + O2 点燃 CO2
9. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO
(2)化合物与氧气的反应:
10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2
11. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
(3)氧气的来源:
13.玻义耳研究空气的成分实验 2HgO 加热 Hg+ O2 ↑
14.加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)
15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O2 MnO22H2O+ O2 ↑(实验室制氧气原理2)
二、自然界中的水:
16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电 2H2↑+ O2 ↑
17.生石灰溶于水:CaO + H2O == Ca(OH)2
18.二氧化碳可溶于水: H2O + CO2==H2CO3
三、质量守恒定律:
19.镁在空气中燃烧:2Mg + O2 点燃 2MgO
20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu
21.氢气还原氧化铜:H2 + CuO 加热 Cu + H2O
22. 镁还原氧化铜:Mg + CuO 加热 Cu + MgO
四、碳和碳的氧化物:
(1)碳的化学性质
23. 碳在氧气中充分燃烧:C + O2 点燃 CO2
24.木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑
25. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑
(2)煤炉中发生的三个反应:(几个化合反应)
26.煤炉的底层:C + O2 点燃 CO2
27.煤炉的中层:CO2 + C 高温 2CO
28.煤炉的上部蓝色火焰的产生:2CO + O2 点燃 2CO2
(3)二氧化碳的制法与性质:
29.大理石与稀盐酸反应(实验室制二氧化碳):
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
30.碳酸不稳定而分H2CO3 == H2O + CO2↑
31.二氧化碳可溶于水: H2O + CO2== H2CO3
32.高温煅烧石灰石(工业制二氧化碳):CaCO3 高温 CaO + CO2↑
33.石灰水与二氧化碳反应(鉴别二氧化碳):
Ca(OH)2 + CO2 === CaCO3 ↓+ H2O
(4)一氧化碳的性质:
34.一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2
35.一氧化碳的可燃性:2CO + O2 点燃 2CO2
其它反应:
36.碳酸钠与稀盐酸反应(灭火器的原理):
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
五、燃料及其利用:
37.甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
38.酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
39. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O
六、金属
(1)金属与氧气反应:
40. 镁在空气中燃烧:2Mg + O2 点燃 2MgO
41. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
42. 铜在空气中受热:2Cu + O2 加热 2CuO
43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3
(2)金属单质 + 酸 -------- 盐 + 氢气 (置换反应)
44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑
45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑
46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑
47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑
48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑
49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑
50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑
51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑
(3)金属单质 + 盐(溶液) ------- 新金属 + 新盐
52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu
53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu
54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg
(3)金属铁的治炼原理:
55.3CO+ 2Fe2O3 高温 4Fe + 3CO2↑
部分酸碱盐溶解性表,书后附页有1年前查看全部
- 九年级下册化学课本P109页列了一张酸碱盐的溶解性表,这张表的全部化学式应该怎么写仔细一点啊?
 sbom0021年前3
sbom0021年前3 -
 cc宝来 共回答了18个问题
cc宝来 共回答了18个问题 |采纳率83.3%氢氧(OH)只溶NH4、K、Na、Ba、Ca
K 、Na 、NH4、硝酸(NO3)全溶
碳酸(CO3)只溶NH4、K、Na、Mg
BaSO4、AgCl不溶
Ca(OH)2蓝色沉淀,大多数为白色沉淀.
BaSO4、AgCl二者为白色沉淀,不溶于水也不和酸反应1年前查看全部
- 图表资料可以为我们提供很多信息.下面是小宗同学对图表资料的理解或使用,其中不正确的是( ) A.根据酸碱盐的溶解性表,
图表资料可以为我们提供很多信息.下面是小宗同学对图表资料的理解或使用,其中不正确的是( ) A.根据酸碱盐的溶解性表,判断某些复分解反应能否发生 B.根据溶解度曲线图,判断从溶液中获得晶体的方法 C.根据某元素的原子结构示意图判断该元素原子核中有几个中子 D.根据金属活动性顺序表,判断金属能否置换出盐酸中的氢  ok_271年前1
ok_271年前1 -
 zflx007 共回答了13个问题
zflx007 共回答了13个问题 |采纳率84.6%A、酸碱盐的溶解性表指出了常见酸碱盐的溶解性,能用来判断酸碱盐之间能否发生复分解反应,故A正确;
B、溶解度曲线能表示出物质的溶解度随温度变化的趋势,可以判断使物质结晶的方法,故B正确;
C、根据某元素的原子结构示意图判断该元素原子核中的质子数,故C错误;
D、根据金属活动性顺序能判断金属能否与酸反应生成氢气,故D正确;
故选C.1年前查看全部
- 九年级下册化学课本P109页列了一张酸碱盐的溶解性表,这张表在讲些什么东西呢?我看
 迷茫的孤舟1年前1
迷茫的孤舟1年前1 -
 疯郎 共回答了15个问题
疯郎 共回答了15个问题 |采纳率93.3%讲的是在室温下部分酸碱盐的溶解性,帮助你分析化学反应,即酸碱盐反应是否生成沉淀、气体、水. 比如第6行的Ca2+,看第1竖行的OH-,它们结合生成Ca(OH)2,微字表示微溶于水,看第2竖行的NO3-,结合生成Ca(NO3)2,溶字代表可溶于水,第5竖行,生成CaCO3,不字代表这是沉淀.1年前查看全部
- 酸碱盐的溶解性表?谁能给我啊,
 nanjing20051年前2
nanjing20051年前2 -
 serein123 共回答了15个问题
serein123 共回答了15个问题 |采纳率93.3%1年前查看全部
- 如何记酸碱盐的溶解性表
 梦-缘1年前3
梦-缘1年前3 -
 灵感2002。 共回答了19个问题
灵感2002。 共回答了19个问题 |采纳率89.5%钾钠铵都可溶
硝酸盐都可溶
氯化物只有银不溶
硫酸盐钙微溶,钡不溶,银微溶
碳酸盐只溶钾钠铵
亚硫酸盐参照碳酸盐
碱只溶钾钠钡钙再加一水合氨
酸除了硅酸都溶1年前查看全部
- 如何巧记酸碱盐的溶解性表
 避暑山庄061年前1
避暑山庄061年前1 -
 有爱的潜水员 共回答了20个问题
有爱的潜水员 共回答了20个问题 |采纳率90%可溶碱只有四个(算上氨水五个),硫酸、盐酸盐各有一个不溶,碳酸盐就没有几个好溶的,钠、钾、铵、硝酸盐全溶,其它微溶的大概记一下就行了1年前查看全部
- 酸碱盐的溶解性表中的问题,溶解表中阳离子和阴离子怎么组合成化学式,举这两个看看(阳)H+和(阴)OH-组合;(阳)H+和
酸碱盐的溶解性表中的问题,
溶解表中阳离子和阴离子怎么组合成化学式,举这两个看看(阳)H+和(阴)OH-组合;
(阳)H+和(阴)CO3组合
说清楚一点吧!THANKS! 做实验的猫1年前1
做实验的猫1年前1 -
 冰冷影子 共回答了22个问题
冰冷影子 共回答了22个问题 |采纳率95.5%化学式的目的是表示物质组成,必须保证物质的电中性(常态下物质对外不显电性),即阳离子和阴离子所带正负电荷总数必须相等.
书写时,阳离子在前,阴离子在后,配比数写成下标,化学式中的电荷数省略不写,离子为离子团时,需加().
比如:
(阳)H+和(阴)OH-组合,保证正负电荷总数,即+和-总数相等,则离子比例为1:1,当下标为1时省略不写,所以写成HOH,由于两个H原子和结构形式(以后会提到)都相同,平时就简写为H2O.
(阳)H+和(阴)CO3^2-组合,保证正负电荷总数,即+和-总数相等,则离子比例为2:1,当下标为1时省略不写,即2个H+和1个CO3^2-,因此写成H2CO3.
再比如:
Fe3+和SO4^2-组合,则比例为2:3,即2个Fe3+和3个SO4^2-,因此写成Fe2(SO4)3.1年前查看全部
- 有没有酸碱盐的溶解性表及顺口溜,
 czbzww1年前5
czbzww1年前5 -
 feiycy98 共回答了19个问题
feiycy98 共回答了19个问题 |采纳率84.2%钾钠铵盐硝酸盐,都能溶于水中间.
盐酸难溶银亚汞,硫酸难溶钡和铅.
碳酸盐类多不溶,溶者只有钾钠铵.
碱溶钾钠铵和钡,注意钙盐常是微.1年前查看全部
- 中考试卷不再给出“酸碱盐的溶解性表”,那么一些难溶性物质有什么简便记法吗
 kevinshenjia1年前1
kevinshenjia1年前1 -
 飞翔147 共回答了15个问题
飞翔147 共回答了15个问题 |采纳率100%老师总结的
所有的酸:硝酸盐 钠盐 钾盐 铵盐都溶与水
碱中只有NH4OH NAOH CA(OH)2 BA(OH)2 可溶外,其余不溶
盐酸盐中只有AGCL不溶,其余都溶
硫酸盐中只有BASO4不溶 CASO4 AGSO4微溶外,其余都溶
碳酸盐中只有NA2CO3 K2CO3 (NH4)2CO3溶之外,其余不溶1年前查看全部
- 关于酸碱盐的溶解性表关于NO3的老师叫我们只要背K,Na,NH4,与NO3能溶于水,其它的都要,但溶解表上所有阳离子和N
关于酸碱盐的溶解性表
关于NO3的老师叫我们只要背K,Na,NH4,与NO3能溶于水,其它的都要,但溶解表上所有阳离子和NO3结合都易溶,不知道是不是因为初中生只要记NO3这些,还是因为NO3有什么性质? dfhsir1年前1
dfhsir1年前1 -
 游戏人间的猪 共回答了14个问题
游戏人间的猪 共回答了14个问题 |采纳率92.9%溶解性表只需要背不溶于水的物质即可.你们老师说的只记那些是因为你们学的硝酸盐很少,只有列出的那些而已.关于硝酸根的性质,你将在高一第一学期的时候学到.祝你中考顺利!1年前查看全部
大家在问
- 1Where is Mike?He--(do) his homework now.正确形式是什么
- 2“多美的陶罐!”一个人说,“千万别把它碰坏了.”这句用了什么描写手法
- 3“摧毁全世界”的英文是什么?
- 4如图所示,梯形ABCD中AD平行BC,AB=DC=4,角B=角C=60度,建立适当的直角坐标系,写出各顶点的坐标.
- 5英语作文:Make Up Your Mind!
- 6.(本题满分11分)如图,在正方形ABCD内,已知两个动圆⊙O 1 与⊙Q 2 互相外切.且⊙O 1 与边AB,AD相切
- 7关于光电效应,下列说法正确的是( )
- 8若A为n阶可逆矩阵,证明A^(-1)A是正定矩阵
- 9求三角函数知识点例题一、角的概念和弧度制:1.在直角坐标系内讨论角2.与角终边相同的集合一些特殊角的集合表示3.区间角的
- 10成语接龙:虎虎生威要20个
- 11设集合A={x|x的平方-3X+2=0,集合B={x|x的平方-(2a+1)+a的平方+a=0}.
- 12括号里填什么;im going to buy a pen [ ]the shop
- 13-Que fait-elle? -Elle est __ à l'hôpital Saint-Louis.
- 14(2013·甘肃兰州名校高三检测)Give me an undisturbed hour and I ________
- 15关于大二的校园生活的稿子 300字左右