工业品盐酸中因含有Fe3+而带黄色,若工业盐酸中Cl-与Fe+的个数比为20:1,则H+与Cl-的个数比应为?
 吟啸阁2022-10-04 11:39:541条回答
吟啸阁2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 cdheshan 共回答了19个问题
cdheshan 共回答了19个问题 |采纳率89.5%- 电荷守恒 设H+有X个
阳离子有H+ 和Fe3+
X*1+1*3
阴离子Cl-
阴离子带电=20*1=20
X*1+1*3=20
X=17
H+与Cl-的个数比=17:20 - 1年前
相关推荐
- 对发展中国家而言,一个完整的工业品全生命周期的全球流通路线(① ② ③)如图2所示。 该图所揭示的经济现象
对发展中国家而言,一个完整的工业品全生命周期的全球流通路线(①
 ②
② ③)如图2所示。 该图所揭示的经济现象
③)如图2所示。 该图所揭示的经济现象
a.表明发达国家***转移环境成本 b.表明发展中国家制造业水平持续提高 c.是由不合理的国际经济旧秩序引起的 d.促进了发展中国家经济增长和***进步  蝴蝶---1年前1
蝴蝶---1年前1 -
 ponygao 共回答了21个问题
ponygao 共回答了21个问题 |采纳率90.5%C
1年前查看全部
- 过氧乙酸(cH3C000H)是预防“非典”常用的一种具有强氧化性的高效消毒剂,工业品过氧 乙酸的质量分数为15
过氧乙酸(cH3C000H)是预防“非典”常用的一种具有强氧化性的高效消毒剂,工业品过氧 乙酸的质量分数为15
过氧乙酸(cH3C000H)是预防“非典”常用的一种具有强氧化性的高效消毒剂,工业品过氧
乙酸的质量分数为15%、密度为1.15g/cm3,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒.(1)工业品过氧乙酸的物质的量浓度为 mol/L.
(2)过氧乙酸易分解,要避光保存.用喷雾法消毒,过氧乙酸半小时内会完全分解成乙酸(CH3COOH)
及一种常见的气体单质,过氧乙酸分解的化学方程式是 500mLO.5mol/L的过氧乙酸完全分解产生的气体单质在标准状况下的体积是▲ L.
, li03931年前1
li03931年前1 -
 蓝棱 共回答了21个问题
蓝棱 共回答了21个问题 |采纳率100%(1)c=1000ρω/M=1000*1.15*15%/76=2.27mol/L
(2)2CH3COOOH=2CH3COOH+O2
2mol 22.4L
0.5mol/L*0.5L=0.25mol V(O2)
V(O2)=5.6L1年前查看全部
- 铝和氢氧化钾都是重要的工业产品(1)工业冶炼铝的化学方程式(2)铝与氢氧化钾反应的离子方程式(3)工业品氢氧化钾的溶液中
铝和氢氧化钾都是重要的工业产品
(1)工业冶炼铝的化学方程式
(2)铝与氢氧化钾反应的离子方程式
(3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯.电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.
①该电解槽的阳极反应式是
该电解槽的阴极反应式是
总反应的离子反应方程式是
②通电开始后,阴极附近溶液pH会增大,请简述原因
③除去杂质后氢氧化钾溶液从液体出口 (填写“A”或“B”)导出.
 baby5happyle1年前1
baby5happyle1年前1 -
 tonysony 共回答了18个问题
tonysony 共回答了18个问题 |采纳率88.9%(1)2Al2O3==(电解)==4Al+3O2
(不能用AlCl3,因为它是共价化合物)
(2)2Al+2OH-+2H2O====2AlO2+3H2
(3)
①
阳极 4OH- -4e- ====O2 +2H2O
阴极 4H+ +4e- ====2H2
总反应 2H2O==(电解)==2H2+O2
②水电离出的氢离子减少,氢氧根增大
③B1年前查看全部
- 工业盐酸中因含有Fe3+而带黄色,若某工业品盐酸中H+和Cl-的个数比为91:94,则该盐酸中Fe3+和Cl-的个数比为
工业盐酸中因含有Fe3+而带黄色,若某工业品盐酸中H+和Cl-的个数比为91:94,则该盐酸中Fe3+和Cl-的个数比为( )
A. 1:1
B. 1:3
C. 91:94
D. 1:94 ztgz1年前3
ztgz1年前3 -
 kangfu88 共回答了17个问题
kangfu88 共回答了17个问题 |采纳率94.1%解题思路:根据溶液呈中性,所有的阳离子所带正电荷总数与所有阴离子所带负电荷总数相等进行设溶液中的H+个数是91x,则Cl-的个数是94x,再设的Fe3+个数是y,由所有的阳离子所带正电荷总数与所有阴离子所带负电荷总数相等得94x=91x+3y,所以,y=x,得出盐酸中Fe3+和Cl-的个数比.设溶液中的H+个数是91x,则Cl-的个数是94x,再设的Fe3+个数是y,由所有的阳离子所带正电荷总数与所有阴离子所带负电荷总数相等得:94x=91x+3y,所以,y=x,得出盐酸中Fe3+和Cl-的个数比:1:94,所以,A、B、C错误,D正确.
故选:D.点评:
本题考点: 分子、原子、离子、元素与物质之间的关系.
考点点评: 解答本题的关键是:利用了在溶液中所有的阳离子所带正电荷总数与所有阴离子所带负电荷总数相等的关系进行求离子的个数比.1年前查看全部
- 李宁买了一件工业品但不知道究竟什么金属制成的于是他用天平和量筒对该工艺品的密度测量
李宁买了一件工业品但不知道究竟什么金属制成的于是他用天平和量筒对该工艺品的密度测量
得到以下一些数据请表格填写完整
工艺品的质量.10.8g
水的体积.14mL
工艺品的体积 (.)
工艺品的密度.(.)
通过对照密度表发现这件工艺品是用()金属制成的,这种金属在日常生活中应用广泛,例如() sea_pumc1年前1
sea_pumc1年前1 -
 olivejiajia 共回答了15个问题
olivejiajia 共回答了15个问题 |采纳率93.3%这个题的原话是不是,左边什么都不放,天平右边放量筒,然后调平,再把工业品加在左边天平上,然后,当两者再次平衡的时候,把工业品加在量筒里,发现量筒里水的体积是14ML ,所以,工艺品的体积为3.2立方厘米,所以,算出来就是3.6g每立方厘米 ,但是,量筒是不允许加异物进去的,我只能猜想到这个地步了,而且也没有这种密度的金属,除非是合金,1年前查看全部
- 工业品盐酸因含有杂质而显黄色.要除掉杂质得到纯净的盐酸,最合理的方法是______.
 我的**我tt1年前1
我的**我tt1年前1 -
 哭笑rr不丈夫 共回答了24个问题
哭笑rr不丈夫 共回答了24个问题 |采纳率100%解题思路:工业品盐酸中含有氯化铁杂质,氯化铁是黄色的,盐酸中的氯化氢受热后能从溶液中挥发出来,且氯化氢气体易溶于水,形成盐酸.工业品盐酸因含有氯化铁杂质而显黄色,要除掉氯化铁,根据盐酸有挥发性的性质,可以采用蒸馏的方法把氯化氢从盐酸中分离出来,氯化铁不挥发,然后把蒸馏出来的气体再溶于水,便可得到纯净的盐酸.
故答案为:蒸馏后气体溶于水.点评:
本题考点: 物质除杂或净化的探究.
考点点评: 氯化氢属于化合物,氯化氢的水溶液称为盐酸属于混合物,二者是不同的.1年前查看全部
- (2014•威海一模)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯.电解槽内装有阳离子交换膜(只
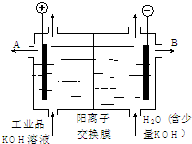 (2014•威海一模)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯.电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.下列说法中正确的是( )
(2014•威海一模)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯.电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.下列说法中正确的是( )
A.该电解槽的阳极反应式是4OH--2e-→2H2O+O2↑
B.通电开始后,阴极附近溶液pH会减小
C.除去杂质后氢氧化钾溶液从液体出口A导出
D.用氯化钾制备氢氧化钾也可采用这种离子交换膜电解法 防弹玻璃221年前1
防弹玻璃221年前1 -
 duida 共回答了17个问题
duida 共回答了17个问题 |采纳率100%解题思路:用阳离子交换膜电解法除去工业品氢氧化钾溶液中的杂质含氧酸根,相当于电解水,故电解时,阳极:4OH--4e-=2H2O+O2↑,阴极:4H++4e-=2H2↑,其中阴极区H+放电,H+浓度减小,使水的电离平衡向右移动促进水的电离,OH-浓度增大.在阴极和阳极之间有阳离子交换膜,只允许阳离子K+和H+通过,这样就在阴极区聚集大量的K+和OH-,从而产生纯的氢氧化钾溶液.A.电解除杂过程相当于电解水,阳极反应式为:4OH--4e-=2H2O+O2↑,故A错误;
B.电解时,阴极电极反应式为:4H++4e-=2H2↑,氢离子浓度减小,溶液的pH增大,故B错误;
C.在B电极附近产生氢氧根离子,钾离子向B电极移动,所以除去杂质后氢氧化钾溶液从液体出口B导出,故C错误;
D.用氯化钾制备氢氧化钾时,阴极上氢离子放电,阳极上氯离子放电,阴极附近产生氢氧化钾,所以也可采用这种离子交换膜电解法,故D正确;
故选D.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解原理,明确离子放电顺序是解本题关键,再结合离子移动方向确定产物,题目难度不大.1年前查看全部
- 下列说法错误的是 [ ] A、发达国家主要销售技术含量高的工业品
下列说法错误的是 [ ]A、发达国家主要销售技术含量高的工业品
B、发展中国家产品种类多,经济落后
C、发达国家从发展中国家购买廉价的原料
D、发展中国家历史上大量资源被掠夺,生产效率不高 贾戌rr1年前1
贾戌rr1年前1 -
 煮酒烂秀才 共回答了9个问题
煮酒烂秀才 共回答了9个问题 |采纳率100%B1年前查看全部
- 若有一批工业品从南京运往上海,请选择一种最便宜的运输方式和运输线路
 爱得愚昧-1年前1
爱得愚昧-1年前1 -
 天下狂 共回答了21个问题
天下狂 共回答了21个问题 |采纳率76.2%如果大批量,对时间要求不高的话可以走长江航运.从南京港出发,上海港卸货1年前查看全部
- (2006•南通模拟)工业盐酸中因含有Fe3+而带黄色,若某工业品盐酸中H+和Cl-的个数比为91:94,则该盐酸中Fe
(2006•南通模拟)工业盐酸中因含有Fe3+而带黄色,若某工业品盐酸中H+和Cl-的个数比为91:94,则该盐酸中Fe3+和Cl-的个数比为( )
A.1:1
B.1:3
C.91:94
D.1:94 yaf_3211年前1
yaf_3211年前1 -
 Jawy 共回答了18个问题
Jawy 共回答了18个问题 |采纳率83.3%解题思路:根据溶液呈中性,所有的阳离子所带正电荷总数与所有阴离子所带负电荷总数相等进行设溶液中的H+个数是91x,则Cl-的个数是94x,再设的Fe3+个数是y,由所有的阳离子所带正电荷总数与所有阴离子所带负电荷总数相等得94x=91x+3y,所以,y=x,得出盐酸中Fe3+和Cl-的个数比.设溶液中的H+个数是91x,则Cl-的个数是94x,再设的Fe3+个数是y,由所有的阳离子所带正电荷总数与所有阴离子所带负电荷总数相等得:94x=91x+3y,所以,y=x,得出盐酸中Fe3+和Cl-的个数比:1:94,所以,A、B、C错误,D正确.
故选:D.点评:
本题考点: 分子、原子、离子、元素与物质之间的关系.
考点点评: 解答本题的关键是:利用了在溶液中所有的阳离子所带正电荷总数与所有阴离子所带负电荷总数相等的关系进行求离子的个数比.1年前查看全部
- (2003•陕西)工业品过氧乙酸原液通常是15%过氧乙酸溶液(密度1.15g/cm3).使用时,通常取20mL原液,加自
(2003•陕西)工业品过氧乙酸原液通常是15%过氧乙酸溶液(密度1.15g/cm3).使用时,通常取20mL原液,加自来水稀释至1000mL,搅拌均匀,即配制成1000mL(密度约为1g/cm3)用于空气喷雾消毒和地面消毒的过氧乙酸溶液.
(1)20mL 15%过氧乙酸原液的质量是多少克?其中含过氧乙酸多少克?
(2)配制成的1000mL过氧乙酸溶液中,过氧乙酸的质量分数是多少? 天堂小鸟1年前1
天堂小鸟1年前1 -
 双龙的桂花 共回答了19个问题
双龙的桂花 共回答了19个问题 |采纳率73.7%解题思路:(1)据溶液的质量=溶液的密度×溶液的体积,溶质的质量=溶液的质量×溶质的质量分数进行解答;
(2)溶质的质量分数=[溶质的质量/溶液的质量]×100%.(1)20 mL 1 5%过氧乙酸原液质量为20 cm3×1.1 5 g/cm3=23 g,其中含过氧乙酸的质量为23 g×1 5%=3.45 g;(2)溶液稀释前后溶质的质量不变,所以1 000&nb...
点评:
本题考点: 有关溶质质量分数的简单计算.
考点点评: 了解溶质的质量分数、溶液的质量的计算方法,并结合题意细心分析解答即可.1年前查看全部
- 1851年的世博会英国有展出的工业品
 传说online1年前1
传说online1年前1 -
 linsuna 共回答了16个问题
linsuna 共回答了16个问题 |采纳率87.5%首届世博会即1851年伦敦世博会,就展示了工业革命的伟大结晶——蒸汽机、火车头、汽轮船、汽压机、起重机、开槽机,钻孔机,拉线机,纺纱机,造币机,抽水机等,它们都使用了蒸汽机提供的强大动力.1年前查看全部
- 过氧乙酸是一种常用的消毒剂,具有强氧化能力,可将各种病原微生物杀灭.工业品过氧乙酸原液通常是15%的,
过氧乙酸是一种常用的消毒剂,具有强氧化能力,可将各种病原微生物杀灭.工业品过氧乙酸原液通常是15%的,
过氧乙酸溶液(密度为1.15g/cm-3).使用时,通常取20ml原液,加自来水稀释至1000ml,搅拌均匀,即配制成1000ml(密度约为1g/cm-3)用于空气喷雾消毒、环境地面消毒的过氧乙酸溶液
(1)20ml15%过氧乙酸原液的质量是多少克?其中含过氧乙酸多少克?
(2)配制成的1000ml过氧乙酸溶液中,过氧乙酸的质量分数是多少? sammel1年前1
sammel1年前1 -
 skywo11 共回答了20个问题
skywo11 共回答了20个问题 |采纳率90%原液质量=20*1.15
含量=20*1.15*15%
质量分数=20*1.15*15%/1000*11年前查看全部
- 1840年一位英国人说:“关于我们对印度贸易的整个问题是他们能否能用他们的土地物产来偿付我们准备输出的工业品。”由此可以
1840年一位英国人说:“关于我们对印度贸易的整个问题是他们能否能用他们的土地物产来偿付我们准备输出的工业品。”由此可以看出 [ ]A.要把印度变为它的商品倾销市场和原料产地
B.要转移贸易对象
C.认为印度经济水平低,商品输出受影响
D.对印度贸易出现入超 珑腾yy1年前1
珑腾yy1年前1 -
 杀身成佛 共回答了16个问题
杀身成佛 共回答了16个问题 |采纳率87.5%A1年前查看全部
- 纯净的盐酸是--------的液体,工业品盐酸中因含FE3+等杂志而显--------.
 clarkerliu1年前1
clarkerliu1年前1 -
 mandymaolihua 共回答了22个问题
mandymaolihua 共回答了22个问题 |采纳率81.8%纯净的盐酸是(无色)的液体,工业品盐酸中因含FE3+等杂志而显(黄色).1年前查看全部
大家在问
- 1数字推理题:1/7,14,1/21,42,1/36,72,1/52,( )
- 2给下列字先加偏旁组成新字,再组词.区 (组成什么字) (组词)要2个
- 3(2012•润州区二模)市场上有“加氟牙膏”、“葡萄糖酸锌”等商品,这里的“钙、氟、锌”应理解为( )
- 4阅读下面的文字,完成小题。刘姥姥只听见咯当咯当的响声,大有似乎打箩柜筛面的一般,不免东瞧西望的。忽见堂屋中柱子上挂着一个
- 5do,you,science,why,like连词成句
- 6合并成带有定语从句的复合句! 急!只要会任何一句就回答
- 7翻译 later on ,I realized that it doesn't matter if you don't
- 8从一块300cm,宽200cm的铁片中央截去一个小长方形,使剩下的长方形四周的宽度一样,并且小长方形的面积是原来铁片面积
- 9已知角θ终边上有一点P(x,2x-3),且tanθ=-x,试求sinθ+cosθ,
- 10六二班男生占全班人数5/9又转来一名女生后女和男的比是5:6六二原来有多少人?
- 11致亲爱的自己生日快乐!的英语怎么写?
- 12计算下列各题.(能简算的要简算)
- 13奇函数+非奇非偶函数=_______
- 14在三角形ABC中,2角c-角B=30度,角A=90度,求角B,角C的度数
- 15函数f(x)的定义域为(0,+∞),并且对任意正实数x,都有f(x)=2f(2005/x )=3x,则f(2)为多少?
