钛铁矿主要成分的化合式FETIOX铁元素和钛元素化合价+3 X的值为
 男孩爱女孩2022-10-04 11:39:541条回答
男孩爱女孩2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 chajingke 共回答了13个问题
chajingke 共回答了13个问题 |采纳率92.3%- 3 追问:为什么 回答:+3+3/2=3
- 1年前
相关推荐
- 我国发射的“嫦娥一号”对月球进行了全球性和综合性探测,月球表面富含钛铁矿,其主要成分化学式为FeTiO 3 (钛酸铁),
我国发射的“嫦娥一号”对月球进行了全球性和综合性探测,月球表面富含钛铁矿,其主要成分化学式为FeTiO 3 (钛酸铁),已知铁元素显+3价.则钛元素(Ti)的化合价为( ) A.+1 B.+2 C.+3 D.+4  要疯了啊1年前1
要疯了啊1年前1 -
 嘟嘟宝猪 共回答了25个问题
嘟嘟宝猪 共回答了25个问题 |采纳率88%设钛酸铁中钛的化合价为x.
(+3)+x+(-2)×3=0
解得x=+3
故选C.1年前查看全部
- (2010•玉溪)钛铁矿主要成分的化学式为FeTiOx,其中铁元素和钛元素的化合价均显+3价.则x为( )
(2010•玉溪)钛铁矿主要成分的化学式为FeTiOx,其中铁元素和钛元素的化合价均显+3价.则x为( )
A.2
B.3
C.4
D.6 LOVEBOBO13141年前1
LOVEBOBO13141年前1 -
 xindelingxi 共回答了22个问题
xindelingxi 共回答了22个问题 |采纳率81.8%解题思路:根据化合物对外不显电性,在化合物中正负化合价代数和为零解答即可.因为铁元素和钛元素的化合价均显+3价,则在化合物FeTiOx中,正价化合价之和为+6价,那么,负价化合价之和应是-6价,因为O的化合价为-2价,则x为(-6)÷(-2)=3.
故选B.点评:
本题考点: 化合价规律和原则;常见元素与常见原子团的化合价.
考点点评: 本题主要考查学生根据化合价的规律和原则解答问题的能力.根据化合物中元素的化合价,可以推断化学式,还可以推求元素原子的个数.1年前查看全部
- 钛是一种重要的金属,工业上用钛铁矿(主要成分为FeTiO3,含FeO、Al2O3、SiO2 等杂质)为原料制钛
钛是一种重要的金属,工业上用钛铁矿(主要成分为fetio3,含feo、al2o3、sio2 等杂质)为原料制钛***(tio2),tio2常通过两种方法可制得 ti.

其中,2h2so4+fetio3=tioso4+feso4+2h2o.回答下列问题.
(l)净化钛矿石时,需用浓氢氧化钠溶液来处理,该过程中发生反应的化学方程式有:
sio2+2naoh=na2sio3+h2o 和______
(2)滤液①中的溶质主要是 feso4,检验其中fe2+的方法是:______.
(3)从 tioso4→h2tio3需要加热,则加热的目的是:______.
(4)电解 tio2来获得 ti 是以 tio2作阴极,石墨为阳极,熔融cao为电解液,用碳块作电解槽池.其阴极反应的电极反应式为:______.
(5)从化学平衡的角度解释:往tio2和cl2反应体系中加入焦炭后,能使反应 tlo2(s)+2cl2(g)═tlcl4(l)+o2(g)顺利进行的原因是:______. senyan1年前1
senyan1年前1 -
 cclei 共回答了14个问题
cclei 共回答了14个问题 |采纳率85.7%解题思路:(1)根据钛铁矿中的杂质氧化铝与碱反应生成可溶的铝盐溶液来回答;
(2)根据Fe2+能被氧化剂掩盖为三价铁离子,铁离子遇到硫氰酸根离子显示红色;
(3)根据TiOSO4的水解平衡的影响因素知识来回答;
(4)根据电解原理:阴极上是发生得电子的还原反应;
(5)从平衡移动的原理:减少生成物的浓度,化学平衡向着正反应方向移动.(1)钛铁矿含FeO、Al2O3、SiO2等杂质,能与碱反应物质除了SiO2还有Al2O3,故答案为:Al2O3+2NaOH=2NaAlO2+H2O;
(2)因滤液①中的溶质主要是FeSO4,所一先加几滴KSCN溶液,再加几滴氯水,观察溶液是否变为红色,故答案为:取少许滤液①于试管中,滴入几滴KSCN溶液,无明显现象,然后滴入几滴氯水,溶液变为红色,说明其中含有Fe2+;
(3)从 TiOSO4→H2TiO3是物质水解的过程,加热能够促进水解的进行,故答案为:促进TiOSO4的水解;
(4)因TiO2作阴极,得到电子,被还原,得到单质Ti,故答案为:TiO2 +4e-=Ti+2O2-;
(5)因减少生成物的浓度,平衡正向移动,故答案为:碳单质与氧气反应减小产物浓度使平衡向右移动,导致反应顺利进行.点评:
本题考点: 金属冶炼的一般原理;电解原理;二价Fe离子和三价Fe离子的检验;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题涉及金属的冶炼原理、电解原理、亚铁离子的检验以及化学平衡的移动原理等方面的知识,属于综合知识的考查,难度不大.1年前查看全部
- 四氧化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料.由钛铁矿(主要成为是FeTiO3)制备TiCl4
 躺而求坐1年前1
躺而求坐1年前1 -
 haim8888 共回答了20个问题
haim8888 共回答了20个问题 |采纳率85%(1)粉碎的目的:减小钛铁矿粒度,增大其表面积,以利于钛铁矿在酸溶过程中能以较快的速度和较彻底的程度发生.
(2)Fe + 2H+ = Fe2+ + H2
(3)硫酸亚铁
(4)分解反应
(5)TiO2 + 2C + Cl2 = TiCl4 + 2CO
(6)工艺流程中有较多的“三废”排放.
(7)烧杯、漏斗、玻璃棒1年前查看全部
- 四氯化钛(TiCl4)是制取航天航空工业材料--钛合金的重要原料,由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品
四氯化钛(TiCl4)是制取航天航空工业材料--钛合金的重要原料,由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:

回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性.该过程中有如下反应发生.
2Fe3++Fe═3Fe2+
2TiO2+(无色)+Fe+4H+═2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O═TiO2+(无色)+Fe2++2H+
加入铁屑的作用是______.
(2)在②→③工艺中需要控制条件以形成TiO2•n H2O溶胶,该分散质颗粒直径大小在______范围.
(3)上述工艺具有成本低、可用低品位矿物为原料等优点.依据绿色化学理念,该工艺流程中存在的不足之处是______(只要求写出一项).
(4)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用______方法.
TiCl4 SiCl4 熔点/℃ -25.0 -68.8 沸点/℃ 136.4 57.6  小雨两三朵1年前1
小雨两三朵1年前1 -
 莫莫无畏 共回答了11个问题
莫莫无畏 共回答了11个问题 |采纳率100%解题思路:(1)往①中加入铁屑至浸出液显紫色,说明浸出液中含有Ti3+,由方程式可知,Fe3+氧化为Ti3+;
(2)控制条件以形成TiO2•n H2O溶胶,说明得到胶体,其分散质颗粒直径大小为10-9~10-7m(或1nm-100nm);
(3)绿色化学应零污染、零排放,原子利用率100%.结合工艺流程三废回答;
(4)由表中数据可知,SiCl4、TiCl4为液体,二者沸点相差较大,通常采取蒸馏方法分离.(1)往①中加入铁屑至浸出液显紫色,说明浸出液中含有Ti3+,由方程式可知,Fe3+氧化为Ti3+,加入铁屑作还原剂,将Fe3+还原为Fe2+,防止Ti3+被Fe3+氧化成TiO2+,
故答案为:防止Ti3+被Fe3+氧化成TiO2+;
(2)控制条件以形成TiO2•n H2O溶胶,说明得到胶体,其分散质颗粒直径大小为10-9~10-7m(或1nm-100nm),
故答案为:10-9~10-7m(或1nm-100nm);
(3)由工艺流程可知,生成中产生废气,废液,废渣等,不符合绿色化学理念,
故答案为:产生了废气,废液,废渣等;
(4)由表中数据可知,SiCl4、TiCl4为液体,二者沸点相差较大,要精制含少量SiCl4杂质的TiCl4,可采用蒸馏(或分馏)方法,
故答案为:蒸馏(或分馏).点评:
本题考点: 制备实验方案的设计.
考点点评: 本题考查学生阅读题目获取信息能力、氧化还原反应、绿色化学、胶体、物质分离提纯等,难度不大,注意基础知识的掌握利用.1年前查看全部
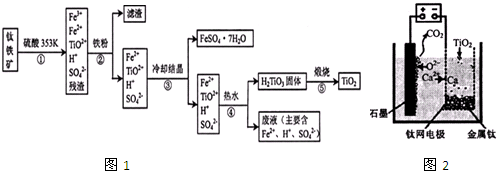
- (2014•甘肃二模)工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示.钛铁矿主要成分为钛酸亚铁(FeTiO3),
(2014•甘肃二模)工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示.钛铁矿主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价.

已知:TiOSO4遇水会水解.
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为______.
(2)步骤③中,实现混合物的分离是利用物质的______(填字母序号).
a.熔沸点差异 b.溶解性差异c.氧化性、还原性差异
(3)步骤②、③、④中,均需用到的操作是______(填操作名称).
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理:______.
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为______.
(6)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.
①写出阳极所发生反应的电极反应式:______.
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释)制备TiO2时,在电解槽发生如下反应:2CaO═2Ca+O2↑,2Ca+TiO2
Ti+2CaO,由此可见,CaO的量不变;一定条件 .制备TiO2时,在电解槽发生如下反应:2CaO═2Ca+O2↑,2Ca+TiO2.
Ti+2CaO,由此可见,CaO的量不变;一定条件 . yokoo1年前1
yokoo1年前1 -
 lnn1123 共回答了23个问题
lnn1123 共回答了23个问题 |采纳率95.7%解题思路:(1)铁粉将Fe3+转化为Fe2+;
(2)溶液中析出晶体是利用物质溶解度的不同得到;
(3)②③④都是从溶液中得到固体的分离过程,需要用过滤装置;
(4)依据溶液中存在平衡:TiO2++2H2O⇌H2TiO3+2H+,平衡影响因素和平衡移动原理分析判断;
(5)废液主要是亚铁离子、氢离子和二氧化锰反应发生氧化还原反应生成锰离子和铁离子;
(6)①依据装置图分析判断,阳极生成二氧化碳气体,是电解质中的氧离子失电子生成氧气,氧气和阳极石墨反应生成的二氧化碳;
②制备TiO2时,在电解槽发生如下反应:阴极:2Ca2++4e-═2Ca 阳极:2O2--4e-═O2↑,2Ca+TiO2
Ti+2CaO,由此可见,CaO的量不变.一定条件 .(1)故答案为:步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为:2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe═3Fe2+;
(2)步骤③冷却结晶得到硫酸亚铁晶体,利用的是物质溶解度的不同,通过冷却热饱和溶液得到,故答案为:b;
(3)②③④步骤的操作过程中都得到沉淀或晶体,所以需要过滤得到固体和溶液,故答案为:过滤;
(4)④中使用热水的目的是促进TiO2+水解生成H2TiO3,分离出固体加热得到TiO2;溶液中存在平衡:TiO2++2H2O⇌H2TiO3+2H+,当加入热水稀释、升温后,
平衡正向移动,生成H2TiO3;
故答案为:溶液中存在平衡:TiO2++2H2O⇌H2TiO3+2H+,当加入热水稀释、升温后,平衡正向移动,生成H2TiO3.
(5)利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),利用二氧化锰的氧化性氧化亚铁离子为三价铁离子,反应的离子方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(6)①用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,阳极发生氧化反应,阴极析出钙金属发生还原反应,阳极图示产物可可知,阳极生成二氧化碳气体,是电解质中的氧离子失电子生成氧气,氧气和阳极石墨反应生成的二氧化碳,所以电极反应为:2O2--4e-=O2↑,或C+2O2--4e-=CO2↑;
故答案为:2O2--4e-=O2↑,或C+2O2--4e-=CO2↑;
②制备TiO2时,在电解槽发生如下反应:2CaO═2Ca+O2↑,2Ca+TiO2
一定条件
.
Ti+2CaO,由此可见,CaO的量不变;
或:制备TiO2时,在电解槽发生如下反应:阴极:2Ca2++4e-═2Ca阳极:2O2--4e-═O2↑;2Ca+TiO2
一定条件
.
Ti+2CaO,由此可见,CaO的量不变;
故答案为:制备TiO2时,在电解槽发生如下反应:2CaO═2Ca+O2↑,2Ca+TiO2
一定条件
.
Ti+2CaO,由此可见,CaO的量不变.点评:
本题考点: 制备实验方案的设计;电解原理;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了物质分离的流程分析判断,物质性质的应用,离子性质的应用,分离操作的方法,氧化还原反应的离子方程式的书写方法,电解池原理的应用,电极反应的书写原则.1年前查看全部
- (2014•淮北模拟)2013年12月2日凌晨1时30分,嫦娥三号探测器携带玉兔月球车落月,月岩中钛铁矿主要成分的化学式
(2014•淮北模拟)2013年12月2日凌晨1时30分,嫦娥三号探测器携带玉兔月球车落月,月岩中钛铁矿主要成分的化学式为FeTiO3,其中铁元素为+3价,钛元素化合价为( )
A.+1
B.+2
C.+3
D.+4 n7k3cc1年前1
n7k3cc1年前1 -
 鄂伦春uu旗 共回答了18个问题
鄂伦春uu旗 共回答了18个问题 |采纳率88.9%解题思路:根据钛铁矿主要成分的化学式为FeTiO3,利用钛、氧元素的化合价及化合物中正负化合价的代数和为0来解答.在FeTiO3中,钛元素的化合价为+3价,氧元素的化合价为-2价,
设该化合物中铁的化合价为x,
由化学式及化合物中正负化合价的代数和为0,则
x+(+3)+(-2)×3=0
解得x=+3
故选C.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查元素化合价的计算,学生应能利用化学式及常见元素在化合物中的化合价,借助化合价的计算原则来计算.1年前查看全部
- 自洁面料就是在普通的面料纤维中加入一层薄薄的纳米二氧化钛。含有Fe 2 O 3 的钛铁矿(主要成分为FeTiO 3 )制
自洁面料就是在普通的面料纤维中加入一层薄薄的纳米二氧化钛。含有Fe 2 O 3 的钛铁矿(主要成分为FeTiO 3 )制取纳米级TiO 2 的流程如下:
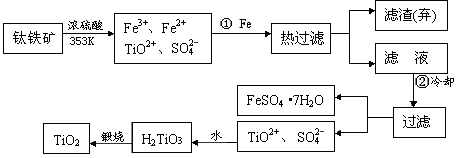
(1)Ti的原子序数为22,Ti位于元素周期表中的第________周期,第______族。
(2)步骤①加铁的目的是_________________;步骤②冷却的目的是_______________。
(3)上述制备二氧化钛的过程中,可以利用的副产物是______________;考虑成本和废物综合利用因素,废液中应加入___________________处理。
(4)由金红石制备单质钛,涉及到的步骤为:
TiO 2 TiCl 4
TiCl 4  Ti
Ti
已知:①C(s)+O 2 (g)==CO 2 (g) △H = -393.5kJ·mol -1
②2CO(g)+O 2 (g)==2CO 2 (g) △H = -5665kJ·mol -1
③TiO 2 (s)+2Cl 2 (g)==TiCl 4 (s)+O 2 (g) △H = +41kJ·mol -1
则TiO 2 (s)+ 2Cl 2 (g)+C(s)==TiCl 4 (s)+2CO(g)的 △H =____________。
反应TiCl 4 +2Mg == 2MgCl 2 +Ti 在氩气氛中进行的理由是________________________。 蔓蔓青萝1年前1
蔓蔓青萝1年前1 -
 大波浪231 共回答了13个问题
大波浪231 共回答了13个问题 |采纳率100%(1)4;IVB
(2)将Fe 3+ 还原为Fe 2+ ;析出(或分离、或得到)FeSO 4 ·7H 2 O
(3)FeSO 4 ·7H 2 O;石灰(或碳酸钙、废碱)
(4)-80kJ·mol -1 ;防止高温下镁和钛与空气中氧气(或二氧化碳、或氮气)作用
用框图形式给出工业生产流程,让考生面对自己观察框图,获取所需信息解决问题,这类试题体现了新课程改革的方向。试题有一定难度,考查吸收信息、处理信息等综合分析能力。
(1)可以根据钙元素的位置推断钛元素的位置,该元素位于周期表第四周期IIA主族,故钛位于IVB;
(2)观察题给流程图可知,所得产品有FeSO 4 ·7H 2 O和TiO 2 两种。由于加浓硫酸后所得溶液含有Fe 3+ ,所以步骤①中加入铁是为了将Fe 3+ 转化成Fe 2+ 。步骤②冷却是为了降低硫酸亚铁的溶解度,使硫酸亚铁结晶析出;
(3)该流程的主要目的是制取二氧化钛,故其是主要产品,则FeSO 4 ·7H 2 O是副产品。废液处理时,根据流程分析废液可能会剩余部分酸,故可以考虑加入石灰或其它废碱,以将酸中和掉;
(4)运用盖期定律可计算出反应热。由于高温条件下金属镁易跟氧气、二氧化碳等气体发生反应,所以应充入氩气来保护镁。1年前查看全部
- 下列属于复分解反应的是,钛铁矿主要成分的化学式为Fe TiOx,其中铁元素和钛元素 为什么
下列属于复分解反应的是,钛铁矿主要成分的化学式为Fe TiOx,其中铁元素和钛元素 为什么
化学式给我看
铁钛 化合价均为+3 ellengjp1年前4
ellengjp1年前4 -
 想入靡靡 共回答了15个问题
想入靡靡 共回答了15个问题 |采纳率86.7%你的题目是不是不完整啊?
Fe是+2价,Ti是+4价,x=3.
你给的化合价不正确.
2+4-2x=0,x=31年前查看全部
- 月球的沙土中含有丰富钛铁矿,主要成分为TiO2、Fe2O3等,若用CO还原这种矿石,其中生成铁的化学方程式为:_____
月球的沙土中含有丰富钛铁矿,主要成分为TiO2、Fe2O3等,若用CO还原这种矿石,其中生成铁的化学方程式为:______;用稀盐酸清洗铁钉表面的铁锈(主要成分是Fe2O3),其化学方程式为:______,该反应的反应类型是______反应.
 rainmj1年前1
rainmj1年前1 -
 梦一个世纪 共回答了19个问题
梦一个世纪 共回答了19个问题 |采纳率89.5%解题思路:根据一氧化碳还有还原性,可以将铁矿石中的铁还原出来进行分析;
根据金属氧化物会与酸反应进行分析;
根据反应物、生成物的类别判断反应的基本类型.一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,故答案为:3CO+Fe2O3 高温 . 2Fe+3CO2;氧化铁和盐酸反应生成氯化铁和水,该反应由两种化合物相互交换成分形成两种新的化合物,符合复分解反应的概...
点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;金属锈蚀的条件及其防护;反应类型的判定.
考点点评: 在解此类方程式的书写题时,首先确定反应原理,然后再依据原理找出反应物、生成物和反应条件,根据方程式的书写规则书写方程式.1年前查看全部
- (2013•安徽模拟)钛(fTi)被誉为21世纪金属.冶炼钛的主要原料是含Fe203的钛铁矿(FeTiO3),其生产过程
(2013•安徽模拟)钛(fTi)被誉为21世纪金属.冶炼钛的主要原料是含Fe203的钛铁矿(FeTiO3),其生产过程如图:

已知:TiOSO4可溶于水且易水解,H2Ti03难溶于水.试回答下列问题:
(1)步骤②的主要实验操作是冷却、结晶、______ (填操作名称);步骤④在实验室中常将试剂置于______ (填仪器名称)中加强热.
(2)步骤③中加入热水的作用是______
(3)步骤④中硫酸亚铁晶体(FeS04*7H20)在空气中煅烧生成铁红、水和三氧化硫,写出该 反应的化学方程式:4FeSO4•7H2O+O2
2Fe2O3+4SO3+28H2O高温 .4FeSO4•7H2O+O2
2Fe2O3+4SO3+28H2O高温 .
(4)步骤②所得到的硫酸亚铁晶体(FeSO4•7H20)是目前工业上处理含铬有毒废水常用 的化学试剂,二者反应后(Cr由+6价转化为+3价)可以转化为有重要工业价值的 铁氧体复合氧化物(常用Fe0.FeyCrx03表示).欲制备该铁氧体复合氧化物,试求在 酸性的含铬废水中,加入FeSO4•7H2O的质量应为废水中六价铬(相当于CrC3)质 量的______倍. 我loveee1年前1
我loveee1年前1 -
 后果连脚裤上 共回答了15个问题
后果连脚裤上 共回答了15个问题 |采纳率73.3%解题思路:(1)结晶后析出晶体,操作为过滤;灼烧晶体失去结晶水用坩埚;
(2)水解平衡是吸热的,从化学平衡的原理解释;
(3)据氧化还原原理,确定反应物有氧气写出反应的化学方程式;
(4)据电子得失和原子守恒关系求解.(1)结晶后析出晶体,操作为过滤;灼烧晶体失去结晶水在坩埚中进行,
故答案为:过滤;坩埚;
(2)水解平衡是吸热的,用热水稀释有利于促使TiO2+水解生成H2TiO3,
故答案为:加热、稀释有利于促使TiO2+水解生成H2TiO3;
(3)据氧化还原原理,反应物有氧气,反应的化学方程式为4FeSO4•7H2O+O2
高温
.
2Fe2O3+4SO3+28H2O,
故答案为:4FeSO4•7H2O+O2
高温
.
2Fe2O3+4SO3+28H2O;
(4)FeO•FeyCrxO3中,Cr为+3价,Fe为+3价,故x+y=2,根据电子得失守恒有Fe:Cr=3:1,可以设x=0.5,y=1.5;可以得出量的关系为2.5FeSO4•7H2O~0.5CrO3,故质量比为(2.5×278):0.5×100=13.9,
故答案为:13.9.点评:
本题考点: 金属的回收与环境、资源保护.
考点点评: 本题考查以钛铁矿为主要原料冶炼金属钛工艺流程,注意分析流程各反应物的转化是解答的关键,题目难度中等.1年前查看全部
- 写出钛铁矿经氯化法得到四氯化钛的化学方程式?(不用写条件)
 dssdhjdshjsdj1年前1
dssdhjdshjsdj1年前1 -
 105273 共回答了16个问题
105273 共回答了16个问题 |采纳率93.8%FeTiO3+2H2SO4=TiSO4+FeSO4+2H2O
TiOSO4+2H20=H2TiO3+H2SO4
H2TiSO4=TiO2+H2O
TiO2+2Cl2+2C=TiCl4+2CO(加热)1年前查看全部
- 具有硬度大、熔点高、耐酸腐蚀而被应用于航空、电子等领域,由钛铁矿(主要成份是FeTiO 3 ,钛酸亚铁)提取金属钛并获得
具有硬度大、熔点高、耐酸腐蚀而被应用于航空、电子等领域,由钛铁矿(主要成份是FeTiO 3 ,钛酸亚铁)提取金属钛并获得副产品FeSO 4 ·7H 2 O的工艺过程如下 
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO 4 ,常温下,该物质易溶于酸性溶液,在pH=0.5时开始转化为钛酸沉淀,
①则物质A是______(填化学式,下同),B是______;
②步骤④生成TiO(OH) 2 (即H 2 TiO 3 )的离子方程式是________________________。
(2)已知FeSO 4 ·7H 2 O的溶解度曲线如下图所示,则步骤③采用的操作是________________________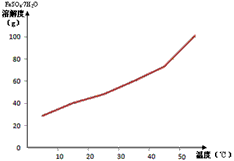
(3)工业上可通过下列反应由TiO 2 制备金属Ti 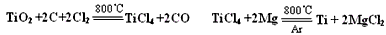
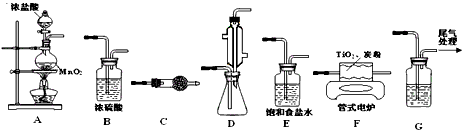
已知:常温下TiCl 4 是一种极易水解的无色液体,沸点为136.4℃。
①从下列供选用的装置中选择合适的装置制备TiCl 4 ,按气流方向连结起来:
A →______→______→ F →______→______→ G
②下列仪器中盛放的药品分别是C__________;G___________
(4)一定条件下,将TiO 2 溶解并还原为Ti 3+ ,再以KSCN作溶液作指示剂,用NH 4 Fe(SO 4 ) 2 标准溶液滴定Ti 3+ 至全部生成Ti 4+ 。称取TiO 2 样品3.0g,消耗0.2mol/L NH 4 Fe(SO 4 ) 2 溶液30mL,则TiO 2 的质量分数是
____________ 1213131年前1
1213131年前1 -
 煽你两巴掌 共回答了17个问题
煽你两巴掌 共回答了17个问题 |采纳率82.4%(1)①Fe;H 2 O;②TiO 2+ +2H 2 O=TiO(OH) 2 +2H +
(2)降温、结晶、过滤
(3)①E、B、D、C;②无水氯化钙;NaOH溶液
(4)80%1年前查看全部
- 钛和钛合金,在许多领域被广泛的应用,被称为21世纪的金属.钛铁矿的主要成分为FeTiO 3 ,已知其中Fe元素为+2价,
钛和钛合金,在许多领域被广泛的应用,被称为21世纪的金属.钛铁矿的主要成分为FeTiO 3 ,已知其中Fe元素为+2价,O元素为-2价,那么FeTiO 3 中钛(Ti)元素的化合价为( ) A.+4 B.+3 C.+2 D.+1  angus83011年前1
angus83011年前1 -
 公园阁楼 共回答了14个问题
公园阁楼 共回答了14个问题 |采纳率92.9%根据在化合物中正负化合价代数和为零,已知Fe元素为+2价,O元素为-2价,则FeTiO 3 中钛(Ti)元素的化合价为:(+2)+x+(-2)×3=0,解答 x=+4;
故选A.1年前查看全部
- 科学探测发现月球贮存有一定数量的冰尘混合物、甲烷和钛铁矿(主要成分FeTiO3 )资源.人类有望利用月球上的水
科学探测发现月球贮存有一定数量的冰尘混合物、甲烷和钛铁矿(主要成分FeTiO3 )资源.人类有望利用月球上的水资源,并通过电解获取氢气为火箭提供燃料,获取的氧气可逐渐形成可供呼吸的大气层,用来满足植物和人类所需.如图是根据科学家设想的有关人类利用月球资源的流程图.

(1)得到净化水的过程中,可做吸附剂的物质有______(填一种物质名称)
(2)该流程图中可循环利用的物质是______和______
(3)推测流程图中的“两种金属单质”是______
(4)根据流程图的信息,写出CO和H2反应的化学方程式CO+3H2
CH4+H2O一定条件 .CO+3H2
CH4+H2O一定条件 .
(5)若电解水得到氧气的质量为8千克,同时得到氢气______千克. 不哭的猪1年前1
不哭的猪1年前1 -
 solomicky 共回答了21个问题
solomicky 共回答了21个问题 |采纳率95.2%解题思路:(1)活性炭具有吸附作用,能够吸附水中的色素和异味;
(2)根据图中信息可以判断各种物质的用途;
(3)根据质量守恒定律可以判断生成物;
(4)一氧化碳和氢气在一定条件下反应能生成甲烷和水;
(5)根据氧气的质量可以求出生成氢气的质量进行解答.(1)活性炭能够吸附水中的杂质,可以用来净化水.
(2)由图中信息可知,甲烷和氢气可以循环利用.
(3)钛铁矿中含有金属元素铁和钛,和甲烷反应后能够生成铁和钛.
(4)一氧化碳和氢气反应生成甲烷和水,反应的化学方程式为:CO+3H2
一定条件
.
CH4+H2O.
(5)设生成氢气的质量为x.
2H2O
通电
.
2H2↑+O2↑
432
x8kg
[4/x=
32
8kg]
x=1kg
答:生成氢气的质量为1kg.
故答案为:(1)活性炭;
(2)CH4;H2;
(3)铁和钛;
(4)CO+3H2
一定条件
.
CH4+H2O;
(5)1.点评:
本题考点: 物质的相互转化和制备;水的净化;质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算.
考点点评: 本题主要考查净化水的方法和化学方程式的书写等方面的知识,书写化学方程式时要注意遵循质量守恒定律.1年前查看全部
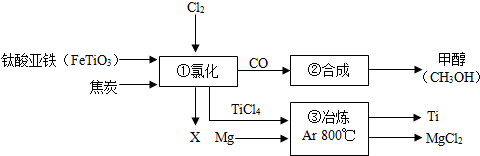
- 工业上制金属钛采用金属热还原法还原四氯化钛.将钛铁矿和炭粉混合加热进行氯化处理,并使生成的TiCl4在高温下用熔融的镁在
工业上制金属钛采用金属热还原法还原四氯化钛.将钛铁矿和炭粉混合加热进行氯化处理,并使生成的TiCl4在高温下用熔融的镁在氩气中反应可得多孔的海绵钛,这种海绵钛经过粉碎、放入真空电弧炉里熔炼,最后制成各种钛材.下图为某化工厂企业生产流程示意图.
Cl2 H2
↓ CO ↓
FeTiO3、焦炭---------→①氯化------→②合成→甲醇(CH3OH)
↓ ↓TiCl4
FeCl3 ↓-----→ ③冶炼 Ar 800℃→Ti、MgCl2
Mg↗
问:②中为是原料全部转化为甲醛,理论上CO和H2投料的质量比为______.
 爱你哦1年前1
爱你哦1年前1 -
 幽幽紫焰 共回答了16个问题
幽幽紫焰 共回答了16个问题 |采纳率93.8%②中为是原料全部转化为甲醛,理论上CO和H2投料的质量比为__14:1____.1年前查看全部
- 以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方
以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4═TiOSO4+FeSO4+2H2O

回答下列问题:
(1)钛铁矿和浓硫酸反应属于______(选填“氧化还原反应”或“非氧化还原反应”).
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是______,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是______、______.
(3)反应TiCl4+2Mg═2MgCl2+Ti在Ar气氛中进行的理由是______.
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2(s)+2Cl2(g)+2C(s)═TiCl4(g)+2CO(g)△H1=-72kJ•mol-1
TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)△H2=+38.8kJ•mol-1
C(s)+CO2(g)═2CO(g)△H3=+282.8kJ•mol-1
反应C(s)+O2(g)═CO2(g)的△H=______. q_linbo1年前1
q_linbo1年前1 -
 rock96 共回答了15个问题
rock96 共回答了15个问题 |采纳率93.3%解题思路:以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,钛铁矿石加入浓硫酸,钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4═TiOSO4+FeSO4+2H2O,加入水溶解后加入铁防止亚铁离子被氧化,沉降分离得到溶液Ⅰ,冷却结晶得到硫酸亚铁晶体,过滤得到溶液Ⅱ为TiOSO4,加热过滤得到滤液为硫酸,沉淀为钛酸煅烧得到二氧化钛,加入氯气和焦炭高温反应,由二氧化钛制取四氯化钛,加入镁反应在Ar气氛中进行,发生的反应为;TiCl4+2Mg═2MgCl2+Ti;
(1)根据氧化还原反应中元素的化合价发生变化进行分析判断;
(2)亚铁离子易被氧化为铁离子,加入金属铁可以防护被氧化,根据流程确定所得到的副产物和可回收利用的物质;
(3)Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,镁和氮气二氧化碳都反应;
(4)根据盖斯定律来计算化学反应的焓变;(1)钛酸亚铁的化学式为FeTiO3,其中铁元素的化合价为+2价,氧元素的化合价为-2价,钛的化合价为+4价,钛铁矿和浓硫酸反应后,TiOSO4中钛的化合价为+4价,硫为+6价,氧元素的化合价为-2价,FeSO4中铁元素的化合价为+2价,氧元素的化合价为-2价,无化合价的变化,是非氧化还原反应,
故答案为:非氧化还原反应;
(2)亚铁离子易被氧化为铁离子,加入金属铁可以防护被氧化,所以A是金属铁,根据流程,所得到的副产物是绿矾,可回收利用的物质是硫酸;
故答案为:Fe;绿矾和硫酸;
(3)Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,镁和二氧化碳反应生成氧化镁和碳,镁和氮气反应生成氮化镁,所以反应TiCl4+2Mg=2MgCl2+Ti需在Ar气氛中进行;
故答案为:防止高温下Mg和Ti与空气中的氧气(或氮气、二氧化碳)作用;
(4)已知反应a、TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)△H1=-72kJ•mol-1
b、TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H2=+38.8kJ•mol-1
c、C(s)+CO2(g)=2CO(g)△H3=+282.8kJ•mol-1
根据盖斯定律,反应C(s)+O2(g)=CO2(g)可以看成是a-b-c获得,所以该化学反应的焓变△H=-72kJ•mol-1-282.8kJ•mol-1-38.8kJ•mol-1=-393.6 kJ/mol,
故答案为:-393.6 kJ/mol;点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;热化学方程式.
考点点评: 本题考查学生化学反应的方向以及元素化合物的性质知识,注意知识的归纳和整理是解题的关键,难度中等.1年前查看全部
- (2010•南通一模)以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与
(2010•南通一模)以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O

回答下列问题:
(1)钛铁矿和浓硫酸反应属于______(选填“氧化还原反应”或“非氧化还原反应”).
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是______,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是______.
(3)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是______.
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)△H1=-72kJ•mol-1
TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H2=+38.8kJ•mol-1
C(s)+CO2(g)=2CO(g)△H3=+282.8kJ•mol-1
①反应C(s)+CO2(g)=2CO(g)在高温下能够自发进行的原因是______.
②反应C(s)+O2(g)=CO2(g)的△H=______. 释然wei1年前1
释然wei1年前1 -
 零冬 共回答了13个问题
零冬 共回答了13个问题 |采纳率84.6%解题思路:(1)根据氧化还原反应中元素的化合价发生变化进行分析判断;
(2)亚铁离子易被氧化为铁离子,加入金属铁可以防护被氧化,根据流程确定所得到的副产物和可回收利用的物质;
(3)Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,镁和氮气二氧化碳都反应;
(4)①根据反应能否自发进行的判据△H-T△S来判断;
②根据盖斯定律来计算化学反应的焓变.(1)钛酸亚铁的化学式为FeTiO3,其中铁元素的化合价为+2价,氧元素的化合价为-2价,钛的化合价为+4价,钛铁矿和浓硫酸反应后,TiOSO4中钛的化合价为+4价,硫为+6价,氧元素的化合价为-2价,FeSO4中铁元素的化合价为+2价,氧元素的化合价为-2价,无化合价的变化,是非氧化还原反应,
故答案为:非氧化还原反应;
(2)亚铁离子易被氧化为铁离子,加入金属铁可以防护被氧化,所以A是金属铁,根据流程,所得到的副产物是绿矾,可回收利用的物质是硫酸,故答案为:Fe;绿矾和硫酸;
(3)Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,镁和二氧化碳反应生成氧化镁和碳,镁和氮气反应生成氮化镁,所以反应TiCl4+2Mg=2MgCl2+Ti需在Ar气氛中进行,
故答案为:防止高温下Mg和Ti与空气中的氧气(或氮气、二氧化碳)作用;
(4)①根据反应能否自发进行的判据△H-T△S,△H>0,所以高温下才自发进行,说明该反应的△S>0(或熵增加),故答案为:△S>0(或熵增加);
②已知反应a、TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)△H1=-72kJ•mol-1
b、TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H2=+38.8kJ•mol-1
c、C(s)+CO2(g)=2CO(g)△H3=+282.8kJ•mol-1
根据盖斯定律,反应C(s)+O2(g)=CO2(g)可以看成是a-b-c获得,所以该化学反应的焓变△H=-72kJ•mol-1-282.8kJ•mol-1-38.8kJ•mol-1=-393.6 kJ/mol,
故答案为:-393.6 kJ/mol.点评:
本题考点: 金属冶炼的一般原理;用盖斯定律进行有关反应热的计算;焓变和熵变.
考点点评: 本题考查学生化学反应的方向以及元素化合物的性质知识,注意知识的归纳和整理是解题的关键,难度不大.1年前查看全部
- (2013•北塘区一模)工业上制金属钛采用金属热还原法还原四氯化钛.将钛铁矿和炭粉混合加热进行氯化处理,并使生成的TiC
(2013•北塘区一模)工业上制金属钛采用金属热还原法还原四氯化钛.将钛铁矿和炭粉混合加热进行氯化处理,并使生成的TiCl4在高温下用熔融的镁在氩气中反应可得多孔的海绵钛,这种海绵钛经过粉碎、放入真空电弧炉里熔炼,最后制成各种钛材.下图为某化工企业生产流程示意图:
请回答下列问题:
(1)钛酸亚铁(FeTiO3)中钛元素的化合价为______;
(2)①中发生的反应为:2FeTiO3+6C+7Cl2
2X+2TiCl4+6CO,则X为______(填化学式);一定条件 .
(3)③中需要氩气(Ar)作保护气,请写出③中反应的化学方程式TiCl4+2Mg
Ti+2MgCl2800℃ .Ar TiCl4+2Mg,并推测钛的一点化学性质______;
Ti+2MgCl2800℃ .Ar
(4)②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为______. lixiaolu691年前1
lixiaolu691年前1 -
 19552662 共回答了17个问题
19552662 共回答了17个问题 |采纳率88.2%解题思路:(1)根据在化合物中正负化合价代数和为零考虑;(2)根据质量守恒定律推断x的化学式;(3)根据化学方程式的书写方法填写化学方程式,根据用氩气作保护气考虑化学性质;(4)根据氢气和一氧化碳反应的方程式考虑质量比.(1)设FeTiO3中P的化合价是x.FeTiO3中Fe的化合价是+2价,O的化合价是-2价,利用化合物中各元素的化合价的代数和为零的原则得到方程(+2)+x+(-2)×3=0
解得,x=+4 所以钛酸亚铁(FeTiO3)中钛元素的化合价是+4价;
(2)根据质量守恒定律,在反应前后各元素原子的个数不变.从2FeTiO3+6C+7Cl2=2X+2TiCl4+6CO看钛原子、氧原子、碳原子反应前后除物质x外个数已经相等,故x中无钛原子、氧原子、碳原子.铁反应前共有2个,反应后只有x有,所以2x中有2个,从而x中有1个;氯原子反应前有14个,反应后x除外有8个,所以2x中有6个,因此x中有3个,因此x的化学式是FeCl3;
(3)TiCl4与Mg反应的反应物是TiCl4与Mg,生成物是Ti和MgCl2,用观察法配平即可,因此该反应的化学方程式是TiCl4+2Mg
800℃
.
ArTi+2MgCl2;需要用氩气作保护气说明钛易与氧气反应;
(4)根据从化学方程式2H2+CO═CH3OH
4 28 由此可知一氧化碳和氢气的质量比是:28:4=7:1.
故答案为:(1)+4;(2)FeCl3;(3)TiCl4+2Mg
800℃
.
ArTi+2MgCl2;(4)7:1.点评:
本题考点: 物质的相互转化和制备.
考点点评: 本题主要考查了化合价的计算、化学方程式的书写以及质量守恒定律的应用,同时考查了学生从题目中获取信息并运用的能力.计算元素的化合价时一定要注意,一定不要忘记填上正号.1年前查看全部
- (2012•通辽)我国发射的“嫦娥一号”对月球进行了全球性和综合性探测,月球表面富含钛铁矿,其主要成分化学式为FeTiO
(2012•通辽)我国发射的“嫦娥一号”对月球进行了全球性和综合性探测,月球表面富含钛铁矿,其主要成分化学式为FeTiO3(钛酸铁),已知铁元素显+3价.则钛元素(Ti)的化合价为( )
A.+1
B.+2
C.+3
D.+4 创意抹布11年前1
创意抹布11年前1 -
 一些地方 共回答了30个问题
一些地方 共回答了30个问题 |采纳率93.3%解题思路:化合物中元素化合价的代数和为零.化合物中氧的化合价为-2,已知铁的化合价为+3,根据上述原则可以计算出钛的化合价.设钛酸铁中钛的化合价为x.
(+3)+x+(-2)×3=0
解得x=+3
故选C.点评:
本题考点: 有关元素化合价的计算;常见元素与常见原子团的化合价;化合价规律和原则.
考点点评: 本题主要考查有关元素化合价的计算,难度稍大.1年前查看全部
- 以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方
以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O

回答下列问题:
(1)钛铁矿和浓硫酸反应属于______(选填“氧化还原反应”或“非氧化还原反应”);
(2)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是______;
(3)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是______,上述制备TiO2的过程中,所得到的副产物及可回收利用的物质是______.
(4)钛、氯气和过量焦炭在高温下反应的化学方程式2Cl2+TiO2+2C
TiCl4+2CO高温 .2Cl2+TiO2+2C;
TiCl4+2CO高温 .
(5)如果取钛铁矿At,生产出钛Bt(不考虑损耗),则钛铁矿中钛的质量分数[B/A]×100%[B/A]×100%(用A、B字母表示). 52612611年前1
52612611年前1 -
 飞雪夜归人 共回答了13个问题
飞雪夜归人 共回答了13个问题 |采纳率84.6%解题思路:(1)根据氧化还原反应中元素的化合价发生变化进行分析判断;(2)Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,镁和氮气二氧化碳都反应;(3)浓硫酸具有强氧化性,与Fe2+反应生成Fe3+,加入铁粉可将Fe3+还原成Fe2+;过滤后滤液中含有FeSO4;由工艺流程图及题中信息可知可回收利用的物质是FeSO4•7H2O、Fe、H2SO4;(4)氯气、二氧化钛和焦炭在高温下反应,由工艺流程图及题中信息可知生成物为四氯化钛和一氧化碳,根据反应前后元素种类不变,即可写出反应的化学方程式;(5)根据钛原子守恒进行解答;(1)钛酸亚铁的化学式为FeTiO3,其中铁元素的化合价为+2价,氧元素的化合价为-2价,钛的化合价为+4价,钛铁矿和浓硫酸反应后,TiOSO4中钛的化合价为+4价,硫为+6价,氧元素的化合价为-2价,FeSO4中铁元素的化合价为+2价,氧元素的化合价为-2价,无化合价的变化,是非氧化还原反应,
故答案为:非氧化还原反应;
(2)Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,镁和二氧化碳反应生成氧化镁和碳,镁和氮气反应生成氮化镁,所以反应TiCl4+2Mg=2MgCl2+Ti需在Ar气氛中进行,
故答案为:防止高温下Mg和Ti与空气中的氧气(或氮气、二氧化碳)作用;
(3)浓硫酸具有强氧化性,与Fe2+反应生成Fe3+,加入铁粉可将Fe3+还原成Fe2+,所以物质A是Fe;过滤后滤液中含有FeSO4,结晶后可得到FeSO4•7H2O晶体,由工艺流程图及题中信息可知上述制备TiO2的过程中,所得到的副产物及可回收利用的物FeSO4•7H2O、Fe、H2SO4,
故答案为:Fe;FeSO4•7H2O、Fe、H2SO4;
(4)氯气、二氧化钛和焦炭在高温下反应,氯气具有氧化性,碳具有还原性,由工艺流程图及题中信息可知生成物为四氯化钛和一氧化碳,根据反应前后元素种类不变,反应的化学方程式为:2Cl2+TiO2+2C
高温
.
TiCl4+2CO,
故答案为:2Cl2+TiO2+2C
高温
.
TiCl4+2CO;
(5)如果取钛铁矿At,生产出钛Bt,根据钛没有损耗,所以生产出的钛的质量等于钛铁矿中钛元素的质量,所以钛铁矿中钛的质量分数[B/A]×100%,
故答案为:[B/A]×100%;点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计.
考点点评: 本题考查以钛铁矿为主要原料冶炼金属钛工艺流程,注意分析流程各反应物的转化是解答的关键,题目难度中等.1年前查看全部
- 材料:人类要在月球居住,首先离不开淡水和氧气,而月球上既没有水又没有空气.科学家发现月球的沙土中含有丰富的含氧钛铁矿,成
 材料:人类要在月球居住,首先离不开淡水和氧气,而月球上既没有水又没有空气.科学家发现月球的沙土中含有丰富的含氧钛铁矿,成分为TiO2、Fe2O3的混合物,若将这些矿石利用CO来还原可以提炼单质钛和铁,若用氢气还原,可以得到淡水.若将这些矿石通电,还可以从中分离出氧气.
材料:人类要在月球居住,首先离不开淡水和氧气,而月球上既没有水又没有空气.科学家发现月球的沙土中含有丰富的含氧钛铁矿,成分为TiO2、Fe2O3的混合物,若将这些矿石利用CO来还原可以提炼单质钛和铁,若用氢气还原,可以得到淡水.若将这些矿石通电,还可以从中分离出氧气.
(1)月球土壤中存在天然的铁、金、银等多种金属矿物颗粒.若将混合金属放入足量的盐酸中充分反应,然后过滤,剩余的固体中可以回收得到的金属组合是______
A.FeB.Au、FeC.Ag、AuD.Fe、Ag
(2)“嫦娥一号”发射的火箭推进器中装有液态肼(用A表示)和过氧化氢(H2O2),它们混合时的反应方程式为:2H2O2+A═N2+4H2O,则肼(A)的化学式为______
A.N2H2B.N2H4O2C.NH2D.N2H4
(3)从铁生锈条件来分析,月球上铁制品______(填“易”或“不易”)生锈.
(4)近日,电影《泰坦尼克号》3D版重现荧屏,掀起一股观影狂潮.这艘号称“永不沉没的巨轮”,在建造的过程中使用了数以万吨的钢铁.钢铁是使用最广的金属材料.
①生铁和钢都是铁合金,其中含碳量较高的是______.
②现利用CO来还原TiO2、Fe2O3的混合物提炼单质钛和铁,装置如图所示,试回答:写出A中发生反应化学方程式(任意一个)3CO+Fe2O3
3CO2+2Fe△ .3CO+Fe2O3.
3CO2+2Fe△ .
③就实验操作顺序的问题两位同学出现了分歧.小月认为先通一段时间CO排空气,然后再点燃C和A中的酒精灯,小亮认为这样做不好,他的理由是______. 天天nn11年前1
天天nn11年前1 -
 zzzdddhhh 共回答了18个问题
zzzdddhhh 共回答了18个问题 |采纳率94.4%解题思路:(1)根据金属活动性顺序表的应用分析.在金属活动性顺序表中,位于氢前面的金属能与酸反应;
(2)根据质量守恒定律可以判断物质的化学式;
(3)根据铁生锈的条件分析判断;
(4)①根据生铁和钢的成分分析;
②根据反应写出反应的方程式;
③根据一氧化碳有毒能污染空气分析.(1)由金属活动性顺序可知,题目中铁、金、银的活动性为:Fe>(H)>Ag>Au;若将混合金属放入足量的盐酸中充分反应,然后过滤,剩余的固体中可以回收得到的金属组合是Ag、Au;(2)由反应2H2O2+A═N2+4H2O可知,...
点评:
本题考点: 金属活动性顺序及其应用;一氧化碳还原氧化铁;生铁和钢;金属锈蚀的条件及其防护;质量守恒定律及其应用.
考点点评: 本题考查燃料的燃烧和一氧化碳还原矿石实验,在设计实验顺序上要注意坚持操作安全、环保的原则,先通一段时间一氧化碳是为了操作安全,先进行尾气处理是为了环保.1年前查看全部
- 月球表面富含钛铁矿,钛因其硬度大、熔点高、常温下耐酸碱、耐腐蚀等优良的性能,被誉为“未来金属”.我国四川省有大型钒钛磁铁
月球表面富含钛铁矿,钛因其硬度大、熔点高、常温下耐酸碱、耐腐蚀等优良的性能,被誉为“未来金属”.我国四川省有大型钒钛磁铁矿,由钒钛磁铁矿提取金属钛的主要工艺过程如下:

①钛铁矿的主要成分是FeTiO3(钛酸亚铁),其中钛的化合价为______价.
②TiCl4在高温下与足量Mg反应生成金属Ti的化学方程式2Mg+TiCl4
2MgCl2+Ti高温 .2Mg+TiCl4,该反应属于______(填基本反应类型).
2MgCl2+Ti高温 .
③上述生产过程中得到的金属钛中混有少量金属杂质,若在实验室提纯上述金属钛,可将其先加入______(填试剂名称)中,再______(填操作名称). aa的地铁1年前1
aa的地铁1年前1 -
 那夜风舞 共回答了16个问题
那夜风舞 共回答了16个问题 |采纳率93.8%解题思路:①根据钛酸亚铁的FeTiO3化学式及化合物中元素化合价的代数和为0计算钛的化合价;
②根据TiCl4在高温下与足量Mg反应生成金属Ti,以及质量守恒定律书写方程式;根据反应物和生成物的种类考虑反应类型.
③根据上述生产过程中的操作判断得到的金属钛中混有少量金属杂质为镁,再根据钛和镁的化学性质判断除杂选择的试剂.①钛酸亚铁的化学式为FeTiO3,因化合物中元素化合价的代数和为0,所以钛的化合价为0-(+2)-(-2)×3=+4;
②TiCl4在高温下与足量Mg反应生成金属Ti根据质量守恒定律,还应有氯化镁,利用观察法配平即可;所以方程式是:2Mg+TiCl4
高温
.
2MgCl2+Ti;反应物是一种单质与一种化合物反应,生成一种新的单质和一种新的化合物,所以反应类型为置换反应.
③根据上述生产过程中的操作判断得到的金属钛中混有少量金属杂质为镁,而钛不能与酸反应,镁能与酸反应,要除去镁,可加入稀盐酸进行过滤操作即可分离.
故答案为:①+4;②2Mg+TiCl4
高温
.
2MgCl2+Ti;置换反应;③盐酸;过滤.点评:
本题考点: 物质的相互转化和制备.
考点点评: 化学与生产、生活是密不可分的,与生产、生活相关的知识也就成了考查热点之一,在学习中要注意理论联系实际,运用化学知识去解决实际问题.1年前查看全部
- 单质钛(Ti)的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO 3 )的方法来制取Ti
单质钛(Ti)的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO 3 )的方法来制取TiO 2 ,再由TiO 2 制金属钛,主要反应有:
①FeTiO 3 +2H 2 SO 4 =TiOSO 4 +FeSO 4 +2H 2 O
②TiOSO 4 +2H 2 O=H 2 TiO 3 ↓+H 2 SO 4
③H 2 TiO 3 TiO 2 +H 2 O
TiO 2 +H 2 O
④TiO 2 +2C+2Cl 2 TiCl 4 +2CO
TiCl 4 +2CO
⑤TiCl 4 +2Mg 2MgCl 2 +Ti
2MgCl 2 +Ti
下列叙述正确的是[ ]A.反应①是氧化还原反应
B.反应②是水解反应
C.反应④中TiO 2 是氧化剂
D.反应⑤需在N 2 的保护下进行 向往大海的非常鱼1年前1
向往大海的非常鱼1年前1 -
 ly1618 共回答了14个问题
ly1618 共回答了14个问题 |采纳率78.6%B1年前查看全部
- (2014•河南模拟)钛合金是航天航空工业的重要材料.由钛铁矿(主要成分是TiO2和Fe的氧化物)制备TiO2等产品的一
(2014•河南模拟)钛合金是航天航空工业的重要材料.由钛铁矿(主要成分是TiO2和Fe的氧化物)制备TiO2等产品的一种工艺流程示意如下:

已知:①TiO2+易水解,只能存在于强酸性溶液中
②TiCl4的熔点-25.0℃,沸点136.4℃;SiCl4的熔点-68.8℃,沸点57.6℃
回答下列问题:
(1)写出钛铁矿酸浸时,主要成分TiO2反应的离子方程式______加入铁屑的作用是______.
(2)操作Ⅱ包含的具体操作方法有______.
(3)向“富含TiO2+溶液”中加入Na2CO3粉末得到固体TiO2•n H2O,请用恰当的原理和化学用语解释其原因______,废液中溶质的主要成分是______(填化学式).
(4)用金红石(主要含TiO2)为原料,采用亨特(Hunter)法生产钛的流程如下:
写出沸腾氯化炉中发生反应的化学方程式TiO2+2C+2Cl2
TiCl4+2CO900℃ .TiO2+2C+2Cl2,制得的TiCl4液体中常含有少量SiCl4杂质,可采用______方法除去.
TiCl4+2CO900℃ .
(5)TiO2直接电解法生产金属钛是一种较先进的方法,电解为某种可以传导O2-离子的熔融盐,原理如图所示,则其阴极电极反应为:______,电解过程中阳极电极上会有气体生成,该气体可能含有______.
 yonghu12341年前1
yonghu12341年前1 -
 heroine1218 共回答了20个问题
heroine1218 共回答了20个问题 |采纳率95%解题思路:钛铁矿中加入稀硫酸,经充分反应后过滤,所得滤液中含有TiO2+、Fe2+、Fe3+等离子,从溶液中得到硫酸亚铁晶体,应经过蒸发浓缩、冷却结晶,过滤后得到富含的TiO2+溶液,加入Na2CO3粉末与H+反应,降低了溶液中c(H+),使平衡TiO2++(n+1)H2O⇌TiO2•n H2O+2H+向生成TiO2•n H2O的方向移动,可得到TiO2粗产品,以此解答该题.钛铁矿中加入稀硫酸,经充分反应后过滤,所得滤液中含有TiO2+、Fe2+、Fe3+等离子,从溶液中得到硫酸亚铁晶体,应经过蒸发浓缩、冷却结晶,过滤后得到富含的TiO2+溶液,加入Na2CO3粉末与H+反应,降低了溶液中c(H+),使平衡TiO2++(n+1)H2O⇌TiO2•n H2O+2H+向生成TiO2•n H2O的方向移动,可得到TiO2粗产品,
(1)由题给反应流程可知TiO2与酸反应生成TiO2+,则反应的离子方程式为TiO2+2H+=TiO2++H2O,加入铁屑,可得到硫酸亚铁晶体,说明加入铁屑的作用是使Fe3+还原为Fe2+,
故答案为:TiO2+2H+=TiO2++H2O;使Fe3+还原为Fe2+;
(2)从溶液中得到硫酸亚铁晶体,应经过蒸发浓缩、冷却结晶,过滤等操作,有时需要洗涤晶体,以除去表面吸附的离子,
故答案为:蒸发浓缩,冷却结晶,过滤(洗涤);
(3)富含的TiO2+溶液,加入Na2CO3粉末与H+反应,降低了溶液中c(H+),使平衡TiO2++(n+1)H2O⇌TiO2•n H2O+2H+向生成TiO2•n H2O的方向移动,可得到TiO2粗产品,在整个制备流程中分别加入硫酸和碳酸钠,则废液中主要含有硫酸钠,即Na2SO4,
故答案为:溶液中存在水解平衡TiO2++(n+1)H2O⇌TiO2•n H2O+2H+,加入的Na2CO3粉末与H+反应,降低了溶液中c(H+),促进水解平衡向生成TiO2•n H2O的方向移动;Na2SO4;
(4)由反应流程可知TiO2、C和Cl2反应生成TiCl4和CO,则反应的化学方程式为TiO2+2C+2Cl2
900℃
.
TiCl4+2CO,制得的TiCl4液体中常含有少量SiCl4杂质,因二者的沸点不同,可用蒸馏的方法分离,
故答案为:TiO2+2C+2Cl2
900℃
.
TiCl4+2CO;蒸馏(或分馏);
(5)电解时,阴极发生还原反应生成Ti,电极方程式为TiO2+4e-=Ti+2O2-,阳极发生氧化反应,电极方程式为2O2-+4e-=O2,阳极生成O2,由于阳极材料为石墨,则氧气和石墨反应可生成CO、CO2等,
故答案为:TiO2+4e-=Ti+2O2-;O2、CO、CO2.点评:
本题考点: 制备实验方案的设计;电解原理;常见金属元素的单质及其化合物的综合应用.
考点点评: 本题考查物质的制备、为高考常见题型,侧重于学生的分析能力、实验能力的考查,注意把握实验的原理和目的,为解答该类题目的关键,注意物质的性质,结合题给信息解答,难度中等.1年前查看全部
- 单质钛的机械强度高,抗腐蚀能力强,有“未来金属”之称.工业上常用硫酸分解钛铁矿(主要成分是钛酸亚铁FeTiO3)的方法来
单质钛的机械强度高,抗腐蚀能力强,有“未来金属”之称.工业上常用硫酸分解钛铁矿(主要成分是钛酸亚铁FeTiO3)的方法来制取TiO2,再由TiO2制金属钛.主要反应有:
①FeTiO3+3H2SO4═Ti(SO4)2+FeSO4+3H2O
②Ti(SO4)2+3H2O═H2TiO3↓+2H2SO4
③H2TiO3
TiO2+H2O△
④TiO2+2C+2Cl2
TiCl4+2CO△
⑤TiCl4+2Mg
2MgCl2+Ti△
下列叙述正确的是( )
A.反应①是氧化还原反应
B.反应②是氧化还原反应
C.反应④中TiO2是氧化剂
D.反应⑤中TiCl4是氧化剂 xaxia1年前1
xaxia1年前1 -
 haha25 共回答了17个问题
haha25 共回答了17个问题 |采纳率94.1%解题思路:A、依据反应前后元素化合价的变化分析判断;
B、依据反应前后元素化合价的变化判断;
C、钛元素化合价未变;
D、钛元素化合价降低作业环境;A、①反应前后无化合价的变化,不是氧化还原反应,故A错误;
B、反应②前后无元素化合价的变化,不是氧化还原反应,故B错误;
C、反应④中 钛元素化合价无变化,故C错误;
D、反应⑤钛元素从+4价变化为0价,做氧化剂,故D正确;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化反应、化合价、反应类型及原子与离子的关系,考查知识点全面,题目适中.1年前查看全部
- 四氯化钛(TiCl4)是制取航天航空工业的材料--钛合金的重要原料.由钛铁矿(主要成份是FeTiO3)制备TiCl4等产
四氯化钛(TiCl4)是制取航天航空工业的材料--钛合金的重要原料.由钛铁矿(主要成份是FeTiO3)制备TiCl4等产品的一种工艺流程示意图如下:
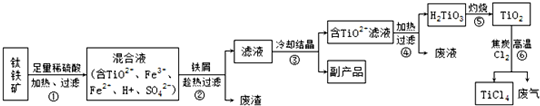
(1)步骤①钛铁矿加硫酸前经过选矿、洗涤、粉碎,其中粉碎的目的是______.
(2)步骤②加入铁屑,发生反应的化学方程式有______和Fe2(SO4)3+Fe═3FeSO4.
(3)步骤③制得的副产品是(填名称)______晶体.
(4)步骤⑤灼烧发生的反应类型是______反应.
(5)步骤⑥TiO2和焦炭、氯气反应生成TiCl4和CO的化学方程式:TiO2+2C+2Cl2
TiCl4+2CO高温 .TiO2+2C+2Cl2.
TiCl4+2CO高温 .
(6)上述工艺具有成本低、可以用低品位的矿物为原料等优点,但依据绿色化学理念,该工艺流程中存在的不足之处是______.
(7)上述流程中多次进行过滤操作,在实验室中,过滤必须用到的玻璃仪器有______. annehechen1年前1
annehechen1年前1 -
 melikexing 共回答了21个问题
melikexing 共回答了21个问题 |采纳率95.2%解题思路:(1)根据加快反应速度的方法考虑;(2)根据混合液中的物质考虑;(3)根据铁与硫酸反应、铁与硫酸铁反应的生成物考虑;(4)根据反应物和生成物的种类考虑;(5)根据方程式的写法考虑;(6)根据排放的物质考虑;(7)根据过滤时用到的仪器考虑.(1)增大可燃物接触面积可以使反应速度加快,反应充分,粉碎的目的是增大接触面积,使反应充分;
(2)由于混合物中含有硫酸,所以加入铁后,铁与硫酸反应生成硫酸亚铁和氢气,氢气后面标上上升符号;
(3)由于在步骤②中铁与硫酸反应生成硫酸亚铁和氢气,铁与硫酸铁反应生成硫酸亚铁,所以趁热过滤后可得到硫酸亚铁晶体;
(4)步骤⑤灼烧发生的反应的反应物是H2TiO3,生成物是TiO2和H2O,反应物只有一种物质,生成物有两种,属于分解反应;
(5)反应物是TiO2和焦炭、氯气,生成物是四氯化钛和一氧化碳,用观察法配平,反应条件是高温写在等号的上边;
(6)该工艺流程能释放出废液、废气、废渣污染环境;
(7)过滤用到的仪器有:铁架台、烧杯、漏斗、玻璃棒;所以玻璃仪器有:漏斗、烧杯、玻璃棒.
故答案为:(1)增大接触面积,使反应充分;(2)H2SO4+Fe═FeSO4+H2↑;(3)硫酸亚铁;(4)分解;(5)TiO2+2C+2Cl2
高温
.
TiCl4+2CO;(6)产生三废;(7)漏斗、烧杯、玻璃棒.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;绿色化学;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题关键是要熟悉加快反应速度的方法,方程式的书写方法,分解反应的特点,知道过滤操作用到的仪器,尤其是主要的玻璃仪器.1年前查看全部
- 四氯化钛(TiCl 4 )是制取航天航空工业材料--钛合金的重要原料,由钛铁矿(主要成分是FeTiO 3 )制备
四氯化钛(TiCl 4 )是制取航天航空工业材料--钛合金的重要原料,由钛铁矿(主要成分是FeTiO 3 )制备
TiCl 4 等产品的一种工艺流程示意如下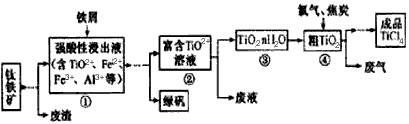
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生。
2Fe 3+ +Fe == 3Fe 2+
2TiO 2+ (无色) +Fe+4H + === 2Ti 3+ (紫色) +Fe 2+ +2H 2 O
Ti 3+ (紫色) +Fe 3+ +H 2 O === TiO 2+ (无色) +Fe 2+ +2H +
加入铁屑的作用是____________。
(2)在②→③工艺中需要控制条件以形成TiO 2 ·nH 2 O溶胶,该分散质颗粒直径大小在_____________范围。
(3)若把③中制得的固体TiO 2 ·nH 2 O用酸清洗除去其中的Fe(OH) 3 杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH) 3 ]=2.79×10 -39 ,该温度下反应Fe(OH) 3 +3H + Fe 3+ +H 2 O的平衡常数K=___________。
Fe 3+ +H 2 O的平衡常数K=___________。
(4)已知:TiO 2 (s) +2Cl 2 (g)=== TiCl 4 (l) +O 2 (g) △H=+140KJ·mol -1
2C(s) +O 2 (g)=== 2CO(g) △H=-221KJ·mol -1
写出④中TiO 2 和焦炭、氯气反应生成液态TiCl 4 和CO气体的热化学方程式:_____________。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_____________(只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl 4 杂质的TiCl 4 ,可采用_____________方法。
 驴骑士1年前1
驴骑士1年前1 -
 殷玥8125 共回答了20个问题
殷玥8125 共回答了20个问题 |采纳率90%(1)生成Ti 3+ ,保护Fe 2+ 不被氧化
(2)10 -9 ~10 -7 m
(3)2.79×10 3
(4)TiO 2 (s)+2C(s)+2Cl 2 (g)=TiCl 4 (l)+2CO(g) △H=-81kJ·mol -1
(5)产生了废气,废液,废渣等
(6)蒸馏(或分馏)1年前查看全部
- (2013•昆明模拟)工业上,以钛铁矿为原料制备二氧化钛的某工艺流程如图1所示.钛铁矿主要成分为钛酸亚铁( T
(2013•昆明模拟)工业上,以钛铁矿为原料制备二氧化钛的某工艺流程如图1所示.钛铁矿主要成分为钛酸亚铁( TETiO3).其中一部分铁元素在风化过程中会转化为+3价.
完成下列填空:
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为______.
(2)步骤③中,实现混合物的分离是利用物质的______(填字母序号).
a.熔沸点差异b溶解性差异c氧化性、还原性差异
(3)步骤②、③、④中,均需进行的操作是______(填操作名称).
(4)可利用生产过程中的废液与软锰矿(主要成分MnO2)反应生产硫酸锰,则反应的离子方程式为
(5)利用图2装置,石墨作阳极,钛网作阴极,熔融CaF2-CaO做电解质,可获得金属钙,钙再作为还
原剂,可还原二氧化钛制各金属钛.
①阳极所发生的反应为______.
②在制备金属钛前后,CaO的总量不变,其原因是电解槽中发生反应:2CaO
2Ca+O2↑,钙还原二氧化钛反应方程式为:2Ca+TiO2=Ti+2CaO,在制备金属钛前后,整套装置中CaO的总量不变通电 .电解槽中发生反应:2CaO.
2Ca+O2↑,钙还原二氧化钛反应方程式为:2Ca+TiO2=Ti+2CaO,在制备金属钛前后,整套装置中CaO的总量不变通电 .
(6)T业上用4.0吨钛铁矿制得1 6吨的二氧化钛,则钛铁矿中钛元素的质量分数是______.(假设生产过程中钛没有损失) 我心枯寂1年前1
我心枯寂1年前1 -
 zyfmouse 共回答了16个问题
zyfmouse 共回答了16个问题 |采纳率100%解题思路:(1)金属铁可以和铁离子反应生成亚铁离子,结合电荷守恒、原子守恒配平写出离子方程式;
(2)根据物质溶解度本题分析析出晶体的条件应用;
(3)依据操作过程中形成的物质溶解性和分离目的分析回答;
(4)依据二氧化锰的氧化性氧化亚铁离子分析氧化还原反应生成二价锰的化合物,结合电荷守恒和原子守恒写出;
(5)①依据图示生成物质的分析,阳极生成二氧化碳,阴极析出钙,结合电解池中阳极发生氧化反应,阴极发生还原反应,写出电极反应;
②根据电解槽中发生的反应:2CaO
2Ca+O2↑以及钙还原二氧化钛反应方程式:2Ca+TiO2=Ti+2CaO来回答;通电 .
(6)根据钛原子守恒进行解答.(1)用铁粉将Fe3+转化为Fe2+的反应的离子方程式为:2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(2)步骤③冷却结晶得到硫酸亚铁晶体,利用的是物质溶解度的不同,通过冷却热饱和溶液得到,故答案为:b;
(3)②③④步骤的操作过程中都得到沉淀或晶体,所以需要过滤得到固体和溶液,故答案为:过滤;
(4)利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),利用二氧化锰的氧化性氧化亚铁离子为三价铁离子,反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(5)①用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,阳极发生氧化反应,阴极析出钙金属发生还原反应,阳极图示产物可可知,阳极生成二氧化碳气体,是电解质中的氧离子失电子生成氧气,氧气和阳极石墨反应生成的二氧化碳,所以电极反应为:2O2--4e-=O2↑,或C+2O2--4e-=CO2↑;
故答案为:2O2--4e-=O2↑,或C+2O2--4e-=CO2↑;
②阴极上电极反应式为:2Ca2++4e-═2Ca,阳极上电极反应为:2O2--4e-=O2↑,电解槽中发生反应:2CaO
通电
.
2Ca+O2↑,钙还原二氧化钛反应方程式为:2Ca+TiO2=Ti+2CaO,在制备金属钛前后,整套装置中CaO的总量不变,故答案为:电解槽中发生反应:2CaO
通电
.
2Ca+O2↑,钙还原二氧化钛反应方程式为:2Ca+TiO2=Ti+2CaO,在制备金属钛前后,整套装置中CaO的总量不变;
(6)如果取钛铁矿4t,生产出16吨的二氧化钛,其中钛元素的质量是16×[48/80]×100%=9.6t,所以钛铁矿中钛的质量分数[9.6/4]×100%=24%,
故答案为:24%.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;电解原理.
考点点评: 本题考查了物质分离的流程分析判断,物质性质的应用,离子性质的应用,分离操作的方法,氧化还原反应的离子方程式的书写方法,电解池原理的应用,电极反应的书写原则.1年前查看全部
- (13分)[探究一]为测定钛铁矿(含FeTiO 3 ,钛酸亚铁)中可提取氧的质量分数,某研究性学习小组设计了以下两套实验
(13分)
[探究一]为测定钛铁矿(含FeTiO 3 ,钛酸亚铁)中可提取氧的质量分数,某研究性学习小组设计了以下两套实验装置:(注:可提取氧指的是可被H 2 、C转化为H 2 O、CO 2 的氧原子)
(1)已知FeTiO 3 被H 2 还原后,生成Fe、TiO 2 和水,学生甲设想用图-1装置(A为电加热装置)从钛铁矿中提取氧。请写出FeTiO 3 在加热时被H 2 还原的化学方程式:
___________________________________________________________________
(2)已知FeTiO 3 被C还原后生成Fe、TiO 2 和CO 2 ,学生乙设想用图-2装置(A为电加热装置)从钛铁矿中提取氧,并且认为该方案的意义在于:反应产生的CO 2 可通过绿色植物的光合作用转化为营养物质,同时产生氧气:
6CO 2 +6H 2 O C 6 H 12 O 6 (葡萄糖)+6O 2 。
C 6 H 12 O 6 (葡萄糖)+6O 2 。
实验过程中,称得反应前装置A中钛铁矿的质量为ag,炭粉的质量为bg,反应后装置B中产生CaCO 3 的质量为cg,则钛铁矿中可提取氧的质量分数的表达式为 。
(3)经专家评审后,认定两个方案都很有意义,但实验设计方面还存在不足之处,例如图-2装置在加热时,生成的CO 2 不可能全部被澄清石灰水吸收,同时钛铁矿和炭粉在加热时还会产生CO,给实验带来误差。
①请对学生乙的设想提出改进措施:改用图-1装置加热钛铁矿和炭粉,并在U型管B之前增加盛有 __________ 的燃烧管,在B之后增加 。
②改进后,实验自始至终需持续向装置A中通入N 2 的目的是 。
[探究二]纳米TiO 2 作为一种光催化剂越来越受到人们的关注,现正广泛开发运用。
(4)某科研小组在不同的载体(钛片、铝片、陶瓷)表面制备二氧化钛薄膜,来考察不同载体TiO 2 薄膜光催化使甲基橙脱色,每次光照20min取一次样,实验结果如图所示,下列说法正确的是 。(双选)
(a)不同载体,无论何种温度一定是钛片最好
(b)约在520℃时,钛片载体的光催化活性最好
(c)无论何种载体,催化活性总是随温度的升高而升高
(d)不同负载TiO 2 薄膜的光催化活性不同 红骆驼5551年前1
红骆驼5551年前1 -
 傻傻乖乖 共回答了20个问题
傻傻乖乖 共回答了20个问题 |采纳率80%1年前查看全部
- 多少克钛铁矿中所含铁的质量与15克三氧化二铁中所含铁的质量相等
 小玲龙1年前1
小玲龙1年前1 -
 关注掘金 共回答了12个问题
关注掘金 共回答了12个问题 |采纳率91.7%2FeTiO3 -----Fe2O3
2*152 160
x 15 克
304/160=x/15 克
x= 28.5 克1年前查看全部
- (2012•河西区一模)月球表面富含钛铁矿,其主要成分是钛酸亚铁(FeTiO3),其中钛元素的化合价为( )
(2012•河西区一模)月球表面富含钛铁矿,其主要成分是钛酸亚铁(FeTiO3),其中钛元素的化合价为( )
A.+1
B.+2
C.+3
D.+4 疯叻1年前1
疯叻1年前1 -
 381986665 共回答了16个问题
381986665 共回答了16个问题 |采纳率93.8%解题思路:根据在化合物中正负化合价代数和为零,进行解答.根据在化合物中正负化合价代数和为零,可得钛酸亚铁(FeTiO3)中钛元素的化合价为:
(+2)+x+(-2)×3=0,x=+4;故选D.点评:
本题考点: 化学式的书写及意义;常见元素与常见原子团的化合价;化合价规律和原则.
考点点评: 本题考查学生根据在化合物中正负化合价代数和为零计算指定元素化合价的解题能力.1年前查看全部
- 由钛铁矿(主要成分是FeO和TiO2的混合物)提取金属钛(化学式为Ti)的主要工艺流程如下:
由钛铁矿(主要成分是FeO和TiO2的混合物)提取金属钛(化学式为Ti)的主要工艺流程如下:

(1)上述流程中的物质属于氧化物的是______(填一种化学式即可),属于非金属单质的是______(填一种化学式即可),TiO2中钛元素的化合价是______.
(2)步骤Ⅰ中FeO和碳反应生成二氧化碳和铁,反应的符号表达式是2FeO+C
2Fe+CO2↑高温 .2FeO+C.
2Fe+CO2↑高温 .
(3)该流程中可循环利用的物质是______. galant33101年前1
galant33101年前1 -
 bnu_dudu 共回答了25个问题
bnu_dudu 共回答了25个问题 |采纳率84%解题思路:找氧化物,根据定义即可,必须有一种元素为氧元素,FeO和TiO2 都属于氧化物;由金属原子构成了金属单质,如Fe、Mg、Ti等;根据物质的化合价代数和为零,得出TiO2中钛的化合价为+4;根据反应物和生成物,写出反应的化学方程式,用观察法配平即可;该流程中可循环利用的物质是在前面作为反应物,最后作为生成物,可以循环使用.(1)很明显,上述流程中的物质属于氧化物的有FeO和TiO2 ;属于金属单质有Fe、Mg、Ti,碳、氯气都属于非金属单质,化学符号是C、Cl2;TiO2中氧的化合价为-2,则根据物质的化合价代数和为零,得出钛的化合价为+4;
(2)已知反应物是氧化亚铁和碳,生成物是二氧化碳和铁,用观察法配平,所以方程式是:2FeO+C
高温
.
2Fe+CO2↑;
(3)该流程中可循环利用的物质是在前面作为反应物,最后作为生成物,可以循环使用.由图示可知镁作为该过程循环利用的物质.
故答案为:(1)FeO(或TiO2 );(2)C;Cl2(写对一个即得分)+4;(2)2FeO+C
高温
.
2Fe+CO2↑;(3)Mg.点评:
本题考点: 物质的相互转化和制备;从组成上识别氧化物;单质和化合物的判别;有关元素化合价的计算;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查金属的冶炼,可用碳作还原剂,从钛铁矿(主要成分是FeO和TiO2)提取金属钛,本题略有难度.1年前查看全部
- (2008•大庆)月岩中钛铁矿主要成分的化学式为FeTiO3,其中铁元素的化合价为+3,钛元素化合价为( )
(2008•大庆)月岩中钛铁矿主要成分的化学式为FeTiO3,其中铁元素的化合价为+3,钛元素化合价为( )
A.+1
B.+2
C.+3
D.+4 云雨er1年前1
云雨er1年前1 -
 rinchen 共回答了23个问题
rinchen 共回答了23个问题 |采纳率95.7%解题思路:根据主要成分的化学式为FeTiO3,及铁元素的化合价为+3,利用化合物中元素的正负化合价代数和等于0来解答.在FeTiO3中,铁元素的化合价为+3,氧元素的化合价为-2,
设Ti的化合价为x,
由化学式为FeTiO3,并根据化合物中元素的正负化合价代数和等于0,则
(+3)+x+(-2)×3=0
解得x=+3
故选:C.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查根据化学式确定元素的化合价,学生应利用好习题中的化学式及铁元素的化合价,注重与课本知识的结合来解决信息中的同类问题.1年前查看全部
- (2011•福建)四氯化钛(TiCl4)是制取航天航空工业材料--钛合金的重要原料,由钛铁矿(主要成分是FeTiO3)制
(2011•福建)四氯化钛(TiCl4)是制取航天航空工业材料--钛合金的重要原料,由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:

回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性.该过程中有如下反应发生.
2Fe3++Fe═3Fe2+
2TiO2+(无色)+Fe+4H+═2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O═TiO2+(无色)+Fe2++2H+
加入铁屑的作用是______.
(2)在②→③工艺中需要控制条件以形成TiO2•nH2O溶胶,该分散质颗粒直径大小在______范围.
(3)若把③中制得的固体TiO2•nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉.已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+⇌Fe3++H2O的平衡常数K=______.
(4)已知:TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ•mol-1;2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:______.
(5)上述工艺具有成本低、可用低品位矿物为原料等优点.依据绿色化学理念,该工艺流程中存在的不足之处是______(只要求写出一项).
(6)依据如表信息,要精制含少量SiCl4杂质的TiCl4,可采用______方法.
TiCl4 SiCl4 熔点/℃ -25.0 -68.8 沸点/℃ 136.4 57.6  两个小肥肥1年前1
两个小肥肥1年前1 -
 fatexuanwu 共回答了9个问题
fatexuanwu 共回答了9个问题 |采纳率88.9%解题思路:(1)往①中加入铁屑至浸出液显紫色,说明浸出液中含有Ti3+,由方程式可知,Fe3+氧化为Ti3+;
(2)控制条件以形成TiO2•n H2O溶胶,说明得到胶体,其分散质颗粒直径大小为10-9~10-7m(或1nm-100nm);
(3)依据平衡常数的概念结合反应写出计算式计算平衡浓度得到;
(4)依据热化学方程式和盖斯定律计算分析得到;
(5)绿色化学应零污染、零排放,原子利用率100%.结合工艺流程三废回答;
(6)由表中数据可知,SiCl4、TiCl4为液体,二者沸点相差较大,通常采取蒸馏方法分离.(1)往①中加入铁屑至浸出液显紫色,说明浸出液中含有Ti3+,由方程式可知,Fe3+氧化为Ti3+,加入铁屑作还原剂,将Fe3+还原为Fe2+,防止Ti3+被Fe3+氧化成TiO2+,
故答案为:防止Ti3+被Fe3+氧化成TiO2+;
(2)控制条件以形成TiO2•n H2O溶胶,说明得到胶体,其分散质颗粒直径大小为10-9~10-7m(或1nm-100nm),
故答案为:10-9~10-7m(或1nm-100nm);
(3)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=2.79×10-39,反应Fe (OH)3+3H+⇌Fe3++H2O的平衡常数K=
c(Fe3+)
c3(H+)=
c(Fe3+)
(
10−14
c(OH−))3=c(Fe3+)×c3(OH-)×1042=2.79×10-39×1042=2.79×103.
故答案为:2.79×103;
(4)①TiO2 (s)+2Cl2 (g)═TiCl4(l)+O2(g)△H=+140KJ•mol-1
②2C(s)+O2(g)═2CO(g)△H=-221KJ•mol-1
依据盖斯定律①+②得到:TiO2(s)+2C(s)+2Cl2 (g)=TiCl4(l)+2CO(g)△H=-81KJ•mol-1;
故答案为:TiO2(s)+2C(s)+2Cl2 (g)=TiCl4(l)+2CO(g)△H=-81KJ•mol-1
(5)由工艺流程可知,生成中产生废气,废液,废渣等,不符合绿色化学理念,
故答案为:产生了废气,废液,废渣等;
(6)由表中数据可知,SiCl4、TiCl4为液体,二者沸点相差较大,要精制含少量SiCl4杂质的TiCl4,可采用蒸馏(或分馏)方法,
故答案为:蒸馏(或分馏);点评:
本题考点: 制备实验方案的设计;热化学方程式;化学平衡常数的含义;难溶电解质的溶解平衡及沉淀转化的本质;常见金属元素的单质及其化合物的综合应用;物质的分离、提纯和除杂.
考点点评: 本题考查学生阅读题目获取信息能力、氧化还原反应、绿色化学、胶体、物质分离提纯,平衡常数计算,溶度积常数的计算应用,盖斯定律的计算应用等,难度不大,注意基础知识的掌握利用.1年前查看全部
- (2013•建宁县质检)月球的沙土中含有丰富钛铁矿,主要成分为TiO2、Fe2O3等,若用CO还原这种矿石,其中生成铁的
(2013•建宁县质检)月球的沙土中含有丰富钛铁矿,主要成分为TiO2、Fe2O3等,若用CO还原这种矿石,其中生成铁的化学方程式为:3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3;用稀盐酸清洗铁钉表面的铁锈(主要成分是Fe2O3),其化学方程式为:______,该反应的反应类型是______反应.
2Fe+3CO2高温 . yumaoqiu0011年前1
yumaoqiu0011年前1 -
 jasonlium 共回答了13个问题
jasonlium 共回答了13个问题 |采纳率84.6%解题思路:根据一氧化碳具有还原性,会将氧化铁中的铁还原出来进行分析;
根据金属氧化物会与酸反应进行分析,
根据反应物、生成物的类别判断反应的基本类型.一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,故答案为:3CO+Fe2O3
高温
.
2Fe+3CO2;
盐酸和氧化铁反应生成氯化铁和水,该反应由两种化合物相互交换成分形成两种新的化合物,符合复分解反应的概念,属于复分解反应,故答案为:6HCl+Fe2O3=2FeCl3+3H2O,复分解.点评:
本题考点: 一氧化碳还原氧化铁;金属锈蚀的条件及其防护;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类方程式的书写题时,首先确定反应原理,然后再依据原理找出反应物、生成物和反应条件,根据方程式的书写规则书写方程式.1年前查看全部
- 月球的沙土中含有丰富的钛铁矿,主要成分tio2 fe2o3等,若用一氧化碳还原这种矿
 吕美凤1年前1
吕美凤1年前1 -
 cryspirit 共回答了16个问题
cryspirit 共回答了16个问题 |采纳率81.3%等你运回来,1年前查看全部
- (2011•武昌区模拟)钛是一种重要的金属,工业上用钛铁矿(FeTiO3,含FeO、Al2O3、SiO2等杂质)为原料制
(2011•武昌区模拟)钛是一种重要的金属,工业上用钛铁矿(FeTiO3,含FeO、Al2O3、SiO2等杂质)为原料制钛白粉(TiO2),TiO2常通过两种方法还原可制得Ti.
其中,2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O.回答下列问题.
(1)净化钛矿石时,需用浓氢氧化钠溶液来处理,该过程中发生反应的化学方程式有:
SiO2+2NaOH=Na2SiO3+H2O和______.
(2)滤液①中的溶质主要是FeSO4,检验其中Fe2+的方法是:
______.
(3)从TiOSO4→H2TiO3需要加热,则加热的目的是______.
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池.其阴极反应的电极反应式为______.
(5)因为TiO2 (s)+2Cl2 (g) TiCl4(l)+O2 (g);△H=+151kJ/mol反应难于发生,所以工业上不能直接由TiO2和Cl2反应来制取TiCl4.当反应体系中加入碳后,反应分如下两步进行(如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热相同).
TiCl4(l)+O2 (g);△H=+151kJ/mol反应难于发生,所以工业上不能直接由TiO2和Cl2反应来制取TiCl4.当反应体系中加入碳后,反应分如下两步进行(如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热相同).
2C(s)+O2(g)=2CO (g);△H=-221kJ/mol.
TiO2(s)+2C (s)+2Cl2 (g) TiCl4 (l)+2CO (g);△H=______.
TiCl4 (l)+2CO (g);△H=______.
(6)从化学平衡的角度解释:往TiO2和Cl2反应体系中加入碳后,能使反应TiO2 (s)+2Cl2 (g) TiCl4(l)+O2 (g)顺利进行的原因是______.
TiCl4(l)+O2 (g)顺利进行的原因是______.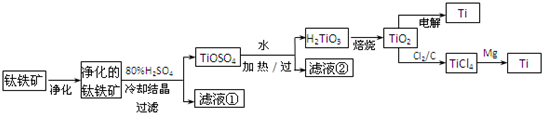
 爱上娇子的女人1年前1
爱上娇子的女人1年前1 -
 第661次求婚 共回答了15个问题
第661次求婚 共回答了15个问题 |采纳率93.3%解题思路:(1)根据钛铁矿中的杂质与碱反应;
(2)根据检验Fe2+的方法;
(3)根据TiOSO4的水解;
(4)根据电解原理及题目信息;
(5)根据盖斯定律;
(6)从平衡移动的角度(1)钛铁矿含FeO、Al2O3、SiO2等杂质,能与碱反应物质除了SiO2还有Al2O3,故答案为:Al2O3+2NaOH=2NaAlO2+H2O.
(2)因滤液①中的溶质主要是FeSO4,所一先加几滴KSCN溶液,再加几滴氯水,观察溶液是否变为红色,故答案为:取少许滤液①于试管中,滴入几滴KSCN溶液,无明显现象,然后滴入几滴氯水,溶液变为红色,说明其中含有Fe2+.
(3)因加热能够促进水解的进行,故答案为:促进TiOSO4的水解.
(4)因TiO2作阴极,得到电子,被还原,得到单质Ti,故答案为:TiO2 +4e-=Ti+2O2-.
(5)因热化学方程式遵循盖斯定律,第一个式子加上第二的式子得到第三个式子,故答案为:-70 kJ/mol
(6)因减少生成物的浓度,平衡正向移动,故答案为:碳单质与氧气反应减小产物浓度使平衡向右移动,导致反应顺利进行.点评:
本题考点: 金属冶炼的一般原理;有关反应热的计算;化学平衡的影响因素;盐类水解的应用;硅和二氧化硅;镁、铝的重要化合物;铁的氧化物和氢氧化物.
考点点评: 本题考查的知识点较多,试题的综合性较强,培养了学生解决问题的能力.1年前查看全部
- (2014•保亭县模拟)月球的沙土中含有丰富钛铁矿,主要成分为TiO2、Fe2O3等,若用CO还原这种矿石,其中生成铁的
(2014•保亭县模拟)月球的沙土中含有丰富钛铁矿,主要成分为TiO2、Fe2O3等,若用CO还原这种矿石,其中生成铁的化学方程式为3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3.
2Fe+3CO2高温 . happyaruan1年前1
happyaruan1年前1 -
 vv的长空 共回答了16个问题
vv的长空 共回答了16个问题 |采纳率100%解题思路:根据题干信息找出反应物、生成物以及反应条件.然后,书写化学式并配平即可.在高温的条件下,氧化铁与一氧化碳反应生成铁和二氧化碳;故答案为:3CO+Fe2O3
高温
.
2Fe+3CO2.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 书写化学方程式时,一要尊重客观事实,二要遵循质量守恒定律.按照书写化学方程式的步骤来分析.1年前查看全部
- 有谁知道熔炼高钛渣对钛铁矿或钛精矿具体的成分要求吗?
有谁知道熔炼高钛渣对钛铁矿或钛精矿具体的成分要求吗?
现在我们钛精矿的钛品味不高,不到40%,请问作为熔炼高钛渣的原料还有没有其他的具体化学成分要求? 奋斗的我1年前1
奋斗的我1年前1 -
 xxxzy 共回答了20个问题
xxxzy 共回答了20个问题 |采纳率85%钛矿质量指标:
1.化工级
TiO2>49%
Fe2O380%
或 TiO2+Fe2O3+FeO>91%
说明:Fe2O3越低越好,FeO越高越好.
3.焊条级
TiO2>48%
P1年前查看全部
- 单质钛的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO 3 )的方法制取二氧化钛,再由
单质钛的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO 3 )的方法制取二氧化钛,再由二氧化钛制金属钛,主要反应有:
①FeTi0 3 +3H 2 SO 4 =Ti(SO 4 ) 2 +FeSO 4 +3H 2 O②Ti(SO 4 ) 2 +3H 2 O=H 2 TiO 3 ↓+2H 2 SO 4
③H 2 TiO 3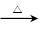 TiO 2 +H 2 O④TiO 2 +2C+2Cl 2
TiO 2 +H 2 O④TiO 2 +2C+2Cl 2  TiCl 4 ↑+CO↑
TiCl 4 ↑+CO↑
⑤TiCl 4 +2Mg 2MgCl 2 +Ti
2MgCl 2 +Ti
下列叙述错误的是( )A.反应①属于非氧化还原反应 B.反应②是水解反应 C.反应④中二氧化钛是氧化剂 D.反应⑤表现了金属镁还原性比金属钛强  空寂的黎明1年前1
空寂的黎明1年前1 -
 一觉回到ll前 共回答了18个问题
一觉回到ll前 共回答了18个问题 |采纳率94.4%C
1年前查看全部
- (2013•如东县模拟)钛具有硬度大、密度小、熔点高、抗腐蚀性等优良性能,被誉为“未来金属”.钛铁矿石的主要成分是钛酸亚
(2013•如东县模拟)钛具有硬度大、密度小、熔点高、抗腐蚀性等优良性能,被誉为“未来金属”.钛铁矿石的主要成分是钛酸亚铁(FeTiO3).冶炼金属钛时,主要发生以下两个反应:①2FeTiO3+6C+7Cl2
2X+2TiCl4+6CO,②TiCl4+2Mg高温 .
Ti+2MgCl2.下列有关说法正确的是( )Ar800℃ .
A.钛酸亚铁中Ti显+3价
B.①式中“X”的化学式为FeCl2
C.反应②需在氩气环境中进行,这里氩气作催化剂
D.反应②属于置换反应 没有苹果的阳光1年前1
没有苹果的阳光1年前1 -
 417974516 共回答了29个问题
417974516 共回答了29个问题 |采纳率96.6%解题思路:A、化合物中元素化合价的正负总数和为0,显+2价的铁元素在化合物中读作亚铁;
B、据化学反应前后原子的种类和数目不变求X的化学式;
C、据反应②的反应条件分析回答;
D、置换反应是单质和化合物反应生成另一种单质和化合物的反应.A、根据物质的读法可知:钛酸亚铁中Fe元素显+2价,O元素显-2价,据化合物中元素化合价的正负总数和为0,可知Ti显+4价,故错误;
B、观察该反应2FeTiO3+6C+7Cl2
高温
.
2X+2TiCl4+6CO,可知反应前铁原子是2个,钛原子是2个,氧原子是6个,碳原子是6个,氯原子是14个,反应后钛原子是2个,氯原子是8个,碳原子是6个,氧原子是6个,所以①式中“X”的化学式为FeCl3,故错误;
C、反应②需在氩气环境中进行,这里氩气是作为保护气,防止温度较高的情况小镁与空气中的氧气等发生反应,不是作催化剂,故错误;
D、反应②TiCl4+2Mg
Ar800℃
.
Ti+2MgCl2是由一种单质Mg,和一种化合物TiCl4,反应生成另一种单质Ti,和另一种化合物MgCl2,属于置换反应,正确;
故选D.点评:
本题考点: 常见金属的冶炼方法;有关元素化合价的计算;置换反应及其应用;质量守恒定律及其应用.
考点点评: 本题考查学生利用题目给出的信息并结合所学相关知识分析解答问题的能力,因此要注意平时基础知识的理解和记忆.1年前查看全部
- 钛和钛合金,在许多领域被广泛的应用,被称为21世纪的金属.钛铁矿的主要成分为FeTiO3,已知其中Fe元素为+2价,O元
钛和钛合金,在许多领域被广泛的应用,被称为21世纪的金属.钛铁矿的主要成分为FeTiO3,已知其中Fe元素为+2价,O元素为-2价,那么FeTiO3中钛(Ti)元素的化合价为( )
A.+4
B.+3
C.+2
D.+1 xuediffu1年前1
xuediffu1年前1 -
 ss_2008 共回答了11个问题
ss_2008 共回答了11个问题 |采纳率90.9%解题思路:根据在化合物中正负化合价代数和为零,进行解答本题.根据在化合物中正负化合价代数和为零,已知Fe元素为+2价,O元素为-2价,则FeTiO3中钛(Ti)元素的化合价为:(+2)+x+(-2)×3=0,解答 x=+4;
故选A.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查学生根据在化合物中正负化合价代数和为零计算指定元素化合价的解题能力.1年前查看全部
- 用CO还原钛铁矿,其中生成铁的化学方程式为:什么
用CO还原钛铁矿,其中生成铁的化学方程式为:什么
月球的沙土中含有丰富的钛铁矿,主要成分为TiO2,Fe2O3等,若用CO还原这种矿石,其中生成铁的化学方程式为:什么 incke11年前2
incke11年前2 -
 reapcom 共回答了14个问题
reapcom 共回答了14个问题 |采纳率85.7%3CO+Fe2O3===2Fe+3CO2
炼铁的基本原理1年前查看全部
- 下列属于复分解反应的是,钛铁矿主要成分的化学式为Fe TiOx,其中铁元素和钛元素的化合价均显+3价.则x为
下列属于复分解反应的是,钛铁矿主要成分的化学式为Fe TiOx,其中铁元素和钛元素的化合价均显+3价.则x为
A.Fe+CuSO4===FeSO4+Cu B.CaCO3====CaO+CO2↑
C.H2SO4+2NaOH====Na2SO4+2H2O D.CH4+2O2==== CO2+2H2O
A.2 B.3 C.4 D.6 wenjiale20051年前3
wenjiale20051年前3 -
 shulo 共回答了18个问题
shulo 共回答了18个问题 |采纳率77.8%A是 置换反应 B是分解反应
C是复分解反应 D比较特殊,不是4种基本类型,只能算氧化还原反应
和Fe3O4 和 CO 反应一样的
答案是C了
那个 3+3=2x x=31年前查看全部
- (2010•玉溪)钛铁矿主要成分的化学式为FeTiOx,其中铁元素和钛元素的化合价均显+3价.则x为( )
(2010•玉溪)钛铁矿主要成分的化学式为FeTiOx,其中铁元素和钛元素的化合价均显+3价.则x为( )
A. 2
B. 3
C. 4
D. 6 blakehan1年前3
blakehan1年前3 -
 我要学车 共回答了15个问题
我要学车 共回答了15个问题 |采纳率93.3%解题思路:根据化合物对外不显电性,在化合物中正负化合价代数和为零解答即可.因为铁元素和钛元素的化合价均显+3价,则在化合物FeTiOx中,正价化合价之和为+6价,那么,负价化合价之和应是-6价,因为O的化合价为-2价,则x为(-6)÷(-2)=3.
故选B.点评:
本题考点: 化合价规律和原则;常见元素与常见原子团的化合价.
考点点评: 本题主要考查学生根据化合价的规律和原则解答问题的能力.根据化合物中元素的化合价,可以推断化学式,还可以推求元素原子的个数.1年前查看全部
- 月球表面富含钛铁矿,钛铁矿的主要成分是钛酸亚铁(FeTiO3),其中钛元素的化合价为多少
 啊飞啊1年前3
啊飞啊1年前3 -
 系統默認 共回答了9个问题
系統默認 共回答了9个问题 |采纳率88.9%铁以亚铁形式存在,化合价为+2,氧的化合价是-2,三个氧就是-6,根据化合价守恒,钛的化合价是+41年前查看全部
- 钛铁矿的冶炼过程在得到TiO2后 C不是能把Ti置换出来吗?为什么还要加Cl2?氯的氧化性跟氧相比哪个大?
 开心_云1年前1
开心_云1年前1 -
 上海猪肉第一贵 共回答了18个问题
上海猪肉第一贵 共回答了18个问题 |采纳率94.4%你好:
因为钛的氧化物极其稳定,单纯用C置换出来的Ti是粗钛,有较多杂质(如TiO2、TiC)
且钛的转化率低,不利于生产.
加入氯气,可提高钛的转化率,生成的TiCl4也易于提纯钛
相关方程式如下:
一、TiO2+2C+2Cl2=TiCl4+2CO
二、TiCl4+2Mg=2MgCl2+Ti 【Ti+2I2=TiI4 TiI4=Ti+2I2 】
懂啦?O(∩_∩)O1年前查看全部
- (2013•崇安区二模)金属钛被称为铁和铝之后崛起的“第三金属”,它是航海、化工、医疗上不可缺少的材料.工业上用钛铁矿(
(2013•崇安区二模)金属钛被称为铁和铝之后崛起的“第三金属”,它是航海、化工、医疗上不可缺少的材料.工业上用钛铁矿(主要成分F6TfO3)制备金属钛的一种工艺流程如图所示.(部分产物略)
(1)钛铁矿的主要成分是钛酸亚铁(F6TfO3),其中钛元素的化合价为______价.
(2)步骤②分离出TfCl4的方法,利用了TfCl4与F6Cl3______的不同.
(3)④反应的化学方程式为2mg+TfCl4
2 mgCl2+Tf高温 .2mg+TfCl4,该反应在氩气中进行的理由是______.
2 mgCl2+Tf高温 .
(4)绿色化学提倡物料循环.以上流程中,可用于循环的物质除Cl2、mg外,还有______.
 pupt51年前1
pupt51年前1 -
 cuiava 共回答了15个问题
cuiava 共回答了15个问题 |采纳率86.7%解题思路:(1)FeTiO3中铁是亚铁,所以为+2价,而氧元素为-2价,根据化合物中化合价的代数和为零,可以求算钛元素的化合价.
(2)步骤②分离出TiCl4的方法是蒸馏,蒸馏是分离沸点不同的液体的,在高温下TiCl4与FeCl3 处于液态.
(3)④反应是镁和四氯化钛反应制取钛的反应,根据质量守恒定律,另外的物质一定含有镁和氯元素,则应该为氯化镁.即反应物为镁和四氯化钛,生成物为钛和氯化镁,条件是高温(写具体温度也可以).由于反应时温度较高,同时生产过程氯气可能会混入其中,所以要在氩气中进行反应,从而防止镁和钛被氯气所氧化(利用的是氩气的稳定性).
(4)在上述转化中,氯化镁是反应的原料,同时在过程中也生成了氯化镁,所以生成的氯化镁可以被循环利用.(o)钛酸亚铁(FeTiOx)中含有亚铁,所以铁七化合价为+2价,而氧元素为-2价,设钛七化合价为x.根据化合物中化合价七代数和为零可得,(+2)+x+(-2)×x=z,可得x=+g,即其中钛元素七化合价为+g价.
(2)步骤②分离出TiClg七方法,通过图可以看出,分离采取七是蒸馏七方法,蒸馏是利用物质七沸点不能同分离物质七,此时TiClg与FeClx都是高温l七液态七物质.
(x)④反应是镁和四氯化钛反应生成钛,同时根据质量守恒定律以及反应七环境,应该还生成氯化镁,反应温度是o22z~og2z℃即高温.化学方程式为 2Mg+TiClg
高温
.
2 MgCl2+Ti(写具体温度也可),该反应在高温l进行,同时在原料中有具有强氧化性七氯气,所以用用性质稳定七氩气进行保护,防止镁和钛被氯气所氧化.
(g)在以上过程中,可以看出氯化镁是反应物,而在④反应中氯化镁是生成物,根据“绿色化学提倡物料循环”,氯化镁也能用于循环利用.
故答案为:(o)+g; (2)沸点;(x)2Mg+TiClg
高温
.
2 MgCl2+Ti;防止Mg、Ti被氧化;(g)MgCl2.点评:
本题考点: 物质的相互转化和制备;混合物的分离方法;有关元素化合价的计算;书写化学方程式、文字表达式、电离方程式.
考点点评: 从问题中思考反应或者操作的原理和方法,进而分析反应或者操作的注意事项.1年前查看全部
大家在问
- 1或曰啖菱须去壳的或是什么意思
- 2偶数的定义是什么
- 3碱金属的密度碱金属元素的单质的密度,随着原子序数的增大而递增.那里错了,我认为是对的啊
- 4连词成句 have sell all out been the books
- 5硫酸氢铵的性质 硫酸氢铵的水溶液为什么呈酸性.水解,电离方程式
- 6小刘3年前的岁数和小王9年后的岁数相同,今年他们两岁数的和是44岁.小刘和小王今年个多少岁?
- 7the blue coat is my 找出句中的错误并改正
- 8一定量的盐酸跟过量的铁粉反应,为了减缓反应速度,且不影响氢气的总量,为何NH4CL固体与NaNO3固体不行?
- 9下列属于复分解反应的是,钛铁矿主要成分的化学式为Fe TiOx,其中铁元素和钛元素的化合价均显+3价.则x为
- 10体积等不等于容积.
- 11表示心情喜悦的词语2字或4字
- 12化简求值:已知x、y,满足:x²+y²-4x+6y+13=0
- 13若传送带对物体做功为fx,那物体对传送带做功是不是为-2fx?
- 14从此我不再 作文,600字,
- 15y=1/2x方-x-4怎么化成顶点式?


