氢化钠投到滴有酚酞的水中的现象,原因,用化学方程式表示.
 aviolet2022-10-04 11:39:544条回答
aviolet2022-10-04 11:39:544条回答
已提交,审核后显示!提交回复
共4条回复
 brainresearcher 共回答了17个问题
brainresearcher 共回答了17个问题 |采纳率94.1%- NaH + H2O=H2 + NaOH
生成物中NaOH显碱性,酚酞试液遇碱会变红 ,因此现象是 酚酞试液变红,原因如前 - 1年前
 垃圾9 共回答了14个问题
垃圾9 共回答了14个问题 |采纳率- NaH+H2O=NaOH+H2↑
- 1年前
 ssj1202 共回答了3个问题
ssj1202 共回答了3个问题 |采纳率- NaH + H2O=H2 + NaOH
(NaH+H2O=Na+ +OH- +H2↑)
有碱生成 酚酞遇碱变红 - 1年前
 友或是 共回答了33个问题
友或是 共回答了33个问题 |采纳率- NaH + H2O=H2 + NaOH
因为生成碱性物质,液体变红。 - 1年前
相关推荐
- 氢化钠(NaH)是一种离子晶体,它与水反应时生成NaOH和H 2 。现有mg氢化钠和铝粉的混合物与足量的水充分反应后,并
氢化钠(NaH)是一种离子晶体,它与水反应时生成NaOH和H 2 。现有mg氢化钠和铝粉的混合物与足量的水充分反应后,并收集到ng氢气。求混合物中铝的质量
 创世之君1年前1
创世之君1年前1 -
 周品芳 共回答了13个问题
周品芳 共回答了13个问题 |采纳率92.3%m(Al) = (m—4.8)g
因NaH与H 2 O反应生成NaOH,而Al可与NaOH进一步反应
①当生成的NaOH过置或适量时,设混合物中Al质量为xg,NaH质量为(m—x)g
NaH+H 2 O==NaOH+H 2 2A1+2NaOH十2H 2 O==2NaAlO 2 +3H 2 ↑
则NaH与H 2 O反应生成H 2 质量为: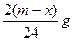
Al与NaOH水溶液反应生成H 2 质量为: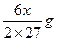
两部分和: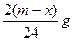 +
+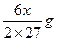 =n 解之x=3(12n—m)
=n 解之x=3(12n—m)
②当生成的NaOH不足量时,Al没有完全反应,设NaH的质量为yg
NaH+H 2 O=NaOH+H 2 2A1+2NaOH+2H 2 O===2NaAlO 2 +3H 2
由NaH生成的H 2 质量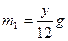
Al与NaOH水溶液反应生成H 2 的质量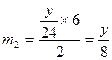
则H 2 总质量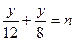 5y="24n " y="4.8n" m(Al) = (m—4.8)g
1年前查看全部
5y="24n " y="4.8n" m(Al) = (m—4.8)g
1年前查看全部
- 氢化钠(NaH)是一种白色的离子化合物,其中钠元素为+1价,NaH与水反应生成氢气,下列叙述正确的是 [
氢化钠(NaH)是一种白色的离子化合物,其中钠元素为+1价,NaH与水反应生成氢气,下列叙述正确的是 [ ]A.NaH在水中显酸性
B.NaH中氢离子半径比锂离子小
C.NaH中氢离子电子排布与氦相同
D.NaH中氢离子被还原成氢气 imred1年前1
imred1年前1 -
 vv的白菜 共回答了13个问题
vv的白菜 共回答了13个问题 |采纳率92.3%C1年前查看全部
- 氢化钠和水反应的离子方程式
 我要红包61年前0
我要红包61年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 氢化钠与水的反应方程式是什么?
 吴星1年前1
吴星1年前1 -
 被雷上来了 共回答了17个问题
被雷上来了 共回答了17个问题 |采纳率88.2%NaH+H2O=NaOH+H2因为氢化钠中的氢是-1价,所以与水中+1价的氢结合生成氢气,明白吗?如果还有不明白的欢迎你来问我!1年前查看全部
- 一些关于氧化还原反应的选择题1.氢化钠(NaH)是一种生氢剂,可发生如下反应:NaH+H2O=NaOH+H2对这一反应的
一些关于氧化还原反应的选择题
1.氢化钠(NaH)是一种生氢剂,可发生如下反应:NaH+H2O=NaOH+H2对这一反应的描述正确的是()
A.NaH是氧化剂 B.NaH是氧化产物 C.NaOH是还原产物 D.NaH在反应中被氧化
2.关于C+CO2=2CO的反应,下列说法正确的是()
A.是化合反应,不是氧化还原反应 B.CO2在反应中表现了氧化性
C.单质C中C的化合价升高,被还原,是氧化剂
D.CO2中的C化合价降低,被氧化,CO2是还原剂
3.下列有单质生成的反应中,化合物作还原剂的是()
A.Zn+H2SO4=ZnSO4+H2 B.Br2+2KI=2KBr+I2
C.2Na+2H2O=2NaOH+H2 D.CuO+H2=Cu+H2O 小達子1年前3
小達子1年前3 -
 传说中的白玉汤 共回答了24个问题
传说中的白玉汤 共回答了24个问题 |采纳率87.5%D
NaH中H-1价,到H2中的0价,升高了,被氧化,是还原剂所以A错D对
而NaH是反应物所以B错
NaOH中的H是H2O中的,为发生氧化还原反应
B
A,碳元素的化合价有变,是氧化还原反应
C,是被氧化,是还原剂
D,是被还原,是氧化剂
B
A,H2SO4中的H被还原,自身作氧化剂
C,H2O是氧化剂
D,CuO是氧化剂1年前查看全部
- 氢化钠(NaH)是一种生氢剂,可发生如下反应:NaH+H2O=NaOH+H2↑,对这一反应的描述正确的是( )
氢化钠(NaH)是一种生氢剂,可发生如下反应:NaH+H2O=NaOH+H2↑,对这一反应的描述正确的是( )
A. NaH是氧化剂
B. NaOH是氧化产物
C. NaOH是还原产物
D. 氧化产物和还原产物的质量比是1:1 玉面达魔1年前7
玉面达魔1年前7 -
 友善的蝎子 共回答了19个问题
友善的蝎子 共回答了19个问题 |采纳率84.2%解题思路:由NaH+H2O=NaOH+H2↑可知,NaH中H元素的化合价由-1价升高为0,水中H元素的化合价由+1价降低为0,以此来解答.A.NaH中H元素的化合价,为还原剂,故A错误;
B.NaOH既不是氧化产物,也不是还原产物,故B错误;
C.NaOH既不是氧化产物,也不是还原产物,而氢气既是氧化产物又是还原产物,故C错误;
D.氢气既是氧化产物又是还原产物,由反应及电子守恒可知,生成等量的还原产物和氧化产物,则氧化产物和还原产物的质量比是1:1,故D正确;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中基本概念的考查,注意从化合价角度分析,题目难度不大.1年前查看全部
- 氢化钠是一种离子化合物,它跟水反应时生成氢氧化钠和氢气,反应方程式为NaH+H2O═NaOH+H2↑,将氢化钠和
氢化钠是一种离子化合物,它跟水反应时生成氢氧化钠和氢气,反应方程式为nah+h2o═naoh+h2↑,将氢化钠和
氢化钠是一种离子化合物,它跟水反应时生成氢氧化钠和氢气,反应方程式为nah+h2o═naoh+h2↑,将氢化钠和***的混合物mg与足量的水充分反应后,若收集到ng氢气,则混合物中的铝的质量为( )
a.(36n-3m)g
b.(m-4.8n)g
c.(12n-m)g
d.(24m-5n)g
 理智的小丁丁1年前1
理智的小丁丁1年前1 -
 黄文治 共回答了16个问题
黄文治 共回答了16个问题 |采纳率81.3%因NaH与H2O反应生成NaOH,而Al可与NaOH进一步反应,则:①当生成的NaOH过量或适量时,设混合物中Al质量为xg,NaH质量为(m-x)g,则:2A1+2NaOH+2H2O=2NaAlO2+3H2↑54&nb...1年前查看全部
- 为什么氢化钠沸点比氨气高
 清凉葡萄1年前3
清凉葡萄1年前3 -
 rizhimian 共回答了24个问题
rizhimian 共回答了24个问题 |采纳率87.5%比较熔沸点高低,首先要先判断晶体类型.
原子晶体最高,金属晶体、离子晶体差不多根据题目信息具体判定,分子晶体最低.
氢化钠,很明显是离子晶体,而氨气是分子晶体.当然离子晶体熔沸点高了1年前查看全部
- 氢化钠(NaH)与水反应放出氢气,对于该反应的下列叙述正确的是( )
氢化钠(NaH)与水反应放出氢气,对于该反应的下列叙述正确的是( )
①反应后溶液显碱性 ②氢化钠中的氢离子还原成氢气
③水是氧化剂 ④该反应不是氧化还原反应.A.①④ B.①②③ C.②③ D.①③  世界边缘1231年前1
世界边缘1231年前1 -
 春秋武霸 共回答了25个问题
春秋武霸 共回答了25个问题 |采纳率88%①反应后生成NaOH,反应后溶液显碱性,故①正确;
②NaH中H元素的化合价升高,则氢化钠中的氢离子被氧化成氢气,故②错误;
③H 2 O中H元素的化合价降低,水是氧化剂,故③正确;
④NaH中H元素的化合价升高,H 2 O中H元素的化合价降低,则属于氧化还原反应,故④错误;
故选D.1年前查看全部
- 已知氢化钠与水反应的方程式为:NaH+H 2 O=NaOH+H 2 ↑,仿照此反应完成下列化学方程式:CaH 2 和H
已知氢化钠与水反应的方程式为:NaH+H 2 O=NaOH+H 2 ↑,仿照此反应完成下列化学方程式:CaH 2 和H 2 O反应______.  chrislou1年前1
chrislou1年前1 -
 19431943 共回答了13个问题
19431943 共回答了13个问题 |采纳率92.3%氢化钙和水反应会生成氢氧化钙和氢气,故答案为:CaH 2 +2H 2 O=Ca(OH) 2 +2H 2 ↑1年前查看全部
- 氢化钠和水反应电子转移的问题2NAH+H20=2NAOH+H2中为什么电子转移是1个,我的理解是水分子中的两个氢把氢化钠
氢化钠和水反应电子转移的问题
2NAH+H20=2NAOH+H2中为什么电子转移是1个,我的理解是水分子中的两个氢把氢化钠中的氢夺走2个电子以后化合价变为0生成氢气,-1变为+1价的氢离子.所以应该是2个电子转移. ik83911年前5
ik83911年前5 -
 阳阳904 共回答了15个问题
阳阳904 共回答了15个问题 |采纳率80%这是同种元素之间的归中反应,化合价只归中,不能交叉,也就是说只由氢化钠中的氢-1到0,水中的氢由+1到0,转移1个电子1年前查看全部
- 硫酸氢化钠与氢氧化钡反应
 hancaixi201年前1
hancaixi201年前1 -
 逍游布衣 共回答了18个问题
逍游布衣 共回答了18个问题 |采纳率83.3%先写离子方程式,先把少量的物质的离子按化学式中的比例写好
如氢氧化钡少量时,先写好Ba2+:OH-为1:2,Ba2+ +2OH- +H+ +SO42- --BaSO4+H2O
再配平Ba2+ +2OH- +2H+ +SO42- ==BaSO4+2H2O
加上箭头Ba2+ +2OH- +2H+ +SO42- ==BaSO4↓+2H2O
(写成化学方程式Ba(OH)2+2NaHSO4==BaSO4↓+2H2O+Na2SO4)
如硫酸氢钠少量时,先写好H+ :SO42-为1:1,H+ +SO42- +Ba2+ +OH---BaSO4+H2O
再配平 H+ +SO42- +Ba2+ +OH-==BaSO4+H2O
加上箭头H+ +SO42- +Ba2+ +OH-==BaSO4↓+H2O
(写成化学方程式NaHSO4+Ba(OH)2==BaSO4↓+H2O+NaOH)1年前查看全部
- 氢化钠是工业上的一种还原剂它极易与水反应生成氢气和氢氧化钠某化学兴趣小组取一定量的氢化钠与97.8g水反
氢化钠是工业上的一种还原剂它极易与水反应生成氢气和氢氧化钠某化学兴趣小组取一定量的氢化钠与97.8g水反
应产生气体0.2g求反应后所得的溶质质量分数 fangfei_2101年前1
fangfei_2101年前1 -
 我终于失去了你 共回答了14个问题
我终于失去了你 共回答了14个问题 |采纳率100%解析: NaH + H2O = NaOH + H2(^)
24 40 2
m(NaH) m(NaOH) 0.2
解得:m(NaH) =2.4g m(NaOH) = 4g
%= 4/( 2.4+97.8-0.2)= 4% 答:略1年前查看全部
- 氢化钠(NaH)是一种白色的离子晶体,其中钠是+1价。NaH与水反应放出氢气。下列叙述正确的是(
氢化钠(NaH)是一种白色的离子晶体,其中钠是+1价。NaH与水反应放出氢气。下列叙述正确的是( )
A.NaH在水中显酸性 B.NaH中氢离子的电子层排布与氦原子相同 C.NaH中氢离子半径比锂离子半径小 D.NaH中氢离子可被还原成氢气  万年小妖精1年前0
万年小妖精1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 氮化钠和氢化钠与水反应的化学方程式如下:Na3N+3H2O→3NaOH+NH3,NaH+H2O→NaOH+H2↑.有关N
氮化钠和氢化钠与水反应的化学方程式如下:Na3N+3H2O→3NaOH+NH3,NaH+H2O→NaOH+H2↑.有关Na3N和NaH的
氮化钠和氢化钠与水反应的化学方程式如下:Na3N+3H2O→3NaOH+NH3,NaH+H2O→NaOH+H2↑.有关Na3N和NaH的叙述正确的是( )
A.离子半径:Na+>N3->H+
B.与水反应都是氧化还原反应
C.与盐酸反应都只生成一种盐
D.加热熔化时,都只破坏离子键
 电之驴1年前1
电之驴1年前1 -
 carpon 共回答了17个问题
carpon 共回答了17个问题 |采纳率88.2%A、电子层越多,半径越大,所以氢离子半径最小,电子层一样,核电荷数越多,半径越小,所以Na+<N3-,即N3->Na+>H+,故A错误;
B、反应Na3N+3H2O=3NaOH+NH3中镁有元素化合价变化,不是氧化还原反应,故B错误;
C、氮化钠和盐酸反应会生成氯化钠、氯化铵两种盐,氢化钠与盐酸反应会生成氯化钠,故C错误;
D、氮化钠和氢化钠中只含有离子键,加热熔化时,钠离子和氮离子以及钠离子和氢离子之间的离子键断开,故D正确.
故选D.1年前查看全部
- 氢化钠(NaH)是一种白色离子晶体,NaH与水反应放出H2,则下列叙述正确的是( )
氢化钠(NaH)是一种白色离子晶体,NaH与水反应放出H2,则下列叙述正确的是( )
A.NaH溶于水显酸性
B.NaH中氢离子被还原为氢气
C.NaH跟水反应时,水是还原剂
D.NaH中氢离子最外层有2个电子 朦胧夜雨里1年前1
朦胧夜雨里1年前1 -
 天霸哥 共回答了22个问题
天霸哥 共回答了22个问题 |采纳率81.8%解题思路:NaH中H元素的化合价为-1价,具有强还原性,与水反应时为还原剂,氢离子最外层有2个电子.A.NaH与水反应生成NaOH和H2,溶液呈碱性,故A错误;
B.NaH中H元素的化合价为-1价,被氧化生成氢气,故B错误;
C.与水反应时NaH为还原剂,水为氧化剂,故C错误;
D.NaH中氢离子为H-,最外层电子数为1+1=2个,故D正确.
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,题目难度不大,本题注意正确判断元素的化合价,根据化合价的变化分析氧化还原反应.1年前查看全部
- 氢化钠这个东西的性质是什么谢谢了,
 可可俊1年前1
可可俊1年前1 -
 阳明 共回答了17个问题
阳明 共回答了17个问题 |采纳率82.4%氢化钠氢化钠 sodium hydride 国标编号 43017 CAS号 7647-69-7 分子式 NaH 分子量 24.00 白色至淡灰色的细微结晶,以25%-50%比例分散在油中; 沸点 分解; 熔点800℃/分解; 溶解性:不溶于液氨、苯、二硫化碳、熔融...1年前查看全部
- 如图是某同学设计的探究光合作用需要某种原料的实验装置和方法,氢氢化钠溶液具有吸收二氧化碳的作用.分析回答下列问题:将天竺
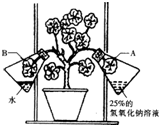 如图是某同学设计的探究光合作用需要某种原料的实验装置和方法,氢氢化钠溶液具有吸收二氧化碳的作用.分析回答下列问题:将天竺葵放在黑暗处一昼夜,按图所示装置放好后,光照2~3小时.取下叶片A和B,去掉叶片中的叶绿素,然后用碘液分别检验.
如图是某同学设计的探究光合作用需要某种原料的实验装置和方法,氢氢化钠溶液具有吸收二氧化碳的作用.分析回答下列问题:将天竺葵放在黑暗处一昼夜,按图所示装置放好后,光照2~3小时.取下叶片A和B,去掉叶片中的叶绿素,然后用碘液分别检验.
(1)该实验设计探究的问题是:植物进行光合作用需要______ 作原料.
(2)实验中,B组对A组起______ 作用.
(3)用碘液分别检验后,不能变蓝的叶片是______(填字母),说明它没有进行______作用. 陆小薇1年前1
陆小薇1年前1 -
 kathy129 共回答了13个问题
kathy129 共回答了13个问题 |采纳率84.6%解题思路:此题考查的是光合作用需要二氧化碳的探究实验内容.解答此题用到淀粉遇碘变蓝这个特性.(1)A组装置与B组装置的区别是B里面是清水,A里面是25%的氢氧化钠溶液,由于氢氧化钠溶液能吸收空气中的二氧化碳,而清水没有此功能,故A、B两装置内B里面有二氧化碳,A里面没有二氧化碳.由于惟一变量是二氧化碳,所以该实验探究的应该是植物进行光合作用需要二氧化碳或者二氧化碳是光合作用的原料.
(2)A组装置与B组装置里分别是清水和25%的氢氧化钠溶液,氢氧化钠溶液能吸收空气中的二氧化碳,而清水没有此功能,由于A、B装置存在惟一的变量二氧化碳的有无,故B组对A组起对照作用.
(3)由于A叶片所处的环境没有二氧化碳,而二氧化碳是进行光合作用的原料之一,所以A叶片由于缺乏原料而没有进行光合作用,不能制造有机物淀粉,因此遇碘不能变蓝色.
故答案为:
(1)二氧化碳;
(2)对照;
(3)A;光合作用.点评:
本题考点: 探究光合作用的条件、原料和产物.
考点点评: 找出实验中的惟一变量,灵活运用光合作用的概念是正确分析本实验的关键.1年前查看全部
- 碱金属氢化物为白色晶体,其中H-有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,写出其化学反应
碱金属氢化物为白色晶体,其中H-有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,写出其化学反应
MH能与水剧烈反应MH+H2O====MOH+H2↑,MH与液氨也有类似反应,写出反应方程式____________ .
2NaH+TiCl4==Ti+2NaCl+2HCl
MH+NH3==H2↑+MNH2
请问第一个方程式2NaH+TiCl4==Ti+2NaCl+2HCl中的生成物除了Ti其余两个怎么写出来? joygod1年前1
joygod1年前1 -
 蜀狂人 共回答了19个问题
蜀狂人 共回答了19个问题 |采纳率89.5%根据题目信息来判断:“其中H-有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti”
氢元素与钛元素之间发生氧化还原,钛元素被还原,氢元素一定会被氧化,化合价会升高,而Na与CI两元素的存在形式则不会发生改变,应保持还来的状态.1年前查看全部
- (2008•镇江)氢化钠(NaH)与水反应的方程式为:NaH+H2O=NaOH+H2↑.CaH2与NaH的化学性质相似.
(2008•镇江)氢化钠(NaH)与水反应的方程式为:NaH+H2O=NaOH+H2↑.CaH2与NaH的化学性质相似.用方程式表示CaH2与Na2CO3水溶液发生的化学反应:
______. yoursfrank1年前1
yoursfrank1年前1 -
 rfrfrf 共回答了19个问题
rfrfrf 共回答了19个问题 |采纳率94.7%解题思路:由题目所给的化学方程式可知:氢化钙与水反应生成相应的氢氧化钙和氢气.
氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠.由题目所给的信息可知:
氢化钙与水反应生成相应的氢氧化钙和氢气.
该反应的化学方程式为:CaH2+2H2O=Ca(OH)2+2H2↑.
氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠.
该反应的化学方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
该反应总的化学方程式为:CaH2+2H2O+Na2CO3=CaCO3↓+2NaOH+2H2↑.
故选CaH2+2H2O+Na2CO3=CaCO3↓+2NaOH+2H2↑.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查化学方程式的书写,难度稍大.1年前查看全部
- 氢化钠(NaH)是一种白色的离子晶体,NaH与水反应放出氢气.下列叙述中,正确的是( )
氢化钠(NaH)是一种白色的离子晶体,NaH与水反应放出氢气.下列叙述中,正确的是( )
A.NaH在水中显酸性
B.NaH中氢离子的电子层排布与氦原子的相同
C.NaH中氢离子半径比锂离子半径小
D.NaH中氢离子可被还原成氢气 756202249abc1年前1
756202249abc1年前1 -
 保卫我的爱人 共回答了12个问题
保卫我的爱人 共回答了12个问题 |采纳率100%解题思路:NaH中H元素的化合价为-1价,NaH具有强还原性,与水反应生成NaOH和H2,反应的化学方程式为NaH+H2O=NaOH+H2,结合对应离子的结构解答该题.A.氢化钠和水反应生成氢气和氢氧化钠NaH+H2O=H2+NaOH,生成物中有氢氧化钠,所以显碱性,故A错误;
B.NaH中H元素是-1价,其核外电子数为2,所以其电子层排布与氦原子的相同,故B正确;
C.负一价氢离子和锂离子的电子层结构相同,电子层结构相同的离子半径与核电荷数成反比,所以氢离子半径大于锂离子半径,故C错误;
D.NaH+H2O=H2+NaOH,氢化钠氢离子失电子被氧化生成氢气,故D错误.
故选B.点评:
本题考点: 钠的重要化合物.
考点点评: 本题考查了粒子半径大小的比较及元素化合物的知识,题目难度不大,注意根据反应方程式结合题意分析.1年前查看全部
- 氢化钠(NaH)化合物中钠元素是+1价,NaH跟水反应放出H2,下列叙述正确的是( )
氢化钠(NaH)化合物中钠元素是+1价,NaH跟水反应放出H2,下列叙述正确的是( )
A.在NaH中的氢离子半径比锂离子半径大
B.在NaH中的氢离子的电子层排布与氦原子不相同
C.NaH跟水反应后溶液呈酸性
D.NaH中的氢离子被还原成氢气 amberaimee1年前1
amberaimee1年前1 -
 dfdd56445 共回答了18个问题
dfdd56445 共回答了18个问题 |采纳率88.9%解题思路:A.核外电子排布相同,核电荷数越大半径越小;
B.NaH中H元素是-1价,其核外电子数为2,与氦原子的核外电子数相同;
C.氢化钠和水反应生成氢气和氢氧化钠;
D.反应NaH+H2O=H2↑+NaOH中,氢化钠氢负离子失电子被氧化生成氢气.A.H-离子和Li+离子电子层相同,锂离子核电荷数大于氢阴离子,故H-离子半径大于Li+离子半径,故A正确;
B.NaH中H元素是-1价,其核外电子数为2,所以其电子层排布与氦原子的相同,故B错误;
C.氢化钠和水发生:NaH+H2O=H2+NaOH,有NaOH生成,其水溶液显碱性,故C错误;
D.反应NaH+H2O=H2↑+NaOH中,氢化钠氢负离子失电子被氧化生成氢气,故D错误.
故选A.点评:
本题考点: 钠的重要化合物.
考点点评: 本题考查了氢化钠的有关知识,明确氢化钠中氢离子的结构是解本题关键,注意氢化钠中氢元素显-1价,为易错点.1年前查看全部
- 氢化钠固体(NaH)和氢化钙固体(CaH 2 )都可与水反应生成氢气和相应的碱.
氢化钠固体(NaH)和氢化钙固体(CaH 2 )都可与水反应生成氢气和相应的碱.
(1)有关反应的化学方程式为______、______.
(2)若用等质量的NaH和CaH 2 分别与水反应,生成氢气较多的是______. zzzz01011年前1
zzzz01011年前1 -
 孤殉雪 共回答了19个问题
孤殉雪 共回答了19个问题 |采纳率89.5%(1)根据题意可以知道氢化钠和水反应生成了氢氧化钠和氢气,而氢化钙和水反应生成了氢氧化钙和氢气,故可以写出它们反应的化学方程式;
(2)在这里我们可以设氢化钠和氢化钙的质量为1g,然后根据化学方程式进行计算并比较后得出结论;
设1g氢化钠和水反应生成氢气的质量为x
NaH+H 2 O═NaOH+H 2 ↑
242
1g x
24
2 =
1g
x
解得 x=0.08g
设1g氢化钙和水反应生成氢气的质量为y
CaH 2 +2H 2 O═Ca(OH) 2 +2H 2 ↑
42 4
1gy
42
4 =
1g
y
解得 y=0.095g
通过比较可以得出等质量的NaH和CaH 2 分别与水反应,生成氢气较多的是氢化钙.
故答案为:(1)NaH+H 2 O═NaOH+H 2 ↑;CaH 2 +2H 2 O=═Ca(OH) 2 +2H 2 ↑;
(2)CaH 2 .1年前查看全部
- 钠与H 2 在一定温度下可反应生成一种叫氢化钠(NaH)的白色化合物,该化合物在熔融状态下可导电,取少量NaH放入水中&
钠与H 2 在一定温度下可反应生成一种叫氢化钠(NaH)的白色化合物,该化合物在熔融状态下可导电,取少量NaH放入水中 ,剧烈反应放出一种无色、无味的气体,并形成一种碱性溶液。
(1)Na与H 2 反应的化学方程式为 _______________________, H 2 作________剂。
(2)NaH与水反应的化学方程式为 ______________________, NaH作________剂。 sxh_song1年前0
sxh_song1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 已知NaH是一种离子化合物,在该化合物中氢显负一价,它能与水反应生成氢气与氢氧化钠,常用作“生氢剂”.现将6g的氢化钠与
已知nah是一种离子化合物,在该化合物中氢显负一价,它能与水反应生成氢气与氢氧化钠,常用作“生氢剂”.现将6g的氢化钠与***混合物,投入到足量的水中,结果放出氢气0.5g,求原混合物中***的质量是多少?
要分类讨论? buai13han1年前1
buai13han1年前1 -
 真的不羁 共回答了23个问题
真的不羁 共回答了23个问题 |采纳率82.6%设原物质中含有NaH 24x g,含有Al 54y g.则
NaH + H2O = NaOH + H2
24 80 2
24x 80x 2x
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2
54 80 6
54y 80y 6y
有一点必须注意,x>y,否则计算公式就不是这个了.
24x+54y=6g
2x+6y=0.5g
x=0.25
所以NaH的质量为 24*0.25=6g
原物质中没有铝的成分.1年前查看全部
- (2010•龙岩)金属氢化物如氢化钙(CaH2)、氢化钠(NaH)是一种重要的制氢剂,与水接触时,分别发生如下反应:
(2010•龙岩)金属氢化物如氢化钙(CaH2)、氢化钠(NaH)是一种重要的制氢剂,与水接触时,分别发生如下反应:
CaH2+2H2O=Ca(OH)2+2H2↑NaH+H2O=NaOH+H2↑
(1)若某化学反应需要消耗10g氢气,需要消耗多少克NaH?
(2)登山运动员登山时也需通过金属氢化物与水反应获得氢气以提供必须的能量.小红认为,若用CaH2替代NaH,有利于登山运动员减轻包袱负担.为什么? 阿珍20081年前1
阿珍20081年前1 -
 1207226 共回答了17个问题
1207226 共回答了17个问题 |采纳率94.1%解题思路:(1)10g氢气来自于氢化钠与水的反应,因此根据氢化钠与水反应的化学方程式可计算生成10g氢气需要消耗氢化钠的质量;
(2)比较生成相同质量的氢气消耗氢化钠与氢化钙的质量大小,就能得到减轻包袱负担的原因.(1)设制10g氢气需消耗氢化钠的质量为x
NaH+H2O=NaOH+H2↑
24 2
x 10g
24:2=x:10g
解之得 x=120g
答:制10g氢气需消耗氢化钠的质量为120g;
(2)设生成10g氢气需消耗氢化钙的质量为y
CaH2+2H2O=Ca(OH)2+2H2↑
42 4
y 10g
42:4=y:10g
解之得 y=105g
∵生成10g氢气需氢化钙105g,而需氢化钠却要120g
∴得到同样质量的氢气消耗氢化钙的质量小于氢化钠质量,因此,可以减轻包袱负担.点评:
本题考点: 根据化学反应方程式的计算;化学方程式的概念、读法和含义.
考点点评: 根据反应的化学方程式可知:消耗24份质量的氢化钠可得到2份质量的氢气,消耗42份质量的氢化钙就可得到4份质量的氢气,显然得到相同质量的氢气,消耗氢化钠的质量大于氢化钙的质量.1年前查看全部
- 氢化钠氢离子半径氢化钠中氢离子离子半径大于钠离子半径.这个是一个选择题中通过排除选出来的三个选项分别是 NaH与水反应后
氢化钠氢离子半径
氢化钠中氢离子离子半径大于钠离子半径.这个是一个选择题中通过排除选出来的
三个选项分别是 NaH与水反应后溶液成酸性、NaH与水反应时,氢离子被还原成氢气、氢离子(H-)与Ne电子排布相同,明显氢离子离子半径大于钠离子半径是对的,也许是H对电子束缚能力太弱太弱了,我想知道他们到底相差多大(我就一高中生,专业术语听不懂,说的易懂点)
我们老师也是说排除法(他不跟我们讲超范围的题,连碳酸根都不叫我们写) 也许是题目出错了吧 Na+怎么和H-比较.我又没那么NB的器材 夜雨铃霖1年前1
夜雨铃霖1年前1 -
 city1031 共回答了22个问题
city1031 共回答了22个问题 |采纳率86.4%1 NaH + H2O = NaOH + H2 (g)
此反应是归中型氧化还原反应,即氢化钠的H-与水的H+的价态分别升高(被氧化)、降低(被还原),变为单质H2中的0价
2 如上面所言,对于氢化钠的氢负离子H-,价态升高,发生的是氧化反应,而水电离产生的氢正离子(一般就称为氢离子),价态降低,发生还原反应.二者都归为氢气.所以,如果指的是H+,那么这一选项就是对的.
3 氢负离子H-与He的电子排布相同(氢原子外层添一个电子),而钠离子则是外层失去一个电子,与Ne的电子排布相同
而Ne比He打了一个周期,因此H-与Na+的核外电子排布是不同的,核电荷数也不同.如果参照Ne与He,半径则应钠离子大于H-才是.
如果是LiH,才有两种离子的外层电子排布相同,才有半径H->Li+
补充:你看到,根据我上述的推断,“NaH与水反应时,氢离子被还原成氢气”是正确的
最后那项没法比较的1年前查看全部
- 氢化钠(NaH)是一种白色的离子化合物,其中钠元素显+1价;氢化钠与水反应放出氢气.下列叙述中,不正确的是( )
氢化钠(NaH)是一种白色的离子化合物,其中钠元素显+1价;氢化钠与水反应放出氢气.下列叙述中,不正确的是( )
A.NaH中存在-1价的氢离子,还原性比氢原子强
B.NaH与H2O反应时水作氧化剂,反应放出热量
C.NaH中氢元素的离子的电子层排布与氦原子的电子层排布相同
D.微粒半径:H+>H>H- 中cc走1年前1
中cc走1年前1 -
 xmulee 共回答了17个问题
xmulee 共回答了17个问题 |采纳率94.1%解题思路:A、根据题意NaH是离子化合物,阴离子是H-,和H原子相比,微粒半径大,电子受原子核的作用相对来说小,所以易失电子,所以还原性比氢原子强;
B、NaH与H2O反应时,负一价氢与正一价氢之间发生了氧化还原反应,生成了氢气,所以水中正一价氢元素化合价降低,水做氧化剂,反应放热;
C、氢阴离子是氢原子得一个电子形成的,其离子的电子层排布与氦原子相同;
D、微粒半径比较一看电子层,二看核电荷数,三看电子数,三种微粒中H、H-都有一个电子层,H原子核外有一个电子,H-核外有两个电子,H+电子层上无电子,所以微粒半径大小为H->H>H+.A、还原性强弱看微粒失电子的能力,阴离子H-比H原子的微粒半径大,最外层电子受原子核的吸引作用相对来说小,所以易失电子,故还原性强,故A正确;
B、NaH与H2O反应NaH+H2O=NaOH+H2↑,反应中水中的氢元素化合价降低,因此水做氧化剂,故B正确;
C、氢阴离子是氢原子得一个电子形成的,其离子的电子层排布与氦原子相同,故C正确;
D、H原子核外有一个电子,H-核外有两个电子,H+电子层上无电子,同种元素的各种微粒,核外电子数越多,半径越大,可知微粒半径大小顺序为H->H>H+,故D错误;
故选D.点评:
本题考点: 离子化合物的结构特征与性质;微粒半径大小的比较;原子核外电子排布.
考点点评: 本题考查了微粒半径大小比较,原子核外电子排布、氧化还原反应的概念判断.1年前查看全部
- 关于氢化物,那时候放在元素前面,那时候放在后面,去氢化钠,氢在后面,氯化氢怎么又在前面了?
 sssyyyqh1年前6
sssyyyqh1年前6 -
 没下雪的冬天 共回答了20个问题
没下雪的冬天 共回答了20个问题 |采纳率90%一般情况下,H显负价时,H在后面,如NaH.H显正价时,H写在前面,如HCl.(但有特殊的,比如氨气,就写成NH3,由于氨气中的H电离,为了区别酸中的H,在氨气中,把H写在了后面)1年前查看全部
- 氢化钠固体(NaH)和氢化钙固体(CaH2)都可与水反应生成氢气和相应的碱.
氢化钠固体(NaH)和氢化钙固体(CaH2)都可与水反应生成氢气和相应的碱.
(1)有关反应的化学方程式为______、______.
(2)若用等质量的NaH和CaH2分别与水反应,生成氢气较多的是______. 排排站吃果果1年前1
排排站吃果果1年前1 -
 lihui2008123456 共回答了22个问题
lihui2008123456 共回答了22个问题 |采纳率90.9%解题思路:(1)根据题给的信息可以完成对这两个化学方程式的书写;
(2)根据化学方程式可以计算出生成氢气的质量,进行比较后可以得出答案.(1)根据题意可以知道氢化钠和水反应生成了氢氧化钠和氢气,而氢化钙和水反应生成了氢氧化钙和氢气,故可以写出它们反应的化学方程式;
(2)在这里我们可以设氢化钠和氢化钙的质量为1g,然后根据化学方程式进行计算并比较后得出结论;
设1g氢化钠和水反应生成氢气的质量为x
NaH+H2O═NaOH+H2↑
242
1g x
[24/2=
1g
x]
解得 x=0.08g
设1g氢化钙和水反应生成氢气的质量为y
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
1gy
[42/4 =
1g
y]
解得 y=0.095g
通过比较可以得出等质量的NaH和CaH2分别与水反应,生成氢气较多的是氢化钙.
故答案为:(1)NaH+H2O═NaOH+H2↑;CaH2+2H2O=═Ca(OH)2+2H2↑;
(2)CaH2.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算.
考点点评: 在书写化学方程式时,首先确定反应原理,然后再依据原理找出反应物、生成物和反应条件;在书写化学方程式时要注意条件,物质的状态符号和配平.1年前查看全部
- 已知氢化钠是一种离子晶体,当跟水反应时,生成NAOH和H2,又知2AL+2NAOH+2H2O=2NAALO2+3H2.现
已知氢化钠是一种离子晶体,当跟水反应时,生成naoh和h2,又知2al+2naoh+2h2o=2naalo2+3h2.现将mg氢化钠和***的混合物与足量的水充分反应,共收集到氢气ng,求混合物中铝的质量
 qq5551年前4
qq5551年前4 -
 石头猫儿 共回答了20个问题
石头猫儿 共回答了20个问题 |采纳率95%本题要考虑NaOH在两个反应中量够不够的问题
设氢化钠为a克,铝为b克,则a+b=m
NaH+H2O=NaOH+H2
24 40 2
a 5a/3 a/12
2Al+2 NaOH+2 H2O= 2NaAlO2+3H2
27 40 3
Al反应完全:b 40b/27 b/9
Al反应不完全:9a/8 5a/3 a/8
1、Al反应完全,此时
则:a/12 + b/9=n
联立:a+b=m
解得:b=36(n-m)
2、Al反应不完全,此时:
a/12 +a/8=n
则:a=n/5
所以:b=m-n/51年前查看全部
- 氢化钠是一种生氢剂,可发生如下反应:NaH+H2O==NaOH+H2,这一反应的描述正确的是?
氢化钠是一种生氢剂,可发生如下反应:NaH+H2O==NaOH+H2,这一反应的描述正确的是?
A.H2O是氧化剂 B.NaH中的氢元素化合价为+1价 C.此反应是非氧化还原反应 D.NaH被还原 微风轻轻地吹1年前1
微风轻轻地吹1年前1 -
 dogflagop 共回答了12个问题
dogflagop 共回答了12个问题 |采纳率100%水是氧化剂,氢化钠中的氢元素化合价为-1价,此反应是氧化还原反应,氢化钠被氧化1年前查看全部
- 氢化钠(NaH)是一种常用的生氢剂,遇水后放出并生成氢氧化钠,写出该反应的化学方程式!
 218984211年前6
218984211年前6 -
 李杜白 共回答了19个问题
李杜白 共回答了19个问题 |采纳率78.9%NaH+H2O=NaOH+H2【气体】1年前查看全部
- 氢化钠中氢元素和钠元素的化合价分别是多少
 a1024453521年前1
a1024453521年前1 -
 wggwcn 共回答了18个问题
wggwcn 共回答了18个问题 |采纳率100%金属一定是正价
NaH中Na+和H-构成
Na+1价
H-1价1年前查看全部
- 将固体氢化钠NaH投入硫酸铁溶液中
将固体氢化钠NaH投入硫酸铁溶液中
化学方程式什么? yuyaoguo1年前1
yuyaoguo1年前1 -
 abcdef2004 共回答了18个问题
abcdef2004 共回答了18个问题 |采纳率100%6NaH+6H2O+Fe2(SO4)3=2Fe(OH)3沉淀符号+6H2+3Na2SO41年前查看全部
- 为什么碳酸氢铵是碱性的,为什么氢化钠碱性强于氨基钠,为什么五氟化金能氧化氟化氢,为什么氨基磺酸不是硫酸铵?
为什么碳酸氢铵是碱性的,为什么氢化钠碱性强于氨基钠,为什么五氟化金能氧化氟化氢,为什么氨基磺酸不是硫酸铵?
谁答得更多就给分
我给码字最多的人了哦 晴天的故事1年前5
晴天的故事1年前5 -
 快乐的尽头 共回答了13个问题
快乐的尽头 共回答了13个问题 |采纳率84.6%哇,你的问题真怪,从基础的到超纲的.不能说碳酸氢铵是碱性的,对待科学要严谨.碳酸氢铵是盐,它的水溶液呈碱性,是因为盐的水解.碳酸氢根水解程度大于铵根水解程度.前者水解产生氢氧根,后者产生氢离子,因而整体显碱性.这个给你提供个诀窍.醋酸根水解程度与铵根基本相同,也就是说,醋酸铵溶液呈中性.如碳酸氢铵,碳酸弱于醋酸,因而碳酸氢跟水解大于醋酸根.相比于铵根水解,碳酸氢跟水解产生氢氧根占主导,所以呈碱性.氢化钠碱性强于氨基钠,是因为H-比NH2-更容易结合H+.在水溶液中,PH的变化主要由于离子与水发生反应.例如氢化钠中的H-,由于静电作用会夺取水分子中的H+,从而只剩下OH-,使溶液呈碱性.五氟化金氧化性强于氟气,更强于氟化氢,而氧化性强的可以与还原剂发生氧化还原反应.产生氧化性较弱的还原产物.五氟化金氧化氟化氢,产物就有氟气.氨基磺酸与硫酸铵分子式就不同.十万八千里 NH2S03H 与(NH4)2SO4能一样吗1年前查看全部
- 若氢化钠固体中含有硫酸钡和氯化钙杂质,该怎样除去杂质
 都跑不了滴1年前1
都跑不了滴1年前1 -
 lbc2007 共回答了18个问题
lbc2007 共回答了18个问题 |采纳率94.4%先溶解,硫酸钡为沉淀,此时溶液中只有钙离子杂质了.再往溶液中滴加过量碳酸钠,使钙离子沉淀.在滴加过量盐酸,除去之前加的碳酸根.然后过滤,然后蒸发结晶虑夜得到纯净NaCl.看我打那么多字,给我加几分咯.1年前查看全部
- 氢化钾 氢化钠 氢化钙都是强碱吗?那为啥氢氧化钙就不是强碱呢?氢氧化钾V.S.氢氧化钠谁更强呢?
 applefxzfxz0351年前6
applefxzfxz0351年前6 -
 adwer 共回答了17个问题
adwer 共回答了17个问题 |采纳率82.4%1.氢化钾、氢化钠、氢化钙从化学定义上不是碱,分类都为氢化物.由于和水一起反应,生成NaOH、KOH等强碱,所以呈强碱性,但不是碱.
2.单从电离度而碱度来看,氢氧化钙是强碱,但由于其水溶性较差,所以溶解在水里部分有限,使得水中氢氧根浓度较小,故只是中强碱.
3.根据元素周期律来说,氢氧化钾碱性应该强于氢氧化钠1年前查看全部
- 氢化钠和四氯化钛反应的产物是如何判断的,有什么依据?到底是氢气还是氯化氢
 枣胡1年前2
枣胡1年前2 -
 pychenw 共回答了14个问题
pychenw 共回答了14个问题 |采纳率85.7%4NaH +
TiCl4 ===4NaCl + Ti +
H2↑
H- 还原了高价的Ti4+ ,生成了H2 而Cl-与Na+结合变为了NaCl .
要使H-变为H+ 需要能把0价氢转化为H+的物质,没有强氧化剂实现此变化.
NaH +H2O 的反应时,H- 生成了H(0价)1年前查看全部
- 问一个反应的产物如何判断碱金属氢化物为白色晶体,其中H-有较强的还原性,因此常用氢化钠在高温下将TiCl4 还原成Ti,
问一个反应的产物如何判断
碱金属氢化物为白色晶体,其中H-有较强的还原性,因此常用氢化钠在高温下将TiCl4 还原成Ti,写出该反应的方程式
我想问的就是产物为什么是HCL 而不是H2 udbscgr1年前1
udbscgr1年前1 -
 dyj-1224 共回答了20个问题
dyj-1224 共回答了20个问题 |采纳率90%这是完全反应:TiCl4+2NaH=2HCl↑+Ti+2NaCl
具体是哪个反应就要看NaH和TiCl4的比例了
比例不同,产物不同的1年前查看全部
- 氢化钠中氢的化合价是多少?
 心杯女孩1年前1
心杯女孩1年前1 -
 Andriy07 共回答了18个问题
Andriy07 共回答了18个问题 |采纳率88.9%-11年前查看全部
- 氢化钠和四氯化钛反应化学方程式
 yukihe911年前2
yukihe911年前2 -
 圣梅西 共回答了20个问题
圣梅西 共回答了20个问题 |采纳率95%2NaH+TiCl4=Ti+2NaCl+2HCl1年前查看全部
- 硝酸铵在弱碱性条件下稳定吗?如题把硝酸铵溶于水后加入一定的氢氢化钠调成弱碱性溶液,硝酸铵会挥发吗?硝酸铵稳定的PH值在多
硝酸铵在弱碱性条件下稳定吗?
如题把硝酸铵溶于水后加入一定的氢氢化钠调成弱碱性溶液,硝酸铵会挥发吗?
硝酸铵稳定的PH值在多少范围内? jackeyworld1年前3
jackeyworld1年前3 -
 一嘛二嘛 共回答了13个问题
一嘛二嘛 共回答了13个问题 |采纳率92.3%肯定是挥发的.1年前查看全部
- 氢化钠(NaH)是离子化合物,则NaH中氢离子的半径小于锂离子的半径,这句话对不对并说明理由.
 fenni61年前2
fenni61年前2 -
 luohaopan2261 共回答了17个问题
luohaopan2261 共回答了17个问题 |采纳率88.2%错
H- > Li+
质子数越多,半径越小1年前查看全部
- 怎么算化学式和原子团的化合价?比如过氧化钠,氢化钠,氯酸钾的化合价是怎么判断的,急
怎么算化学式和原子团的化合价?比如过氧化钠,氢化钠,氯酸钾的化合价是怎么判断的,急
你要怎么知道氧不是-2价,有没有变价? 加德信1年前1
加德信1年前1 -
 林克衡 共回答了15个问题
林克衡 共回答了15个问题 |采纳率80%一般情况是,氢正1价,氧负2价,金属元素呈正价,非金属元素呈负价,稀有气体元素0价,特殊情况再分析,
比如你说的,过氧化钠,钠是第一主族的金属元素,极容易失去1个电子而趋于稳定,因而钠是正1价,从而两个氧原子整体显现负1价,这两个氧原子构成的基团就是我们说的过氧根(负1价),
后面的依次类推,氢化钠中,钠正1价,氢负1价;氯酸钾中,钾正1价,氯酸根负1价,
而氯的含氧酸,你可以记一下,高氯酸、氯酸、亚氯酸、次氯酸中的氯元素分别为正7价、正5价、正3价、正1价,氧均为负2价1年前查看全部
- 固体氢化钠(化学式为NaH)投入硫酸铜溶液中,请描述产生的现象和反映的化学方程式
固体氢化钠(化学式为NaH)投入硫酸铜溶液中,请描述产生的现象和反映的化学方程式
固体氢化钠(化学式为NaH,其性质与CaH2相似)投入硫酸铜溶液中,请描述产生的现象和反映的化学方程式.
注意:是氢化钠 NaH.硫酸铜溶液. uncleiier1年前1
uncleiier1年前1 -
 perrymason 共回答了20个问题
perrymason 共回答了20个问题 |采纳率90%NaH固体先和水反应,放出气泡2NaH+2H2O=2NaOH+H2↑
然后,蓝色溶液出现絮状物(也是蓝色的) 2NaOH+CuSO4=Na2SO4+Cu(OH)2 ↓1年前查看全部
- 金属氢化物是如何制备的?如氢化钠,氢化钙
 无名06081年前2
无名06081年前2 -
 第五骑兵kk 共回答了15个问题
第五骑兵kk 共回答了15个问题 |采纳率80%制备条件比较苛刻:
300度以上,细的金属粉末在高压氢气流中加热10多个小时才能得到产品
实验室制备几乎不可能1年前查看全部
- 氢化钠(NaH)是一种白色离子晶体,NaH与水反应放出H2 它的化学反应方程式是怎样的
 rualiu1年前1
rualiu1年前1 -
 牵了小猪泡MM 共回答了17个问题
牵了小猪泡MM 共回答了17个问题 |采纳率88.2%NaH+H2O=NaOH+H21年前查看全部
- 金属氢化物如氢化钙(CaH2)、氢化钠(NaH)是一种重要的制氢剂,与水接触时,分别发生如下反应:
金属氢化物如氢化钙(CaH2)、氢化钠(NaH)是一种重要的制氢剂,与水接触时,分别发生如下反应:
CaH2+2H2O=Ca(OH)2+2H2↑NaH+H2O=NaOH+H2↑
(1)若某化学反应需要消耗10g氢气,需要消耗多少克NaH?
(2)登山运动员登山时也需通过金属氢化物与水反应获得氢气以提供必须的能量.小红认为,若用CaH2替代NaH,有利于登山运动员减轻包袱负担.为什么? 西塞山前桃花流水1年前3
西塞山前桃花流水1年前3 -
 如雪如梅18 共回答了22个问题
如雪如梅18 共回答了22个问题 |采纳率95.5%解题思路:(1)10g氢气来自于氢化钠与水的反应,因此根据氢化钠与水反应的化学方程式可计算生成10g氢气需要消耗氢化钠的质量;
(2)比较生成相同质量的氢气消耗氢化钠与氢化钙的质量大小,就能得到减轻包袱负担的原因.(1)设制10g氢气需消耗氢化钠的质量为x
NaH+H2O=NaOH+H2↑
24 2
x 10g
24:2=x:10g
解之得 x=120g
答:制10g氢气需消耗氢化钠的质量为120g;
(2)设生成10g氢气需消耗氢化钙的质量为y
CaH2+2H2O=Ca(OH)2+2H2↑
42 4
y 10g
42:4=y:10g
解之得 y=105g
∵生成10g氢气需氢化钙105g,而需氢化钠却要120g
∴得到同样质量的氢气消耗氢化钙的质量小于氢化钠质量,因此,可以减轻包袱负担.点评:
本题考点: 根据化学反应方程式的计算;化学方程式的概念、读法和含义.
考点点评: 根据反应的化学方程式可知:消耗24份质量的氢化钠可得到2份质量的氢气,消耗42份质量的氢化钙就可得到4份质量的氢气,显然得到相同质量的氢气,消耗氢化钠的质量大于氢化钙的质量.1年前查看全部
大家在问
- 1用8开纸画中国地图比例是多少?
- 2五年级第四单元有哪些是把思想感情含在事情的叙述中
- 3求几句古文古诗,写“小人”有关的.
- 4将下列短语译成英语两瓶牛奶三名女医生教师节妇女节五棵梨树我妈妈的一位朋友一幅世界地图会多少答多少
- 5英文介绍朋友 Name:David;Age:12;Country:England;Iike:football
- 64个篮球和3个排球共用去141元,5个篮球和4个排球共用去180元,每个篮球和每个排球各多少元?
- 7这句英语里后半句的as和has With a laptop as her main computing device,B
- 8【小题大放送】高一三角函数1函数 y=2sinx(sinx+cosx) 的最大值为求分析
- 90.02mol/L的HCl和0.01mol/L的Na2SO4溶液哪个导电能力强
- 10发生瓦斯爆炸的原因用化学方程式表示为()?
- 11一个两位数的个位数上的数字为4,若把个位上的数字与十位上的数字对调,则所得的两位数与原两位数的比值是7/4,求原两位数
- 12设x=54321×54324,y=54323×54322,你能比较x与y的大小吗?
- 13一个两位数,它的十位数字与个位数字对调后,所得数是原两位数两个数字和的6倍,则此两位数是______.
- 14高尔基体在植物细胞和动物细胞中的作用分别是什么?
- 15一个空长方体容器长50厘米宽40厘米高30厘米另一个是长方体容器长40厘米宽30厘米里面装有24厘米深的水
