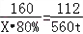钢铁工业是国家工业的基础.铁矿石的冶炼是一个复杂的过程,其中赤铁矿冶炼的主要反应原理是:Fe 2 O 3 +3CO 2F
 zjessie2022-10-04 11:39:541条回答
zjessie2022-10-04 11:39:541条回答 钢铁工业是国家工业的基础.铁矿石的冶炼是一个复杂的过程,其中赤铁矿冶炼的主要反应原理是:Fe 2 O 3 +3CO 2Fe+3CO 2 .某钢铁厂现要冶炼560吨的铁,理论上需要含氧化铁80%的赤铁矿多少吨? 2Fe+3CO 2 .某钢铁厂现要冶炼560吨的铁,理论上需要含氧化铁80%的赤铁矿多少吨? |

已提交,审核后显示!提交回复
共1条回复
相关推荐
- 钢铁工业是国家工业的基础.请回答钢铁腐蚀、防护过程中的有关问题.
钢铁工业是国家工业的基础.请回答钢铁腐蚀、防护过程中的有关问题.
(1)铁在潮湿的空气中容易被腐蚀,写出铁发生电化学腐蚀时负极的电极反应:______.
(2)如图1是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图.
①该腐蚀属于______(填“析氢腐蚀”或“吸氧腐蚀”).
②如图中A、B、C、D四个区域,生成铁锈最多的是______(填字母).
(3)生产中可用盐酸来除铁锈.现将一生锈的铁片放入盐酸中,当铁锈被完全除尽后,溶液中继续发生的化合反应的离子方程式为______
(4)下列各个装置中铁棒被腐蚀由难到易的顺序是______(填字母).
(5)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置如图:请回答:
①B电极对应的金属是______,A电极的电极反应式是______
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因______. klp991年前1
klp991年前1 -
 度是0423 共回答了22个问题
度是0423 共回答了22个问题 |采纳率90.9%解题思路:(1)铁发生电化学腐蚀时,负极上Fe失电子发生氧化反应生成亚铁离子;
(2)中性或弱酸性条件下,铁发生吸氧腐蚀,铁接触空气、水时腐蚀最严重;
(3)铁锈和HCl反应生成铁离子,铁离子和Fe发生氧化还原反应生成亚铁离子;
(4)作原电池负极或电解池阳极的金属加速被腐蚀,作原电池正极或电解池阴极的金属被保护;
(5)①电镀时,镀层作阳极、镀件作阴极,阳极上金属材料失电子发生氧化反应;
②作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护.(1)铁发生电化学腐蚀时,负极上Fe失电子发生氧化反应生成亚铁离子,电极反应式为Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
(2)海水溶液呈中性,则钢铁发生吸氧腐蚀,钢铁接触空气、水时腐蚀最严重,所以B处腐蚀最严重,
故答案为:吸氧腐蚀;B;
(3)铁锈和HCl反应生成铁离子,铁离子和Fe发生氧化还原反应生成亚铁离子,离子方程式为2 Fe3++Fe═3 Fe2+,故答案为:2 Fe3++Fe═3 Fe2+;
(4)在金属腐蚀中,腐蚀快慢顺序是做电解池阳极>作原电池负极>化学腐蚀>作原电池正极>作电解池阴极,根据图象知,A中Fe作负极、B中铁作正极、C中铁发生化学腐蚀、D中铁作阴极,所以铁腐蚀快慢顺序是D BCA,故答案为:D BCA;
(5)①电镀时,镀层Cu作阳极、镀件Fe作阴极,所以B的材料是Fe,阳极电极反应式为Cu-2e-=Cu2+,故答案为:铁;Cu-2e-=Cu2+;
②Fe、Cu和电解质溶液构成原电池时,铁易失电子作负极加速被腐蚀,Zn、Fe和电解质溶液构成原电池,Zn易失电子作负极,Fe作正极被保护,所以铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀,
故答案为:铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀.点评:
本题考点: 金属的电化学腐蚀与防护.
考点点评: 本题考查金属的腐蚀与防护,明确原电池和电解池原理是解本题关键,知道金属腐蚀快慢顺序、钢铁发生析氢腐蚀和吸氧腐蚀条件,题目难度不大.1年前查看全部
- 读右图回答15—17题: 小题1:右图中③所表示的工业部门可能是: A.采掘工业 B.钢铁工业 C.电视机装配工业 D.
读右图回答15—17题:

小题1:右图中③所表示的工业部门可能是:
小题2:工业生产活动中,最可能有地域性特点的是哪一类工业:a.采掘工业 b.钢铁工业 c.电视机装配工业 d.制糖工业
小题3:由于影响工业的区位因素在不断发展变化,③的位置移向⑤处,其原因最可能是:a.① b.② c.③ d.④ a.信息通信网络越来越通达 b.该工业生产的机械化、自动化程度提高 c.***的影响力加强 d.工业污染严重,***搬迁  DONNAJIANGFEI1年前1
DONNAJIANGFEI1年前1 -
 爱我不爱的人 共回答了20个问题
爱我不爱的人 共回答了20个问题 |采纳率95%小题1:C
小题2:D
小题3:B
小题1:图中③最接近劳动力,因此③的主导因素是劳动力,因此是劳动力密集型的工业,电视机装配厂需要大量劳动力,因此选择C。采掘业需要原料,是原料指向型的工业,钢铁工业需要大量原料和燃料,制糖工业需要大量原料,属于原料指向型工业。
小题2:工业生产活动中,制糖工业的原料具有地域性特点,原料北方是甜菜,南方是甘蔗,所以选择D。
小题3:③移向⑤,是逐渐靠近市场,因此市场对工业布局的影响越来越大,而劳动力的数量影响变小,说明在生产中生产机械化、自动化提高,替代了许多的劳动力,劳动力数量要求减少。,选择B。1年前查看全部
- 有关鲁尔区衰落原因的叙述,错误的是( ) A.煤炭、钢铁工业发展过慢 B.煤炭的能源
有关鲁尔区衰落原因的叙述,错误的是( )
A.煤炭、钢铁工业发展过慢 B.煤炭的能源地位下降 C.世界性钢铁过剩 D.新技术革命的冲击  huangzhidong1年前1
huangzhidong1年前1 -
 一半替身 共回答了17个问题
一半替身 共回答了17个问题 |采纳率94.1%A
鲁尔区在20世纪50年代以前主要依托煤炭发展了传统工业,生产结构比较单一,20世纪50年代以后,由于煤炭的能源地位下降,世界性钢铁过剩,新技术革命的冲击,导致鲁尔区开始衰落。1年前查看全部
- 1.印度的钢铁工业主要分布在德干高原东北部的原因是?
1.印度的钢铁工业主要分布在德干高原东北部的原因是?
2.印度工业的分布有何特点? 兰兰兰兰1年前1
兰兰兰兰1年前1 -
 爆煲粥 共回答了17个问题
爆煲粥 共回答了17个问题 |采纳率82.4%1.题见下图
2.印度工业的分布有何特点?
1.主要接近于原料产地的大城市.如棉纺织工业中心孟买,麻纺织工业中心加尔各答
2.东北部和西部为传统工业区,南部班加罗尔为新型工业区.
3.主要分布在接近沿海的大城市,交通便利.1年前查看全部
- 读图,回答28~29题.28.根据图中资料显示,京津唐工业基地发展钢铁工业的有利条件是:有丰富的( )29.位于京津唐
 读图,回答28~29题.
读图,回答28~29题.
28.根据图中资料显示,京津唐工业基地发展钢铁工业的有利条件是:有丰富的( )
29.位于京津唐工业基地内的首都钢铁公司已迁出北京,这有利于北京市( )
A.提高空气质量
B.减少沙尘暴
C.减少噪声
D.改善水质 无风也有三尺浪1年前1
无风也有三尺浪1年前1 -
 guanglingsanying 共回答了25个问题
guanglingsanying 共回答了25个问题 |采纳率88%解题思路:依据钢铁工业的污染问题解答.钢铁工业属于高耗能和高污染企业,对周围环境产生较大的污染,因此位于京津唐工业基地内的首都钢铁公司已迁出北京可以有效提高当地的空气质量.
故选:A.点评:
本题考点: 首都北京的地理概况.
考点点评: 本题考查首都钢铁公司搬迁的原因.1年前查看全部
- 读图,完成14~17题.⑤城市发展钢铁工业的最有利条件是( )A.临近港、澳地区B.靠近消费市场C.有丰富的煤、铁资源
 读图,完成14~17题.
读图,完成14~17题.
⑤城市发展钢铁工业的最有利条件是( )
A.临近港、澳地区
B.靠近消费市场
C.有丰富的煤、铁资源
D.是我国著名的侨乡 妖女hong1年前1
妖女hong1年前1 -
 fpcnnet 共回答了22个问题
fpcnnet 共回答了22个问题 |采纳率86.4%解题思路:沪宁杭是上海、南京、杭州的通称.其中上海是全国最大的城市,主要有机械、钢铁、纺织、电子等综合性工业部门.沪宁杭发展工业的有利条件有:工业基础和科技力量雄厚,消费市场广阔,水陆交通便利等,不利条件是煤铁资源缺乏.⑤所代表城市即上海,该市发展钢铁工业的最有利条件是地理位置优越,消费市场广阔.根据题意.
故选:B.点评:
本题考点: 长江三角洲工业基地的位置和特点.
考点点评: 该题考查上海发展钢铁工业的有利条件,理解记忆即可.1年前查看全部
- 钢铁工业是国家工业的基础,请回答钢铁腐蚀、防护过程中的有关问题.
钢铁工业是国家工业的基础,请回答钢铁腐蚀、防护过程中的有关问题.

(1)若把锌片和铁片放在盛有食盐水和酚酞的表面皿中,如图1所示,能观察到酚酞变红的现象的区域是______(填I、II、III、IV),写出II处电极的电极反应式:______;写出IV处电极的电极反应式:______;写出该两种情况下发生的总反应的离子方程式:______;Fe+2H2O
Fe(OH)2+H2↑通电 .Fe+2H2O.若把III的铁片改为碳棒,写出该处发生的电极反应式:______
Fe(OH)2+H2↑通电 .
(2)如图2所示各个装置中铁棒被腐蚀由易到难的顺序是______(填字母)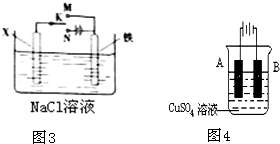
(3)利用如图3装置,可模拟铁的电化学防护,下列有关说法正确的是______(填字母)
A.若X为碳棒,为减缓铁的腐蚀,开关K应置于M处
B.若X为锌板,K置于M或N处,均能减缓铁的腐蚀
C.若X为碳棒,K置于M或N处,一段时间后溶液pH均不变
D.若X为碳棒,K置于M或N处,Cl-均向X电极移动
(4)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置如图4,请回答:
①B电极对应的金属是______(写元素名称),A电极的电极反应式是______
②若电镀前铁、铜两电极的质量相同,电镀完成后,若电镀时电路中通过的电子为0.2mol,将它们取出洗净、烘干、称量,则A、B两极质量相差______ g. erbo991年前1
erbo991年前1 -
 honeybabyjojo 共回答了14个问题
honeybabyjojo 共回答了14个问题 |采纳率100%解题思路:(1)根据原电池和电解池的工作原理来确定电极反应、总反应以及电极区域的现象;
(2)同一种金属的腐蚀由快到慢的顺序是:电解池的阳极>原电池的负极>原电池正极>电解池阴极,据此分析解答;
(3)根据金属的防护,若K置于N处,必须让被保护的金属接电源负极;若开关K置于M处,形成原电池,锌作负极,金属铁为正极,金属铁被保护;
(4)电镀池中,作阳极的是镀层金属,做阴极的是待镀金属,金属阳离子在该极上发生得电子的还原反应,在原电池中,负极金属更易被腐蚀.(1)第一个装置是原电池,Zn为负极,溶液中的氧气在Ⅰ处得电子生成OH-,所以Ⅰ处变红;第二个装置是电解池,铁为阳极,溶液中的H+在Ⅳ处得电子,破坏了锌片附近水的电离平衡,使得OH-浓度增大,所以Ⅳ处变红,Ⅱ处是原电池的负极,电极反应为:Zn-2e-=Zn2+,Ⅳ处是电解池的阴极,发生电极反应为:2H++2e-=H2↑,该两种情况下发生的总反应的离子方程式:2Fe+O2+H2O=2Fe(OH)2、Fe+2H2O
通电
.
Fe(OH)2+H2↑,若把III的铁片改为碳棒,写出该处电极为惰性电极,发生的电极反应式:2Cl--2e-=Cl2↑,
故答案为:Ⅰ、Ⅳ;Zn-2e-=Zn2+;2H++2e-=H2↑;2Fe+O2+H2O=2Fe(OH)2;Fe+2H2O
通电
.
Fe(OH)2+H2↑;2Cl--2e-=Cl2↑;
(2)A、该装置中铁作负极,铁易失去电子而易被腐蚀;
B、该装置中铁作正极,铁电极上易得电子而被保护;
C、铁不发生电化学腐蚀;
D、铁作电解池的阴极而被保护;
同一种金属的腐蚀由快到慢的顺序是:电解池的阳极>原电池的负极>原电池正极>电解池阴极,所以铁棒被腐蚀由易到难的顺序ACBD,
故答案为:A>C>B>D;
(3)A、若X为锌棒,开关K置于M处,形成原电池,此时金属锌为负极,金属铁为正极,金属铁被保护,故A正确;
B、若X为锌棒,开关K置于M处,形成原电池,此时金属锌为负极,金属铁为正极,金属铁被保护,若X为锌板,K置于N处,形成原电池,此时金属锌为负极,金属铁为正极,金属铁被保护,故B正确;
C、若X为碳棒,K置于N处,形成电解池,金属铁为阴极,该极上氢离子得电子放出氢气,氢离子减少,阳极上是氯离子失电子产生氯气,导致溶液的pH增大,故C错误;
D、若X为碳棒,K置于M处形成原电池,氯离子移向负极金属铁,K置于N处,Cl-均向阳极碳棒电极移动,故D错误;
故选AB;
(4)①在铁件的表面镀铜的电镀池中,作阳极A的是镀层金属铜,Cu-2e-=Cu2+,阴极B是金属铁,故答案为:铁;Cu-2e-=Cu2+;
②电镀时两极反应为:A电极:Cu-2e-=Cu2+,B电极上:Cu2++2e-=Cu,若电镀时电路中通过的电子为0.2mol,则A极上质量减少6.4g,B极上质量增加6.4g,所以A、B两极质量相差12.8g,故答案为:12.8.点评:
本题考点: 金属的电化学腐蚀与防护;电解原理.
考点点评: 本题考查了原电池和电解池的工作原理的应用,考查学生分析和解决问题的能力,综合性强,难度大.1年前查看全部
- 日本的钢铁工业主要分布在太平洋沿岸和濑户内海沿岸的主要原因是什么
 cfcvgy1年前1
cfcvgy1年前1 -
 dawny_buaa 共回答了23个问题
dawny_buaa 共回答了23个问题 |采纳率91.3%沿海地形是平原,地势平坦,多港湾,适合建立大港口.在海边,原料运进和产品外运极为方便,减少了陆上运输,省时、省钱、成本低.日本矿产资源多是从太平洋航线运到日本,因此,工业多建在太平洋沿岸地区.----接近消费市场和对外贸易的海港.1年前查看全部
- Ⅰ.钢铁工业是国家工业的基础.请回答钢铁腐蚀、防护过程中的有关问题.
Ⅰ.钢铁工业是国家工业的基础.请回答钢铁腐蚀、防护过程中的有关问题.
请写出钢铁在碱性、潮湿的环境下发生电化学腐蚀正极的电极反应式:______下列哪个装置示意图可防止铁棒被腐蚀______.
Ⅱ.某同学利用CuSO 4 溶液,进行以下实验探究.
①图1是根据反应Zn+CuSO 4 ═Cu+ZnSO 4 设计成的锌铜原电池.Cu极的电极反应式是______,盐桥中是含有琼胶的KCl饱和溶液,电池工作时K + 向______移动(填“甲”或“乙”).
②图2中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是______(填“CH 4 ”或“O 2 ”),a处电极上发生的电极反应式是______;当铜电极的质量变化3.2g,则消耗的CH 4 在标准状况下的体积为______L. 常人91年前1
常人91年前1 -
 何时月明 共回答了19个问题
何时月明 共回答了19个问题 |采纳率78.9%I.钢铁在碱性、潮湿的环境下发生吸氧腐蚀,负极上铁失电子,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O 2 +2H 2 O+4e - =4OH - ,金属铁作原电池正极或电解池阴极都被保护而防止被腐蚀,A装置中铁作原电池负极加快铁腐蚀,B装置中铁作原电池正极被保护,在C装置中,金属铁和水以及少量的氧气接触,也会被腐蚀,D装置中铁作电解池阴极被保护,故选BD;
故答案为:O 2 +2H 2 O+4e - =4OH - ;BD;
II.①根据反应Zn+CuSO 4 ═Cu+ZnSO 4 ,结合图一可知,Zn为负极,Cu为正极,铜离子在Cu电极上得电子析出Cu,电极反应式为Cu 2+ +2e - ═Cu,
盐桥中是含有琼胶的KCl饱和溶液,电池工作时,Cl - 向负极移动,K + 向正极移动,所以,K + 向乙装置移动,
故答案为:Cu 2+ +2e - ═Cu;乙;
②甲烷碱性燃料电池为电源,总电极反应式为CH 4 +2O 2 +2KOH=K 2 CO 3 +3H 2 O,负极发生氧化反应,正极发生还原反应,电镀时,镀件铁作电解池的阴极,连接甲烷燃料电源的负极,所以a应通入CH 4 ,镀层金属作电解池的阳极,发生氧化反应,连接甲烷燃料电源的正极,所以b应通入O 2 .甲烷碱性燃料电池a处电极上CH 4 放电,发生氧化反应,电极反应式是CH 4 -8e - +10OH - =CO 3 2- +7H 2 O,
根据电子转移守恒8n(CH 4 )=2n(Cu)=2×
3.2g
64g/mol =0.1mol,
n(CH 4 )=
1
80 mol,所以v(CH 4 )=
1
80 mol ×22.4L/mol=0.28L,
故答案为:O 2 ;CH 4 -8e - +10OH - =CO 3 2- +7H 2 O;0.28.1年前查看全部
- 下列关于澳大利亚的叙述中( )A澳大利亚盛产羊毛,纺织工业发达B澳大利亚盛产铁矿石,钢铁工业发达C澳大利亚盛产铝土矿,大
下列关于澳大利亚的叙述中( )
a澳大利亚盛产羊毛,纺织工业发达
b澳大利亚盛产铁矿石,钢铁工业发达
c澳大利亚盛产铝土矿,大量出口***
d澳大利亚是南半球经济发达的资本主义国家 yuanpeng5201年前1
yuanpeng5201年前1 -
 泰山11 共回答了14个问题
泰山11 共回答了14个问题 |采纳率85.7%选D
A.澳大利亚是世界上最大的羊毛出口国
B.澳大利亚矿产资源更多的是对外出口
C.澳大利亚不盛产铝土矿1年前查看全部
- 钢铁工业是国家工业的基础。(1)下图是教材中炼铁高炉及炉内化学变化过程示意图,
钢铁工业是国家工业的基础。
(1)下图是教材中炼铁高炉及炉内化学变化过程示意图,根据图示回答下列问题。若下图中采用的铁矿石的主要成分为氧化铁,请写出A区和B区所发生主要反应的化学方程式:A区 _______________________________ B区________________________________
(2)某兴趣小组在实验室中模拟炼铁化学原理的实验,对固体产物成分等进行探究。
[设计实验]用一氧化碳还原纯净的氧化铁粉末,实验装置如下图
[进行实验]该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量) 
[分析与讨论] 本实验中,玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料。
[查阅资料]①一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关。②一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁。
[实验与猜想]①该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和 。②进行猜想:黑色固体粉末可能a.全部为铁b· c· 。
[得出结论]通过实验中获得的数据进行计算,得出黑色固体粉末为(写名称) 。
[反思与评价]①一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度和延长反应时间。②实验装置图中采用虚线框内的装置,其作用有 。A.收集一氧化碳B.吸收二氧化碳C.检验二氧化碳 5025boy1年前1
5025boy1年前1 -
 66sshabv 共回答了16个问题
66sshabv 共回答了16个问题 |采纳率75%1年前查看全部
- (2009•柳州)钢铁工业是国家工业的基础.铁矿石的冶炼是一个复杂的过程,其中赤铁矿冶炼的主要反应原理是:Fe2O3+3
(2009•柳州)钢铁工业是国家工业的基础.铁矿石的冶炼是一个复杂的过程,其中赤铁矿冶炼的主要反应原理是:Fe2O3+3CO
2Fe+3CO2.某钢铁厂现要冶炼560吨的铁,理论上需要含氧化铁80%的赤铁矿多少吨?高温 . plto1年前1
plto1年前1 -
 huamei76 共回答了16个问题
huamei76 共回答了16个问题 |采纳率93.8%解题思路:根据冶炼铁的反应化学方程式,可确定反应中铁与氧化铁的质量关系,利用这一质量关系,可由冶炼铁的质量求得氧化铁的质量,从而计算出所需赤铁矿石的质量.设理论上需要含有氧化铁80%的赤铁矿的质量为X
Fe2O3+3CO
高温
.
2Fe+3CO2
160 112
X•80% 560t
[160/X•80%=
112
560t]
X=1000t
答:理论上需要含有氧化铁80%的赤铁矿1000吨.点评:
本题考点: 含杂质物质的化学反应的有关计算;物质组成的综合计算.
考点点评: 根据化学方程式的计算,所使用的物质质量均为纯净物的质量,含杂质的物质质量不能直接代入化学方程式进行计算.1年前查看全部
- 钢铁工业受区位因素的影响,区位是发展变化的。据此回答下列各题。
钢铁工业受区位因素的影响,区位是发展变化的。据此回答下列各题。
小题1:世界钢铁工业受其区位因素的影响,布局变化的基本规律是( )
小题2:根据下面钢铁工业布局主要区位因素分析,下列钢铁企业所在地排序正确的是a.20世纪初多指向煤炭产地 b.第二次世界大战后,多规划建设在港口 c.最早多指向铁矿产地 d.目前,多在既有煤炭,又有铁矿的地方建厂
市场——①——交通原料——②——燃料
***——③——原料交通——④——原料a.①攀枝花②武汉③上海④鞍山 b.①武汉②攀枝花 ③鞍山④上海 c.①鞍山②上海③攀枝花④武汉 d.①上海②鞍山③攀枝花④武汉  加油好女孩1年前1
加油好女孩1年前1 -
 ttoomm1 共回答了22个问题
ttoomm1 共回答了22个问题 |采纳率95.5%小题1:B
小题2:D
小题1:钢铁工业区位的变化为由原料—交通—市场。钢铁工业最初布局在原料丰富,如铁矿石丰富的地区,二战后,钢铁工业主要布局在港口,便于运输,接近于消费市场,为临海型工业布局。所以本题选择B选项。
小题2:本题考查钢铁工业的布局原则。上海的工业布局属于临海型,鞍山,攀枝花主要是资源型。所以本题选择D选项。1年前查看全部
- Ⅰ.钢铁工业是国家工业的基础.请回答钢铁腐蚀、防护过程中的有关问题.请写出钢铁在碱性、潮湿的环境下发生电化学腐蚀正极的电
Ⅰ.钢铁工业是国家工业的基础.请回答钢铁腐蚀、防护过程中的有关问题.请写出钢铁在碱性、潮湿的环境下发生电化学腐蚀正极的电极反应式:______;图1中哪个装置示意图可防止铁棒被腐蚀______.

Ⅱ.某小组为研究电化学原理,设计如图2的装置.请回答下列问题:
(1)a和b不连接时,铁片上发生反应的离子方程式为______,此时能量转化形式主要是化学能转化为______能.
(2)a和b用导线连接时,外电路中的电子是从______电极流出(填“Fe”或“Cu”),______(填Cu2+或SO42-)离子朝负极移动,Cu极所发生反应的电极反应式为______.
(3)现在要在铁片上镀一层金属铜,则a极要和直流电源的______(填“正极”或“负极”)连接;此时铜片上发生的电极反应式为______. 牵猪去看海1年前1
牵猪去看海1年前1 -
 小唐堂 共回答了15个问题
小唐堂 共回答了15个问题 |采纳率86.7%解题思路:I.钢铁在碱性条件下发生吸氧腐蚀,正极上氧气得电子和水反应生成氢氧根离子;金属作原电池正极或电解池阴极都能被保护;
Ⅱ.(1))a和b不连接时,会发生金属的化学腐蚀,根据化学反应知识来回答;
(2)a和b用导线连接时,形成原电池的工作原理,根据原电池的工作原理来回答;
(3)根据电镀吃的工作原理来回答.I.钢铁在碱性、潮湿的环境下发生吸氧腐蚀,负极上铁失电子,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,金属铁作原电池正极或电解池阴极都被保护而防止被腐蚀,A装置中铁作原电池负极...
点评:
本题考点: 金属的电化学腐蚀与防护;原电池和电解池的工作原理.
考点点评: 本题考查学生金属腐蚀以及防护知识,注意电化学原理的应用是关键,难度不大.1年前查看全部
- 包头“草原钢地”发展钢铁工业的优势和限制因素?
 快乐书虫1年前1
快乐书虫1年前1 -
 全部放掉 共回答了20个问题
全部放掉 共回答了20个问题 |采纳率75%是准备来包头投产吗?如果准备投产的话,只能找新的开发区,在包头的西部,也就是包钢北面有一个新的工业区,这里是名正言顺的地方;如果想找个旮旯角,那么就去北面的山里,有的是资源,但是电力和水是个问题,因为这地方这些年缺水比较严重,只有先解决了水的问题,才能发展下面的东西,否则钱就打水漂了1年前查看全部
- (2010•浦口区二模)联合钢铁工业的基本生产流程示意图如下,请回答相关问题.
(2010•浦口区二模)联合钢铁工业的基本生产流程示意图如下,请回答相关问题.

(1)上述3种含铁物质中,属于金属材料的是:______;
(2)铁在氧气中燃烧的化学方程式为:3Fe+2O2
Fe3O4点燃 .3Fe+2O2
Fe3O4点燃 .
(3)某同学取赤铁矿样品10g,与足量的一氧化碳充分反应,并将生成的气体通入足量的氢氧化钠的溶液中,溶液的质量增加了5.5g.请你根据该同学的实验数据,计算出赤铁矿样品中三氧化二铁的质量分数.
(4)铁制品使用过程中会生锈,情况调查如下:
从调查中可知铁制品生锈的主要条件是______;工业上常用稀盐酸除去铁锈,反应的化学方程式为:______;下列保护铁资源的建议中,正确的是______.(填字母)调查内容 掉漆的自行车 裸露在混凝土
以外的钢筋涂油的
无锈铁钉镀铬铁质剪刀 铁制品锈蚀
的现象风吹雨淋,时间长了,掉漆的部分会生锈 时间长了钢筋表面出现锈层 铁钉较长时间仍不生锈 剪刀较长时间不生锈
A.防止铁制品腐蚀B.回收利用废旧铁制品C.任意开采铁矿石
(5)锰和铁在周期表中位置、相对原子质量(锰是55,铁是56)相近.锰与铁的金属活动性谁更强呢?
实验设计:相同温度下,取大小相同的两种金属薄片,用砂纸将表面擦光亮,分别投入等体积、等浓度且足量的稀盐酸中反应,观察现象,填写结论.
除了比较与酸反应产生气体速度的快慢,你还有其他化学方法可比较这二种金属活动性的强弱吗?请举出一种方法(写出原理即可)______.金属 铁 锰 与盐酸反应现象 放出气泡速度缓慢 放出气泡速度较快 结论 ______  xiaoyun5161年前1
xiaoyun5161年前1 -
 ictok 共回答了18个问题
ictok 共回答了18个问题 |采纳率83.3%解题思路:(1)金属材料包括纯金属和合金;
(2)书写化学方程式时,必须熟悉反应物、生成物和反应条件,必须遵守质量守恒定律、依据客观事实;
(3)根据题意,溶液增加的质量5.5g即还原氧化铁生成二氧化碳的质量,根据反应的化学方程式,由二氧化碳质量计算参加反应氧化铁的质量,并完成赤铁矿样品中氧化铁的质量分数的计算;
(4)铁生锈的条件是铁与水和氧气同时接触;保护金属资源的措施是①防止金属的腐蚀②金属的回收利用③寻找金属的代用品④有计划合理的开采矿物;
(5)根据实验现象可以判断金属的活泼性.(1)生铁和钢是铁的合金,属于金属材料;
(2)铁与氧气在点燃条件下反应生成四氧化三铁,该反应的化学方程式为:3Fe+2O2
点燃
.
Fe3O4;
(3)设样品中Fe2O3的质量为x.
Fe2O3+3CO
高温
.
2Fe+3CO2
160 132
x 5.5g
[160/132=
x
5.5g]
解得x=≈6.67g
样品中Fe2O3的质量分数为[6.67g/10g]×100%=66.7%;
(4)铁生锈的条件是铁与水和氧气同时接触;盐酸除锈的化学方程式为:6HCl+Fe2O3═2FeCl3+3H2O;任意开采铁矿石不正确,应该有计划合理的开采铁矿石;
(5)金属与酸反应的速率越快,金属越活泼.结论:锰比铁活泼;另一种方法:将锰放入硫酸亚铁溶液中观察.
故答案为:(1)生铁、钢;
(2)3Fe+2O2
点燃
.
Fe3O4;
(3)66.7%;(共(4分):化学方程式(1分),设答(1分),比例式(1分),答案1分)
(4)与水和氧气同时接触;6HCl+Fe2O3═2FeCl3+3H2O; A B
(5)金属活动性锰>铁;将锰放入硫酸亚铁溶液(等合理答案).点评:
本题考点: 铁的冶炼;金属的化学性质;金属活动性顺序及其应用;金属材料及其应用;金属锈蚀的条件及其防护;金属资源的保护;书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算.
考点点评: 本道题综合考查了化学方程式的书写及其金属活泼性比较、金属生锈的条件和保护铁资源的措施,增强了学生节约资源、爱护资源的意识.1年前查看全部
- 重庆市是长江上游重要的钢铁基地之一,简要分析其发展钢铁工业的区位条件
 uukuuk1年前1
uukuuk1年前1 -
 peptideg 共回答了7个问题
peptideg 共回答了7个问题 |采纳率100%1.动力导向型产业,附近有攀枝花,六盘水等铁矿和煤矿生产基地,能源与原料供应充足.
2.交通运输便利
3.市场广阔
4.重庆位于中国中西部地区,职工平均工资水平低,但是劳动力素质高,这也是非常重要的因素.1年前查看全部
- 印度钢铁工业分布在东北部地区的原因是
 果做为人1年前1
果做为人1年前1 -
 夏日郑公子 共回答了25个问题
夏日郑公子 共回答了25个问题 |采纳率96%钢铁工业是一种对煤炭和铁矿石需求量非常大的工业,往往在布局上靠近煤矿和铁矿基地.印度的煤炭和铁矿主要分布在其东北部,所以印度的钢铁工业也分布于此,这样可以节省大量的运输费用.1年前查看全部
- (2008•常州)联合钢铁工业的基本生产流程示意图如下:
(2008•常州)联合钢铁工业的基本生产流程示意图如下:

请回答下列问题:
(1)写出设备A 的名称:______;
(2)写出以赤铁矿为原料在高温下与一氧化碳反应制取铁的化学方程式:3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3;
2Fe+3CO2高温 .
(3)应用化学原理分析,工业炼钢时用纯氧而不用空气的原因是:____________;
(4)铁粉与生石灰都是常用的干燥剂,现欲用化学方法检验某食品袋中的干燥剂究竟是其中的哪一种?请你简述方法和现象:______.
(5)生产上要配制1200g溶质质量分数为10%的盐酸来测定钢坯中铁的含量,则约需溶质质量分数为40%的浓盐酸(密度以1.2g/mL计)多少毫升? 我追寻1年前1
我追寻1年前1 -
 偷偷悄悄地 共回答了17个问题
偷偷悄悄地 共回答了17个问题 |采纳率82.4%解题思路:工业上由铁矿炼铁的设备是高炉,原理是利用还原剂CO在高温下还原Fe2O3.反应后,产物中因含有少量杂质而变成生铁,炼钢是进一步除去炼出的铁中的杂质的过程,利用的是氧气与杂质反应.因为杂质含量本来就不多,所以如果采用空气的话,氧气含量只有不到1/5,与杂质金属接触的几率更小了,不利于除杂,氧气浓度越大碰撞几率越大也更容易除去杂质.
铁粉因生锈时需要有水参加,故可以做干燥剂;生石灰可与水反应生成熟石灰,因此也可做干燥剂.根据这两种物质的性质不同,可将其区分开.如加水,溶于水的是生石灰,不溶的是铁粉;也可加入稀盐酸,有气泡产生的为铁粉,否则为生石灰.
用浓溶液配制稀溶液时,只需加水就可以,而其溶质质量不变,即浓溶液中溶质的质量等于稀溶液中溶液的质量.(1)工业上由铁矿炼铁的设备是高炉;
(2)炼铁的原理是利用还原剂CO把金属氧化物还原为金属单质,自身生成CO2的过程 3CO+Fe2O3
高温
.
2Fe+3CO2
(3)物质发生反应,实际上是物质微粒的相互碰撞,微粒浓度越大反应越充分、越剧烈,故本题中选用氧气是为了促使反应更加剧烈,并获得更多的热量
(4)根据活泼金属可与酸反应生成H2,而金属氧化物与酸反应生成盐和水,故可加入稀盐酸,有气泡产生的为铁粉,否则为生石灰;另根据生石灰溶于水,铁粉不溶于水,可加水,溶于水的是生石灰,不溶于水的为铁粉
(5)根据浓溶液中溶质的质量=稀溶液中溶液的质量
即稀溶液溶液质量×稀溶液溶质质量分数=浓溶液溶液质量×浓溶液溶质质量分数
溶液质量=密度(ρ)×体积(V)
设需溶质质量分数为40%的浓盐酸的体积为V
1200g×10%=1.2g/mL×V×40%
解得:V=250mL
答:需溶质质量分数为40%的浓盐酸250mL点评:
本题考点: 铁的冶炼;食品干燥剂、保鲜剂和真空包装的成分探究;生铁和钢;书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算.
考点点评: 此类题综合性较强,相关联的知识点较多,是中考的常考知识点.其中,1、2考查炼铁的设备及原理,其中有考查了还原反应的书写与配平;3题从微观的角度考查化学反应的实质,4题考查物质的鉴别,而鉴别物质,首先要熟悉物质的性质;5题考查浓、稀溶液的配制,计算时,要确立浓溶液与稀溶液之间的等量关系.1年前查看全部
- 钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程中的有关问题.
钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程中的有关问题.
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:Fe2O3+3CO
2Fe+3CO2高温 .Fe2O3+3CO.
2Fe+3CO2高温 .
(2)铁是一种重要的催化剂,请写出铁在有机反应中做催化剂的化学方程式:C6H6+Br2
C6H5Br+HBrFe C6H6+Br2.
C6H5Br+HBrFe
(3)生产中可用盐酸来除铁锈.现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式______.
(4)下列哪个装置可防止铁棒被腐蚀______.
(5)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置示意图如下:
请回答:
①A电极对应的金属是______(写元素名称),B电极的电极反应式是______.
②若电镀前铁.铜两片金属质量相同,电镀完成后将它们取出洗净.烘干.称量,二者质量差为5.12g,则电镀时电路中通过的电子为______mol.
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因______. hlbz2041年前1
hlbz2041年前1 -
 麦芽糖手枪 共回答了15个问题
麦芽糖手枪 共回答了15个问题 |采纳率86.7%解题思路:(1)高温条件下,氧化铁和一氧化碳发生氧化还原反应生成铁和二氧化碳;
(2)溴和苯发生取代反应时铁作催化剂;
(3)铁锈的成分是Fe2O3•xH2O,能和盐酸反应生成氯化铁和水,铁和氯化铁发生氧化还原反应生成氯化亚铁;
(4)作原电池正极或作电解池阴极的铁被保护;
(5)①电镀时,镀层作阳极,镀件作阴极;
②电镀时,阳极上金属失电子导致金属质量减少,阴极上析出金属,导致质量增加,电镀后两极质量差的一半为阴极上析出的铜质量,根据析出铜质量和转移电子之间的关系式计算;
③作原电池负极的金属易被腐蚀.(1)高温条件下,氧化铁和一氧化碳发生氧化还原反应生成铁和二氧化碳,反应方程式为:Fe2O3+3CO
高温
.
2Fe+3CO2 ,
故答案为:Fe2O3+3CO
高温
.
2Fe+3CO2 ;
(2)苯和液溴在铁作催化剂条件下发生取代反应生成溴苯,反应方程式为:C6H6+Br2
Fe
C6H5Br+HBr,
故答案为:C6H6+Br2
Fe
C6H5Br+HBr;
(3)铁锈的成分是Fe2O3•xH2O,能和盐酸反应生成氯化铁和水,氯化铁具有氧化性,能和铁发生氧化还原反应生成氯化亚铁,
反应方程式为2FeCl3+Fe═3FeCl2,
故答案为:2FeCl3+Fe═3FeCl2;
(4)作原电池正极或作电解池阴极的铁被保护,
A.该装置能构成原电池,但铁作负极,加速被腐蚀,故A错误;
B.该装置能构成原电池,铁作正极而被保护,故B正确;
C.铁和水接触不能被保护,故C错误;
D.该装置是电解池,铁作阴极而被保护,故D正确;
故选:B D;
(5)①在铁上镀铜时,铜作阳极连接原电池正极,铁作阴极连接原电池负极,所以A为铜,B为铁,铁电极上铜离子得电子生成铜单质,
电极反应式为 Cu2++2e-═Cu,
故答案为:铜;Cu2++2e-═Cu;
②电镀时,阳极上金属失电子导致金属质量减少,阴极上析出金属,导致质量增加,电镀后两极质量差的一半为阴极上析出的铜质量,
所以阴极上析出铜的质量=5.12g×[1/2]=2.56g,转移电子的物质的量=
2.56g
64g/mol×2=0.08 mol,
故答案为:0.08;
③铜、铁和电解质溶液构成的原电池中,铁作负极而加速被腐蚀,铁、锌和电解质溶液构成的原电池中,铁作正极被保护,所以镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,
故答案为:铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀.点评:
本题考点: 金属冶炼的一般原理;金属的电化学腐蚀与防护.
考点点评: 本题以铁为载体考查了金属的冶炼、原电池和电解池原理等知识点,根据电镀原理、金属的腐蚀与防护来分析解答即可,易错题是(5)②,很多同学往往认为两极的质量差全部为阴极析出的铜而导致错误,为易错点.1年前查看全部
- 读美国地图,完成26-30题.丙是世界上最大的高新技术产业中心.其主要的工业部门是( )A.钢铁工业B.船舶工业C.电
读美国地图,完成26-30题.

丙是世界上最大的高新技术产业中心.其主要的工业部门是( )
A.钢铁工业
B.船舶工业
C.电子产业
D.纺织工业 闪电911gt21年前1
闪电911gt21年前1 -
 tancongxian 共回答了8个问题
tancongxian 共回答了8个问题 |采纳率100%解题思路:美国本土位于北美洲中南部,东、西、南三面分别濒临大西洋、太平洋和墨西哥湾,北与加拿大接壤,西南与墨西哥毗邻.领土还包括北美洲西北部的阿拉斯加和太平洋上的夏威夷群岛.自20世纪90年代以来,美国以高新技术为核心的新兴工业则呈现蓬勃向上的发展趋势;读图可知,丙是位于美国旧金山东南部的硅谷,它是世界上最大的高新技术产业中心,也是世界上最大的电子工业基地.
故选:C.点评:
本题考点: 美国的工农业生产及分布.
考点点评: 该题考查美国最大的高新技术产业中心及其主要的工业部门.1年前查看全部
- (14分)Ⅰ.钢铁工业是国家工业的基础。请回答钢铁腐蚀、防护过程中的有关问题。
(14分)Ⅰ.钢铁工业是国家工业的基础。请回答钢铁腐蚀、防护过程中的有关问题。
请写出钢铁在碱性、潮湿的环境下发生电化学腐蚀正极的电极反应式: ;
下列哪个装置示意图可防止铁棒被腐蚀 。
Ⅱ.某小组为研究电化学原理,设计如下图装置。请回答下列问题:
(1)a和b不连接时,铁片上发生反应的离子方程式为 ,
此时能量转化形式主要是化学能转化为 能。
(2)a和b用导线连接时,外电路中的电子是从 电极流出
(填“Fe”或“Cu”), (填Cu 2+ 或SO 4 2- )离子朝负极
移动,Cu极所发生反应的电极反应式为 。
(3)现在要在铁片上镀一层金属铜,则a极要和直流电源的 (填“正极”或“负极”)连接;此时铜片上发生的电极反应式为 。 bati_851年前1
bati_851年前1 -
 minihouse1 共回答了23个问题
minihouse1 共回答了23个问题 |采纳率100%Ⅰ.O 2 +2H 2 O+4e - = 4OH - (2分);
B D (2分,漏选一个扣1分,错选、多选不得分)
Ⅱ.(1)Fe+Cu 2+ = Fe 2+ +Cu (2分);热(1分)
(2)Fe (1分);SO 4 2 - (1分); Cu 2+ +2e - =" Cu" (2分)
(3)正极(1分); Cu-2e - = Cu 2+ (2分)
略1年前查看全部
- 钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe 2 O 3 )的化学方程式: __________________________。
(2)铁在潮湿的空气中容易被腐蚀为铁锈(Fe 2 O 3 ·xH 2 O),反应的化学方程式是: ______________________________。
(3)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式是:____________________________。
(4)下列哪个装置可防止铁棒被腐蚀____________。
(5)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下 
请回答:
①A电极对应的金属是_______(写元素名称),B电极的电极反应式是:____________。
②若电镀前铁、铜两极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为____________mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因____________________________________________。 悠悠香橙1年前1
悠悠香橙1年前1 -
 990181 共回答了21个问题
990181 共回答了21个问题 |采纳率90.5%1年前查看全部
- (2005•菏泽)从长江上游到人海口沿岸的大型钢铁工业基地依次是( )
(2005•菏泽)从长江上游到人海口沿岸的大型钢铁工业基地依次是( )
A.重庆、攀枝花、武汉、上海
B.攀枝花、重庆、武汉、上海
C.重庆、马鞍山、武汉、上海
D.攀枝花、马鞍山、重庆、上海 泡泡蝴蝶1年前1
泡泡蝴蝶1年前1 -
 舟过坪 共回答了13个问题
舟过坪 共回答了13个问题 |采纳率92.3%解题思路:长江沿岸的大型钢铁工业基地除上海、重庆外,还有四川攀枝花钢铁基地、湖北武汉钢铁基地及安徽马鞍山钢铁基地.长江沿岸的钢铁工业基地中位于上游的是攀枝花和重庆;位于中游的是武汉;马鞍山和上海位于长江下游.
故选:B.点评:
本题考点: 我国工业的发展概况;长江三角洲工业基地的位置和特点.
考点点评: 本题考查了我国长江沿岸的钢铁工业基地的名称及其位置,对应长江水系图记忆简单有效.1年前查看全部
- 钢铁工业对促进经济和社会发展起了重要作用.
钢铁工业对促进经济和社会发展起了重要作用.
①不锈钢含有的Cr元素是在炼钢过程的氧吹______(填“前”或“后”)加入.
②炼钢时,加入硅、锰和铝的目的是______.
③炼铁和炼钢生产中,尾气均含有的主要污染物是______.从环保和经济角度考虑,上述尾气经处理可用作______. 情系两阳1年前1
情系两阳1年前1 -
 乒乒乓乓513709 共回答了15个问题
乒乒乓乓513709 共回答了15个问题 |采纳率100%解题思路:①因为Cr易被氧化,为防止Cr被氧化,不锈钢含有的Cr元素是在炼钢过程的氧吹后,若氧吹前加入Cr会形成炉渣被除去;
②炼钢时,加入硅、锰和铝主要是可以脱氧和调整钢的成分;
③炼铁和炼钢生产中,CO是主要的还原剂,故尾气均含有的主要污染物是CO,一氧化碳气体易燃烧来解题;①因为Cr易被氧化,为Cr被氧化,不锈钢含有的Cr元素是在炼钢过程的氧吹后,若氧吹前加入Cr会形成炉渣被除去,
故答案为:后;
②炼钢时,加入硅、锰和铝,可与氧气反应,且能改变合金的性质,起到脱氧和调整钢的成分的作用,
故答案为:脱氧和调整钢的成分;
③炼铁和炼钢生产中,CO是主要的还原剂,故尾气均含有的主要污染物是CO,一氧化碳会引起中毒,故需对其进行尾气处理.一氧化碳是一种很好的还原剂同时还是一种燃料,
故答案为:CO; 燃料(或还原剂).点评:
本题考点: 金属冶炼的一般原理;高炉炼铁.
考点点评: 本题考查工业炼铁,题目难度不大,注意把握反应的原理,注重相关基础知识的积累.1年前查看全部
- (2009•本溪)钢铁工业是本溪市的支柱产业,近期本溪市又发现了可观的铁矿石资源.
(2009•本溪)钢铁工业是本溪市的支柱产业,近期本溪市又发现了可观的铁矿石资源.
(1)写出以赤铁矿为原料冶炼生铁的化学方式:Fe2O3+3CO
2Fe+3CO2高温 .Fe2O3+3CO;
2Fe+3CO2高温 .
(2)金属的锈蚀造成了金属资源的巨大损失,请你写出家庭生活中经常使用的铁质菜刀的防锈方法______. llz10171年前1
llz10171年前1 -
 qhs1412kid 共回答了21个问题
qhs1412kid 共回答了21个问题 |采纳率81%解题思路:根据已有的知识进行分析,一氧化碳具有还原性,能将氧化铁还原为铁,铁在有水和氧气并存时易生锈,防锈就是破坏生锈的条件.(1)一氧化碳能与氧化铁反应生成铁和二氧化碳,所以本题答案为:Fe2O3+3CO
高温
.
2Fe+3CO2;
(2)生活中常用的防止铁生锈的方法就是保持铁制品表面洁净干燥,所以本题答案为:保持菜刀表面的清洁干燥.点评:
本题考点: 铁的冶炼;金属锈蚀的条件及其防护.
考点点评: 本题考查了铁的冶炼和防锈的措施,题目较为简单,完成此题,可以依据已有的知识进行,要求同学们加强基础知识的储备,以便灵活运用.1年前查看全部
- (2010•株洲)钢铁工业的产品往往是其它工业的原料,下列工业部门中需要大量钢铁为原料的是( )
(2010•株洲)钢铁工业的产品往往是其它工业的原料,下列工业部门中需要大量钢铁为原料的是( )
A.纺织
B.服装
C.食品
D.机械制造 lcy681年前1
lcy681年前1 -
 jk3512 共回答了14个问题
jk3512 共回答了14个问题 |采纳率100%解题思路:机械工业和钢铁工业等主要是提供生产资料为主的工业部门,属于重工业,该工业部门需要大量钢铁为原料;食品工业、纺织工业、服装工业主要是提供生活资料为主的工业部门,属于轻工业,不需要大量钢铁为原料.比较题干中的四个选项可得,需要大量钢铁为原料的是机械制造,选项ABC不符合题意.
故选:D.点评:
本题考点: 钢铁工业的分布.
考点点评: 本题考查不同工业的原料,理解解答即可.1年前查看全部
- 下列城市与其主要工业部门的组合,正确的是( ) A.郑州——钢铁工业 B.洛阳——电子工业 C.平顶山——煤炭工业 D
下列城市与其主要工业部门的组合,正确的是( )
A.郑州——钢铁工业 B.洛阳——电子工业 C.平顶山——煤炭工业 D.开封——石油工业  w哈哈哈1年前1
w哈哈哈1年前1 -
 冻结888 共回答了14个问题
冻结888 共回答了14个问题 |采纳率92.9%C
1年前查看全部
- 钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程的有关问题.
钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程的有关问题.
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:3CO+Fe2O3
3CO2+2Fe高温 .3CO+Fe2O3.
3CO2+2Fe高温 .
(2)生产中可用盐酸来除铁锈.现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式______.
(3)下列哪个装置可防止铁棒被腐蚀______.
 晴烹雨炸1年前1
晴烹雨炸1年前1 -
 weishiyi 共回答了19个问题
weishiyi 共回答了19个问题 |采纳率84.2%解题思路:(1)一氧化碳具有还原性可以还原氧化铁生成铁和二氧化碳;
(2)氧化铁可以和盐酸之间反应生成氯化铁和水,金属铁可以和氯化铁之间反应得到氯化亚铁;
(3)根据金属生锈的条件以及原电池和电解池的工作原理知识来回答判断;(1)一氧化碳具有还原性,一氧化碳可以还原氧化铁生成铁和二氧化碳,化学方程为:3CO+Fe2O3
高温
.
3CO2+2Fe;
故答案为:3CO+Fe2O3
高温
.
3CO2+2Fe;
(2)氧化铁可以和盐酸之间反应生成氯化铁和水,当铁锈除净后,金属铁可以和氯化铁之间反应得到氯化亚铁,即2FeCl3+Fe=3FeCl2,
故答案为:2FeCl3+Fe=3FeCl2;
(3)B装置中,金属铁做原电池的正极,被保护,不易生锈,D装置中,金属铁作阴极,被保护起来,C装置具备金属生锈的条件,A装置中,金属铁是原电池的负极,易被腐蚀,
故答案为:BD;点评:
本题考点: 金属冶炼的一般原理;金属的电化学腐蚀与防护.
考点点评: 本题考查原电池和电解池的工作原理以及金属的腐蚀和防护知识,注意知识的归纳和整理是解题关键,题目难度不大.1年前查看全部
- 大庆适宜发展的工业是 A.钢铁工业 B.石油工业 C.机械工业 D.煤炭工业
 cver45a1年前1
cver45a1年前1 -
 游111111 共回答了27个问题
游111111 共回答了27个问题 |采纳率92.6%B
1年前查看全部
- (1)钢铁工业对促进经济和社会发展起了重要作用。
(1)钢铁工业对促进经济和社会发展起了重要作用。
①不锈钢含有的Cr元素是在炼钢过程的氧吹 (填“前”或“后”)加入。
②炼钢时,加入硅、锰和铝的目的是 。
③炼铁和炼钢生产中,尾气均含有的主要污染物是 。从环保和经济角度考虑,上述尾气经处理可用作 。
(2)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。
①“氨碱法”产生大量CaCl 2 废弃物,写出该工艺中产生CaCl 2 的化学方程式: ;
②写出“联合制碱法”有关反应的化学方程式: ;
③CO 2 是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO 2 的来源有何不同? 。 紫眸清瞳1年前1
紫眸清瞳1年前1 -
 yawo 共回答了22个问题
yawo 共回答了22个问题 |采纳率90.9%1年前查看全部
- 读图,完成21~24题.澳大利亚的铁矿运到图中发展钢铁工业,主要运输方式是( )A.河运B.海运C.铁路运输D.公路运
 读图,完成21~24题.
读图,完成21~24题.
澳大利亚的铁矿运到图中发展钢铁工业,主要运输方式是( )
A.河运
B.海运
C.铁路运输
D.公路运输 twmedia1年前1
twmedia1年前1 -
 renzheye 共回答了20个问题
renzheye 共回答了20个问题 |采纳率90%解题思路:人们出行大多希望尽快到达,所以远距离出行多乘飞机或者乘火车,近距离多乘汽车.有时为了欣赏河流两岸的风景,也有专门乘旅游船的.货运要根据货物的性质、数量、运输距离、价格、时效等情况,选择运输方式.一般来说,贵重或急需的货物而数量又不大的,多由航空运送;容易死亡、变质的活物或鲜货,短程可由公路运送,远程而又数量大的可用铁路上的专用车;大宗笨重的货物,远距离运输,尽可能利用水运或铁路运输.水路运输主要包括内河运输和海洋运输两大类.水路运输的优点是运载量大、投资省、运价低,缺点是速度慢,受到自然条件的限制.船舶遇大风、浓雾天气往往不能航行.因此,水运是一种适宜运输量大、距离长、时效性不很强的大宗货物的运输方式.
故选:B.点评:
本题考点: 各种主要运输方式的特点.
考点点评: 考查运输方式的选择,要理解记忆.1年前查看全部
- 读俄罗斯图,回答8~9题.对俄罗斯工业描述,正确的是( )A.俄罗斯重工业发达,航空航天工业、钢铁工业在世界占重要地位
读俄罗斯图,回答8~9题.

对俄罗斯工业描述,正确的是( )
A.俄罗斯重工业发达,航空航天工业、钢铁工业在世界占重要地位
B.图中①附近的工业区是圣彼得堡工业区
C.图中②是著名的秋明油田
D.图中③是著名的库尔斯克煤田 龙凤劫1年前1
龙凤劫1年前1 -
 小恩rr3 共回答了19个问题
小恩rr3 共回答了19个问题 |采纳率89.5%解题思路:俄罗斯幅员辽阔,领土1708万平方千米,是世界上面积最大的国家,也是惟一地跨两个大洲和东西半球的国家.俄罗斯重工业发达,核工业和航空航天工业在世界占有重要地位.图中①附近为莫斯科工业区,图中②是著名的秋明油田,图中③是库兹巴斯煤田.
故选:C.点评:
本题考点: 俄罗斯的煤、铁、石油、森林资源.
考点点评: 本题考查俄罗斯的工业发展状况,要理解记忆.1年前查看全部
- 钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe 2 O 3 )的化学方程式:
。
(2)下列可防止铁棒被腐蚀装置是 。
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:
请回答:A电极对应的金属是______(写元素名称),B电极的电极反应式是 。
镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。 冷漠的灿烂1年前1
冷漠的灿烂1年前1 -
 tdein 共回答了22个问题
tdein 共回答了22个问题 |采纳率90.9%1年前查看全部
- 攀枝花市发展钢铁工业的有利条件是哪些?
 冰色快感1年前1
冰色快感1年前1 -
 sadfgkaLWRgjlkes 共回答了17个问题
sadfgkaLWRgjlkes 共回答了17个问题 |采纳率76.5%1,铁矿资源丰富
2交通便利,攀枝花虽然处于山区,但是公路交通便利,并且铁路干线较多
武汉就更不用说了,交通发达,并且挨着长江 ,水路也是好的选择1年前查看全部
- (10分)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(10分)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(1)下列哪个装置可防止铁棒被腐蚀_____________ 。
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如右:
请回答:
①A电极对应的金属是______(写元素名称),B电极的电极反应式是 。
②若电镀前铁、铜两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为51.2 g,则电镀时电路中通过的电子物质的量为_______。 热风ii有限ii1年前1
热风ii有限ii1年前1 -
 g7g7_g7 共回答了16个问题
g7g7_g7 共回答了16个问题 |采纳率93.8%(1)BD(2分) (2)①铜(2分) Cu 2+ +2e - ="Cu" (3分)
②0.8 mol(3分)(单位未没写扣1分)
略1年前查看全部
- 读下图回答问题。 (1)图中各工厂属于钢铁工业各生产工序的是_____________________________。
读下图回答问题。 
(1)图中各工厂属于钢铁工业各生产工序的是_____________________________。
(2)图中各工厂与钢铁厂有生产联系的是_____________________。
(3)图中各工厂与钢铁厂共同利用基础设施的是_____________________。
(4)钢铁工业往往发展为工业城市的原因是____________________________________________________
_______________________________________________________________________________________。 zcp877225081年前1
zcp877225081年前1 -
 阿亮小子 共回答了15个问题
阿亮小子 共回答了15个问题 |采纳率93.3%1年前查看全部
- 印度的钢铁工业多分布在铁矿,锰矿,煤炭资源丰富的地区,为什么会这样
 乖朵啦1年前1
乖朵啦1年前1 -
 hxc1828 共回答了15个问题
hxc1828 共回答了15个问题 |采纳率93.3%钢铁工业是原料指向性和动力指向性工业,所以要接近原料--铁矿石,燃料——煤炭.1年前查看全部
- 钢铁工业对促进经济和社会发展起了重要作用。
钢铁工业对促进经济和社会发展起了重要作用。




 (1)炼铁高炉分为五部分,铁矿石与高温煤气主要在 部分发生反应,在 部分开始生成铁和炉渣。
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在 部分发生反应,在 部分开始生成铁和炉渣。 (2)炼钢时,除磷的化学方程式为 ;
(2)炼钢时,除磷的化学方程式为 ; 加入硅、锰和铝的目的是 。
加入硅、锰和铝的目的是 。 (3)不锈钢含有的Cr元素是在炼钢过程的氧吹 (填“前”或“后”)加入,原因是 。
(3)不锈钢含有的Cr元素是在炼钢过程的氧吹 (填“前”或“后”)加入,原因是 。 (4)炼铁和炼钢生产中,尾气均含有的主要污染物是 。
(4)炼铁和炼钢生产中,尾气均含有的主要污染物是 。 从环保和经济角度考虑,上述尾气经处理可用作 。
从环保和经济角度考虑,上述尾气经处理可用作 。 若叶1年前1
若叶1年前1 -
 豆豆爱睡觉 共回答了17个问题
豆豆爱睡觉 共回答了17个问题 |采纳率94.1%(1)炉身炉腰
 (2)2P+5FeO+3CaO Ca 3 (PO 4 ) 2 +5Fe脱氧和调整钢的成分
(2)2P+5FeO+3CaO Ca 3 (PO 4 ) 2 +5Fe脱氧和调整钢的成分 (3)后 避免Cr被氧化(或“氧吹前加入Cr会形成炉渣被除去”)
(3)后 避免Cr被氧化(或“氧吹前加入Cr会形成炉渣被除去”) (4)CO 燃料(或还原剂)
(4)CO 燃料(或还原剂)
 (1)高炉炼铁,铁矿石的主要反应是在炉身部分发生,在炉腰处生成生铁和炉渣。
(1)高炉炼铁,铁矿石的主要反应是在炉身部分发生,在炉腰处生成生铁和炉渣。
 (2)除钢中的磷的化学方程式为2P+5FeO+3CaO Ca 3 (PO 4 )2+5Fe,加入硅、锰和铝的目的是脱去氧和调整钢中的成分。
(2)除钢中的磷的化学方程式为2P+5FeO+3CaO Ca 3 (PO 4 )2+5Fe,加入硅、锰和铝的目的是脱去氧和调整钢中的成分。 (3)为了防止Cr元素被高温下的氧氧化,应在氧吹后加入。
(3)为了防止Cr元素被高温下的氧氧化,应在氧吹后加入。



 (4)炼铁时用到C作燃料生成CO作还原剂,炼钢时钢中本身含有C,因此都有CO产生,而CO是有毒气体,对环境有污染,同时CO可以燃烧生成CO 2 。
1年前查看全部
(4)炼铁时用到C作燃料生成CO作还原剂,炼钢时钢中本身含有C,因此都有CO产生,而CO是有毒气体,对环境有污染,同时CO可以燃烧生成CO 2 。
1年前查看全部
- 钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程中的有关问题.
钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程中的有关问题. 
(1)图1中下列哪个装置可防止铁棒被腐蚀______.
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置示意图如图2,请回答:
①A电极对应的金属是______(写元素名称).
②B电极电极反应式______.
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因______. 三碗白饭1年前1
三碗白饭1年前1 -
 嚼蜡 共回答了6个问题
嚼蜡 共回答了6个问题 |采纳率83.3%(1)在B原电池装置中,正极金属铁被保护,在电解池装置D中,阴极铁金属被保护,A装置中,金属铁做原电池的负极,更易被腐蚀,在C装置中,金属铁和水以及少量的氧气接触,也会被腐蚀,故答案为:BD;
(2)①在铁件的表面镀铜的电镀池中,作阳极的是镀层金属铜,故答案为:铜;
②在铁件的表面镀铜的电镀池中,做阴极的是待镀金属铁,该极上金属阳离子铜离子发生得电子的还原反应,即Cu 2+ +2e - =Cu,故答案为:Cu 2+ +2e - =Cu;
③镀铜铁破损后,金属铁为负极,镀锌铁破损后,金属铁是正极,在原电池中,负极金属更易被腐蚀,所以镀铜铁比镀锌铁更容易被腐蚀,
故答案为:镀铜铁破损后,金属铁为负极,镀锌铁破损后,金属铁是正极,负极金属易被腐蚀.1年前查看全部
- 钢铁工业是国家工业的基础.(1)如图1是教材中炼铁高炉及炉内化学变化过程示意图,根据图示回答下列问题.若图中采用的铁矿石
钢铁工业是国家工业的基础.

(1)如图1是教材中炼铁高炉及炉内化学变化过程示意图,根据图示回答下列问题.若图中采用的铁矿石的主要成分为氧化铁,请写出A区和B区所发生主要反应的化学方程式:A区Fe2O3+3CO
2Fe+3CO2高温 .Fe2O3+3CO;B区
2Fe+3CO2高温 .C+O2
CO2高温 .C+O2,
CO2高温 .,CO2+C
2CO高温 .,CO2+C;
2CO高温 .
焦炭作用是______、______;
(2)某兴趣小组在实验室中模拟炼铁化学原理的实验,对固体产物成分等进行探究.
[设计实验]用一氧化碳还原纯净的氧化铁粉末,实验装置如图2.
[进行实验]该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量64.2g(冷却到室温称量)
[分析与讨论]本实验中,玻璃管内固体粉末由红色全部变为黑色.袁超同学认为该黑色固体全部是铁,但姜宇同学提出了质疑,于是大家提出查阅资料.
[查阅资料]
①一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关.
②一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁.
③见右表
[实验与猜想]①该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和______.物质性质 四氧化三铁 氧化亚铁 氧化铁 铁粉 颜色 黑色 黑色 红色 黑色 能否被磁铁吸引 能 不能 不能 能
②进行猜想:黑色固体粉末可能a.全部为铁b.______c.______.
[得出结论]通过实验中获得的数据进行计算,得出黑色固体粉末为(写名称)______.
[反思与评价]①一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度和延长反应时间.
②实验装置图中采用虚线框内的装置,其作用有______.
A.收集一氧化碳B.检验二氧化碳C.吸收二氧化碳.
③若该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,若它是四氧化三铁、铁混合物,必须具备的条件是:反应后玻璃管和内盛黑色固体的总质量范围(冷却到室温称量)______. 春飞燕1年前1
春飞燕1年前1 -
 xuwuhua 共回答了19个问题
xuwuhua 共回答了19个问题 |采纳率78.9%解题思路:(1)根据A区主要生成铁B区主要生成一氧化碳分析发生的反应,写出反应的方程式;根据炼铁的原理分析焦炭的作用;
(2)[实验与猜想]①根据题意黑色固体粉末全部能被吸引分析不可能含有的物质;
②根据铁和四氧化三铁都是黑色、都能被磁铁吸引,对黑色粉末进行猜想.
[得出结论]根据氧化铁的质量,可求出铁的质量和含有的氧元素的质量,再根据减少的质量分析黑色固体粉末的成分.
[反思与评价]②根据一氧化碳有毒能污染空气需要处理尾气和二氧化碳能与氢氧化钠溶液反应分析.
③利用极值法计算分析,假设全部是铁,可求出铁的质量,再假设全部是四氧化三铁,再求出四氧化三铁的质量,应介于二者之间.(1)由炼铁的原理可知,在A区发生的反应主要是:在高温条件下,一氧化碳将氧化铁还原为铁同时生成了二氧化碳,反应的方程式是:Fe2O3+3CO
高温
.
2Fe+3CO2;在B区中,发生的反应主要是碳燃烧生成了二氧化碳,二氧化碳在高温条件下,与碳反应生成了一氧化碳,反应的方程式是:C+O2
高温
.
CO2,CO2+C
高温
.
2CO;由炼铁的原理可知,焦炭作用是 提供热量、制取CO;
(2)①由题意可知,黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和氧化亚铁.
②由题意可知,黑色固体粉末全部能被吸引,黑色固体粉末可能是全部为铁或全部为四氧化三铁或四氧化三铁与铁粉的混合物.
[得出结论]由实验的数据可知,氧化铁的质量为:66.0g-60.0g=6g,这些氧化铁中含有的氧元素的质量为:6g×[16×3/56×2+16×3×100%=1.8g.则铁的质量为:6g-1.8g=4.2g,如果6g的氧化铁全部炼成铁,减少的适量应是1.8g,由题意可知,固体减少的质量为:66g-64.2g=1.8g,所以,黑色粉末全部是铁.
[反思与评价]②由于一氧化碳有毒能污染空气需要处理尾气,二氧化碳能与氢氧化钠溶液反应.所以,虚线框内的装置,其作用是收集一氧化碳和吸收二氧化碳.
③假设生成的产物全部是铁,由上述分析可知,铁的质量为4.2g.则反应后玻璃管和内盛黑色固体的总质量=60g+4.2g=64.2g;
假设全是四氧化三铁,设生成的四氧化三铁质量是x
CO+3Fe2O3
高温
.
]2Fe3O4+CO2
480 464
6g x
[480/464=
6g
x] 解得 x=5.8g
所以,反应后玻璃管和内盛黑色固体的总质量60g+5.8g=65.8g
由上分析可知,若它是四氧化三铁、铁混合物,必须具备的条件是:反应后玻璃管和内盛黑色固体的总质量范围大于64.2g,小于65.8g.
故答为:(1)Fe2O3+3CO
高温
.
2Fe+3CO2;C+O2
高温
.
CO2,CO2+C
高温
.
2CO;提供热量,制取CO;
(2)[实验与猜想]①氧化亚铁;②全部为四氧化三铁,四氧化三铁与铁粉的混合物.
[得出结论]铁;
[反思与评价]A,C;③大于64.2g,小于65.8g.点评:
本题考点: 铁的冶炼;常见气体的检验与除杂方法;一氧化碳还原氧化铁;根据化学反应方程式的计算.
考点点评: 本题综合性较强,较全面的考查了一氧化碳还原氧化铁,尤其是利用数据对混合物的判断增加了试题难度,掌握反应前后元素的质量不变,并会结合方程式分析即可顺利解答.1年前查看全部
- 鲁尔区钢铁工业发展的最主要因素
 shierchai1年前1
shierchai1年前1 -
 半落江流 共回答了17个问题
半落江流 共回答了17个问题 |采纳率94.1%主要是鲁尔区丰富的煤炭资源,对早期以蒸汽机为动力的工业帮助很大,再加上鲁尔区位于德国的中心,水运陆运比较发达,形成了举世闻名的鲁尔区1年前查看全部
- 地理钢铁工业区位选择的三次变化
 plainking1年前1
plainking1年前1 -
 紫堙 共回答了16个问题
紫堙 共回答了16个问题 |采纳率87.5%1,19世纪开始,钢铁工业以煤炭资源为主导区位因素,钢铁企业靠近大煤田,如鲁尔区1年前查看全部
- (6分)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(6分)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe 2 O 3 )的化学方程式:___ _ _____________ _。
(2)铁在潮湿的空气中容易被腐蚀为铁锈(Fe 2 O 3 · x H 2 O),反应的化学方程式为___________ __ ___ _ ________。
(3)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被完全除尽后,溶液中继续发生的化合反应的化学方程式为____________________________。 balance0011年前1
balance0011年前1 -
 sijikaoshi 共回答了22个问题
sijikaoshi 共回答了22个问题 |采纳率100%(6分)(1)3CO+Fe 2 O 3 2Fe+3CO 2
(2)4Fe+3O 2 +2 x H 2 O=2Fe 2 O 3 · x H 2 O(或其他合理答案) (3)2FeCl 3 +Fe=3FeCl 2
略1年前查看全部
- .(共三个问题,只求思路)22.(6分)钨是熔点最高的金属,是重要的战略物资,广泛用于钢铁工业、电真空照明材料等方面.钨
.(共三个问题,只求思路)
22.(6分)钨是熔点最高的金属,是重要的战略物资,广泛用于钢铁工业、电真空照明材料等方面.钨在自然界主要以钨(+6价)酸盐的形式存在.有开采价值的钨矿石是白钨矿和黑钨矿.黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成fewo4、mnwo4.黑钨矿传统冶炼工艺的第一阶段是碱熔法(如下图,已知钨酸是一种难溶性强酸、对热不稳定).
其中a、b、c都是钨的化合物.
(1)写出a的化学式:a ;写出生成b的化学方程式:;由产品c得到***的钨,应该用h2作还原剂,写出用h2还原三氧化钨的化学方程式:
.
(2)目前,冶炼拉制钨丝的金属钨,都用组成为非整比的钨氧化物为原料,这种氧化钨中存在五价和六价两种价态的钨.试确定组成为wo2.9的氧化钨中这两种价态的钨原子数之比等于 .
【【【【只问最后一空】】】】
26.(6分)亚硝酸钠是实验室常用的试剂,实验室一般用亚硝酸钠溶液与氯化铵溶液反应来制取n2.n2的化学性质十分稳定,但在一定条件下能与h2部分化合生成nh3.下图为制取少量nh3的装置(制取h2的装置已略去):
(1)c装置的硬质试管中发生反应的化学方程式为_______________________________.
(2)反应时n2和h2的最佳质量比是__________.如果按此比例进行反应,反应时,d中导管口是否会逸出气泡?(已知nh3极易溶于水),说明逸出气泡的原因:_______________
________________________________________________________________________.
(3)b中浓硫酸的作用是 .
(4)用实验方法证明确实有nh3生成:_______________________________________.
【【【【问题:反应时n2和h2的最佳质量比是_________】】】】
28.(11分)某学习小组的三位同学为测定镀锌铁皮的锌镀层的厚度,提出了各自的设计方案.(忽略锌镀层的氧化)
(1)甲同学的方案是先用盐酸将镀锌铁皮表面的锌反应掉,通过差量计算出锌的质量,然后再由锌的密度算出锌层的体积,最后由体积除以镀锌铁皮的面积计算得到锌层的厚度.在实际操作中,甲同学的方案存在一个很大的问题是
.
(2)乙同学是通过查阅资料,知道zn(oh)2既可以与酸也可与碱反应,于是设计了如下方案:
配制5%的盐酸1 l (ρ=1.025g/cm3 ),需取用36.5%(ρ=1.181g/cm3)的盐酸 ml(保留一位小数).配制过程中用到的玻璃仪器,除烧杯外,还有 .步骤③的操作是 .
若使用的镀锌铁皮的质量为28.156 g,最后称得灼烧后固体的质量为40.000g,镀锌铁皮的长5.10cm,宽5.00cm,锌的密度为7.14 g/cm3,则锌层的厚度为 .
(3)丙同学的方案是通过右图所示装置,测量镀锌铁皮与强酸反应产生气体的质量来计算锌层的厚度.己知镀锌铁皮质量为18.200g,加入稀硫酸质量为140g,则稀硫酸的质量百分比浓度至少应大于 .
若改用浓盐酸,则测出锌的厚度会 (填“偏大”、“偏小”、或“无影响”).
(4)实验后,将乙同学和丙同学的结果进行比较,发现他们对同种镀锌铁皮的测量结果差异很大,你认为谁的方案更加可靠呢?
原因是 .
【【【【问题:(3)中的方法为何可行?铁和锌不都会和硫酸反应吗?
此方法没看懂】】】】 lebinbin1年前1
lebinbin1年前1 -
 泡泡222 共回答了20个问题
泡泡222 共回答了20个问题 |采纳率80%1.根据化合价设个方程就出来了
五价比六价1:4
2应该就是根据方程式的配比吧N2+3 H2=2 NH3 质量比14:3
3相同质量Fe和Zn与酸反应消耗酸的质量是不同的,可能是根据总质量和酸的质量,推出Zn和Fe的质量,进而推出厚度的吧
做个参考吧1年前查看全部
- 在第一次世界大战期间,鲁尔区的钢铁工业属于___型 ( ) A.煤铁复合体 B.临海 C.移铁就煤 D.铁矿石指向
在第一次世界大战期间,鲁尔区的钢铁工业属于___型 ( ) A.煤铁复合体 B.临海 C.移铁就煤 D.铁矿石指向
我想问A.B.C.D.四个选项具体的都是什么意思? oo代言狼1年前1
oo代言狼1年前1 -
 zhongbf 共回答了15个问题
zhongbf 共回答了15个问题 |采纳率80%我觉得选C,鲁尔区不缺少煤炭,但是铁不是它的产地,所以排除AD,虽然鲁尔区离北海不远,但不是依靠海运或者港口发展的,所以不选B1年前查看全部
- 读图回答16—18题: 小题1:图中③所表示的工业部门可能是: A.采掘工业 B.钢铁工业 C.电视机装配工业 D.制糖
读图回答16—18题:

小题1:图中③所表示的工业部门可能是:
小题2:工业生产活动中,最可能有地域性特点的是哪一类工业:a.采掘工业 b.钢铁工业 c.电视机装配工业 d.制糖工业
小题3:由于影响工业的区位因素在不断发展变化,③的位置移向⑤处,其原因最可能是:a.① b.② c.③ d.④ a.信息通信网络越来越通达 b.该工业生产的机械化、自动化程度提高 c.***的影响力加强 d.工业污染严重,***搬迁  嘭嘭嘭嘭1年前1
嘭嘭嘭嘭1年前1 -
 majory_xj 共回答了19个问题
majory_xj 共回答了19个问题 |采纳率94.7%小题1:C
小题2:D
小题3:B
小题1:根据图中信息可知,③是劳动力密集型产业,所以是电视机装配工业,选择C项。
小题2:根据图中信息可知,有地域性特点一般是原料导向型的工业,所以符合的是④。
小题3:③的位置移向⑤处,说明对劳动力的需求越来越少,因此是生产的机械化、自动化程度提高。所以B项正确。1年前查看全部
- 钢铁工业生态化的含义是什么?欲实现钢铁工业的生态化,主要应借鉴自然生态系统中的哪些内容采取哪些措施
 小小小钟1年前1
小小小钟1年前1 -
 duwenwen83 共回答了18个问题
duwenwen83 共回答了18个问题 |采纳率83.3%好熟悉的题目啊.个人感觉就是工业生态化应用于钢铁这个行业,即工业生态化借鉴自然生态系统的那些东西.1年前查看全部
- (2013•阳江三模)近年来印度经济迅猛发展,图中①②③④四个城市相比较:①发展钢铁工业的条件最优越;②与日本的海运最为
 (2013•阳江三模)近年来印度经济迅猛发展,图中①②③④四个城市相比较:①发展钢铁工业的条件最优越;②与日本的海运最为便捷;③最适宜发展软件等高科技产业;④人口最多,最适宜发展棉纺织产业( )
(2013•阳江三模)近年来印度经济迅猛发展,图中①②③④四个城市相比较:①发展钢铁工业的条件最优越;②与日本的海运最为便捷;③最适宜发展软件等高科技产业;④人口最多,最适宜发展棉纺织产业( )
A.①②③
B.②③④
C.①③
D.②④ mm殿下TO1年前1
mm殿下TO1年前1 -
 孤注一世 共回答了25个问题
孤注一世 共回答了25个问题 |采纳率96%解题思路:读图可得,①是加尔各答,该城市是印度人口最多的城市,也是印度的麻纺织工业中心,②是孟买,该城市是印度的棉纺织工业中心,③是班加罗尔,该城市是印度的新兴工业中心,④是印度的首都新德里.读图可得,加尔各答附近煤铁锰资源丰富,该城市发展钢铁工业的条件最优越,加尔各答位于孟加拉湾沿岸,该城市与日本的海运最为便捷,班加罗尔最适宜发展软件等高科技产业,加尔各答人口最多,最适宜发展麻纺织产业,选项ABD不符合题意.
故选:C.点评:
本题考点: 印度的工业及分布.
考点点评: 本题考查印度的工业及其城市,读图比较记忆即可.1年前查看全部
大家在问
- 1文言文促织带点字解释
- 2已知椭圆标准方程求焦点
- 3客车每小时行60千米,货车每小时行50千米.两车同时从两地相对开出,8小时相遇,两地相距多少千米?一次比赛,六年级80人
- 4下列关于太阳黑子的说法不正确的是
- 5一、直接写得数14-7.4= 1.92/0.04= 0.32*500= 0.65+4.35= 10-5.4=4/20=
- 6“姑苏城外寒山寺,夜半钟声到客船”.诗句中所描写的客船上的人听到了寒山寺的钟声,这钟声是由寺里的大钟被僧人撞击_____
- 7高中英语作文,假如你是李华,上月你去新加坡参加了一个为期一个月的国际交流活动,期间导游凯茜(Ca
- 8把teke,my,English, book,don't, I。组成一个句子
- 9“我现在是一无所有”翻译成英文,怎么翻译?
- 10遗传因子组成为DD与dd的个体杂交得F1,F1自交得F2,取出表现型为显性的个体自由交配,后代显隐性之比为?
- 11带飞和带走和太阳的成语
- 12人生的启迪 作文
- 13在化学符号“3H2SO4”中隐含着数字“1、2、3、4”,关于这些数字的说法正确的是( )
- 14英语翻译Her family eat it as the culmination of the traditional
- 15正压力和压力有什么不同?正压力不一定等于重力,为什么?