硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置略)并回答:
 右撇子-2022-10-04 11:39:541条回答
右撇子-2022-10-04 11:39:541条回答| 硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置略)并回答: (1)进行微量实验:如图所示,将浓硫酸滴入装有na 2 so 3 固体的培养皿一段时间后,a、b、c三个棉球变化如下表. 
 (2)如图所示,将硬质玻璃管改装为燃烧管.挤压软塑瓶壁,向装有固体b的锥形瓶中加入溶液a,同时往燃烧管中通入气体c并点燃,可看到明显的燃烧现象(金属网用以防止气体混合***). ①用此装置模拟工业合成盐酸,则关于试剂选择正确的是______(填序号),管口可观察到______色火焰.
|

已提交,审核后显示!提交回复
共1条回复
 清风伴云 共回答了15个问题
清风伴云 共回答了15个问题 |采纳率86.7%- (1)a、品红试液是红色的,二氧化硫能使品红褪色,漂白原理是:SO 2 与品红反应生成无色不稳定物质,遇热分解又生成SO 2 和品红,又恢复红色,
故答案为:品红溶液;SO 2 与品红反应生成无色不稳定物质,遇热分解又生成SO 2 和品红;
b、氢氧化钠遇到酚酞也是红色的,二氧化硫能和氢氧化钠反应导致红色消失,反应原理是:SO 2 +OH - =HSO 3 - ,故答案为:SO 2 +OH - =HSO 3 - ;
c、碘单质遇到淀粉变为蓝色,二氧化硫能将碘单质还原为碘离子,SO 2 +I 2 +2H 2 O=H 2 SO 4 +2HI,从而使蓝色消失,故答案为:碘;SO 2 +I 2 +2H 2 O=H 2 SO 4 +2HI;
(2)a、装置中塑料瓶中的液体被挤压可以进入固体B中反应,生成一种密度小的气体氢气,才能使得燃烧反应在上方进行,所以a错误;
b、该装置不需加热即可获得氯气,而二氧化锰和浓盐酸的反应需加热才能发生,故b错误;
c、金属铁和硝酸反应不会产生氢气,故c错误;
d、浓盐酸和高锰酸钾在不加热的条件下可以生成氯气,氯气和氢气燃烧可以获得氯化氢,燃烧时产生苍白色火焰,被水吸收而获得盐酸,故d正确.
故答案为:d;苍白色;
(3)碳化钙和水反应就会生成乙炔,乙炔气体燃烧火焰明亮并产生浓烈的黑烟,故答案为:CaC 2 . - 1年前
相关推荐
- 烃类物质的裂化反应问题将浸透了石蜡油的石棉放在硬质玻璃管底部,试管中放入碎瓷片,给碎瓷片加强热.实验过程中有黑烟产生,老
烃类物质的裂化反应问题
将浸透了石蜡油的石棉放在硬质玻璃管底部,试管中放入碎瓷片,给碎瓷片加强热.实验过程中有黑烟产生,老师说是碳的烟尘,如果说碳的烟尘是大分子烃裂化而得到的,那烃类是如何裂化得到碳的?
至少要多少个原子以上的烃才会发生裂化反应?裂化反应的产物是什么?
说漏了,把该实验产生的气体收集并点燃,才有的黑烟.还有不是“多少个原子”,是”多少个碳原子“ 蕨菜兄1年前1
蕨菜兄1年前1 -
 yt9007 共回答了11个问题
yt9007 共回答了11个问题 |采纳率100%目前来看至少要4个C才能裂化
裂化产物是随机的 遵循碳原子数守恒,
如:
C4H10→CH4+C3H6
C4H10→C2H4+C2H6
产生气体点燃产生碳的黑烟不是因为裂化 而是因为碳的质量分数较大导致燃烧不完全,如乙烯、乙炔、苯等燃烧都会有这一现象1年前查看全部
- 下列关于实验现象的描述正确的是A镁在CO2中燃烧生成大量白雾,集气瓶内壁有黑色固体B氢气通入盛有红热的氧化铜的硬质玻璃管
下列关于实验现象的描述正确的是
A镁在CO2中燃烧生成大量白雾,集气瓶内壁有黑色固体
B氢气通入盛有红热的氧化铜的硬质玻璃管内,观察到氧化铜由红色变黑色
C常温下将铝片投入浓硫酸中,观察到有大量气体生成
D放在潮湿空气中的铁钉,几天后它表面有一层红棕色的铁锈 变化不变1年前1
变化不变1年前1 -
 3654216664 共回答了22个问题
3654216664 共回答了22个问题 |采纳率95.5%选D
A错,生成的碳是烟不是雾,雾指的是小液滴,烟指的是固体小颗粒;
B错,观察到氧化铜由黑色变红色,说反了;
C错,常温下将铝片投入浓硫酸中会钝化,不会生成气体;
D对的.1年前查看全部
- 用CO还原铁的氧化物的实验中,硬质玻璃管质量是71.7g,在通入CO前,铁的氧化物和玻璃管的总质量是86.2
用CO还原铁的氧化物的实验中,硬质玻璃管质量是71.7g,在通入CO前,铁的氧化物和玻璃管的总质量是86.2 g,当铁的氧化物与足量的CO充分反应且生成的CO2全部逸出玻璃管后,玻璃管和管内固体的总质量为82.2 g,通过计算推测该铁的氧化物的化学式.
 oaf9161年前1
oaf9161年前1 -
 巴山泉涌 共回答了15个问题
巴山泉涌 共回答了15个问题 |采纳率100%解题思路:根据质量守恒定律知:反应后玻璃管和管内固体的总质量去掉玻璃管的质量就是生成铁的质量,也是氧化物中铁元素的质量.
反应前玻璃管和氧化物的总质量去掉玻璃管的质量就是氧化物的质量,再去掉铁元素的质量,就是氧化物中氧元素的质量.
由氧化物中铁元素和氧元素的质量可以计算出氧化物中铁、氧元素的原子个数比,从而得到氧化物的化学式.氧化物中铁、氧元素的原子个数比为
[82.2g−71.7g/56]:[86.2g−82.2g/16]=3:4
即氧化物的化学式为Fe3O4.
答:该铁的氧化物的化学式为Fe3O4.点评:
本题考点: 物质组成的综合计算;有关化学式的计算和推断;质量守恒定律及其应用.
考点点评: 本题主要考查质量守恒定律和有关化学式的计算,难度较大.1年前查看全部
- 根据高炉炼铁原理设计的一氧化碳还原氧化铁的实验装置中(就是硬质玻璃管里面有氧化铁,导管中通一氧化碳,用酒精灯加热硬质玻璃
根据高炉炼铁原理设计的一氧化碳还原氧化铁的实验装置中(就是硬质玻璃管里面有氧化铁,导管中通一氧化碳,用酒精灯加热硬质玻璃管,后面还有一个瓶子里装的是澄清石灰水)
怎样知道玻璃内的反应开始发生 品位生活20071年前1
品位生活20071年前1 -
 zhimeng 共回答了20个问题
zhimeng 共回答了20个问题 |采纳率95%看瓶子里澄清的石灰水是否开始混浊
这是因为一氧化碳被氧化后变成二氧化碳 二氧化碳和氢氧化钙反映生成不溶于水的碳酸钙 看见水变浑浊就知道反应开始了1年前查看全部
- 铁与水蒸气的反应实验中,要先加热硬质玻璃管还是先加热圆底烧瓶
 joinall1年前1
joinall1年前1 -
 倾冷 共回答了15个问题
倾冷 共回答了15个问题 |采纳率73.3%先加热圆底烧瓶,产生的水蒸气可先贯通整个反应通路,起到保护气的作用,防止高温下铁被空气氧化而损失.后加热玻璃管,铁马上可以和水蒸气反应,先前凝结在管壁上的水也会被蒸发,不影响实验.1年前查看全部
- 某化学兴趣小组用硬质玻璃管设计了如图所示的一套微型实验装置(固定装置略),实验时将浓硫酸滴入装有Na2SO3固体的培养皿
某化学兴趣小组用硬质玻璃管设计了如图所示的一套微型实验装置(固定装置略),实验时将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如表中所示.请将表中空白处填写完整.

棉球 棉球上滴加试剂 实验现象 解释或结论 a ______ 棉球变白,微热后又恢复红色 解释:______
结论:该气体具有漂白性b 含酚酞的NaOH溶液 棉球变为白色 离子方程式:______ C ______ 棉球变为白色 化学方程式:
结论:该气体具有______性 悠影1年前1
悠影1年前1 -
 ╬米米メ小乖 共回答了14个问题
╬米米メ小乖 共回答了14个问题 |采纳率100%a、品红试液是红色的,二氧化硫能使品红褪色,漂白原理是:SO2与品红反应生成无色不稳定物质,遇热分解又生成SO2和品红,又恢复红色,
故答案为:品红溶液;SO2与品红反应生成无色不稳定物质,遇热分解又生成SO2和品红;
b、氢氧化钠遇到酚酞也是红色的,二氧化硫能和氢氧化钠反应导致红色消失,反应原理是:SO2+OH-=HSO3-,故答案为:SO2+OH-=HSO3-;
c、碘单质遇到淀粉变为蓝色,二氧化硫能将碘单质还原为碘离子,SO2+I2+2H2O=H2SO4+2HI,从而使蓝色消失,故答案为:淀粉和碘的混合溶液;1年前查看全部
- 一氧化碳还原氧化铜实验为什么要用硬质玻璃管
 十点六十1年前1
十点六十1年前1 -
 稻叶淳 共回答了16个问题
稻叶淳 共回答了16个问题 |采纳率93.8%因为硬质玻璃管两头都可以连接导管,可以使得一氧化碳与之反应,不过,其实用其他的也不是不可以,比如之形试管,也可以1年前查看全部
- (2014•上海模拟)实验室可将硬质玻璃管改装为燃烧管(如图所示).挤压软塑料瓶壁,向装有固体B的锥形瓶中加入液体A,同
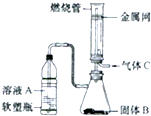 (2014•上海模拟)实验室可将硬质玻璃管改装为燃烧管(如图所示).挤压软塑料瓶壁,向装有固体b的锥形瓶中加入液体a,同时往燃烧管中通入气体c并点燃,可看到明显的燃烧现象(金属网用以防止气体混合***).若用此装置模拟工业制氯化氢,则关于试剂选择正确的是( )
(2014•上海模拟)实验室可将硬质玻璃管改装为燃烧管(如图所示).挤压软塑料瓶壁,向装有固体b的锥形瓶中加入液体a,同时往燃烧管中通入气体c并点燃,可看到明显的燃烧现象(金属网用以防止气体混合***).若用此装置模拟工业制氯化氢,则关于试剂选择正确的是( )选项 溶液a 固体b 气体c a 稀硫酸 zn cl2 b 浓盐酸 mno2 h2 c 稀硝酸 fe cl2 d 浓盐酸 kmno4 h2
a.a
b.b
c.c
d.d urosy1年前1
urosy1年前1 -
 hlmdd123 共回答了23个问题
hlmdd123 共回答了23个问题 |采纳率91.3%解题思路:由装置可知,装置中塑料瓶中的液体被挤压可以进入固体B中反应,生成气体应比空气的大,而通入C应为密度比空气小的氢气,在燃烧管中氢气可与氯气混合反应,以此来解答.A.Zn与稀硫酸反应生成的氢气,在燃烧管中不能与氯气充分混合,不能燃烧;故A错误;
B.该装置不需加热即可获得氯气,而二氧化锰和浓盐酸的反应需加热才能发生,故B错误;
C.金属铁和硝酸反应不会产生氢气,故C错误;
D.浓盐酸和高锰酸钾在不加热的条件下可以生成氯气,氯气和氢气在燃烧管中混合均匀可以获得氯化氢,燃烧时产生苍白色火焰,被水吸收而获得盐酸,故D正确.
故选D.点评:
本题考点: 实验装置综合.
考点点评: 本题考查实验装置的综合应用,为高频考点,把握燃烧管中C通入的为氢气及常见气体的制取原理为解答的关键,侧重分析与实验能力的考查,题目难度中等.1年前查看全部
- 用CO还原铁的氧化物的实验中,硬质玻璃管质量是71.7g,在通入CO前,铁的氧化物和玻璃管的总质量是86.2
用CO还原铁的氧化物的实验中,硬质玻璃管质量是71.7g,在通入CO前,铁的氧化物和玻璃管的总质量是86.2 g,当铁的氧化物与足量的CO充分反应且生成的CO2全部逸出玻璃管后,玻璃管和管内固体的总质量为82.2 g,通过计算推测该铁的氧化物的化学式.
 mayasol1年前2
mayasol1年前2 -
 咪蒙 共回答了17个问题
咪蒙 共回答了17个问题 |采纳率100%解题思路:根据质量守恒定律知:反应后玻璃管和管内固体的总质量去掉玻璃管的质量就是生成铁的质量,也是氧化物中铁元素的质量.
反应前玻璃管和氧化物的总质量去掉玻璃管的质量就是氧化物的质量,再去掉铁元素的质量,就是氧化物中氧元素的质量.
由氧化物中铁元素和氧元素的质量可以计算出氧化物中铁、氧元素的原子个数比,从而得到氧化物的化学式.氧化物中铁、氧元素的原子个数比为
[82.2g−71.7g/56]:[86.2g−82.2g/16]=3:4
即氧化物的化学式为Fe3O4.
答:该铁的氧化物的化学式为Fe3O4.点评:
本题考点: 物质组成的综合计算;有关化学式的计算和推断;质量守恒定律及其应用.
考点点评: 本题主要考查质量守恒定律和有关化学式的计算,难度较大.1年前查看全部
- 将浸透了石蜡油的石棉放在硬质玻璃管底部 试管中放入碎瓷片 给碎瓷片加强热
 迷籴天使1年前1
迷籴天使1年前1 -
 伊酩 共回答了20个问题
伊酩 共回答了20个问题 |采纳率90%问什么?产物主要是乙烯和烷烃的混合物.乙烯能使酸性高锰酸钾溶液、溴水、溴的四氯化碳溶液褪色.1年前查看全部
- (1)小红用下图装置进行CO还原铁的某种氧化物实验,她先称量硬质玻璃管的质量为66.7g,往硬质玻璃管内放入该铁的氧化物
 (1)小红用下图装置进行co还原铁的某种氧化物实验,她先称量硬质玻璃管的质量为66.7g,往硬质玻璃管内放入该铁的氧化物后,称得铁的氧化物和硬质玻璃管的总质量是81.2g.然后通入co并加热,使铁的氧化物与足量的co充分反应,冷却后称得硬质玻璃管和管内残留固体的总质量是77.2g.由此推断,该氧化物的化学式为fe3o4fe3o4;实验完毕称得洗气瓶的质量增加了1111g.
(1)小红用下图装置进行co还原铁的某种氧化物实验,她先称量硬质玻璃管的质量为66.7g,往硬质玻璃管内放入该铁的氧化物后,称得铁的氧化物和硬质玻璃管的总质量是81.2g.然后通入co并加热,使铁的氧化物与足量的co充分反应,冷却后称得硬质玻璃管和管内残留固体的总质量是77.2g.由此推断,该氧化物的化学式为fe3o4fe3o4;实验完毕称得洗气瓶的质量增加了1111g.
(2)某实验研究小组将6.5g由h2、o2、co组成的混合气体置于密闭容器中点火***.冷却至室温,干燥后测得气体质量为4.7g;再通入足量的苛性钠溶液,干燥后测得剩余气体质量为0.3g,经检验,这0.3g气体是氧气.求原混和气体中h2、o2、co的质量各是多少? 夏日清泉1年前1
夏日清泉1年前1 -
 自行车兜风的猪猪 共回答了13个问题
自行车兜风的猪猪 共回答了13个问题 |采纳率84.6%解题思路:(1)根据质量守恒定律知:反应后玻璃管和管内固体的总质量去掉玻璃管的质量就是生成铁的质量,也是氧化物中铁元素的质量,反应前玻璃管和氧化物的总质量去掉玻璃管的质量就是氧化物的质量,再去掉铁元素的质量,就是氧化物中氧元素的质量,由氧化物中铁元素和氧元素的质量可以计算出氧化物中铁、氧元素的原子个数比,从而得到氧化物的化学式;根据氧化铁的质量,据化学方程式算的二氧化碳的质量,即为洗气瓶的质量增加量.
(2)根据题意获得反应生成的CO2质量以及生成H2O的质量,然后根据化学方程式计算即可.(1)氧化物中铁元素的质量:77.2g-66.7g=10.5g,铁的氧化物的质量:81.2g-66.7g=14.5g 铁的氧化物中氧元素的质量14.5g-10.5g=4.0g,氧化物中铁、氧元素的原子个数比为:
10.5g
56
4.0g
16=
3
4,即氧化物的化学式为Fe3O4.
设:生成二氧化碳的质量为x
4CO+Fe3O4
高温
.
3Fe+4CO2
232 176
14.5g x
232
14.5g=
176
x x=11g
答:生成二氧化碳的质量为11g.
(2)反应生成的CO2质量为:4.7g-0.3g=4.4g,生成H2O的质量为:6.5g-4.7g=1.8g,
设:原混合气体中含CO的质量为X,含H2的质量为Y,分别与质量为m、n的O2反应
2CO+O2
点燃
.
2CO2
563288
Xm 4.4g
32
m=
88
4.4gm=1.6g
56
X=
88
4.4gX=2.8g
2H2+O2
点燃
.
2H2O
43236
Yn 1.8g
4
Y=
36
1.8gY=0.2g
32
n=
36
1.8g n=1.6g
则原混合气体中含O2的质量为:0.3g+1.6g+1.6g=3.5g (或:6.5g-2.8g-0.2g=3.5g).
答:原混和气体中H2、O2、CO的质量各是0.2g、3.5g、2.8g.点评:
本题考点: 一氧化碳还原氧化铁;根据化学反应方程式的计算.
考点点评: 本题主要考查质量守恒定律和有关化学方程式的计算,要求学生会从题目已知信息中挖掘出暗藏的已知条件,并具备分析和解决问题的能力,难度较大,是一道综合实验和计算为一体的题目.1年前查看全部
- (1)小红用下图装置进行CO还原铁的某种氧化物实验,她先称量硬质玻璃管的质量为66.7g,往硬质玻璃管内放入该铁的氧化物
(1)小红用下图装置进行co还原铁的某种氧化物实验,她先称量硬质玻璃管的质量为66.7g,往硬质玻璃管内放入该铁的氧化物后,称得铁的氧化物和硬质玻璃管的总质量是81.2g.然后通入co并加热,使铁的氧化物与足量的co充分反应,冷却后称得硬质玻璃管和管内残留固体的总质量是77.2g.由此推断,该氧化物的化学式为 ___ ;实验完毕称得洗气瓶的质量增加了 ___ g.
(2)某实验研究小组将6.5g由h2、o2、co组成的混合气体置于密闭容器中点火***.冷却至室温,干燥后测得气体质量为4.7g;再通入足量的苛性钠溶液,干燥后测得剩余气体质量为0.3g,经检验,这0.3g气体是氧气.求原混和气体中h2、o2、co的质量各是多少?
 kuangbiaowj1年前3
kuangbiaowj1年前3 -
 独行在ii 共回答了11个问题
独行在ii 共回答了11个问题 |采纳率81.8%解题思路:(1)根据质量守恒定律知:反应后玻璃管和管内固体的总质量去掉玻璃管的质量就是生成铁的质量,也是氧化物中铁元素的质量,反应前玻璃管和氧化物的总质量去掉玻璃管的质量就是氧化物的质量,再去掉铁元素的质量,就是氧化物中氧元素的质量,由氧化物中铁元素和氧元素的质量可以计算出氧化物中铁、氧元素的原子个数比,从而得到氧化物的化学式;根据氧化铁的质量,据化学方程式算的二氧化碳的质量,即为洗气瓶的质量增加量.
(2)根据题意获得反应生成的CO2质量以及生成H2O的质量,然后根据化学方程式计算即可.(1)氧化物中铁元素的质量:77.2g-66.7g=10.5g,铁的氧化物的质量:81.2g-66.7g=14.5g 铁的氧化物中氧元素的质量14.5g-10.5g=4.0g,氧化物中铁、氧元素的原子个数比为:
10.5g
56
4.0g
16=[3/4],即氧化物的化学式为Fe3O4.
设:生成二氧化碳的质量为x
4CO+Fe3O4
高温
.
3Fe+4CO2
232 176
14.5g x
[232/14.5g=
176
x] x=11g
答:生成二氧化碳的质量为11g.
(2) 反应生成的CO2质量为:4.7g-0.3g=4.4g,生成H2O的质量为:6.5g-4.7g=1.8g,
设:原混合气体中含CO的质量为X,含H2的质量为Y,分别与质量为m、n的O2反应
2CO+O2
点燃
.
2CO2
563288
Xm 4.4g
[32/m=
88
4.4g]m=1.6g
[56/X=
88
4.4g]X=2.8g
2H2+O2
点燃
.
2H2O
43236
Yn 1.8g
[4/Y=
36
1.8g]Y=0.2g
[32/n=
36
1.8g] n=1.6g
则原混合气体中含O2的质量为:0.3g+1.6g+1.6g=3.5g (或:6.5g-2.8g-0.2g=3.5g).
答:原混和气体中H2、O2、CO的质量各是0.2g、3.5g、2.8g.点评:
本题考点: ["一氧化碳还原氧化铁","根据化学反应方程式的计算"]
考点点评: 本题主要考查质量守恒定律和有关化学方程式的计算,要求学生会从题目已知信息中挖掘出暗藏的已知条件,并具备分析和解决问题的能力,难度较大,是一道综合实验和计算为一体的题目.1年前查看全部
- 如下图所示的装置中,A是氯气发生装置,C、D 为气体净化装置(C中装有饱和食盐水;D 中装有浓硫酸),E 是硬质玻璃管装
如下图所示的装置中,A是氯气发生装置,C、D 为气体净化装置(C中装有饱和食盐水;D 中装有浓硫酸),E 是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G 中装有氢氧化钠溶液。

试回答:
(1)实验室制氯气的化学方程式:_______________________________;
(2)C装置的作用是________________;D 装置的作用是__________________;
E中发生化学反应的方程式为:_____________________________。
(3)烧杯G 中装有氢氧化钠溶液的作用是___________________;发生反应的化学方程式为:_______________________________________。 婉清wq1年前1
婉清wq1年前1 -
 bg3raw 共回答了25个问题
bg3raw 共回答了25个问题 |采纳率88%(1)MnO 2 + 4 HCl(浓) = MnCl 2 + Cl 2 ↑+ 2 H 2 O
(2)除去氯气中混有的氯化氢干燥氯气
2 Fe + 3 Cl 2 =" 2" FeCl 3
(3)吸收多余的氯气
Cl 2 + 2 NaOH =" NaCl" + NaClO + H 2 O
略1年前查看全部
- (15分)硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
(15分)硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na 2 SO 3 固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白:
棉球 棉球上滴加的试剂 实验现象 解释和结论 a 棉球变白,微热后又恢复红色 b 含酚酞的NaOH溶液 棉球变为白色 离子方程式: c
棉球变为白色 该气体具有 (选填“氧化性”或“还原性”)
Ⅱ、硬质玻璃管与其它装置结合完成定性或定量实验。下图是某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究的装置。
实验一:铁矿石中含氧量的测定
(1)按上图组装仪器(夹持仪器均省略),检查装置的气密性;
(2)将10.0g铁矿石放入硬质玻璃管中;
(3)从左端导气管口处不断地缓缓通入H 2 , 后,点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(5)测得反应后装置B增重2.70g,则铁矿石中氧的质量分数为______________________。
实验二:铁矿石中含铁量的测定
(1)步骤②和⑤中都要用到的玻璃仪器是 __。
(2)下列有关步骤⑥的操作中说法不正确的是 _______ 。
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成,由实验一、二得出该铁矿石中铁的氧化物的化学式为 _老袁1年前1
_老袁1年前1 -
 精神璐璐 共回答了20个问题
精神璐璐 共回答了20个问题 |采纳率90%Ⅰ
棉球
棉球上滴加的试剂
现象
解释和结论
a
品红试液
SO 2 具有漂白性,且为暂时性漂白1年前查看全部
- 用CO还原铁的氧化物的实验中,硬质玻璃管质量是71.7g,在通入CO前,铁的氧化物和玻璃管的总质量是86.2
用CO还原铁的氧化物的实验中,硬质玻璃管质量是71.7g,在通入CO前,铁的氧化物和玻璃管的总质量是86.2 g,当铁的氧化物与足量的CO充分反应且生成的CO2全部逸出玻璃管后,玻璃管和管内固体的总质量为82.2 g,通过计算推测该铁的氧化物的化学式.
 意大利前锋1年前1
意大利前锋1年前1 -
 linyaohua1226 共回答了16个问题
linyaohua1226 共回答了16个问题 |采纳率81.3%解题思路:根据质量守恒定律知:反应后玻璃管和管内固体的总质量去掉玻璃管的质量就是生成铁的质量,也是氧化物中铁元素的质量.
反应前玻璃管和氧化物的总质量去掉玻璃管的质量就是氧化物的质量,再去掉铁元素的质量,就是氧化物中氧元素的质量.
由氧化物中铁元素和氧元素的质量可以计算出氧化物中铁、氧元素的原子个数比,从而得到氧化物的化学式.氧化物中铁、氧元素的原子个数比为
[82.2g−71.7g/56]:[86.2g−82.2g/16]=3:4
即氧化物的化学式为Fe3O4.
答:该铁的氧化物的化学式为Fe3O4.点评:
本题考点: 物质组成的综合计算;有关化学式的计算和推断;质量守恒定律及其应用.
考点点评: 本题主要考查质量守恒定律和有关化学式的计算,难度较大.1年前查看全部
- 硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置略)并回答问题。
硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置略)并回答问题。
(1)进行微量实验:如图所示,将浓硫酸滴入装有Na 2 SO 3 固体的培养皿一段时间后,a、b、c三个棉球变化如下表。

(2)如图所示,将硬质玻璃管改装为燃烧管。挤压软塑瓶壁,向装有固体B的锥形瓶中加入溶液A,同时往 燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸)。
①用此装置模拟工业合成盐酸,则关于试剂选择正确的是____(填序号),管口可观察到____色火焰。

②若溶液A为浓氨水,气体C为氧气,固体B为NaOH。利用该装置可完成NH 3 在O 2 中燃烧的实验。A与B混合能够产生NH 3 的原因是____________________。  zhujunwei6261年前1
zhujunwei6261年前1 -
 dice2000 共回答了25个问题
dice2000 共回答了25个问题 |采纳率80%1年前查看全部
- 用CO还原氧化物的试验中,硬质玻璃管的质量是71.7g
用CO还原氧化物的试验中,硬质玻璃管的质量是71.7g
接↑
在通入CO前,铁的氧化物和玻璃管得总质量为86.2g,当铁的氧化物与足量的CO充分反应而且生成CO2全部逸散出玻璃管,玻璃管和管内的固体物质总质量是82.2g,通过计算确定该铁的氧化物的化学式
请具体解释一下反应消耗的氧化物的质量是多少?为什么? meilidehuaduo1年前2
meilidehuaduo1年前2 -
 zgfczsww 共回答了17个问题
zgfczsww 共回答了17个问题 |采纳率88.2%铁的氧化物m=86.2-71.7=14.5g
由于氧化物中的氧被CO还原生成了CO2,其中氧的质量86.2-82.2=4g
则铁的质量14.5-4=10.5g
铁的物质的量10.5/56=0.1875氧的物质的量4/16=0.25
nFe:nO=0.1875:0.25=0.75=3:4
所以答案是Fe3O41年前查看全部
- 用CO还原铁的氧化物的实验中,硬质玻璃管质量是71.7g,在通入CO前,铁的氧化物和玻璃管的总质量是86.2 g,当铁的
用CO还原铁的氧化物的实验中,硬质玻璃管质量是71.7g,在通入CO前,铁的氧化物和玻璃管的总质量是86.2 g,当铁的氧化物与足量的CO充分反应且生成的CO2全部逸出玻璃管后,玻璃管和管内固体的总质量为82.2 g,通过计算推测该铁的氧化物的化学式.
 cycy1231年前2
cycy1231年前2 -
 zy3358 共回答了18个问题
zy3358 共回答了18个问题 |采纳率88.9%解题思路:根据质量守恒定律知:反应后玻璃管和管内固体的总质量去掉玻璃管的质量就是生成铁的质量,也是氧化物中铁元素的质量.
反应前玻璃管和氧化物的总质量去掉玻璃管的质量就是氧化物的质量,再去掉铁元素的质量,就是氧化物中氧元素的质量.
由氧化物中铁元素和氧元素的质量可以计算出氧化物中铁、氧元素的原子个数比,从而得到氧化物的化学式.氧化物中铁、氧元素的原子个数比为
[82.2g−71.7g/56]:[86.2g−82.2g/16]=3:4
即氧化物的化学式为Fe3O4.
答:该铁的氧化物的化学式为Fe3O4.点评:
本题考点: 物质组成的综合计算;有关化学式的计算和推断;质量守恒定律及其应用.
考点点评: 本题主要考查质量守恒定律和有关化学式的计算,难度较大.1年前查看全部
- 关于氧气制法的实验``实验前在一侧针管内留20ml空气,然后给装有铜丝的硬质玻璃管加热,同时缓慢交替推拉两个注射器的活塞
关于氧气制法的实验``
实验前在一侧针管内留20ml空气,然后给装有铜丝的硬质玻璃管加热,同时缓慢交替推拉两个注射器的活塞,只玻璃管内的铜丝变黑,且装置内气体的量不再进一步变化.停止加热后,带冷却至室温,将气体全部推至一个注射器中,记录下注射器内剩余气体的体积.
根据你对上述试验的理解和你做次试验的经验回答问题:
1.实验结束后,注射器内的气体体积理论上应该减少 ( )ml
这是因为:
2.试验的加热过程中,多次缓慢交替推动两个注射器活塞的目的:
3.如果该小组测得的空气中氧气的含量大于理论值,请你帮助该小组的同学分析出现的误差的原因:(多答)`
4.如果该小组测得的空气中氧气的含量小于理论值,请你帮助该小组的同学分析出现的误差的原因. Amnesia1年前1
Amnesia1年前1 -
 武汉基地视觉摄影 共回答了22个问题
武汉基地视觉摄影 共回答了22个问题 |采纳率81.8%1:因为铜在加热的情况下与氧气反应生成氧化铜,因为空气中氧气含量为20%,所以理论上应减少约4毫升.2.为了使铜能把氧气充分反应掉,把注射器内部的氧气推出来反应掉.3.在把气体推至另一注射器时部分气体流失.注射器活塞...1年前查看全部
- 将浸透了石蜡油的石棉放在硬质玻璃管底部,试管中放入碎瓷片,给碎瓷片加强热
将浸透了石蜡油的石棉放在硬质玻璃管底部,试管中放入碎瓷片,给碎瓷片加强热
问:反应过程中产生了黑烟,即碳的烟尘,那碳的烟尘是怎么产生的? rg65675g1年前2
rg65675g1年前2 -
 lisiming151052 共回答了16个问题
lisiming151052 共回答了16个问题 |采纳率100%出现烃的裂化反应.甲烷可以分解变为C和氢气的.逐步裂化,是可能产生碳单质的.1年前查看全部
大家在问
- 1英语翻译客源丰富:合理面积,经济投资,超植前景;打造商业良机,实现财富梦想的最好机会人口密集:商业成熟,周遍居民居住多为
- 2I think I can.But I was
- 3电离方程式中:多元弱酸分步写,多元弱碱一步完.
- 4高中阶段哪些化合物既可以被认为是共价化合物,又可以是离子化合物?
- 5把多项式a的平方-2ba+b的平方-c的平方,写成两个代数式差的形式,使被减式中只含字母a,减式不含字母a:
- 6如图所示,质量m2=5kg的物块置于光滑水平面上,再将m1=5kg的另一物块置于m2的水平表面上,两物块之间的动摩擦因数
- 7张老师为图书室买书,如果他买6本童话书和7本故事书需要144元,如果他买9本童话书和7本同样的故事书需要174
- 8甲数的七分之一和乙数的八分之一相等,甲乙两数谁更大
- 9一元二次方程2x的平方加3x减1等于0两根的倒数之和为多少?
- 10表达好好照顾自己,等我回来的句子
- 11读地球仪示意图,回答30~33题.
- 12(2018•株洲县模拟)某同学在探究测定绿豆种子9发芽率时,进行了重复实验,重复4次,记录结果如下表,你认为他所测得9绿
- 13在细胞分裂时,要想在显微镜下看清染色体,必须用的染色剂是( )
- 14快车从A地开往B地,慢车从B地开往A的,两车同时相对开出8小时后相遇,然后各自继续行驶4小时,这时快车离
- 15第四自然段 詹天佑 遇到什么难题?


