铁原子核外电子排布图是什么?请说明理由.
 ovo792022-10-04 11:39:541条回答
ovo792022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 深水悠悠猪 共回答了17个问题
深水悠悠猪 共回答了17个问题 |采纳率88.2%- +26 2 8 14 2 原子核 K L M N
- 1年前
相关推荐
- 与氩原子核外电子排布相同的一组阴离子是
与氩原子核外电子排布相同的一组阴离子是
A.氧离子和铁离子 B.硫离子和氯离子 C氯离子和溴离子 D.铁离子和氯离子 4848501年前1
4848501年前1 -
 malefic123 共回答了18个问题
malefic123 共回答了18个问题 |采纳率94.4%B1年前查看全部
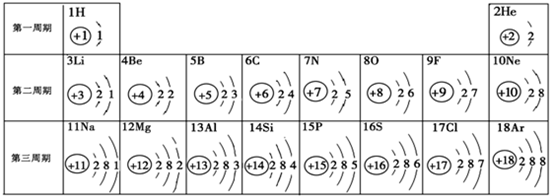
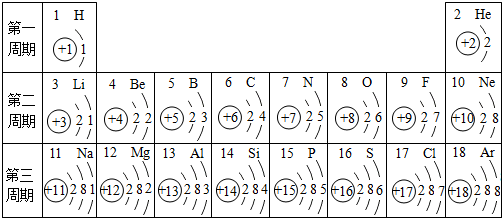
- 元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
 元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
(1)第11号元素属于______元素(填“金属”或“非金属”);
(2)元素的化学性质与原子结构中的______关系最密切;
(3)研究表明:在上表同一横行,从左至右,原子失去电子的能力逐渐减弱,得到电子的能力逐渐增强;在同一纵行中,从上到下,原子失去电子的能力逐渐增强,得到电子的能力逐渐减弱.上表中,失去电子能力最强的原子是______(填元素符号). Deanlily71年前1
Deanlily71年前1 -
 shang34jk3000 共回答了14个问题
shang34jk3000 共回答了14个问题 |采纳率85.7%解题思路:(1)根据元素原子最外层电子数的特点:金属元素的原子最外层电子的数目一般少于4,进行解答;
(2)根据元素的化学性质与原子核外的最外层电子数有密切关系,进行解答;(1)根据元素原子最外层电子数的特点:金属元素的原子最外层电子的数目一般少于4,在化学反应中容易得到电子达到稳定结构,可知:第11号元素最外层电子的数目为1属于非金属元素,在化学反应中容易失去电子;
(2)元素的化学性质与原子核外的最外层电子数有密切关系;
(3)在同一纵行中,从上到下,原子失去电子的能力逐渐增强,所以钠原子失去电子能力最强.
故答案为:(1)金属(2)最外层电子数;(3)Na点评:
本题考点: 元素周期表的特点及其应用;核外电子在化学反应中的作用;元素的简单分类.
考点点评: 本题考查元素原子最外层电子数的特点及与化学性质的关系和元素周期表的知识理解与应用.1年前查看全部
- 元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:

(1)第16号元素属于______元素(填“金属”或“非金属”),它在化学反应中容易______(填“得”或“失”)电子;
(2)元素的化学性质与原子结构中的______数关系密切;
(3)此表纵行排列的依据是______;此表横行排列的依据是______.
(4)我发现如下规律:
①原子序数与元素原子核电荷数在数值上相等;
②______;
③______. 非常观点1年前1
非常观点1年前1 -
 xyhwsl 共回答了22个问题
xyhwsl 共回答了22个问题 |采纳率95.5%解题思路:(1)根据元素原子最外层电子数的特点:非金属元素的原子最外层电子的数目一般多于4,在化学反应中容易得到电子达到稳定结构,进行解答;(2)根据元素的化学性质与原子核外的最外层电子数有密切关系:电子数少于四个的一般容易失去电子形成阳离子,电子数少于八个而多于或等于四个的一般容易得到电子形成阴离子,电子数为八个的化学性质一般稳定,不容易发生化学变化;进行解答;(3)根据在同一个族中,电子层数的变化或最外层电子数的特点等或从上到下核电荷数变化特点进行分析解答;(4)依据表中信息;进行分析解答.(1)根据元素原子最外层电子数的特点:非金属元素的原子最外层电子的数目一般多于4,在化学反应中容易得到电子达到稳定结构,可知:第16号元素属于非金属元素;故答案为:非金属;得;
(2)元素的化学性质与原子核外的最外层电子数有密切关系;故答案为:最外层电子;
(3)根据在同一个族中,从上到下最外层电子数相等,同一横行的从左到右电子层数相同;故答案为:最外层电子数相等;电子层数相同;
(4)发现如下规律:原子中的质子数=核外电子数;同一横行的从左到右最外层电子数依次增大;故答案为:②原子中的质子数=核外电子数;③同一横行的从左到右最外层电子数依次增大.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查元素原子最外层电子数的特点及与化学性质的关系和元素周期表的知识理解与应用.1年前查看全部
- 在某元素的原子核外电子排布中,K电子层和L电子层的电子数之和等于M电子层和N电子层的电子数之和.则该元素的核电荷数为(
在某元素的原子核外电子排布中,K电子层和L电子层的电子数之和等于M电子层和N电子层的电子数之和.则该元素的核电荷数为( )
A. 30
B. 12
C. 17
D. 20 happysky1985101年前4
happysky1985101年前4 -
 hexinyee 共回答了23个问题
hexinyee 共回答了23个问题 |采纳率87%解题思路:由于该元素原子含有M、N电子层,故K层、L层已经排满,K电子层和L电子层的电子数之和为10,所以M电子层和N电子层的电子数之和也为10.电中性原子核电荷数=质子数=核外电子数.据此判断由于该元素原子含有M、N电子层,故K层、L层已经排满,K电子层和L电子层的电子数之和为10,所以M电子层和N电子层的电子数之和也为10,故该元素原子核外电子数为10+10=20,所以该元素核电荷数为20.
故选:D.点评:
本题考点: 原子核外电子排布;核电荷数.
考点点评: 考查核外电子排布规律等,比较基础,掌握核外电子排布规律并能灵活运用.1年前查看全部
- 元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
(1)第16号元素属于______元素(填“金属”或“非金属”),它在化学反应中容易______(填“得”或“失”)电子;
(2)在同一周期中,各元素的原子结构呈现的规律有______;
(3)写出由原子序数为1、7、8的三种元素所组成的一种化合物的化学式______. 东方高阳1年前1
东方高阳1年前1 -
 dai1318 共回答了10个问题
dai1318 共回答了10个问题 |采纳率90%解题思路:(1)根据元素周期表可知,第12号元素名称、由其汉语名称可知其元素种类、由最外层电子数可知得失电子情况;
(2)根据元素周期律,同一周期中,随质子数或原子序数的递增(或从左到右)各原子的(最外层)电子数依次增多,进行解答.
(3)根据元素周期表可知原子序数为1的元素为H,原子序数为8的元素是O,原子序数为7的元素是N;(1)根据元素周期表可知,第16号元硫元素,它属于非金属元素,它的原子的最外层有6个电子,在化学反应中容易得电子;
(2)根据元素周期律,同一周期中,随质子数或原子序数的递增(或从左到右)各原子的(最外层)电子数依次增多,
(3)根据元素周期表可知原子序数为1的元素为H,原子序数为8的元素是O,原子序数为7的元素是N,由氮、氢、氧三种元素组成的化合物的化学式可以为:HNO2或NH4OH或HNO3
故答案为:(1)非金属;得;(2)从左到右各原子的质子数依次递增;(3)HNO2或NH4OH或HNO3
.点评:
本题考点: 元素周期表的特点及其应用.
考点点评: 了解元素周期表的特点及其应用;核外电子在化学反应中的具体作用是解题的关键.1年前查看全部
- 元素周期表是我们学习化学和研究化学的重要工具.如图所示是元素周期表中1~18号元素原子核外电子排布,请你对它进行研究:
元素周期表是我们学习化学和研究化学的重要工具.如图所示是元素周期表中1~18号元素原子核外电子排布,请你对它进行研究:

(1)稀有气体原子最外层电子数为______个(He除外,为2个),达到稳定结构,所以稀有气体化学性质稳定;金属原子最外层电子数一般<4个,容易______电子,变成______离子;非金属原子的最外层电子数一般≥4个,容易______电子,变成______离子.
(2)第11号元素名称是______,它在化学反应中容易______电子,它的离子符号为______;第17号元素名称是______,它在化学反应中容易______电子,它的离子符号为______.这两种离子相互作用就形成了______(填一种具体物质的名称) 奇搜搜1年前1
奇搜搜1年前1 -
 123dbt 共回答了20个问题
123dbt 共回答了20个问题 |采纳率90%解题思路:(1)根据元素原子最外层电子数的特点,最外层电子数与得失电子的关系考虑;(2)根据元素的化学性质与原子核外的最外层电子数有密切关系,离子的写法回答本题.(1)由图示可知稀有气体原子最外层电子数为8(He除外,为2个),带正电荷的离子属于阳离子,带负电荷的离子属于阴离子,金属原子最外层电子数一般<4个,易失去电子变成阳离子;非金属原子的最外层电子数一般≥4个,容易得到电子变成阴离子;
(2)由图示可知第11号元素名称是钠,最外层电子数是1,易失去电子,带一个单位正电荷,所以钠离子为:Na+;第17号元素名称是氯,最外层电子数是7,易得到1个电子,带一个单位负电荷,所以离子是Cl-;由于钠显+1价,氯显-1价,所以化学式是:NaCl,名称为氯化钠.
故答案为:(1)8;失去;阳;得到;阴;(2)钠;失去;Na+;氯;得到;Cl-;氯化钠.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查元素原子最外层电子数的特点及与化学性质的关系和元素周期表的知识理解与应用.1年前查看全部
- (2010•云南)元素周期表是学习化学的重要工具,如图是元素周期表中1-18号元素原子核外电子排布示意图,根据提供的信息
(2010•云南)元素周期表是学习化学的重要工具,如图是元素周期表中1-18号元素原子核外电子排布示意图,根据提供的信息回答:

(1)第11号元素属于______元素(填“金属”或“非金属”),第2号元素的名称为______.
(2)第16号元素的原子最外层电子数为______. traveller1年前1
traveller1年前1 -
 相思紫薇星 共回答了19个问题
相思紫薇星 共回答了19个问题 |采纳率78.9%解题思路:根据元素周期表中原子结构示意图的信息进行分析回答;(1)由11号元素的元素名称是钠元素,属于金属元素;第2号元素的名称为氦;
(2)由原子结构示意图可知第16号元素的原子最外层电子数为6;
答案:(1)金属;氦;(2)6.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查学生根据元素周期表中所给信息解题的能力,难度较小.1年前查看全部
- 原子核外电子排布的问题.1.为什么电子轨道中的电子数小于等于2n^2(n为轨道序号)2.为什么最外层电子数为8时是稳定结
原子核外电子排布的问题.
1.为什么电子轨道中的电子数小于等于2n^2(n为轨道序号)
2.为什么最外层电子数为8时是稳定结构?
3.最外层电子数与原子的化合价有何关系?为什么有这种关系? ys_1997_20031年前1
ys_1997_20031年前1 -
 zhyyshqm 共回答了28个问题
zhyyshqm 共回答了28个问题 |采纳率96.4%1:原子核外电子层每层最多容纳2n^2(n代表电子层数)这是化学家研究的人们默认的!
2:原子核最外电子数达到8时不易失电子,也不易的电子!
3:请你多看看初中的化学书行吧!化学书上写的清清楚楚的!1年前查看全部
- (2010•安徽模拟)气态中性基态原子的原子核外电子排布发生如下变化,吸收能量最多的是( )
(2010•安徽模拟)气态中性基态原子的原子核外电子排布发生如下变化,吸收能量最多的是( )
A.1s22s22p63s23p2→1s22s22p63s23p1
B.1s22s22p63s23p3→1s22s22p63s23p2
C.1s22s22p63s23p4→1s22s22p63s23p3
D.1s22s22p63s23p64s24p2→1s22s22p63s23p64s24p1 198201155211年前1
198201155211年前1 -
 有种你tt我 共回答了16个问题
有种你tt我 共回答了16个问题 |采纳率100%解题思路:由原子核外电子排布可知A、B、C、D依次为Si、P、S、Ge,结合同周期自左而右第一电离能具有增大,同主族自上而下第一电离能降低判断.注意P元素3p轨道半充满,电子能量较低,第一电离能高于同周期相邻元素.第一电离能越高,失去1个电子吸收的能量越多.由原子核外电子排布可知A、B、C、D依次为Si、P、S、Ge;Si和Ge同一主族,Si在Ge上方,Si第一电离能大;Si、P、S为同一周期相邻元素,P元素原子的3p轨道为半充满,电子能量较低,P元素的第一电离能大,即第一电离能P>S>Si.所以第一电离能P>S>Si>Ge.故P原子失去1个电子吸收的能量最多.
答选:B.点评:
本题考点: 原子核外电子排布.
考点点评: 考查核外电子排布规律、电离能的比较,难度中等,注意电离能的递变规律.1年前查看全部
- (4分)下表是元素周期表中的1~18号元素原子核外电子排布,我们对它进行研究:
(4分)下表是元素周期表中的1~18号元素原子核外电子排布,我们对它进行研究:

(1)写出硫元素的一种氧化物的化学式 。
(2)写出质子数为1、6、8、11四种元素组成的可以治疗胃酸过多物质的化学式: 。
(3) 表示一种元素的两种粒子,它们属于同一种元素的依据是 。
表示一种元素的两种粒子,它们属于同一种元素的依据是 。
(4)图中He与Ne、Ar原子最外层电子数不一样,但都处在每周期的结尾处,从原子结构上分析其原因 。 缘来是你CUI1年前1
缘来是你CUI1年前1 -
 火浴修罗 共回答了13个问题
火浴修罗 共回答了13个问题 |采纳率84.6%(1)SO 2 或SO 3 (2)NaHCO 3 (3)这两种微粒的质子数相同
(4)氦原子只有一个电子层,只能容纳2个电子,与Ne、Ar原子一样,它们的最外层电子数都达到稳定结构
1年前查看全部
- (2012•高青县一模)用原子结构示意图可以方便简明地表示原子核外电子排布,如图是某元素的原子结构示意图,下列说法正确的
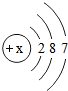 (2012•高青县一模)用原子结构示意图可以方便简明地表示原子核外电子排布,如图是某元素的原子结构示意图,下列说法正确的是( )
(2012•高青县一模)用原子结构示意图可以方便简明地表示原子核外电子排布,如图是某元素的原子结构示意图,下列说法正确的是( )
A.第一层上有7个电子
B.该元素为金属元素
C.该原子核电荷数为17
D.该原子易形成阳离子 仗691年前1
仗691年前1 -
 Regina_89 共回答了18个问题
Regina_89 共回答了18个问题 |采纳率83.3%解题思路:原子结构示意图中圆内数字为原子的质子数;圆外的弧线为电子层、弧线上的数字为该层上的电子数、离圆圆最近的弧线表示第一层,依次向外为第二层、第三层等;离圆最远的弧线表示最外层,非金属元素的最外层电子数一般大于4个且易得电子;A、由原子结构示意可知,离圆圆最近的弧线表示第一层,第一层上有2个电子,所以A错误;
B、原子的最外层电子数是7;电子数大于4,则判定为非金属元素,所以B错误;
C、在原子中,质子数=核电荷数=电子数,核外电子数是17,所以该原子核电荷数为17,所以C正确;
D、该原子最外层电子数为7,化学反应中易得到1个电子,从而形成带1个负电荷的阴离子,所以D错误.
故选C.点评:
本题考点: 原子结构示意图与离子结构示意图.
考点点评: 主要考查了原子的结构示意图,及有关的得失电子形成阴阳离子的知识,培养学生分析问题、应用知识的能力.1年前查看全部
- “主族元素中的金属元素形成的最高价阳离子一定与上一周期稀有气体元素的原子核外电子排布相同.”是否...
“主族元素中的金属元素形成的最高价阳离子一定与上一周期稀有气体元素的原子核外电子排布相同.”是否...
“主族元素中的金属元素形成的最高价阳离子一定与上一周期稀有气体元素的原子核外电子排布相同.”是否正确?请说明理由 yanqq121年前1
yanqq121年前1 -
 fdsorie 共回答了16个问题
fdsorie 共回答了16个问题 |采纳率75%对的.
主族元素中的金属元素形成的最高价阳离子时,失去的电子数等于其族序数.
而失去这些电子后,总电子数等于上一周期稀有气体元素的原子核外电子数.
两者的电子排布相同.1年前查看全部
- 1-36号元素原子核外电子排布中未成对电子数最多的是求大神帮助
1-36号元素原子核外电子排布中未成对电子数最多的是求大神帮助
这怎么看啊?还要一个一个去比较吗? zyx19871年前1
zyx19871年前1 -
 kiss120825650 共回答了24个问题
kiss120825650 共回答了24个问题 |采纳率87.5%最多的是Cr元素,他的d轨道半满,有五个未成对电子,还有4s有一个未成对电子,总共六个,最多1年前查看全部
- 某元素原子的电子排布式为[Ar]3d104s24p1,根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:
某元素原子的电子排布式为[Ar]3d104s24p1,根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:
(1)该元素处于元素周期表的第______周期,该周期的元素种数是______;
(2)该元素处于元素周期表的第______族,该族的非金属元素种数是______;
(3)该元素处于元素周期表的______区,该区所包括元素族的种类是______. 小希1年前1
小希1年前1 -
 keroro214 共回答了17个问题
keroro214 共回答了17个问题 |采纳率100%解题思路:(1)电子层数=周期数,由核外电子排布可知,该元素处于第四周期,含有18种元素;
(2)根据外围电子排布可知,为主族元素,主族族序数=最外层电子数,非金属性元素的最外层电子数大于电子层数,据此判断;
(3)根据价层电子排布为4s24p1,可以确定该元素在p区,ⅡA~ⅦA族、零族.(1)根据元素原子有4个电子层容纳电子,则该元素处于第四周期,该周期元素原子的电子排布式为[Ar]3d1-104s1-24p1-6,故共有18种元素,故答案为:四;18;(2)由外围电子排布为4s24p1,可知该元素处于p区,为主族元...
点评:
本题考点: 原子结构与元素的性质;元素周期表的结构及其应用.
考点点评: 本题考查结构与位置的关系、元素周期表的结构,难度不大,注意整体把握元素周期表结构.1年前查看全部
- 什么是原子核外电子排布相同1、什么是原子核外电子排布相同2、在分子,原子,原子核,质子,中子,电子等微粒中,质量与氢原子
什么是原子核外电子排布相同
1、什么是原子核外电子排布相同
2、在分子,原子,原子核,质子,中子,电子等微粒中,质量与氢原子质量近似相等的微粒是
1、什么是原子核外电子排布相同
2、在分子,原子,原子核,质子,中子,电子等微粒中,质量与氢原子质量近似相等的微粒是
(要详细解析)3、初三要学氯化钠,主要要知道它的什么?
(非专业人士或不知道正确答案的不要回答误导)
如果好的话再加财富值 仲夏晨雨1年前4
仲夏晨雨1年前4 -
 源源生 共回答了21个问题
源源生 共回答了21个问题 |采纳率95.2%1、就是电子层数相同,每一层所排电子也相同.
2、氢原子有一个质子和一个电子,而电子的质量很小,氢原子的质量接近一个质子的质量,而质子和中子的质量近似相等,所以选质子和中子.1年前查看全部
- 若原子核外电子排布的基本规律为最外层电子数不超过5个,次外层电子数不超过10个,倒数第3层电子数不超过
若原子核外电子排布的基本规律为最外层电子数不超过5个,次外层电子数不超过10个,倒数第3层电子数不超过
15个,而各电子层最大容量为2乘以n的平方,则元素周期表中第三,四,五周期含有的元素分别有几种
10种 15种 是如何解出来的? freewfrwer1年前1
freewfrwer1年前1 -
 jayjuzhong 共回答了22个问题
jayjuzhong 共回答了22个问题 |采纳率100%2n^2:二周期(8),三周期(18),四周期(32),5周期(50);
第三层为最外层不超过5,而第二层作为次外层为8,所以第三周期为8个;
以此类推.1年前查看全部
- 11-17号元素为例,原子核外电子排布与元素常见化合价之间的联系是什么?
 微微vio1年前1
微微vio1年前1 -
 新用户注册已存在 共回答了20个问题
新用户注册已存在 共回答了20个问题 |采纳率95%该元素如何易达到稳定结构(最外层电子数为8)
失电子 化合价为正 加它所失电子数 如Na +1
得电子 化合价为负 加它所失电子数 如Cl -1
一般 金属元素成正价1年前查看全部
- 1-30号原子核外电子排布
 Berry_Q1年前4
Berry_Q1年前4 -
 444yuan 共回答了16个问题
444yuan 共回答了16个问题 |采纳率100%原子核外电子排布规律
1、Pauli不相容原理:每个轨道最多只能容纳两个电子,且自旋相反配对
2、能量最低原理:电子尽可能占据能量最低的轨道
3、Hund规则:简并轨道(能级相同的轨道)只有被电子逐一自旋平行地占据后,才能容纳第二个电子
另外:等价轨道在全充满、半充满或全空的状态是比较稳定的,亦即下列电子结构是比较稳定的:
全充满---p6或d10 或f14
半充满----p3或d5或f7
全空-----p0 或d0或 f0
还有少数元素(如某些原子序数较大的过渡元素和镧系、锕系中的某些元素)的电子排布更为复杂,既不符合鲍林能级图的排布顺序,也不符合全充满、半充满及全空的规律.而这些元素的核外电子排布是由光谱实验结构得出的,我们应该尊重光谱实验事实.
对于核外电子排布规律,只要掌握一般规律,注意少数例外即可.
处于稳定状态的原子,核外电子将尽可能地按能量最低原理排布,另外,由于电子不可能都挤在一起,它们还要遵守保里不相容原理和洪特规则,一般而言,在这三条规则的指导下,可以推导出元素原子的核外电子排布情况,在中学阶段要求的前36号元素里,没有例外的情况发生.
1.最低能量原理
电子在原子核外排布时,要尽可能使电子的能量最低.怎样才能使电子的能量最低呢?比方说,我们站在地面上,不会觉得有什么危险;如果我们站在20层楼的顶上,再往下看时我们心理感到害怕.这是因为物体在越高处具有的势能越高,物体总有从高处往低处的一种趋势,就像自由落体一样,我们从来没有见过物体会自动从地面上升到空中,物体要从地面到空中,必须要有外加力的作用.电子本身就是一种物质,也具有同样的性质,即它在一般情况下总想处于一种较为安全(或稳定)的一种状态(基态),也就是能量最低时的状态.当有外加作用时,电子也是可以吸收能量到能量较高的状态(激发态),但是它总有时时刻刻想回到基态的趋势.一般来说,离核较近的电子具有较低的能量,随着电子层数的增加,电子的能量越来越大;同一层中,各亚层的能量是按s、p、d、f的次序增高的.这两种作用的总结果可以得出电子在原子核外排布时遵守下列次序:1s、2s、2p、3s、3p、4s、3d、4p……
2.保里不相容原理
我们已经知道,一个电子的运动状态要从4个方面来进行描述,即它所处的电子层、电子亚层、电子云的伸展方向以及电子的自旋方向.在同一个原子中没有也不可能有运动状态完全相同的两个电子存在,这就是保里不相容原理所告诉大家的.根据这个规则,如果两个电子处于同一轨道,那么,这两个电子的自旋方向必定相反.也就是说,每一个轨道中只能容纳两个自旋方向相反的电子.这一点好像我们坐电梯,每个人相当于一个电子,每一个电梯相当于一个轨道,假设电梯足够小,每一个电梯最多只能同时供两个人乘坐,而且乘坐时必须一个人头朝上,另一个人倒立着(为了充分利用空间).根据保里不相容原理,我们得知:s亚层只有1个轨道,可以容纳两个自旋相反的电子;p亚层有3个轨道,总共可以容纳6个电子;f亚层有5个轨道,总共可以容纳10个电子.我们还得知:第一电子层(K层)中只有1s亚层,最多容纳两个电子;第二电子层(L层)中包括2s和2p两个亚层,总共可以容纳8个电子;第3电子层(M层)中包括3s、3p、3d三个亚层,总共可以容纳18个电子……第n层总共可以容纳2n2个电子.
3.洪特规则
从光谱实验结果总结出来的洪特规则有两方面的含义:一是电子在原子核外排布时,将尽可能分占不同的轨道,且自旋平行;洪特规则的第二个含义是对于同一个电子亚层,当电子排布处于
全满(s2、p6、d10、f14)
半满(s1、p3、d5、f7)
全空(s0、p0、d0、f0)时比较稳定.这类似于我们坐电梯的情况中,要么电梯是空的,要么电梯里都有一个人,要么电梯里都挤满了两个人,大家都觉得比较均等,谁也不抱怨谁;如果有的电梯里挤满了两个人,而有的电梯里只有一个人,或有的电梯里有一个人,而有的电梯里没有人,则必然有人产生抱怨情绪,我们称之为不稳定状态.
二、核外电子排布的方法
对于某元素原子的核外电子排布情况,先确定该原子的核外电子数(即原子序数、质子数、核电荷数),如24号元素铬,其原子核外总共有24个电子,然后将这24个电子从能量最低的1s亚层依次往能量较高的亚层上排布,只有前面的亚层填满后,才去填充后面的亚层,每一个亚层上最多能够排布的电子数为:s亚层2个,p亚层6个,d亚层10个,f亚层14个.最外层电子到底怎样排布,还要参考洪特规则,如24号元素铬的24个核外电子依次排列为
1s22s22p63s23p64s23d4
根据洪特规则,d亚层处于半充满时较为稳定,故其排布式应为:
1s22s22p63s23p64s13d5
最后,按照人们的习惯“每一个电子层不分隔开来”,改写成
1s22s22p63s23p63d54s1
即可.1年前查看全部
- 为什么钙的原子核外电子排布第三层不能为9,第四层为1,不是每一层上最多容纳的电子数目为2n²?
 baobei2251年前0
baobei2251年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 核电荷数为12的元素的原子失去两个电子,形成的粒子符号——,他的河外电子排布与什么元素的原子核外电子排布相同
 carollujuan1年前1
carollujuan1年前1 -
 zhangyu881215 共回答了20个问题
zhangyu881215 共回答了20个问题 |采纳率95%Mg2+
Ne1年前查看全部
- 与氖原子核外电子排布相同的离子与跟氩原子核外电子排布相同的离子形成的离子化合物是( )
与氖原子核外电子排布相同的离子与跟氩原子核外电子排布相同的离子形成的离子化合物是( )
A. MgCl2
B. Na2O
C. NaF
D. KCl 陌路单行1年前1
陌路单行1年前1 -
 喂肥一刀宰 共回答了13个问题
喂肥一刀宰 共回答了13个问题 |采纳率92.3%解题思路:与氖原子核外电子排布相同的离子有:N3-、O2-、F-、Na+、Mg2+、Al3+,跟氩原子核外电子排布相同的离子有P3-、S2-、Cl-、K+、Ca2+,据此分析解答.与氖原子核外电子排布相同的离子有:N3-、O2-、F-、Na+、Mg2+、Al3+,跟氩原子核外电子排布相同的离子有P3-、S2-、Cl-、K+、Ca2+,
A.Mg2+和Ne核外电子排布式相同、Cl-和Ar原子核外电子排布式相同,所以符合条件,故A正确;
B.O2-、Na+都与Ne原子核外电子排布式相同,不符合条件,故B错误;
C.F-、Na+都与Ne原子核外电子排布式相同,不符合条件,故C错误;
D.Cl-、K+和Ar原子核外电子排布式相同,不符合条件,故D错误;
故选A.点评:
本题考点: 离子化合物的结构特征与性质.
考点点评: 本题考查了离子核外电子排布式,明确形成10电子、18电子简单离子有哪些是解本题关键,根据离子是否符合题意即可,题目难度不大.1年前查看全部
- 原子核外电子排布方式命名就像氧是2s2 2p4一样,是怎样写出来的?最好有教学课件·~
 HHFAR1年前1
HHFAR1年前1 -
 1494 共回答了11个问题
1494 共回答了11个问题 |采纳率90.9%对于某元素原子的核外电子排布情况,先确定该原子的核外电子数(即原子序数、质子数、核电荷数),如24号元素铬,其原子核外总共有24个电子,然后将这24个电子从能量最低的1s亚层依次往能量较高的亚层上排布,只有前面的亚层填满后,才去填充后面的亚层,每一个亚层上最多能够排布的电子数为:s亚层2个,p亚层6个,d亚层10个,f亚层14个.最外层电子到底怎样排布,还要参考洪特规则,如24号元素铬的24个核外电子依次排列为 1s22s22p63s23p64s23d4 根据洪特规则,d亚层处于半充满时较为稳定,故其排布式应为:1s22s22p63s23p64s13d5 最后,按照人们的习惯“每一个电子层不分隔开来”,改写成 1s22s22p63s23p63d54s1 即可.1年前查看全部
- 铁原子核外电子排布(为什么不是2,8,8,8呀)
 东东的丫头1年前1
东东的丫头1年前1 -
 杨小龙和韩香 共回答了20个问题
杨小龙和韩香 共回答了20个问题 |采纳率90%2、8、8、8?不是吧?
应该是:2、8、14、2.1年前查看全部
- 和氖原子核外电子排布相同的阴离子都有什么
 白雪妹妹1年前1
白雪妹妹1年前1 -
 谗古八拉 共回答了16个问题
谗古八拉 共回答了16个问题 |采纳率93.8%氖原子核外电子为10个,所以N3-,O2-,F-,OH-,NH2-为十电子阴离子1年前查看全部
- (2010•安徽模拟)下列原子或离子原子核外电子排布不属于基态排布的是( )
(2010•安徽模拟)下列原子或离子原子核外电子排布不属于基态排布的是( )
A.N:1s22s22p3
B.S2-:1s22s22p63s23p6
C.Na:1s22s22p53s2
D.Si:1s22s22p63s23p2 wdvhukng1年前1
wdvhukng1年前1 -
 lwqwkd 共回答了17个问题
lwqwkd 共回答了17个问题 |采纳率100%解题思路:原子或离子核外电子排布属于基态排布应满足构造原理:1s、2s2p;3s3p;4s3d4p;5s4d5p;6s4f5d6p;7s5f6d7p按此顺序填充,注意满足半满、全满、全空稳定状态,洪特规则、泡利原理.A、N原子核外有7个电子,核外电子基态排布式为1s22s22p3,故A正确;
B、S2-核外电子数为18,核外电子基态排布式为1s22s22p63s23p6,故B正确;
C、选项中2p能级未填充满电子就填充3s能级,Na原子核外电子数为11,核外电子基态排布式为1s22s22p63s1,故C错误;
D、Si原子核外电子数为14,核外电子基态排布式为1s22s22p63s23p2,故D正确.
故选:C.点评:
本题考点: 原子结构的构造原理.
考点点评: 考查核外电子排布规律,难度不大,掌握核外电子排布规律与常见电子排布式书写.1年前查看全部
- 请将下面有关原子核外电子排布原理叙述填写完整:
请将下面有关原子核外电子排布原理叙述填写完整:
(1)能量最低原理:原子核外电子先占有能量______的轨道.然后依次进入能量______的轨道.
(2)泡利不相容原理:每个原子轨道上最多只能容纳______个自旋状态______的电子.
(3)洪特规则:原子核外电子在能量相同的各个轨道上排布时①电子尽可能分占不同的原子轨道,②自旋状态______同,③全空、______或______时能量最低. cell251年前1
cell251年前1 -
 tsdhyxdfhdfhfdh 共回答了17个问题
tsdhyxdfhdfhfdh 共回答了17个问题 |采纳率88.2%解题思路:(1)在不违反泡利原理、和洪特规则的条件下,电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低;
(2)泡利不相容原理:每个原子轨道上最多只能容纳 2个自旋状态 相反的电子;
(3)洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同.(1)在不违反泡利原理、和洪特规则的条件下,电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低,这样的状态是原子的基态,故答案为:较低;较高;
(2)泡利不相容原理:每个原子轨道上最多只能容纳 2个自旋状态相反电子,故答案为:2;相反;
(3)洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同,故答案为:相;全满;半满.点评:
本题考点: 原子核外电子排布.
考点点评: 本题考查能量最低原理、泡利不相容原理、洪特规则的定义,难度不大,注意基础知识的积累.1年前查看全部
- (2006•崇文区二模)元素周期表是我们学习和研究化学的重要工具.下表是元素周期表中1-18号元素原子核外电子排布.
(2006•崇文区二模)元素周期表是我们学习和研究化学的重要工具.下表是元素周期表中1-18号元素原子核外电子排布.
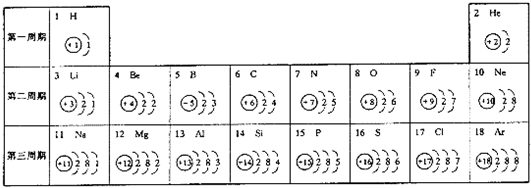
请问:(1)第17号元素的名称是______,它在化学反应中容易______(填“得”或“失”)电子,在18号元素中,与该元素具有相似化学性质的元素是______.
(2)从上表中还可以得出以下规律:原子核外电子数等于原子序数等于______、等于______.
(3)写出第8号元素的单质与第16号元素的单质反应的化学方程式S+O2
SO2点燃 .S+O2.
SO2点燃 . 乐趣老人1年前1
乐趣老人1年前1 -
 cabalalove 共回答了15个问题
cabalalove 共回答了15个问题 |采纳率93.3%解题思路:(1)根据周期表中的原子序数来分析元素,然后利用原子结构中的最外层电子数来分析性质,元素的化学性质跟它的原子的最外层电子数目关系非常密切;
(2)根据原子核外电子数=原子序数=核内质子数=核电荷数分析;
(3)根据周期表中的原子序数来分析元素,根据元素分析元素的单质,从而写出化学反应方程式.(1)第17号元素的名称氯,因其原子结构中最外层电子数为7,所以在反应中容易得到1个电子,从而达到稳定结构;最外层电子数相同,元素的化学性质相似,在18号元素中,与氯元素具有相似化学性质的元素是氟.
故答案为:氯;得;氟;
(2)在原子中,原子核外电子数=原子序数=核内质子数=核电荷数;
故答案为:核内质子数;核电荷数;
(3)第8号元素是氧,氧元素的单质是氧气,第16号元素是硫,硫元素的单质是硫磺,硫磺燃烧的化学方程式是S+O2
点燃
.
SO2;
故答案为:S+O2
点燃
.
SO2.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查学生对周期表的认识,要求学生能利用信息来发现规律,较好的考查了学生的分析归纳能力.1年前查看全部
- 初三化学问题某元素的原子核外电子排布是:第一层有2个电子,第二层有6个电子,第三层没有电子,则该元素属于A 金属元素B
初三化学问题
某元素的原子核外电子排布是:第一层有2个电子,第二层有6个电子,第三层没有电子,则该元素属于
A 金属元素
B 非金属元素
C 稀有气体元素
D 不能确定
答案给的是B
我觉得是D 如果是离子的话不就是不能确定么
求解答 风神伊吹1年前4
风神伊吹1年前4 -
 千弓长 共回答了18个问题
千弓长 共回答了18个问题 |采纳率94.4%首先题中说的是 元素 第一层有2个电子,第二层有6个电子,第三层没有电子 一看就是氧了 就是非金属
你说你觉得答案是D 觉得可能是离子 你要明白 离子的电子层一定是达到了稳定结构的 呵呵1年前查看全部
- 什么时候电子排布图表示的是原子原子核外电子排布图什么时候表示的是原子 好像是核外质子数要等于电子数才表示的是原子 说清楚
什么时候电子排布图表示的是原子
原子核外电子排布图什么时候表示的是原子 好像是核外质子数要等于电子数才表示的是原子 说清楚些 风之雷霆1年前2
风之雷霆1年前2 -
 haochidian 共回答了24个问题
haochidian 共回答了24个问题 |采纳率95.8%在结构示意图中,圆圈里的数字表示质子数,核外半弧线上的数字是每层上的电子数,当质子数和半弧线上的电子总数比较一下当:质子数=电子数 则是原子当:质子数>电子数 则是阳离子当:质子数1年前查看全部
- 请将下面有关原子核外电子排布原理叙述填写完整:
请将下面有关原子核外电子排布原理叙述填写完整:
(1)能量最低原理:原子核外电子先占有能量______的轨道.然后依次进入能量______的轨道.
(2)泡利不相容原理:每个原子轨道上最多只能容纳______个自旋状态______的电子.
(3)洪特规则:原子核外电子在能量相同的各个轨道上排布时①电子尽可能分占不同的原子轨道,②自旋状态______同,③全空、______或______时能量最低. 木水三人1年前1
木水三人1年前1 -
 朗朗之风 共回答了20个问题
朗朗之风 共回答了20个问题 |采纳率90%(1)在不违反泡利原理、和洪特规则的条件下,电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低,这样的状态是原子的基态,故答案为:较低;较高;
(2)泡利不相容原理:每个原子轨道上最多只能容纳 2个自旋状态相反电子,故答案为:2;相反;
(3)洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同,故答案为:相;全满;半满.1年前查看全部
- 元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:

(1)第16号元素属于______元素(填“金属”或“非金属”),它在化学反应中容易______(填“得”或“失”)电子;
(2)元素的化学性质与原子结构中的______数关系密切;
(3)在同一族中,各元素的原子结构呈现的规律有______(任写一点);
(4)研究表明:第二周期从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.我分析第三周期从11~17号元素原子半径变化规律是______. 乐水无忧1年前1
乐水无忧1年前1 -
 风舞轩 共回答了11个问题
风舞轩 共回答了11个问题 |采纳率90.9%解题思路:(1)根据元素原子最外层电子数的特点:非金属元素的原子最外层电子的数目一般多于4,在化学反应中容易得到电子达到稳定结构,进行解答;
(2)根据元素的化学性质与原子核外的最外层电子数有密切关系:电子数少于四个的一般容易失去电子形成阳离子,电子数少于八个而多于或等于四个的一般容易得到电子形成阴离子,电子数为八个的化学性质一般稳定,不容易发生化学变化;进行解答;
(3)根据在同一个族中,电子层数的变化或最外层电子数的特点等或从上到下核电荷数变化特点进行分析解答;
(4)依据题中信息从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.进行分析解答.(1)根据元素原子最外层电子数的特点:非金属元素的原子最外层电子的数目一般多于4,在化学反应中容易得到电子达到稳定结构,可知:第16号元素属于非金属元素;故答案为:非金属;得;
(2)元素的化学性质与原子核外的最外层电子数有密切关系;故答案为:最外层电子;
(3)根据在同一个族中,电子层数的变化或最外层电子数的特点等或从上到下核电荷数变化特点可知:电子层数递增,或最外层电子数相等,或从上到下核电荷数增大等;故答案为:电子层数递增 或最外层电子数相等 或从上到下核电荷数增大等;
(4)依据题中信息从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.所以从11~17号元素原子半径变化规律是;逐渐减小;故答案为:逐渐减小.点评:
本题考点: 元素周期表的特点及其应用;原子的定义与构成;核外电子在化学反应中的作用;原子结构示意图与离子结构示意图.
考点点评: 本题考查元素原子最外层电子数的特点及与化学性质的关系和元素周期表的知识理解与应用.1年前查看全部
- 化学原子核外电子排布元素周期表里 比如H 下边的1S^1是什么意思?s p d 前边的系数呢?看那个东西能画出来原子的电
化学原子核外电子排布
元素周期表里 比如H 下边的1S^1是什么意思?s p d 前边的系数呢?看那个东西能画出来原子的电子排布吗?
怎么看那个东西排原子核外电子? 自春来1年前2
自春来1年前2 -
 宠er_ 共回答了15个问题
宠er_ 共回答了15个问题 |采纳率86.7%那个是核外电子排部轨道.1S^1表示1S轨道上有一个电子.如果对这个有兴趣详细可以去看〖无机化学〗.1年前查看全部
- 什么元素原子核外电子排布仅有一种轨道
 黄绮敏1年前1
黄绮敏1年前1 -
 思远小怡 共回答了18个问题
思远小怡 共回答了18个问题 |采纳率100%氢元素 只有一个S轨道,并且只有一个自旋方向
如果你还在中学的话,那么不需要考虑自旋的问题,氦元素也是只有一个S轨道1年前查看全部
- 元素的性质与元素的原子核外电子排布有什么关系
 心如夏荷1年前2
心如夏荷1年前2 -
 吧唧吧唧吧唧 共回答了19个问题
吧唧吧唧吧唧 共回答了19个问题 |采纳率94.7%元素的化学性质由最外层电子数决定1年前查看全部
- 34号元素的原子核外电子排布是?
34号元素的原子核外电子排布是?
还有53和88号... jim7891231年前1
jim7891231年前1 -
 让你心疼 共回答了17个问题
让你心疼 共回答了17个问题 |采纳率94.1%34号:Se硒 核外电子排布式:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4
核外电子层上排布:28186
53号:I碘 核外电子排布式:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5
核外电子层上排布:2818187
88号:Ra镭 核外电子排布式:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 6p6 6d10 7s2
核外电子层上排布:28183218821年前查看全部
- 化学:电子云示意图含义,原子核外电子排布与元素化合价的关系等等.
化学:电子云示意图含义,原子核外电子排布与元素化合价的关系等等.
***了,做暑假作业,有好几个问题不会,希望解释得能够懂点,谢谢.
电子云示意图含义,原子核外电子排布与元素化合价的关系,“根据原子结构只是,你可以归纳出哪些等量关系?”“元素,核素,同位素的区别”“原子的相对原子质量和元素的相对原子质量的确定方法”
暂时这些,真心谢谢.
 liujie19861年前1
liujie19861年前1 -
 快乐鱼儿任遨游 共回答了18个问题
快乐鱼儿任遨游 共回答了18个问题 |采纳率94.4%1;表电子出现的概率大小
2;最外层电子数等于最高化合价《金属只有1234》价,满足最外层电子数等于8就好,
《特例H最外层电子数为2、1》一般就这样
3
4
51年前查看全部
- 同一周期中,各原子核外电子排布有什么规律?
同一周期中,各原子核外电子排布有什么规律?
最外层电子数变化与金属性,非金属性关系的规律 dd牛股1年前2
dd牛股1年前2 -
 诸葛1981 共回答了11个问题
诸葛1981 共回答了11个问题 |采纳率72.7%同一周期,随原子序数的增加,核外电子数增加
最外层电子数增加,金属性逐渐降低,非金属性逐渐增高1年前查看全部
- 某粒子的盐溶液,能使溴水退色,并浑浊,该粒子的原子核外电子排布为288,问这是什么粒子
某粒子的盐溶液,能使溴水退色,并浑浊,该粒子的原子核外电子排布为288,问这是什么粒子
谢谢! haoziwei1年前1
haoziwei1年前1 -
 polycom 共回答了18个问题
polycom 共回答了18个问题 |采纳率94.4%S2-(负二价的硫).Br2+S2-=2Br-+S↓.溴的氧化性比硫强,能置换出硫离子.类似于金属件的置换.1年前查看全部
- 化学元素周期表的划分规律一、原子核外电子排布的原理 二、核外电子排布的方法 三、核外电子排布在中学化学中的应用
 c1_i1年前0
c1_i1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 四个量子数与各原子核外电子排布的关系,请举例子说明
 故人舒眉1年前1
故人舒眉1年前1 -
 销户 共回答了13个问题
销户 共回答了13个问题 |采纳率100%四个量子数与原子核外电子排布没有太大的关系.只是原子核外每个电子都有自己特定的四个量子数定制的波函数而已.
如钠原子的最外层的3s1电子,可用四个量子数:3,0,0,1/2或-1/2;而当其中的某个电子激发到3d轨道上时,该轨道上的电子描述为:3,2,m,ms,其中,m = 2,1,0,-1,-2中的任意一个数;而 ms = 1/2,-1/2中的任意一值.1年前查看全部
- 高中化学元素周期表内容我原子核外电子排布还不是很清楚.原子序数大的,比如原子序数为38的锶和55的铯核外电子该如何排列?
高中化学元素周期表内容
我原子核外电子排布还不是很清楚.
原子序数大的,比如原子序数为38的锶和55的铯核外电子该如何排列?
是不是遵循2、8、18、32、32、18、8的顺序不对的话帮我改正下,我看到课件是说每层不得超过2的n平方,除了第一层不能是2外,我到底应该怎么排呢? asd13720031年前0
asd13720031年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在某元素的原子核外电子排布中,K电子层和L电子层的电子数之和等于M电子层和N电子层的电子数之和.则该元素的核电荷数为(
在某元素的原子核外电子排布中,K电子层和L电子层的电子数之和等于M电子层和N电子层的电子数之和.则该元素的核电荷数为( )
A.30
B.12
C.17
D.20 剑折有寸利1年前1
剑折有寸利1年前1 -
 东巴鱼 共回答了17个问题
东巴鱼 共回答了17个问题 |采纳率88.2%解题思路:由于该元素原子含有M、N电子层,故K层、L层已经排满,K电子层和L电子层的电子数之和为10,所以M电子层和N电子层的电子数之和也为10.电中性原子核电荷数=质子数=核外电子数.据此判断由于该元素原子含有M、N电子层,故K层、L层已经排满,K电子层和L电子层的电子数之和为10,所以M电子层和N电子层的电子数之和也为10,故该元素原子核外电子数为10+10=20,所以该元素核电荷数为20.
故选:D.点评:
本题考点: 原子核外电子排布;核电荷数.
考点点评: 考查核外电子排布规律等,比较基础,掌握核外电子排布规律并能灵活运用.1年前查看全部
- 元素周期表是学习化学的重要工具。下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
元素周期表是学习化学的重要工具。下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
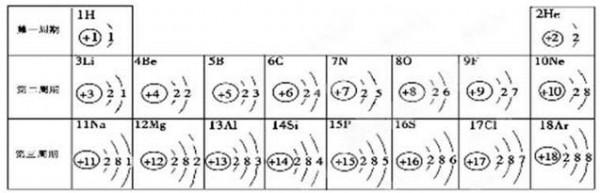
(1)第16号元素属于_______元素(填“金属”或“非金属”),它在化学反应中容易________(填“得”或“失”)电子;
(2)元素的化学性质与原子结构中的______________数关系密切;
(3)在同一纵行中,各元素的原子结构呈现的规律有________________ (任写一点);
(4)研究表明:第二周期从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小。请分析第三周期从11~17号元素原子半径变化规律是 _______________________。 无迹飞鸟1年前1
无迹飞鸟1年前1 -
 彩色公主 共回答了19个问题
彩色公主 共回答了19个问题 |采纳率100%(1)非金属;得;(2)最外层电子;(3)电子层数递增 或最外层电子数相等 或从上到下核电荷数增大等;(4)逐渐减小。
1年前查看全部
- 那些原子核外电子排布会是洪特规则的特例呢
 lltiger031年前1
lltiger031年前1 -
 梦蝶枕月 共回答了22个问题
梦蝶枕月 共回答了22个问题 |采纳率95.5%都符合洪特规则.在能量相等的轨道上,电子尽可能自旋平行地多占不同的轨道.1年前查看全部
- 下列有关原子核外电子排布的说法正确的是( )
下列有关原子核外电子排布的说法正确的是( )
A.离核较近区域运动的电子能量较高
B.M层最多容纳的电子数不超过8
C.K层为最外电子层时最多只能容纳8个电子
D.稀有气体元素的原子形成了稳定的电子层结构 孤舟_笠翁1年前1
孤舟_笠翁1年前1 -
 wxm1984 共回答了20个问题
wxm1984 共回答了20个问题 |采纳率95%解题思路:A、离核较近区域运动的电子能量较低;
B、M层最多容纳的电子数不超过18个;
C、K层为最外电子层时最多只能容纳2个电子;
D、稀有气体元素的原子最外层都达到了8个电子(He为2个电子)的稳定结构.A、离核较近区域运动的电子能量较低,故A错误;
B、M层最多容纳的电子数不超过18个,故B错误;
C、K层为最外电子层时最多只能容纳2个电子,故C错误;
D、稀有气体元素的原子最外层都达到了8个电子(He为2个电子)的稳定结构,故D正确;
故选D.点评:
本题考点: 原子核外电子排布.
考点点评: 本题考查了原子核外电子排布规律,难度不大,注意对基础知识的理解掌握.1年前查看全部
- 与氖原子核外电子排布相同的一组阳离子是
与氖原子核外电子排布相同的一组阳离子是
A、Li+ Be2+ B、K+ Ca2+ C、Mg2+ Al3+ D、Na+ K+ tianhai3161年前1
tianhai3161年前1 -
 ieqb6l 共回答了17个问题
ieqb6l 共回答了17个问题 |采纳率100%C
都是2 8结构1年前查看全部
- (p00n•北碚区)元素周期表是我们学习和研究化学的重要工具.下表是元素周期表中七号~七8号元素原子核外电子排布,我对它
(p00n•北碚区)元素周期表是我们学习和研究化学的重要工具.下表是元素周期表中七号~七8号元素原子核外电子排布,我对它进行研究:
(七)第七七号元素名称是______,它属于______元素(填“金属”或“非金属”),它在化学反应中容易______(填“1”或“失”)电子,它的离子符号为______.
(p)从上表中我还可以探究出以下规律:原子核外电子数=原子序数=______=______.
(3)研究表明:第二周期从3号~了号元素的原子电子层数相同,核电荷数逐渐增9,核对核外电子的引力逐渐增9,故原子半径逐渐减小.我分析第三周期从七七号~七7号元素原子半径变化规律是______. blestgod1年前1
blestgod1年前1 -
 hotcozeQQ 共回答了19个问题
hotcozeQQ 共回答了19个问题 |采纳率89.5%解题思路:(1)根据元素周期表可知,第11号元素名称、由其汉语名称可知其元素种类、由最外层电子数可知得失电子情况;
(2)熟记规律:“原子序数=核内质子数=核外电子数=核电荷数”;
(3)总结规律:“第二周期从3号~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小”,利用知识迁移,则可知第三周期从11号~17号元素原子半径变化规律.(1)根据元素周期表可知,第11号元素名称是钠元素,它属于金属元素,它在化学反应中容易失电子,它的离子符号为N4+;
(2)从上表中还可以探究出以下规律:原子核外电子数=原子序数=核电荷数=核内质子数;
(如)研究表明:第我周期从如号~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.利用知识迁移,则可分析第三周期从11号~1f号元素原子半径变化规律是原子半径逐渐减小.
故答为:(1)钠;金属;失;N4+;(2)核电荷数;核内质子数(此两空不分顺序);(如)原子半径逐渐减小点评:
本题考点: 元素周期表的特点及其应用;核外电子在化学反应中的作用;元素的符号及其意义.
考点点评: 了解元素周期表的特点及其应用;核外电子在化学反应中的作用;了解元素的符号及其意义.1年前查看全部
- 与氖原子核外电子排布相同的阳离子,跟与氩原子核外电子排布相同的阴离子所形成的化合物化学式是
与氖原子核外电子排布相同的阳离子,跟与氩原子核外电子排布相同的阴离子所形成的化合物化学式是
1.CCl4 2.Na2S 3.KCl 4.KF
为什么?
在多电子原子中,能量最高的电子是
A.离原子核最近的电子
B.一定是第1电子层的电子
C.在化学反应中最易失去的电子
D.在化学反应中最难失去的电子
第1题选择题我更改清楚点
A.CCl4
B.Na2S
C.KCl
D .KF 陈加强1年前3
陈加强1年前3 -
 moses_han 共回答了17个问题
moses_han 共回答了17个问题 |采纳率76.5%与氖原子核外电子排布相同的阳离子
意思就是失去电子后的离子和氖相同,所以必定是下一个周期的金属元素.
Na Mg Al
与氩原子核外电子排布相同的阴离子
意思就是得到电子后离子的电子排部与氩相同,所以必定是本周期的非金属元素.
P S Cl
所以选Na2S
第二题选C
能量高表示不稳定,容易失去
电子层数越高能量越高
A B都是能量最低的
D难失去也表示能量低1年前查看全部
- 原子核外电子排布遵循下列规律:(1)电子将尽可能排布在离核近的、能量低的电子层上;(2)每层最多容纳电子2n2(n为层数
原子核外电子排布遵循下列规律:
(1)电子将尽可能排布在离核近的、能量低的电子层上;
(2)每层最多容纳电子2n2(n为层数);
(3)最外层电子数不超过8个,次外层不超过18个电子,倒数第三层不超过32个电子.近年科学家发现的核电荷数为118的元素,其核外电子排布应是( )
A.2、8、18、32、32、18、8
B.2、8、18、32、18、18、22
C.2、8、18、32、50、8
D.2、8、32、32、18、8 聊也痛不聊也痛1年前1
聊也痛不聊也痛1年前1 -
 jzcenter 共回答了23个问题
jzcenter 共回答了23个问题 |采纳率95.7%解题思路:在原子结构示意图中,质子数即核电荷数等于核外电子数,核电荷数为118则核外也应有118个电子;核外电子在分层排布时,应遵循各电子层最多容纳电子数2n2(n为电子层数,且次外层电子数不超过18个).A、核外电子数=2+8+18+32+32+18+8=118,与核电荷数相等,且符合最外层不超过8、次外层不超过18个电子的规律;故A正确;
B、核外电子数=2+8+18+32+18+18+22=136,与核电荷数不等,不是核电荷数为118的元素的原子核外电子的排布;故B不正确;
C、核外电子数=2+8+18+32+50+8=118,与核电荷数相等,最外层也不超过8个电子,但其次外层电子数为50,不符合次外层电子数不超过18个的规律;故C不正确;
D、核外电子数=2+8+18+32+18+8=86,与核电荷数不等,不是核电荷数为118的元素的原子核外电子的排布;故D不正确.
故选A.点评:
本题考点: 原子的定义与构成.
考点点评: 在原子的结构示意图中,质子数即核电荷数等于核外电子总数,根据原子结构中的这一关系,可判断微粒是否为原子.1年前查看全部
大家在问
- 1容字会么写才好看
- 2某工厂9月份的产量是40,九月份比八月份增长了1/7,八月份的产量是( )万元 (填空)
- 3学习一道数学公式 ,并且希望能告诉我详细的解题方法.题目是3000*log2(1001)
- 4平均速度和平均速率的定义?
- 5传送带AB始终保持v=1m/s的速度水平移动,将一质量为m=0.5 kg的物块从离皮带很近处轻轻放在A点,物体与皮带间的
- 6饥肠辘辘的反义词快点哦,我很需要啊!
- 7读了春笋这篇短文你有什么感受
- 8球的体积与其表面积的数值相等,则球的半径等于______.
- 9一桶油连桶重33.2千克,第一次倒油的一半,第二次又倒剩下油的一半,这时连桶还重9.8千克.
- 10谁有意义深刻的哲理故事,最好有一些独到的见解,并十分钟可以演讲完成
- 11小女子不才,写了一封英文信,只求意思通顺无歧义就好.拜谢~
- 12已知点P是圆x*x+y*y-2x=0上的任意一点,O为坐标原点,则OP的最大值为 ,OP的最小值为
- 13求定积分∫tan^3xdx,^3是三次方
- 14求向量a,b夹角的取值范围?向量a,b满足|a|=2,|a-b|=1,则向量a,b夹角的取值范围?
- 15以生活给予我们快乐为题,写作文
