阳离子交换膜与阳离子交换树脂制备去离子水时,让水通过阳离子交换树脂,阳离子被交换,阴离子流过,也就是说阴离子可以通过阳离
 皖口书生2022-10-04 11:39:542条回答
皖口书生2022-10-04 11:39:542条回答制备去离子水时,让水通过阳离子交换树脂,阳离子被交换,阴离子流过,也就是说阴离子可以通过阳离子交换树脂;电解氯化钠溶液制烧碱时用的阳离子交换膜却只允许阳离子通过,不允许阴离子通过.那么这个阳离子交换树脂与阳离子交换膜有什么区别,会产生这样的差异

已提交,审核后显示!提交回复
共2条回复
 rg042 共回答了11个问题
rg042 共回答了11个问题 |采纳率100%- 阳离子交换树脂是阳离子在通过树脂的时候,被树脂吸附或者与树脂上的其他阳离子进行交换,而阴离子不吸附和交换.阳离子交换膜的交换机理和阳离子交换树脂的交换机理是不一样的,该膜是一种具有选择性透过的膜,阳离子可以通过,使阳极区和阴极区的阳离子得以互相交换,阴离子无法投过该膜,无法达到交换的目的.重点理解“交换”这个概念,前者在树脂上进行的离子置换,而后者是两极区之间离子的相互迁移,达到交换目的.
- 1年前
 necnecnec 共回答了3个问题
necnecnec 共回答了3个问题 |采纳率- 离子交换膜是对离子具有选择透过性的高分子材料制成的薄膜,
阳离子膜通常是磺酸型的,带有固定基团和可解离的离子 如钠型磺酸型:固定基团是磺酸根 解离离子是钠离子
阳离子交换膜上的磺酸集团带有负电荷和可解离离子相互吸引着,他们具有亲水性
由于阳膜带负电荷,虽然原来的解离正离子受水分子作用解离到水中,但在膜外我们通电通过电场作用,带有正电荷的阳离子就可以通过阳膜,而阴离子因为同性... - 1年前
相关推荐
- 为何食盐的电解常用阳离子交换膜电解槽而不常用阴离子交换膜电解槽
 zzbsbb1年前2
zzbsbb1年前2 -
 迷糊着的小猪 共回答了23个问题
迷糊着的小猪 共回答了23个问题 |采纳率100%ClO-也是阴离子,可能就得到NaClO,减少了氯气量.1年前查看全部
- (2013•上海二模)如图,用有阳离子交换膜(只允许阳离子通过)的立式隔膜电解槽电解食盐水时,下列叙述错误的是( )
 (2013•上海二模)如图,用有阳离子交换膜(只允许阳离子通过)的立式隔膜电解槽电解食盐水时,下列叙述错误的是( )
(2013•上海二模)如图,用有阳离子交换膜(只允许阳离子通过)的立式隔膜电解槽电解食盐水时,下列叙述错误的是( )
A.精制饱和氯化钠溶液从阳极区补充
B.产品烧碱溶液从阴极区流出
C.产品烧碱比未用离子交换膜时更纯
D.每转移NA个电子理论上可生成0.5mol 烧碱 爱婷久久1年前1
爱婷久久1年前1 -
 glory_1917 共回答了13个问题
glory_1917 共回答了13个问题 |采纳率84.6%解题思路:电解食盐水时,阳极发生氧化反应,消耗NaCl,则应在阳极补充NaCl,左侧应为电解池的阳极区,右侧应为电解池的阴极区,电解时,阳离子经过离子交换膜向阴极区移动.A.电解食盐水时,阳极发生氧化反应,消耗NaCl,则应在阳极补充NaCl,故A正确;
B.阴极生成OH-,且Na+向阴极移动,则产品烧碱溶液从阴极区流出,故B正确;
C.未用离子交换膜时,阴极区混有NaCl,产品不纯,而用离子交换膜时,只有Na+向阴极移动,产品较为纯净,故C正确;
D.电解方程式为2NaCl+2H2O
电解
.
2NaOH+Cl2↑+H2↑,每转移NA个电子理论上可生成1mol烧碱,故D错误.
故选D.点评:
本题考点: 电解原理.
考点点评: 本题考查电解原理,侧重于氯碱工业的考查,注意把握题给信息,阳离子交换膜为解答该题的关键,注意审题,题目难度不大.1年前查看全部
- 磷酸二氢钾是一种复合肥,电解法制备KH2PO4是用石墨作电极,将电解槽分为a区和b区,中间用阳离子交换膜隔离,a区为1L
磷酸二氢钾是一种复合肥,电解法制备KH2PO4是用石墨作电极,将电解槽分为a区和b区,中间用阳离子交换膜隔离,a区为1L 3mol/l的H3PO4.b区为1L 3mol/l的KCl.总反应为2KCl+2H3PO4=电解=H2↑+Cl2↑+2KH2PO4,请写出阴,阳两极的电极反应式:
阴极:
阳极: fuzhuoran1年前2
fuzhuoran1年前2 -
 jcghkghc5675g 共回答了16个问题
jcghkghc5675g 共回答了16个问题 |采纳率100%阳极 b区KCl 2ci- - 2e- = ci2
阴极 a区H3PO4 2H+ + 2e- = H2
K+从B区穿过阳离子交换膜到A区与H2PO4-形成KH2PO4复合肥1年前查看全部
- 工业上生产氯气,常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分.下图(左图
工业上生产氯气,常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分.下图(左图)为电解槽的示意图.
(1)这种阳离子交换膜,只允许溶液中的______通过.(填下列微粒的编号)
①h2②cl2③h+④cl-⑤na+⑥oh-
(2)写出在电解过程中阳极发生的电极方程式:______.
(3)已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896l,而且两边的水不能***流通.则理论上计算,电解后流出的氢氧化钠溶液的质量分数为______.
(4)某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如图所示,设计要求:①所用的交换膜不能让分子***通过;②电解过程中消耗的原料是氢氧化钠和乙醇.回答下列问题:
①写出在电解过程中阴极发生的电极方程式______.
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是:______. uumm1年前1
uumm1年前1 -
 ggss135 共回答了13个问题
ggss135 共回答了13个问题 |采纳率92.3%解题思路:(1)阳离子交换膜只允许阳离子通过,而阴离子、分子不能通过;
(2)电解池中和电源的正极相连的是电解池的阳极,发生失电子的氧化反应;
(3)根据氢气的体积计算生成的氢氧化钠的质量、溶液减少的氢气的质量、溶液增加的质量(钠的质量),再根据质量分数公式计算即可;
(4)①电解池中和电源的负极相连的是电解池的阴极,发生得电子的还原反应;
②从溶液中析出溶质的方法是蒸发结晶,可类比食盐的蒸发结晶.(1)阳离子交换膜只允许阳离子钠离子、氢离子通过,而阴离子和分子均不能通过,故答案为:③⑤;
(2)电解池中和电源的正极相连的是电解池的阳极,阳极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑;
(3)氢气的质量=[V
VmM=
896L/22.4L/mol×2g/mol=80g;电解水时,生成氢气与氢氧化钠的物质的量之比为1:2,所以生成氢氧化钠的质量=2
896L
22.4L/mol]×40g/mol=3200g,溶液增加的质量为增加的钠元素的质量减去生成氢气的质量=2×
896L
22.4L/mol×23g/mol-80g=1760g;溶液中溶质氢氧化钠的质量为10000g×10%+3200g=4200g,溶液的质量为10000g+1760g=11760g,
电解后流出的氢氧化钠溶液的质量分数=
4200g
11760g×100%=35.7%,
故答案为:35.7%;
(4)①电解池中和电源的负极相连的是电解池的阴极,阴极上乙醇得电子发生还原反应,即2CH3CH2OH+2e-=2CH3CH2O-+H2↑.
故答案为:2CH3H2OH+2e-=2CH3CH2O-+H2↑;
②从溶液中析出溶质的方法是蒸发结晶,故答案为:蒸发结晶.点评:
本题考点: 电解原理;物质的分离、提纯和除杂.
考点点评: 本题考查了电解原理等知识点,难度不大,易错题是(3)题,注意电解氢氧化钠溶液时,氢气与氢氧根离子的物质的量之比为1:2,明确溶液增加质量的计算方法.1年前查看全部
- 如图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是
如图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是

A.从E口逸出的气体是H 2 B.从B口加入含少量NaOH的水溶液以增强导电性 C.标准状况下每生成22.4 LCl 2 ,便产生2 mol NaOH D.F电极材料为金属铁  小树叶子1年前1
小树叶子1年前1 -
 shellynan 共回答了20个问题
shellynan 共回答了20个问题 |采纳率100%D
根据装置图可知,在溶液中阳离子钠离子向右侧移动,所以G电极是阴极,F电极是阳极。所以氢离子在右侧生成,氯气在左侧生成。由于F是阳极,所以不能用活性电极铁作阳极。因此正确的答案是D。1年前查看全部
- 如图1所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.请按要求回答相关问
如图1所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.请按要求回答相关问题:

(1)甲烷燃料电池负极电极反应式是:______;
(2)石墨电极(C)的电极反应式为______;
(3)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体体积为______L;丙装置中阴极析出铜的质量为______g;
(4)某同学利甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图2所示).
若用于制漂白液时a为电池______极,电解质溶液最好用______.
若用于制Fe(OH)2,使用硫酸钠做电解质溶液,阳极选用______作电极. toughbanker1年前1
toughbanker1年前1 -
 海角哥 共回答了19个问题
海角哥 共回答了19个问题 |采纳率94.7%解题思路:燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极.
(1)燃料电池中,负极上投放燃料,负极上失电子发生氧化反应.
(2)甲中投放氧化剂的电极是正极,所以乙装置中石墨是阳极,阳极上氯离子失电子发生氧化反应.
(3)根据串联电池中转移电子数相等计算铁电极上生成氢气的体积、丙装置中析出铜的质量.
(4)电解饱和食盐水时,阴极上析出氢气,阳极上析出氯气,氯气和氢氧化钠反应生成次氯酸钠,次氯酸钠是漂白液的有效成分;若用于制Fe(OH)2,使用硫酸钠做电解质溶液,阴极上氢离子放电生成氢气,阳极上铁失电子生成亚铁离子,亚铁离子和氢氧化钠反应生成氢氧化亚铁.燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极.
(1)燃料电池中,负极上投放燃料所以投放甲烷的电极是负极,负极上失电子发生氧化反应,电极反应式为:
CH4+10OH--8e-=CO32-+7H2O.
故答案为:CH4+10OH--8e-=CO32-+7H2O.
(2)甲中投放氧化剂的电极是正极,所以乙装置中石墨电极是阳极,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑.
故答案为:2Cl--2e-=Cl2↑.
(3)串联电池中转移电子数相等,若在标准状况下,有2.24L氧气参加反应,则转移电子的物质的量=
2.24L
22.4L/mol×4=0.4mol,乙装置中铁电极上氢离子放电生成氢气,设生成氢气的体积为xL;丙装置中阴极上析出铜,设析出铜的质量为yg.
2H++2e-=H2↑
2mol 22.4L
0.4mol xL
x=4.48
2Cu 2++2e-=Cu
2mol 64g
0.4mol yg
y=12.8
故答案为:4.48;12.8.
(4)电解饱和食盐水时,阴极上析出氢气,阳极上析出氯气,氯气和氢氧化钠反应生成次氯酸钠,次氯酸钠是漂白液的有效成分,B电极上生成氯气,氯气的密度小于溶液的密度,所以生成的氯气上升,能和氢氧化钠溶液充分的接反应生成次氯酸钠,所以A极上析出氢气,即A极是阴极,所以a为电池负极;若用于制Fe(OH)2,使用硫酸钠做电解质溶液,阴极上氢离子放电生成氢气,如果阳极是惰性电极,阳极上氢氧根离子放电生成氧气得不到氢氧化亚铁,所以阳极上应该是铁失电子生成亚铁离子,亚铁离子和氢氧化钠反应生成氢氧化亚铁.
故答案为:负极;饱和食盐水;铁.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池和电解池原理及物质的量的有关计算,难点是(4)题中电解质溶液的选取及电极材料的选取,根据实验目的进行正确选取即可.1年前查看全部
- CuSO4和铜正极区,ZnSO4和Zn负极区.为什么要用回阴离子交换膜不用阳离子交换膜
 飘飘幽幽1年前1
飘飘幽幽1年前1 -
 恋黧 共回答了12个问题
恋黧 共回答了12个问题 |采纳率91.7%用阳离子交换膜导致锌,铜离子发生分子运动,影响原电池化学反应.1年前查看全部
- 下列有关叙述正确的是( )A.工业上电解饱和食盐水制烧碱,用阳离子交换膜阻止0H- 移向阳极B.输油管道为了
下列有关叙述正确的是( )
A.工业上电解饱和食盐水制烧碱,用阳离子交换膜阻止0H- 移向阳极
B.输油管道为了防止表面被腐蚀应涂上隔水材料并与电源的正极相连
C.在铁制品上电镀银时,用银作阴极
D.电解法精炼铜时,粗铜连接电源的负极 喧闹中的孤独1年前1
喧闹中的孤独1年前1 -
 问天阁 共回答了12个问题
问天阁 共回答了12个问题 |采纳率100%解题思路:A.阳离子交换膜只能使阳离子通过;
B.应与电源负极相连;
C.电镀时,镀层金属为阳极;
D.精炼铜时,粗铜为阳极.A.工业上电解饱和食盐水制烧碱,溶液中阴离子向阳极移动,阳离子向阴极移动,用离子交换膜阻止0H-移向阳极,可制得烧碱,故A正确;
B.为防止输油管道被腐蚀,应与电源负极相连,为外加电源的阴极保护法,故B错误;
C.电镀时,镀层作阳极,镀件作阴极,在铁制品上电镀银时,用银作阳极,故C错误;
D.精炼铜时,粗铜为阳极,纯铜为阴极,故D错误.
故选A.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了电化学知识,难度不大,侧重于理论知识与实际应用的考查,注意化学来源于化学而服务于化学的理念,注意把握原电池和电解池的工作原理.1年前查看全部
- 电解饱和食盐水不加阳离子交换膜的话,电解槽里会发生什么反应?
电解饱和食盐水不加阳离子交换膜的话,电解槽里会发生什么反应?

为什么是这个方程式?我们老师原来讲过不加膜直接生成84,(cl2+2naoh=nacl+naclo+h2o),哪个是对的? ylh151年前1
ylh151年前1 -
 蚂蚁上树猪下海 共回答了17个问题
蚂蚁上树猪下海 共回答了17个问题 |采纳率70.6%CL离子比OH离子先失电子,H离子比Na离子先得电子 所以相当于电解HCL H离子变成氢气.CL利离子变成氯气.剩下的离子结合生成NaOH1年前查看全部
- 工业上利用电解饱和食盐水中阳离子交换膜的作用是什么?
 溪兰花1年前1
溪兰花1年前1 -
 金华慧子 共回答了16个问题
金华慧子 共回答了16个问题 |采纳率87.5%(1)只允许阳离子通过
(2)阻止分子和阴离子通过
如果分子和阴离子通过,那么生成的Cl2就会与OH-反应.1年前查看全部
- (2014•闵行区一模)如图为阳离子交换膜法电解饱和食盐水原理示意图,其中的阳离子交换膜仅允许Na+通过,b为阳极.下列
 (2014•闵行区一模)如图为阳离子交换膜法电解饱和食盐水原理示意图,其中的阳离子交换膜仅允许Na+通过,b为阳极.下列说法错误的是( )
(2014•闵行区一模)如图为阳离子交换膜法电解饱和食盐水原理示意图,其中的阳离子交换膜仅允许Na+通过,b为阳极.下列说法错误的是( )
A.a极的电极反应式为:2H++2e-→H2↑
B.D口导出的是NaOH溶液
C.浓盐水从A口注入
D.C口导出的是NaOH和NaCl的混合溶液 --知秋一叶--1年前1
--知秋一叶--1年前1 -
 z9361 共回答了20个问题
z9361 共回答了20个问题 |采纳率95%解题思路:b为阳极,发生:2Cl─-2e-=Cl2↑,则a为阴极,发生2H++2e-=H2↑,电解时,阳极生成氯气,消耗NaCl,则应在阳极补充NaCl,阴极生成OH-,且Na+向阴极移动,则产品烧碱溶液从阴极区导出,注意题中阳离子交换膜仅允许Na+通过的特点.A.a为阴极,发生2H++2e-=H2↑,故A正确;
B.阴极生成OH-,且Na+向阴极移动,则产品烧碱溶液从D口导出,故B正确;
C.电解时,阳极生成氯气,消耗NaCl,则应在阳极补充NaCl,即浓盐水从A口注入,故C正确;
D.阳离子交换膜仅允许Na+通过,则在C口不可能有NaOH导出,故D错误.
故选D.点评:
本题考点: 电解原理.
考点点评: 本题考查电解原理,侧重于氯碱工业的考查,注意把握题给信息,阳离子交换膜为解答该题的关键,注意审题,题目难度不大.1年前查看全部
- (12分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回
(12分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:

(1)甲烷燃料电池负极反应式是 ;
(2)石墨(C)极的电极反应式为 ;
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成 的气体体积为________L ,丙装置中阴极析出铜的质量为________g ;
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH) 2 的实验装置(如图所示)。
若用于制漂白液,a为电池的________极,电解质溶液最好用________;若用于制Fe(OH) 2 ,使用硫酸钠作电解质溶液,阳极选用________作电极。 jiguihua1年前1
jiguihua1年前1 -
 背锦离乡 共回答了15个问题
背锦离乡 共回答了15个问题 |采纳率93.3%(12分) (1) CH 4 +10OH - -8e - =CO 3 2- +7H 2 O ;(3分)
(2)2Cl - -2e - =Cl 2 ↑;(2分) (3)4.48L,(2分) 12.8g;(2分)
(4) 负(1分) 饱和氯化钠溶液或食盐水(1分) 铁 (1分)
1年前查看全部
- 如图为阳离子交换膜法电解饱和食盐水原理示意图. 下列说法不正确的是( ) A.从E口逸出的气体是H 2 B.
如图为阳离子交换膜法电解饱和食盐水原理示意图. 下列说法不正确的是( ) A.从E口逸出的气体是H 2 B.从B口加入含少量NaOH的水溶液以增强导电性 C.标准状况下每生成22.4LC1 2 ,便产生2molNaOH D.粗盐水中含Ca 2+ 、Mg 2+ 、Fe 2+ 、SO 4 2- 等离子,精制时最先加Na 2 CO 3 溶液 
 yyyvyyy1年前1
yyyvyyy1年前1 -
 cttynqy 共回答了21个问题
cttynqy 共回答了21个问题 |采纳率90.5%A、在电解池中,钠离子移向阴极,所以D极是阴极,该极除了产生氢氧化钠以外还会产生氢气,故从E口逸出的气体是H 2 ,故A正确;
B、阴极D极产生大量的氢氧化钠,为了增强导电性,可以从B口加入含少量NaOH的水溶液,故B正确;
C、电解原理方程式2NaCl+2H 2 O
通电
.
2NaOH+Cl 2 ↑+H 2 ↑,标准状况下每生成22.4L即1molC1 2 ,便产生2molNaOH,故C正确;
D、粗盐的提纯要加入氯化钡、氢氧化钠、碳酸钠,但是碳酸钠一定要加在氯化钡的后面,出去过量的钡离子,故D错误.
故选D.1年前查看全部
- (12分)(1)右图为阳离子交换膜法电解饱和食盐水(滴有酚酞)原理示意图,E口产生H 2 ,电解食盐水的离子方程式为:
(12分)(1)右图为阳离子交换膜法电解饱和食盐水(滴有酚酞)原理示意图,E口产生H 2 ,电解食盐水的离子方程式为: ,溶液变红色的是: 区(填A或B)。
(2)电化腐蚀是钢铁发生腐蚀的主要原因,又可分为吸氧腐蚀和析氢腐蚀,发生吸氧腐蚀的电极反应式:负极 正极
(3)下图是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计
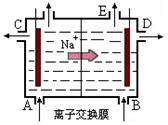
此装置中进行的反应是可逆反应,其反应方程式式为:AsO 4 3 - +2I - +H + AsO 3 3- +I 2 +H 2 O,向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是 D电极上的电极反应式为
AsO 3 3- +I 2 +H 2 O,向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是 D电极上的电极反应式为  悟真1年前1
悟真1年前1 -
 375545550 共回答了17个问题
375545550 共回答了17个问题 |采纳率94.1%1年前查看全部
- (2014•威海一模)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯.电解槽内装有阳离子交换膜(只
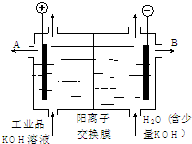 (2014•威海一模)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯.电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.下列说法中正确的是( )
(2014•威海一模)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯.电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.下列说法中正确的是( )
A.该电解槽的阳极反应式是4OH--2e-→2H2O+O2↑
B.通电开始后,阴极附近溶液pH会减小
C.除去杂质后氢氧化钾溶液从液体出口A导出
D.用氯化钾制备氢氧化钾也可采用这种离子交换膜电解法 防弹玻璃221年前1
防弹玻璃221年前1 -
 duida 共回答了17个问题
duida 共回答了17个问题 |采纳率100%解题思路:用阳离子交换膜电解法除去工业品氢氧化钾溶液中的杂质含氧酸根,相当于电解水,故电解时,阳极:4OH--4e-=2H2O+O2↑,阴极:4H++4e-=2H2↑,其中阴极区H+放电,H+浓度减小,使水的电离平衡向右移动促进水的电离,OH-浓度增大.在阴极和阳极之间有阳离子交换膜,只允许阳离子K+和H+通过,这样就在阴极区聚集大量的K+和OH-,从而产生纯的氢氧化钾溶液.A.电解除杂过程相当于电解水,阳极反应式为:4OH--4e-=2H2O+O2↑,故A错误;
B.电解时,阴极电极反应式为:4H++4e-=2H2↑,氢离子浓度减小,溶液的pH增大,故B错误;
C.在B电极附近产生氢氧根离子,钾离子向B电极移动,所以除去杂质后氢氧化钾溶液从液体出口B导出,故C错误;
D.用氯化钾制备氢氧化钾时,阴极上氢离子放电,阳极上氯离子放电,阴极附近产生氢氧化钾,所以也可采用这种离子交换膜电解法,故D正确;
故选D.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解原理,明确离子放电顺序是解本题关键,再结合离子移动方向确定产物,题目难度不大.1年前查看全部
- 下图是目前世界上比较先进的电解法制烧碱技术-阳离子交换膜法的示意图。 (1)精制饱和食盐水从 __________口加入
下图是目前世界上比较先进的电解法制烧碱技术-阳离子交换膜法的示意图。 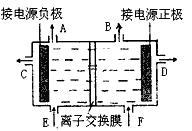
(1)精制饱和食盐水从 __________口加入,从另一口加入水(含少量NaOH)。水中加入NaOH的作用是___________ ;制得的烧碱溶液从______________ 口导出。
(2)为有效除去粗盐中的Ca 2+ 、Mg 2+ 、SO 4 2- ,加入试剂的合理顺序为___________ (填字母)。
a.先加NaOH,再加Na 2 CO 3 ,最后加钡试剂;
b.先加NaOH,再加钡试剂,最后加Na 2 CO 3 ;
c.先加钡试剂,再加Na 2 CO 3 ,最后加NaOH。
(3)现有1000mL食盐水,用石墨电极电解。当阴极产生气体的体积为112mL(标准状况)时停止电解,阳极的电极反应式为_______________,电解后,溶液在常温下的pH约为_____。 applegirlyz1年前1
applegirlyz1年前1 -
 hh通用 共回答了18个问题
hh通用 共回答了18个问题 |采纳率94.4%(1)F; 增强溶液的导电性;C
(2)bc
(3)2Cl - -2e - = Cl 2 ↑; 121年前查看全部
- 阳离子交换膜在饱和食盐水电解中的作用
 十年一觉江南梦1年前2
十年一觉江南梦1年前2 -
 killoper 共回答了10个问题
killoper 共回答了10个问题 |采纳率100%工业中制取氯气常用的方法是电解饱和食盐水,产物是氢氧化钠、氯气和氢气,溶液中的阴阳离子极易发生反应,使用阳离子交换膜可以有效得对阴阳离子进行隔离,因为只有阳离子可以穿过,阴离子不能穿过.1年前查看全部
- 水分子能通过阳离子交换膜吗?(不懂别复制别人的答案)
 134723330321年前1
134723330321年前1 -
 一二三四五六 共回答了15个问题
一二三四五六 共回答了15个问题 |采纳率93.3%交换膜的作用实际上起到一个阴阳离子相对来说隔绝的一个作用,对于交换膜来讲,允许通过的粒子的最大直径不能超过1纳米,对于水分子来讲,其整体分子直径小于1个纳米,所以水分子可以通过交换膜,阳离子交换膜实际上是将某一边的阳离子渗透到另一面内,而阴离子无法通过,所以答案是肯定的,水分子可以通过阳离子交换膜,一般情况下,所有溶液都可以透过交换膜,胶体不行,交换膜性质和你们高中所学的胶体的半透膜差不多,只不过阳离子交换膜提供的是更多的条件,就是允许所有的阳离子和小于1纳米的溶质透过,而阴离子因为在电场的作用下无法通过交换膜1年前查看全部
- 如图为阳离子交换膜法电解饱和食盐水原理示意图.下列说法不正确的是( )
 如图为阳离子交换膜法电解饱和食盐水原理示意图.下列说法不正确的是( )
如图为阳离子交换膜法电解饱和食盐水原理示意图.下列说法不正确的是( )
A.从D口逸出的气体是H2
B.从B口加入稀NaOH(增强导电性)的水溶液
C.每生成22.4L Cl2,同时产生2mol NaOH
D.从A口加入精制的浓食盐水 owenery1年前1
owenery1年前1 -
 无名5351893 共回答了14个问题
无名5351893 共回答了14个问题 |采纳率92.9%解题思路:根据钠离子移动方向知,右边是阴极时,左边是阳极时,阴极上氢离子放电生成氢气,发生2H++2e-=H2↑,阳极上氯离子放电生成氯气,电极反应式为2Cl─-2e-=Cl2↑,电解时,阳极生成氯气,消耗NaCl,则应在阳极补充NaCl,阴极生成OH-,且Na+向阴极移动,则产品烧碱溶液从阴极区导出.A.右边是阴极区,发生2H++2e-=H2↑,所以从D口逸出的气体是H2,故A正确;
B.阴极生成OH-,且Na+向阴极移动,阴极区生成NaOH,为增强导电性,则从B口加入稀NaOH(增强导电性)的水溶液,故B正确;
C.电池反应式为2NaCl+2H2O
电解
.
Cl2↑+H2↑+2NaOH,标准状况下每生成22.4L Cl2,生成1mol氯气时,同时产生2molNaOH,因为温度和压强未知,无法计算氯气的物质的量,故C错误;
D.电解时,阳极生成氯气,消耗NaCl,则应在阳极补充NaCl,即浓盐水从A口注入,故D正确;
故选C.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解原理,根据钠离子移动方向确定阴阳极,再结合电极上发生的反应来分析解答即可,注意阳离子交换膜只有阳离子才能通过,题目难度不大.1年前查看全部
- (18分)如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
(18分)如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

根据要求回答相关问题:
(1)通入氧气的电极为________(填“正极”或“负极”),写出负极的电极反应式___________________
 _____________________________________。
_____________________________________。
(2)铁电极为________(填“阳极”或“阴极”),石墨电极(C)的电极反应式为________________________________________________________________________。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在________(填“铁极”或 “石墨极”)区
“石墨极”)区
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成 的气体的分子数为________;丙装置中阴极析出铜的质量为_______
的气体的分子数为________;丙装置中阴极析出铜的质量为_______ _。
_。 guwen12231年前1
guwen12231年前1 -
 nishialibaba 共回答了21个问题
nishialibaba 共回答了21个问题 |采纳率76.2%1年前查看全部
- 右图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是( )
右图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是()

A.从E口逸出的气体是H 2 B.从B口加入含少量NaOH的水溶液以增强导电性 C.标准状况下每生成22.4 LCl 2 ,便产生2 mol NaOH D.粗盐水中含Ca 2+ 、Mg 2+ 、Fe 3+ 、SO 4 2 - 等离子,精制时先加Na 2 CO 3 溶液  大红肚兜1年前1
大红肚兜1年前1 -
 任良天 共回答了14个问题
任良天 共回答了14个问题 |采纳率78.6%D
1年前查看全部
- 如图为阳离子交换膜法电解饱和食盐水原理示意图,其中的阳离子交换膜仅允许Na + 通过。下列说法错误的是
如图为阳离子交换膜法电解饱和食盐水原理示意图,其中的阳离子交换膜仅允许Na + 通过。下列说法错误的是

A.a极的电极反应式为:2 H + + 2 e  H 2 ↑
H 2 ↑B.D口导出的是NaOH溶液 C.浓盐水从A口注入 D.C口导出的是NaOH和NaCl的混合溶液  walyun1年前1
walyun1年前1 -
 allenssl 共回答了16个问题
allenssl 共回答了16个问题 |采纳率100%D
1年前查看全部
- (2012•烟台一模)氯碱工业常利用阳离子交换膜电解食盐水,下列说法不正确的是( )
(2012•烟台一模)氯碱工业常利用阳离子交换膜电解食盐水,下列说法不正确的是( )
A.随着电解的进行,c(NaCl)降低,需不断补充饱和食盐水
B.电解过程中采用增大阳极区溶液pH的方法,可以减少Cl2在水中的溶解量
C.阳离子交换膜的作用是阻止OH-移向阳极,以使氢氧化钠在阴极区富集
D.阳极表面用钛氧化物涂层处理,目的是降低电解产物Cl2对电极的腐蚀 xatvgy1年前1
xatvgy1年前1 -
 孔雀之家 共回答了17个问题
孔雀之家 共回答了17个问题 |采纳率94.1%解题思路:A.电解食盐水时,阳极发生氧化反应,消耗NaCl,则应在阳极补充NaCl;
B.增大阳极区溶液pH,会增大Cl2在水中的溶解量;
C.电解时,阳离子经过离子交换膜向阴极区移动;
D.Cl2具有强氧化性,能氧化电极材料.A.电解食盐水时,阳极发生氧化反应,消耗NaCl,则应在阳极补充NaCl,故A正确;
B.增大阳极区溶液pH,会增大Cl2在水中的溶解量,故B错误;
C.电解时,阳离子经过离子交换膜向阴极区移动,所以阳离子交换膜的作用是阻止OH-移向阳极,以使氢氧化钠在阴极区富集,故C正确;
D.Cl2具有强氧化性,能氧化电极材料,则阳极表面用钛氧化物涂层处理来保护电极材料,故D正确;
故选B.点评:
本题考点: 电解原理.
考点点评: 本题考查电解原理,侧重于氯碱工业的考查,注意把握题给信息,阳离子交换膜为解答该题的关键,注意审题,题目难度不大.1年前查看全部
- 右图为阳离子交换膜法电解饱和食盐水原理示意图.完成下列问题:
 右图为阳离子交换膜法电解饱和食盐水原理示意图.完成下列问题:
右图为阳离子交换膜法电解饱和食盐水原理示意图.完成下列问题:
(1)从E口逸出的气体是______,从F口逸出的气体是______.
(2)写出电解时两极的电极反应式:
阳极:______;
阴极:______.
(3)若用阳离子交换膜法电解K2SO4溶液,则可以同时生成两种重要的化合物,它们是______.
(4)以下关于阳离子交换膜法电解饱和食盐水的叙述中,正确的是______.
A、使用阳离子交换膜可避免Cl2和NaOH溶液作用生成NaClO而影响烧碱的质量
B、电解时,常常从B口加入含少量NaOH的水溶液以增强导电性
C、常温常压下,每生成22.4LCl2,便产生2molNaOH
D、粗盐水中含有Ca2+、Mg2+、Fe3+、SO42-等离子,用Na2CO3、BaCl2、NaOH精制时应最后加入BaCl2溶液. gaogao9061年前1
gaogao9061年前1 -
 肉肉de 共回答了27个问题
肉肉de 共回答了27个问题 |采纳率92.6%解题思路:(1)图为阳离子交换膜法电极饱和食盐水,依据钠离子移动方向可知E为阳极,F为阴极,结合电解原理判断两极的产物;
(2)分析可知E为阳极,溶液中的阴离子氯离子失电子生成氯气,F为阴极,溶液中阳离子得到电子发生还原反应生成氢气;
(3)若用阳离子交换膜法电解K2SO4溶液,阳极附近生成硫酸,阴极附近氢离子放电生成氢气,得到氢氧化钾;
(4)A、使用阳离子交换膜,生成的氯气在阳极,生产的氢氧化钠在阴极,可避免Cl2和NaOH溶液作用生成NaClO而影响烧碱的质量;
B、电解时,氢氧化钠在阴极析出,常常从B口加入含少量NaOH的水溶液以增强导电性
C、常温常压下,每生成22.4LCl2,物质的量不是1mol,不能产生2molNaOH;
D、粗盐水中含有Ca2+、Mg2+、Fe3+、SO42-等离子,用Na2CO3、BaCl2、NaOH精制时应最后加入碳酸钠溶液;(1)图为阳离子交换膜法电极饱和食盐水,依据钠离子移动方向可知E为阳极,F为阴极,饱和氯化钠溶液中氯离子移向阳极E失电子生成氯气,氢离子移向阴极得到电子发生还原反应生成氢气;故答案为:Cl2;H2;(2)E为阳...
点评:
本题考点: 电解原理.
考点点评: 本题考查了电解原理的应用,电极判断和电极反应产物判断是解题关键,题目难度中等.1年前查看全部
- 化学阳离子交换膜类比制烧碱 这个图没有告诉我们电源怎么判断正负极?为什么B
化学阳离子交换膜类比制烧碱 这个图没有告诉我们电源怎么判断正负极?为什么B
化学阳离子交换膜类比制烧碱 这个图没有告诉我们电源怎么判断正负极?为什么B出来的是氧气C出来的是氢气?

 倦飞之鸟1年前1
倦飞之鸟1年前1 -
 xinyicn 共回答了22个问题
xinyicn 共回答了22个问题 |采纳率90.9%看电极补充液.
补充液的成分和那个电极上生成的溶液成分是一样的
X电极补充的是H2SO4,X电极上反应生成H+,那么生成的气体就是O2
Y电极同理1年前查看全部
- 如何判断阳离子交换膜和阴离子交换膜的位置?
如何判断阳离子交换膜和阴离子交换膜的位置?

如图为海水淡化过程,如何判断离子交换膜位置? ywfw88881年前1
ywfw88881年前1 -
 左手起家 共回答了16个问题
左手起家 共回答了16个问题 |采纳率87.5%膜的作用是通过离子,通电时,正极吸引负点离子,需要负离子通过,是负离子交换膜,相反负极吸引的是正离子,需要正离子通过,是正离子交换膜.1年前查看全部
- 电渗析法为什么要用离子交换膜就算阴极区不用阳离子交换膜,阴离子也不会跑到阴极区啊,不是多此一举吗?
 lsj05131年前1
lsj05131年前1 -
 feixingyuan1 共回答了20个问题
feixingyuan1 共回答了20个问题 |采纳率85%因为溶液中阴阳离子同时存在,阴阳膜同时使用提高了除盐效率;另外,也分出浓水、淡水室,将不同离子浓度的溶液分隔开1年前查看全部
- (2012•厦门二模)用Na2SO3溶液吸收硫酸工业尾气中的SO2,所得混合液可电解循环再生(A为阳离子交换膜;B为阴离
 (2012•厦门二模)用Na2SO3溶液吸收硫酸工业尾气中的SO2,所得混合液可电解循环再生(A为阳离子交换膜;B为阴离子交换膜).相关物料的传输与转化关系如右图.下列说法不正确的是( )
(2012•厦门二模)用Na2SO3溶液吸收硫酸工业尾气中的SO2,所得混合液可电解循环再生(A为阳离子交换膜;B为阴离子交换膜).相关物料的传输与转化关系如右图.下列说法不正确的是( )
A.X为直流电源的负极,Pt(Ⅱ)为阳极
B.阳极区pH减小
C.图中的n<m
D.阴极电极反应式为2H++2e-=H2↑ tycoms1年前1
tycoms1年前1 -
 学山来客 共回答了13个问题
学山来客 共回答了13个问题 |采纳率92.3%解题思路:A.根据电解质溶液中阴阳离子的移动方向确定电源的正负极;
B.阳极上亚硫酸根离子被氧化生成硫酸根离子,溶液酸性增强;
C.根据S原子守恒判断m、n大小;
D.电解池阴极上氢离子得电子,阳极上亚硫酸根离子失电子.A.根据阴阳离子的移动方向知,Pt(I)为阴极,Pt(II)为阳极,所以X为直流电源的负极,Y为直流电源的正极,故A正确;
B.阳极上,亚硫酸根离子被氧化生成硫酸根离子,亚硫酸是弱电解质,硫酸是强电解质,所以阳极附近氢离子浓度增大,溶液的pH减小,故B正确;
C.阳极室中,出来的硫酸中不仅有加入的稀硫酸还有亚硫酸根离子被氧化生成的硫酸,所以n>m,故C错误;
D.该电解池中阳极上生成硫酸,阴极上生成氢气,阴极电极反应式为2H++2e-=H2↑,所以该过程中的产品主要为H2SO4和H2,故D正确;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查学生电解池的工作原理,能正确分析图片是解本题的关键,注意图片中加入物质和析出物质的变化,题目难度较大.1年前查看全部
- (1)100mL含0.001molCa2+的中性溶液让其通过强酸型阳离子交换膜HR,使Ca2+完全被树脂所交换,再用10
(1)100mL含0.001molCa2+的中性溶液让其通过强酸型阳离子交换膜HR,使Ca2+完全被树脂所交换,再用100mL蒸馏水洗涤树脂到中性,将交换液和洗涤液收集在一起,所得混合液(体积为两者之和)的PH为______
(2)取10.00g纯碱样品,配成1000mL溶液,取25.00mL放入锥形瓶中,加入某种指示剂,用0.15mol/L的标准盐酸溶液滴定至终点(反应为Na2CO3+2HCl═2NaCl+H2O+CO2↑,杂质不与盐酸反应).消耗盐酸体积为30.00mL.试回答下列问题:
取25.00mL溶液所用的仪器是______
纯碱样品中碳酸钠的质量分数为______. 不要盗我号1年前0
不要盗我号1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜,丙中滴有少量的酚酞试液.请
 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜,丙中滴有少量的酚酞试液.请按要求回答相关问题:
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜,丙中滴有少量的酚酞试液.请按要求回答相关问题:
(1)甲烷燃料电池负极电极反应式是:______.
(2)石墨电极(C)的电极反应式为______.
(3)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体体积为______ L.
(4)铜丝a处在开始一段时间的现象为______;原因是______.
(5)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是______.
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(6)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应为______. blueboy_xp1年前1
blueboy_xp1年前1 -
 xxhlzx 共回答了20个问题
xxhlzx 共回答了20个问题 |采纳率95%解题思路:燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极.
(1)燃料电池中,负极上投放燃料,负极上失电子发生氧化反应.
(2)甲中投放氧化剂的电极是正极,所以乙装置中石墨是阳极,阳极上氯离子失电子发生氧化反应;
(3)根据串联电池中转移电子数相等计算铁电极上生成氢气的体积;
(4)a为阴极,阴极发生还原反应生成氢气,促进水的电离;
(5)铜的精炼时,粗铜为阳极,纯铜为阴极;
(6)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,铜被氧化,应为负极,正极上氧气被还原.(1)燃料电池中,负极上投放燃料所以投放甲烷的电极是负极,负极上失电子发生氧化反应,电极反应式为:CH4+10OH--8e-=CO32-+7H2O.
故答案为:CH4-8e-+10OH-═CO23-+7H2O;
(2)甲中投放氧化剂的电极是正极,所以乙装置中石墨电极是阳极,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,
故答案为:2Cl--2e-═Cl2↑;
(3)串联电池中转移电子数相等,若在标准状况下,有2.24L氧气参加反应,则转移电子的物质的量=[2.24L/22.4L/mol]×4=0.4mol,乙装置中铁电极上氢离子放电生成氢气,设生成氢气的体积为xL;
2H++2e-=H2↑
2mol 22.4L
0.4mol xL
x=4.48,
故答案为:4.48;
(4)a为阴极,发生2H++2e-=H2↑,水的电离平衡正向移动,使溶液显碱性,酚酞遇碱变红,
故答案为:溶液变红;由于2H++2e-=H2↑,水的电离平衡正向移动,使溶液显碱性,酚酞遇碱变红;
(5)电解精炼铜时利用了电解原理,电能转化为化学能,也有少量转化为热能.电解精炼时粗铜做阳极,发生氧化反应,精铜做阴极,阴极上发生还原反应.电解时,溶液中的阳离子向阴极移动,在阴极上得电子.粗铜中的不活泼金属不能失电子,以阳极泥的形式沉积在阳极附近.此题应选b、d;
故答案为:bd;
(6)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,铜被氧化,应为负极,正极上氧气被还原,电极方程式为4H++O2+4e-═2H2O,
故答案为:4H++O2+4e-═2H2O.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题综合考查电解池和原电池知识,注意把握电化学工作原理,为高考常见题型,侧重于学生的分析能力的考查,有利于培养学生的良好的科学素养,难度中等.1年前查看全部
- 2010年重庆卷化学阳离子交换膜的题为什么左边生成的氢离子要到右边
 流云人1年前2
流云人1年前2 -
 jiaowaimai 共回答了18个问题
jiaowaimai 共回答了18个问题 |采纳率88.9%电化学的吧,氢离子带正电,如果右边得电子,氢离子就会过去中和.1年前查看全部
- 电解KI制备KIO3如果把阴离子交换膜换成阳离子交换膜反应总方程式会变吗
 edu051年前1
edu051年前1 -
 0sophia0 共回答了19个问题
0sophia0 共回答了19个问题 |采纳率94.7%个人觉得会变.因为如果是阳离子交换膜的话 ,氢氧根无法到阳极为碘离子提供氧 ,只有氢离子可以自由通过阳离子膜.1年前查看全部
- 阳离子交换膜电解槽中交换膜的作用
阳离子交换膜电解槽中交换膜的作用
给你积分! eaglelcy1年前1
eaglelcy1年前1 -
 挖煤的好人 共回答了23个问题
挖煤的好人 共回答了23个问题 |采纳率87%工业中制取氯气常用的方法是电解饱和食盐水,产物是氢氧化钠、氯气和氢气,溶液中的阴阳离子极易发生反应,使用阳离子交换膜可以有效得对阴阳离子进行隔离,因为只有阳离子可以穿过,阴离子不能穿过.1年前查看全部
- 工业上生产氯气,常用电解槽电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分.如图1为电解
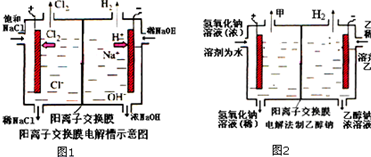 工业上生产氯气,常用电解槽电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分.如图1为电解槽的示意图.
工业上生产氯气,常用电解槽电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分.如图1为电解槽的示意图.
(1)这种阳离子交换膜,只允许溶液中的______通过.(填下列微粒的编号)
①H2 ②Cl2 ③H+ ④Cl- ⑤Na+ ⑥OH-
(2)某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如图2所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇.回答下列问题:
①写出在电解过程中发生的电极方程式阴极:______.
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是:______. 猪太善1年前1
猪太善1年前1 -
 圆点花边 共回答了20个问题
圆点花边 共回答了20个问题 |采纳率90%解题思路:(1)阳离子交换膜只允许阳离子通过,而阴离子、分子不能通过;
(2)①电解池中和电源的负极相连的是电解池的阴极,发生得电子的还原反应;
②从溶液中析出溶质的方法是蒸发结晶,可类比食盐的蒸发结晶.(1)阳离子交换膜只允许阳离子钠离子、氢离子通过,而阴离子和分子均不能通过,故答案为:③⑤;
(2)①电解池中和电源的负极相连的是电解池的阴极,阴极上乙醇得电子发生还原反应,即2CH3CH2OH+2e-=2CH3CH2O-+H2↑.
故答案为:2CH3H2OH+2e-=2CH3CH2O-+H2↑;
②从溶液中析出溶质的方法是蒸发结晶,故答案为:蒸发结晶.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了电解原理、电极反应式书写、混合物分离等知识点,难度不大.1年前查看全部
- 如图为阳离子交换膜法以石墨为电极电解饱和食盐水原理示意图.据图判断下列说法不正确的是( )
 如图为阳离子交换膜法以石墨为电极电解饱和食盐水原理示意图.据图判断下列说法不正确的是( )
如图为阳离子交换膜法以石墨为电极电解饱和食盐水原理示意图.据图判断下列说法不正确的是( )
A.从E口逸出的气体是H2
B.从F口逸出的气体是Cl2
C.标准状况下,生成22.4LCl2的同时有2molNaOH生成
D.从C口流出的是NaOH溶液 小小的房奴1年前1
小小的房奴1年前1 -
 xiaohuigj 共回答了22个问题
xiaohuigj 共回答了22个问题 |采纳率95.5%解题思路:由电源正负极可知左侧电极为阳极,发生:2Cl--2e-=Cl2↑,则右侧电极为阴极,发生2H++2e-=H2↑,电解时,阳极生成氯气,消耗NaCl,则应在阳极补充NaCl,阴极生成OH-,且Na+向阴极移动,则产品烧碱溶液从阴极区导出,注意题中阳离子交换膜仅允许Na+通过的特点.A.在电解池中,钠离子移向阴极,所以D极是阴极,发生2H++2e-=H2↑,故从E口逸出的气体是H2,故A正确;
B.左侧电极阳极,溶液中的阴离子氯离子失电子生成氯气,电极反应为:2Cl--2e-=Cl2↑,故B正确;
C.电解原理方程式2NaCl+2H2O
通电
.
2NaOH+Cl2↑+H2↑,标准状况下每生成22.4L即1molC12,便产生2molNaOH,故C正确;
D.阳离子交换膜仅允许Na+通过,则在C口不可能有NaOH导出,故D错误.
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查电解原理,侧重于氯碱工业的考查,注意把握题给信息,阳离子交换膜为解答该题的关键,注意审题,题目难度不大.1年前查看全部
- 目前世界上比较先进的电解法制烧碱技术-阳离子交换膜法.
目前世界上比较先进的电解法制烧碱技术-阳离子交换膜法.
(1)电解精制饱和食盐水时,产生的氯气比理论值少的原因是______;电解总反应方程式为2NaCl+2H2O
Cl2↑+H2↑+2NaOH电解 .2NaCl+2H2O
Cl2↑+H2↑+2NaOH电解 .
(2)为有效除去粗盐中的Ca2+、Mg2+、SO42-,加入试剂的合理顺序为______(填字母).
a.先加NaOH,再加Na2CO3,最后加钡试剂;
b.先加NaOH,再加钡试剂,最后加Na2CO3;
c.先加钡试剂,再加Na2CO3,最后加NaOH.
(3)现有1000ml食盐水,用石墨电极电解.当阴极产生气体的体积为112mL(标准状态)时停止电解,阳极的电极反应式为______,电解后,溶液在常温下的pH约为______.(溶液体积变化忽略不计) ifiona21年前1
ifiona21年前1 -
 往高处流的水 共回答了20个问题
往高处流的水 共回答了20个问题 |采纳率95%解题思路:(1)电解食盐水生成NaOH、氢气、氯气,且氯气与NaOH溶液能发生反应;
(2)除去粗盐中的Ca2+、Mg2+、SO42-,为除去杂质又不引入新的杂质,先除去Mg2+,再除去SO42-,最后除Ca2+,或先除去SO42-也可;
(3)根据电解时阳极氯离子放电及电解反应来计算.(1)电解氯化钠溶液的生成物是氢氧化钠、氯气和氢气,即:2NaCl+2H2O
电解
.
Cl2↑+H2↑+2NaOH,因氯气与NaOH溶液能发生反应,则产生的氯气比理论值少,
故答案为:氯气与NaOH溶液能发生反应;2NaCl+2H2O
电解
.
Cl2↑+H2↑+2NaOH;
(2)根据除去钙离子用碳酸根离子进行沉淀,除去镁离子用氢氧根离子进行沉淀,除去硫酸根离子用钡离子沉淀,过量的钡离子需要用碳酸根离子除去,加入Na2CO3的顺序必须在加入钡离子的后面即可,显然只有a不符合,故答案为:bc;
(3)阴极生成氢气,阳极上生成氯气,阳极电极反应式为2Cl--2e-═Cl2↑,由2NaCl+2H2O
电解
.
Cl2↑+H2↑+2NaOH可知,Cl2↑~H2↑~2NaOH,则n(NaOH)=[0.112L/22.4L/mol]=0.01mol,所以c(NaOH)=[0.01mol/1L]=0.01mol/L,所以pH=12,故答案为:2Cl--2e-═Cl2↑;12.点评:
本题考点: 电解原理;物质的分离、提纯和除杂.
考点点评: 本题考查电解原理,明确电解食盐水发生的电极反应及除杂时试剂的先后顺序是解答本题的关键,题目难度中等.1年前查看全部
- 如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问
如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:

(1)甲烷燃料电池负极电极反应式是:
(2)石墨电极(C)的电极反应式为
(3)若在标准状况下,有2. 24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为_ L;丙装置中阴极析出铜的质量为 g
(4)某同学利甲烷燃料电池设计电解法制取漂白液或Fe(OH) 2 的实验装置(如图所示)。若用于制漂白液时a为电池_ 极,电解质溶液最好用_ 。若用于制 Fe(OH) 2 ,使用硫酸钠做电解质溶液,阳极选用 作电极。
 过眼vs云烟1年前1
过眼vs云烟1年前1 -
 ttqqTT 共回答了16个问题
ttqqTT 共回答了16个问题 |采纳率93.8%(1)CH 4 -8e - +10OH - =CO 3 2 - +7H 2 O
(2)2Cl - -2e - =Cl 2 ↑
(3)4.48 12.8
(4)负 饱和氯化钠溶液或食盐水 铁
1年前查看全部
大家在问
- 1初一英语导学案用一般现在时完成下列句子1.Bill-----(work)on the farm.2.Candy ofte
- 2“You name the time”的英语翻译
- 3She's( )at the moment.
- 4问一道初二数学题 请高手们帮帮忙,谢谢啦! y=丨x丨是y关于x的函数吗? 3x-2y是y关于x的函数吗?
- 5第四题sit.please.down. 连词成句 求高人帮个忙内.
- 6解方程:||x-2|-1|=1/2
- 7VL Fe2(so4)3溶液中有Fe+3离子 mg .求硫酸根的物质量的浓度?
- 8计算(-2)*(-2)^2*(-2)^3*……*(-2)^100的值
- 9“那时我很快乐”这篇作文怎么写啊?????
- 10火山是()运动的表现形式之一.火山由().().()三部分组成,火山喷发物有().().()等喷发物.岩浆来自地壳中的(
- 11孙叔敖正衣冠而见之是什么意思?
- 12英语翻译Without facts,we can not form a worth while opinion for
- 13一个长2米的圆木,切成2段,表面积增加50平方米,这个圆木的体积是什么
- 14(英语)否定疑问句的回答是肯定的还是否定的?(yes or no)
- 15一次函数y=x的平方减9分之2x的取值范围?




