硝酸 硫酸钡 硫酸镁 硫酸铜 硫酸亚铁 硫酸铁 硫酸铵
 tgren2022-10-04 11:39:545条回答
tgren2022-10-04 11:39:545条回答还有碳酸钠 碳酸钾 碳酸钡 碳酸钙 碳酸铵 氢氧化钠 氢氧化钙 氢氧化铁 氢氧化铜 氢氧化铝 氢氧化铵 硝酸钾 硝酸钠 硝酸银 硝酸铜 硝酸铵
有点多啊,我给多点分啊

已提交,审核后显示!提交回复
共5条回复
 小雪是星星 共回答了19个问题
小雪是星星 共回答了19个问题 |采纳率94.7%- 硝酸 HNO3
硫酸钡 BaSO4
硫酸镁 MgSO4
硫酸铜 CuSO4
硫酸亚铁 FeSO4
硫酸铁 Fe2(SO4)3
硫酸铵 (NH4)2SO4
碳酸钠 Na2CO3
碳酸钾 K2CO3
碳酸钡 BaCO3
碳酸钙 CaCO3
碳酸铵 (NH4)2CO3
氢氧化钠 NaOH
氢氧化钙 Ca(OH)2
氢氧化铁 Fe(OH)3
氢氧化铜 CU(OH)2
氢氧化铝 Al(OH)3
氢氧化铵 NH3.H2O
硝酸钾 KNO3
硝酸钠 NaNO3
硝酸银 AgNO3
硝酸铜 Cu(NO3)2
硝酸铵NH4NO3 - 1年前
 迷雾之城 共回答了12个问题
迷雾之城 共回答了12个问题 |采纳率- HNO3,BaSO4,MgSO4,CuSO4,FeSO4,Fe2(SO4)3,(NH4)2SO4,
Na2CO3,K2CO3,BaCO3,CaCO3,(NH4)2CO3,NaOH,Ca(OH)2,Fe(OH)3,Cu(OH)2,
Al(OH)3,NH4OH,KNO3,AgNO3,Cu(NO3)2,NH4NO3, - 1年前
 qu_ao_ti_ba 共回答了39个问题
qu_ao_ti_ba 共回答了39个问题 |采纳率- Na2CO3
K2CO3
BaCO3
CaCO3
NaOH
Ca(OH)2
Fe(OH)3
Cu(OH)2
Al(OH)3
NH4OH
KNO3
NaNO3
AgNO3
Cu(NO3)2
NH4NO3
其实并不多,掌握方法就行了 - 1年前
 三十分钟阳光 共回答了5个问题
三十分钟阳光 共回答了5个问题 |采纳率- 碳酸钠 Na2CO3 碳酸钾 K2CO3 碳酸钡 BaCO3 碳酸钙 CaCO3
碳酸铵 (NH4)2CO3 氢氧化钠 NAOH 氢氧化钙 Ca(OH)2 氢氧化铁 Fe(OH)3
氢氧化铜 Cu(OH)2 氢氧化铝 Al(OH)3 氢氧化铵 NH4OH 硝酸钾 KNO3
硝酸钠 NaNO3 硝酸银 AgNO3 硝酸铜 Cu(NO3)2 硝酸铵 NH4NO3
给分吧 - 1年前
 qwe298wt 共回答了2个问题
qwe298wt 共回答了2个问题 |采纳率- 硝酸 HNO₃
硫酸钡 BaSO4
硫酸镁 MgSO4
硫酸铜 CuSO4
硫酸亚铁 FeSO4
硫酸亚铁 Fe2(SO4)3
硫酸铵 (NH4)2SO4
碳酸钠 Na2CO3
碳酸钾 Ka2CO3
碳酸钡 BaCO3
碳酸钙 CaCO3 - 1年前
相关推荐
- 高一化学中学的酸都有哪些?如题,除了盐酸 硫酸 硝酸 碳酸 硅酸 醋酸 还有哪些能把化学式写出来吗?形如H3XO4和HX
高一化学中学的酸都有哪些?
如题,除了盐酸 硫酸 硝酸 碳酸 硅酸 醋酸 还有哪些能把化学式写出来吗?形如H3XO4和HXO4的什么酸啊. d1503721年前3
d1503721年前3 -
 虫子521 共回答了25个问题
虫子521 共回答了25个问题 |采纳率100%卤族元素加H都是算
HF氢氟酸
HBr氢溴酸
HI氢碘酸
HClO4高氯酸(最强的酸)
H3PO4磷酸
HClO次氯酸
H2SO3亚硫酸
HNO2亚硝酸
还有有机的酸
草酸 苯酚1年前查看全部
- 将1.28g 铜粉全部溶解在硝酸中.假设产生气体不含N2O4,则参加反应的硝酸物质的量可能为?
将1.28g 铜粉全部溶解在硝酸中.假设产生气体不含N2O4,则参加反应的硝酸物质的量可能为?
05 老娘就是看不惯1年前4
老娘就是看不惯1年前4 -
 云风飘流 共回答了23个问题
云风飘流 共回答了23个问题 |采纳率87%首先n(cu)=0.02mol,反应生成cu(no3)2所需hno3为0.04mol
假设产生气体是no,由转移电子数守恒得n(no)*3=0.02*2 得n(no)=0.013mol,所需hno3为0.04+0.013=0.053mol
假设是no2,同理所需hno3是0.04+0.04(no2的物质的量)=0.08mol
所以介于0.053mol与0.08mol之间1年前查看全部
- 知道氮氧化物的量如何求算硝酸的量
 willing心愿1年前1
willing心愿1年前1 -
 fbywhy 共回答了17个问题
fbywhy 共回答了17个问题 |采纳率88.2%基本上就是根据氮原子守恒,分析氮原子的去向,或者是用化合价的升价相同来解决,具体问题具体分析.1年前查看全部
- 检验氯离子时为什么要加硝酸酸化的硝酸银?
 ansun3201年前5
ansun3201年前5 -
 wxiaozhi 共回答了16个问题
wxiaozhi 共回答了16个问题 |采纳率93.8%如果溶液中存在SO42-、CO32- 等离子时,它们也会与Ag+生成白色的沉淀,这将干扰AgCl沉淀的判断,但Ag2SO4、Ag2CO3等在硝酸中是可溶的,故加用硝酸酸化的硝酸银,可以排除其它离子的干扰.1年前查看全部
- 什么叫硝酸酸化RT.
 zuoxun1年前1
zuoxun1年前1 -
 lotus2003 共回答了22个问题
lotus2003 共回答了22个问题 |采纳率95.5%就是用硝酸来降低溶液的ph值.1年前查看全部
- 3.84克铜投入盛定量浓度HNO3中标准状况下收集到1.68L气体时铜恰全消耗写化学方程式求反应中耗硝酸物质量
3.84克铜投入盛定量浓度HNO3中标准状况下收集到1.68L气体时铜恰全消耗写化学方程式求反应中耗硝酸物质量
能具体点吗
方程式帮我写清楚点好吗
我会非常感谢 moonfetch1年前1
moonfetch1年前1 -
 hst168 共回答了19个问题
hst168 共回答了19个问题 |采纳率89.5%n(Cu)=0.06mol
n气体=0.075mol
所以反应就是8Cu+24HNO3=8Cu(NO3)2+3NO(气体)+5NO2(气体)+12H2O
消耗硝酸物质的量为0.18mol1年前查看全部
- 甲醇 乙醇 硝酸 硫酸 双氧水可以用来清洁什么
甲醇 乙醇 硝酸 硫酸 双氧水可以用来清洁什么
清洗什么物品 不把斋的和尚被封1年前2
不把斋的和尚被封1年前2 -
 vampire32167 共回答了17个问题
vampire32167 共回答了17个问题 |采纳率70.6%甲醇 乙醇清洗油污及其他有机物
硝酸洗可除去银镜、铜镜等物质
硫酸洗可除去金属、金属氧化物
双氧水可以除去带有还原性的物质,1年前查看全部
- S和N;O和CL非金属性哪个大就已S,N为例,如果N大的化,那么最高价水化物硝酸的酸性将比硫酸的大,但事实是这样吗?
 嗔恋1年前3
嗔恋1年前3 -
 djgh 共回答了21个问题
djgh 共回答了21个问题 |采纳率95.2%这么说不确切 而且实际酸性硝酸确实大于硫酸的一级电离(二级电离只有10%)
这个不准确说法的来源应该是
首先 最高价态氧化性越高 其最高价含氧酸酸性越强 而 有的时候 价态越高 氧化性越强
这两点被压缩误读成了你的说法
实质原因是 含氧酸也就是最高价水化物提供酸性的H都连氧上
氧化性越强吸引电子的能力越强 连在上面O对连在这个O上的氢原子束缚力就越小 也就是这个H越容易失去电子 也就是H越容易脱离 成为H+
也就是酸性强1年前查看全部
- 溶液的配制 500g/L硝酸溶液的配制方法
 尉迟于菟1年前1
尉迟于菟1年前1 -
 fenni5 共回答了18个问题
fenni5 共回答了18个问题 |采纳率94.4%如果要配制1升这种浓度的硝酸,那么首先要计算出所用浓硝酸的质量,我们常用的浓硝酸的质量分数为65%,那么所需要浓硝酸的质量是
500÷65%=769.23克
将769.23克65%的浓硝酸放入到容量瓶中,在搅拌的情况下,加水至一升即可.1年前查看全部
- (2012•许昌三模)将Fe和Cu的混合物17.6g完全溶解于足量的硝酸溶液中,收集反应产生的X气体.再向所得溶液中加入
(2012•许昌三模)将Fe和Cu的混合物17.6g完全溶解于足量的硝酸溶液中,收集反应产生的X气体.再向所得溶液中加入足量的NaOH溶液,产生31.2g沉淀.根据题意推断气体X的成分可能是( )
A.0.2 mol NO2和0.1mol N2O4
B.0.8molNO
C.0.3 mol NO2和0.3molNO
D.0.1molNO2、0.2mol NO和0.05molN2O4 weiwei515561年前1
weiwei515561年前1 -
 knv123 共回答了31个问题
knv123 共回答了31个问题 |采纳率100%解题思路:向Fe、Cu混合物与足量的硝酸反应所得溶液中加入足量的NaOH溶液,产生31.2g沉淀为氢氧化铜及铁的氢氧化物的质量,沉淀增重为氢氧根的质量,根据电荷守恒可知,金属提供的电子等于氢氧根的物质的量,结合选项根据电子转移守恒验证判断.向Fe、Cu混合物与足量的硝酸反应所得溶液中加入足量的NaOH溶液,产生31.2沉淀为氢氧化铜及铁的氢氧化物质量,沉淀增重为氢氧根的质量,所以沉淀中氢氧根的质量为31.2g-17.6g=13.6g,其物质的量为[13.6g/17g/mol]=0.8mol,根据电荷守恒可知,17.6g的Fe和Cu提供的电子为0.8mol,
A、生成0.2mo1NO2和0.1mo1N2O4,N元素获得电子为0.2mol×(5-4)+0.1mol×2×(5-4)=0.4mol,得失电子不相等,故A错误;
B、生成0.8molNO,N元素获得电子为0.8mol×(5-2)=2.4mol,得失电子不相等,故B错误;
C、生成0.3mo1NO2和0.3mo1NO,N元素获得电子为0.3mol×(5-4)+0.3mol×(5-2)=1.2mol,得失电子不相等,故C错误;
D、生成0.1molNO2、0.2mol NO和0.05molN2O4,N元素获得电子为0.1mol×(5-4)+0.2mol×(5-2)+0.05mol×2×(5-4)=0.8mol,得失电子相等,故D正确.
故选:D.点评:
本题考点: 化学方程式的有关计算;有关混合物反应的计算.
考点点评: 本题考查混合物的计算、氧化还原反应计算等,难度中等,计算金属提供的电子的物质的量是解题的关键,注意守恒思想的运用.1年前查看全部
- 已知常温下,硝酸浓度越稀,其还原产物的价态越低.(本题气体数据均已折算至标准状况)
已知常温下,硝酸浓度越稀,其还原产物的价态越低.(本题气体数据均已折算至标准状况)
(1)实验室欲用70%的浓硝酸(密度1.41g/mL)配制1.0mol/L的稀硝酸(密度1.04g/mL)500mL.求:70%浓硝酸的物质的量浓度______mol/L(保留1位小数,下同),配制时需浓硝酸______mL.
(2)将9.65克某铜锌合金加入到足量的浓硝酸中,得到气体 6.72L(假设不含N2O4),则该合金中铜与锌的物质的量之比为______.
(3)向100mL某浓度的硝酸溶液中加入足量的铁粉,铁粉部分溶解,却无气体产生.向反应后的溶液中加入过量的氢氧化钠溶液,过滤后对滤渣进行洗涤后灼烧得到固体物质4.8g,写出铁与硝酸反应的化学方程式______,该硝酸溶液的物质的量浓度______.
(4)将13克锌加入到200mL 3.6mol/L的硝酸溶液中,锌全部溶解,得到无色气体2.464L(已知常温下N2O3为液体),测得反应后的溶液pH=0(假设反应前后溶液体积无变化).取少量反应后的溶液加入足量的氢氧化钠溶液并加热,无刺激性气味的气体生成.试求该无色气体的组成及其物质的量. 扭曲的小圈儿1年前1
扭曲的小圈儿1年前1 -
 83648364 共回答了19个问题
83648364 共回答了19个问题 |采纳率84.2%解题思路:(1)根据c=[1000ρw/M]计算浓硝酸的浓度,根据稀释定律计算所需浓硝酸的体积;
(2)6.72LNO2的物质的量为0.3mol,设Cu为xmol,Zn为ymol,根据质量9.65g与生成NO2的物质的量0.3mol列式计算;
(3)铁粉部分溶解,说明生成Fe(NO3)2,却无气体产生说明即生成NH4NO3;
(4)由加入NaOH没有刺激性气体产生,得到没有生成NH3,则得到的无色气体为NO、N2,根据原子守恒和得失电子守恒计算物质的量.(1)浓硝酸的物质的量浓度c=[1000ρw/M]=[1000×1.41×70%/63]mol/L=15.7 mol/L,
由稀释定律可得:15.7 mol/L×V浓硝酸 =1.0mol/L×500mL,解得:V浓硝酸 =31.8ml,
故答案为:15.7;31.8;
(2)标准状况下,6.72LNO2的物质的量为[6.72L/22.4L/mol]=0.3mol,设Cu为xmol,Zn为ymol,则
①xmol×64g/mol+ymol×65g/mol=9.65g
②2xmol+2ymol=0.3mol,
①②联立解得:x=0.1,y=0.05,
因此该合金中铜与锌的物质的量之比为0.1mol:0.05mol=2:1,
故答案为:2:1;
(3)铁粉部分溶解,说明生成Fe(NO3)2,却无气体产生说明即生成NH4NO3,所以方程式为10HNO3+4Fe=4Fe(NO3)2+NH4NO3+3H2O,
再加NaOH,Fe(NO3)2都转化成Fe(OH)2,并进一步转化成Fe(OH)3,再灼烧,则生成Fe2O3为4.8g,Fe2O3的物质的量为[4.8g/160g/mol]=.03mol,
所以Fe为0.03mol×2=0.06mol,HNO3为0.06mol×[10/4]=0.15mol,因此该硝酸溶液的物质的量浓度为[0.15mol/0.1L]=1.5mol/L,
故答案为:10HNO3+4Fe=4Fe(NO3)2+NH4NO3+3H2O;1.5mol/L;
(4)13g锌的物质的量为[13g/65g/mol]=0.2mol,2.464L气体共[2.464L/22.4L/mol]=0.11mol,HNO3的物质的量为0.2L×3.6mol/L=0.72mol,测得反应后的溶液pH=0,则剩余H+的物质的量为1mol/L×0.2L=0.2mol,因此有0.72mol-0.2mol=0.52mol硝酸发生了反应,
由加入NaOH没有刺激性气体产生,得到没有生成NH3,NO2为红棕色气体,因此得到的无色气体为NO、N2;
化学方程式为20Zn+52HNO3=20Zn(NO3)2+26H2O+10NO(g)+N2(g),
因此无色气体为NO 0.1mol和N2 0.01mol,
答:无色气体有NO和N2组成,NO 0.1mol,N2 0.01mol.点评:
本题考点: 化学方程式的有关计算;物质的量浓度的相关计算.
考点点评: 本题考查了化学方程式的计算,侧重于化学性质、原子守恒、电荷守恒的应用,题目难度较大,熟悉物质的性质及物质之间的转化是解题的关键.1年前查看全部
- 木炭与浓硝酸反应硝酸的还原产物是NO还是NO2北师大《无机化学》的写法是NO2,但是严宣申老师的《普通无机化学》说是NO
木炭与浓硝酸反应
硝酸的还原产物是NO还是NO2
北师大《无机化学》的写法是NO2,但是严宣申老师的《普通无机化学》说是NO.
我个人认为是NO2.烦请各位高手给我一个明确的说法, 月影酒馆1年前1
月影酒馆1年前1 -
 艾楚风 共回答了14个问题
艾楚风 共回答了14个问题 |采纳率85.7%浓硝酸与木炭,应该是生成NO2,应该不会生成NO,因为当浓硝酸变为稀硝酸反应便停止发生,所以不会生成NO,不行就做个试验1年前查看全部
- 将1.92 g 纯铜片投入足量的某硝酸溶液中,铜片完全溶解.放出气体有导管通过盛有蒸馏水的洗气瓶充分反应,测得洗气瓶中液
将1.92 g 纯铜片投入足量的某硝酸溶液中,铜片完全溶解.放出气体有导管通过盛有蒸馏水的洗气瓶充分反应,测得洗气瓶中液体增重W g.排水后理论上从洗气瓶出气口收集到气体(S.T.P)__________mL.
答案是448,怎么会没有W的=.= 胡aa1年前1
胡aa1年前1 -
 王府井前门 共回答了21个问题
王府井前门 共回答了21个问题 |采纳率90.5%这个题目.有点意思,你看好
铜是在不加热的情况不和稀硝酸反应
所以那个一定是浓硝酸
产生的气体是NO2
依据电子守恒 1.92克铜是0.03摩尔
转移了0.06摩尔电子 即有0.06摩尔NO2产生
0.06摩尔的NO2会与水反应生成NO
3摩尔NO2产生1摩尔NO
所以产生气体体积是0.02摩尔×22.4升每摩尔
就是448ML
那个W是骗人用的.
祝你新年快乐 学习进步!1年前查看全部
- 硝酸工业生产中的尾气可用纯碱溶液吸收.有关的化学反应为:1、2NO2+Na2CO3=NaNO2+NaNO3+CO2 2、
硝酸工业生产中的尾气可用纯碱溶液吸收.有关的化学反应为:1、2NO2+Na2CO3=NaNO2+NaNO3+CO2 2、NO+NO2+Na2CO2=2NaNO+CO2 现有1000g质量分数为21.2%的纯碱吸收液吸收尾气,每产生22.4L(标准状况)CO2时,吸收液质量增加了44g.计算吸收液中NaNO2与NaNO3的物质的量比
 猪头肉炒饭1年前1
猪头肉炒饭1年前1 -
 fly1025228 共回答了26个问题
fly1025228 共回答了26个问题 |采纳率84.6%第二个反应该是:NO + NO2 + Na2CO3 ==== 2NaNO2 + CO2
【解析】
反应①
2NO2 + Na2CO3==== NaNO2 + NaNO3 + CO2 液体增重
质量 2×46 92-44=48
物质的量 2 1
反应②
NO + NO2 + Na2CO3 ==== 2NaNO2 + CO2 液体增重
质量 30 46 138 44 30+46-44=32
物质的量 1 1 2 1
现在假设,由NO2和Na2CO3反应,生成的CO2为 Xmol
而,有NO、NO2和Na2CO3反应,生成的CO2为Y mol
得到俩方程: X + Y = 1 (该等式为CO2的物质的量)
48X + 32Y = 44 (该等式为、溶液增重的质量)
====> X=0.75 Y =0.25
所以,在反应①中,生成NaNO2 0.75mol、NaNO3 0.75mol
在反应②中,生成NaNO2 0.5mol
也就是说,总共生成NaNO2 1.25mol NaNO3 0.75mol
物质的量比为: NaNO2 : NaNO3 = 0.75 : 1.25 = 3:5
就是这样~~~
回答满意请采纳!1年前查看全部
- "硝酸的酸酐不可由单质和氧气直接化合"WHY
 中国青年ww学院1年前1
中国青年ww学院1年前1 -
 coolfzb 共回答了21个问题
coolfzb 共回答了21个问题 |采纳率95.2%N2O5是硝酸酸酣但氮气和氧只能先化合成NO或NO2,必须先由低价再氧化为高价,所以硝酸的酸酣不能直接制取.1年前查看全部
- 硝酸的酸酐是什么?什么叫酸酐?
 华之靖1年前1
华之靖1年前1 -
 1fytry 共回答了20个问题
1fytry 共回答了20个问题 |采纳率95%硝酸的酸酐是N2O5
酸酐就是跟碱,反应能生成相对应盐+水的酸性氧化物!
比如N2O5+2NaOH===2NaNO3+H2O
或者H2SO4的酸酐是SO3,那么其酸酐是SO3
SO3+2NaOH===Na2SO4+H2O
或者你可以这样理解比如HNO3中N的化合价是+5价,那么它的酸酐就是+5的N的氧化物N2O5,这样会比较简单的找出相对应的酸酐!
就是这样的!1年前查看全部
- 初中化学中什么白色沉淀不溶于硝酸
 未激活2171年前4
未激活2171年前4 -
 wsq1214 共回答了15个问题
wsq1214 共回答了15个问题 |采纳率80%AgCl
BaSO41年前查看全部
- 物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原
物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是( )
A. 1:4
B. 1:5
C. 2:3
D. 2:5 jlingka1年前3
jlingka1年前3 -
 Eaglet_01 共回答了15个问题
Eaglet_01 共回答了15个问题 |采纳率86.7%解题思路:锌与稀硝酸反应时硝酸既表现酸性又表现氧化性,根据原子守恒和电子守恒规律来解决.锌与稀硝酸反应时硝酸既表现酸性又表现氧化性,根据原子守恒和电子守恒,2mol锌失去4mol电子,生成2mol锌离子,由于生成硝酸锌,则其结合的硝酸根离子是4mol,则剩余的1mol的硝酸被还原为N2O就得到4mol电子,硝酸也全部反应,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是1:4,即4Zn+10HNO3(一般稀)=4Zn(NO3)2+N2O↑+5H2O.故选A.
点评:
本题考点: 硝酸的化学性质;氧化还原反应的电子转移数目计算.
考点点评: 本题是对硝酸的氧化性知识的考查,注意电子守恒思想在氧化还原反应中的运用.1年前查看全部
- H2SO4(硫酸)和HNO3(硝酸)哪个酸性更强?
 特蕾西麦格雷帝1年前4
特蕾西麦格雷帝1年前4 -
 072570 共回答了19个问题
072570 共回答了19个问题 |采纳率84.2%1、氧化性:
硝酸 〉硫酸
2、酸性:
中学化学中,所谓的酸性通常指物质在水溶液中表现出来的性质.酸性强弱是指酸将质子给予水分子的能力.常用酸在水中的电离常数来衡量.硝酸和硫酸的电离方程式如下:
HNO3 = H(+) + NO3(-) pKa = -1.34
H2SO4 = H(+) + HSO4(-) pKa = -3
HSO4(-) = H(+) + SO4(2-) pKa = 1.9
显然pKa(HNO3) > pKa(H2SO4),即Ka(HNO3) < Ka(H2SO4),说明硫酸比硝酸的酸性更强.1年前查看全部
- 1.氯化铜和硫酸能反应么?我觉得可以,可为什么氯化银和硝酸不能反应?
1.氯化铜和硫酸能反应么?我觉得可以,可为什么氯化银和硝酸不能反应?
2.碳酸钠解离到水中是什么样的?产生OH离子?那这时它是具有碳酸根离子的性质还是OH离子的性质? zpml20041年前8
zpml20041年前8 -
 放ヌ弃 共回答了22个问题
放ヌ弃 共回答了22个问题 |采纳率86.4%不反应啊!
交换成分后没有沉淀\气体\水等
不符合复分解反映规律!氯化银和硝酸不反应!因为:
AgNO3+HCl=AgCl(沉淀)+HNO3,所以氯化银是不会跟硝酸银反应的....碳酸钠是强碱弱酸盐,所以水溶液显一定的碱性1年前查看全部
- 初三科学四道选择题1.为了中和某一氢氧化钠溶液,要消耗一定量的盐酸,如改用与盐酸质量分数相同的等质量的硝酸,则反应后的溶
初三科学四道选择题
1.为了中和某一氢氧化钠溶液,要消耗一定量的盐酸,如改用与盐酸质量分数相同的等质量的硝酸,则反应后的溶液的pH( )
A.=7 B.大于7 C.小于7
2.用浓度和质量都相同的两份盐酸分别与足量的碳酸钙和碳酸镁反应,则比较生成CO2的质量正确的是( )
A.相等 B.CaCO3 C.MgCO3 D.无法比较
3.已知浓硫酸的密度比稀硫酸的密度大.质量分数分别是90%和10%的两种硫酸溶液等体积混合后,所得硫酸溶液中溶质的质量分数 ( )
A.大于50% B.小于50% C.=50% D.无法确定
4.有w克10%的NaCl溶液,若将其浓度增大一倍,采取的措施是( )
A.把溶剂蒸发掉一半 B.把溶剂蒸发掉0.5w克 C.加如0.1w克NaCl D.加入w克10%的NaCl溶液
请认真答,很急,非常感谢!
 cureeric1年前1
cureeric1年前1 -
 lxf1000 共回答了20个问题
lxf1000 共回答了20个问题 |采纳率85%BAAB
如果需要过程请补充.1年前查看全部
- 取三张蓝色石蕊试纸湿润后贴在玻璃片上,然后按顺序分别滴加65%硝酸溶液、98%的硫酸溶液、新制氯水,三张试纸最终变成(
取三张蓝色石蕊试纸湿润后贴在玻璃片上,然后按顺序分别滴加65%硝酸溶液、98%的硫酸溶液、新制氯水,三张试纸最终变成( ).
 屋檐无语1年前1
屋檐无语1年前1 -
 诗韵梦月 共回答了25个问题
诗韵梦月 共回答了25个问题 |采纳率88%取三张蓝色石蕊试纸湿润后贴在
玻璃片上,然后按顺序分别滴加65%硝酸溶液、98%的硫酸溶液、新制氯水,三张试纸最终变成( ).
(A)白、红、白 (B)红、黑、白
(C)红、红、红 (D)白、黑、白1年前查看全部
- (10分)硝酸是一种重要的 化工原料,工业上生产硝酸的主要过程如下:
(10分)硝酸是一种重要的
 化工原料,工业上生产硝酸的主要过程如下:
化工原料,工业上生产硝酸的主要过程如下:
(1)以N 2 和H 2 为原料合成氨气。一定温度下,在密闭容器中充入ImolN 2 和3molH 2 发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的 ,则N 2 的转化率
,则N 2 的转化率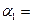 ;若容器压强恒定,达到平衡状态时,N=的转化率为
;若容器压强恒定,达到平衡状态时,N=的转化率为 ,则
,则
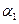 (‘填“>”、“<”或“=”)。
(‘填“>”、“<”或“=”)。
(2)用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH 3 +5O 2 4NO+6H 2 O 4NO+3O 2 +2H 2 O=4HNO 3
4NO+6H 2 O 4NO+3O 2 +2H 2 O=4HNO 3
现以3.4吨液氨为原料来生产质量分数为50%的硝酸,理论上需要加水的质量为
吨。(假设生产过程中反应物和生成物均无损耗)
(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO 2 +Na 2 CO 3 =NaNO 2 +NaNO 3 +CO 2 ,NO+NO 2 +Na 2 CO 3 =2NaNO 2 +CO 2 。若在标准状况下有NO、NO 2 的混合气体(不考虑N 2 O 4 )恰好与50mL 1. 0 mol·L -1 的Na 2 CO 3 溶液反应完全,且生成NaNO 2 和NaNO 3 的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
0 mol·L -1 的Na 2 CO 3 溶液反应完全,且生成NaNO 2 和NaNO 3 的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程) h686421861年前1
h686421861年前1 -
 叫我qq胡 共回答了12个问题
叫我qq胡 共回答了12个问题 |采纳率91.7%(1)12.5%或1/8、>(4分,每空2分)(2)9(3分)
(2)解析:由反应4NH 3 +5O 2 4NO+6H 2 O、4NO+3O 2 +2H 2 O=4HNO 3 得:
4NO+6H 2 O、4NO+3O 2 +2H 2 O=4HNO 3 得:
NH 3 +2O 2 =HNO 3 +H 2 O,3.4吨液氨产生的硝酸为12.6吨,水为3.6吨,则理论上需加水的质量为为:126.t/50%-(12.6+3.6)t=9t
(3)(3分)由反应转化关系知,反应过程中钠元素 守恒,设NaNO 2 和NaNO 3 的物质的量分别为4a mol和a mol,则4a+a=50mL×10 -3 mL·L -1 ×1.0 mol·L -1 ×2,解得:a=0.02 mol,于是,推出NO、NO 2 的物质的量分虽为:0.03 mol、0.07 mol,即:NO所占的体积分数为30%。
守恒,设NaNO 2 和NaNO 3 的物质的量分别为4a mol和a mol,则4a+a=50mL×10 -3 mL·L -1 ×1.0 mol·L -1 ×2,解得:a=0.02 mol,于是,推出NO、NO 2 的物质的量分虽为:0.03 mol、0.07 mol,即:NO所占的体积分数为30%。
略1年前查看全部
- 硝酸具有挥发性说明硝酸不稳定?如题.
 yuanyou30001年前4
yuanyou30001年前4 -
 djspark 共回答了23个问题
djspark 共回答了23个问题 |采纳率91.3%不对
具有挥发性的东西不一定都不稳定,如浓盐酸也具有挥发性,但是盐酸比较稳定
硝酸不稳定是硝酸本身自有的性质,和挥发性无关
有挥发性的东西不一定不稳定,不具有挥发性的东西也不一定稳定1年前查看全部
- 负一硝酸氢氧根,负二硫酸碳酸根,负三磷酸根正一价是氨根举例说明,
 非常fish1年前2
非常fish1年前2 -
 llsky21 共回答了23个问题
llsky21 共回答了23个问题 |采纳率100%NaOH
CaSO4
CaCO3
H3PO2
NH4Cl1年前查看全部
- 化学酸碱盐溶解性顺口溜“钾钠铵盐硝酸溶,盐酸盐中除去银,碳磷酸溶钾钠铵,硫酸铅和钡不溶”是什么意思?
 怎么爱都不够1年前3
怎么爱都不够1年前3 -
 longjingbinbin 共回答了19个问题
longjingbinbin 共回答了19个问题 |采纳率73.7%就是初中阶段常见盐的溶解性
以一句就是指钾钠铵的盐溶液易溶于水,例如碳酸钾碳酸钠氯化钠氯化铵硫酸钾,等等
第二句指AgCl不易溶于水(极难溶)
第三句知此俩酸根离子盐只有钾钠铵溶,即碳酸钠,碳酸钾,碳酸铵,其他不溶,如碳酸钡,碳酸钙等等不溶.
最后一句与第2句类似1年前查看全部
- 甲烷、氨气、溴化氢、碘化氢、硝酸、碳酸、磷酸、亚硫酸的化学式是什么?
 断刀流水11151年前1
断刀流水11151年前1 -
 烁远 共回答了17个问题
烁远 共回答了17个问题 |采纳率100%CH4,NH3,BrH,IH,HNO3,H2CO3,H3PO4,H2SO31年前查看全部
- 例如:二缩三硝酸,一缩二乙二醇.
例如:二缩三硝酸,一缩二乙二醇.
$(co) teneyoon1年前1
teneyoon1年前1 -
 非仙子 共回答了22个问题
非仙子 共回答了22个问题 |采纳率100%两个简单含氧酸分子间缩去一分子水,可以用“一缩某二酸”来命名.二缩三硝酸 是三个硝酸分子之间缩去两分子水;一缩二乙二醇 是两个乙二酸分子之间缩去一份子水1年前查看全部
- 化学高手进!关于氧化还原和硝酸(NO3离子)的问题
化学高手进!关于氧化还原和硝酸(NO3离子)的问题
书上说,硝酸(HNO3)有强的氧化性,所以可以与一些物质发生氧化还原反应.
例如HNO3+Cu的反应.
书上的E.C.S.的列表,写的是NO3-是强的氧化剂(oxidizing agent)
我想问,那么在Fe(铁)和Cu(NO3)2的反应中,为什么NO3-不是氧化剂了?是因为只要不是硝酸,而是和其他元素组成盐,它就不具氧化性了? 江南茶秀1年前4
江南茶秀1年前4 -
 dhscjx 共回答了19个问题
dhscjx 共回答了19个问题 |采纳率89.5%NO3的强氧化性要在酸性条件下才显现出来.在铁和硝酸铜的反应中,若加入硫酸,NO3-的氧化性就会显现出来了.1年前查看全部
- 硫酸 盐酸 硝酸 氯酸钾 高锰酸钾 锰酸钾 氯化钠 食盐 氯化钾
硫酸 盐酸 硝酸 氯酸钾 高锰酸钾 锰酸钾 氯化钠 食盐 氯化钾
氯化钙 氯化镁 氯化锌 氯化铝 氯化银 氯化铁 氯化亚铁 氯化铜 氯化亚铜 氯化钡 sp_zy1年前3
sp_zy1年前3 -
 江薇cc 共回答了16个问题
江薇cc 共回答了16个问题 |采纳率87.5%H2SO4
HCl
HNO3
KClO3
KMnO4
K2MnO4
KMnO3
NaCl
NaCl
KCl
CaCl2
MgCl2
ZnCl2
AlCl3
AgCl
FeCl3
FeCl2
CuCl2
CuCl
BaCl2
Cu(OH)2CO31年前查看全部
- 氯化氢,硫酸,硝酸都是什么性酸,氧化性还是还原性,为什么
 xinliyi1年前1
xinliyi1年前1 -
 天地随风 共回答了23个问题
天地随风 共回答了23个问题 |采纳率91.3%盐酸是非氧化性酸,只是具有酸的通性,但氯化氢气体具有一定的还原性(-1价的氯化合价可升高),但不强
硫酸分两种情况,稀硫酸具有酸的通性,氧化性却很弱(主要是SO4 2-的氧化性弱),所以是非氧化性酸,而浓硫酸除了具有酸的通性外,由于水的含量极少,因此浓硫酸主要以H2SO4分子的形式存在,而H2SO4分子具有很强的氧化性,所以它是强氧化性酸,与强还原性的物质(如硫化氢等)无法共存,它与金属反应生成最高价态的金属盐,并且可与活动性表中排在H后的铜、汞、银等金属反应
硝酸无论稀浓,都同时具有酸的通性强氧化性,它的氧化性主要来自NO3-离子,也属于强氧化性酸1年前查看全部
- Cu-HNO3反应的一道题.含a mol Cu,b mol Ag的金属混合物与含c mol HNO3的某浓度硝酸恰好反应
Cu-HNO3反应的一道题.
含a mol Cu,b mol Ag的金属混合物与含c mol HNO3的某浓度硝酸恰好反应.
生成气体只有m mol NO2和 n mol NO.下列式子不成立的是.
A.2a+b=m+3n
B.8a/3+2b=c
C.c=2m+4n
D.c=2a+b+m+n.
有分给的. 约定齐1年前1
约定齐1年前1 -
 逸五 共回答了16个问题
逸五 共回答了16个问题 |采纳率81.3%选B
A 得失电子守恒:Cu Ag 失电子数等于NO2 NO 得电子数:则有2a+b=m+3n
B.错误
D 氮守恒:HNO3中的N等于Cu(NO3)2 AgNO3 NO2 NO 中的N相加,则有c=2a+b+m+n.
C.D中有c=2a+b+m+n.A中有2a+b=m+3n 代入D中即得c=2m+4n1年前查看全部
- 硝酸是什么气体溶于水,为何和金属反应不一定放出氢气?
 kundali1年前3
kundali1年前3 -
 forevernan 共回答了15个问题
forevernan 共回答了15个问题 |采纳率93.3%五氧化二氮,是硝酸酸酐不假,但常温下为白色固体,微溶于水,热水才全溶.融水后生成硝酸.
二氧化氮是红棕色气体,溶水生成硝酸.在无氧气条件下还会生成无色气体一氧化氮,有氧气时生成硝酸.以下为化学式:
4NO2+3O2+2H2O=4HNO3 3NO2+H2O=2HNO3+NO1年前查看全部
- 酸碱和盐的溶解性表的读法~例如:H2SO4(硫酸),HCL(盐酸),HNO3(硝酸) NaOH(氢氧化钠),KOH(氢氧
酸碱和盐的溶解性表的读法~
例如:H2SO4(硫酸),HCL(盐酸),HNO3(硝酸)
NaOH(氢氧化钠),KOH(氢氧化钾),NH4OH(氨水)
Na2CO3(碳酸钠),CuSO4(硫酸铜) ,NH4NO3(硝酸铵) bmx9991年前1
bmx9991年前1 -
 13aizjb 共回答了14个问题
13aizjb 共回答了14个问题 |采纳率92.9%H2CO3【碳酸】.HF【氢氟酸】
CaOH【氢氧化钙】.Cu(OH)2【氢氧化铜】.Fe(OH)2【氢氧化亚铁】.Fe(OH)3【氢氧化铁】.
CaCO3【碳酸钙】.Ca2NO3【硝酸钙】.Na2CO3【碳酸钠】.AgCl【氯化银】1年前查看全部
- 像一个澄清的溶液中加入硝酸酸化的BaNO3,有白色沉淀生成,可否说明溶液中只有SO4离子而没有CO3离子?
 lolo80031年前2
lolo80031年前2 -
 mazland 共回答了13个问题
mazland 共回答了13个问题 |采纳率92.3%s是的!
加BaNO3有白色沉淀生成,说明可能含有CO3离子和SO4离子,若是硝酸酸化,即溶液中有硝酸,在硝酸存在时,CO3离子,会变成气体二氧化碳,碳酸钡溶解;若白色沉淀不溶解,只能是硫酸钡,即说明溶液中只有SO4离子1年前查看全部
- 尿素,醋酸.硝酸三者的相对分子质量相近,形成的晶体都属于分子晶体,但三者的溶沸点相差较大,
 魍魉魑魅111年前3
魍魉魑魅111年前3 -
 寒城风云 共回答了24个问题
寒城风云 共回答了24个问题 |采纳率100%首先硝酸是无机物,无机物的溶沸点一般都比有机物要高,醋酸和尿素的主要是空间结构不同!1年前查看全部
- 硝酸与H前金属反应生成什么?有没有稀和浓的差异?
硝酸与H前金属反应生成什么?有没有稀和浓的差异?
硝酸是只有对H后金属有氧化性么?还是与H前也有? ronyers1年前2
ronyers1年前2 -
 思念人之屋1 共回答了18个问题
思念人之屋1 共回答了18个问题 |采纳率100%有,浓的生成二氧化氮,稀得生成一氧化氮.对什么金属都有氧化性.比如氢后的铜,1年前查看全部
- 为什么高氯酸酸性最强?高溴酸,高碘酸,硝酸都是强酸,相同浓度下都能完全电离,那么ph应该相同啊?
 michelle12301年前3
michelle12301年前3 -
 神kk 共回答了17个问题
神kk 共回答了17个问题 |采纳率76.5%酸性有强弱,只是水中都 反应变成了水合氢离子,故酸性一样,也就是说在水这个溶剂中不能区分这几个酸的酸性强弱1年前查看全部
- 镁和硝酸反应配平!( )Mg+( )HNO3==( )Mg(NO3)2+( )NH4NO3+( )H2O
 任未来1年前2
任未来1年前2 -
 小笑世上士 共回答了20个问题
小笑世上士 共回答了20个问题 |采纳率95%4 10 4 1 31年前查看全部
- 一定量的铁和氧化铁混合物投入250mL2mol/L的硝酸溶液中,反应完全后,无固体剩余,生成1.12LNO气体
一定量的铁和氧化铁混合物投入250mL2mol/L的硝酸溶液中,反应完全后,无固体剩余,生成1.12LNO气体
一定量的Fe和Fe2O3混合物投入250ml2mol/L的HNO3溶液中,反应完全后,无固体剩余,生成1.12LNO气体(标况),再向反应后溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是?400ml
错了,答案是450ml怎么算的? ssx05461年前2
ssx05461年前2 -
 Doffy 共回答了13个问题
Doffy 共回答了13个问题 |采纳率84.6%生成1.12LNO气体(标况)——需要硝酸1.12/22.4=0.05摩尔,这是被还原的硝酸的物质的量;250ml2mol/L的HNO3溶液中含有硝酸=2*0.25=0.5摩尔,这是硝酸总的物质的量.
那么总的物质的量—被还原的物质的量=0.5-0.05=0.45摩尔,0.45摩尔消耗1mol/L的NaOH溶液体积=0.45/1=0.45升=450毫升.1年前查看全部
- 小刚也查阅了一分资料,了解到氯化铜溶液,硝酸铜溶液中均含有铜离子,氯化钠溶液中含有氯离子,硝酸钠溶液含硝酸离子.他于是马
小刚也查阅了一分资料,了解到氯化铜溶液,硝酸铜溶液中均含有铜离子,氯化钠溶液中含有氯离子,硝酸钠溶液含硝酸离子.他于是马上到实验室观察氯化钠,硝酸钠,氯化铜,硝酸铜溶液的颜色,基于这些溶液的颜色他可以作一个判断,若 ,则可以得出结论——铜离子使硫酸铜溶液呈现蓝色.
 我是驹1年前1
我是驹1年前1 -
 riot转圈圈 共回答了19个问题
riot转圈圈 共回答了19个问题 |采纳率89.5%若 氯化铜,硝酸铜溶液为蓝色,氯化钠,硝酸钠溶液为无色 ,则可以得出结论——铜离子使硫酸铜溶液呈现蓝色.1年前查看全部
- 磷酸二氢钠与少量氢氧化钠的反应如题,然后加氯化钙溶液,有何现象?若用硝酸代替氢氧化钠溶液,将有什么现象?为什么?自学者需
磷酸二氢钠与少量氢氧化钠的反应
如题,然后加氯化钙溶液,有何现象?
若用硝酸代替氢氧化钠溶液,将有什么现象?
为什么?
自学者需要琢磨嗯. 青草燕窝1年前2
青草燕窝1年前2 -
 鹰之梦残剑1 共回答了22个问题
鹰之梦残剑1 共回答了22个问题 |采纳率90.9%没有任何现象
NaH2PO4+NaOH=Na2HPO4+H2O(氢氧化钠是少量,因此只反应一个H+)
CaCl2和Na2HPO4不反应.
有白色沉淀生成
NaH2PO4+HNO3=NaNO3+H3PO4
2H3PO4+3CaCl2=Ca3(PO4)2+6HCl
Ca3(PO4)2是白色沉淀1年前查看全部
- 为什么硝酸银只能用硝酸酸化?原理何在 以次推广到:物质酸化时的原里和注意事项?
 夏之湖1年前2
夏之湖1年前2 -
 sdhfbjkfg 共回答了20个问题
sdhfbjkfg 共回答了20个问题 |采纳率85%因为银离子与其他酸根会生成沉淀,再一点是为了避免引入杂质.酸化硝酸银是为了防止银离子的水解产生沉淀.酸化的原理主要就是避免引入杂质(尽量使用相应的酸根,当然也有例外),避免使药剂变质(就是别让药剂发生化学反应).1年前查看全部
- 有四种物质的溶液,1氢氧化钡2硫酸钠3硝酸4氯化铁
有四种物质的溶液,1氢氧化钡2硫酸钠3硝酸4氯化铁
不用其他试剂就可以将它们逐一鉴别出来,其鉴别顺序是?
A 1234
B 4321
C 3124
D 4132 liquan21281年前3
liquan21281年前3 -
 阳光ss 共回答了16个问题
阳光ss 共回答了16个问题 |采纳率87.5%氯化铁呈黄色,所以先鉴别出来是氯化铁.
用三支试管,各取少量其它三种待测液,然后分别加入氯化铁溶液,产生红褐色沉淀的为氢氧化钡溶液.
再另取二支试管,各取已产生的红褐色沉淀,然后分别其它二种待测液,红褐色沉淀消失的为硝酸,无现象的为硫酸钠.
所以答案为D.1年前查看全部
- 下列场合中不能之接使用氮气的是 A 填充灯泡 B做焊接保护气 C 制硝酸 D制氨 选C的理由是
 瓷漆xx1年前2
瓷漆xx1年前2 -
 辋阕 共回答了14个问题
辋阕 共回答了14个问题 |采纳率92.9%题目应该是“不能直接使用氮气的是”.
答案应该是C.原因是工业上制备硝酸是用氨的催化氧化法,先得到NO,然后再和氧气作用得到NO2,最后NO2和水反应得到硝酸的,所以不能直接使用氮气!
具体如下:
其法以氨和空气为原料,用Pt—Rh合金网为催化剂在氧化炉中于 800℃进行氧化反应,生成的NO在冷却时与O2生NO2,NO2在吸收塔内用水吸收在过量空气中O2的作用下转化为硝酸,最高浓度可达50%.
4NH3+5O2=催化剂、高温=4N0+6H20 ①
2NO+O2==2NO2 ②
3NO2+H2O==2HNO3+NO ③
4NO2+O2+2H2O==4HNO3 ④
③中的NO可以进入②中继续利用制取的50%的硝酸用硝酸镁或者浓H2SO4做吸水剂,蒸馏,可得到高浓度的硝酸,甚至98%以上的“发烟”硝酸.
尾气处理,生产过程中NO循环使用,可以最大程度利用原料,并且减少尾气中的NOX 的排放,
尾气一般用NaOH溶液进行吸收 ,发生氧化还原反应,可以综合利用尾气中的NOX
2NO2+2NaOH =NaNO2 +NaNO3 +H2O
NO +NO2 +2NaOH =2NANO3+H2O1年前查看全部
- 含硝酸跟离子的溶液中,有氨根离子、钡离子、亚铁离子、溴离子.在这溶液中,为什么能大量共存?亚铁不是会水解吗?
 谷熙1年前2
谷熙1年前2 -
 clematis 共回答了18个问题
clematis 共回答了18个问题 |采纳率88.9%NH4+ + H2O ==可逆== NH3 H2O + H+
Fe2+ + 2H2O ==可逆== Fe(OH)2 + 2H+
NH4+ 和 Fe2+ 在溶液中都会发生小程度的水解,它们产生的H+会互相抑制对方的水解,减弱水解的程度,此时可以认为NH4+和Fe2+可以大量共存
若是将其中一种离子换成弱酸银离子如HCO3-
HCO3- + H2O ==可逆== H2CO3 + OH-
这个时候产生的OH-会和阳离子水解产生的H+反应,使得阴阳离子双方的水解程度增大,此时不能共存1年前查看全部
- 什么材料的槽子能够盛装硝酸、铬酸、氢氟酸混合液?并且能够耐85度加温浓缩?
什么材料的槽子能够盛装硝酸、铬酸、氢氟酸混合液?并且能够耐85度加温浓缩?
现有一含有以上三酸混合液的槽液报废,需要加温浓缩处理.想单独用一个槽子加温浓缩,不知道选用什么材料的槽子?并且想问一下如果是移动的应选用什么样的装置(大致有2000升溶液)? 落叶的旋律1年前1
落叶的旋律1年前1 -
 颜的同事 共回答了17个问题
颜的同事 共回答了17个问题 |采纳率70.6%用聚四氟乙烯罐子吧!我们经常做实验用的就是这种罐子哦!不过价格也不是那么便宜的!1年前查看全部
- 27%的盐酸怎么样配比王水?一般的说是用硝酸浓度为68% 盐酸的浓度为36%-38%按照 体积比1:3来配比.可要是盐酸
27%的盐酸怎么样配比王水?
一般的说是用硝酸浓度为68% 盐酸的浓度为36%-38%按照 体积比1:3来配比.可要是盐酸的密度是27%呢?怎么配比? 爱乐天1年前3
爱乐天1年前3 -
 荷米恩 共回答了16个问题
荷米恩 共回答了16个问题 |采纳率93.8%王水的浓度是粗略的,在这个范围的配比都能有这个效果,差不多1:2多一点就行了,就当稀释前后总体极不变,化学中的近似是很重要的,要学会忽略,像1:2,1:3这种数字的话只要精确到整数位就可以了1年前查看全部
- (1)二氧化氮溶于水中生成硝酸和一氧化氮
(1)二氧化氮溶于水中生成硝酸和一氧化氮
(2)盐酸与碳酸钠反应成制取二氧化碳
写出它们的化学式
要配平 viviching1年前1
viviching1年前1 -
 BMW0708 共回答了15个问题
BMW0708 共回答了15个问题 |采纳率86.7%3NO2+2H2O=2HNO3+NO
2HCl+Na2CO3=2NaCl+CO2↑1年前查看全部
大家在问
- 1等比数列中,已知a3=8,a6=64.求数列an的通项公式
- 2100g CaCO3与NaHCO3组成的混合物,恰好能与3mol/L的HCl 500mL反应.求混合物中CaCO3与Na
- 3已知等比数列{an}中,a3=3,a6=24,则该数列的通项an=______.
- 4几种物质在标准大气压下的熔点和沸点,下列正确的是……
- 5下表为几种物质在标准大气压下的熔点和沸点,根据表中数据可判断出下列说法正确的是()
- 6诗句描写景物是侧面描写吗?
- 7“但是没有人会反对流泪是人类表达感情的一种方式,而且是一种非同寻常的方式.”中非同寻常的作用
- 8合并成宾语从句复合句I don not know.Is it polite to speak loudly at the
- 9实验pb-bi铅铋混合液中铅和铋的连续滴定中.第一终点后,加入六亚甲基四胺后,溶液变为紫红色,为什么?
- 10英语中h和u搭配u有没有发音成“啊”的
- 11"同旁内角"是什么?怎么样才能准确的判定一个角是同旁内角?
- 12高四英语怎么学?有什么好的方法?不要说背单词,看句子等等的大而化之的方法,要具体的.
- 13在等差数列{an}中,已知S3=6,S6=-8求S9
- 14怎样学高数?(要具体不要大而化之)
- 150.22为什么要读成零点二二,而不读成零点二十二?0.18为什么要读成零点一八而不读成零点十八?
