固体氧化物燃料电池(SOFC)以固体氧化物作为电解质。其工作原理如右图所示:下列关于固体燃料电池的有关说法正确的是
 一只鸟2022-10-04 11:39:541条回答
一只鸟2022-10-04 11:39:541条回答| 固体氧化物燃料电池(SOFC)以固体氧化物作为电解质。其工作原理如右图所示:下列关于固体燃料电池的有关说法正确的是() 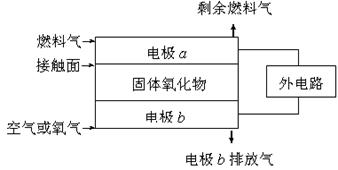 A.电极 b 为电池负极,电极反应式为O 2 +4e - =4O 2 - [ B.固体氧化物的作用是让电子在电池内通过 C.若H 2 作为燃料气,则接触面上发生的反应为H 2 +2OH - -4e - =2H + +H 2 O D.若C 2 H 4 作为燃料气,则接触面上发生的反应为C 2 H 4 +6O 2 - -12e - =2CO 2 +2H 2 O |

已提交,审核后显示!提交回复
共1条回复
 sololos 共回答了20个问题
sololos 共回答了20个问题 |采纳率95%- D
原电池中负极失去电子,而氧气是得到电子的,A不正确;B不正确,电子是通过导线传递的,而不是在溶液中;由于电解质是固体氧化物,所以电池内部传递的是氧离子,即负极反应式是H 2 +O 2 - -2e - =H 2 O,所以选项C不正确,因此正确的答案选D。 - 1年前
相关推荐
- 化学(燃料电池:请老师高人)某固体氧化物燃料电池(SOFC)以固体氧化物作电解质(能通过O2-),写出C2H4与O2燃料
化学(燃料电池:请老师高人)
某固体氧化物燃料电池(SOFC)以固体氧化物作电解质(能通过O2-),写出C2H4与O2燃料电池两极反应式和总反应式
不同的网友给了两个答案:
(一)
阳极:O2 +4e==2O2-
阴极:C2H4 +8O2- -12e ==2(CO3)(2-) +2H2O
总的 :C2H4 + 3O2 + 2O2- = 2(CO3)(2-) + 2H2O
(二)
负极:C2H4+6O2- -12e- = 2CO2+2H2O
正极:3O2 +12e- = 6O2-
总反应式:C2H4+3O2 = 2CO2+2H2O
我无法辨别,请老师帮看一下,是两个都对,还是其中有、之一对
修改如下
(一)
正极:O2 +4e==2O2-
负极:C2H4 +8O2- -12e ==2(CO3)(2-) +2H2O
总的 :C2H4 + 3O2 + 2O2- = 2(CO3)(2-) + 2H2O cathywamg1年前1
cathywamg1年前1 -
 fjpccar 共回答了20个问题
fjpccar 共回答了20个问题 |采纳率80%两个都对.
原电池,高中说法应该是正负极(第二个对)
大学的说法才可以阴极-正极,阳极-负极的,高中通常不这样说的.
但是方程式是第一个对.1年前查看全部
- A、B、C、D分别为固体氧化物燃料电池、碱性燃料电池、质子交换膜燃料电池、熔融盐燃料电池,其中正极的反应产物为水的是
A、B、C、D分别为固体氧化物燃料电池、碱性燃料电池、质子交换膜燃料电池、熔融盐燃料电池,其中正极的反应产物为水的是
( )
A.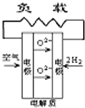
B.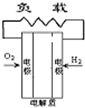
C.
D.
 xjdhappy11年前1
xjdhappy11年前1 -
 wananwa 共回答了23个问题
wananwa 共回答了23个问题 |采纳率91.3%解题思路:原电池中,阳离子向正极移动,正极上得到电子,结合正极的反应产物为水来解答.A.在固体氧化物燃料电池中,正极上O2+4e-=2O2-,故A不选;
B.碱性燃料电池中,正极上发生O2+2H20+4e-=4OH-,故B不选;
C.质子交换膜燃料电池,正极上发生4H++O2+4e-=2H20,故C选;
D.熔融盐燃料电池中,2CO2+O2+4e-=2CO32-,故D不选;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查燃料电池,明确原电池的工作原理是解答本题的关键,注意电解质及电极反应,题目难度不大.1年前查看全部
- 固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,O2-可以在其内部自由通过.其工作原理如图所示.下列关于固体燃料电
固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,O2-可以在其内部自由通过.其工作原理如图所示.下列关于固体燃料电池的有关说法正确的是( )
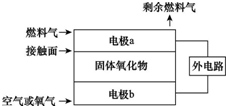 A. 电极b为电池负极,电极反应式为O2+4e-═2O2-
A. 电极b为电池负极,电极反应式为O2+4e-═2O2-
B. 固体氧化物的作用是让电子在电池内通过
C. 若H2作为燃料气,则接触面上发生的反应为H2+2OH--4e-═2H++H2O
D. 若C2H4作为燃料气,则接触面上发生的反应为C2H4+6O2--12e-═2CO2+2H2O 云帆19941年前1
云帆19941年前1 -
 cqtnmx 共回答了14个问题
cqtnmx 共回答了14个问题 |采纳率92.9%解题思路:A、燃料做负极失电子发生氧化反应,氧气做正极得到电子发生还原反应;
B、电子不通过固体电解质;
C、O2-可以在其内部自由通过,若氢气做燃料气,则在负极接触面上氢气失去电子发生反应生成氢离子,而氢离子与正极移动来的氧离子结合为水;
D、O2-可以在其内部自由通过,若C2H4作为燃料气,则接触面上发生的反应是乙烯失电子;A、燃料电池都是燃料在负极失电子,氧气在正极得到电子,所以b电极为正极,故A错误;
B、在电池内部阴离子向负极移动,而不是电子移向负极,故B错误;
C、若氢气做燃料气,则在负极接触面上氢气失去电子发生反应生成氢离子,而氢离子与正极移动来的氧离子结合为水,所以电极反应为2H2+2O2--4e-=2H2O,故C错误;
D、若C2H4作为燃料气,则接触面上发生的反应为C2H4+6O2--12e-═2CO2+2H2O,故D正确;
故选D.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了化学新型电源的原电池原理应用,主要是考查电极的书写,注意不是电解质溶液中而是固体电解质形成的原电池.1年前查看全部
- 固体氧化物燃料电池(SOFC)以固体氧化物(能传导O2-)作为电解质.
固体氧化物燃料电池(SOFC)以固体氧化物(能传导O2-)作为电解质.
接触面上发生的反应为:C2H4+6O2--12e-=2CO2+2H2O
为什么不是生成CO3 2- 月明1431年前3
月明1431年前3 -
 sinqinzhu 共回答了23个问题
sinqinzhu 共回答了23个问题 |采纳率82.6%除非有其它正价离子与其结合形成稳定的碳酸盐,否则碳酸根离子是不稳定的.以上面的体系为例,如果生成碳酸根离子,那么势必有H离子,这样碳酸根离子在酸性条件下肯定是不稳定的,分解成CO2,所以肯定不可能生成碳酸根离子1年前查看全部
- 有四种燃料电池:A固体氧化物燃料电池;B碱性氢氧化物燃料电池;C质子交换膜燃料电池;D熔融盐燃料电池,下面是工作原理示意
有四种燃料电池:A固体氧化物燃料电池;B碱性氢氧化物燃料电池;C质子交换膜燃料电池;D熔融盐燃料电池,下面是工作原理示意图,其中正极反应生成水的是( )
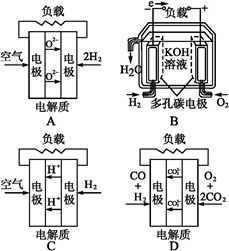
 我就不信收1年前1
我就不信收1年前1 -
 小猪莎拉 共回答了17个问题
小猪莎拉 共回答了17个问题 |采纳率94.1%C
A项,正极反应生成O 2- ;B项,正极反应生成OH - ;C项,正极反应生成H 2 O;D项,正极反应生成C。1年前查看全部
- 我国科学家成功开发便携式固体氧化物燃料电池,它以丙烷气体为燃料,每填充一次燃料,大约可连续24小时输出50W的电力.一极
我国科学家成功开发便携式固体氧化物燃料电池,它以丙烷气体为燃料,每填充一次燃料,大约可连续24小时输出50W的电力.一极通入空气,另一极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O2-,下列对该燃料电池的说法不正确的是( )
A.电路中每流过5mol电子,肯定有5.6 L丙烷被完全氧化
B.该电池的总反应是:C3H8+5O2→3CO2+4H2O
C.在熔融电解质中,O2-由正极移向负极
D.通丙烷的电极为电池负极,发生的电极反应为:C3H8+10O2--20e-═3CO2+4H2O 星绒绒1年前1
星绒绒1年前1 -
 静静的小静 共回答了18个问题
静静的小静 共回答了18个问题 |采纳率94.4%解题思路:该燃料电池中,燃料失电子发生氧化反应,所以通入燃料的电极为负极,通入氧化剂的电极为正极,电池反应式C3H8+5O2═3CO2+4H2O,放电时,负极电极方程式为C3H8-20e-+10O2-═3CO2+4H2O,氧气在正极被还原,电极反应式为O2-4e-═2O2-,熔融电解质中阳离子向正极移动,阴离子向负极移动.A.温度和压强未知,所以无法计算5.6 L丙烷的物质的量,故A错误;
B.丙烷燃料电池的总反应式与丙烷燃烧的方程式相同,都为C3H8+5O2═3CO2+4H2O,故B正确;
C.氧气在正极被还原,电极反应式为O2-4e-═2O2-,原电池放电时,阴离子向负极移动,所以O2-由正极移向负极,故C正确;
D.通入燃料的电极是负极,负极上燃料失电子发生氧化反应,电极反应式为C3H8-20e-+10O2-═3CO2+4H2O,故D正确;
故选:A.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查燃料电池原理,明确正负极上发生的电极反应是解本题关键,难点是电极反应式的书写,注意该电池电解质的特殊性,易错选项是A,有关气体体积的计算一定要注意温度和压强,为易错点.1年前查看全部
- (2008•湛江二模)目前科学家已经开发出便携式固体氧化物燃料电池,它以烷烃气体为燃料,每填充一次燃料,可连续几小时,甚
(2008•湛江二模)目前科学家已经开发出便携式固体氧化物燃料电池,它以烷烃气体为燃料,每填充一次燃料,可连续几小时,甚至几十小时以50W的功率向外输出电能.这种电池的一极通入的是空气,而另一极通入的是烷烃气体;电解质是一种固体氧化物,该固体氧化物在熔融状态下能传导O2-.下列对该燃料电池说法中正确的是( )
A.在熔融电解质中,O2-由负极移向正极
B.通甲烷的电极为电池的正极
C.负极的电极反应方程式为:CH4+4O2--8e-═CO2+2H2O
D.电路中每流过1mol电子,约有5.6L甲烷被完全氧化 漂洋过海去见你1年前1
漂洋过海去见你1年前1 -
 梁老大 共回答了26个问题
梁老大 共回答了26个问题 |采纳率100%解题思路:甲烷燃料电池的总反应式与甲烷燃烧的方程式相同,都为CH4+2O2═CO2+2H2O,电池工作时,甲烷在负极被氧化,电极方程式为CH4-8e-+4O2-═CO2+2H2O,氧气在正极被还原,电极反应式为O2-4e-═2O2-,熔融电解质中阳离子向正极移动,阴离子向负极移动.A.在熔融电解质中,O2-由正极移向负极,故A错误;
B.燃料电池中甲烷在负极失电子,发生氧化反应,故B错误;
C.燃料电池中甲烷在负极失电子,发生氧化反应,电极方程式为CH4-8e-+4O2-═CO2+2H2O,故C正确;
D.负极的电极方程式为CH4-8e-+4O2-═CO2+2H2O,电路中每流过1mol电子,有[1/8]mol甲烷被完全氧化,所以在标准状况下甲烷的体积为2.8L,故D错误;
故选:C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查化学电源新型电池,题目难度中等,本题注意把握丙烷燃料电池的工作原理,能正确写出电极反应式为解答该题的关键,注意题中电解质.1年前查看全部
- A,B,C,D分别为固体氧化物燃料电池,碱性燃料电池,质子交换膜燃料电池,熔融盐燃料电池,其中正极的反应产物为水的是
 顽皮少爷1年前1
顽皮少爷1年前1 -
 345059405 共回答了20个问题
345059405 共回答了20个问题 |采纳率70%选C
A中正极为O2+4e==2O2-
B中正极为O2+4e+2H2O==4OH-
C中为O2+4e+4H+==2H2O
D为O2+4e+2CO2==2CO3 2-
高二这一块内容其实并不难,你要把最简单的原电池和电解池原理掌握好,然后遇到提用这些知识来解决即可,一开始可能不太熟悉,多练一练就好了,对了,还要注意电解质,写完基本的以后若能与电解质反应把电解质也加进去,写出最后的产物就好了.不太熟的话可以一步一步写,然后叠加,也可以得到.试试吧1年前查看全部
- 固体氧化物燃料电池阴极反应生成二氧化碳还是碳酸根?
固体氧化物燃料电池阴极反应生成二氧化碳还是碳酸根?
乙烯作为燃料气 cwsqall1年前1
cwsqall1年前1 -
 yangjinqiong474 共回答了14个问题
yangjinqiong474 共回答了14个问题 |采纳率100%生成二氧化碳.
固体氧化物燃料电池(电池的电解质传递O2-).
固定正极反应式:O2+4e-=2O2-
例:一个电极通入空气,另一个电极通入C2H4,电池的电解质是掺杂了Y2O3 的ZrO2 晶体,它在高温下能传递O2-.
总反应式:C2H4+3O2 = 2CO2+2H2O.
正极反应式:3O2+12e-=6O2- (O2+4e- =2O2-)
负极反应式:C2H4+3O2 -12e- = 2CO2+2H2O
另外:电解池称为阴阳极,原电池称正负极1年前查看全部
- 美国科学家成功开发出便携式固体氧化物燃料电池,它以丙烷气体为燃料,每填充一次燃料,大约可连续24小时输出50 W的电力。
美国科学家成功开发出便携式固体氧化物燃料电池,它以丙烷气体为燃料,每填充一次燃料,大约可连续24小时输出50 W的电力。一极通入空气,另一极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O 2 - ,下列对该燃料电池的说法不正确的是
A.在熔融电解质中,O 2 - 由负极移向正极 B.电路中每通过5 mol电子,在标准状况下约有5.6 L丙烷被完全氧化 C.通丙烷的电极为电池负极,该极发生的电极反应式为C 3 H 8 -20e - +10O 2 - ===3CO 2 +4H 2 O D.丙烷燃料电池的能量利用率比丙烷燃烧的能量利用率大  wushihua17161年前1
wushihua17161年前1 -
 lgx121 共回答了30个问题
lgx121 共回答了30个问题 |采纳率86.7%A
在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,所以选项A是不正确的,其余都是正确的吗÷,答案选A。1年前查看全部
- 试就一种燃料电池体系(如质子交换膜燃料电池,固体氧化物燃料电池)说明燃料电池的特点、优势及目前存在
 wer36691年前2
wer36691年前2 -
 依破天 共回答了24个问题
依破天 共回答了24个问题 |采纳率87.5%……你是要交论文么?随便找篇综述翻译一下就好了,比如固体氧化物燃料电池(sofc),找篇阳极支撑型的review,翻译前半段就好了.像sofc的特点就是生产以及使用过程当中无毒无污染,发电效率高,可以实现热电联供.1年前查看全部
- (2008•揭阳二模)科学家成功开发便携式固体氧化物燃料电池,它以丙烷气体为燃料.电池中的一极通入空气,另一极通入丙烷气
(2008•揭阳二模)科学家成功开发便携式固体氧化物燃料电池,它以丙烷气体为燃料.电池中的一极通入空气,另一极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O2-.下列对该燃料电池的说法不正确的是( )
A.在熔融电解质中,O2-由负极移向正极
B.该电池的总反应是:C3H8+5O2=3CO2+4H2O
C.电路中每通过5mol电子,约有5.6L标准状况下的丙烷被完全氧化
D.通丙烷的电极为电池负极,发生的电极反应为:C3H8-20e-+10O2-=3CO2+4H2O 草跟水飘1年前1
草跟水飘1年前1 -
 淮南壮丁 共回答了18个问题
淮南壮丁 共回答了18个问题 |采纳率83.3%解题思路:丙烷燃料电池的总反应式与丙烷燃烧的方程式相同,都为C3H8+5O2=3CO2+4H2O,电池工作时,丙烷在负极被氧化,电极方程式为C3H8-20e-+10O2-=3CO2+4H2O,氧气在正极被还原,电极反应式为O2-4e-=2O2-,熔融电解质中阳离子向正极移动,阴离子向负极移动.A.在熔融电解质中,O2-由正极移向负极,故A错误;
B.丙烷燃料电池的总反应式与丙烷燃烧的方程式相同,都为C3H8+5O2=3CO2+4H2O,故B正确;
C.n(C3H8)=[5.6L/22.4L/mol]=0.25mol,C3H8被氧化为CO2,根据化合价的变化可知,转移电子的物质的量为0.25mol×[3×4-(-8)]=5mol,也可根据电极反应式判断,故C正确;
D.电池工作时,丙烷在负极被氧化,电极方程式为C3H8-20e-+10O2-=3CO2+4H2O,故D正确.
故选A.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查化学电源新型电池,题目难度中等,本题注意把握丙烷燃料电池的工作原理,能正确写出电极反应式为解答该题的关键,注意题中电解质.1年前查看全部
大家在问
- 1有一个焦距为20cm的凸透镜,关于它所成的像,下列说法中正确的是( )
- 2已知x,y满足约束条件x-y+5>=0 x+y>=0 X
- 3(2013•郑州模拟)如图,在边长为a的正方形中挖去一个边长为b的小正方形(a>b),再把剩余的部分剪拼成一个矩形,通过
- 4英语翻译1.This is___(he) mother.She likes____(house)2.How many__
- 524㎡用150块砖,56㎡用多少块砖,用比例来做
- 6单项选择。 Drink more water and you will
- 7以 走出校园 为话题的作文素材有哪些?
- 8能够净化水质的水生植物有哪些?
- 9为什么烧出来的焦碳发脆,发轻?计算下来,平均1.8吨出一吨焦碳.焦碳太轻,太脆
- 10有一个序列A=< a1,a2,…,an >.
- 111.John was so drunk that he fell off the bike and _______ by
- 12实数x,y满足条件x+y-4≤0,x-2y+2≥0,x≥0,y≥0,则log4(x/2+y+1)的最大值为
- 13命题p:x2-4x<0;命题q:0<x≤3,则命题p是命题q的( )
- 14得 怎么注音
- 15生物竞赛怎么准备
