1mol N2=几mol N 在标准状况下,22.4L由N2、N2O 组成的混合气体中所含有的N原子的物质的量约为几mo
 天地英雄882022-10-04 11:39:543条回答
天地英雄882022-10-04 11:39:543条回答在标准状况下,22.4L由N2、N2O 组成的混合气体中所含有的N原子的物质的量约为几mol?
答案是2mol,为什么,我觉得是4mol

已提交,审核后显示!提交回复
共3条回复
 终于86 共回答了25个问题
终于86 共回答了25个问题 |采纳率88%- 22.4L 理想气体 标况下 就是1mol
是混合气体
也就是说 N2+N2O是1mol
假设 这两种气体 体积比一样 0.5的N2 0.5的N20 那么 N原子一共是2 能算出来吧?
再假设 是0.4的N2 0.6的N2O N原子也是 0.8+1.2 = 2
以此类推
他们并不是 直观的 一共4个N原子 分子是1mol 原子就是4mol 而是每一种分子都是这1mol的一部分,N原子数就是这一部分的2倍,相加还是2倍.
举个例子:一根冰糕是1元 一个面包是1元 现在每根1元的冰糕可以兑换2个5毛的 每个1元的面包也可以兑换2个5毛的.那么 你可以用你本来的1根冰糕和一个面包 兑换2个小面包和小冰糕.你说换出来以后是2倍还是4倍呢?
我不知道这样说你明白不 我记得 我上学的时候也会因为这样的问题感到纠结.我就用这样的例子来想 慢慢就明白了…… - 1年前
 44715636 共回答了4个问题
44715636 共回答了4个问题 |采纳率- 2mol . N是氮原子 N2是氮分子 一个氮分子由两个氮原子组成 所以2mol
- 1年前
 ssukiecheng 共回答了1712个问题
ssukiecheng 共回答了1712个问题 |采纳率0.4%- 1个 N2分子里面有2个N原子
1mol N2=2mol N - 1年前
相关推荐
- ①一定条件下,N2和H2反应生成lmolNH3过程中能量变化如图所示,则1mol N2完全反应时的焓变为:__
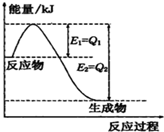 ①一定条件下,N2和H2反应生成lmolNH3过程中能量变化如图所示,则1mol N2完全反应时的焓变为:______(用含Q1、Q2的代数式表示).
①一定条件下,N2和H2反应生成lmolNH3过程中能量变化如图所示,则1mol N2完全反应时的焓变为:______(用含Q1、Q2的代数式表示).
②25℃,将a mol•L-1氨水与b mol•L-1盐酸等体积混合,使溶液显中性,则c(NH4+)______c(Cl-)(填“>”、“<”或“=”);
用含a、b的代数式表示该混合溶液中氨水的电离平衡常数K=b×10−7 a−b .b×10−7 a−b  孤独的花朵1年前1
孤独的花朵1年前1 -
 丁丁张 共回答了11个问题
丁丁张 共回答了11个问题 |采纳率90.9%解题思路:①Q1和Q2分别代表反应物和生成物的活化能,焓变等于反应物的活化能减去生成物的活化能;
②将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,根据k=
计算.[NH4+]•[OH−] [NH3•H2O] ①由图可知,N2和H2反应生成1molNH3的焓变为(Q1-Q2)kJ,该反应的热化学反应方程式为N2(g)+3H2(g)⇌2NH3(g)△H=2(Q1-Q2)kJ•mol-1,
所以1mol N2完全反应生成2molNH3时的焓变为△H=2(Q1-Q2)kJ•mol-1,故答案为:△H=2(Q1-Q2)kJ•mol-1;
(2)将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,
溶液中c(NH4+)=c(Cl-)=[b/2]mol/L,混合后反应前c(NH3•H2O)=[a/2]ol/L,则反应后c(NH3•H2O)=([a/2]-[b/2])mol/L,
则k=
[NH4+]•[OH−]
[NH3•H2O]=
b
2×10−7
a
2−
b
2=
b×10−7
a−b,
故答案为:=;
b×10−7
a−b.点评:
本题考点: 反应热和焓变;弱电解质在水溶液中的电离平衡.
考点点评: 本题考查了热化学方程式书写,弱电解质电离平衡的计算应用,沉淀溶解平衡的分析判断,题目难度中等.1年前查看全部
- 1MOL N2与3MOL H2反应放热92KJ,为什么1MOL N2与4MOL H2反应放热一定小于92KJ?
 娃哈哈l2981年前1
娃哈哈l2981年前1 -
 个园 共回答了18个问题
个园 共回答了18个问题 |采纳率94.4%可逆反应,1molN2不能完全反应.1年前查看全部
- 一定温度下,在固定容积、体积为2L 的密闭容器中充入1mol N2 和3mol
一定温度下,在固定容积、体积为2L 的密闭容器中充入1mol N2 和3mol H2 发生反应,当反应进行到10s 末时反应达到平衡,此时容器中c(NH3)=0.1mol•L-1.下列有关判断不正确的是( )
A. 反应达平衡时N2的转化率为10%
B. 该反应达到平衡时,N2的平衡浓度为0.45 mol•L-1
C. 该反应达到平衡时的压强是起始压强的0.95 倍
D. 反应进行到10 s末时,消耗 H2的平均反应速率是 0.03 mol•(L•s)-1 raoyujie1年前1
raoyujie1年前1 -
 言咏春 共回答了24个问题
言咏春 共回答了24个问题 |采纳率87.5%解题思路:依据化学平衡的三段式列式计算,
A、平衡转化率等于消耗量除以起始量;
B、依据三段式计算N2的平衡浓度;
C、一定条件下气体压强之比等于物质的量之比;
D、反应速率与化学计量数成正比,根据氨气的反应速率计算出氢气的反应速率.达到平衡时氨气的物质的量为:n(NH3)=0.1mol•L-1×2L=0.2mol,
N2 +3H2 =2NH3
起始量(mol) 1 3 0
变化量(mol)0.1 0.3 0.2
平衡量(mol)0.9 2.7 0.2
A、反应达平衡时N2的转化率=[0.1mol/1mol]×100%=10%,故A正确;
B、该反应达到平衡时,N2的平衡浓度=[0.9mol/2L]=0.45 mol/L,故B正确;
C、该反应达到平衡时的压强和起始时压强之比等于气体物质的量之比,则(0.9+2.7+0.2):(1+3)=0.95,故C正确;
D、应进行到10 s末时,氨气的反应速率为:v(NH3)=[0.1mol/L/10s]=0.01mol•(L•s)-1 ,H2的平均反应速率为:v(H2)=[3/2]v(NH3)=0.015mol•(L•s)-1 ,故D错误;
故选D.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查了化学平衡的基本计算方法,题目难度中等,主要考查了反应物的转化率、化学反应速率、平衡浓度、压强之比等于物质的量之比,试题侧重对学生灵活运用基础知识解决实际问题的能力的培养.1年前查看全部
- 在一密闭容器下,并保持温度不变,发生反应:H2(g)+I2(g)=2HI(g) 保持容积不变的情况下,加入1mol N2
在一密闭容器下,并保持温度不变,发生反应:H2(g)+I2(g)=2HI(g) 保持容积不变的情况下,加入1mol N2...
在一密闭容器下,并保持温度不变,发生反应:H2(g)+I2(g)=2HI(g)
保持容积不变的情况下,加入1mol N2.
增加了不反应的气体不等于减少了容积,增大了压强吗?那么是否可当作增加反应物浓度? wzj0071年前1
wzj0071年前1 -
 芜月 共回答了16个问题
芜月 共回答了16个问题 |采纳率93.8%不是,“参加反应气体压强”是指气体分压,举例来说就是你所说的 H2在HI,I2,H2这三种气体总体积的比例,因此,反应气体的压强只会因为直接改变容积(即拉伸反应容器)或充入参加反应气体而改变.超字数了请上网查1年前查看全部
- 1L密闭容器中加入1MOL N2 ,和3MOL氢气,使反应N2 + 3H2===2NH3
1L密闭容器中加入1MOL N2 ,和3MOL氢气,使反应N2 + 3H2===2NH3
达到平衡,测得平衡混合物种N2,H2,NH3的物质的量分别为M,N,Q,如果温度不变,只改变初始物质的加入量,则要求M,N,Q维持不变,则N2,H2,NH3的加入量分别用X,Y,Z表示.
当X=0.75时,Y=?Z=?
由于N原子守恒,:Z=2MOL -0.75*2
由于H原子守恒:Y=(6-3*0.5)/2
为什么这么列啊?希望说得具体点每个数值. czzcyw1年前1
czzcyw1年前1 -
 Gorillaz-blue 共回答了23个问题
Gorillaz-blue 共回答了23个问题 |采纳率87%加入1MOL N2 ,和3MOL氢气和加入2摩尔NH3是等效的.
N2 + 3H2===2NH3
1---------3-----0
N2 + 3H2===2NH3
0.75------------0.75*2=1.5
假定反应从2molNH3开始反应,有1.5摩尔转化为N2和H2,则NH3的物质的量=2-0.75*2=0.5mol
由于H原子守恒:Y=(2*3-3*0.5)/21年前查看全部
- 已知破坏各1mol N三N键,H一H键和N一H键需吸收的能量分别为946KJ,436KJ,391KJ.计算1mol N2
已知破坏各1mol N三N键,H一H键和N一H键需吸收的能量分别为946KJ,436KJ,391KJ.计算1mol N2(g),和3mol H2(g)完全转化为NH3(g)的反应热的理论值.
 wlyu001年前5
wlyu001年前5 -
 eeevcb 共回答了18个问题
eeevcb 共回答了18个问题 |采纳率94.4%焓变= I 破坏旧键吸收能量的和 I - I 形成新建释放能量的和 I (H=E1-E2,"I I" 绝对值符号) 这种说法不用考虑吸热,放热符号的问题.
=(946+3*436)- 391*6= - 92Kj/mol1年前查看全部
- 在恒温和使用催化剂的条件下,向容积可变的密闭容器中,充入3mol H2和1mol N2,反应达到平衡
在恒温和使用催化剂的条件下,向容积可变的密闭容器中,充入3mol H2和1mol N2,反应达到平衡时有a
mol NH3生成,N2的转化率为b%.
(1)若在相同条件下,向容积可变的密闭容器中充入x mol H2和y mol N2,反应达到平衡时有3a mol NH3生成,N2的转化率仍为b%,则x=______,y=______.
(2)若在相同条件下,向容积可变的密闭容器中充入x mol H2、y mol N2和z mol NH3,若达到平衡时N2的转化率仍为b%,则x、y的关系为______,z的取值范围为______.
(3)其他条件不变,向容积不变的密闭容器中充入3mol H2和1mol N2,反应达平衡时N2的转化率为c%,则b、c的大小关系是______. blueeater1年前1
blueeater1年前1 -
 toyota77 共回答了25个问题
toyota77 共回答了25个问题 |采纳率92%解题思路:(1)恒温恒压条件下,只要加入的起始的反应物的物质的量之比相同,就属于等效平衡,根据等效平衡知识计算出x、y;
(2)根据恒温恒压下的等效平衡分析x、y的关系及z的取值范围;
(3)根据在恒温恒容条件下,反应N2(g)+3H2(g)⇌2NH3(g),从起始到平衡状态时,反应的气体总物质的量减小,则压强减小分析.(1)在恒温恒压下,由于氮气的转化率相同,该反应与原反应为等效平衡,由于反应达到平衡时有3amol NH3生成,说明加入的反应物的物质的量是原反应的各物质的物质的量的3倍,即加入了3mol×3=9mol氢气、1mol×3=3mol氮气,
故答案为:9;3;
(2)在恒温恒压下,氮气的转化率相同,所以该反应达到的平衡与原平衡互为等效平衡,由于初始加入的氮气和氢气满足化学分离式1:3的关系,所以氨气的物质的量不影响氮气的转化率,只要满足z≥0即可;而氮气和氢气的物质的量必须满足1:3,即x=3y,
故答案为:x=3y;z≥0;
(3)在恒温恒容条件下,由于该反应是气体体积减小的反应,从起始到平衡状态时,反应的气体总物质的量减小,则压强减小,不利于氨气的生成,所以生成的氨气的物质的量减小,氮气的转化率减小,即b>c,
故答案为:b大于c.点评:
本题考点: 等效平衡.
考点点评: 本题考查了化学平衡的计算,题目难度中等,涉及了等效平衡的判断及应用,注意恒温恒压条件下的等效平衡的条件,试题培养了学生的分析、理解、计算能力及灵活应用所学知识的能力.1年前查看全部
- 一定条件下,1mol N2与3molH2反应:N2(g)+3H2(g)2NH3(g)的反应达到平衡时,下列判断正确的是
一定条件下,1mol N2与3molH2反应:N2(g)+3H2(g)2NH3(g)的反应达到平衡时,下列判断正确的是
A 混合气体的总物质的量保持不变 B 混合气体的平均相对分子质量为167 C混合气体中n(N2):n(H2):n(NH3)=1:3:2 D 混合气体总的物质的量为2mol
求详解 jj_dj1年前4
jj_dj1年前4 -
 sunarea 共回答了14个问题
sunarea 共回答了14个问题 |采纳率92.9%A这个反应前后气体物质的量总数不一样,反应4摩尔气体只生成2摩尔气体,所以当总物质的量不变时平衡
B167?楼主这个数有问题吧,应该是某个值,10-20左右吧,但是这个反应的程度不知道,平衡时的K不知道,无法算出反应平衡时的总物质的量,B错误
C这个选项的问题和B一样,不是平衡就是刚好反应一半,平衡可能出现在任何位置,取决于不同的反应条件,错误
D如果是D则这个反应中反应物全部生成生成物,不是可逆反应,矛盾,错误
所以选A,有疑问追问1年前查看全部
- 在 2L的密闭容器中,充入 1mol N2 和 3mol H
在 2L的密闭容器中,充入 1mol N2 和 3mol H2,在一定的条件下反应,2 分钟后达到平衡状态,相同温度下,测得平衡时混合气体的压强比反应前混合气体的压强减小了 1/10,计算:
(1)平衡时混合气体中三种气体的物质的量比为多少?
(2)N2 的转化率为多少?
(3)2分钟内,NH3 的平均反应速率为多少? 飘来飘去啊1年前0
飘来飘去啊1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2010•南京二模)(1)在一定条件下,将1mol N2与3mol H2混合于一个10L密闭容器中
(2010•南京二模)(1)在一定条件下,将1mol N2与3mol H2混合于一个10L密闭容器中,反应在不同温度下达到平稳时NH3的浓度如图1所示.其中,温度为T1时平稳混合气体中氨的体积分数为25%.
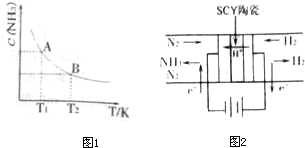
①当温度由T1变化到T2时,平稳常数KA______KB(填“>”、“<”或“=”)
②T1温度达到平衡时N2的转化率为______.
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g)此反应的△S______0(填“>”、“<”或“=”)△H______.
(已知:N2(g)+3H2(g)⇌2NH3(g)△=-92.44kJ/mol2H2(g)+O2(g)⇌2H2O(l)△H=-571.6kJ/mol)
(3)科学家采用高质子导电性的SCY陶瓷(可传递H+),实现了低温常压下高转化率的电化学合成氨,其实验原理如图2所示,则阴极的电极反应式为______. 秦文豪1年前1
秦文豪1年前1 -
 wgf889 共回答了16个问题
wgf889 共回答了16个问题 |采纳率100%解题思路:(1)①由图可知,温度越高,平衡时NH3的浓度越小,说明升高温度平衡向逆反应进行,平衡常数减小;
②令参加反应的氮气的物质的量为nmol,利用三段式用n表示处于平衡时各组分的物质的量,根据氨气的体积分数列方程计算n的值,再根据转化率定义计算;
(2)正反应气体的物质的量增大,混乱度增大;
根据盖斯定律,由已知热化学方程式构造目标热化学方程式,据此计算;
(3)阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气.(1)①由图可知,温度越高,平衡时NH3的浓度越小,说明升高温度平衡向逆反应进行,平衡常数减小,故平衡常数KA>KB,
故答案为:>;
②令参加反应的氮气的物质的量为nmol,则:
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
开始(mol):1 3 0
变化(mol):n 3n 2n
平衡(mol):1-n 3-3n 2n
所以[2n
(1−n)mol+(3−3n)mol+2nmol×100%=25%,解得n=0.4,
所以氮气的转化率为
0.4mol/1mol]×100%=40%,
故答案为:40%;
(2)正反应气体的物质的量增大,混乱度增大,故△S>0;
已知:①、N2(g)+3H2(g)⇌2NH3(g)△=-92.4kJ/mol
②、2H2(g)+O2(g)⇌2H2O(l)△H=-571.6kJ/mol
根据盖斯定律,①×2-②×3得2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g),故△H=(-92.4kJ/mol)×2-3(-571.6kJ/mol)=+1530kJ/mol
故答案为:>;+1530kJ/mol;
(3)阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气,电极反应式为N2+6e-+6H+=2NH3,
故答案为:N2+6e-+6H+=2NH3.点评:
本题考点: 物质的量或浓度随时间的变化曲线;反应热和焓变;原电池和电解池的工作原理;化学平衡的影响因素.
考点点评: 本题考查化学平衡计算、反应热计算、原电池等,难度中等,旨在考查学生对知识的掌握与运用,加强基础知识的掌握理解.1年前查看全部
- 1mol N2 可与 3mol H2完全反应生成2mol NH3 这句话不对吗
1mol N2 可与 3mol H2完全反应生成2mol NH3 这句话不对吗
有道题选了这个 说这个是错误的 为什么 chenzhubang1年前2
chenzhubang1年前2 -
 看见蜻蜓的下午 共回答了18个问题
看见蜻蜓的下午 共回答了18个问题 |采纳率77.8%因为这是一个可逆反应,反应物决不可能完全转化为产物1年前查看全部
- 分别算出1mol CO2和1mol N2的分子数、电子数、质子数、质量.
 blwxhf1年前2
blwxhf1年前2 -
 julylfish 共回答了24个问题
julylfish 共回答了24个问题 |采纳率83.3%1mol 22mol 22mol 44g (CO2)
1mol 14mol 14mol 28g (N2)1年前查看全部
- 向体积为2L的容器中加入1mol N2和6 mol H2合成氨.2min后达到平衡,测得氨气为0.6mol,氢气的反应速
向体积为2L的容器中加入1mol N2和6 mol H2合成氨.2min后达到平衡,测得氨气为0.6mol,氢气的反应速率是()
0.3mol/(L•s) 忙你的去1年前1
忙你的去1年前1 -
 风幻光 共回答了15个问题
风幻光 共回答了15个问题 |采纳率100%反应速率=变化量/时间1年前查看全部
- (1)一定条件下,N2和H2反应生成lmolNH3过程中能量变化如右图所示,则1mol N2完全反应时的焓变为
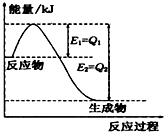 (1)一定条件下,N2和H2反应生成lmolNH3过程中能量变化如右图所示,则1mol N2完全反应时的焓变为:______(用含Q1、Q2的代数式表示).
(1)一定条件下,N2和H2反应生成lmolNH3过程中能量变化如右图所示,则1mol N2完全反应时的焓变为:______(用含Q1、Q2的代数式表示).
(2)25℃,将a mol•L-1氨水与b mol•L-1盐酸等体积混合,使溶液显中性,则c(NH4+)______c(Cl-)(填“>”、“<”或“=”);
用含a、b的代数式表示该混合溶液中氨水的电离平衡常数K=b×10−7 a−b .b×10−7 a−b
(3)25℃,向0.1L0.002mol•L-l的NaCl溶液中逐滴加入0.1L0.002mol•L-l AgNO3溶液,有白色沉淀生成,从溶度积的角度解释产生沉淀的原因______,向反应后的浊液中继续加入0.1L0.0012mol•L-1的NaI溶液,看到的现象是______,产生该现象的原因是(用离子方程式表示)______.
(已知:25℃时KSP(AgCl)=1.6×l0-10KSP(AgI)=1.5×l0-16) 小文青青1年前1
小文青青1年前1 -
 xfgjxfgj4574ff 共回答了12个问题
xfgjxfgj4574ff 共回答了12个问题 |采纳率100%解题思路:(1)由图求出N2和H2反应生成1molNH3的反应热,再根据热化学反应方程式的书写解答;
(2)将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,根据k=
计算;c(NH4+)c(OH−) c(NH3•H2O)
(3)根据Qc与Ksp的相对大小来确定有没有沉淀产生,溶解度越小越易形成沉淀.(1)由图可知,N2和H2反应生成1molNH3放出的热量为(Q1-Q2)kJ,该反应的热化学反应方程式为N2(g)+3H2(g)⇌2NH3(g)△H=-2(Q1-Q2)kJ•mol-1,
故答案为:2(Q1-Q2) kJ•mol-1;
(2)将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,
溶液中c(NH4+)=c(Cl-)=[b/2]mol/L,混合后反应前c(NH3•H2O)=[a/2]mol/L,则反应后c(NH3•H2O)=([a/2]-[b/2])mol/L,
则k=
c(NH4+)c(OH−)
c(NH3•H2O)=
b
2×10−7
a
2−
b
2=
b×10−7
a−b,
故答案为:=;
b×10−7
a−b;
(3)Qc=c(Ag+).c(Cl-)=0.001mol•L-l×0.001mol•L-l=10-6>Ksp(AgCl),所以有沉淀,KSP(AgCl)>KSP(AgI)沉淀转化,所以AgCl会转化为AgI,白色沉淀转化为黄色沉淀,离子反应为AgCl(s)+I-(aq)=AgI(s)+Cl-(aq),
故答案为:c(Ag+).c(Cl-)>Ksp(AgCl);白色沉淀转化为黄色沉淀;AgCl(s)+I-(aq)=AgI(s)+Cl-(aq).点评:
本题考点: 反应热和焓变;弱电解质在水溶液中的电离平衡;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了热化学方程式书写,弱电解质电离平衡的计算应用,沉淀溶解平衡的分析判断,题目难度中等.1年前查看全部
- (1)已知在298K、101kPa的条件下,3mol H2和1mol N2恰好完全反应,生成2mol
(1)已知在298K、101kPa的条件下,3mol H2和1mol N2恰好完全反应,生成2mol NH3,同时放出92.2kJ的热量.在298K、101kPa的条件下,将6mol H2和2mol N2混合使其充分发生化学反应,反应放出的热量(填“>”“=”“<”)______2×92.2kJ,作出判断的理由是______.
(2)下列说法中,可以证明反应N2+3H2⇌2NH3已达到平衡状态的是______
A.1个N≡N 键断裂的同时,有3个H-H键形成
B.1个N≡N 键断裂的同时,有3个H-H键断裂
C.1个N≡N 键断裂的同时,有6个N-H键断裂
D.1个N≡N 键断裂的同时,有6个H-H键形成. 轻浊1年前1
轻浊1年前1 -
 liushuhaha 共回答了16个问题
liushuhaha 共回答了16个问题 |采纳率93.8%解题思路:(1)合成氨反应是可逆反应,反应物不能完全转化为生成物;
(2)从化学键的角度判断平衡状态时,注意正逆反应速率相等,即不同反应物化学键断裂与形成速率相等,反应物与生成物化学键断裂速率相同或形成速率相同.(1)合成氨是可逆反应,6mol H2和2mol N2不可能完全反应,所以,放热少于2×92.2kJ,故答案为:<;N2与H2合成NH3的反应是可逆反应;
(2)A、1个N≡N 键断裂的同时,有3个H-H键形成,说明正逆反应速率相等,故A正确;
B、1个N≡N 键断裂的同时,有3个H-H键断裂,都是正反应速率,故B错误;
C、1个N≡N 键断裂的同时,有6个N-H键断裂,说明正逆反应速率相等,故C正确;
D、1个N≡N 键断裂的同时,有6个H-H键形成,都是正反应速率,故D错误;
故选:AC.点评:
本题考点: 反应热和焓变;化学平衡状态的判断.
考点点评: 本题考查了可逆反应的反应热、平衡状态的判断,题目难度不大.1年前查看全部
- NaNO2和NH4CL 制N2,生成1mol N2时转移3mol电由是什么意思,是哪一个内容的?
 塞外落日1年前2
塞外落日1年前2 -
 weewew21 共回答了16个问题
weewew21 共回答了16个问题 |采纳率100%这是一个归中反应,+3价的N从-3价中的N得到电子,从而生成N2,是氮族元素的内容1年前查看全部
- 积为1L的容器中加入1mol N2和6mol H2进行可逆反应:N2+3H2 2NH3,2min后测得N2的物质的量为0
积为1L的容器中加入1mol N2和6mol H2进行可逆反应:N2+3H2 2NH3,2min后测得N2的物质的量为0.6mol,则:⑴用三段式法填写各物质的反应改变量和2min末的物质的量
⑵求v(NH3) 010630401年前0
010630401年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在密闭容器内,使1mol N2 3mol H2混合发生下列反应:3H2+N2⇌2NH3 △
在密闭容器内,使1mol N2 3mol H2混合发生下列反应:3H2+N2⇌2NH3 △H<0
(1)当反应达到平衡时,N2和H2的浓度比是______.
(2)保持体积不变,升高温度时,混合气体的平均相对分子是质量______,密度______.(填增大、减少或不变,第3~6题填“正向”、“逆向”或“不”)
(3)当达到平衡时,充入Ar气,并保持体积不变,平衡将______移动.
(4)当达到平衡时,充入Ar气,并保持压强不变,平衡将______移动.
(5)当达到平衡时,充入NH3气,并保持压强不变,平衡将______移动.
(6)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡将______移动. 拆客客1年前2
拆客客1年前2 -
 hhddt123 共回答了18个问题
hhddt123 共回答了18个问题 |采纳率83.3%解题思路:(1)根据加入氨气与氢气的物质的量之比为1:3等于方程计量数之比,结合方程式分析;
(2)升高温平衡逆移,据此判断平均相对分子质量和密度的变化;
(3)恒温恒容容器,加入Ar气,总压增大,分压不变,平衡不动;
(4)恒温恒压容器,充入Ar气,容器体积增大,保持压强不变,平衡逆向进行;
(5)当达到平衡时,充入NH3气,平衡逆移;
(6)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,相当于增大压强,平衡正向进行.(1)已知加入的1mol N2 3mol H2,氨气与氢气的物质的量之比为1:3等于方程计量数之比,反应转化的氨气与氢气的物质的量之比为1:3,所以平衡时氨气与氢气的物质的量之比为1:3,故答案为:1:3;
(2)升高温平衡逆移,气体的物质的量增大,质量不变,所以平均相对分子质量减小;气体体积不变,质量守恒,所以密度不变,故答案为:减小;不变;
(3)恒温恒容容器,加入Ar气,总压增大,分压不变,平衡不动,故答案为:不;
(4)恒温恒压容器,充入Ar气,容器体积增大,保持压强不变,平衡逆向进行,故答案为:逆向;
(5)当达到平衡时,充入NH3气,平衡逆移;故答案为:逆向;
(6)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,相当于增大压强平衡向计量数减小的方向,即平衡正向进行.
故答案为:正向.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查了化学平衡的影响因素分析判断,反应特征和容器特征的分析应用时解题关键,题目难度中等.1年前查看全部
- (2013•潍坊模拟)(1)恒温下,向一个2L的密闭容器中充入1mol N2和2.6mol H2,反
 (2013•潍坊模拟)(1)恒温下,向一个2L的密闭容器中充入1mol N2和2.6mol H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
(2013•潍坊模拟)(1)恒温下,向一个2L的密闭容器中充入1mol N2和2.6mol H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
此条件下,该反应达到化学平衡时,氮气的浓度为______,平衡常数K=______.时间/min 5 10 15 20 25 30 C(N3H)/(mol/L) 0.08 0.14 0.18 0.20 0.20 0.20
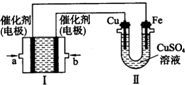
(2)如图,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜.
①b处电极上发生的电极反应式是______.
②电镀结束后,装置Ⅰ中溶液的pH______,装置Ⅱ中Cu2+的物质的量浓度______.(填“变大”“变小”或“不变”)
③若完全反应后,装置Ⅱ中阴极质量增加12.8g,则装置I中理论上消耗甲烷______L(标准状况下). 爱ww你的温柔1年前1
爱ww你的温柔1年前1 -
 zhangfish123 共回答了15个问题
zhangfish123 共回答了15个问题 |采纳率93.3%解题思路:(1)依据图表数据判断平衡时氨气浓度为0.20mol/L,结合起始量,利用活性平衡三段式列式计算平衡浓度,根据平衡常数概念用生成物平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积计算平衡常数;
(2)图Ⅰ为原电池,为甲烷燃烧电池,燃料甲烷做原电池负极反应物失电子发生氧化反应,图Ⅱ为电解池,铁棒镀铜,推断铁做电解池阴极,铜做电解池阳极;a为原电池负极,b为原电池正极;
①b处是氧气得到电子发生的电极反应;
②原电池反应是碱性溶液中进行消耗氢氧根生成水,溶液PH减小;装置Ⅱ是电镀阳极电极反应可知,铜离子浓度不变;
③依据原电池和电解池中电子守恒计算消耗甲烷的体积;(1)图表数据判断平衡时氨气浓度为0.20mol/L,物质的量为0.20mol/L×2L=0.40mol,结合起始量,利用活性平衡三段式列式计算平衡浓度
N2+3H2=2NH3
起始量(mol) 1 2.6 0
变化量(mol)0.2 0.60.4
平衡量(mol)0.82 0.4
得到平衡后物质浓度c(N2)=0.4mol/L;c(H2)=1molL,c(NH3)=0.2mol/L
K=
c2(NH3)
c3(H2)c(N2)=
0.22
0.4×13=0.1(L/mol)2,
故答案为:0.4mol/L;0.1(L/mol)2;
(2)图Ⅰ为原电池,为甲烷燃烧电池,燃料甲烷做原电池负极反应物失电子发生氧化反应,图Ⅱ为电解池,铁棒镀铜,推断铁做电解池阴极,铜做电解池阳极;a为原电池负极,b为原电池正极;
①b处是氧气得到电子发生的电极反应;电极反应为:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
②原电池反应是碱性溶液中进行消耗氢氧根生成水,溶液PH减小;装置Ⅱ是电镀阳极电极反应可知,阳极电极反应为:Cu-2e-=Cu2+,阴极电极反应为:Cu2++2e-=Cu,铜离子浓度不变;
故答案为:减小,不变;
③装置Ⅱ中阴极电极反应为Cu2++2e-=Cu,质量增加12.8g为铜物质的量为0.2mol,转移电子为0.4mol,装置I中负极电极反应为:CH4+10OH--8e-=CO32-+7H2O理论上消耗甲烷物质的量为:0,05mol,标准状况下的体积=0.05mol×22.4L/mol=1.12L;
故答案为:1.12;点评:
本题考点: 化学平衡的计算;化学电源新型电池.
考点点评: 本题考查化学平衡的判断,化学平衡的三段式计算应用,平衡常数概念的计算应用,原电池、电解池原理的计算应用和电极书写方法,题目难度中等.1年前查看全部
- 一定温度下,在固定容积、体积为2L 的密闭容器中充入1mol N2 和3mol
一定温度下,在固定容积、体积为2L 的密闭容器中充入1mol N2 和3mol H2 发生反应,当反应进行到10s 末时反应达到平衡,此时容器中c(NH3)=0.1mol•L-1.下列有关判断不正确的是( )
A. 反应达平衡时N2的转化率为10%
B. 该反应达到平衡时,N2的平衡浓度为0.45 mol•L-1
C. 该反应达到平衡时的压强是起始压强的0.95 倍
D. 反应进行到10 s末时,消耗 H2的平均反应速率是 0.03 mol•(L•s)-1 blue_shine_y1年前1
blue_shine_y1年前1 -
 sirius09 共回答了21个问题
sirius09 共回答了21个问题 |采纳率85.7%解题思路:依据化学平衡的三段式列式计算,
A、平衡转化率等于消耗量除以起始量;
B、依据三段式计算N2的平衡浓度;
C、一定条件下气体压强之比等于物质的量之比;
D、反应速率与化学计量数成正比,根据氨气的反应速率计算出氢气的反应速率.达到平衡时氨气的物质的量为:n(NH3)=0.1mol•L-1×2L=0.2mol,
N2 +3H2 =2NH3
起始量(mol) 1 3 0
变化量(mol)0.1 0.3 0.2
平衡量(mol)0.9 2.7 0.2
A、反应达平衡时N2的转化率=[0.1mol/1mol]×100%=10%,故A正确;
B、该反应达到平衡时,N2的平衡浓度=[0.9mol/2L]=0.45 mol/L,故B正确;
C、该反应达到平衡时的压强和起始时压强之比等于气体物质的量之比,则(0.9+2.7+0.2):(1+3)=0.95,故C正确;
D、应进行到10 s末时,氨气的反应速率为:v(NH3)=[0.1mol/L/10s]=0.01mol•(L•s)-1 ,H2的平均反应速率为:v(H2)=[3/2]v(NH3)=0.015mol•(L•s)-1 ,故D错误;
故选D.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查了化学平衡的基本计算方法,题目难度中等,主要考查了反应物的转化率、化学反应速率、平衡浓度、压强之比等于物质的量之比,试题侧重对学生灵活运用基础知识解决实际问题的能力的培养.1年前查看全部
- 3H2+N2=NH3 (可逆反应),先通入1mol N2,3molH2.将达到平衡后的 反应物和生成物的浓度都X2,问反
3H2+N2=NH3 (可逆反应),先通入1mol N2,3molH2.将达到平衡后的 反应物和生成物的浓度都X2,问反应怎样移
求 解析. 咆哮狼1年前1
咆哮狼1年前1 -
 皇家狮鹫 共回答了21个问题
皇家狮鹫 共回答了21个问题 |采纳率90.5%理想气体状态方程PV=nRT(压强*体积=物质的量*常数*开尔文温度),得到P=cRT,就是反应物和生成物浓度同时增加一倍,压强必定增加一倍,平衡向合成氨的方向移动1年前查看全部
- 题目是这样的:在2L的密闭容器中充入1mol N2 和3mol H2 ,在一定的条件下反应,2分钟后达到平衡状态,相同温
题目是这样的:
在2L的密闭容器中充入1mol N2 和3mol H2 ,在一定的条件下反应,2分钟后达到平衡状态,相同温度下,测得平衡时混合气体的压强比反应前混合气体的压强减小了 1/10 ,填写下列空白:
(1)平衡时混合气体中三种气体的物质的量的比为______.
(2)N2 的转化率为_______.
(3)2分钟内,NH3 的平均反应速率为________.
请把空填一下,过了今天晚上就关闭问题~ 魔罗王子1年前1
魔罗王子1年前1 -
 puer520 共回答了21个问题
puer520 共回答了21个问题 |采纳率100%1,N2:H2:NH3=0.8:2.4:0.4
2,20%
3,0.2 mol/min
反应式(设N2反应了x mol):
N2+3H2=2NH3
x 3x 2x
方程式:反应之后压强减小了1/10
4-(x+3x)+2x=4×(1-0.1)
解得x=0.2
即反应了0.2的N2,0.6的H2,得到了0.4的NH3
此时容器里剩0.8molN2,2.4molH2,0.4mol NH31年前查看全部
- 现向一密闭容器中充入1mol N2与3molH2 ,在一定条件下反应,达到化学平衡时,N2与H2物质的量浓度之比1:3,
现向一密闭容器中充入1mol N2与3molH2 ,在一定条件下反应,达到化学平衡时,N2与H2物质的量浓度之比1:3,
讲明白就好,量浓度不是等于物质的量除以体积吗,无质量之比还等于速率之比,我觉得是1:3,可答案不选这个. wangpeng2791年前1
wangpeng2791年前1 -
 jslxt 共回答了16个问题
jslxt 共回答了16个问题 |采纳率100%化学平衡?就是反应物和生成物共存,正反应速率等于逆反应速率从而达到化学平衡,并不是完全反应只有生成物而是反应物和生成物共存,所以是小于1:3.1年前查看全部
- 在一密闭容器下,并保持温度不变,发生反应:H2(g)+I2(g)=2HI(g) 保持容积不变的情况下,加入1mol N2
在一密闭容器下,并保持温度不变,发生反应:H2(g)+I2(g)=2HI(g) 保持容积不变的情况下,加入1mol N2...
在一密闭容器下,并保持温度不变,发生反应:H2(g)+I2(g)=2HI(g)
保持容积不变的情况下,加入1mol N2.
请问反应速率如何变化? 清月竹韵1年前1
清月竹韵1年前1 -
 zzz5102 共回答了29个问题
zzz5102 共回答了29个问题 |采纳率82.8%氮气是惰性的,不参与反应.
对于反应物来说,温度不变,浓度不变(体积不变),分子碰撞反应的几率是一样的,因此反应速率也不变.1年前查看全部
大家在问
- 1初二物理捏、高手帮一下咯.将电阻R1和R2分别接入某电压下,其功率分别为P1=15W,P2=10W,若将R1,R2串联后
- 2李大钊先生的文章《今》中的最后一句话 "宇宙即我 我即宇宙"大概是什么思想?什么意义?
- 3三班以后怎么办 作文
- 4读了精卫填海,你有什么感受?一个小时后就要要,
- 5课时特训 练习七内容义务的
- 6小华5分之1小时行了8分之3千米,他每小时行( )千米 行一千米需要( )小时
- 7平面镜M1和M2的夹角为60度,物点S在角平分线上经过这两块平面镜所成的清晰像共有几个?
- 8怎么做才算是关心班集体?
- 9一.解释画线的词语:1 施八尺屏障 2.但闻屏障中抚尺一下 3.宾客意稍舒 4.曳屋许许声 5.众宾团坐 6.妇抚儿
- 10已知:如图△ABC,AB=AC,∠C=30°,AB垂直于AD=4cm.求BC的长.
- 11Did your brother go to America last year No,___.
- 12请问英语中主语、谓语、宾语、定语、表语各是什么意思
- 13爬山虎是怎样一脚一脚的往上爬
- 14一种电视机,减去定价的百分之五卖出,可得360元利润,按七五折卖出,就会亏损160元,这种电视机的进价是
- 15植物根尖细胞中均能转录与翻译的场所有细胞核和线粒体,这句话为什么是错的
