圣路易斯大学研制的新型乙醇燃料电池,用能传递质子(H+)的介质作溶剂,反应为C2H5OH+3O2→2CO2+3H2O,如
 不解的心结2022-10-04 11:39:541条回答
不解的心结2022-10-04 11:39:541条回答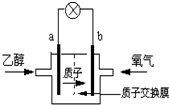 圣路易斯大学研制的新型乙醇燃料电池,用能传递质子(H+)的介质作溶剂,反应为C2H5OH+3O2→2CO2+3H2O,如图是该电池的示意图,下列说法正确的是( )
圣路易斯大学研制的新型乙醇燃料电池,用能传递质子(H+)的介质作溶剂,反应为C2H5OH+3O2→2CO2+3H2O,如图是该电池的示意图,下列说法正确的是( )A.a极为电池的正极
B.电池正极的电极反应为:4H++O2+4e-═2H2O
C.电池工作时电流由a极沿导线经灯泡再到b极
D.电池工作时,1mol乙醇被氧化时就有6 mol电子转移

已提交,审核后显示!提交回复
共1条回复
 细细砂砾 共回答了15个问题
细细砂砾 共回答了15个问题 |采纳率93.3%- 解题思路:由质子的移动方向可知a为负极,a极上是乙醇失电子发生氧化反应,乙醇被氧化生成CO2和H+,电极反应式为C2H5OH+3H2O-12e-═2CO2+12H+,b为正极,发生还原反应,电极方程式为4H++O2+4e-═2H2O,以此解答该题.
A.原电池工作时,阳离子向正极移动,则a为负极,故A错误;
B.正极氧气得到电子被还原,电极反应式为4H++O2+4e-=2H2O,故B正确;
C.电池工作时,电流由正极经外电路流向负极,在该电池中由b极流向a极,故C错误;
D.乙醇中C元素的化合价为-2价,被氧化后升高到+4价,则电池工作时,1mol乙醇被氧化时就有12mol电子转移,故D错误.
故选B.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池知识,为高考常见题型和高频考点,侧重于学生的分析能力的考查,本题注意把握根据电池总反应书写电极方程式的方法,难度不大. - 1年前
相关推荐
大家在问
- 1氯化钠溶于水形成溶液,如果氯化钠分散在汽油中,形成的分散系是( )
- 2下列各句中,加点的成语使用不恰当的一项是
- 3英语翻译只写英语
- 4英语翻译我家附近的那个公园真是个有趣的去处注意真是一定要翻出来
- 5谁懂英语的进来看看吧.一、中英互译1.穿白色短裙的女孩 | 2.一些年轻的女服务员 | 3.在7:05 | 4.在周末
- 6选修4-4:坐标系与参数方程:已知点P(x,y)在椭圆x216+y212=1上,试求z=2x−3y的最大值.
- 7(2012•资阳)抛物线y=[1/4x2+x+m的顶点在直线y=x+3上,过点F(-2,2)的直线交该抛物线于点M、N两
- 815:()=()/20=五分之三=()%=()折
- 9数不清的前一句歇后语
- 10Let her play it还是Let her plays it
- 11be concerned with sb.是与某人有关吗?介词with可以换成in吗
- 12把.climb翻译成汉语怎么写
- 13求一篇写景的300字作文
- 14某次试验中,测得两个变量v和m的对应数据如下表,则v和m之间的关系最接近下列函数中的( ).
- 15小敏和小金想估测一段铁路长,但由于合适的直尺所以不能如愿以偿,学习了声学的知识后他们想到了方法
