在110~130这21个数中,将所有奇数的十位与个位之间加一个小数点;再将所有偶数的百 位与十位之间加一个小数点,经变换
 hanMM1302022-10-04 11:39:541条回答
hanMM1302022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 六日六夜 共回答了20个问题
六日六夜 共回答了20个问题 |采纳率90%- S奇=111+...+129=(111+129)[(129-111)/2+1]/2=240x10/2=1200
S偶=110+...+130=(110+130)[(130-110)/2+1]/2=240x11/2=1320
将所有奇数的十位与个位之间加一个小数点,即是除以10,得120;再将所有偶数的百 位与十位之间加一个小数点,即是除以100,得13.2
经变换后的21个数之和是多少120+13.2=133.2 - 1年前
相关推荐
- 利用如图所示实验装置可以测定一定条件下1mol气体的体积.图中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线.将一
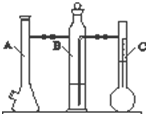 利用如图所示实验装置可以测定一定条件下1mol气体的体积.图中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线.将一定质量的镁带和过量的稀硫酸在仪器A瓶中完全反应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H2的体积.
利用如图所示实验装置可以测定一定条件下1mol气体的体积.图中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线.将一定质量的镁带和过量的稀硫酸在仪器A瓶中完全反应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H2的体积.
实验步骤:
①装配好化学反应气体体积测定仪,作气密性检查.
②用砂纸擦去镁带表面的氧化物,然后称取0.100~0.110g的镁带,把数据记录于表格中.
③取下A瓶加料口的橡皮塞,用小烧杯加入20mL水,再把已称量的镁带加到A瓶的底部,用橡皮塞塞紧加料口.
④用注射器从A瓶加料口处抽气,使B瓶导管内外液面持平.
⑤用注射器吸取10mL 3mol/L硫酸,用针头扎进A瓶加料口橡皮塞,将硫酸注入A瓶,注入后迅速拔出针头.
⑥当镁带完全反应后,读取C瓶中液体的体积,把数据记录于表格.
⑦用注射器从A瓶加料口处抽气,使B瓶中导管内外液面持平,记录抽出气体的体积,把数据记录于表格.
重复上述操作进行第二次实验,避免偶然误差.
根据上述实验方法回答下列问题:
实验室温度:25℃;压强:101kPa.该条件下1mol氢气体积的理论值为24.5L.
(1)连接装置及气密性检查:当A瓶加料口塞上橡胶塞,______
可以确认装置气密性合格.
(2)B中所装液体一般是______(填“水”或“品红”).
A中发生反应的离子方程式为______.
(3)实验数据如下:温度:25℃(镁元素的相对原子质量为24.3)
①上表中x=______;实验
次数m(Mg)/g 硫酸体
积/mL液体量瓶中
液体体积/mL抽出气体
体积/mL氢气体
积/mL计算1mol
氢气体积/L1 0.100 10.0 110.0 6.5 x 2 0.115 10.0 121.0 8.0
②计算1mol氢气体积:两次实验的平均值=______L;
③计算实验误差:[实验值−理论值/理论值]×100%=______;
④引起该误差的可能原因是______(填字母).
A.镁带中含有跟硫酸不反应的杂质
B.没有除去镁带表面的氧化镁
C.镁带中含有杂质铝
D.所用稀硫酸不足量. liutianxy1年前1
liutianxy1年前1 -
 九天九纵 共回答了9个问题
九天九纵 共回答了9个问题 |采纳率88.9%解题思路:(1)装置气密性可以利用装置内气体压强变化和液面变化分析判断装置气密性;
(2)利用品红溶液呈红色便于观察液面调整,A中是镁和硫酸反应生成硫酸镁和氢气,依据产物写出离子方程式;
(3)①依据实验步骤分析,加入的硫酸溶液体积也计算在量气瓶中的液体体积,反应后抽出的气体体积调整液面平衡,所以需要在气体体积中加入抽出气体的体积;
②依据实验的数据计算两次体积平均值;
③依据实验误差计算公式和计算得到的数据计算;
④A、镁带中含有跟硫酸不反应的杂质,对反应生成氢气量减少,体积偏小;
B、镁条表面的氧化物没有除,部分氧化物和硫酸反应而没有气体生成,会导致气体体积偏小;
C、镁带中含有少量的铝,相同质量的镁和铝,铝生成的氢气多,所以会导致气体体积偏大;
D、所用稀硫酸不足量,镁条不能全部反应,生成氢气减小,体积偏小;(1)当A瓶加料口塞上橡胶塞,微热,储液瓶(B瓶)内导管中液面会上升,观察上升液面在一段时间内无明显下降,证明装置气密性完好;
故答案为:储液瓶(B瓶)内导管中液面会上升,观察上升液面在一段时间内无明显下降;
(2)品红溶液呈红色,比水更直观观察液面变化;装置中的反应是镁和硫酸反应生成硫酸镁和氢气的反应,反应离子方程式为:Mg+2H+═Mg2++H2↑;
故答案为:品红;Mg+2H+═Mg2++H2↑;
(3)①实验步骤分析,加入的硫酸溶液体积也计算在量气瓶中的液体体积,反应后抽出的气体体积调整液面平衡,所以需要在气体体积中加入抽出气体的体积;
图表数据分析气体体积X=110mL-10mL+6.5mL=106.5mL;
故答案为:106.5;
②实验1测定体积为106.5mL,计算得到1mol氢气的体积=[0.1065L×24.3g/mol/0.100g]×1mol=25.9L;实验2测定氢气的体积=121mL-10mL+8mL=119mL,计算得到1mol氢气的体积=[0.119L×24.3g/mol/0.115g]×1mol=25.1L;两次测定的平均值=[25.9+25.1/2]=25.5L
故答案为:25.5;
③实验误差=[实验值−理论值/理论值]×100%=[25.5−24.5/24.5]×100%=4.08%
故答案为:4.08%;
④实际测得1mol氢气的体积为25.5L,理论上为22.4L,则实际上偏大,
A、镁带中含有跟硫酸不反应的杂质,对反应生成氢气量减少,体积偏小,故A错误;
B、镁条表面的氧化物没有除,部分氧化物和硫酸反应而没有气体生成,会导致气体体积偏小,故B错误;
C、镁带中含有少量的铝,相同质量的镁和铝,铝生成的氢气多,所以会导致气体体积偏大,故C正确;
D、所用稀硫酸不足量,镁条不能全部反应,生成氢气减小,体积偏小,故D错误;
故答案为:C.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查了探究物质的组成或测量物质的含量的实验设计,主要是测定物质氢气体积的方法和步骤,数值换算和数据应用,误差分析判断的依据,注意表格中数据的计算应用,题目难度中等.1年前查看全部
大家在问
- 1110~130这21个数中,在所有单数的十位数与个位数之间加上一个小数点,如117变为11.7
- 2英语翻译解释wear out
- 315分请教个英语问题but this did not prove to be a problem. 上面这个句子助动词d
- 4几的平方怎么算(如:11×11≡121 12×12=144.)照这样算,从19往下算到30,该咋算?thang kou
- 5在一次英语口语比赛中,小明,小伟,小亮三人的平均分是90分,小明和小伟的平均成绩比小亮的成绩多3分,他
- 6紫牡丹多少一条!
- 70.65六五折谁更大
- 8下列说法不正确的是A 空间中,一组对边平行且相等的四边形一定是平行四边形D过一条直线有且只有一个平面与已知平面垂直为什么
- 9家门连续两次被写上"9"字,本人女生,独自生活一段时间了.前几天回家发现门上被油笔写上了个"9"字,因为写在春联上,我就
- 10英语翻译企业可以非常好的和客户进行互动,增加客户的参与感.将企业的最新产品动态发布给客户,这种轻量级的产品发布方式,可以
- 11从100到127,在所有奇数的各位和十位间点上小数点,在所有偶数的白位和十位之间点上小数点.求经过变化后所有数字之和是多
- 12在上下放置的双缝干涉实验中,若把下面一条缝封闭,并将一平面反射镜(镜面向上平放在两缝的垂直平分线上,
- 13欲看到人体的全身像,平面反射镜尺寸至少多大?如何放置?镜中的像放大倍率为多少?为
- 14定义在(-1,1)上的函数f(x)满足f(x)+f(-x)=0,且在区间[0,1)上单调递减,求满足f(x-2)+f(3
- 15一辆汽车的发动机输出功率为62700W,每小时耗柴油18kg,计算发动机的热机效率
