在轻质碳酸钙的制作过程中,由氧化钙到氢氧化钙这一过程中,过滤操作的目的是什么呢?
 健身馆老板娘2022-10-04 11:39:544条回答
健身馆老板娘2022-10-04 11:39:544条回答
已提交,审核后显示!提交回复
共4条回复
 茗_zz 共回答了16个问题
茗_zz 共回答了16个问题 |采纳率93.8%- 过滤去掉不溶杂物,是为了:第一,可防止在下一步碳化结晶成核反应过程中,杂质提供晶核,影响碳酸钙粒径;第二,可防止那些不易溶解的氢氧化钙甚至烧老了的氧化钙,在碳化结束后继续溶解,造成产品返碱(PH值过高).
- 1年前
 brkh 共回答了4个问题
brkh 共回答了4个问题 |采纳率- 过滤掉未溶于水的氢氧化钙。
- 1年前
 为爱上吊 共回答了14个问题
为爱上吊 共回答了14个问题 |采纳率- 除去多余的不溶性杂质!
- 1年前
 逃离伤害 共回答了6个问题
逃离伤害 共回答了6个问题 |采纳率- 除杂,杂质可能是多余的氧化钙和其他不溶水的杂质
- 1年前
相关推荐
- 在牙膏中,常用轻质碳酸钙粉末作摩擦剂。人们通常用下列方法生产轻质碳酸钙:将石灰石煅烧制得氧化钙,再将氧化钙加水制成石灰乳
在牙膏中,常用轻质碳酸钙粉末作摩擦剂。人们通常用下列方法生产轻质碳酸钙:将石灰石煅烧制得氧化钙,再将氧化钙加水制成石灰乳[主要成份是Ca(OH)2],然后将净化后的石灰乳与二氧化碳作用得到碳酸钙。试用化学方程式表示上述反应的原理。
 玻璃心馨1年前0
玻璃心馨1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 用作牙膏摩擦剂的轻质碳酸钙可以用矿石A来制备,某化学兴趣小组设计了2种转化流程,如图所示.
用作牙膏摩擦剂的轻质碳酸钙可以用矿石A来制备,某化学兴趣小组设计了2种转化流程,如图所示.

已知:a.二氧化碳持续通入氢氧化钙溶液发生如下反应:CO2+Ca(OH)2═CaCO3↓+H2O,CaCO3+H2O+CO2═Ca(HCO3)2;
b.碳酸氢钙微溶于水,微热易分解:Ca(HCO3)2
CaCO3↓+H2O+CO2↑;微热 .
c.生石灰与水充分反应后可得到颗粒非常细小的熟石灰浆.
试填空.
(1)小王主张用流程①、②、④和操作Ⅱ的设计,认为其工艺简单.请写出反应①和④的化学方程式:
①CaCO3
CaO+CO2↑高温 .CaCO3;④______;操作Ⅱ包括______等工序.
CaO+CO2↑高温 .
(2)制轻质碳酸钙时,D为______(选填“悬浊液”或“溶液”或“乳浊液”),理由是:______.
(3)小李认为流程①、②、③和操作I比小王的主张更好,其理由是:______;操作I包括搅拌和微热等工序. 百幽灵1年前1
百幽灵1年前1 -
 岭南八家 共回答了28个问题
岭南八家 共回答了28个问题 |采纳率100%解题思路:碳酸钙能分解生成氧化钙,氧化钙能与水反应生成氢氧化钙,氢氧化钙能与二氧化碳或碳酸钠反应生成碳酸钙,生成的碳酸钙不溶于水,可以通过过滤的方法从溶液中分离出来.(1)①碳酸钙能高温分解生成氧化钙和二氧化碳,故A为碳酸钙,②生成的氧化钙与水反应生成氢氧化钙,故B为二氧化碳,C为氧化钙,生成的D为氢氧化钙,③氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,④氢氧化钙能与碳酸钠发生复分解反应生成碳酸钙和氢氧化钠,生成的碳酸钙不溶于水,可以通过过滤的方法从溶液中分离出来,所以本题答案为:CaCO3
高温
.
CaO+CO2↑,
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,过滤;
(2)氢氧化钙的颗粒细小,悬浊液更为合适,所以本题答案为:悬浊液,氢氧化钙的颗粒细小;
(3)流程①、②、③的③是将碳酸钙分解生成的二氧化碳加以利用,所以本题答案为:二氧化碳得到充分利用,节约原料.点评:
本题考点: 碳酸钙、生石灰、熟石灰之间的转化;化学实验方案设计与评价;过滤的原理、方法及其应用;悬浊液、乳浊液的概念及其与溶液的区别;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了碳酸钙、氧化钙和氢氧化钙的相互转化,完成此题,可以依据已有的知识进行.1年前查看全部
- 试用化学表达式表示反应的原理在牙膏中,常用轻质碳酸钙粉末做摩擦剂.人们通常用下列方法生产轻质碳酸钙:将石灰水煅烧制得氧化
试用化学表达式表示反应的原理
在牙膏中,常用轻质碳酸钙粉末做摩擦剂.人们通常用下列方法生产轻质碳酸钙:将石灰水煅烧制得氧化钙再制成石灰乳,然后将净化后的石灰乳与二氧化钙作用得到碳酸钙 幻觉漂移1年前1
幻觉漂移1年前1 -
 马远踏歌 共回答了27个问题
马远踏歌 共回答了27个问题 |采纳率88.9%CaCO3=高温=CaO+CO2↑
CaO+H2O=Ca(OH)2
Ca(OH)2+CO2=CaCO3↓+H2O1年前查看全部
- 轻质碳酸钙粉目数与白度有没有关系?
 我腾龙1年前1
我腾龙1年前1 -
 wyrucipingfan 共回答了13个问题
wyrucipingfan 共回答了13个问题 |采纳率92.3%在实质上是没有关系的,但在检测过程中,应为更细的钙粉做成的白饼表面吸光性更强,会影响检测值,目数更大的钙粉白度检测值会更低一点,一般只影响2个白度值以内.1年前查看全部
- (2005•溧水县模拟)一些补钙保健品中主要成分是轻质碳酸钙.以下是以石灰石为原料,设计的探究制备碳酸钙的实验方案,你认
(2005•溧水县模拟)一些补钙保健品中主要成分是轻质碳酸钙.以下是以石灰石为原料,设计的探究制备碳酸钙的实验方案,你认为其中不可行的是(部分生成物已略去)( )
A.
B.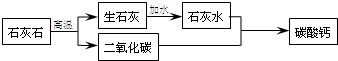
C.
D.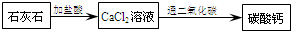
 半斗1年前1
半斗1年前1 -
 fanyuer19720303 共回答了12个问题
fanyuer19720303 共回答了12个问题 |采纳率83.3%解题思路:这道题看似很难实质上是利用我们课本上所学的知识点来解决,认真审题就变的很简单.根据我们所学的有关石灰石的性质可知,石灰石在高温煅烧后生产了氧化钙(生石灰)和二氧化碳;生石灰遇到水后变成熟石灰即氢氧化钙,它和可溶性的碳酸盐能够生成白色沉淀碳酸钙.对于以“石灰石为原料制备碳酸钙”的方法是多种的,只要紧紧抓住碳酸钙、氧化钙和氢氧化钙三种物质间的联系和各种物质的特性,方法是多种的.最熟悉的大家知道,熟石灰中通入二氧化碳会变浑浊,那么我们可以利用此反应来进行.A、石灰石不溶于水,与碳酸钠溶液不反应,故不可行;
B、生石灰能与水反应生成氢氧化钙,氢氧化钙能与二氧化碳反应生成碳酸钙和水;此做法可行;
C、石灰石与稀盐酸反应生成氯化钙,氯化钙与碳酸钠溶液反应生成碳酸钙沉淀,故可行;
D、氯化钙与二氧化碳不反应,故不可行.
故选A、D.点评:
本题考点: 碳酸钙、生石灰、熟石灰之间的转化.
考点点评: 本题将化学知识应用到生活实践中为情境考查了以氢氧化钙为轴心的物质关联起来的三角关系,要学会巧妙利用三角关系来解决问题.这是初中化学中常考的知识点,要能够知识的迁移.1年前查看全部
- (6分)用作牙膏摩擦剂的轻质碳酸钙可以用矿石A来制备,某化学兴趣小组设计了2种转化流程,如下图所示。
(6分)用作牙膏摩擦剂的轻质碳酸钙可以用矿石A来制备,某化学兴趣小组设计了2种转化流程,如下图所示。

已知:a.二氧化碳持续通入氢氧化钙溶液发生如下反应:
CO 2 +Ca(OH) 2 ===CaCO 3 ↓+H 2 O, CaCO 3 + H 2 O + CO 2 ===Ca(HCO 3 ) 2 ;
b.碳酸氢钙微溶于水,微热易分解:微热
Ca(HCO 3 ) 2 ="====" CaCO 3 ↓+H 2 O+ CO 2 ↑;
c.生石灰与水充分反应后可得到颗粒非常细小的熟石灰浆。
试填空。
(1)小王主张用流程①、②、④和操作Ⅱ的设计,认为其工艺简单。
请写出反应①和④的化学方程式:
① ▲ ;④ ▲ ;
操作Ⅱ包括 ▲ 等工序。
(2)制轻质碳酸钙时,D为 ▲ (选填“悬浊液”或“溶液”或“乳浊液”),
理由是: ▲ .
(3)小李认为流程①、②、③和操作I比小王的主张更好,其理由是:_______________
▲ ;操作I包括搅拌和微热等工序。 shebestephanie1年前1
shebestephanie1年前1 -
 zhangyunya 共回答了16个问题
zhangyunya 共回答了16个问题 |采纳率93.8%

分析:碳酸钙能分解生成氧化钙,氧化钙能与水反应生成氢氧化钙,氢氧化钙能与二氧化碳或碳酸钠反应生成碳酸钙,生成的碳酸钙不溶于水,可以通过过滤的方法从溶液中分离出来.
(1)①碳酸钙能高温分解生成氧化钙和二氧化碳,故A为碳酸钙,②生成的氧化钙与水反应生成氢氧化钙,故B为二氧化碳,C为氧化钙,生成的D为氢氧化钙,③氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,④氢氧化钙能与碳酸钠发生复分解反应生成碳酸钙和氢氧化钠,生成的碳酸钙不溶于水,可以通过过滤的方法从溶液中分离出来,所以本题答案为:CaCO 3 CaO+CO 2 ↑,
CaO+CO 2 ↑,
Ca(OH) 2 +Na 2 CO 3 =CaCO 3 ↓+2NaOH,过滤;
(2)轻质碳酸钙的颗粒细小,悬浊液更为合适,所以本题答案为:悬浊液,碳酸钙的颗粒细小;
(3)流程①、②、③的③是将碳酸钙分解生成的二氧化碳加以利用,所以本题答案为:二氧化碳得到充分利用,节约原料.1年前查看全部
- 在牙膏和一些药品中,常用轻质碳酸钙粉末做填充剂或载体.人们通常将石灰石煅成烧制得氧化钙加水制成石灰乳(主要成分是Ca(O
在牙膏和一些药品中,常用轻质碳酸钙粉末做填充剂或载体.人们通常将石灰石煅成烧制得氧化钙加水制成石灰乳(主要成分是Ca(OH)2,2在下方),然后将净化石灰乳与二氧化碳作用得到轻质碳酸钙.试用化学方程式表示上述反映的原理.
将120g石灰水放入盛有200g稀盐酸的烧杯中,恰好完全反应(杂质不反应),反应后烧杯中剩余的质量为276g,求原石灰石的纯度. 逝去岁月1年前1
逝去岁月1年前1 -
 lantian1229 共回答了18个问题
lantian1229 共回答了18个问题 |采纳率94.4%CaCO3=(煅烧)=CaO+CO2
CaO+H2O=Ca(OH)2
Ca(OH)2+CO2=CaCO3
m(CO2)=120+200-276=44g
m(CaCO3)=100g
纯度=83.3%1年前查看全部
- 轻质碳酸钙制取过程的物质转化如下:
轻质碳酸钙制取过程的物质转化如下:
大理石(碳酸钙)→氧化钙→氢氧化钙→碳酸钙→轻质碳酸钙上述过程中没有涉及的物质类别是( )A.盐 B.氧化物 C.碱 D.有机物  孤·城1年前1
孤·城1年前1 -
 囡_囡 共回答了14个问题
囡_囡 共回答了14个问题 |采纳率100%碳酸钙是由钙离子和碳酸根离子组成的化合物,属于盐;氧化钙是由钙、氧两种元素组成的化合物,属于氧化物;氢氧化钙是由钙离子和氢氧根离子组成的化合物,属于碱;
因此没有涉及的物质类别是有机物.
故选D.1年前查看全部
- 在牙膏和一些药品中,常用轻质碳酸钙粉末作填充剂或载体.人们通常将石灰石煅烧制得氧化钙,再将氧化钙加水制成石灰乳【主要成分
在牙膏和一些药品中,常用轻质碳酸钙粉末作填充剂或载体.人们通常将石灰石煅烧制得氧化钙,再将氧化钙加水制成石灰乳【主要成分是(Ca(OH)2)】,然后将净化后的石灰乳与二氧化碳作用得到碳酸钙.试用化学方程式表示上述反应的原理.
 jtgy1年前4
jtgy1年前4 -
 Batt 共回答了21个问题
Batt 共回答了21个问题 |采纳率90.5%高温
CaCo3==CaO+CO2↑
CaO+H2O==Ca(oH)2
Ca(oH)2+Co2===Caco31年前查看全部
- (2002•重庆)工业上用沉淀法生产的轻质碳酸钙是极细的粉末,是制造牙膏的原料之一.某学生设计了一种用沉淀法制备碳酸钙的
(2002•重庆)工业上用沉淀法生产的轻质碳酸钙是极细的粉末,是制造牙膏的原料之一.某学生设计了一种用沉淀法制备碳酸钙的实验方案:
石灰石
生石灰高温
石灰水加水
碳酸钙加碳酸钠溶液
(1)上述方案中还可得到的另外两种生成物是______.
(2)请你仍用石灰石为原料(其他试剂自选),设计另一种用沉淀法制备碳酸钙的实验方案,简要写出实验过程的主要步骤以及每一步反应的化学方程式.
(3)你设计的方案的优点是:______. cbpeb1年前1
cbpeb1年前1 -
 沉默的烟头 共回答了16个问题
沉默的烟头 共回答了16个问题 |采纳率100%解题思路:(1)由题中实验方案:石灰石
生石灰高温
石灰水加水
碳酸钙,可知:石灰石高温生成二氧化碳和氧化钙,石灰水和碳酸钠溶液生成碳酸钙和氢氧化钠.加碳酸钠溶液
(2)此题是利用天然矿物质石灰石来制取纯净的碳酸钙.设计实验方案:石灰石
氯化钙溶液加盐酸
碳酸钙加碳酸钠溶液
(3)根据(2)中的实验设计,解答.(1)由题中实验方案:石灰石
高温
生石灰
加水
石灰水
加碳酸钠溶液
碳酸钙,可知:
①高温分解石灰石制生石灰和二氧化碳:CaCO3
高温
.
CaO+ CO2↑
②在生石灰中加水制石灰水;CaO+H2O=Ca(OH)2
(2)设计实验方案:石灰石
加盐酸
氯化钙溶液
加碳酸钠溶液
碳酸钙
①在石灰石中加盐酸制氯化钙溶液;CaCO3+2HCl=CaCl2+H2O+CO2↑
②在氯化钙溶液中加入碳酸钠溶液制碳酸钙.CaCl2+Na2CO3=CaCO3↓+2NaCl
故答案:(1)CO2、NaOH
第一种方法:
(2)①在石灰石中加盐酸制氯化钙溶液;CaCO3+2HCl=CaCl2+H2O+CO2↑
②在氯化钙溶液中加入碳酸钠溶液制碳酸钙.CaCl2+Na2CO3=CaCO3↓+2NaCl
(3)不需要高温,节约能量
第二种方法:
(2)①高温分解石灰石制生石灰和二氧化碳;CaCO3
高温
.
CaO+ CO2↑
②在生石灰中加水制石灰水;CaO+H2O=Ca(OH)2
③把二氧化碳通入石灰水制碳酸钙.Ca(OH)2+CO2=CaCO3↓+H2O
(3)二氧化碳得以充分利用,节约原料.点评:
本题考点: 实验步骤的探究;化学实验方案设计与评价;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要①探究实验的步骤,合理的设计实验方案和评价.②正确的书写化学方程式.1年前查看全部
- (2014•济宁)轻质碳酸钙广泛应用于橡胶、塑料、油漆、水性涂料以及造纸等行业,日常生活中的牙膏也常用它作摩擦剂.目前轻
(2014•济宁)轻质碳酸钙广泛应用于橡胶、塑料、油漆、水性涂料以及造纸等行业,日常生活中的牙膏也常用它作摩擦剂.目前轻质碳酸钙的生产主要是碳化法,工艺流程如图:

请分析轻质碳酸钙的生产流程,回答下列问题:
(1)物质B的化学式为______;
(2)在A→B之间,过滤操作的目的是______;
(3)在B+C→CaCO3的过程中,应控制物质C的流量,原因是______(用化学方程式表示);
(4)生产轻质碳酸钙的方法很多请再设计一种制备方法______(用化学方程式表示). vivien07131年前1
vivien07131年前1 -
 吴下ww 共回答了18个问题
吴下ww 共回答了18个问题 |采纳率94.4%解题思路:根据已有的知识进行分析,石灰石高温能分解生成氧化钙和二氧化碳,氧化钙能与水反应生成氢氧化钙,故A是氧化钙,C是二氧化碳,B是氢氧化钙,氢氧化钙能与二氧化碳反应生成碳酸钙和水,据此解答.石灰石高温能分解生成氧化钙和二氧化碳,氧化钙能与水反应生成氢氧化钙,故A是氧化钙,C是二氧化碳,B是氢氧化钙,氢氧化钙能与二氧化碳反应生成碳酸钙和水;
(1)B是氢氧化钙,故填:Ca(OH)2;
(2)进行过滤操作能将氢氧化钙和水分离,故填:将Ca(OH)2与水分离;
(3)碳酸钙、二氧化碳和水能反应生成碳酸氢钙,故需要控制二氧化碳的流量,故填:CaCO3+CO2+H2O=Ca(HCO3)2;
(4)碳酸钠能与氯化钙反应生成碳酸钙沉淀和氯化钠,故填:Na2CO3+CaCl2=CaCO3↓+2NaCl.点评:
本题考点: 碳酸钙、生石灰、熟石灰之间的转化;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了常见物质间的转化,完成此题,可以依据物质的性质进行.1年前查看全部
- 小明购得用于食用菌种植的轻质碳酸钙,标签如下图.为测定其含钙量,小明进行的实验是:1、称取样品5g
小明购得用于食用菌种植的轻质碳酸钙,标签如下图.为测定其含钙量,小明进行的实验是:1、称取样品5g
2、加入足量7.3%的盐酸充分反应,反应的化学方程式为:CaCO3+2HCl==CaCl2+H2O+CO2
3、将所生成的全部气体除杂、干燥后,通入100g氢氧化钠浓溶液,反应后此溶液的总质量为102.2g.
(1)样品中碳酸钙的质量分数是多少?
(2)标签标示的含钙量是否正确?若不正确,应如何改正?

 树未眠1年前1
树未眠1年前1 -
 阿皓645 共回答了19个问题
阿皓645 共回答了19个问题 |采纳率89.5%CO2的质量:102.2-100=2.2g
CaCO3+2HCl==CaCl2+H2O+CO2
100 44
X 2.2
X=5g
5/5*100%=100%
不正确,含量应改为100%1年前查看全部
- 在某些牙膏中常用纯净的轻质碳酸钙粉末作摩擦剂.其生产流程是:石灰石煅烧得到生石灰,再将生石灰水洗制得石灰乳,然后向纯净的
在某些牙膏中常用纯净的轻质碳酸钙粉末作摩擦剂.其生产流程是:石灰石煅烧得到生石灰,再将生石灰水洗制得石灰乳,然后向纯净的石灰乳中通入二氧化碳就得到轻质碳酸钙粉末.某工厂现有含有氢氧化钙14.8kg的石灰乳,至少通入多少千克二氧化碳气体才能使氢氧化钙全部转化为碳酸钙沉淀?  stoneangle1年前1
stoneangle1年前1 -
 tinlinx 共回答了17个问题
tinlinx 共回答了17个问题 |采纳率82.4%设需要二氧化碳的质量为X,
CO 2 +Ca(OH) 2 ═CaCO 3 ↓+H 2 O
44 74
X 14.8kg
∴
44
74 =
x
14.8g
∴X=
14.8g×44
74 =8.8kg.
答:至少需要二氧化碳的质量为8.8kg.1年前查看全部
- 用作牙膏摩擦剂的轻质碳酸钙可以用矿石A来制备,某化学兴趣小组设计了2种转化流程,如图所示.
用作牙膏摩擦剂的轻质碳酸钙可以用矿石A来制备,某化学兴趣小组设计了2种转化流程,如图所示.
[生产流程]
[相关资料]
a.二氧化碳持续通入氢氧化钙溶液发生如下反应:
CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+H2O+CO2=Ca(HCO3)2;
b.碳酸氢钙微溶于水,微热易分解:Ca(HCO3)2
CaCO3↓+H2O+CO2↑;加热 .
c.生石灰与水充分反应后可得到颗粒非常细小的熟石灰浆.
[问题讨论]
(1)小王主张用流程①、②、④和操作Ⅱ的设计.请写出反应①和④的化学方程式:①CaCO3
CaO+CO2↑,高温 .CaCO3;④______;
CaO+CO2↑,高温 .
操作Ⅱ包括搅拌和______、洗涤、烘干等工序;该流程中,通过反应④可回收副产品______.
(2)小李认为流程①、②、③和操作I比小王的主张更好,理由是:______;
(3)制轻质碳酸钙时,D为______(选填“悬浊液”或“溶液”),理由是:______.
(4)小李认为得到的产品中可能含有杂质Ca(HCO3)2,所以操作Ⅰ包括搅拌、______和过滤、烘干等工序,以提高产率.
[产品含量测定]CaCO3含量的测定:
取20.0g产品,研成粉状后,按如图进行实验.
(5)实验步骤:
①连接好装置,检查气密性;②打开弹簧夹C,在A处缓缓通入一段时间空气;③称量F的质量;④关闭弹簧夹C,慢慢滴加稀硫酸至过量,直至D中无气泡冒出;⑤打开弹簧夹C,再次缓缓通一段时间空气;⑥称量F的质量,得前后两次质量差为8.7g.
(6)问题探究
①产品研成粉的目的______;
②B装置的作用是______;G装置的作用是______,
③若没有E装置,则测定的CaCO3的质量分数会______(填“偏大”、“偏小”、“不变”).
称量F的质量,得前后两次质量差为8.7g,可求得产品中CaCO3的质量分数为______%.
计算过程:
[总结反思]
某同学设计上述实验方案测定牙膏中钙元素的质量分数:向一定量牙膏中加入过量稀盐酸,测定生成CO2的质量,据此计算牙膏中钙元素的质量分数.小李同学认为即使排除实验仪器和操作的影响,上述测定的结果仍不一定准确,理由是______. 真理在qq的一边1年前1
真理在qq的一边1年前1 -
 aixiaoxi 共回答了20个问题
aixiaoxi 共回答了20个问题 |采纳率95%解题思路:(1)碳酸钙能分解生成氧化钙,氧化钙能与水反应生成氢氧化钙,氢氧化钙能与二氧化碳或碳酸钠反应生成碳酸钙,生成的碳酸钙不溶于水,可以通过过滤的方法从溶液中分离出来.
(2)根据物质的循环利用分析
(3)根据氢氧化钙的溶解性分析
(4)根据题中信息二氧化碳过量会生成碳酸氢钙以及碳酸氢钙微热分解的性质分析
(6)根据流程图及实验原理,要测定碳酸钙的质量分数,可测定生成的二氧化碳的质量,可利用F装置吸收二氧化碳,在吸收之前需除去二氧化碳中的水分及空气中的二氧化碳,因此要利用除去二氧化碳的空气将生成的二氧化碳全部排到F装置中.根据二氧化碳的溶解性解答.(1)①碳酸钙高温分解生成氧化钙和二氧化碳,②生成的氧化钙与水反应生成氢氧化钙,故B为二氧化碳,C为氧化钙,生成的D为氢氧化钙,③氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,④氢氧化钙能与碳酸钠发生复分解反应生成碳酸钙和氢氧化钠,生成的碳酸钙不溶于水,可以通过过滤的方法从溶液中分离出来,同时得到副产品氢氧化钠.
(2)流程①、②、③的③是将碳酸钙分解生成的二氧化碳加以利用,节约了原料.
(3)澄清石灰水中氢氧化钙浓度太小,生产效率很低.悬浊液中含有氢氧化钙较多,得到的轻质碳酸钙多.
(4)由题中信息二氧化碳持续通入氢氧化钙溶液发生如下反应:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+H2O+CO2=Ca(HCO3)2;碳酸氢钙微溶于水,微热易分Ca(HCO3)2═CaCO3↓+H2O+CO2↑可知将碳酸氢钙转化成碳酸钙可以采用微热的方法.
(6)①为增大反应物的接触面积,加快反应速率,让反应物充分反应,可将产品研成粉末;
②根据流程图装置分析,要通过测定生成的二氧化碳的质量计算碳酸钙的含量,则需将生成的二氧化碳用除去二氧化碳的空气全部排出,因此B装置的作用是除去空气中的二氧化碳;E装置是除去生成的二氧化碳中的水,F装置是吸收生成的二氧化碳,G装置的作用是防止空气中的二氧化碳进入F装置;
③若没有E装置,生成的二氧化碳气体中含有水分而使二氧化碳的质量增大,则测定的CaCO3的质量分数会偏大.
称量F的质量,得前后两次质量差为8.7g,故生成的二氧化碳的质量为8.7g
设碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 8.7g
根据[100/44=
x
8.7g]解得 x=19.77g
故碳酸钙的质量分数为:[19.77g/20g]×100%=98.86%
【总结反思】利用碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,通过所设计的方案测量完全反应产生气体二氧化碳的质量,然后根据反应的化学方程式计算参加反应碳酸钙的质量,求得牙膏中碳酸钙的质量分数;二氧化碳能溶于水,而会使测得的二氧化碳体积偏小.
故答案为:(1)CaCO3
高温
.
CaO+CO2↑,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,过滤;NaOH
(2)二氧化碳得到充分利用,节约原料(3)悬浊液,澄清石灰水中氢氧化钙浓度太小,生产效率很低.
(4)微热
(6)①增大接触面积,充分反应;
②除去空气中的二氧化碳; 防止空气中的二氧化碳进入F装置;
③偏大; 98.86;二氧化碳能溶于水.点评:
本题考点: 物质的相互转化和制备.
考点点评: 本题考查了碳酸钙、氧化钙和氢氧化钙的相互转化以及化学方程式的书写、根据化学方程式计算、判断物质的组成等方面的问题.1年前查看全部
- 下列物质不能用来治疗胃酸 1轻质碳酸钙2氢氧化镁3氢氧化铝4氢氧化钠
 千羽林1年前3
千羽林1年前3 -
 开心颜 共回答了17个问题
开心颜 共回答了17个问题 |采纳率82.4%氢氧化钠,强碱的腐蚀性极强,对胃有很大伤害1年前查看全部
- (2012•润州区二模)用作牙膏摩擦剂的轻质碳酸钙,工业上常用石灰石来制备,主要生产流程如下:
(2012•润州区二模)用作牙膏摩擦剂的轻质碳酸钙,工业上常用石灰石来制备,主要生产流程如下:
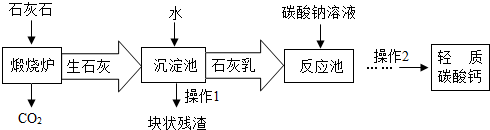
(1)投入到“反应池”中的石灰乳是混合物,属于______(选填:溶液、悬浊液或乳浊液).
(2)若在化学实验室里分离“反应池”中的混合物,该操作的名称是______.
(3)本流程图中______(物质)可以替代“碳酸钠溶液”达到降低生产成本和节能减排. 风铃呓语1年前1
风铃呓语1年前1 -
 高松真二 共回答了8个问题
高松真二 共回答了8个问题 |采纳率87.5%解题思路:(1)根据悬浊液和乳浊液的定义进行分析回答;
(2)过滤是将不溶于液体的固体分离出来的一种方法;
(3)用二氧化碳代替碳酸钠溶液,可达到降低生产成本和节能减排;(1)固体小颗粒和液体形成的不均一、不稳定的混合物就叫悬浊液,液体与液体形成的不均一、不稳定的混合物就叫乳浊液,本题中是固体小颗粒和液体形成的故为悬浊液;
(2)过滤是把不溶于溶液的固体和液体分开的一种分离混合物的方法,“反应池”中的混合物分离出生成的碳酸钙固体,可用过滤的方法;
(3)向石灰乳中通入二氧化碳,二者反应生成碳酸钙沉淀,可以替代“碳酸钠溶液”达到降低生产成本和节能减排.
故答案为(1)悬浊液; (2)过滤; (3)二氧化碳(CO2);点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;悬浊液、乳浊液的概念及其与溶液的区别;碳酸钙、生石灰、熟石灰之间的转化.
考点点评: 本题主要考查了悬浊液的定义及过滤的方法,题目较为简单.1年前查看全部
- 生产轻质碳酸钙的化学反应方程式
 biao2000lion1年前1
biao2000lion1年前1 -
 onlyzs2287 共回答了22个问题
onlyzs2287 共回答了22个问题 |采纳率95.5%CO2+Ca(OH)2===CaCO3+H2O
Na2CO3+Ca(OH)2===CaCO3+2NaOH1年前查看全部
- 化学小组为了测定某轻质碳酸钙的含钙量,进行如下实验; 1 称取样品5克 2、加入足量的7.3%稀盐酸充分反映
化学小组为了测定某轻质碳酸钙的含钙量,进行如下实验; 1 称取样品5克 2、加入足量的7.3%稀盐酸充分反映
(杂质不与酸反应) 3、将所得气体除杂干燥后,通入100克氢氧化钠溶液,反映后溶液总质量101.76克
计算 所用稀盐酸的质量
该轻质碳酸钙中钙的质量 ai7761年前1
ai7761年前1 -
 zhuliang1991 共回答了22个问题
zhuliang1991 共回答了22个问题 |采纳率100%氢氧化钠溶液质量增加的原因是吸收了二氧化碳,所以产生二氧化碳的质量=101.76g-100g=1.76g
设所用稀盐酸的质量为x 该轻质碳酸钙中钙的质量为y
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
100 73 44
y x*7.3% 1.76g
100/y=73/x*7.3%=44/1.76g
x =40g y=4g1年前查看全部
- (2013•淮北一模)林茵同学查阅资料发现用来制钙片的轻质碳酸钙常用石灰石来制备,获取碳酸钙的过程如下图,请你帮助他回答
(2013•淮北一模)林茵同学查阅资料发现用来制钙片的轻质碳酸钙常用石灰石来制备,获取碳酸钙的过程如下图,请你帮助他回答下列问题:
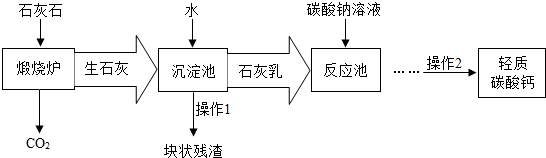
(1)石灰石属于______(填“纯净物”或“混合物”).
(2)操作1、2的名称是______;该过程中玻璃棒的作用是______.
(3)请帮助林茵写出“反应池”中发生反应的化学方程式______.
(4)上图中,整个制备过程中涉及到的基本反应类型共______种. wgbljl1年前1
wgbljl1年前1 -
 chenzai0 共回答了15个问题
chenzai0 共回答了15个问题 |采纳率80%解题思路:(1)石灰石的主要成分是碳酸钙;
(2)根据反应流程操作后的物质及过滤的原理分析,并据玻璃棒在过滤中的作用分析解答;
(3)依据氢氧化钙和碳酸钠反应原理书写方程式;
(4)分析反应流程发生的化学反应,根据反应特点分析涉及的反应类型.(1)石灰石的主要成分是碳酸钙,所以石灰石属于混合物;
(2)观察流程图可知:通过操作1将块状残值与石灰乳分离开来,通过操作2将碳酸钙沉淀和液体分离开来,说明是采用过滤的方法加以分离,过滤中玻璃棒的作用是引流;
(3)反应池中发生的是碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,方程式是:Na2CO3+Ca(OH)2═2NaOH+CaCO3↓;
(4)煅烧炉中发生的化学反应是碳酸钙高温分解生成氧化钙和二氧化碳,属于分解反应;沉淀池中发生的是氧化钙和水反应生成氢氧化钙,属于化合反应;反应池中发生的是碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,属于复分解反应,所以制备过程中涉及到的反应类型有3种;
故答案为:(1)混合物(2)过滤;引流(3)Na2CO3+Ca(OH)2═2NaOH+CaCO3↓(4)3.点评:
本题考点: 碳酸钙、生石灰、熟石灰之间的转化.
考点点评: 解答时分析清楚流程图中每步发生的化学反应,会判断纯净物、混合物,了解过滤的操作原理,判断反应类型等,才能正确解答.1年前查看全部
- (6分)轻质碳酸钙可用作牙膏摩擦剂。工业上常用石灰石(含有少量杂质)来制备比较纯净的轻质碳酸钙。
(6分)轻质碳酸钙可用作牙膏摩擦剂。工业上常用石灰石(含有少量杂质)来制备比较纯净的轻质碳酸钙。

已知:①石灰石高温煅烧可以生成生石灰和二氧化碳,此外还有少量不反应的杂质剩余。
②生石灰与水充分反应后可得到颗粒非常细小的熟石灰浆。
某实验小组同学设计了2种转化流程,如下图所示。
请回答下列问题:
(1)石灰石高温煅烧反应的化学方程式是 。
(2)物质B为 。
(3)反应④的化学方程式是 。
(4)操作Ⅱ应采用的方法是 。
(5)采用反应①②③制备轻质碳酸钙的方法优点有(写出一种即可) ;采用反应①②④制备轻质碳酸钙的方法优点有(写出一种即可) 。 爱的信息1年前1
爱的信息1年前1 -
 仙人指路315 共回答了20个问题
仙人指路315 共回答了20个问题 |采纳率90%1年前查看全部
- 轻质碳酸钙广泛应用于橡胶、塑料、油漆、水性涂料以及造纸等行业,日常生活中的牙膏也常用它作摩擦剂。目前轻质碳酸钙的生产主要
轻质碳酸钙广泛应用于橡胶、塑料、油漆、水性涂料以及造纸等行业,日常生活中的牙膏也常用它作摩擦剂。目前轻质碳酸钙的生产主要是碳化法,工艺流程见下图:

请分析轻质碳酸钙的生产流程,回答下列问题:
(1)物质B的化学式为 ;
(2)在A→B之间,过滤操作的目的是 ;
(3)在B+C→CaCO 3 的过程中,应控制物质C的流量,原因是 (用化学方程式表示);
(4)生产轻质碳酸钙的方法很多请再设计一种制备方法 (用化学方程式表示)。 ipadr1年前1
ipadr1年前1 -
 shaxliug 共回答了10个问题
shaxliug 共回答了10个问题 |采纳率90%Ca(OH) 2 ;将Ca(OH) 2 与水分离 ;CaCO 3 +CO 2 +H 2 O=Ca(HCO 3 ) 2 ; Na 2 CO 3 +CaCl 2 =CaCO 3 ↓+2NaCl
1年前查看全部
- (2006•玄武区二模)工业上用沉淀法生产的轻质碳酸钙是极细的粉末,是制造牙膏的原料之一.某学生设计了一种用沉淀法制备碳
(2006•玄武区二模)工业上用沉淀法生产的轻质碳酸钙是极细的粉末,是制造牙膏的原料之一.某学生设计了一种用沉淀法制备碳酸钙的实验方案,其流程图如下:
石灰石
生石灰高温
石灰水加水
碳酸钙加碳酸钠溶液
(1)写出上述方案中涉及的化学方程式:CaCO3
CaO+CO2↑高温 .CaCO3,______,______.
CaO+CO2↑高温 .
(2)请你仍用石灰石为原料(其他试剂自选),设计另一种用沉淀法制备碳酸钙的实验方案,用流程图简要写出实验过程的主要步骤.
(3)你设计的方案的优点是______. 2st_half_year1年前1
2st_half_year1年前1 -
 A错觉 共回答了21个问题
A错觉 共回答了21个问题 |采纳率76.2%解题思路:根据物质的性质进行分析,碳酸钙高温能分解生成氧化钙,氧化钙能与水反应生成氢氧化钙,氢氧化钙能与碳酸钠反应生成碳酸钙沉淀,氢氧化钙能与二氧化碳反应生成碳酸钙.(1)碳酸钙高温能分解生成氧化钙和二氧化碳,氧化钙能与水反应生成氢氧化钙,氢氧化钙能与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,所以本题答案为:CaCO3
高温
.
CaO+CO2↑,
CaO+H2O═Ca(OH)2,Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(2)乙石灰石为原料,高温分解生成的氧化钙与水反应生成氢氧化钙,然后向其中通入二氧化碳即可生成碳酸钙,所以本题答案为:石灰石
高温
生石灰
加水
石灰水
通入二氧化碳
碳酸钙;
(3)这样做能将石灰石分解生成的二氧化碳直接利用,节约原料,且减少了二氧化碳的排放,所以本题答案为:节约原料,减少二氧化碳的排放.点评:
本题考点: 碳酸钙、生石灰、熟石灰之间的转化;化学实验方案设计与评价;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了常见物质间的转化,完成此题,可以依据已有的物质的性质进行,要求同学们加强物质性质的识记,以便灵活应用.1年前查看全部
- 钙塑板是以高压聚乙烯、轻质碳酸钙和少量助剂为原料制成的新型家庭装饰材料,具有质轻、消声、隔热、防潮等特点。下列有关说法中
钙塑板是以高压聚乙烯、轻质碳酸钙和少量助剂为原料制成的新型家庭装饰材料,具有质轻、消声、隔热、防潮等特点。下列有关说法中错误的是 [ ]A.钙塑板是一种功能高分子材料
B.制造钙塑板时掺入的碳酸钙应该适量
C.聚乙烯是一种“白色污染”物
D.钙塑板的优点之一是可以长期接触酸性溶液而不被腐蚀 coolstar51年前1
coolstar51年前1 -
 愣呆 共回答了18个问题
愣呆 共回答了18个问题 |采纳率94.4%D1年前查看全部
- 钙塑板是具有质轻、消声、隔热、防潮等作用的新型家庭装修材料,它是以高压聚乙烯、轻质碳酸钙和少量助剂为原料制成的.下列关于
钙塑板是具有质轻、消声、隔热、防潮等作用的新型家庭装修材料,它是以高压聚乙烯、轻质碳酸钙和少量助剂为原料制成的.下列关于钙塑板说法中错误的是( )
A.钙塑板是一种功能高分子材料
B.在制造钙塑板时,为降低成本渗入大量的碳酸钙
C.钙塑板长期接触酸性溶液会降低使用寿命
D.聚乙烯是一种“白色污染”物 亮媚1年前1
亮媚1年前1 -
 jason16 共回答了24个问题
jason16 共回答了24个问题 |采纳率79.2%解题思路:A.功能高分子是一类以基本合成材料为原料、在其中添加一些特殊的物质或经过特殊的处理后具有特殊功能的高分子材料;B.制造钙塑板时掺入的碳酸钙应该适量;C.碳酸钙能与盐酸反应;D.白色污染是人们对难降解的塑料垃圾(多指塑料袋)污染环境现象的一种形象称谓.A.钙塑板是功能高分子材料,故A正确;
B.制造钙塑板时掺入的碳酸钙应该适量,过量会影响性能,故B错误;
C.碳酸钙能与盐酸反应,长期接触酸性溶液会降低使用寿命,故C正确;
D.聚乙烯是塑料,是白色污染,故D正确.
故选B.点评:
本题考点: 合成材料.
考点点评: 本题考查传统合成材料和功能高分子材料的区别,难度不大,注意基础知识的积累.1年前查看全部
- 用作牙膏摩擦剂的轻质碳酸钙可以用矿石A来制备,某化学兴趣小组设计了2种转化流程,如下图所示.
用作牙膏摩擦剂的轻质碳酸钙可以用矿石A来制备,某化学兴趣小组设计了2种转化流程,如下图所示.

资料:a.二氧化碳持续通入氢氧化钙溶液发生如下反应:CO2+Ca(OH)2═CaCO3↓+H2O,CaCO3+H2O+CO2═Ca(HCO3)2;
微热
b.碳酸氢钙溶于水,微热易分解,发生如下反应:Ca(HCO3)2═CaCO3↓+H2O+CO2↑;
c.生石灰与水充分反应后可得到颗粒非常细小的熟石灰乳.
请你分析上面的转化流程图及资料后,回答下列问题:
(1)制轻质碳酸钙时,D常用的是悬浊液.理由是:______.
(2)小王主张用流程①、②、④和操作Ⅱ的设计,认为其工艺简单.请写出反应④的化学方程式:______.
(3)小李认为流程①、②、③和操作I比小王的主张更好,其理由是:
其一:______.
其二:______. 春华落尽凌云笔1年前1
春华落尽凌云笔1年前1 -
 恨无缘 共回答了14个问题
恨无缘 共回答了14个问题 |采纳率78.6%解题思路:(1)根据氢氧化钙的溶解度进行分析;
(2)根据题中的叙述找出反应物、生成物书写方程式;
(3)根据两个流程中的反应物和生成物的成本和危害进行分析.(1)生石灰与水充分反应后可得到颗粒非常细小的熟石灰乳,氢氧化钙的溶解度相当小,不制成悬浊液,会使生产效率相当低,故答案为:澄清石灰水中氢氧化钙浓度太小,生产效率很低;(2)氧化钙C和水会生成氢氧化钙D,...
点评:
本题考点: 物质的相互转化和制备;物质除杂或净化的探究;化学实验方案设计与评价;书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,首先分析流程图中各步试剂的作用和反应物生成物的成分,然后结合学过的知识进行分析.1年前查看全部
- 用作牙膏摩擦剂的轻质碳酸钙可以用矿石A来制备,某化学兴趣小组设计了2种转化流程,如下图所示.
用作牙膏摩擦剂的轻质碳酸钙可以用矿石A来制备,某化学兴趣小组设计了2种转化流程,如下图所示.

已知:a.二氧化碳持续通入氢氧化钙溶液发生如下反应:CO2+Ca(OH)2═CaCO3↓+H2O,CaCO3+H2O+CO2═Ca(HCO3)2;
b.碳酸氢钙微溶于水,微热易分解:Ca(HCO3)2
CaCO3↓+H2O+CO2↑;微热 .
c.生石灰与水充分反应后可得到颗粒非常细小的熟石灰浆.
试填空.
(1)小王主张用流程①、②、④和操作Ⅱ的设计,认为其工艺简单.
请写出反应④的化学方程式:______;操作Ⅱ包括______等工序.
(2)制轻质碳酸钙时,D为______(选填“悬浊液”或“溶液”或“乳浊液”),理由是:______;
(3)小李认为流程①、②、③和操作I比小王的主张更好,其理由是:______;操作I包括搅拌和微热等工序. 醉尘埃1年前1
醉尘埃1年前1 -
 翅膀- 共回答了21个问题
翅膀- 共回答了21个问题 |采纳率90.5%解题思路:碳酸钙能分解生成氧化钙,氧化钙能与水反应生成氢氧化钙,氢氧化钙能与二氧化碳或碳酸钠反应生成碳酸钙,生成的碳酸钙不溶于水,可以通过过滤的方法从溶液中分离出来.(1)氢氧化钙能与碳酸钠发生复分解反应生成碳酸钙和氢氧化钠,反应的化学方程式:Ca(OH)2+Na2CO3═2NaOH+CaCO3↓;生成的碳酸钙不溶于水,可以通过搅拌、过滤的方法从溶液中分离出来;
(2)轻质碳酸钙的颗粒非常细小,悬浊液更为合适,故填:悬浊液,氢氧化钙的颗粒非常细小;
(3)流程①、②、③和操作I比小王的主张更好,是因为将碳酸钙分解生成的二氧化碳可以回收利用,不但使生产成本降低,而且有利于节能减排.
故答案为:(1)Ca(OH)2+Na2CO3═2NaOH+CaCO3↓;搅拌、过滤;
(2)悬浊液、氢氧化钙的颗粒非常细小;
(3)回收利用二氧化碳,不但使生产成本降低,而且有利于节能减排.点评:
本题考点: 碳酸钙、生石灰、熟石灰之间的转化;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了碳酸钙、氧化钙和氢氧化钙的相互转化,完成此题,可以依据已有的知识进行.1年前查看全部
- 石灰石 盐酸 纯碱 怎么生成 轻质碳酸钙
 tunnyhu1年前1
tunnyhu1年前1 -
 碧姬1 共回答了15个问题
碧姬1 共回答了15个问题 |采纳率86.7%先用盐酸和石灰石反应得到氯化钙,再把氯化钙与纯碱反应就得到碳酸钙沉淀,最后将所得碳酸钙沉淀过滤,干燥,就能得到轻质碳酸钙粉末.1年前查看全部
- 用在橡胶上,重质碳酸钙和轻质碳酸钙哪个好,为什么?
用在橡胶上,重质碳酸钙和轻质碳酸钙哪个好,为什么?
还有,用于印刷的话,是哪种碳酸钙好? 大盘客1年前2
大盘客1年前2 -
 MARGARITA_ICE 共回答了19个问题
MARGARITA_ICE 共回答了19个问题 |采纳率100%用于橡胶行业是轻质碳酸钙好,因为其分散性能好,比表面积大些.
用于印刷就是重质的好.压分量.1年前查看全部
- 用作牙膏摩擦剂的轻质碳酸钙,工业上常用石灰石来制备,主要生产流程如下: ① 在“煅烧炉
用作牙膏摩擦剂的轻质碳酸钙,工业上常用石灰石来制备,主要生产流程如下: 
① 在“煅烧炉”中发生反应的化学方程式是____________。
② 在“沉淀池”中生石灰与水反应的化学方程式是____________。
③ 投入到“反应池”中的石灰乳是不均一、不稳定的混合物,属于___________(选填:溶液、悬浊液或乳浊液)。
④ 若在化学实验室里分离“反应池”中的混合物,该操作的名称是 ____________ 。
⑤ 本流程图中___________(物质)可以替代“碳酸钠溶液”达到降低生产成本和节能减排。 683315851年前1
683315851年前1 -
 可可和果果的糖糖 共回答了17个问题
可可和果果的糖糖 共回答了17个问题 |采纳率100%1年前查看全部
- (2012•镇江二模)用作牙膏摩擦剂的轻质碳酸钙可以用矿石A来制备,某化学兴趣小组设计了2种转化流程,如图所示.
(2012•镇江二模)用作牙膏摩擦剂的轻质碳酸钙可以用矿石A来制备,某化学兴趣小组设计了2种转化流程,如图所示.
【生产流程】
【相关资料】
a.二氧化碳持续通入氢氧化钙溶液发生如下反应:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+H2O+CO2=Ca(HCO3)2;
b.碳酸氢钙微溶于水,微热易分解:Ca(HCO3)2═CaCO3↓+H2O+CO2↑;
c.生石灰与水充分反应后可得到颗粒非常细小的熟石灰浆.
【问题讨论】
(1)小王主张用流程①、②、④和操作Ⅱ的设计.请写出反应①和④的化学方程式:①CaCO3
CaO+CO2↑高温 .CaCO3;④______;
CaO+CO2↑高温 .
操作Ⅱ包括搅拌和______、洗涤、烘干等工序;该流程中,通过反应④可回收副产品______.
(2)小李认为流程①、②、③和操作I比小王的主张更好,理由是:______;
(3)制轻质碳酸钙时,D为______(选填“悬浊液”或“溶液”),理由是:______.
(4)小李认为得到的产品中可能含有杂质Ca(HCO3)2,所以操作Ⅰ包括搅拌、______和过滤、烘干等工序,以提高产率.
【产品含量测定】CaCO3含量的测定:
取20.0g产品,研成粉状后,按下图进行实验.
(5)实验步骤:
①连接好装置,检查气密性;②打开弹簧夹C,在A处缓缓通入一段时间空气;
③称量F的质量;④关闭弹簧夹C,慢慢滴加稀盐酸至过量,直至D中无气泡冒出;
⑤打开弹簧夹C,再次缓缓通一段时间空气;⑥称量F的质量,得前后两次质量差为8.7g.
(6)问题探究
①产品研成粉的目的______;
②B装置的作用是______;G装置的作用是______;
③若没有E装置,则测定的CaCO3的质量分数会______(填“偏大”、“偏小”、“不变”).
称量F的质量,得前后两次质量差为8.7g,可求得产品中CaCO3的质量分数为______%.
计算过程:
【总结反思】
某同学设计上述实验方案测定牙膏中钙元素的质量分数:向一定量牙膏中加入过量稀盐酸,测定生成CO2的质量,据此计算牙膏中钙元素的质量分数.小李同学认为即使排除实验仪器和操作的影响,上述测定的结果仍不一定准确,理由是______. starformore1年前1
starformore1年前1 -
 lufang0130 共回答了14个问题
lufang0130 共回答了14个问题 |采纳率100%解题思路:(1)碳酸钙能分解生成氧化钙,氧化钙能与水反应生成氢氧化钙,氢氧化钙能与二氧化碳或碳酸钠反应生成碳酸钙,生成的碳酸钙不溶于水,可以通过过滤的方法从溶液中分离出来.
(2)根据物质的循环利用分析
(3)根据氢氧化钙的溶解性分析
(4)根据题中信息二氧化碳过量会生成碳酸氢钙以及碳酸氢钙微热分解的性质分析
(6)根据流程图及实验原理,要测定碳酸钙的质量分数,可测定生成的二氧化碳的质量,可利用F装置吸收二氧化碳,在吸收之前需除去二氧化碳中的水分及空气中的二氧化碳,因此要利用除去二氧化碳的空气将生成的二氧化碳全部排到F装置中.根据二氧化碳的溶解性解答.(1)①碳酸钙高温分解生成氧化钙和二氧化碳,②生成的氧化钙与水反应生成氢氧化钙,故B为二氧化碳,C为氧化钙,生成的D为氢氧化钙,③氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,④氢氧化钙能与碳酸钠发生复分解反应生成碳酸钙和氢氧化钠,生成的碳酸钙不溶于水,可以通过过滤的方法从溶液中分离出来,同时得到副产品氢氧化钠.
(2)流程①、②、③的③是将碳酸钙分解生成的二氧化碳加以利用,节约了原料.
(3)澄清石灰水中氢氧化钙浓度太小,生产效率很低.悬浊液中含有氢氧化钙较多,得到的轻质碳酸钙多.
(4)由题中信息二氧化碳持续通入氢氧化钙溶液发生如下反应:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+H2O+CO2=Ca(HCO3)2;碳酸氢钙微溶于水,微热易分Ca(HCO3)2═CaCO3↓+H2O+CO2↑可知将碳酸氢钙转化成碳酸钙可以采用微热的方法.
(6)①为增大反应物的接触面积,加快反应速率,让反应物充分反应,可将产品研成粉末;
②根据流程图装置分析,要通过测定生成的二氧化碳的质量计算碳酸钙的含量,则需将生成的二氧化碳用除去二氧化碳的空气全部排出,因此B装置的作用是除去空气中的二氧化碳;E装置是除去生成的二氧化碳中的水,F装置是吸收生成的二氧化碳,G装置的作用是防止空气中的二氧化碳进入F装置;
③若没有E装置,生成的二氧化碳气体中含有水分而使二氧化碳的质量增大,则测定的CaCO3的质量分数会偏大.
称量F的质量,得前后两次质量差为8.7g,故生成的二氧化碳的质量为8.7g
设碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 8.7g
[100/44]=[x/8.7g] x=19.77g
故碳酸钙的质量分数为:[19.77g/20g]×100%=98.86%
【总结反思】利用碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,通过所设计的方案测量完全反应产生气体二氧化碳的质量,然后根据反应的化学方程式计算参加反应碳酸钙的质量,求得牙膏中碳酸钙的质量分数;二氧化碳能溶于水,而会使测得的二氧化碳体积偏小.
故答案为:(1)CaCO3
高温
.
CaO+CO2↑,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,过滤;NaOH
(2)二氧化碳得到充分利用,节约原料(3)悬浊液,澄清石灰水中氢氧化钙浓度太小,生产效率很低.
(4)微热
(6)①增大接触面积,充分反应;
②除去空气中的二氧化碳; 防止空气中的二氧化碳进入F装置;
③偏大. 98.86%%.
二氧化碳能溶于水点评:
本题考点: 物质的相互转化和制备;悬浊液、乳浊液的概念及其与溶液的区别;碳酸钙、生石灰、熟石灰之间的转化;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了碳酸钙、氧化钙和氢氧化钙的相互转化以及化学方程式的书写、根据化学方程式计算、判断物质的组成等方面的问题.1年前查看全部
- (4分)用作牙膏摩擦剂的轻质碳酸钙,工业上常用石灰石来制备,主要生产流程如下:
(4分)用作牙膏摩擦剂的轻质碳酸钙,工业上常用石灰石来制备,主要生产流程如下:

(1)在“煅烧炉”中发生反应的化学方程式是 。
(2)在“沉淀池”中生石灰与水反应属于 反应。(填“化合”“分解”“置换”“复分解”之一)
(3)若在化学实验室里分离“反应池”中的混合物,该操作的名称是 。
(4)本流程图中 (物质)可以替代“碳酸钠溶液”达到降低生产成本和节能减排。 寻乐人1年前1
寻乐人1年前1 -
 雪儿885 共回答了23个问题
雪儿885 共回答了23个问题 |采纳率91.3%1年前查看全部
- 用作牙膏摩擦剂的轻质碳酸钙可以用矿石 A 来制备,某化学兴趣小组设计了 2 种转
用作牙膏摩擦剂的轻质碳酸钙可以用矿石 A 来制备,某化学兴趣小组设计了 2 种转化流程,如图所示.
已知:生石灰与水充分反应后可得到颗粒非常细小的熟石灰浆.
(1)小王主张用流程①、②、④和操作Ⅱ的设计,认为其工艺简单.请写出反应①和④的化学方程式:①______;④______; 操 作Ⅱ包 括______等工序.
(2)制轻质碳酸钙时,D 为______(选填“悬浊液”、“溶液”或“乳浊液”),理由是______
(3)小李认为流程①、②、③和操作Ⅰ比小王的主张更好,其理由是______;操作Ⅰ包括搅拌和微热等工序. 8jingling81年前1
8jingling81年前1 -
 oldboy1971 共回答了21个问题
oldboy1971 共回答了21个问题 |采纳率95.2%解题思路:碳酸钙能分解生成氧化钙,氧化钙能与水反应生成氢氧化钙,氢氧化钙能与二氧化碳或碳酸钠反应生成碳酸钙,生成的碳酸钙不溶于水,可以通过过滤的方法从溶液中分离出来.(1)①碳酸钙能高温分解生成氧化钙和二氧化碳,故A为碳酸钙,②生成的氧化钙与水反应生成氢氧化钙,故B为二氧化碳,C为氧化钙,生成的D为氢氧化钙,③氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,④氢氧化钙能与碳酸钠发生复分解反应生成碳酸钙和氢氧化钠,生成的碳酸钙不溶于水,可以通过过滤的方法从溶液中分离出来,故答案为:CaCO3
高温
.
CaO+CO2↑,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,搅拌、过滤;
(2)轻质碳酸钙的颗粒细小,悬浊液更为合适,故答案为:悬浊液,澄清石灰水中氢氧化钙的浓度太小,生产效率很低;
(3)流程①、②、③的③是将碳酸钙分解生成的二氧化碳加以利用.故答案为:利用产生的二氧化碳比另加碳酸钠溶液更经济,生产成本更低.点评:
本题考点: 碳酸钙、生石灰、熟石灰之间的转化;悬浊液、乳浊液的概念及其与溶液的区别;生石灰的性质与用途;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了碳酸钙、氧化钙和氢氧化钙的相互转化,完成此题需要掌握生石灰的用途以及化学方程式的书写.1年前查看全部
- (2000•安徽)在牙膏中常加入一种细微的粉末一轻质碳酸钙,以增大摩擦力,提高洁齿效果.石灰石经过煅烧、溶解、通过C02
(2000•安徽)在牙膏中常加入一种细微的粉末一轻质碳酸钙,以增大摩擦力,提高洁齿效果.石灰石经过煅烧、溶解、通过C02,过滤、干燥,就可得到轻质碳酸钙.写出制取轻质碳酸钙过程中各反应化学方程式:
(1)CaC03
CaO+C02↑高温 .CaC03.
CaO+C02↑高温 .
(2)______.
(3)______. 麦田露珠1年前1
麦田露珠1年前1 -
 微笑的丫头 共回答了25个问题
微笑的丫头 共回答了25个问题 |采纳率84%解题思路:(1)石灰石中的碳酸钙高温分解生成氧化钙;
(2)氧化钙与水化合生成氢氧化钙;
(3)氢氧化钙与二氧化碳反应生成碳酸钙.(1)石灰石中的碳酸钙高温分解生成氧化钙和二氧化碳.
该反应的化学方程式为:CaC03
高温
.
CaO+C02↑.
(2)氧化钙与水化合生成氢氧化钙.
该反应的化学方程式为:CaO+H20=Ca(OH)2.
(3)氢氧化钙与二氧化碳反应生成碳酸钙.
该反应的化学方程式为:CO2+Ca(OH)2=CaC03↓十H20.
故答案为:
(1)CaC03
高温
.
CaO+C02↑;
(2)CaO+H20=Ca(OH)2;
(3)CO2+Ca(OH)2=CaC03↓十H20.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;水的性质和应用;碱的化学性质;盐的化学性质.
考点点评: 本题主要考查化学方程式的书写,难度较大.1年前查看全部
- 用作牙膏摩擦剂的轻质碳酸钙可以石灰石来制备,工业上主要生产流程如图,请回答:
用作牙膏摩擦剂的轻质碳酸钙可以石灰石来制备,工业上主要生产流程如图,请回答:
(1)写出下列物质或主要成分的化学式:生石灰______,石灰乳______.
(2)“煅烧炉”中发生反应的化学方程式是:______.
在“反应池”中主要发生反应的化学方程式是:______.
(3)从反应池中分离出轻质碳酸钙的方法是______.
(4)有人建议在上述流程中用煅烧炉排出的CO 2 气体替代“碳酸钠溶液”,这样做的优点是:
______.(任写1点)
 爱上一个人的味道1年前1
爱上一个人的味道1年前1 -
 我是瞅瞅 共回答了15个问题
我是瞅瞅 共回答了15个问题 |采纳率86.7%(1)生石灰的化学式为:CaO;石灰乳的溶质是氢氧化钙,其化学式为:Ca(OH) 2
故答案是:CaO;Ca(OH) 2 ;
(2)煅烧炉中的反应是:石灰石经高温煅烧生成生石灰和二氧化碳,反应的化学方程式为:CaCO 3
高温
.
CaO+CO 2 ↑;
反应池中的反应是:碳酸钠与氢氧化钙发生反应,生成碳酸钙沉淀和氢氧化钠,其反应的化学方程式为:Na 2 CO 3 +Ca(OH) 2 ═CaCO 3 ↓+2NaOH;
故答案是:CaCO 3
高温
.
CaO+CO 2 ↑;Na 2 CO 3 +Ca(OH) 2 ═CaCO 3 ↓+2NaOH;
(3)过滤是把不溶于溶液的固体和液体分开的一种分离混合物的方法,“反应池”中的混合物分离出生成的碳酸钙固体,可用过滤的方法;
故答案是:过滤;
(4)用二氧化碳代替碳酸钠溶液,可达到降低生产成本和节能减排.
故答案是:原料利用率高,降低生产成本,减少温室气体CO 2 排放.(答任一点即可,合理即给分).1年前查看全部
- 轻质碳酸钙指标
 啊喔哦1年前1
啊喔哦1年前1 -
 一叶枫飘飘 共回答了16个问题
一叶枫飘飘 共回答了16个问题 |采纳率100%工业活性沉淀碳酸钙;技术指标;HG/T 2567-2006
项目 指标
一等品 合格品
主含量(以CaCo3计),%大于等于 96.0 95.0
PH值 8.0-10.0 8.0-11.0
105度下挥发物含量,% 小于等于 0.40 0.60
盐酸不溶物含量,% 小于等于 0.15 0.30
筛余物:125µm试验筛,% 小于等于 0.005 0.01
45µm试验筛,% 小于等于 0.20 0.30
铁(Fe)含量,% 小于等于 0.08 0.08
锰(Mn)含量,% 小于等于 0.006 0.008
白度,度 大于等于 92 90
吸油值,g/100g 小于等于 60 70
活化度,% 大于等于 96 901年前查看全部
- 用作牙膏摩擦剂的轻质碳酸钙可以用矿石A来制备,某化学兴趣小组设计了2种转化流程,如下图所示.
用作牙膏摩擦剂的轻质碳酸钙可以用矿石A来制备,某化学兴趣小组设计了2种转化流程,如下图所示. 
已知:a.二氧化碳持续通入氢氧化钙溶液发生如下反应:CO 2 +Ca(OH) 2 ═CaCO 3 ↓+H 2 O,CaCO 3 +H 2 O+CO 2 ═Ca(HCO 3 ) 2 ;
b.碳酸氢钙微溶于水,微热易分Ca(HCO 3 ) 2 ═CaCO 3 ↓+H 2 O+CO 2 ↑;
c.生石灰与水充分反应后可得到颗粒非常细小的熟石灰浆.
试填空.
(1)小王主张用流程①、②、④和操作Ⅱ的设计,认为其工艺简单.请写出反应①和④的化学方程式:
①______;④______;操作Ⅱ包括______等工序.
(2)制轻质碳酸钙时,D为______(选填“悬浊液”或“溶液”或“乳浊液”),理由是:______.
(3)小李认为流程①、②、③和操作I比小王的主张更好,其理由是:______;操作I包括搅拌和微热等工序. YY7_71年前1
YY7_71年前1 -
 qqlulu 共回答了23个问题
qqlulu 共回答了23个问题 |采纳率91.3%(1)①碳酸钙能高温分解生成氧化钙和二氧化碳,故A为碳酸钙,②生成的氧化钙与水反应生成氢氧化钙,故B为二氧化碳,C为氧化钙,生成的D为氢氧化钙,③氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,④氢氧化钙能与碳酸钠发生复分解反应生成碳酸钙和氢氧化钠,生成的碳酸钙不溶于水,可以通过过滤的方法从溶液中分离出来,所以本题答案为:CaCO 3
高温
.
CaO+CO 2 ↑,
Ca(OH) 2 +Na 2 CO 3 =CaCO 3 ↓+2NaOH,过滤;
(2)轻质碳酸钙的颗粒细小,悬浊液更为合适,所以本题答案为:悬浊液,碳酸钙的颗粒细小;
(3)流程①、②、③的③是将碳酸钙分解生成的二氧化碳加以利用,所以本题答案为:二氧化碳得到充分利用,节约原料.1年前查看全部
- 在牙膏和一些药品中,常用轻质碳酸钙粉末作为填充剂或载体.工业上通常将石灰石煅烧制得氧化钙,再将氧化钙加水制成石灰乳[主要
在牙膏和一些药品中,常用轻质碳酸钙粉末作为填充剂或载体.工业上通常将石灰石煅烧制得氧化钙,再将氧化钙加水制成石灰乳[主要成分是Ca(OH)2],然后将净化后的石灰乳与二氧化碳作用得到纯净的碳酸钙粉末.请用化学方程式表示上述反应的原理.
 海边季候风1年前3
海边季候风1年前3 -
 ll不耿直 共回答了21个问题
ll不耿直 共回答了21个问题 |采纳率81%解题思路:根据物质的性质进行分析,石灰石高温能分解生成氧化钙,氧化钙与水反应生成氢氧化钙,氢氧化钙能与二氧化碳反应生成碳酸钙.碳酸钙高温能分解生成氧化钙和二氧化碳,氧化钙能与水反应生成氢氧化钙,氢氧化钙能与二氧化碳反应生成碳酸钙和水,所以本题答案为:CaCO3
高温
.
CaO+CO2↑,
CaO+H2O═Ca(OH)2,CO2+Ca(OH)2═CaCO3↓+H2O.点评:
本题考点: 碳酸钙、生石灰、熟石灰之间的转化;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了常见物质的性质和有关化学方程式的书写,完成此题,可以依据应用的知识进行,要求同学们加强对化学方程式的识记,以便应用.1年前查看全部
- 在牙膏中常加入一种细微的粉末一轻质碳酸钙,以增大摩擦力,提高洁齿效果.石灰石经过煅烧、溶解、通过C0 2 ,过滤、干燥,
在牙膏中常加入一种细微的粉末一轻质碳酸钙,以增大摩擦力,提高洁齿效果.石灰石经过煅烧、溶解、通过C0 2 ,过滤、干燥,就可得到轻质碳酸钙.写出制取轻质碳酸钙过程中各反应化学方程式:
(1)______.
(2)______.
(3)______. 跟你玩到底881年前1
跟你玩到底881年前1 -
 riniqusi 共回答了19个问题
riniqusi 共回答了19个问题 |采纳率89.5%(1)石灰石中的碳酸钙高温分解生成氧化钙和二氧化碳.
该反应的化学方程式为:CaC0 3
高温
.
CaO+C0 2 ↑.
(2)氧化钙与水化合生成氢氧化钙.
该反应的化学方程式为:CaO+H 2 0=Ca(OH) 2 .
(3)氢氧化钙与二氧化碳反应生成碳酸钙.
该反应的化学方程式为:CO 2 +Ca(OH) 2 =CaC0 3 ↓十H 2 0.
故答案为:
(1)CaC0 3
高温
.
CaO+C0 2 ↑;
(2)CaO+H 2 0=Ca(OH) 2 ;
(3)CO 2 +Ca(OH) 2 =CaC0 3 ↓十H 2 0.1年前查看全部
- 用作牙膏摩擦剂的轻质碳酸钙可以用矿石A来制备,某化学兴趣小组设计了2种转化流程,如下图所示
 寻找猎物1年前2
寻找猎物1年前2 -
 SCOTLANDFOX 共回答了14个问题
SCOTLANDFOX 共回答了14个问题 |采纳率100%是不是这个- -
用作牙膏摩擦剂的轻质碳酸钙可以用矿石 A 来制备,某化学兴趣小组设计 了 2 种转化流程,如下图所示.已知:a.二氧化碳持续通入氢氧化钙溶液发生如下反应:CO2+Ca(OH)2===CaCO3↓+H2O,CaCO3+ H2O + CO2===Ca(HCO3)2; b.碳酸氢钙微溶于水,微热易分Ca(HCO3)2===== CaCO3↓+H2O+ CO2↑; c.生石灰与水充分反应后可得到颗粒非常细小的熟石灰浆.试填空.(1)小王主张用流程①、②、④和操作Ⅱ的设计,认为其工艺简单.请写出反应①和④的化学方程式:①CaCO3 高温 微热 CaO + CO2 ↑;④Ca(OH) 2 + Na2CO3 ==== CaCO 3↓+2NaOH 操作Ⅱ包括搅拌过滤等工序.(2)制轻质碳酸钙时,D 为 悬浊液 (选填“悬浊液”或“溶液”或“乳浊液”),理由是:澄清石灰水中氢氧化钙浓度太小,生产效率很低.. (3)小李认为流程①、②、③和操作 I 比小王的主张更好,其理由是:利用产生的二氧化 碳比另加碳酸钠溶液更经济,生产成本更低.若产生的二氧化碳不回收直接排放,不利于 “节 能减排”;操作 I 包括搅拌和微热等工序..1年前查看全部
- 在牙膏和一些药品中,常用轻质碳酸钙粉末作填充剂或载体.人们通常将石灰煅烧制得氧化钙,再将氧化钙加水制成石灰乳,再将净化后
在牙膏和一些药品中,常用轻质碳酸钙粉末作填充剂或载体.人们通常将石灰煅烧制得氧化钙,再将氧化钙加水制成石灰乳,再将净化后的石灰乳与二氧化碳作用得到碳酸钙.试用化学方程式表示上述反应原理
若制得50g碳酸钙粉末需净化后含杂质0.5%的石灰乳多少克 后安天方夜潭1年前2
后安天方夜潭1年前2 -
 yanmin022 共回答了19个问题
yanmin022 共回答了19个问题 |采纳率89.5%CaCO3=CaO+CO2(反应条件是高温)
CaO+H2O=Ca(OH)2
Ca(OH)2 + CO2 = CaCO3(沉淀符号)+H2O
制得50g碳酸钙粉末需净化后含杂质0.5%的石灰乳质量为X
Ca(OH)2 + CO2 = CaCO3(沉淀符号)+H2O
56 100
X*(1-0.5%) 50
X=56*50/100/(1-0.5%)=28.14g1年前查看全部
- 牙膏的配料中加入了纯度较高的轻质碳酸钙粉末,它是以石灰石为原料经过分解、化合等化学反应的过程提纯的,写出各步反应的化学方
牙膏的配料中加入了纯度较高的轻质碳酸钙粉末,它是以石灰石为原料经过分解、化合等化学反应的过程提纯的,写出各步反应的化学方程式
①
②
③ 只为你预言1年前2
只为你预言1年前2 -
 老男人了 共回答了18个问题
老男人了 共回答了18个问题 |采纳率83.3%石灰石(主要成分是碳酸钙)在高温下分解为氧化钙(生石灰)和二氧化碳,化学反应方程式为CaCO3==高温CaO+CO2↑
在生石灰里加水就得到熟石灰(氢氧化钙),化学反应方程式为CaO+H2O==Ca(OH)2
然后熟石灰(氢氧化钙)和二氧化碳反应得到碳酸钙Ca(OH)2+CO2==CaCO3↓+H2O1年前查看全部
- 横亘在我市衢江、开化、常山的千里岗山脉的岩石以石灰岩为主,石灰石储量达50亿吨,是我市制造水泥、石灰、轻质碳酸钙的主要原
横亘在我市衢江、开化、常山的千里岗山脉的岩石以石灰岩为主,石灰石储量达50亿吨,是我市制造水泥、石灰、轻质碳酸钙的主要原料来源.某校科学探究小组同学把一块从三衢山捡来的石灰石做纯度分析,进行了如下实验:取来了一些样品,并用稀盐酸200克,平均分成4份进行4次实验,结果如右表:(CaCO3+2HCL====CaCL2+H2O+CO2↑)
实验次数 1 2 3 4
加入样品质量(克) 5 10 15 20
生成CO2质量(克) 1.76 3.52 4.4 M
(1)哪几次反应中盐酸有剩余(2)上表中的M数值是多少(3)这种石灰石中碳酸钙的质量分数是多少2、3题目解释详细点 我爱你实在太累1年前1
我爱你实在太累1年前1 -
 whitebirdzr 共回答了14个问题
whitebirdzr 共回答了14个问题 |采纳率85.7%(1).第12两次有剩余.(12加入样品少---稀盐酸没有反应完---生成CO2少)
(2).数值是4.4.(hcl已经消耗完不能再产生co2)
(3).设第一次碳酸钙的质量为x 则CO2为1.76
CaCO3+2HCl=CaCl2+H2O+CO2
100 44
1.76g x
x=4g则碳酸钙的质量分数=4/5x100%=80%1年前查看全部
- 在牙膏中,常用轻质碳酸钙粉末做摩擦剂.人们通常用下列方法生产轻质碳酸钙;将石灰
在牙膏中,常用轻质碳酸钙粉末做摩擦剂.人们通常用下列方法生产轻质碳酸钙;将石灰
在牙膏中,常用轻质碳酸钙粉末做摩擦剂.人们通常用下列方法生产轻质碳酸钙;将石灰石煅烧制的氧化钙再将 氧化钙加水制成石灰乳(主要成分是Ca(OH)2),然后将净化后的石灰乳与二氧化碳作用得到碳酸钙.试用化学方程式表示上述反应. 不是文学青年1年前1
不是文学青年1年前1 -
 小刺猬 共回答了9个问题
小刺猬 共回答了9个问题 |采纳率88.9%CaCO3=高温= CaO+CO2↑
CaO + H2O === Ca(OH)2
CO2 +Ca(OH)2 ==CaCO3↓+ H201年前查看全部
- 在牙膏中,常用轻质碳酸钙粉末做摩擦剂.人们通常用下列方法生产轻质碳酸钙;将石灰石煅烧制的氧化钙,
在牙膏中,常用轻质碳酸钙粉末做摩擦剂.人们通常用下列方法生产轻质碳酸钙;将石灰石煅烧制的氧化钙,
(接上)再将 氧化钙加水制成石灰乳(主要成分是Ca(OH)2),然后将净化后的石灰乳与二氧化碳作用得到碳酸钙.试用化学方程式表示上述反应. ffnt1年前1
ffnt1年前1 -
 lxmwj75 共回答了15个问题
lxmwj75 共回答了15个问题 |采纳率93.3%1、CaCO3 =高温 =CaO + CO2↑
2、CaO + H2O =Ca(OH)2
3、Ca(OH)2 + CO2 = CaCO3 ↓+ H2O1年前查看全部
- 制取轻质碳酸钙的化学反应方程式
 minibread1年前3
minibread1年前3 -
 一夜贵族 共回答了17个问题
一夜贵族 共回答了17个问题 |采纳率88.2%大哥,是轻质碳酸钙,你这些反映是干嘛的?
这很容易,是用碳酸钠和氢氧化钙反应,生成的碳酸钙就是轻质碳酸钙!1年前查看全部
- 碳酸钙加水加二氧化碳生成什么请快轻质碳酸钙是什么?
 吐真言1年前2
吐真言1年前2 -
 乘着微风 共回答了17个问题
乘着微风 共回答了17个问题 |采纳率100%将石灰石煅烧,加水,通入二氧化碳 可生成轻质碳酸钙
没有反应条件就没的反应1年前查看全部
- 在牙膏和一些药品中,常用轻质碳酸钙粉末作为填充剂或载体.工业上通常将石灰石煅烧制得氧化钙,再将氧化钙加水制成石灰乳[主要
在牙膏和一些药品中,常用轻质碳酸钙粉末作为填充剂或载体.工业上通常将石灰石煅烧制得氧化钙,再将氧化钙加水制成石灰乳[主要成分是Ca(OH)2],然后将净化后的石灰乳与二氧化碳作用得到纯净的碳酸钙粉末.请用化学方程式表示上述反应的原理.
 ip4w1年前2
ip4w1年前2 -
 cnlilang 共回答了21个问题
cnlilang 共回答了21个问题 |采纳率81%解题思路:根据物质的性质进行分析,石灰石高温能分解生成氧化钙,氧化钙与水反应生成氢氧化钙,氢氧化钙能与二氧化碳反应生成碳酸钙.碳酸钙高温能分解生成氧化钙和二氧化碳,氧化钙能与水反应生成氢氧化钙,氢氧化钙能与二氧化碳反应生成碳酸钙和水,所以本题答案为:CaCO3
高温
.
CaO+CO2↑,
CaO+H2O═Ca(OH)2,CO2+Ca(OH)2═CaCO3↓+H2O.点评:
本题考点: 碳酸钙、生石灰、熟石灰之间的转化;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了常见物质的性质和有关化学方程式的书写,完成此题,可以依据应用的知识进行,要求同学们加强对化学方程式的识记,以便应用.1年前查看全部
- 在牙膏和一些药品中,常用轻质碳酸钙粉末作为填充剂或载体.工业上通常将石灰石煅烧制得氧化钙,再将氧化钙加水制成石灰乳[主要
在牙膏和一些药品中,常用轻质碳酸钙粉末作为填充剂或载体.工业上通常将石灰石煅烧制得氧化钙,再将氧化钙加水制成石灰乳[主要成分是Ca(OH)2],然后将净化后的石灰乳与二氧化碳作用得到纯净的碳酸钙粉末.请用化学方程式表示上述反应的原理.
 会飞的小鼠1年前2
会飞的小鼠1年前2 -
 男人的样子 共回答了17个问题
男人的样子 共回答了17个问题 |采纳率88.2%解题思路:根据物质的性质进行分析,石灰石高温能分解生成氧化钙,氧化钙与水反应生成氢氧化钙,氢氧化钙能与二氧化碳反应生成碳酸钙.碳酸钙高温能分解生成氧化钙和二氧化碳,氧化钙能与水反应生成氢氧化钙,氢氧化钙能与二氧化碳反应生成碳酸钙和水,所以本题答案为:CaCO3
高温
.
CaO+CO2↑,
CaO+H2O═Ca(OH)2,CO2+Ca(OH)2═CaCO3↓+H2O.点评:
本题考点: 碳酸钙、生石灰、熟石灰之间的转化;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了常见物质的性质和有关化学方程式的书写,完成此题,可以依据应用的知识进行,要求同学们加强对化学方程式的识记,以便应用.1年前查看全部
- (2014•江门模拟)用作牙膏摩擦剂的轻质碳酸钙可以石灰石来制备,工业上主要生产流程如图,请回答:
(2014•江门模拟)用作牙膏摩擦剂的轻质碳酸钙可以石灰石来制备,工业上主要生产流程如图,请回答:

(1)写出下列物质或主要成分的化学式:生石灰______,石灰乳______.
(2)“煅烧炉”中发生反应的化学方程式是:CaCO3
CaO+CO2↑高温 .CaCO3.
CaO+CO2↑高温 .
在“反应池”中主要发生反应的化学方程式是:______.
(3)从反应池中分离出轻质碳酸钙的方法是______.
(4)有人建议在上述流程中用煅烧炉排出的CO2气体替代“碳酸钠溶液”,这样做的优点是:
______.(任写1点) alangrant1年前1
alangrant1年前1 -
 homleelay 共回答了29个问题
homleelay 共回答了29个问题 |采纳率86.2%解题思路:(1)石灰乳中的溶质是氢氧化钙,生石灰是氧化钙的俗称,以及化学式的书写规则进行解答;
(2)碳酸钙高温煅烧生成氧化钙和二氧化碳和二氧化碳和氢氧化钙反应生成氢氧化钙沉淀和水,碳酸钠与氢氧化钙发生反应生成碳酸钙沉淀和氢氧化钠.根据书写化学方程式的步骤:写、配、注、等,正确书写化学方程式即可;
(3)过滤是将不溶于液体的固体分离出来的一种方法;
(4)用二氧化碳代替碳酸钠溶液,可达到降低生产成本和节能减排.(1)生石灰的化学式为:CaO;石灰乳的溶质是氢氧化钙,其化学式为:Ca(OH)2
故答案是:CaO;Ca(OH)2;
(2)煅烧炉中的反应是:石灰石经高温煅烧生成生石灰和二氧化碳,反应的化学方程式为:CaCO3
高温
.
CaO+CO2↑;
反应池中的反应是:碳酸钠与氢氧化钙发生反应,生成碳酸钙沉淀和氢氧化钠,其反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
故答案是:CaCO3
高温
.
CaO+CO2↑;Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(3)过滤是把不溶于溶液的固体和液体分开的一种分离混合物的方法,“反应池”中的混合物分离出生成的碳酸钙固体,可用过滤的方法;
故答案是:过滤;
(4)用二氧化碳代替碳酸钠溶液,可达到降低生产成本和节能减排.
故答案是:原料利用率高,降低生产成本,减少温室气体CO2排放.(答任一点即可,合理即给分).点评:
本题考点: 碳酸钙、生石灰、熟石灰之间的转化;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查了化学方程式的书写以及悬浊液的定义及过滤的方法,考查较为全面.1年前查看全部
大家在问
- 1(20分)读澳大利亚人口分布图,回答问题。
- 2对于做匀速圆周运动的物体,下面说法正确的是( )
- 3中文译英文我跟着你走就是了
- 4读下面的句子整理成一段通顺的话.
- 5a=2是不是代数式像a=2这样的式子是不是代数式?
- 6在0,1,2,3,4,5这六个数字所组成的没有重复数字的三位数中,其各个数字之和为9的三位数的个数为( )
- 7已知椭圆的中心在坐标原点O,焦点在x轴上,且经过点A(0,2倍根号3),离心率为2分之1,求椭圆的方程.
- 8C5H12的一氯代物有几种,怎么看
- 9in 的用法区分in可以用于现在完成时:in the past 10 years(在过去的十年中) 也可用于一般将来时,
- 10已知一个三角形是直角三角形,三条边的比是3:4:5,周长是36厘米,那么斜边上的
- 11(2010•天河区模拟)当水的温度和压强升高到某临界点以上时,水就处于一种既不同于液态,又不同于固态和气体的新的流体态-
- 12已知函数f(x)=(a-1)lnx+aX^2+1,(1)讨论
- 13阅读下面的一段文字,完成1一4题。 化学制剂 地球上生命的历史也就是生物与它们的环境相互作用的历史。动植物的形体和习
- 14who do the three family photo?怎么回答?
- 15直线ax+bx+cx=0中a.b.c是集合(-3,-2,-1,0,1,2,3)中3个不同数,该直线倾斜角是锐角,这样的直



