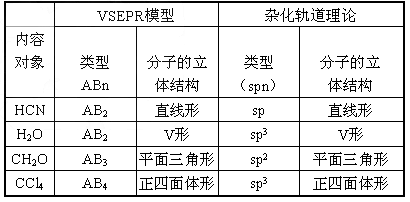
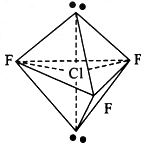
用价层电子对互斥理论预测H2S和BCl3的立体结构,两个结论都正确的是( )
 卡西高档2022-10-04 11:39:541条回答
卡西高档2022-10-04 11:39:541条回答A. 直线形;三角锥形
B. V形;三角锥形
C. 直线形;平面三角形
D. V形;平面三角形

已提交,审核后显示!提交回复
共1条回复
 待机会的小强 共回答了16个问题
待机会的小强 共回答了16个问题 |采纳率93.8%- 解题思路:价层电子对互斥理论认为:分子的立体构型是“价层电子对”相互排斥的结果.价层电子对就是指分子中的中心原子上的电子对,包括σ 键电子对和中心原子上的孤电子对;σ 键电子对数和中心原子上的孤电子对数之和就是价层电子对数,由于价层电子对的相互排斥,就可得到含有孤电子对的VSEPR模型,略去孤电子对就是该分子的空间构型.
H2S分子的中心原子S原子上含有2个σ 键,中心原子上的孤电子对数=[1/2](a-xb)=[1/2](6-2×1)=2,所以硫化氢分子的VSEPR模型是四面体型,略去孤电子对后,实际上其空间构型是V型;
BCl3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=[1/2](a-xb)=[1/2](0-3×1)=0,所以BCl3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形,
故选D.点评:
本题考点: 判断简单分子或离子的构型.
考点点评: 本题考查了分子空间构型的判断,难度不大,易错点是阴阳离子中孤电子对数的确定,注意中心原子上的孤电子对数=[1/2](a-xb),a为中心原子的价电子数,x为与中心原子结合的原子数,b为与中心原子结合的原子最多能接受的电子数. - 1年前
相关推荐
- 求解释杂化轨道理论,价层电子对互斥理论,电子配对原理,原子轨道最大重叠原理,σ键,π键
求解释杂化轨道理论,价层电子对互斥理论,电子配对原理,原子轨道最大重叠原理,σ键,π键
不要太高深,求考点 2502sk1年前2
2502sk1年前2 -
 最大考验 共回答了21个问题
最大考验 共回答了21个问题 |采纳率95.2%杂化轨道就是中心原子为了成建现将自己的能量非常接近的sp等轨道进行混杂----在与配位原子成建---这样的好处是稳定的对称几何分子构型----能量最低原理啊!
一般而言,杂化在一下情况会出现:
1、多个原子形成的分子(配合物如:【Fe(SCN)6】3-)的中心原子!一般只讲中心原子因为它是研究的核心(如上面的Fe3+就是sp3d2杂化!)!当然,非中心原子也有可能杂化(如【Fe(SCN)6】3-中SCN-中的C就是sp杂化的直线构型-S=C=N-就是)).
关于你谈的判断-个分子有大兀键?及形成大兀间的三个条件:
大兀键--就是超出了两个原子(形成的单个定域兀键)的大分子形成的离域兀键,比如苯环、己三烯、石墨等等!其形成条件就是教科书上的三原则:
1、整个分子共平面
2、又相互平行的Pz轨道(这样才可以肩并肩啊)
3、这些相互平行的P轨道中有单电子且:空的P轨道数《单电子数《2倍的空的P轨道数
这样的每秒结构式一个平面大分子中的各离域兀键渐长缩短、键能加大、分子稳定性加大:如异常稳定的石墨和苯环(所有的芳香烃)就是明证!1年前查看全部
- 价层电子对互斥理论中,价层电子和孤对电子到底是什么啊?还有空间构型和VSEPR模型的区别有哪些?
 pym57331年前1
pym57331年前1 -
 virvan 共回答了19个问题
virvan 共回答了19个问题 |采纳率94.7%价层电子是中心原子周围的所有价电子(包括配位离子的),孤对电子就是价层电子中减去成键电子后所剩余的电子,也就是不成键的电子.
空间构型是整个分子的构型,只考虑成键原子之间的空间造型.而模型仅仅考虑价层电子,即所有的成键电子和孤对电子都要算进去.1年前查看全部
- 试用价层电子对互斥理论推断下列各分子的几何构型,并用杂化轨道理论加以说明
试用价层电子对互斥理论推断下列各分子的几何构型,并用杂化轨道理论加以说明
1、SiCl4 - 2、CS2 3、BBr3 4、PF3 5、OF2 6、SO2 川西耗子1年前3
川西耗子1年前3 -
 雾中迷茫 共回答了19个问题
雾中迷茫 共回答了19个问题 |采纳率89.5%1、VP=4,LP=0,正四面体型,sp3杂化
2、VP=2,LP=0,直线型,sp杂化
3、VP=3,LP=0,正三角型,sp2杂化
4、VP=4,LP=2,V型(折线型),sp3杂化
5、VP=3,LP=1,V型,sp2杂化1年前查看全部
- 价层电子对互斥理论和杂化轨道理论怎么联系在一起啊?急求高人帮忙解答!
价层电子对互斥理论和杂化轨道理论怎么联系在一起啊?急求高人帮忙解答!
例如SOF4分子,为什么是sp3d,不是sp3d2杂化.S是中心原子,如果是sp3d2杂化,就有6个成单电子,O原子核外电子排布是1s22s22p4,有两个成单电子,F有一个成单电子,不就正好都配对吗?
但如果用价层电子互斥理论,S原子的价层电子对是5,而配位原子数也是5,类似PCl5的,所以是sp3d杂化. 云端彼海1年前2
云端彼海1年前2 -
 BeaTlesanY 共回答了19个问题
BeaTlesanY 共回答了19个问题 |采纳率100%使用杂化轨道理论时请记住,杂化轨道只能用于形成σ键(或者用于填充孤电子对),形成π键的电子只能位于未杂化的原子轨道上.这一点教材上基本都没讲过,但确实是这样.这也就是一般所说的杂化轨道“非专门研究人士难以使用”的原因.
具体到SOF4,O与S形成了双键,其中一个是π键,S中形成这个π键的电子必须位于一个未杂化的d轨道上,其他的s、p、d杂化后与O和4个F形成σ键,所以杂化方式是sp3d.
对于两个理论的联系,只要中心原子是主族元素,或者是IIB元素,都可以用价层电子对互斥理论计算价层电子对数目,进而得到杂化方式.这样降低了杂化轨道理论的应用难度.1年前查看全部
- 用价层电子对互斥理论判断SO3的分子构型( )
用价层电子对互斥理论判断SO3的分子构型( )
A.正四面体形
B.V形
C.三角锥形
D.平面三角形 ntfac5_4wz573_01年前1
ntfac5_4wz573_01年前1 -
 道常非 共回答了13个问题
道常非 共回答了13个问题 |采纳率92.3%解题思路:根据价层电子对互斥理论确定分子的空间构型,配原子个数为σ键个数,价层电子对个数=σ键个数+孤电子对个数,据此分析解答.三氧化硫分子中,中心原子硫原子最外层6个电子,外围有三个原子,所以不含有孤电子对,价层电子对个数=σ键个数+孤电子对个数=3+[1/2](6-3×2)=3,且不含孤电子对,所以三氧化硫分子为平面三角形结构,
故选D.点评:
本题考点: 判断简单分子或离子的构型.
考点点评: 本题考查了微粒空间构型的判断,根据价层电子对互斥理论来分析解答即可,该知识点为考试热点,要熟练掌握方法、技巧,难点是孤电子对个数的计算方法,题目难度不大.1年前查看全部
- 价层电子对互斥理论中中孤对电子占不占位置?能否用这个解释一下水的极性
价层电子对互斥理论中中孤对电子占不占位置?能否用这个解释一下水的极性
价层电子对互斥理论中中孤对电子占不占位置?
能否用这个解释一下水的极性 qingting9981年前1
qingting9981年前1 -
 jbfly 共回答了19个问题
jbfly 共回答了19个问题 |采纳率89.5%当然占.水中心原子O采取sp3不等性杂化,形成四条轨道,其中两条填充两对孤电子对.另外两条各一个单电子分别和H的1s轨道头碰头形成西格玛键.理论上应该是直线型,由于两对孤电子对的排斥作用把直线挤成了v型.分子不对称故水分子是极性分子1年前查看全部
- 下列说法不正确的是 A.用价层电子对互斥理论预测H 2 S和BF 3 的立体结构为:V形和平面三角形 B.分子晶体中一定
下列说法不正确的是
A.用价层电子对互斥理论预测H 2 S和BF 3 的立体结构为:V形和平面三角形 B.分子晶体中一定存在分子间作用力,不一定存在共价键 C.SiO 2 晶体中每个硅原子与两个氧原子以共价键相结合 D.CCl 2 F 2 无同分异构体,说明其中碳原子采用sp 3 方式杂化  132351年前1
132351年前1 -
 YJPYU43363 共回答了20个问题
YJPYU43363 共回答了20个问题 |采纳率80%C
答案:C
A.正确,H 2 S和BF 3 的杂化方式分别为:sp3,sp2,用价层电子对互斥理论预测H 2 S和BF 3 的立体结构为:V形和平面三角形
B.正确,分子晶体中一定存在分子间作用力,不一定存在共价键,如稀有气体分子是单原子分子,分子中不存在化学键。
C.不正确,SiO 2 晶体中每个硅原子与四个氧原子以共价键相结合
D.正确,CCl 2 F 2 无同分异构体,说明其中碳原子采用sp 3 方式杂化,是四面体结构。1年前查看全部
- 2a世纪5a年代科学家提出价层电子对互斥理论(简称VSE右R模型),用于预测简单分子立体构型.其要点可以概括为:
2a世纪5a年代科学家提出价层电子对互斥理论(简称VSE右R模型),用于预测简单分子立体构型.其要点可以概括为:
用ABn表示只含5个中心原子少分子,A为中心原子,B为与中心原子相结合少原子,m为中心原子最外层未参与成键少孤电子对,(n+m)称为价层电子对数.分子中少价层电子对总是互相排斥,均匀少分布在中心原子周围少空间…
(1)根据上述要点可以画出ABn少VSE右R理想模型,请填写下表:
(2)SO32−少立体构型为______.n+m 2 4 VSE右R理想模型 直线形 ______ 价层电子对之间少理想键角 ______ 1a9°2a′  萧扬飘雪1年前1
萧扬飘雪1年前1 -
 烸鸣 共回答了18个问题
烸鸣 共回答了18个问题 |采纳率94.4%解题思路:(1)当n+m=4时,VSEPR模型为四面体形,当n+m=2时,VSEPR模型为直线形;
(2)根据价层电子对互斥理论确定亚硫酸根离子空间构型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=[1/2](a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.(1)当n+m=4时,V我EhR模型为四面体形,其键角是109°28′,当n+m=2时,V我EhR模型为直线形,其键角是180°,
故答案为:
n+m 2 4
V我EhR理想模型 正四面体形
价层电子对之间如理想键角 180° (2)该离子中价层电子对3数=3+[1/2](6+2-3×2)=4,且含有一3孤电子对,所以V我EhR理想模型是四面体形,立体构型是1角锥形,
故答案为:1角锥形.点评:
本题考点: 判断简单分子或离子的构型.
考点点评: 本题考查了微粒空间构型的判断,根据价层电子对互斥理论来分析解答即可,明确孤电子对个数=[1/2](a-xb)中各个字母的含义,难度不大.1年前查看全部
- 价层电子对互斥理论相关问题为什么中心原子的孤电子对越多,成键电子对与成键电子对之间的斥力越小?能不能从物理受力角度帮我分
价层电子对互斥理论相关问题
为什么中心原子的孤电子对越多,成键电子对与成键电子对之间的斥力越小?
能不能从物理受力角度帮我分析下, 84885621年前2
84885621年前2 -
 dd曰 共回答了17个问题
dd曰 共回答了17个问题 |采纳率88.2%“中心原子的孤电子对越多,成键电子对与成键电子对之间的斥力越小”的说法是错的,应该是孤电子越多,成键电子对之间的斥力也越大,因为成键电子对间的距离越小了.
孤电子对由于只受一个原子(中心原子)控制,因此其扩展区域很大,与其它电子对间的作用(斥力)就很强;孤电子对越多,则孤电子对间的斥力就越强;
成键电子对受两个原子控制,因此成键电子对间的斥力相对较小;
而分子结构是达斥力达到平衡时的状态,也就是各电子对间的斥力相等;
由于成键电子对间的斥力相对孤电子对间的斥力而言相对较小,因此成键电子对间就会通过缩短距离,而孤电子对间通过增大距离,以使各电子对间的斥力相等.1年前查看全部
- 用价层电子对互斥理论推测下列分子的立体构型 BeCl2 SCl2 BF3 PF3
 4的晓得了1年前1
4的晓得了1年前1 -
 烟霞逸士 共回答了2个问题
烟霞逸士 共回答了2个问题 |采纳率直线,v形,平面正三角形,三角锥1年前查看全部
- OF2是什么杂化OF2到底是什么杂化啊?它的中心原子:C原子不是全成键了吗?按照价层电子对互斥理论-n=2,不是应该时s
OF2是什么杂化
OF2到底是什么杂化啊?
它的中心原子:C原子不是全成键了吗?按照价层电子对互斥理论-n=2,不是应该时sp杂化吗?为什么答案说是sp3杂化啊? 向导男儿1年前2
向导男儿1年前2 -
 今夜听风 共回答了20个问题
今夜听风 共回答了20个问题 |采纳率90%用那个判断公式啊,对于AXn的分子:[(A的族价-|X的化合价|·X的个数-离子的电荷数)/2 ]+n,的得数如果是2,就是sp杂化,如果是4,就是sp3杂化,对于OF2:[(6-1×2)/2]+2=4,即sp31年前查看全部
- 什么确定分子的构型?中心原子的杂化理论还是价层电子对互斥理论?
 多么好的ii11年前3
多么好的ii11年前3 -
 sandy3621233 共回答了25个问题
sandy3621233 共回答了25个问题 |采纳率96%怎么解释通,怎么好.一般用价层电子对互斥理论解释,中心原子杂化理论解释的是理想的情况(即中心原子的电子全部参与成键,没有孤对电子的情况),如果有孤对电子就要用价层电子对互斥理论解释.1年前查看全部
- 若AB n 的中心原子A上没有未用于形成共价键的孤对电子,运用价层电子对互斥理论,下列说法正确的是
若AB n 的中心原子A上没有未用于形成共价键的孤对电子,运用价层电子对互斥理论,下列说法正确的是 ()
A.若n = 2,则分子的立体结构为V形 B.若n = 3,则分子结构为三角锥形 C.若n = 4,则分子的立体结构为正四面体形 D.以上说法都不正确  chenbinnww1年前1
chenbinnww1年前1 -
 lewawa 共回答了19个问题
lewawa 共回答了19个问题 |采纳率94.7%C
若中心原子A上没有未用于成键的孤对电子,则根据斥力最小的原则,当n = 2时,分子结构为直线形;当n = 3时分子为平面三角形;当n = 4时分子结构为正四面体形。故选C。1年前查看全部
- 试确定BF3,(NH4)+,(SO3)2-,(SO4)2-,PCl5的VSEPR模型(价层电子对互斥理论)和它们的立体构
试确定BF3,(NH4)+,(SO3)2-,(SO4)2-,PCl5的VSEPR模型(价层电子对互斥理论)和它们的立体构型
《选修3——物质的结构和性质》第二章第二节…… beibeipi1年前3
beibeipi1年前3 -
 熊猫猪猪 共回答了23个问题
熊猫猪猪 共回答了23个问题 |采纳率91.3%BF3 成三个键 没有孤电子 因此平面三角形
铵根 成四个键 无孤电子对 正四面体
亚硫酸根 成三个键 得到两个电子 因此是三角锥形 像氨气
硫酸根 正四面体
五氯化磷 三角双锥 相当于平面三角形 上下各垂直一个
vsepr只有亚硫酸根不同 因为只有他有单电子 他是变形四面体 其他与实际结构相似1年前查看全部
- 关于价层电子对互斥理论的问题H2O中的O是SP3杂化的,又"因价层电子对中有2对孤对电子,所以H2O分子的空间构型为V形
关于价层电子对互斥理论的问题
H2O中的O是SP3杂化的,又"因价层电子对中有2对孤对电子,所以H2O分子的空间构型为V形",请问根据2对孤对电子是怎么判断空间构型为V形的,有什么依据,最好说的详细点 四月樱花开1年前2
四月樱花开1年前2 -
 小妖菁 共回答了17个问题
小妖菁 共回答了17个问题 |采纳率88.2%你想想,H2O公用电子对相邻的把..假如没有孤对电子是不是应该直角,但是正是由于存在孤对电子,使到90度变少了,变成了V型
注意:孤对电子的静电力比公用电子的静电力要强
还有问题可以找我1年前查看全部
- 用价层电子对互斥理论预测NH3和BF3的空间构型,结论正确的是( )
用价层电子对互斥理论预测NH3和BF3的空间构型,结论正确的是( )
A.直线形;三角锥形
B.V形;三角锥形
C.三角锥形;平面三角形
D.直线形;平面三角形 jgtyfed1年前1
jgtyfed1年前1 -
 hover0714 共回答了15个问题
hover0714 共回答了15个问题 |采纳率86.7%解题思路:价层电子对互斥理论认为:分子的立体构型是“价层电子对”相互排斥的结果.价层电子对就是指分子中的中心原子上的电子对,包括σ 键电子对和中心原子上的孤电子对;σ 键电子对数和中心原子上的孤电子对数之和就是价层电子对数,由于价层电子对的相互排斥,就可得到含有孤电子对的VSEPR模型,略去孤电子对就是该分子的空间构型.NH3分子的中心原子N原子上含有3个σ 键,中心原子上的孤电子对数=12(5-3×1)=1,所以NH3的VSEPR模型是四面体型,略去孤电子对后,其空间构型是三角锥形;BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电...
点评:
本题考点: 判断简单分子或离子的构型.
考点点评: 本题考查了分子空间构型的判断,难度不大,注意中心原子上的孤电子对数=[1/2](a-xb),a为中心原子的价电子数,x为与中心原子结合的原子数,b为与中心原子结合的原子最多能接受的电子数.1年前查看全部
- 价层电子对互斥理论的一些问题经过计算,得出的结果可能一样.比如NH3,与NF3,如此情况如何判断键角大小.我不是单纯地问
价层电子对互斥理论的一些问题
经过计算,得出的结果可能一样.
比如NH3,与NF3,
如此情况如何判断键角大小.
我不是单纯地问NH3与NF3的键角大小,而是遇到这类问题的做法
3L的,不要看不起人。
什么超出中学范围,
这个问题能提出来就已经不只是中学范围了!
你们和书上解释的好像不能有点创新吗? 凤盏馨1年前1
凤盏馨1年前1 -
 samsgenie 共回答了27个问题
samsgenie 共回答了27个问题 |采纳率96.3%NH3的H--N--H键角大于NF3的F--N--F键角,这是因为F的电负性大于N,使电子云靠近F的一边,所以在离核较近处电子云的相斥作用较小.
对于一二周期元素来说可以用上述的电负性来判断,但对于PF3和PH3来说,PF3的键角却大于PH3的键角,因为F的孤对电子可以占据P的空3d轨道形成配位键,导致离核较近处电子云密度加大,相斥作用加大.
所以还是要具体情况具体分析的,希望你能自己总结出规律.1年前查看全部
- 用价层电子对互斥理论判断SO3的分子构型( )
用价层电子对互斥理论判断SO3的分子构型( )
A. 正四面体形
B. V形
C. 三角锥形
D. 平面三角形 诗韵131年前1
诗韵131年前1 -
 79868438 共回答了17个问题
79868438 共回答了17个问题 |采纳率94.1%解题思路:根据价层电子对互斥理论确定分子的空间构型,配原子个数为σ键个数,价层电子对个数=σ键个数+孤电子对个数,据此分析解答.三氧化硫分子中,中心原子硫原子最外层6个电子,外围有三个原子,所以不含有孤电子对,价层电子对个数=σ键个数+孤电子对个数=3+[1/2](6-3×2)=3,且不含孤电子对,所以三氧化硫分子为平面三角形结构,
故选D.点评:
本题考点: 判断简单分子或离子的构型.
考点点评: 本题考查了微粒空间构型的判断,根据价层电子对互斥理论来分析解答即可,该知识点为考试热点,要熟练掌握方法、技巧,难点是孤电子对个数的计算方法,题目难度不大.1年前查看全部
- DE3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为
 zhangtingbar1年前1
zhangtingbar1年前1 -
 icu001 共回答了23个问题
icu001 共回答了23个问题 |采纳率95.7%推出的D:P,E:Cl DE3:PCl3
如果推出的元素没错的话,杂化方式应为sp3,空间构型为三角锥形1年前查看全部
- 用价层电子对互斥理论和杂化轨道理论完成下表。
 candyu21年前1
candyu21年前1 -
 Lyuke 共回答了17个问题
Lyuke 共回答了17个问题 |采纳率82.4%1年前查看全部
- 用价层电子对互斥理论判断SO 3 的分子构型( ) A.正四面
用价层电子对互斥理论判断SO 3 的分子构型()
A.正四面体形 B.V形 C.三角锥形 D.平面三角形  无愿百合1年前1
无愿百合1年前1 -
 hanjunguo2003 共回答了17个问题
hanjunguo2003 共回答了17个问题 |采纳率94.1%D
SO 3 的中心原子上的孤电子对数为0,分子的价层电子对数为3,即VSEPR模型为平面三角形。1年前查看全部
- 试用价层电子对互斥理论判断下列分子或离子的空间构型并指出其中心原子的杂化轨道类型 hgcl2 co32
试用价层电子对互斥理论判断下列分子或离子的空间构型并指出其中心原子的杂化轨道类型 hgcl2 co32
大一贾之慎的无机及分析化学的课后题目 阳光梦想阳光1年前2
阳光梦想阳光1年前2 -
 是恢复我们 共回答了16个问题
是恢复我们 共回答了16个问题 |采纳率93.8%这主要看成键电子对和孤立电子对在空间平均分布,在显示时,孤立电子对不显示.计算步骤太多我就不写了,你看例题,然后再代一下应该可以的.答案:直线形Sp杂化,三角锥形Sp3杂化,V形Sp2杂化,正四面体Sp3杂化,三角锥形Sp3杂化,T形Sp3d杂化.1年前查看全部
- 用价层电子对互斥理论预测H2S和BCl3的立体结构,两个结论都正确的是( )
用价层电子对互斥理论预测H2S和BCl3的立体结构,两个结论都正确的是( )
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形 物不平则呜1年前1
物不平则呜1年前1 -
 uhkc 共回答了24个问题
uhkc 共回答了24个问题 |采纳率87.5%解题思路:价层电子对互斥理论认为:分子的立体构型是“价层电子对”相互排斥的结果.价层电子对就是指分子中的中心原子上的电子对,包括σ 键电子对和中心原子上的孤电子对;σ 键电子对数和中心原子上的孤电子对数之和就是价层电子对数,由于价层电子对的相互排斥,就可得到含有孤电子对的VSEPR模型,略去孤电子对就是该分子的空间构型.H2S分子的中心原子S原子上含有2个σ 键,中心原子上的孤电子对数=[1/2](a-xb)=[1/2](6-2×1)=2,所以硫化氢分子的VSEPR模型是四面体型,略去孤电子对后,实际上其空间构型是V型;
BCl3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=[1/2](a-xb)=[1/2](0-3×1)=0,所以BCl3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形,
故选D.点评:
本题考点: 判断简单分子或离子的构型.
考点点评: 本题考查了分子空间构型的判断,难度不大,易错点是阴阳离子中孤电子对数的确定,注意中心原子上的孤电子对数=[1/2](a-xb),a为中心原子的价电子数,x为与中心原子结合的原子数,b为与中心原子结合的原子最多能接受的电子数.1年前查看全部
- 二氧化硫的价电子对数目怎么算?由价层电子对互斥理论,S的价电子数是6,氧族元素按不提供价电子计算,那么价电子对数=(6+
二氧化硫的价电子对数目怎么算?
由价层电子对互斥理论,S的价电子数是6,氧族元素按不提供价电子计算,那么
价电子对数=(6+0)/2=3不是平面三角形吗? 0320321101年前2
0320321101年前2 -
 ngwxr 共回答了16个问题
ngwxr 共回答了16个问题 |采纳率87.5%如果算上SO2中的那一对孤对电子,的确是平面三角形,但是我们说分子构型的时候都是忽略了孤对电子的,而只考虑带核的配体,所以SO2是V型(折线形).
希望对你有所帮助!1年前查看全部
- 根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为( )
根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为( )
A.直线形sp杂化
B.三角形sp2杂化
C.三角锥形sp2杂化
D.三角锥形sp3杂化 买高1年前1
买高1年前1 -
 flyingboss 共回答了18个问题
flyingboss 共回答了18个问题 |采纳率94.4%解题思路:根据价层电子对互斥理论确定分子空间构型及中心原子杂化方式,价层电子对个数=配原子个数+孤电子对个数.NF3分子中N原子的价层电子对个数=3+[1/2]×(5-3×1)=4,且含有一个孤电子对,所以该分子是三角锥形结构,中心原子采用sp3杂化.
故选:D.点评:
本题考点: 原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查了微粒空间构型及原子杂化方式,根据价层电子对互斥理论来分析解答即可,难点的孤电子对个数的计算方法,为常考查点,要熟练掌握.1年前查看全部
- 根据价层电子对互斥理论和杂化轨道理论,填写下表空格:
根据价层电子对互斥理论和杂化轨道理论,填写下表空格:
分子或离子 CH2O BeCl2 NH4+ CO32- 中心原子杂化轨道类型 ______ ______ ______ ______ 分子或离子的空间构型 ______ ______ ______ ______  lvkexin121年前1
lvkexin121年前1 -
 s882 共回答了21个问题
s882 共回答了21个问题 |采纳率100%解题思路:根据价层电子对互斥理论确定中心原子杂化方式及粒子的空间构型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=[1/2](a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.CH2O分子中价层电子对个数=3+[1/2](4-2×1-1×2)=3,且不含孤电子对,所以C原子为sp2杂化,空间构型为平面三角形;
BeCl2分子中价层电子对个数=2+[1/2](2-2×1)=2,且不含孤电子对,所以Be原子采用sp杂化,为直线形结构;
NH4+中价层电子对个数=4+[1/2](5-1-4×1)=4,且不含孤电子对,所以N原子采用sp3杂化,空间构型为正四面体形;
CO32-中碳原子价层电子对个数=3+[1/2](4+2-3×2)=3,且不含孤电子对,所以C原子采用sp2杂化,空间构型为平面三角形,
故答案为:
分子或离子 CH2O BeCl2 NH4+ CO32-
中心原子杂化轨道类型 sp2 sp sp3 sp2
分子或离子的空间构型 平面三角形 直线形 正四面体形 平面三角形.点评:
本题考点: 原子轨道杂化方式及杂化类型判断;判断简单分子或离子的构型.
考点点评: 本题考查了原子杂化方式的判断、粒子空间构型的判断等知识点,根据价层电子对互斥理论来分析解答即可,注意“孤电子对个数=[1/2](a-xb)”中各个字母的含义,为易错点.1年前查看全部
- 杂化轨道理论,价层电子对互斥理论,分子轨道理论三种原子理论各有什么优点和局限性?
 ss恶狼1年前1
ss恶狼1年前1 -
 好麦子 共回答了20个问题
好麦子 共回答了20个问题 |采纳率90%杂化轨道理论一般只考虑中心原子的杂化情况和σ/π键成键情况,但未考虑到配体的空间位置对其的影响;但在配体较多、空间结构复杂的情况下,杂化轨道的可选择的轨道较多,需要考虑各种组合方式,解释能力较弱.
价电子对互斥理论,考虑到了了中心原子于周围配位原子/孤对电子之间的形态,但是是基于σ键电子对和孤对电子之间的相互排斥作用,未考虑到π键的形态和配位原子对中心原子的影响,对存在多重键的多中心结构无法很好地解释.
分子轨道理论将轨道组合的范围,从杂化轨道中的中心原子扩展到了整个分子,考虑到了中心原子与配体的能级相互作用;但是其计算量较大,得到的冗余信息较多(比如配体的轨道实际上是不会和中心原子的全满的内层轨道组合的);而且基于原始原子轨道能级的排布,未考虑到中心原子事先通过轨道杂化、再组成分子轨道的可能性(或者说,需要把中心原子的轨道杂化和整个分子的轨道组合共同考虑才行).
随便写写的.1年前查看全部
- 用价层电子对互斥理论(VSEPR)判断下列分子或离子的空间构型
用价层电子对互斥理论(VSEPR)判断下列分子或离子的空间构型
①H2S:______,②ClO4-:______. melon_ljy1年前1
melon_ljy1年前1 -
 88537821 共回答了15个问题
88537821 共回答了15个问题 |采纳率93.3%解题思路:根据价层电子对互斥理论确定其空间构型,价层电子对个数=σ键个数+孤电子对个数,据此分析解答.①H2S分子中价层电子对个数=σ键个数+孤电子对个数=2+2=4,而中心原子外围只有两个原子所以含有2个孤电子对,即H2S为V型结构,故答案为:V型;
②ClO4-离子中价层电子对个数=σ键个数+孤电子对个数=4+0=4,中心原子外围有四个原子所以不含有孤电子对,即ClO4-为正四面体结构,故答案为:正四面体.点评:
本题考点: 判断简单分子或离子的构型.
考点点评: 本题考查了粒子空间构型的判断,根据价层电子对互斥理论来分析解答即可,注意孤电子对个数的计算方法,为易错点.1年前查看全部
- 求杂化轨道理论和价层电子对互斥理论的详解
求杂化轨道理论和价层电子对互斥理论的详解
这里一点也不明白 、 求详解 百事不留1年前1
百事不留1年前1 -
 我先劫个社 共回答了14个问题
我先劫个社 共回答了14个问题 |采纳率100%1 杂化轨道:
在形成分子的过程中,由于原子间的相互影响,若干类型不同而能量相近的原子轨道相互混杂,
重新组合成一组能量相等,成分相同的新轨道,这一过程称为杂化.经过杂化而形成的新轨道叫做杂化轨道,杂化轨道与其他原子轨道重叠时形成σ共价键.原子在形成分子的过程中,为了使所成化学键强度更大,更有利于体系能量的降低,总趋向于将原来的原子轨道进一步线性组合,以形成新的原子轨道.
价键理论的论证
价键理论对共价键的本质和特点做了有力的论证,但它把讨论的基础放在共用一对电子形成一个共价键上,在解释许多分子、原子的价键数目及分子空间结构时却遇到了困难.例如C原子的价电子是2s22p2,按电子排布规律,2个s电子是已配对的,只有2个p电子未成对,而许多含碳化合物中C都呈4价而不是2价,可以设想有1个s电子激发到p轨道去了.那么1个s轨道和3个p轨道都有不成对电子,可以形成4个共价键,但s和p的成键方向和能量应该是不同的.而实验证明:CH4分子中,4个 C-H共价键是完全等同的,键长为114pm,键角为109°28'.BCl3,BeCl2,PCl3等许多分子也都有类似的情况.为了解释这些矛盾,1928年鲍林(Pauling)提出了杂化轨道概念[1],丰富和发展了的价键理论.他根据量子力学的观点提出:在同一个原子中,能量相近的不同类型的几个原子轨道在成键时,可以互相叠加重组,成为相同数目、能量相等的新轨道,这种新轨道叫杂化轨道.C原子中 1个2s电子激发到2p后,1个2s轨道和3个2p轨道重新组合成4个sp3杂化轨道,它们再和4个H原子形成4个相同的C-H键,C位于正四面体中心,4个H位于四个顶角.
相关种类
杂化轨道种类很多,如三氯化硼(BCl3)分子中B有sp2杂化轨道,即由1个s轨道和2个p轨道组合成3个sp2杂化轨道,在氯化铍(BeCl2)中有sp杂化轨道,在过渡金属化合物中还有d轨道参与的sp3d和 sp3d2杂化轨道等.以上几例都是阐明了共价单键的性质,至于乙烯和乙炔分子中的双键和三键的形成,又提出了σ键和π键的概念.如把两个成键原子核间联线叫键轴,把原子轨道沿键轴方向“头碰头”的方式重叠成键,称为σ键.把原子轨道沿键轴方向“肩并肩”的方式重叠,称为π键.例如在乙烯(CH2= CH2)分子中有碳碳双键(C=C),碳原子的激发态中2px,2py和2s形成sp2杂化轨道,这3个轨道能量相等,位于同一平面并互成120℃夹角,另外一个pz轨道未参与杂化,位于与平面垂直的方向上.碳碳双键中的sp2杂化如下所示.
这3个sp2杂化轨道中有2个轨道分别与2个H原子形成σ单键,还有1个sp2轨道则与另一个 C的sp2轨道形成头对头的σ键,同时位于垂直方向的pz轨道则以肩并肩的方式形成了π键.也就是说碳碳双键是由一个σ键和一个π键组成,即双键中两个键是不等同的.π键原子轨道的重叠程度小于σ键,π键不稳定,容易断裂,所以含有双键的烯烃很容易发生加成反应,如乙烯(H2C=CH2)和氯 (Cl2)反应生成氯乙烯(Cl—CH2—CH2—Cl).
乙炔分子(C2H2)中有碳碳叁键 (HC≡CH),激发态的C原子中2s和2px轨道形成sp杂化轨道.这两个能量相等的sp杂化轨道在同一直线上,其中之一与H原子形成σ单键,另外一个 sp杂化轨道形成C原子之间的σ键,而未参与杂化的py与pz则垂直于x轴并互相垂直,它们以肩并肩的方式与另一个C的py,pz形成π键.即碳碳三键是由一个σ键和两个π键组成.这两个π键不同于σ键,轨道重叠也较少并不稳定,因而容易断开,所以含三键的炔烃也容易发生加成反应.
杂化轨道限于最外层电子,而在第一层的两个电子不参与反应,而在其他层上有许多的轨道,电子会从能量低的层“跃迁”到能量高的层,而原来能量低的层是因为电子的运动方向相反,而跃迁以后电子就只向一种方向运动,所以能量会高.并且反应以后组成的能量介于原来的S轨道和P轨道能量之间.
几种杂化轨道之后的分子空间形态
sp杂化:直线型
sp2杂化:平面三角形(等性杂化为平面正三角形)
sp3杂化:空间四面体(等性杂化为正四面体)
2 价电子对互斥理论
一个分子的中心原子究竟采取哪种类型的轨道杂化,直接可以预测整个分子的空间构型. 杂化轨道理论成功地解释了部分共价分子杂化与空间构型关系,但是,仅用杂化轨道理论预测有时是难以确定的.1940年美国的Sidgwick NV等人相继提出了价层电子对互斥理论(valence shell electron pair repulsion theory),简 称VSEPR法,该法适用于主族元素间形成的ABn型分子或离子.该理论认为,一个共价分子或离子中,中心原子A周围所配置的原子B(配位原子)的几何构型,主要决定于中心原子的价电子层中各电子对间的相互排斥作用.这些电子对在中心原子周围按尽可能互相远离的位置排布,以使彼此间的排斥能最小.所谓价层电子对,指的是形成σ键的电子对和孤对电子.孤对电子的存在,增加了电子对间的排斥力,影响了分子中的键角,会改变分子构型的基本类型.根据此理论,只要知道分子或离子中的中心原子上的价层电子对数,就能比较容易而准确地判断 ABn 型共价分子或离子的空间构型.
空间构型步骤
价层电子对理论预测分子空间构型步骤为:
1.确定中心原子中价层电子对数
中心原子的价层电子数和配体所提供的共用电子数的总和除以2,即为中心原子的价层电子对数. 规定:(1)作为配体,卤素原子和H 原子提供1个电子,氧族元素的原子不提供电子;(2)作为中心原子,卤素原子按提供7个电子计算,氧族元素的原子按提供6个电子计算;(3)对于复杂离子,在计算价层电子对数时,还应加上负离子的电荷数或减去正离子的电荷数;(4)计算电子对数时,若剩余1个电子,亦当作 1对电子处理.(5) 双键、叁键等多重键作为1对电子看待.
2.判断分子的空间构型
根据中心原子的价层电子对数,从表9-4中找出相应的价层电子对构型后,再根据价层电子对中的孤对电子数,确定电子对的排布方式和分子的空间构型.
实例分析:试判断PCl5 离子的空间构型.
P离子的正电荷数为5,中心原子P有5个价电子,Cl原子各提供1个电子,所以P原子的价层电子对数为(5+5)/2 = 5,其排布方式为三角双锥.因价层电子对中无孤对电子,所以PCl5 为三角双锥构型.
实例分析:试判断H2O分子的空间构型.
解 :O是H2O分子的中心原子,它有 6个价电子,与O化合的2个H原子各提供1个电子,所以O原子价层电子对数为(6+2)/2 = 4,其排布方式为 四面体,因价层电子对中有2对孤对电子,所以H2O分子的空间构型为V形.
表9-5 理想的价层电子对构型和分子构型
实例分析
判断HCHO分子和HCN分子的空间构型
解分子中有1个C=O双键,看作1对成键电子,2个C-H单键为2对成键电子,C原子的价层电子对数为3,且无孤对电子,所以HCHO分子的空间构型为平面三角形.
HCN分子的结构式为H—C≡N∶,含有1个C≡N叁键,看作1对成键电子,1个 CH单键为1对成键电子,故C原子的价层电子对数为2,且无孤对电子,所以HCN分子的空间构型为直线.1年前查看全部
- 如何用价层电子对互斥理论推测分子构型
 g3670uoqing1年前1
g3670uoqing1年前1 -
 孤天易 共回答了24个问题
孤天易 共回答了24个问题 |采纳率100%价层电子对互斥理论
应用该理论可预测一些非过渡元素,ABm型简单分子或离子的空间构型.
理论要点:
(1)价层电子对尽可能远离使相互间斥力最小.常采取下列排布方式.
价层电子对数
2
3
4
5
6
空间构型
直线形
等边三角形
正四面体
三角双键
正八面体
(2)根据中心原子(A)的价层电子对数确定电子对的空间排布,再根据中心原子的孤对电子数及其所在位置推出ABm分子的空间构型.
(3)电子对之间斥力大小顺序是:
孤对-孤对>孤对-成键>成键-成键
在考虑价层电子对排布时需选择最少数目的90度角的孤对-孤对排布.
计算价层电子对数和孤对电子对数的方法:
价层电子对数= (A原子的价层电子数+ B原子提供的形成共价单键的
电子数±离子的电荷数)
(规定B原子为氧族元素时不提供电子)
孤对电子对数=价层电子对数―成键电子对数1年前查看全部
- 用价层电子对互斥理论预测CO32-和BF3的立体结构分别是( )
用价层电子对互斥理论预测CO32-和BF3的立体结构分别是( )
A.平面三角形;三角锥形
B.三角锥形;平面三角形
C.三角锥形;三角锥形
D.平面三角形;平面三角形 cadugs1年前1
cadugs1年前1 -
 oo精神开发办 共回答了21个问题
oo精神开发办 共回答了21个问题 |采纳率90.5%解题思路:价层电子对互斥理论认为:分子的立体构型是“价层电子对”相互排斥的结果.价层电子对就是指分子中的中心原子上的电子对,包括σ 键电子对和中心原子上的孤电子对;σ 键电子对数和中心原子上的孤电子对数之和就是价层电子对数,由于价层电子对的相互排斥,就可得到含有孤电子对的VSEPR模型,略去孤电子对就是该分子的空间构型.CO32-的中心原子C原子上含有3个σ 键,中心原子上的孤电子对数=[1/2](a-xb)=[1/2](4+2-2×3)=0,所以CO32-的空间构型是平面三角形;
BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=[1/2](a-xb)=[1/2](3+1×3)=0,所以其空间构型就是平面三角形.
故选D.点评:
本题考点: 判断简单分子或离子的构型.
考点点评: 本题考查了分子空间构型的判断,题目难度不大,注意把握离子和分子价层电子对数的判断方法.1年前查看全部
- 价层电子对互斥理论怎么理解(高中)?怎么判断杂化类型?
 flyingxlj1年前1
flyingxlj1年前1 -
 luoweicool 共回答了17个问题
luoweicool 共回答了17个问题 |采纳率82.4%我高三、你第一个问题或许听说过但是绝对只是听说,没有大用
sp3杂化是立体的,单键
sp2杂化是平面的,双键 苯环
sp杂化是直线,三键1年前查看全部
- 用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是( )
用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是( )
A.SO2、CS2、HI都是直线形的分子
B.BF3键角为120°,SnBr2键角大于120°
C.COCl2、BF3、SO3都是平面三角形的分子
D.PCl3、NH3、PCl5都是三角锥形的分子 mary1251年前1
mary1251年前1 -
 忍者神人 共回答了16个问题
忍者神人 共回答了16个问题 |采纳率81.3%解题思路:根据价层电子对互斥理论确定分子空间构型,分子中孤电子对与成键电子对之间的排斥力大于成键电子对之间的排斥力,据此分析解答.A.SO2中价层电子对个数=2+12×(6-2×1)=4且含有2个孤电子对,所以二氧化硫为V型结构,CS2、HI为直线形结构,故A错误;B.BF3中价层电子对个数=3+12×(3-3×1)=3,所以为平面三角形结构;SnBr2中价层电子对个数=...
点评:
本题考点: 判断简单分子或离子的构型.
考点点评: 本题考查了分子空间构型及键角,明确价层电子对互斥理论的作用是解本题关键,难点是计算孤电子对的方法,难度不大.1年前查看全部
- 试用价层电子对互斥理 试用价层电子对互斥理论判断下列分子或离子的空间构型.BCl 3 、NH 3 、H 2 O、CO 2
试用价层电子对互斥理
试用价层电子对互斥理论判断下列分子或离子的空间构型.
BCl 3 、NH 3 、H 2 O、CO 2 、SO 2 、COCl 2 、NH 4 + 、CCl 4
_________________________________ yhz51年前1
yhz51年前1 -
 lige2000 共回答了11个问题
lige2000 共回答了11个问题 |采纳率100%BCl 3 、COCl 2 是平面三角形;H 2 O、SO 2 是V形;NH 3 是三角锥形;CO 2 是直线形;NH 4 + 、CCl 4 是正四面体形.1年前查看全部
- 用价层电子对互斥理论预言下列分子和原子的几何构型
用价层电子对互斥理论预言下列分子和原子的几何构型
CS2,NO2-,ClO2-,I3-,NO3-,BrF3 ,PCl4+,BrF4-,PF5,BrF5,[AlF6]3- 饿鬼郎1年前1
饿鬼郎1年前1 -
 三白草 共回答了14个问题
三白草 共回答了14个问题 |采纳率100%直线型
折线形
折线形
折线形
平面三角形
平面三角形
三角锥形
三角双锥形
正八面体1年前查看全部
- 用价层电子对互斥理论(VSEPR)预测H 2 S和COCl 2 的立体结构,两个结论都正确的是 [
用价层电子对互斥理论(VSEPR)预测H 2 S和COCl 2 的立体结构,两个结论都正确的是 [ ]A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形 虾子饼1年前1
虾子饼1年前1 -
 guiqiu 共回答了21个问题
guiqiu 共回答了21个问题 |采纳率100%D1年前查看全部
- SO3这个我们知道是S和O一个是双键,另外两个是单键,但是学了价层电子对互斥理论上面说的是每个原子的价位接近于0是最好的
SO3这个我们知道是S和O一个是双键,另外两个是单键,但是学了价层电子对互斥理论上面说的是每个原子的价位接近于0是最好的路易斯结构-.那我SO3为什么不能写成S和O全部是双键那样的话S和O都是0价0-.就像XeO3一样,
 su_lai161年前1
su_lai161年前1 -
 caryyoung 共回答了16个问题
caryyoung 共回答了16个问题 |采纳率100%O原子最多只能连接两个化学键,S和O原子如果都是双键的话,其中一个O原子会连接四个化学单键,有点离谱了、、、1年前查看全部
- (2009•海口模拟)用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
(2009•海口模拟)用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形 HSYYUN1年前1
HSYYUN1年前1 -
 经典名字 共回答了12个问题
经典名字 共回答了12个问题 |采纳率100%解题思路:价层电子对互斥理论认为:分子的立体构型是“价层电子对”相互排斥的结果.价层电子对就是指分子中的中心原子上的电子对,包括σ 键电子对和中心原子上的孤电子对;σ 键电子对数和中心原子上的孤电子对数之和就是价层电子对数,由于价层电子对的相互排斥,就可得到含有孤电子对的VSEPR模型,略去孤电子对就是该分子的空间构型.H2S分子的中心原子S原子上含有2个σ 键,中心原子上的孤电子对数=[1/2](a-xb)=[1/2](6-2×1)=2,所以硫化氢分子的VSEPR模型是四面体型,略去孤电子对后,实际上其空间构型是V型;
BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=[1/2](a-xb)=[1/2](0-3×1)=0,所以BF3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形.
故选D.点评:
本题考点: 判断简单分子或离子的构型.
考点点评: 本题考查了分子空间构型的判断,难度不大,易错点是阴阳离子中孤电子对数的确定,注意中心原子上的孤电子对数=[1/2](a-xb),a为中心原子的价电子数,x为与中心原子结合的原子数,b为与中心原子结合的原子最多能接受的电子数.1年前查看全部
- 价层电子对互斥理论中,三氧化硫的空间构型是什么?极性还是非极性?
 葬于零度1年前4
葬于零度1年前4 -
 aiyi410 共回答了23个问题
aiyi410 共回答了23个问题 |采纳率87%气态的SO3是一种具有D3h对称的平面正三角形分子,这与价层电子对互斥理论(VSEPR)所预测的结论一致.SO3分子中的S已经达到+6价,所有的电子都参与成键,没有孤对电子,不需要给孤对电子留出空间了,所以它是很对称的平面正三角形.
S元素采取sp2杂化,在竖直方向(就是没形成杂化轨道剩下的p轨道)上的p轨道中有一对电子,在形成的杂化轨道中有一对成对电子和2个成单电子,有2个氧原子分别与其形成σ键,2个氧原子竖直方向上p轨道各有1个电子,一个氧原子与杂化轨道的孤对电子形成配位键,其竖直方向上有2个电子,这样,在4个原子的竖直方向的电子共同形成一套大π键,这套大π键是离域的键.
是非极性分子.1年前查看全部
- I.根据价层电子对互斥理论(VSEPR)可以判断分子或离子的空间构型。
i.根据价层电子对互斥理论(vsepr)可以判断分子或离子的空间构型。
请回答下列问题:
①解释co 2 为直线型分子的原因 ;
② pbcl 2 分子的立体构型为 ,该分子属于 分子(填“极性”或“非极性” ),其中pb原子的杂化轨道类型为 。
ii.铜在***有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:
(1)铜原子基态电子排布式为 ;
(2)用晶体的x射线衍射法可以测得阿伏伽德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.00g/cm 3 ,则铜晶胞的体积是
cm 3 ,晶胞的质量是 克,阿伏伽德罗常数为
(列式计算,已知ar(cu)=63.6)。 阿南达玛1年前1
阿南达玛1年前1 -
 hqkurus 共回答了13个问题
hqkurus 共回答了13个问题 |采纳率100%I. (1) ①CO 2 属 n + m =2,SP杂化,故为直线形 (每空2分)
②折线形(或V形)极性分子 SP 2 (每空1分)
II.(1)1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 (2)4.70×10 -23 4.23×10 -22
I. (1)CO 2 中中心原子碳原子的孤对电子对数是(4-2×2)÷2=0,即碳原子是sp杂化,所以是直线型结构。
②PbCl 2 中中心原子Pb原子的孤对电子对数是(4-1×2)÷2=1,即Pb原子是sp2杂化,所以是V型结构。
II.(1)根据构造原理可知,基态铜原子的电子排布式为1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 。
(2)边长是361pm,所以体积是 。根据密度可知晶胞的质量是
。根据密度可知晶胞的质量是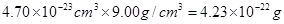 。由于铜晶胞中含有的铜原子数是8×1/8+6×1/2=4,所以有
。由于铜晶胞中含有的铜原子数是8×1/8+6×1/2=4,所以有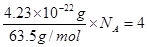 ,因此
,因此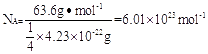 。
1年前查看全部
。
1年前查看全部
- 如何用价层电子对互斥理论推测CHCl3的空间构型
 mtvcctv1年前1
mtvcctv1年前1 -
 大眼睛小昕 共回答了27个问题
大眼睛小昕 共回答了27个问题 |采纳率96.3%同甲烷.sp3杂化.正四面体结构,C在中间,H,Cl在顶点.
价层电子对互斥理论的基础是,分子或离子的几何构型主要决定于与中心原子相关的电子对之间的排斥作用.该电子对既可以是成键的,也可以是没有成键的(叫做孤对电子).只有中心原子的价层电子才能够对分子的形状产生有意义的影响.
分子中电子对间的排斥的三种情况为:
孤对电子间的排斥(孤-孤排斥);孤对电子和成键电子对之间的排斥(孤-成排斥);成键电子对之间的排斥(成-成排斥).分子会尽力避免这些排斥来保持稳定.当排斥不能避免时,整个分子倾向于形成排斥最弱的结构(与理想形状有最小差异的方式).
孤对电子间的排斥被认为大于孤对电子和成键电子对之间的排斥,后者又大于成键电子对之间的排斥.因此,分子更倾向于最弱的成-成排斥.
配体较多的分子中,电子对间甚至无法保持90°的夹角,因此它们的电子对更倾向于分布在多个平面上.
价层电子对理论(VSEPR theory)预测分子空间构型步骤为: 1
.确定中心原子中价层电子对数
中心原子的价层电子数和配体所提供的共用电子数的总和减去离子带电荷数除以2[价电子对数=1/2(中心原子的价电子数+配位原子提供的σ电子数-离子电荷代数值)],即为中心原子的价层电子对数. 规定:
(1)作为配体,卤素原子和H 原子提供1个电子,氧族元素的原子不提供电子;
(2)作为中心原子,卤素原子按提供7个电子计算,氧族元素的原子按提供6个电子计算;
(3)对于复杂离子,在计算价层电子对数时,还应加上负离子的电荷数或减去正离子的电荷数;
(4)计算电子对数时,若剩余1个电子,亦当作 1对电子处理.
(5) 双键、叁键等多重键作为1对电子看待.
2.判断分子的空间构型 根据中心原子的价层电子对数,找出相应的价层电子对构型后,再根据价层电子对中的孤对电子数,确定电子对的排布方式和分子的空间构型.1年前查看全部
- 用价层电子对互斥理论推测水分子的几何形状为……到底是v型还是四面体啊,不知道要不要忽视孤电子对
 空投爱情1年前2
空投爱情1年前2 -
 9小天hao 共回答了19个问题
9小天hao 共回答了19个问题 |采纳率89.5%不要忽视孤对电子,应该是四面体型,但单看三个原子是V型.1年前查看全部
- 价层电子对互斥理论中怎样判断中心原子和配对原子
价层电子对互斥理论中怎样判断中心原子和配对原子
价层电子对互斥理论中有:H和卤原子作配对原子时各提供一个价电子,卤素作为中心原子时,提供的价电子数为7.但有时不知道哪个是中心原子,请问该如何判断呢?比如二氯代甲醛(COCl2),中心原子不知道是O还是C呢? alexhong771年前3
alexhong771年前3 -
 请您选1择 共回答了22个问题
请您选1择 共回答了22个问题 |采纳率95.5%提供电子的是配位原子啊,显然是电负性大的那个.你只要找出电负性最小的那个元素,就是中心原子,其他的作为配位原子.一般配位原子都是卤素和氧1年前查看全部
- 氮气的分子几何构型是什么?可是按照价层电子对互斥理论该怎么解释呢?
 xxren1001年前3
xxren1001年前3 -
 Longman朗文 共回答了14个问题
Longman朗文 共回答了14个问题 |采纳率92.9%N2分子只有两个原子,肯定是直线形 .
价层电子对互斥理论是用于多原子分子的(如NH3)1年前查看全部
- 用价层电子对互斥理论预言下列分子和原子的几何构型 CS2,NO2-,ClO2-,I3-,N
用价层电子对互斥理论预言下列分子和原子的几何构型 CS2,NO2-,ClO2-,I3-,N
用价层电子对互斥理论预言下列分子和原子的几何构型
CS2,NO2-,ClO2-,I3-,NO3-,BrF3 ,PCl4+,BrF4-,PF5,BrF5,[AlF6]3- 彩多少1年前1
彩多少1年前1 -
 yangfy01 共回答了19个问题
yangfy01 共回答了19个问题 |采纳率94.7%举几个例子给你吧.例如CS2 中心原子C的价电子数为4那么就用4/2那么中心原子的价电子层的电子对数就是2 也就是有两根键 正好有两个s那么也就没有孤对电子是直线行1年前查看全部
- 用价层电子对互斥理论预言下列分子和离子的几何构型
用价层电子对互斥理论预言下列分子和离子的几何构型
CS2,NO2-,ClO2-,I3-,NO3-,BrF3,PCl4+,BrF4-,PF5,BrF5,[AlF6]-
这是大学化学........ 澜枫1年前2
澜枫1年前2 -
 gqf5678 共回答了17个问题
gqf5678 共回答了17个问题 |采纳率82.4%cs2直线型;no2v型;clo2v型;no3三角锥型;brf3平面三角型;pcl4四面体型;pf5五边形;brf5四面体;alf6四面体1年前查看全部
- 试用价层电子对互斥理论判断ClF 3 可能有几种结构,哪一种结构最稳定?
试用价层电子对互斥理论判断ClF 3 可能有几种结构,哪一种结构最稳定?
_________________________________ 玉茜1年前1
玉茜1年前1 -
 rherndtnhjdtr 共回答了12个问题
rherndtnhjdtr 共回答了12个问题 |采纳率100%1年前查看全部
- 用价层电子对互斥理论判断HgCl2的空间构型
 c7011年前1
c7011年前1 -
 hd1506 共回答了14个问题
hd1506 共回答了14个问题 |采纳率71.4%Hg是第二副族,价电子数是2,Cl是1,所以VPN=(2+2)/2=2,孤对电子数n=(2-2)/2=0,所以是直线型1年前查看全部
- 价层电子对互斥理论推测NO2构型
价层电子对互斥理论推测NO2构型
中心原子价电子对数的计算:中心原子的价电子数+单键共用对方原子的电子数 总和除2
中心原子的价在正规的共价键中:
氧原子和硫原子作为配位原子时,可认为不提供共用电子
那么N有5个价电子.O不提供,则结果是2.5
希望有人解释一下,顺便把公式的具体注意事项说明一下,谢谢
 shuiji811181年前1
shuiji811181年前1 -
 sunvar 共回答了13个问题
sunvar 共回答了13个问题 |采纳率92.3%价层电子对互斥理论
应用该理论可预测一些非过渡元素,ABm型简单分子或离子的空间构型.
理论要点:
(1)价层电子对尽可能远离使相互间斥力最小.常采取下列排布方式.
价层电子对数
2
3
4
5
6
空间构型
直线形
等边三角形
正四面体
三角双键
正八面体
(2)根据中心原子(A)的价层电子对数确定电子对的空间排布,再根据中心原子的孤对电子数及其所在位置推出ABm分子的空间构型.
(3)电子对之间斥力大小顺序是:
孤对-孤对>孤对-成键>成键-成键
在考虑价层电子对排布时需选择最少数目的90度角的孤对-孤对排布.
计算价层电子对数和孤对电子对数的方法:
价层电子对数= (A原子的价层电子数+ B原子提供的形成共价单键的
电子数±离子的电荷数)
(规定B原子为氧族元素时不提供电子)
孤对电子对数=价层电子对数―成键电子对数
http://202.114.128.246/shenbao/wjhx/%CE%DE%BB%FA%BB%AF%D1%A7%B8%A8%B5%BC/%B7%D6%D7%D3%BD%E1%B9%B9/%B7%D6%D7%D3%BD%E1%B9%B9%BB%F9%B1%BE%D2%AA%C7%F3%D3%EB%D2%AA%B5%E3.htm1年前查看全部
大家在问
- 1可惜你不会中文,要不我们一定会交流得更好,用英语怎么说
- 2下列设备中利用了通电导体在磁场中受到力作用的是( )
- 3有红黄两种玻璃球一堆,其中红球个数是黄球个数的1.5倍,如果从这堆球中每次同时取出红球5个,黄球4个,那么取了_____
- 4建筑工地用1份水泥,2份黄沙,6份石子配制一种混凝土,现在工地上水泥,黄沙,石子各有20吨,
- 5已知函数y=f(x)在R上可导,满足 x•f′(x)+f(x)>0,则下列不等式一定成立的是( )
- 6石碱的化学式是啥?属于啥类别?
- 7诗句“无边落木萧萧下,不尽长江滚滚来”出自唐诗什么
- 8太阳能集热器的选择主要有哪些依据?
- 9140千克的甲种玉米可以磨出95千克的玉米粉100千克的乙种玉米可以磨出75千克玉米粉同样多的两种玉米那种磨出
- 10读句子,仿写句子 (7 17:56:45)
- 11形容愿望没有实现的词语,两字词语`四字词语都行
- 12△ABC中,BA=BC,∠ABC=45°,AD是BC边上的高,E是AD上的一点,ED=CD,连接EC.求证:EA=EC.
- 13细胞内进行物质交换的结构是什么?细胞膜还是细胞质?
- 14关于匀速圆周运动的性质,以下说法中正确的是( )
- 15They like listening to music better than watching films.改同义句