ph=5的强酸与ph=13的强碱等体积混合,混合后溶液ph为什么会等于12.
 robertyq2022-10-04 11:39:543条回答
robertyq2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 Й多谢Si恋Ω 共回答了21个问题
Й多谢Si恋Ω 共回答了21个问题 |采纳率100%- 这是因为ph=5的强酸与ph=13的强碱比起来,酸太稀,所以可以看成是水,这样一来,氢氧根离子浓度就成为原来的一半:0.05mol/L,pOH=1.3 所以 pH=12.7 .
- 1年前
 送流水 共回答了1个问题
送流水 共回答了1个问题 |采纳率- 假设双方各取1L的溶液,那么,ph=5的强酸里含有的氢离子的量就是10(-5)mol,ph=14的强碱里含有的氢氧根的量就就是1mol,把他们混合在一起,他们先发生中和反应,最后溶液中的氢氧根的含量就是0.5mol/L(因为酸的量太少了,所以忽略不计),那么溶液中的氢离子的含量就是2*10(-14),按照ph的算法,混合后的溶液的ph就是12.7。...
- 1年前
 chfi 共回答了7个问题
chfi 共回答了7个问题 |采纳率- 氢氧根浓度是10^13,氢离子浓度10^5,相减取负对数是12.7
- 1年前
相关推荐
- 为什么可以用铝罐车装强酸
 mousewdk1年前4
mousewdk1年前4 -
 爱在雨季 共回答了18个问题
爱在雨季 共回答了18个问题 |采纳率83.3%只是用来装浓硫酸、浓硝酸.
因为铝遇浓硫酸、浓硝酸会发生钝化,就是在表面会形成致密的氧化膜,从而阻止反应继续进行.
这个是铝的特性,只与浓硫酸和浓硝酸钝化,所以不能装盐酸、稀硫酸等等其他酸.1年前查看全部
- 为了用实验证明醋酸是弱酸,盐酸是强酸.甲,乙两同学设计的实验方案如下:
为了用实验证明醋酸是弱酸,盐酸是强酸.甲,乙两同学设计的实验方案如下:
甲:(1)分别称取一定质量的醋酸钠和氯化钠,配制0.1mol/L的溶液各100毫升;
(2)用湿润的pH试纸测出两种溶液的pH值,即可证明盐酸的酸性比醋酸强.
乙:(1)用已知浓度的醋酸溶液,盐酸分别配制pH=1的两种酸溶液各100毫升;
(2)分别取这两种溶液各10毫升,加水稀释至100毫升;
(3)再分别测出两种稀释液的pH值,即可证明醋酸的酸性比盐酸弱.
请回答下列问题:
(1)甲的实验目的是:证明醋酸弱酸性的理由是测得所配醋酸钠溶液的pH值____7,而氯化钠溶液的pH值___7.(填"大于","小于"或"等于")
(2)乙的实验目的是:证明醋酸弱酸性的理由是稀释后醋酸溶液的pH值____
(填"大于","小于"或"等于")盐酸的pH值.
(3)请你评价:甲方案中不妥之处是_____ .不必要之处是______,乙方案中难以实现之处是____ vv二条根1年前9
vv二条根1年前9 -
 103724297 共回答了22个问题
103724297 共回答了22个问题 |采纳率86.4%(1)大于、等于
(2)小于
(3)不妥之处是醋酸钠水解程度很弱,pH值接近7,很难用pH试纸测出.不必要之处是测氯化钠溶液pH值,乙方案中难以实现之处是配制pH=1的错酸溶液很困难.1年前查看全部
- I.强酸与强碱的稀溶液发生中和反应的热化学方程式:H + (aq)+OH - (aq)═H 2 O(1)△H=-57.3
I.强酸与强碱的稀溶液发生中和反应的热化学方程式:H + (aq)+OH - (aq)═H 2 O(1)△H=-57.3kJ•mol -1 1L 0.5mol•L -1 的NaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,恰好完全反应时的热效应分别为△H 1 、△H 2 、△H 3 则三者关系为______(用<、>或=表示).
II.在饱和Mg(OH) 2 溶液中c(OH - )=1.0×10 -4 mol/L.,若往该溶液中加入NaOH溶液,使溶液中的c(OH - )变为原来的10倍,则Mg(OH) 2 在此溶液中的溶解度在理论上将变为原来的______倍. happy08081年前0
happy08081年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 化学——电解质(高中知识)①强酸是共价化合物?②强碱是离子化合物?③大多数盐是离子化合物?④弱酸是共价化合物?⑤弱碱是共
化学——电解质(高中知识)
①强酸是共价化合物?
②强碱是离子化合物?
③大多数盐是离子化合物?
④弱酸是共价化合物?
⑤弱碱是共价化合物或者是离子化合物?
(氨水和氢氧化铝是共价化合物?氢氧化铁是离子化合物?)
不要过于繁琐的补充
麻烦正确简明的答案和简单的补充
氢氧化铝到底是共价化合物还是离子化合物? mengwenshaohan1年前4
mengwenshaohan1年前4 -
 mouseyao 共回答了11个问题
mouseyao 共回答了11个问题 |采纳率90.9%1.是
2.是
3.是,Pb(Ac)2,HgCl2等少数除外
4.不一定,如果是有机酸,且含多个酸性基团,可能是离子化合物,因为只要有离子键就是离子化合物
5.一水合氨是共价化合物,氢氧化铁也是共价化合物1年前查看全部
- 用酸滴定碱为什么用已知强酸滴定强碱酚酞过多碱的物质量浓度会偏大?
 文艺小生1年前1
文艺小生1年前1 -
 人类天使 共回答了14个问题
人类天使 共回答了14个问题 |采纳率92.9%强碱滴定强酸常用的指示剂是酚酞,变色后溶液呈现弱碱性.1年前查看全部
- 为什么在强酸中碳酸根离子不存在
 阴历11月111年前1
阴历11月111年前1 -
 csguigui 共回答了14个问题
csguigui 共回答了14个问题 |采纳率100%强酸条件下
碳酸根和酸反应生成二氧化碳和水1年前查看全部
- 如果一种酸的ha浓度为0.01mol l ph 2该酸是强酸吗
 ldl00001年前1
ldl00001年前1 -
 sosocakezs 共回答了25个问题
sosocakezs 共回答了25个问题 |采纳率92%是强酸.
HA代表一元酸.
pH= -lg c(H+)
pH=2带入得lgc(H+)= -2
c(H+)= 10^-2=0.01mol/L
酸的浓度为0.01mol/L,氢离子浓度也为0.01mol/L
说明了 一元酸完全电离了.
完全电离 即证明了 这种酸HA为强酸1年前查看全部
- 25℃,101k Pa时,强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3kJ/mol;
25℃,101k Pa时,强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3kJ/mol;辛烷(C8H18)的燃烧热为5518kJ/mol.下列热化学方程式书写正确的是( )
A.CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol
B.KOH(aq)+[1/2]H2SO4(aq)=[1/2]K2SO4(aq)+H2O(l)△H=-57.3kJ/mol
C.C8H18(l)+[25/2]O2(g)=8CO2(g)+9H2O(g)△H=-5518 kJ/mol
D.2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l)△H=-5518kJ/mol 吃烤肉要喝啤酒1年前1
吃烤肉要喝啤酒1年前1 -
 ttp5858 共回答了10个问题
ttp5858 共回答了10个问题 |采纳率90%解题思路:A、中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量,醋酸是弱酸,电离要吸热;
B、中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量,
C、燃烧热是1mol可燃物完全反应生成稳定氧化物时放出的热量;
D、燃烧热是1mol可燃物完全反应生成稳定氧化物时放出的热量,反应热与化学计量数成正比.A、因醋酸是弱酸,电离要吸热,所以该反应的反应热△H不是-57.3kJ/mol,故A错误;
B、符合中和热的概念,故B正确;
C、反应热化学方程式中生成的水是气体,不是稳定氧化物,故C错误;
D、热化学方程式中不是1mol物质燃烧,所以热化学方程式为:2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l)△H=-11036kJ/mol,故D错误;
故选B.点评:
本题考点: 热化学方程式.
考点点评: 本题考查了中和热、燃烧热的概念应用,注意概念的内涵理解是解题关键.1年前查看全部
- 强酸制弱酸 要怎么理解?就比如给一个方程式,要怎么比较强弱?
 蓝蓝圆子1年前3
蓝蓝圆子1年前3 -
 蜗牛的呐喊 共回答了24个问题
蜗牛的呐喊 共回答了24个问题 |采纳率100%强酸制弱酸,顾名思义,就是用酸性强的物质制出酸性弱的物质,一般这为离子反应,但要明白,离子反应总是朝着离子浓度减小的方向移动,所以因为弱酸的电离程度比强酸的小,所以能够制的.例如盐酸和碳酸钠或亚硫酸钠反应能够制出CO2或SO2.但这也有特例,如果反应中出现难溶物,就可以利用弱酸制强酸,例如H2S+CUSO4=H2SO4+CUS,硫化铜为难溶于酸的黑色沉淀,所以能够用硫化氢制出硫酸.所以不是绝对的,但大部分是强酸制弱酸.1年前查看全部
- 强酸和强碱在稀溶液中完全中和生成1molH2O(l),放出57.3kJ热量,浓硫酸与氢氧化钠溶液反应生成1molH2O(
强酸和强碱在稀溶液中完全中和生成1molH2O(l),放出57.3kJ热量,浓硫酸与氢氧化钠溶液反应生成1molH2O(l),
反应放出57.3kJ热量,这句话为什么不对 wewelove1年前1
wewelove1年前1 -
 最佳cc 共回答了19个问题
最佳cc 共回答了19个问题 |采纳率100%浓硫酸与氢氧化钠溶液反应生成1molH2O(l),反应放出大于57.3kJ热量
因为浓硫酸稀析会放出一部分热量1年前查看全部
- 高一常用的弱酸弱碱强酸强酸
 rogerluluk1年前3
rogerluluk1年前3 -
 quldy 共回答了14个问题
quldy 共回答了14个问题 |采纳率92.9%弱酸:碳酸,醋酸,次氯酸
强酸:盐酸,硫酸,硝酸
弱碱:氨水
强碱:氢氧化钠,氢氧化钾,氢氧化钡,氢氧化钙1年前查看全部
- 强酸置换弱酸 这句话对吗应该说强酸酸根置换弱酸酸根 还有 这句话中的强酸与弱酸是相对的吧能不能举个例子说明有气体生成时,
强酸置换弱酸 这句话对吗
应该说强酸酸根置换弱酸酸根 还有 这句话中的强酸与弱酸是相对的吧
能不能举个例子说明有气体生成时,弱酸制强酸 xihuali881年前1
xihuali881年前1 -
 cq_924 共回答了19个问题
cq_924 共回答了19个问题 |采纳率84.2%很多都是的,但置换好像不是很正确吧,一些是反应但不是置换.
而且有些是相反的,如果有难溶或是气体等生成也可以是反应物是弱酸而产物是强酸.1年前查看全部
- 强酸制弱酸,电离程度,酸和盐反应.
 好文啊011年前1
好文啊011年前1 -
 mt74di72 共回答了16个问题
mt74di72 共回答了16个问题 |采纳率93.8%这个问题的中心即是酸和盐反应的问题.
酸和盐反应,只有生成气体、沉淀、难电离的物质才能发生.
1、强酸制弱酸:弱酸即是弱电解质,即是难电离的物质,包括弱酸制更弱的酸.符合规则.
2、生成难溶于酸的盐,是由物质的性质决定的.如硫酸钡、氯化银等.
3、生成气体.大部分也是生成易分解的酸(也属于弱酸)1年前查看全部
- 钛(Ti)因为具有神奇的性能越来越引起人们的关注,常温下钛不和非金属、强酸反应,红热时却能与常见的非金属单质反应.钛是航
钛(Ti)因为具有神奇的性能越来越引起人们的关注,常温下钛不和非金属、强酸反应,红热时却能与常见的非金属单质反应.钛是航空、军工、电力等方面的必需原料.目前大规模生产钛的方法是:
第一步,金红石(主要成分TiO2)、炭粉混合在高温条件下通入氯气制得TiCl4和一种可燃性气体.该反应的化学方程式______.该反应的还原剂是______.
第二步,在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛.该反应的化学方程式为______. timyao1年前1
timyao1年前1 -
 ddnangelwings 共回答了20个问题
ddnangelwings 共回答了20个问题 |采纳率90%解题思路:第一步:金红石(主要成分TiO2)、炭粉混合在高温条件下通入氯气制得TiCl4和一种可燃性气体,写出反应的化学方程式即可.
第一步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛,写出反应的化学方程式即可.第一步:在高温时,将金红石(TiO2)、炭粉混合并通入氯气制得TiCl4和一种可燃气体(由质量守恒定律,反应前后元素种类不变,该气体是一氧化碳),反应的化学方程式为:TiO2+2C+2Cl2
高温
.
TiCl4+2CO;C夺取了二氧化钛中的氧,该反应的还原剂是C.
第二步:在氩气的环境中,用过量的镁在加热条件下与TiCl4反应制得金属钛,反应的化学方程式为:2Mg+TiCl4
高温
.
2MgCl2+Ti.
故答案为:TiO2+2C+2Cl2
高温
.
TiCl4+2CO;C;2Mg+TiCl4
高温
.
2MgCl2+Ti.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- 强酸和强碱都有什么性质,
 kk33236231年前1
kk33236231年前1 -
 yixiaosheng 共回答了23个问题
yixiaosheng 共回答了23个问题 |采纳率82.6%就初一而言,只需要这样打就可以了强碱: 溶于水能发生完全电离,溶液能使特定指示剂变色的物质(如使石蕊变蓝,使酚酞变红等),在标准情况下,PH值大于7.在溶液中完全电离的碱是强碱.(最简单的说法)强酸:溶于水能发...1年前查看全部
- 强酸和强酸反应吗?
 zjh985481年前3
zjh985481年前3 -
 鱼化石_tan 共回答了20个问题
鱼化石_tan 共回答了20个问题 |采纳率90%有可能的
如果两种强酸一种具有强氧化性,一种具有强还原性,就可以发生氧化还原反应.
例如硝酸和碘化氢.1年前查看全部
- ph等于2的强酸稀释1000倍后ph等于多少?主要是写出计算过程啊!
ph等于2的强酸稀释1000倍后ph等于多少?主要是写出计算过程啊!
用何公式?请写出! szy13141681年前1
szy13141681年前1 -
 臻锋 共回答了12个问题
臻锋 共回答了12个问题 |采纳率100%原来c(H+)=10^-2
稀释1000倍后,c(H+)=10^-2/1000=10^-5
则PH=51年前查看全部
- 强酸和强碱的中和热怎么定义?
 qq狂歌1年前2
qq狂歌1年前2 -
 棋落无悔 共回答了20个问题
棋落无悔 共回答了20个问题 |采纳率100%在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热.
注意几点:
1、酸和碱必须是稀溶液,因为浓溶液稀释时会有热效应;
2、酸和碱必须是强酸、强碱,因为弱酸或弱碱在中和过程中要电离,吸收热量;
3、必须以生成1 mol水为标准;
4、中和生成的盐必须是可溶盐,因为若生成沉淀,生成沉淀的过程也伴随着热效应,如硫酸和氢氧化钡就不行.1年前查看全部
- 为什么金属在弱酸中就是化学腐蚀(如Al在醋酸中),而在强酸中就是电化学腐蚀?
为什么金属在弱酸中就是化学腐蚀(如Al在醋酸中),而在强酸中就是电化学腐蚀?
书上说在强酸里面是析氢反映 licanwei1年前4
licanwei1年前4 -
 qyg123 共回答了21个问题
qyg123 共回答了21个问题 |采纳率90.5%不是这样吧
都是化学腐蚀
在盐里一般是电化学
析氢只是说有氢气放出,化学和电化学腐蚀都可以有,吸氧是电化学专有的1年前查看全部
- 然后,酸化有什么用啊?还有,为什么亚硫酸不能和氯化钡反应啊?弱酸不可以存在强酸中吗?道理是什么呢?
 尽入渔樵闲话1年前1
尽入渔樵闲话1年前1 -
 残缺的浴缸 共回答了18个问题
残缺的浴缸 共回答了18个问题 |采纳率94.4%1.酸化:在溶液里加酸,使溶液呈酸性.
2.酸化作用:抑制一些强酸弱碱盐的水解,如在氯化铁溶液中要加盐酸酸化.
增强氧化剂的氧化性,如酸性高锰酸钾溶液的氧化性比中性要强.
排除一些离子的干扰,如鉴别硫酸根离子时,应先加稀盐酸酸化,可排除银离子、碳酸根离子、碳酸氢根、亚硫酸根等离子的干扰.
3.亚硫酸不能与氯化钡反应,因亚硫酸的酸性没有盐酸强.也可以假设要反应,生成的亚硫酸钡可与盐酸反应,所以实际上不可能反应.
4.弱酸有的不能存在于强酸中,主要是易挥发的酸.如碳酸,亚硫酸,氢硫酸等.
若弱酸不是挥发性的就可以存在,如乙酸就可以在硫酸中存在.
顺便说一句:弱酸是不能水解的,应该是弱酸盐水解,在这里没有此情况.1年前查看全部
- 物质的量浓度相同的强酸与弱酸稀释相同的倍数,哪个的ph大?
 zcyx99991年前2
zcyx99991年前2 -
 Lee-boy 共回答了20个问题
Lee-boy 共回答了20个问题 |采纳率90%你是想问哪个pH的变化大吧……
如果是的话,强酸的变化大,因为弱酸在稀释过程中,会促使电离平衡正移,相当于会“多”出H+.1年前查看全部
- 酸碱指示剂问题为什么强碱滴定弱酸时常用酚酞作指示剂,强酸滴定强碱时常用甲基橙作指示剂?
 玉米粥1年前1
玉米粥1年前1 -
 哨兵的爱 共回答了17个问题
哨兵的爱 共回答了17个问题 |采纳率94.1%强碱滴定弱酸等当点时,溶液相当于强碱弱酸盐溶液,由于水解略显碱性,故应用酚酞(变色范围8-10).
强酸滴定弱碱等当点时,溶液相当于弱碱强酸盐溶液,由于水解略显酸性,故应用甲基橙(变色范围3.1-4.4).1年前查看全部
- 【紧急,强酸制弱酸问题.】.最底下实验装置.请问分液漏斗加入HNO3或者H2SO4怎么验证非金属性大小.为什么前者N>C
【紧急,强酸制弱酸问题.】.最底下实验装置.请问分液漏斗加入HNO3或者H2SO4怎么验证非金属性大小.为什么前者N>C>Si不对?后者H2SO4验证S>C>Si.

 风在发鬓1年前1
风在发鬓1年前1 -
 lsw211211 共回答了10个问题
lsw211211 共回答了10个问题 |采纳率100%因为硝酸易挥发,前者只能说明N>C,N>SI1年前查看全部
- 强酸和弱碱怎样中和例:pH值为1的强酸和pH值为8的弱碱如何中和,生成什么东东?
 evawh1年前1
evawh1年前1 -
 dxmn 共回答了26个问题
dxmn 共回答了26个问题 |采纳率76.9%例如盐酸和氨水~将两种溶液混合后利用PH计就可以中和~生成混有少量氨水的氯化铵溶液~1年前查看全部
- 25度时,将ph=5的强酸与ph=10的强碱溶液等体积混合,求混合溶液ph
 evlancer1年前3
evlancer1年前3 -
 showmutou 共回答了13个问题
showmutou 共回答了13个问题 |采纳率92.3%强酸pH=5 ;
强碱pH=10.pOH=14-10=4 .
混合液的氢氧根量浓度:
[OH]=[10^-4 - 10^-5]/2
=[10*10*-5 - 10^-5]/2
=0.5*9*10^-5
=4.5*10*-5
混合液 pOH=-(lg4.5+lg10^-5)
=-(0.6532 - 5)
=-(-4.35)
=4.35
混合液 pH=14-4.35=9.65 .1年前查看全部
- (2008•肇庆二模)氯酸是一种强酸,浓度超过40%时会发生分解:a HClO3═bO2↑+c Cl
(2008•肇庆二模)氯酸是一种强酸,浓度超过40%时会发生分解:a HClO3═bO2↑+c Cl2↑+d HClO4+e H2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色.下列说法正确的是( )
A.由反应可确定:氧化性HClO4>HClO
B.若化学计量数a=8,b=3,生成2molCl2,则该反应转移电子数为20e-
C.变蓝的淀粉碘化钾试纸褪色是因为发生了:5Cl2+I2+6H2O═12H++10Cl-+2IO3-
D.若氯酸分解所得混合气体1mol,其气体质量为47.6g,则反应方程式可表示为:26HClO3═15O2↑+8Cl2↑+10HClO4+8H2O mengba5211年前1
mengba5211年前1 -
 八月的爱人ai 共回答了12个问题
八月的爱人ai 共回答了12个问题 |采纳率91.7%解题思路:A.反应没有涉及HClO,根据该反应不能确定HClO4和HClO的强氧化性强弱;
B.还原产物只有Cl2,由HClO3→Cl2,Cl元素化合价由+5价降低为0价,据此计算生成2molCl2时转移电子的物质的量;
C.试纸先变蓝后褪色,说明氯气可氧化碘单质;
D.根据混合气体的物质的量、质量,计算n(O2)、n(Cl2),确定b、c关系,再根据电子转移守恒、元素守恒配平方程式.A.反应没有涉及HClO,根据该反应不能确定HClO4和HClO的强氧化性强弱,故A错误;
B.还原产物只有Cl2,由HClO3→Cl2,Cl元素化合价由+5价降低为0价,故生成2molCl2时转移电子的物质的量为2mol×2×(5-0)=20mol,故B正确;
C.试纸先变蓝后褪色,说明氯气可氧化碘,反应的方程式为5Cl2+I2+6H2O═12H++10Cl-+2IO3-,故C正确;
D.n(Cl2)+n(O2)=1mol,n(Cl2)×71g/mol+n(O2)×32g/mol=47.6g,
解得n(Cl2)=0.4mol,n(O2)=0.6mol,
故n(Cl2):n(O2)=2:3,与方程式中的计量数关系不同,
故D错误.
故选:BC.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应反应的计算、配平、基本概念等,题目难度较大,D选项为易错点,涉及计算与配平,注意电子守恒的应用.1年前查看全部
- 常见金属单质A、B和非金属单质C、D以及它们化合物之间的转化关系如下。F、J既能溶于强酸M又能溶于强碱N,Z的摩尔质量为
常见金属单质A、B和非金属单质C、D以及它们化合物之间的转化关系如下。F、J既能溶于强酸M又能溶于强碱N,Z的摩尔质量为198 g·mol -1 ,且其中各元素的质量比为:钾:金属B:氧=39:28:32。
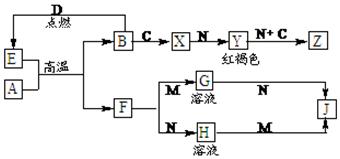
请回答下列问题:
(1)C的化学式为 ,Z的化学式为 。
(2)写出检验X中阳离子的方法 。
(3)写出E和A在高温下反应的化学方程式为 。
(4)写出A和N反应的离子方程式 。 yinxiangsc1年前1
yinxiangsc1年前1 -
 gjl6866 共回答了15个问题
gjl6866 共回答了15个问题 |采纳率100%1年前查看全部
- 强酸制弱酸,那么怎么分辨哪个酸性强哪个酸性弱?
强酸制弱酸,那么怎么分辨哪个酸性强哪个酸性弱?
写化学方程式的时候不是说不能弱酸制强酸么?
那么怎么确定哪个是强酸哪个是弱酸? klarkek1年前3
klarkek1年前3 -
 ZHENGBO520 共回答了14个问题
ZHENGBO520 共回答了14个问题 |采纳率100%如果是在水溶液中进行的那就是反应物的酸比生成物的酸强
我们熟悉的实验室制CO2
CaCO3+2HCl=CaCl2+H2O+CO2(箭头)
像实验室制HCl气体就不能了,因为这个是在加热下发生的
2NaCl+H2SO4=(加热)Na2SO4+2HCl
这个反应能发生是因为氯化氢沸点低,容易挥发出来,有利于向正反应方向进行,也就是平时说的高沸点酸制低沸点酸,或者叫难挥发性酸制易挥发性酸
强酸呢,我知道几个的强弱
HClO4>HI>HBr>H2SO4>HCl>HNO3
注意:不要以为氧化性和酸性有必然的联系
虽然上述几种酸的酸性有区别,但是在水中不会存在这几种酸之间的强制弱,你就理解成强到一定程度大概没什么分别
这个在大学中叫拉平效应
弱酸呢
草酸(乙二酸),亚硫酸,磷酸,亚硝酸(以上五种为中强酸),氢氟酸,乙酸,碳酸,氢硫酸,次氯酸,硼酸,硅酸
这几个全都见过了吧1年前查看全部
- 一元强酸(0PH=A)和一元强碱(PH=B)以VA和VB的体积混合恰好中和.(在线等!答得好有追加分!)
一元强酸(0PH=A)和一元强碱(PH=B)以VA和VB的体积混合恰好中和.(在线等!答得好有追加分!)
一元强酸(0PH=A)和一元强碱(PH=B)以VA和VB的体积混合恰好中和,已知VA 告知1年前1
告知1年前1 -
 ssm163 共回答了22个问题
ssm163 共回答了22个问题 |采纳率90.9%A=3 B=6.都酸性不可能
A=5 B=10
[H+]A=1*10^-5MOL/L
[OH-]B=1*10^-4MOL/L
所以VA>VB,也不可能1年前查看全部
- (2012•宜春模拟)一般较强酸可制取较弱酸,这是复分解反应的规律之一.已知在常温下测得浓度均为0.1mol/L的下列6
(2012•宜春模拟)一般较强酸可制取较弱酸,这是复分解反应的规律之一.已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:
(1)①请根据上述信息判断下列反应不能发生的是______(填编号).溶质 CH3COONa NaHCO3 Na2CO3 NaClO NaCN C6H5ONa pH 8.1 8.8 11.6 10.3 11.1 11.3
A.CH3COOH+NaCN═CH3COONa+HCN
B.CO2+H2O+2NaClO═Na2CO3+2HClO
C.2HCN+Na2CO3-→2NaCN+CO2+H2O
D.Na2CO3+C6H5OH-→NaHCO3+C6H5ONa
E.CO2+H2O+C6H5ONa-→NaHCO3+C6H5OH
②已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A-=B2-+2HA,则A-、B2-、HB-三种阴离子结合H+的难易顺序为______.
(2)一些复分解反应的发生还遵循其他规律.下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液 ②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体.根据上述反应,总结出复分解反应发生的另一规律为______.
(3)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9mol•L-1,则该电解质可能是______(填序号).
A. CuSO4B. HClC. Na2SD.NaOHE.K2SO4
(4)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.
①浓度为1.0×l0-3mol.L-1的氨水b L;
②c(OH -)=1.0×10-3mol.L-l的氨水c L;
③c(OH-)=1.0×10-3mol•L-1的氢氧化钡溶液d L.
则a、b、c、d之间由大到小的关系是:______.
(5)一定温度下,向等体积等物质的量浓度的下列三份溶液:①NaOH、②CH3COOH、③CH3COONa分别加等量水,pH变化最小的是______(填编号).一定温度下,向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,两溶液中阴离子的总物质的量分别为n1和n2,则n1和n2的关系为n1______n2(填“>”、“<”或“=”).
(6)己知常温时Ksp(AgCl)=1.8×10-10mol2•L-2,向50mL 0.018mol•L-1的AgNO3溶液中加入相同体积0.020mol•L-1的盐酸,则c(Ag+)=______,此时所得混合溶液的pH=______. jc07231年前1
jc07231年前1 -
 77cx75 共回答了20个问题
77cx75 共回答了20个问题 |采纳率75%解题思路:(1)①六种盐都为强碱弱酸盐,盐的pH越大,说明对应的酸水解程度越大,则对应的酸越弱,根据强酸生成弱酸的特点判断反应能否进行;
②根据反应H2B(少量)+2A-=B2-+2HA,可知,HA酸性小于H2B,HA酸性最弱,酸性越弱,对应的酸根离子得H+能力越强;
(2)复分解反应中有一种条件是生成难溶物质,由②③可以看出,在饱和溶液中,可生成溶解度更小的物质;
(3)溶液中的c(H+)=10-9mol.L-1,说明溶液呈碱性;
(4)一水合氨为弱电解质,不能完全电离,pH相同时,氨水浓度最大;
(5)CH3COONa为强碱弱酸盐,水解呈碱性,且水解程度较小,加水稀释时,浓度减小同时促进水解,但pH变化不大;向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,NaCN水解程度比大CH3COONa,结合溶液电中性原则分析;
(6)根据溶度积常数计算.(1)①六种盐都为强碱弱酸盐,盐的pH越大,说明对应的酸水解程度越大,则对应的酸越弱,则
A.CH3COOH酸性大于HCN,反应能发生,故A正确;
B.酸性H2CO3>HClO>HCO3-,应生成NaHCO3,反应不能发生,故B错误;
C.酸性H2CO3>HClO>HCN,应生成NaHCO3,不能生成CO2,故C错误;
D.酸性C6H5OH>HCO3-,反应能发生,故D正确;
E.酸性H2CO3>C6H5OH>HCO3-,反应能发生,故E正确,
故答案为:BC;
②据反应H2B(少量)+2A-=B2-+2HA,可知,HA酸性小于H2B,HA酸性最弱,酸性越弱,对应的酸根离子得H+能力越强,没有HB-生成,说明得电子能力A-大于HB-,则得电子能力顺序为A->B2->HB-,故答案为:A->B2->HB-;
(2)各反应均有固体生成,其溶解度更小,故复分解反应能够向生成更难溶的物质的方向进行,
故答案为:由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行;
(3)溶液中的c(H+)=10-9mol•L-1,说明溶液呈碱性,只有Na2S和NaOH符合,故答案为:CD;
(4)一水合氨为弱电解质,不能完全电离,与盐酸反应至中性时,氨水应稍过量,则b>a,c(OH -)=1.0×10-3mol•L-1的氨水,一水合氨浓度远大于1.0×10-3mol.L-l的氨水,反应至中性时,a>c,氢氧化钡为强碱,与盐酸完全中和时,a=d,则b>a=d>c,
故答案为:b>a=d>c;
(5)CH3COONa为强碱弱酸盐,水解呈碱性,且水解程度较小,加水稀释时,浓度减小同时促进水解,但pH变化不大;向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,NaCN水解程度比大CH3COONa,两种溶液中c(Na+)相等,由于CH3COONa溶液中H+浓度大于NaCN溶液中H+的浓度,则CH3COONa溶液中阴离子浓度较大,
故答案为:③;>;
(6)向50mL 0.018mol•L-1的AgNO3溶液中加入相同体积0.020mol•L-1的盐酸,盐酸过量,反应后的c(Cl-)=[0.02mol/L×0.05L-0.018mol/L×0.05L/0.1L]=0.001mol/L,
则c(Ag+)=
Ksp(AgCl)
c(Cl-)=
1.8×10-10
0.001mol/L=1.8×10-7 mol/L,
c(H+)=[0.02mol/L×0.05L/0.1L]=0.01mol/L,
pH=2,
故答案为:1.8×10-7 mol/L; 2.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;弱电解质在水溶液中的电离平衡;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查较为综合,题目难度较大,易错点为(1),注意弱电解质的比较方法以及判断角度.1年前查看全部
- 强酸和弱酸的问题Br2+SO2+2H2O=2HBr+H2SO4 二氧化硫和水是亚硫酸,但是这里亚硫酸制成了硫酸,怎么变成
强酸和弱酸的问题
Br2+SO2+2H2O=2HBr+H2SO4
二氧化硫和水是亚硫酸,但是这里亚硫酸制成了硫酸,怎么变成了弱酸制强酸? 伪装的潇洒1年前6
伪装的潇洒1年前6 -
 juanjuanlove 共回答了20个问题
juanjuanlove 共回答了20个问题 |采纳率90%这里发生的是氧化还原反应和强酸弱酸没有关系!Br2的氧化性比较强而SO2的还原性比较强,因此反映一般情况下能发生!1年前查看全部
- 关于鲁米诺的困惑鲁米诺(又称发光氨),它是一种黄色的晶体,一种刺激性的强酸.如果要跟血迹反应,是应该先把它配成溶液试剂吗
关于鲁米诺的困惑
鲁米诺(又称发光氨),它是一种黄色的晶体,一种刺激性的强酸.如果要跟血迹反应,是应该先把它配成溶液试剂吗?如果时晶体状态,可以跟血迹反应吗? 寓羚先尊1年前1
寓羚先尊1年前1 -
 裴不了 共回答了12个问题
裴不了 共回答了12个问题 |采纳率83.3%鲁米诺luminol,又名发光氨.可以鉴别经过擦洗,时间很久以前的血痕.它常温下是一种黄色晶体或者米黄色粉末,是一种比较稳定的化学试剂.它的化学式是C8H7N3O2 结构式在下面的图图里面有.同时,鲁米诺又是一种碱性物质,对眼睛、皮肤、呼吸道有一定刺激作用.在检验血痕时,鲁米诺与血红素(hemoglobin,血红蛋白中负责运输氧的一种蛋白质)发生反应,显出蓝绿色的荧光.鲁米诺的灵敏度可以达到一百万分之一.即1滴血混在 999,999滴水中时也可以被检验出来.不过它与其他具有氧化性的物质也发生反应,但是显示的颜色和显色的时间长短都是不同的.任何东西都不会不留痕迹地消失.这对于暴力犯罪受害者尤为适用.凶手可以处理掉受害者尸体,擦去一滩滩的血,但如果不使用强效清洁剂,仍将会留下一些痕迹.血液中的微小粒子将会附着在现场表面许多年,却无人知晓.
编辑本段基本原理
发光氨的基本原理是:几种化学物质与血液中的含氧蛋白——血红蛋白发生发光化学反应,从而显示血液的痕迹.分子会分裂成原子,原子重新组合成新分子.在这一特定反应中,反应物(原有分子)比生成物(生成分子)能量大.分子以可见光子的形式释放出多余的能量.这一过程通常称为化学发光,与萤火虫和荧光棒发光现象类似.
编辑本段适用范围
.使用发光氨的一个问题是化学反应会破坏犯罪现场的其他证据.基于这一原因,调查人员仅会在尝试其他办法之后,才使用发光氨.发光氨的确是警察的有用工具,但在现实犯罪调查中,并不像有些电视节目上使用得那样普遍.警察不会一走进犯罪现场,便开始向所有物体表面喷射发光氨.
编辑本段缺点
发光氨的缺点:它能照亮如铜和漂白剂等物质而不是血液.一直用发光氨来检测血液,也能摧毁血液证据,虽然研究证明一个能自行生产发育的DNA匹配经常在发光氨血液检测中被发现.最后一点就是,目前还不清楚发光氨是否是一种致癌物质.当CSI用发光氨检测血液时,他们首先将发光氨与过氧化氢混合.发光氨与过氧化氢进行化学反应.发光氨损耗氢和氮生成过氧化物,而过氧化物损耗氧生成发光氨.反应产生3个氨基.当发光氨进行化学反应时,它会损失电子,使之成为一个氧化反应.所以,在这个化学反应过程中,过氧化氢是氧化剂,因为它正在不断减少.反应后,3个氨基中的电子留在较高的能量水平.当电子回落到它们的正常能量水平,能量被释放,而人眼所看到的是一缕浅蓝色的光 虽然,发光氨的用途没有一些化学品的多.但是,在加拿大,在抓捕极端危险的罪犯时,它发挥了非常重要的作用,使其成为一个非常重要的化学品.1年前查看全部
- 强酸与强碱不等体积混合求PH值.例如:PH=1的盐酸与PH=13的强碱不等体积混合,体积比为1:9,混合后PH值为多少?
 击败猫的鱼1年前1
击败猫的鱼1年前1 -
 lq3623541 共回答了19个问题
lq3623541 共回答了19个问题 |采纳率89.5%计算混合前的氢离子数和氢氧根数,再算混合后的氢离子浓度.比如本题,酸的氢离子数是0.1mol,碱的氢氧根数是0.9mol,中和后还剩0.8mol,若溶液体积是10L,则氢氧根浓度为0.08mol/L,用十的负十四次方除以它,再求负指数,可以得到pH为11-log1.25(这里假设1:9就是1L:9L)1年前查看全部
- 牛血清蛋白在强酸条件下会如何变化
牛血清蛋白在强酸条件下会如何变化
在实验课中,牛清蛋白溶液用作标准蛋白溶液,用考马斯亮蓝染色后测吸光度,作标准曲线.
我想问,如果在pH等于1 的时候,牛血清蛋白会如何变化,是否还可以用作标准溶液?会变性, tiyloveyou1年前1
tiyloveyou1年前1 -
 沙漠一匹狼12 共回答了18个问题
沙漠一匹狼12 共回答了18个问题 |采纳率94.4%会发生变性反应1年前查看全部
- 强酸和强碱反映生成.强酸和弱碱生成.之类的总结 记得以前在参考书上看过
强酸和强碱反映生成.强酸和弱碱生成.之类的总结 记得以前在参考书上看过
还有一个问题 可以用FeCl3溶液 溴水来鉴别 己烯 甲苯 丙醛 理由是什么谢谢 雨中的风筝1年前2
雨中的风筝1年前2 -
 alyforever 共回答了20个问题
alyforever 共回答了20个问题 |采纳率85%能使溴水褪色者是己烯;
丙醛有还原性,可使黄色的三氯化铁几乎便无色;
剩下的则是甲苯.1年前查看全部
- 关于离子碱性强弱的问题HF是弱酸,HI是强酸,也就是说 酸性:HFI-而Lewis酸碱理论说,“碱是在反应过程中能够给出
关于离子碱性强弱的问题
HF是弱酸,HI是强酸,
也就是说 酸性:HFI-
而Lewis酸碱理论说,
“碱是在反应过程中能够给出电子对的物质”,
那么我是否可以理解为,物质给出电子对的能力越强,碱性越强呢?
如果可以这么理解的话,
F-和I-都是一价卤素离子,性质类似,
而F-的半径远比I-要小,
所以F-的还原性(失电子能力)远比I-要弱.
那么,
F-给出电子对的能力也是应比I-给出电子对的能力弱的,
那么它的碱性也应比I-弱.
这与事实不符,为何?是我理解的Lewis酸碱理论不对么?如果我没理解对的话,Lewis理论中如何判断酸碱的强弱呢?
Lewis理论,也叫“电子理论”
缺点:在判断酸碱强度时,电子理论和质子理论有部分冲突,如对Zn2+的判断
Zn2+是怎么样的矛盾呢?我举的卤素离子的例子就属于矛盾之列么? vbj_ii1年前1
vbj_ii1年前1 -
 wangwei_11221166 共回答了25个问题
wangwei_11221166 共回答了25个问题 |采纳率88%Lewis酸碱理论中的提供电子对,不等于氧化还原反应中的失去电子.
在Lewis酸碱理论中,F^-提供了电子对后,共用电子对仍可以偏向F原子,这样F并没有被氧化.举个例子,F^-和H^+结合成HF,F^-提供了共用电子对给H^+,所以F^-是Lewis碱,但是HF中的共用电子对仍偏向F原子.可见Lewis酸碱理论中的提供电子对,和氧化还原反应中的失去电子,是有区别的.1年前查看全部
- 强酸制弱酸原理,强酸制弱酸的原理为什么都从降低能量的角度来解释?谁能用什么常用的高中原理说一说?本人化学基础较差,但选修
强酸制弱酸原理,
强酸制弱酸的原理为什么都从降低能量的角度来解释?谁能用什么常用的高中原理说一说?本人化学基础较差,但选修4的化学原理还可以,新课标二卷的考生, huayuqian1年前1
huayuqian1年前1 -
 milaure111 共回答了19个问题
milaure111 共回答了19个问题 |采纳率100%强酸制弱酸,氢离子浓度减小,混乱度减小,生成的弱酸中的共价键,对外释放能量.所以能量降低.换句话说,逆向过程,由于弱酸电离是吸热的,同浓度的强酸溶液和稀酸溶液,要想稀酸溶液中氢离子浓度接近强酸的,通过加热途径可以实现,实际上就是供给能量,使体系能量升高1年前查看全部
- 已知周期表中,元素Q、W、Y与元素X相邻.R与Y同族.Y的最高化合价氧化物的水化物是强酸.回答下列问题:
已知周期表中,元素Q、W、Y与元素X相邻.R与Y同族.Y的最高化合价氧化物的水化物是强酸.回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料.W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是______;
(2)Q的具有相同化合价且可以相互转变的氧化物是______;
(3)R和Y形成的二种化合物中,Y呈现最高化合价的化合物是化学式是______;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)______,其原因是______
②电子总数相同的氢化物的化学式和立体结构分别是______;
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料.上述相关反应的化学方程式(各物质用化学式表示)是______. feifei87171年前1
feifei87171年前1 -
 小袄 共回答了20个问题
小袄 共回答了20个问题 |采纳率85%解题思路:(1)根据W与Q可以形成一种高温结构陶瓷材料,及W的氯化物分子呈正四面体结构可知W为硅,然后分析二氧化硅的晶体类型;
(2)根据高温结构陶瓷材料可知Q可能为氮元素,则二氧化氮与四氧化二氮可以相互转变;
(3)根据位置及Y的最高化合价氧化物的水化物是强酸、R和Y形成的二价化合物来推断R;
(4)根据氢键的存在来比较氢化物的沸点,并根据最外层电子数来分析结构;
(5)根据W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料,利用反应物与生成物来书写化学反应方程式.(1)W的氯化物为正四面体型,则应为SiCl4或CCl4,又W与Q形成高温陶瓷,故可推断W为Si,W的氧化物为SiO2,原子之间以共价键结合成空间网状结构,则为原子晶体,故答案为:原子晶体;(2)高温陶瓷可联想到Si3N4,Q为...
点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查位置、结构、性质的关系及应用,明确物质的性质及元素的位置来推断元素是解答的关键,并注意与元素化合物知识、原子结构与性质相联系来分析解答即可.1年前查看全部
- 复分解反应存在这样一个规律:较强酸可制取较弱酸.盐类的水解也是复分解反应,弱酸强碱盐对应的弱酸越弱,其盐越容易发生水解.
复分解反应存在这样一个规律:较强酸可制取较弱酸.盐类的水解也是复分解反应,弱酸强碱盐对应的弱酸越弱,其盐越容易发生水解.
A.CO2+H2O+2NaClO===Na2CO3+2HClO
B.CO2+H2O+NaClO===NaHCO3+HClO
弱酸的酸性由强到弱的顺序为CH3COOH、H2CO3、HClO、HCN、C6H5OH、HCO(注意:Na2CO3对应的弱酸为HCO,NaHCO3对应的弱酸为H2CO3A反应若生成HClO,则可与Na2CO3起反应生成NaClO和NaHCO3,A不能发生,B能发生
为什么A不能反映呢?我根本看不懂答案,明明强酸制弱酸,HClO不是可以制HCO(即Na2CO3)吗? leo_hu1年前3
leo_hu1年前3 -
 shastef 共回答了21个问题
shastef 共回答了21个问题 |采纳率90.5%CO2 + H2O就是H2CO3.H2CO3是二元酸,其一级电离:H2CO3 = H+ + HCO3-
与NaClO反应时,其实只有其一级电离出来的H+与ClO-发生反应,所以是得到NaHCO3与HClO
这里体现的强制弱,是“H2CO3”制“HClO".1年前查看全部
- 为什么高氯酸酸性最强?高溴酸,高碘酸,硝酸都是强酸,相同浓度下都能完全电离,那么ph应该相同啊?
 michelle12301年前3
michelle12301年前3 -
 神kk 共回答了17个问题
神kk 共回答了17个问题 |采纳率76.5%酸性有强弱,只是水中都 反应变成了水合氢离子,故酸性一样,也就是说在水这个溶剂中不能区分这几个酸的酸性强弱1年前查看全部
- 酸碱混合常温下,将体积V1,PH=a,的某一元强碱与体积为V2,PH=b的某二元强酸混合.若所得溶液的PH=11,且a=
酸碱混合
常温下,将体积V1,PH=a,的某一元强碱与体积为V2,PH=b的某二元强酸混合.
若所得溶液的PH=11,且a=13,b=2,则V1:V2=__:__ liang36267991年前1
liang36267991年前1 -
 yu6112 共回答了19个问题
yu6112 共回答了19个问题 |采纳率89.5%(V1*0.1-V2*0.01)/(V1+V2)=0.001
V1:V2=1:91年前查看全部
- 化学以弱碱和盐制强碱用硫化氢和硫酸铜溶液可以制硫酸,是弱酸制强酸 那么有没有一种弱碱和盐可以制强碱? 可以多举几个例子吗
 鉃麮钫銄1年前1
鉃麮钫銄1年前1 -
 尼克库博 共回答了23个问题
尼克库博 共回答了23个问题 |采纳率82.6%氨是弱碱,甲基化后生成甲胺,是强碱.其他广义的:水,醇等是弱碱,与金属钠反应生成强碱.碳酸氢钠、碳酸氢钾等是较弱的碱,加热生成碱性较强的碳酸盐.氯化钠电解得到氢氧化钠.还有络合的超强碱,也是用一般强碱制的,但碱性更强.1年前查看全部
- 强酸的酸式盐以及弱酸的酸式盐 如碳酸氢钾显什么性?
 foolish_jr1年前3
foolish_jr1年前3 -
 白蛇传的小编剧 共回答了25个问题
白蛇传的小编剧 共回答了25个问题 |采纳率88%酸式盐可能是酸性,也可能是碱性的,这就要看酸式盐的电离和水解程度那个大,水解能力大的则碱性强,例如:KHCO3,HCO3-的水解能力大于电力能力,所以是碱性的;若电解能力强,则显酸性,例如:KH2PO4酸性的.1年前查看全部
- 强酸 弱酸 一元酸 二元酸 等导电能力由强到弱顺序是怎样的?
 wtt2011年前1
wtt2011年前1 -
 阳光无风 共回答了17个问题
阳光无风 共回答了17个问题 |采纳率94.1%其导电能力由电离电子决定,电离粒子越多,导电性越好,所以强酸大于弱酸,二元酸大于一元酸1年前查看全部
- 一道关于PH值的科学题完全中和某一强酸溶液,需用10克溶质质量分数为百分之5.6的KOH溶液.如果改用10克溶质质量分数
一道关于PH值的科学题
完全中和某一强酸溶液,需用10克溶质质量分数为百分之5.6的KOH溶液.如果改用10克溶质质量分数为百分之5.6的NaOH溶液,反应后溶液的PH值是大于7还是小于7或等于7
不过答案好像是大于7 谁能给我详细的思路啊 iiilhb1年前1
iiilhb1年前1 -
 lcmxx 共回答了20个问题
lcmxx 共回答了20个问题 |采纳率85%考虑相对分子质量就行,KOH的相对分子质量要比NaOH要大.然后通过化学方程式可以得出反应相同质量的酸,需要相对分子质量小的碱比相对分子质量大的碱要少.1年前查看全部
- 分别在强酸溶液,强碱溶液中什么离子不能共存
 a4480757031年前2
a4480757031年前2 -
 eamison 共回答了16个问题
eamison 共回答了16个问题 |采纳率81.3%强酸:
氢氧根,偏铝酸根,碳酸根,碳酸氢根,醋酸根,亚硫酸根,亚硫酸氢根,氟离子,硫离子,硫氢根,亚铜离子,次氯酸根,硅酸根等
强碱:
氢离子,铝离子,镁离子,铜离子,亚铁离子,铁离子,铵根离子,碳酸氢根,亚硫酸氢根,硫氢根,汞离子,银离子,亚铜离子等1年前查看全部
- 弱酸与强酸混合pH计算可以计算的吗?
 八卦中成长1年前1
八卦中成长1年前1 -
 txfck 共回答了18个问题
txfck 共回答了18个问题 |采纳率88.9%大多数无法直接计算,只能知道大概的ph值.如果给出一些数据,还是可以计算的.比如醋酸和盐酸混合,告诉醋酸根和盐酸的浓度,则可以计算.1年前查看全部
- 如何判断盐是酸性还是碱性,但看成分,不知道是不是强酸或者是强碱.
 feiji021031年前2
feiji021031年前2 -
 漠之水 共回答了17个问题
漠之水 共回答了17个问题 |采纳率82.4%如果是强酸强碱盐像硫酸钠氯化钠就是中性;
是弱酸强碱盐像碳酸钠的酸根离子就会水解生成碳酸氢根和氢氧根呈碱性;
强酸弱碱盐像硫酸铁,氯化铝金属离子会水解放出氢离子所以呈酸性;
弱酸弱碱盐就要看这两种离子谁的水解性更强,谁强显示对方的性质,例如某种铵盐中铵根离子水解性强就显酸性.1年前查看全部
- 好像磷酸也能制造硫酸吧磷酸+硫酸铜溶液=磷酸铜(沉淀)+硫酸.“必须是强酸才能制弱酸”这话也不完全对!这个实验如果倒过来
好像磷酸也能制造硫酸吧
磷酸+硫酸铜溶液=磷酸铜(沉淀)+硫酸.“必须是强酸才能制弱酸”这话也不完全对!这个实验如果倒过来应该不成立,因为没有沉淀、气体和水生成!我能拿诺化奖啦!
 hong999long1年前1
hong999long1年前1 -
 xjy1979 共回答了18个问题
xjy1979 共回答了18个问题 |采纳率100%点击率低1年前查看全部
大家在问
- 1硬币的两面用英语怎么表达,一般比赛或决定什么的时候总是抛硬币,那么“抛硬币来决定吧” 如何表达?
- 2求函数y=丨3-x丨+丨x-1丨的最小值
- 3欧洲气候类型的分布与地形的关系
- 4下面这句话中为什么positive attitude用的是单数,而后面的productive communication
- 5两个同样的长方形,长都是6厘米,宽都是3厘米,分别拼成一个正方形和一个长方形,它们周长分别是多少厘米
- 6your is a small potato
- 7已知阴离子A2-的原子核内有x个中子,A原子的质量数为m,则Wg A2-含有电子的物质的量为( )
- 8我最喜欢的运动 英文的关于篮球的,50字左右,别出现真名,最好是小学到初中的水平.走过路过别错,分不会少你的,
- 9跪求解初三物理题!两种金属密度分别为p1,p2,区质量相同的这两种金属做成合金,是证明该合金密度为 (2p1p2)/(p
- 10描写人物动作的和含“笑”字的四字词语
- 11凝结泵的冷却水和密封水一样吗
- 12他之前已经读过这本书了吗?用英语怎么写?
- 13寒风(呼啸) 海浪(拍岸) 雪花( ) 阳光( ) 又冷又黑的夜晚 又 又 的教堂 又 又 的 又 又 的
- 145个包子15元,20盘包子可以卖多少钱。第一个回答必采纳
- 15好好珍惜一直在身旁关心你的朋友们用英语翻译

