在氯化铜、氯化铝溶液中加入过量的铁粉,充分反应后过滤,滤液里的溶质是( )
 cey002022-10-04 11:39:541条回答
cey002022-10-04 11:39:541条回答A.氯化铜
B.氯化铝
C.氯化铁
D.氯化亚铁和氯化铝

已提交,审核后显示!提交回复
共1条回复
 水果月亮 共回答了15个问题
水果月亮 共回答了15个问题 |采纳率100%- 解题思路:铜不如铁活泼,因此铁和氯化铜反应生成氯化亚铁和铜;
铝比铁活泼,铁不能和氯化铝反应.氯化铝不能和铁反应;
铁和氯化铜反应生成氯化亚铁和铜,因此在氯化铜、氯化铝溶液中加入过量的铁粉,充分反应后过滤,滤液里的溶质是氯化亚铁和氯化铝.
故选:D.点评:
本题考点: 金属的化学性质.
考点点评: 金属活动性顺序中,排在前面的金属,能够把排在后面的金属从它的盐溶液中置换出来,这里要注意是从它的盐溶液中置换出来,如果排在后面的金属形成的盐不溶于水,则不能发生置换反应,要注意理解. - 1年前
相关推荐
- 现有铁、氧化铁、稀硫酸、氢氧化镁、氢氧化钠溶液、氯化铜溶液六种物质,两两混合能发生的反应有 [ &
现有铁、氧化铁、稀硫酸、氢氧化镁、氢氧化钠溶液、氯化铜溶液六种物质,两两混合能发生的反应有 [ ]A.4个
B.5个
C.6个
D.7个 在线挨砸1年前1
在线挨砸1年前1 -
 lkek 共回答了18个问题
lkek 共回答了18个问题 |采纳率94.4%C1年前查看全部
- 氯化铜与氢氧化钙反应后的废液怎么处理
 stella_shao1年前3
stella_shao1年前3 -
 云天8899 共回答了22个问题
云天8899 共回答了22个问题 |采纳率95.5%废液可以通入稀盐酸中1年前查看全部
- 什么可溶于硝酸银A铜B碳酸铜C氧化铜D氯化铜
 hwei6781年前1
hwei6781年前1 -
 weilianlian 共回答了19个问题
weilianlian 共回答了19个问题 |采纳率84.2%D 生成氯化银沉淀1年前查看全部
- 初中化学题有一包固体粉末,可能含有碳酸钠.硫酸钠.硝酸钡.氯化钾和氯化铜中的一种或几种.为确定其组成,进行如下实验: (
初中化学题
有一包固体粉末,可能含有碳酸钠.硫酸钠.硝酸钡.氯化钾和氯化铜中的一种或几种.为确定其组成,进行如下实验:
(1)取该固体粉末少量,加足量水,搅拌,静置,得到白色沉淀,上层为无色溶液;
(2)过滤,在白色沉淀中加入少量稀硝酸,白色沉淀有一部分溶解且有无色气体产生.依据上述实验,对白色沉淀判断正确的是( )
A.一定含有碳酸钠.硫酸钠.硝酸钡.氯化钾,可能含有氯化铜·
B·一定含有碳酸钠·硫酸钠·硝酸钡,一定不含氯化铜,可能含有氯化钾
C·一定含有碳酸钠·硫酸钠·硝酸钡,可能含有氯化铜·氯化钾
D·一定含有碳酸钠·硝酸钡,一定不含硫酸钠氯化铜,可能含有氯化钾
要答案和解释 谢谢 骷髅男1年前7
骷髅男1年前7 -
 沙子a 共回答了13个问题
沙子a 共回答了13个问题 |采纳率84.6%(1)取该固体粉末少量,加足量水,搅拌,静置,得到白色沉淀,上层为无色溶液(没有氯化铜,铜离子的溶液为蓝色);
(2)过滤,在白色沉淀中加入少量稀硝酸,白色沉淀有一部分溶解且有无色气体产生
部分溶解(部分不溶解)且有无色气体产生 沉淀是碳酸钡,所以一定有碳酸钠·和硝酸钡,
部分不溶解,沉淀是硫酸钡,所以一定有硫酸钠·和硝酸钡,
所以 选 B1年前查看全部
- 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图1连接.
 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图1连接.
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图1连接.
(1)如果把电键K接A,Zn②的电极反应为______.
(2)上述反应进行5min后,转换电键K到B,Zn①的电极反应式是______.
(3)将Zn②换成铁片,电解质溶液换成ZnCl2饱和溶液,把电键K接A,此时该装置为______,阴极电极反应式为______.
(4)将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,如图2所示.
正极上发生的电极反应为______
阴极上发生的电极反应为______. 新123151年前1
新123151年前1 -
 cypxxx 共回答了20个问题
cypxxx 共回答了20个问题 |采纳率85%解题思路:(1)如果把电键K接A,由图可知,为电解装置,Zn②与负极相连,为电解池阴极,发生还原反应生成铜,Zn①极为阳极,发生氧化反应;
(2)反应进行5min后,转换电键K到B,为原电池装置,Zn①为负极,发生Zn置换Cu的反应;
(3)将Zn②换成铁片,电解质溶液换成ZnCl2饱和溶液,把电键K接A,为电镀装置,镀层金属为阳极,阴极发生还原反应;
(4)将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,甲形成原电池反应,锌为负极,铁为正极;
乙为电解反应,铁为阳极被氧化生成亚铁离子,阴极发生还原反应生成氢气.(1)Zn②极为阴极,发生还原反应生成铜,电极方程式为Cu2++2e-=Cu,
故答案为:Cu2++2e-═Cu;
(2)反应进行5min后,转换电键K到B,为原电池装置,Zn①为负极,电极方程式为Zn-2e-═Zn2+,
故答案为:Zn-2e-═Zn2+;
(3)将Zn②换成铁片,电解质溶液换成ZnCl2饱和溶液,把电键K接A,为电镀装置,镀层金属Zn为阳极,阴极发生还原反应,电极方程式为Zn2++2e-═Zn,
故答案为:电镀池;Zn2++2e-═Zn;
(4)将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,甲形成原电池反应,锌为负极,铁为正极;
正极反应的电极方程式为2H2O+O2+4e-═4OH-,乙为电解反应,铁为阳极被氧化生成亚铁离子,阴极发生还原反应生成氢气,电极方程式为2H++2e-═H2↑,
故答案为:2H2O+O2+4e-═4OH-;2H++2e-═H2↑.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池和电解质,侧重装置的分析及原理的考查,注意开关K的位置变化及发生的反应是解答的关键,题目难度中等.1年前查看全部
- (2009•鞍山)在氯化铜和氯化镁的混合溶液中,加入过量的铁粉,充分反应后过滤,留在滤纸上的物质是( )
(2009•鞍山)在氯化铜和氯化镁的混合溶液中,加入过量的铁粉,充分反应后过滤,留在滤纸上的物质是( )
A.Fe和Cu
B.Cu
C.Fe
D.Mg和Cu 闲人浪子1年前1
闲人浪子1年前1 -
 烟影夜 共回答了12个问题
烟影夜 共回答了12个问题 |采纳率91.7%解题思路:在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.在金属活动性顺序中,铜、镁、铁的活动性顺序为镁>铁>铜,加入过量的铁粉,铁能将铜置换出来仍有剩余,而不能将镁置换出来,所以一定有固体铁和铜;
故选A.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 氯化铜与氧化镁的混合溶液中加入一定质量的铁粉,充分反应后过滤.在滤渣中加入稀硫酸有气泡产生,则滤液中一定含有的阳离子是什
氯化铜与氧化镁的混合溶液中加入一定质量的铁粉,充分反应后过滤.在滤渣中加入稀硫酸有气泡产生,则滤液中一定含有的阳离子是什么?
滤渣中一定含有的物质是什么? 让自己快乐些1年前4
让自己快乐些1年前4 -
 7221178 共回答了16个问题
7221178 共回答了16个问题 |采纳率93.8%因为加稀硫酸有气泡产生,所以铁粉一定过量,即铜全部被置换出来了
滤液中一定含有的阳离子有Mg2+,Fe2+
滤渣中一定含有Fe,Cu1年前查看全部
- 某化学试剂厂,有甲,乙,丙,丁四个车间,排放的废水中分别有氯化铜,硫酸,氢氧化钠,碳酸钠中的一种?
 蒙蒙大大大1年前3
蒙蒙大大大1年前3 -
 ck3lkjfaslkd 共回答了24个问题
ck3lkjfaslkd 共回答了24个问题 |采纳率95.8%给出完整的题目1年前查看全部
- 氯化铜与氧化铝反应,而硫酸铜不与氧化铝反应说明氯的性质比铜活泼吗?
 xzm05281年前1
xzm05281年前1 -
 龙行无忌杰 共回答了22个问题
龙行无忌杰 共回答了22个问题 |采纳率100%不是,氯(盐酸根)比硫酸根活泼1年前查看全部
- 化学题,速度给答案谢谢!根据金属活动性顺序。判断下列反应是否发生?写出化学方程式1.铜跟硝酸根溶液 2.锌跟氯化铜溶液
化学题,速度给答案谢谢!
根据金属活动性顺序。判断下列反应是否发生?写出化学方程式1.铜跟硝酸根溶液 2.锌跟氯化铜溶液 3.汞跟稀盐酸溶液 4.铜跟硝酸汞溶液
 家住层城邻汉苑1年前1
家住层城邻汉苑1年前1 -
 maomao850711 共回答了19个问题
maomao850711 共回答了19个问题 |采纳率89.5%1.Cu+2AgNO3===2Ag+Cu(NO3)22.Zn+CuCl2===Cu+ZnCl23.不反应4.Cu+Hg(NO3)2====Hg+Cu(NO3)21年前查看全部
- 氯化铜溶液中含有少量氯化铁杂质,若要制得纯净的氯化铜,向溶液中加入下列试剂,不能达到目的的是 A
氯化铜溶液中含有少量氯化铁杂质,若要制得纯净的氯化铜,向溶液中加入下列试剂,不能达到目的的是 A
氯化铜溶液中含有少量氯化铁杂质,若要制得纯净的氯化铜,向溶液中加入下列试剂,不能达到目的的是
A,NaOH B,CuO C,Cu(OH)2 D,Cu(OH)2CO3 fowler151年前2
fowler151年前2 -
 fiona328 共回答了17个问题
fiona328 共回答了17个问题 |采纳率88.2%因为氢氧化铁的溶度积大于氢氧化铜,所以先生成氢氧化铜沉淀,故A不行!
由于Fe3+ + 3H20 == 3Fe(OH)3 + 3H+
加另外三种物质都可以消耗H+,促进Fe3+水解,故B.C.D可以!1年前查看全部
- 氯化钙氯化锌氯化钡氯化铝氯化钾氯化银氯化铁氯化亚铁氯化铜氯化亚铜硫酸钠硫酸铜硫酸锌硫酸镁硫酸钡硫酸钙硫酸铝硫酸铁硫酸亚铁
氯化钙
氯化锌
氯化钡
氯化铝
氯化钾
氯化银
氯化铁
氯化亚铁
氯化铜
氯化亚铜
硫酸钠
硫酸铜
硫酸锌
硫酸镁
硫酸钡
硫酸钙
硫酸铝
硫酸铁
硫酸亚铁
硫酸铵
硫酸钾
碳酸钙
碳酸钾
碳酸钠
碳酸银
碳酸钡
碳酸镁
碳酸锌
碳酸铵
硝酸钾
硝酸钠
硝酸银
硝酸钙
硝酸镁
硝酸钡
硝酸锌
硝酸铜
硝酸铁
硝酸亚铁
硝酸铵
硝酸汞 海岸之珠1年前2
海岸之珠1年前2 -
 charmcao 共回答了20个问题
charmcao 共回答了20个问题 |采纳率100%氯化钙CaCl2
氯化锌ZnCl2
氯化钡BaCL2
氯化铝AlCl3
氯化钾KCl
氯化银AgCl
氯化铁FeCl3
氯化亚铁FeCl2
氯化铜CuCl2
氯化亚铜CuCl
硫酸钠Na2SO4
硫酸铜CuSO4
硫酸锌ZnSO4
硫酸镁MgSO4
硫酸钡BaSO4
硫酸钙CaSO4
硫酸铝Al2(SO4)3
硫酸铁Fe2(SO4)3
硫酸亚铁FeSO4
硫酸铵(NH4)2SO4
硫酸钾K2SO4
碳酸钙CaCO3
碳酸钾K2CO3
碳酸钠Na2CO3
碳酸银Ag2CO3
碳酸钡BaCO3
碳酸镁MgCO3
碳酸锌ZnCO3
碳酸铵(NH4)2CO3
硝酸钾KNO3
硝酸钠NaNO3
硝酸银AgNO3
硝酸钙Ca(NO3)2
硝酸镁Mg(NO3)2
硝酸钡Ba(NO3)2
硝酸锌Zn(NO3)2
硝酸铜Cu(NO3)2
硝酸铁Fe(NO3)3
硝酸亚铁Fe(NO3)2
硝酸铵NH4NO3
硝酸汞Hg(NO3)21年前查看全部
- 有一纯求为80%铁7G,能与多少克的氯化铜反应,而生成的金属质量又是多少?)
 我是小天天1年前1
我是小天天1年前1 -
 你很rr 共回答了16个问题
你很rr 共回答了16个问题 |采纳率87.5%m(Fe)=7g*80%=5.6g
Fe+CuCl2=FeCl2+Cu
56 135 127 64
5.6g x y
56/5.6=135/x=64/y
x=13.5g
y=6.4g
能与13.5g氯化铜反应,生成金属质量6.4g1年前查看全部
- 除去氯化铁溶液中的氯化铜,其方法为
 舍予亭1年前1
舍予亭1年前1 -
 jer6688f 共回答了22个问题
jer6688f 共回答了22个问题 |采纳率95.5%pH调到2.9,此时Fe3+沉淀完全,Cu2+还没开始沉淀,然后取沉淀Fe(OH)3再用盐酸溶解就好了.1年前查看全部
- 【1】分离氯化钠,氯化铜,碳酸钡的混合物,在不引入新杂质的条件下,可以依次加入的一组试剂是()
【1】分离氯化钠,氯化铜,碳酸钡的混合物,在不引入新杂质的条件下,可以依次加入的一组试剂是()
A水.盐酸.氢氧化钡 B水 氢氧化钠 盐酸
C 水 硫酸 氢氧化钙 D水 氢氧化钡 盐酸
【2】下列物质能在PH=1的溶液中共存且形成的溶液为无色的是( )
A .(NH4)2SO4 ;HCl ;NaNO3; K2SO4
B,K2SO4 ; KNO3; H2SO4; KMnO4
C,.BaSO4; NaCl; KNO3; Na2CO3
D,BaCl2; NaNO3; KCl; H2SO4
【3】【双选】在一定条件下,反应物溶液中质量的质量分数越大,化学反应速率越快.现有50g溶质的质量分数为百分之32的硫酸溶液与过量的锌粉反应.为了减缓反应速率,而不影响生成的H2总质量.可向硫酸中加入适量的()
A氢氧化钾溶液 B氯化钾溶液 C碳酸钾溶液 D水
【要解释为什么选这个选项】
【我就剩这么多分了】
(1)黑8 三套 13题
(2黑8 三套 16题
(3黑8 三套 18题 hr3651年前1
hr3651年前1 -
 oo之痛痛 共回答了16个问题
oo之痛痛 共回答了16个问题 |采纳率75%不求悬赏只求最佳
1,选B
加入水后,碳酸钡不溶,分离出去,溶液中剩下氯化钠和氯化铜,然后加入氢氧化钠生成氢氧化铜沉淀,然后用盐酸与溶液中剩余的氢氧化钠反应,蒸发结晶得氯化钠,盐酸与氢氧化铜反应使其溶解,在氯化氢气体氛围中蒸发溶液得氯化铜
2,选A
B选项溶液显高锰酸钾溶液的紫色,C选项pH=1酸性溶液中不会存在碳酸根,且硫酸钡不溶于水D选项溶于水后会生成硫酸钡沉淀
3,选BD
A氢氧根会与氢离子反应影响氢气的生成量C碳酸根与氢离子反应会影响氢气的生成量BD都相当于稀释了硫酸溶液,减缓了反应速率1年前查看全部
- (2006•杨浦区二模) 物质名称 碳酸 氢氧化镁 氯化铜 化学式 SO2 CuSO4•5H2O
(2006•杨浦区二模)
物质名称 碳酸 氢氧化镁 氯化铜 化学式 SO2 CuSO4•5H2O  言吾堂堂主1年前1
言吾堂堂主1年前1 -
 brokenman 共回答了16个问题
brokenman 共回答了16个问题 |采纳率87.5%解题思路:根据化合价原则书写化学式,根据物质命名原则给物质命名.碳酸由氢离子和碳酸根离子组成,氢离子显+1价,碳酸根离子显-2价,根据化合价原则,其化学式可表示为:H2CO3;
由两种元素构成的化合物读作某化某,有时读出元素符号右下角的数字,故SO2读作二氧化硫;
氢氧化镁由显+2价的镁元素和显-1价的氢氧根组成,根据化合价原则,其化学式为:Mg(OH)2;
CuSO4•5H2O是带着5个结晶水的硫酸铜,故读作五水硫酸铜;
氯化铜由显+2价的铜元素和显-1价的氯元素组成,根据化合价原则,其化学式可表示为:CuCl2;
故答案为:
二氧化硫 五水硫酸铜
H2CO3 Mg(OH)2 CuCl2点评:
本题考点: 化学式的书写及意义.
考点点评: 明确化学式的书写方法及物质组成是解答本题关健.1年前查看全部
- 现有硫酸镁,硝酸钡,氢氧化钠,氯化铜,氯化钾五种溶液,不加任何其他试剂 被鉴别出的先后顺序正确的是
 xbcdsfghsdfg1年前4
xbcdsfghsdfg1年前4 -
 带微笑的眼泪 共回答了26个问题
带微笑的眼泪 共回答了26个问题 |采纳率88.5%首先观察颜色,蓝绿色的氯化铜,其他都是无色的;
各取少量试剂,将氯化铜分别滴入,能够产生沉淀的是氢氧化钠(沉淀是氢氧化铜,具体什么颜色忘记了,应该是蓝色的吧.);
另取其他三种试剂少量,滴入氢氧化钠,产生白色沉淀的是硫酸镁(沉淀是氢氧化镁);
另取剩余两种试剂少量,滴入硫酸镁,产生白色沉淀的是硝酸钡(沉淀是硫酸钡);
剩下的没有反应的就是氯化钾.
所以顺序是 氯化铜——氢氧化钠——硫酸镁——硝酸钡——氯化钾1年前查看全部
- 氧化铁,氯化铜的化学式是什么
 醉了散了1年前6
醉了散了1年前6 -
 qq西湖才子 共回答了24个问题
qq西湖才子 共回答了24个问题 |采纳率91.7%氧化铁 Fe2O3
氧化铜 CuO1年前查看全部
- 为什么在锌和盐酸反应中加入少的氯化铜可以加速.
 朔朔1年前1
朔朔1年前1 -
 zhengtaihuhu 共回答了20个问题
zhengtaihuhu 共回答了20个问题 |采纳率100%首先锌和置换出氯化铜中的铜,然后锌和铜就接触了,形成了原电池,加快反应速率了.因为电子移动加快了.不懂继续追问.1年前查看全部
- 请回答以下几个化学问题1.生锈的铁钉加入氢氧化钠溶液后的现象2.氯化铜溶液加入氢氧化钠溶液后的现象3.生锈的铁钉加入氢氧
请回答以下几个化学问题
1.生锈的铁钉加入氢氧化钠溶液后的现象
2.氯化铜溶液加入氢氧化钠溶液后的现象
3.生锈的铁钉加入氢氧化钙溶液后的现象
4.氯化铜溶液加入氢氧化钙溶液后的现象
5.氢氧化钙露置在空气中的变化 穿上xx好逃命91年前1
穿上xx好逃命91年前1 -
 gzsdx 共回答了14个问题
gzsdx 共回答了14个问题 |采纳率92.9%1无
2蓝色沉淀(氢氧化铜)
3无
4蓝色沉淀(氢氧化铜)
5浑浊 (吸收二氧化碳生成碳酸钙)1年前查看全部
- 除去氯化铁中的杂质氯化铜
 红色的秋叶1年前1
红色的秋叶1年前1 -
 煊子 共回答了20个问题
煊子 共回答了20个问题 |采纳率95%亲爱的楼主:
1,向氯化铁和氯化铜的混合溶液中加入过量的铁
2,向溶液中加入过量的浓盐酸,把过量的铁溶解掉
3,稍微加热,使过量的盐酸挥发掉
祝您步步高升1年前查看全部
- 硫酸氢钠、碳酸氢钠、碳酸铵、氯化铜分别与酸和碱怎么反应?
硫酸氢钠、碳酸氢钠、碳酸铵、氯化铜分别与酸和碱怎么反应?
反应的写方程式
不反应的写清楚 黑皮大苍蝇1年前1
黑皮大苍蝇1年前1 -
 无雨雪 共回答了16个问题
无雨雪 共回答了16个问题 |采纳率87.5%硫酸氢钠在水中解离出H+ Na+ SO42-
碳酸氢钠在水中解离出Na+ HCO3-
碳酸铵在水中解离出NH4+ 碳酸根离子
氯化铜在水中解离出Cl-和Cu2+
以下是常见的酸碱,不考虑硝酸等
碱 :NaOH 酸:HCl为例
H+ 与OH-不能共存所以硫酸氢钠和碱反应 NaHSO4+NaOH=Na2SO4+H20
Cu2+与OH-不能共存所以氯化铜和碱反应
CuCl2+2NaOH=Cu(OH)2沉淀+2NaCl
HCO3-与OH-不能共存所以碳酸氢钠和碱反应
NaHCO3+NaOH=H2O+Na2CO3
NH4+与OH-不能共存所以碳酸铵和碱反应
(NH4)2CO3+2NaOH=2NH3气体+2H2O+Na2CO3
HCO3-与H+不能共存所以碳酸氢钠和酸反应
NaHCO3+HCl=CO2气体+H2O+NaCl
CO32-与H+不能共存所以碳酸铵和酸反应
(NH4)2CO3+2HCl=2NH4Cl+CO2气体+h2o
其他的应该不反应了吧
自己改写离子方程式吧1年前查看全部
- 氧化铁和氯化铜反应生成氯化铁和氧化铜?
 恒大电脑1年前1
恒大电脑1年前1 -
 hqb9978 共回答了18个问题
hqb9978 共回答了18个问题 |采纳率83.3%不会反应的1年前查看全部
- 氯化铜和硫酸铜谁的酸性强原因
 RainMisty1年前1
RainMisty1年前1 -
 dcliu123 共回答了23个问题
dcliu123 共回答了23个问题 |采纳率95.7%硫酸铜,因为硫酸强于盐酸1年前查看全部
- 铁加入氯化铁,氯化亚铁,氯化铜混合溶液中,反应后铁有剩余,则溶液中浓度最大的阳离子是?
 Lionswong1年前4
Lionswong1年前4 -
 blackhawk3 共回答了18个问题
blackhawk3 共回答了18个问题 |采纳率100%2价铁离子
3价铁会与铁反应生成2价铁离子!铁能与铜离子反应生成铜.铁有剩余,则溶液中没有铜离子,全部变成铜,也没有3价铁离子,全部是2价铁离子!1年前查看全部
- 除去氯化亚铁中的氯化铜可以用适量的夜态铁吗?
 小汐子1年前3
小汐子1年前3 -
 票票预先 共回答了15个问题
票票预先 共回答了15个问题 |采纳率100%可以,因为液态的铁带有很高的温度,能够还原铜,还原后只需过滤就除去氯化铜了.1年前查看全部
- 氯化铜溶液怎样得到无水氯化铜晶体
 小虫9301年前1
小虫9301年前1 -
 胡诌一通 共回答了16个问题
胡诌一通 共回答了16个问题 |采纳率87.5%因为氯化铜会水解,要通入HCl气体后加热蒸发浓缩冷却结晶可得到. 望采纳,谢谢!1年前查看全部
- 氯化铜晶体(CuCl2•xH2O)是重要的化工原料,可用作催化剂、消毒剂等.用孔雀石[主要含Cu2(OH)2CO3,还含
氯化铜晶体(CuCl2•xH2O)是重要的化工原料,可用作催化剂、消毒剂等.用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如下:
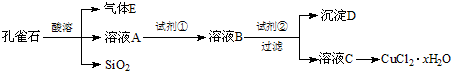
已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
(1)若溶液A含有的金属离子有Cu2+、Fe2+、Fe3+,则试剂①选用______(填字母).Fe3+ Cu2+ Fe2+ 开始沉淀的pH 2.7 5.4 8.1 沉淀完全的pH 3.7 6.9 9.6
A.CuB.Cl2C.NH3•H2OD.NaOH
(2)加入试剂②的目的是调节pH至a,a的范围是______.由溶液C获得CuCl2•xH2O,包含4个基本实验操作,这4个基本实验操作依次是______、______过滤和无水乙醇洗涤等操作,使用无水乙醇代替水进行洗涤的主要原因是______.
(3)为了测定制得的氯化铜晶体(CuCl2•xH2O)中x值,有同学设计了如下两种实验方案:
①称取一定质量的晶体加热使其失去结晶水,称量所得无水CuCl2的质量.该方案存在的问题是______.
②称取a g晶体、加入足量氢氧化钠溶液,过滤、洗涤、加热沉淀至质量不再减轻为止,称量所得固体的质量为b g.则x=[80a−135b/18b][80a−135b/18b](用含a、b的代数式表示). 香如玉1年前1
香如玉1年前1 -
 vcactor 共回答了19个问题
vcactor 共回答了19个问题 |采纳率100%解题思路:(1)由工艺流程转化关系可知,实现由溶液A至溶液B转化,目的是将Fe2+氧化为Fe3+,试剂①应为氧化剂,且不能引入新的杂质.
(2)由工艺流程转化关系可知,试剂②应为调节溶液pH值,使Fe3+转化为Fe(OH)3,除去Fe3+,不能沉淀Cu2+,结合金属离子从开始沉淀到沉淀完全时溶液的pH选择pH的范围.
由溶液到晶体需要蒸发浓缩、冷却结晶、过滤、洗涤等.使用无水乙醇代替水进行洗涤,防止CuCl2•xH2O晶体溶解损失.
(3)①CuCl2•xH2O晶体加热时会发生水解.
②加热沉淀至质量不再减轻为止,b g为CuO质量,根据铜元素守恒可知,n(CuO)=n(CuCl2•xH2O),再结合m=nM计算x的值.(1)由工艺流程转化关系可知,实现由溶液A至溶液B转化,目的是将Fe2+氧化为Fe3+,试剂①应为氧化剂,且不能引入新的杂质.
A.Cu不能与Fe2+反应,故A错误;
B.Cl2可以将Fe2+氧化为Fe3+,且不引入新杂质,故B正确;
C.NH3•H2O可以沉淀Cu2+、Fe2+、Fe3+,引入铵根离子,故C错误;
D.NaOH可以沉淀Cu2+、Fe2+、Fe3+,引入钠离子,故D错误.
故选:B.
(2)由工艺流程转化关系可知,试剂②应为调节溶液pH值,使Fe3+转化为Fe(OH)3,除去Fe3+,不能沉淀Cu2+,由金属离子从开始沉淀到沉淀完全时溶液的pH可知,Fe3+从pH=2.7开始沉淀,在pH=3.7沉淀完全,Cu2+从pH=5.4开始沉淀,所以应该可知pH范围为3.7~5.4.
由溶液获得CuCl2•xH2O晶体需要蒸发浓缩、冷却结晶、过滤、洗涤等.
氯化铜易溶于水,使用无水乙醇代替水进行洗涤,防止CuCl2•xH2O晶体溶解损失.
故答案为:3.7~5.4;蒸发浓缩、冷却结晶;防止CuCl2•xH2O晶体溶解损失.
(3)①CuCl2•xH2O晶体加热时会发生水解CuCl2+2H2O⇌Cu(OH)2+2HCl,有HCl气体放出,CuCl2质量偏小,测得x值偏大.
故答案为:CuCl2•xH2O晶体加热时会发生水解.
②b g为CuO质量为[bg/80g/mol]=[b/80]mol,根据铜元素守恒可知,n(CuO)=n(CuCl2•xH2O),所以ag=[b/80]mol×(135+18x)g/mol,解得,x=[80a−135b/18b].
故答案为:[80a−135b/18b].点评:
本题考点: 制备实验方案的设计;化学方程式的有关计算;常见阳离子的检验;探究物质的组成或测量物质的含量.
考点点评: 考查阅读获取信息能力、对工艺流程理解与实验条件控制、实验方案的评价、化学计算、物质分离提纯除杂等有关实验操作以及在新情境下综合运用知识解决问题的能力.题目难度中等,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,注意基础知识的全面掌握.1年前查看全部
- 氯化铜与水的反应的化学方程式怎样的?
 who061年前1
who061年前1 -
 wanghongqi1120 共回答了17个问题
wanghongqi1120 共回答了17个问题 |采纳率82.4%氯化铜与水再常温下是不反应的!好像高中的时候,在电解反映里有它,可以发电!好像是!氯化铜溶液电解质后溶液的PH应该是增大的.x0d因为氯化铜溶液电解的方程式为:x0dCuCl2=电解=Cu+Cl2(气体)x0d从方程式中可以看出,溶液中的Cu2+离子被消耗,x0d因为Cu2+水解生成H+,使溶液呈酸性,则Cu2+离子被消耗后.x0d没有水解出来的H+,则溶液的PH应该是增大的.x0d中学阶段,氯化铜的电解是不考虑氯气溶解于水的.x0d因此就不考虑溶解在水中后对溶液PH的影响.x0d不知道你说的是你懂了没有.x0d不过考试的话,不用考虑氯气溶解在水中,因此PH应该是增大的.而在实际中情况就多了.1年前查看全部
- 正极是铁,负极是铁,电解质溶液是氯化铜,写出电极反应和总反应
 不长叶子之树1年前4
不长叶子之树1年前4 -
 男人孟 共回答了20个问题
男人孟 共回答了20个问题 |采纳率95%负极,Cu2+ +2e-=cu
正极,2cl- -2e-=Cl2
CuCl2=(电解)=Cu+Cl21年前查看全部
- 晶体和固体有什么区别是化学上的晶体,不是物理上的,比如氯化铜晶体为绿色,而氯化铜固体为蓝色,那一定有区别,是什么区别?
 狐狸和妖精1年前4
狐狸和妖精1年前4 -
 大嘴- 共回答了25个问题
大嘴- 共回答了25个问题 |采纳率80%晶体都是固态的,具有固定的形态,一般中学阶段所讲的是有结晶水的,一般是纯净物,或金属晶体,原子晶体,分子晶体的分类.而固体仅仅是固态的,可以是混合物,没有严格的特点.1年前查看全部
- 铝与盐酸反应、铝与氢氧化钠溶液反应、锌粒与氯化铜溶液反应的化学方程式和离子方程式各是什么?
 啾啾鳞1年前1
啾啾鳞1年前1 -
 神秘dē猫 共回答了10个问题
神秘dē猫 共回答了10个问题 |采纳率80%2Al+6HCl===2AlCl3+3H2↑
2Al+6H+===2Al3++3H2↑
2Al+ 2NaOH + 2H2O=== 2NaAlO2+ 3H2↑
2Al+ 2OH-+2H2O===2AlO2-+3H2↑
Zn+CuCl2===Cu+ZnCl2
Zn+Cu2+===Cu+Zn2+1年前查看全部
- 根据以下叙述制备氯化铜:先将浓盐酸用蒸气加热至80℃左右,慢慢加入含有FeO杂质的CuO粉,充分反应,使其溶解.已知:F
根据以下叙述制备氯化铜:先将浓盐酸用蒸气加热至80℃左右,慢慢加入含有FeO杂质的CuO粉,充分反应,使其溶解.已知:FeS不溶于水,但溶于酸;在除去溶液中的Fe 2+ 时,可采用的方法是( )
溶液中被沉淀离子 Fe 3+ Fe 2+ Cu 2+ 完全生成氢氧化物沉淀时,溶液的pH ≥3.7 ≥9.6 ≥6.4 A.可直接加碱,调整溶液的pH≥9.6 B.加入纯铜粉,将Fe 2+ 还原为Fe C.先将Fe 2+ 氧化成Fe 3+ ,再调整溶液pH至3~4 D.通入H 2 S使Fe 2+ 直接沉淀  一地碎发1年前1
一地碎发1年前1 -
 宇宙猪之ww姐 共回答了18个问题
宇宙猪之ww姐 共回答了18个问题 |采纳率83.3%A、因直接加碱,调整溶液pH≥9.6,Fe 2+ 以Fe(OH) 2 形式完全沉淀,此时的pH≥9.6,同时Cu 2+ 以Cu(OH) 2 的形式完全沉淀,不但除去了Fe 2+ ,也除去了Cu 2+ ,不符合除杂的原则,故A错误;
B、因铜粉的还原性比铁弱,不能将Fe 2+ 还原出来,故B错误;
C、将Fe 2+ 氧化成Fe 3+ ,Fe 3+ 以Fe(OH) 3 形式完全沉淀,pH在3~4,此时Cu 2+ 形成没有沉淀,过滤除去Fe(OH) 3 沉淀,既除去除去了杂质,也没有除去原物质,故C正确;
D、FeS不溶于水,但溶于酸,通入硫化氢,不能除去Fe 2+ ,但使Cu 2+ 形成CuS沉淀,除去了Cu 2+ ,不符合除杂的原则,故D错误;
故选C.1年前查看全部
- 在氯化铁,氯化铜,和盐酸混合溶液中加入铁粉,写出有关的四个离子方程式
在氯化铁,氯化铜,和盐酸混合溶液中加入铁粉,写出有关的四个离子方程式
在氯化铁,氯化铜,和盐酸混合溶液中加入铁粉,写出有关的四个离子反应方程式, 杰特1年前2
杰特1年前2 -
 粉红烟丝 共回答了14个问题
粉红烟丝 共回答了14个问题 |采纳率92.9%这里的反应要看铁粉的量.
假如铁粉过量.有 2FE3+ + FE==3FE2+
CU2+ + FE==FE2+ + CU
2H+ + FE == FE 2+ + H2(气体符号) 因为氧化性FE3+>CU2+>H+,可以由金属活动顺序表可知,但FE3+不是FE对应阳离子,故特殊.以上3条反应式一次进行.理论上只有上式完成才到下式进行
暂时想不到4个离子方程式1年前查看全部
- 怎样出去氯化铁中少量的氯化铜杂质?
 曰卯1年前5
曰卯1年前5 -
 清风冷月1974 共回答了17个问题
清风冷月1974 共回答了17个问题 |采纳率94.1%先加入铁粉,把铜置换出来,过滤后再在滤液中加入过氧化氢溶液,把二价铁离子转化为三价的.1年前查看全部
- 向氯化铜溶液中加入一定量的锌粉充分反应后过滤,下列情况可能出现的是( )
向氯化铜溶液中加入一定量的锌粉充分反应后过滤,下列情况可能出现的是( )
①滤液中只有Zn2+,滤渣为Zn
②滤液中有Zn2+、Cu2+,滤渣为Cu
③滤液中有Zn2+、Cu2+,滤渣为Zn
④滤液中只有Zn2+,滤渣为Zn、Cu.
A.①②
B.②③
C.②④
D.③④ scacrise1年前1
scacrise1年前1 -
 贝壳壳 共回答了19个问题
贝壳壳 共回答了19个问题 |采纳率100%解题思路:在金属活动顺序表中锌的活动性比铜强,向CuCl2溶液加入一定量的锌粉,锌粉置换氯化铜中的铜得到铜和氯化锌,根据加入锌粉的量,分析氯化铜完全反应还是部分反应,是判断可能出现情况的根本依据.①溶液只有 Zn2+不溶物为Zn,因为加入的锌粉一定会与氯化铜反应而得到铜,固体中一定含有铜,因此该情况不可能出现;
②若加入锌粉的量不足,氯化铜部分被置换,则溶液中含有氯化铜和氯化锌,所得固体只含有铜,即溶液中有Zn2+、Cu2+,不溶物为Cu;故该情况有可能;
③溶液中有Zn2+、Cu2+,不溶物为Zn,因为锌会继续与氯化铜发生反应,故该情况不可能出现;
④若加入锌粉的过量,氯化铜全部被置换,则溶液中只含有氯化锌,所得固体含有铜及剩余的锌粉,即溶液中只有Zn2+,不溶物为Zn、Cu;故该情况有可能.
故选C点评:
本题考点: 金属的化学性质.
考点点评: 在金属活动性顺序中,活动性强的金属能将活动性弱的金属从其盐溶液中置换出来,这是解决此类题的关键所在.1年前查看全部
- 用一种试剂出去下列物质中的杂质(括号内为杂质),写出有关化学方程式.1.氯化钾(碳酸钾)2.氯化亚铁(氯化铜)3.氢氧化
用一种试剂出去下列物质中的杂质(括号内为杂质),写出有关化学方程式.1.氯化钾(碳酸钾)2.氯化亚铁(氯化铜)3.氢氧化铜(碳酸钠)
 温岭一言九鼎1年前3
温岭一言九鼎1年前3 -
 hansar101 共回答了16个问题
hansar101 共回答了16个问题 |采纳率93.8%除去杂质要注意和先找物理性质的差异,特别关注溶解性及其他一些物质的特性(如铁能被磁铁所吸引)然后才是化学性质差异.如本题中第三小题,一个可溶一个不溶,则用溶解过滤除之.
第一题分析两者相同点及不同点,特别关注不同点一个是碳酸根一个氯离子.所以本题我们只需用氯离子来换碳酸根离子,同时使用杂离子变成沉淀或气体.本题应加入含氯离子的物质,同时将碳酸根除去,可用酸及能使用碳酸根沉淀的金属离子.如钙离子,钡离子等
K2CO3+2HCl=2KCl+H2O+CO2 K2CO3+CaCl2=CaCO3+2KCl
第三题 分析 不同的离子是金属离子,但凡是亚铁离子不溶的,铜离子也不溶.但二者由在金属活动性表中顺序不同,按金属活动顺序表中置换的规律是前金属后盐,而题中正好是后金属盐,所以就用前金属单质铁去转换铜.这样就使用氯化铜转化为了氯化亚铁.
CuCl2+Fe=Cu+FeCl21年前查看全部
- 写出下列反应的离子方程式:①向氢氧化钠溶液中加入氯化铜溶液:______②稀硫酸与氢氧化钡溶液反应:______③向碳酸
写出下列反应的离子方程式:
①向氢氧化钠溶液中加入氯化铜溶液:______
②稀硫酸与氢氧化钡溶液反应:______
③向碳酸氢钠溶液中加入稀盐酸:______
④过量二氧化碳通入澄清石灰水:______. 亩亩不1年前1
亩亩不1年前1 -
 jian520174 共回答了22个问题
jian520174 共回答了22个问题 |采纳率90.9%解题思路:①反应生成氢氧化铜沉淀和氯化钠;②反应生成硫酸钡沉淀和水;③反应生成氯化钠和是、二氧化碳;④反应生成碳酸氢钙.①向氢氧化钠溶液中加入氯化铜溶液反应生成氢氧化铜沉淀和氯化钠,该离子反应为Cu2++2OH-=Cu(OH)2↓,故答案为:Cu2++2OH-=Cu(OH)2↓;
②稀硫酸与氢氧化钡溶液反应生成硫酸钡沉淀和水,该离子反应为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;
③向碳酸氢钠溶液中加入稀盐酸反应生成氯化钠和是、二氧化碳,该离子反应为HCO3-+H+=C02↑+H2O,故答案为:HCO3-+H+=C02↑+H2O;
④过量二氧化碳通入澄清石灰水中反应生成碳酸氢钙,该离子反应为CO2+OH-=HCO3-,故答案为:CO2+OH-=HCO3-.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意离子反应的书写方法即可解答,题目难度不大.1年前查看全部
- 一定质量的铁粉加入盐酸和氯化铜混合溶液中,反应完全后过滤,称得滤渣的质量与所加的铁粉质量相同,则混合溶液中盐酸和氯化铜两
一定质量的铁粉加入盐酸和氯化铜混合溶液中,反应完全后过滤,称得滤渣的质量与所加的铁粉质量相同,则混合溶液中盐酸和氯化铜两溶质的分子个数比为____.为什么是8:27?
 小潼天天天蓝1年前2
小潼天天天蓝1年前2 -
 巴黎人7512 共回答了15个问题
巴黎人7512 共回答了15个问题 |采纳率93.3%①Fe+Cucl2=FeSO4+Cu; ②Fe+2HCl=FeCl2+H2↑(基本上反应①先于②发生)
因为铁粉质量未知所以有三种情况符合题意:
一 铁粉与Cucl2反应完全后,剩下的铁粉与盐酸正好完全反应.这种情况下1molFe(56g)消耗1molCucl2生成1molCu(64g),固体质量增加了8g;所以还应消耗8gFe与盐酸恰好完全反应,计算得盐酸物质的量为2*8/56,即2/7mol,所以盐酸和氯化铜两溶质的分子个数比为是2/7,质量比则是8:27;题目中的8:27是误把分子个数比认为是质量比;
二 铁粉大大过量,铁粉与氯化铜和盐酸反应完全后,还剩下铁粉.此种情况说明溶液中盐酸正好是2/7mol,最终计算结果也是2/7;
三 盐酸大大过量,铁粉被氯化铜和盐酸消耗后,还剩盐酸.此种情况下1molFe(56g)消耗1molCucl2生成1molCu(64g),固体质量增加了8g;所以还应消耗8gFe与盐酸反应.符合题中的“称得滤渣的质量与所加的铁粉质量相同”条件,盐酸过量,故盐酸的量未知,所以无法计算.1年前查看全部
- 1.氯化铜和硫酸能反应么?我觉得可以,可为什么氯化银和硝酸不能反应?
1.氯化铜和硫酸能反应么?我觉得可以,可为什么氯化银和硝酸不能反应?
2.碳酸钠解离到水中是什么样的?产生OH离子?那这时它是具有碳酸根离子的性质还是OH离子的性质? zpml20041年前8
zpml20041年前8 -
 放ヌ弃 共回答了22个问题
放ヌ弃 共回答了22个问题 |采纳率86.4%不反应啊!
交换成分后没有沉淀\气体\水等
不符合复分解反映规律!氯化银和硝酸不反应!因为:
AgNO3+HCl=AgCl(沉淀)+HNO3,所以氯化银是不会跟硝酸银反应的....碳酸钠是强碱弱酸盐,所以水溶液显一定的碱性1年前查看全部
- 硫酸铜、碱式碳酸铜、氯化铜的颜色区别?
硫酸铜、碱式碳酸铜、氯化铜的颜色区别?
为什么眼镜框上的铜锈是绿色的而硫酸铜溶液时蓝色的?更奇怪的是氯化铜溶液就然是看浓度的?具体的临界浓度值是多少的时候颜色才会发生明显变化 小妖feeling1年前2
小妖feeling1年前2 -
 孩子气给的勇气 共回答了25个问题
孩子气给的勇气 共回答了25个问题 |采纳率92%硫酸铜白色,遇水变蓝、
碱式碳酸铜,就是铜绿(铜生锈后的产物),所以是绿色.
氯化铜不了解.1年前查看全部
- 在溶液里如何除去氯化铜中的氯化亚铁?
 zhangyzgh12211年前2
zhangyzgh12211年前2 -
 小盯 共回答了31个问题
小盯 共回答了31个问题 |采纳率83.9%像溶液中通入过量氯气,在向溶液中加入氧化铜或氢氧化铜至PH=5,过滤即可得到纯净的氯化铜溶液1年前查看全部
- 把锌片放入下列溶液,溶液颜色有明显变化的是 A稀硫酸 B氯化铜溶液 C硝酸银溶液 D稀盐酸
把锌片放入下列溶液,溶液颜色有明显变化的是 A稀硫酸 B氯化铜溶液 C硝酸银溶液 D稀盐酸
反应的化学方程式是什么? lihao05161年前3
lihao05161年前3 -
 lapers 共回答了14个问题
lapers 共回答了14个问题 |采纳率85.7%当然是氯化铜溶液了
CuCl2+Zn=ZnCl2+Cu 置换反应
锌片溶解,铜析出1年前查看全部
- 关于硫酸铜为什么硫酸铜不能用来区分稀HCl和Na2CO3,听说生成的氯化铜是绿色的,就算硫酸铜和碳酸钠反应不了也应该能区
关于硫酸铜
为什么硫酸铜不能用来区分稀HCl和Na2CO3,听说生成的氯化铜是绿色的,就算硫酸铜和碳酸钠反应不了也应该能区分啊.还是说干脆硫酸铜和稀盐酸他俩就反应不了 溶冰咖啡1年前1
溶冰咖啡1年前1 -
 ylno123 共回答了27个问题
ylno123 共回答了27个问题 |采纳率96.3%硫酸铜和盐酸不反应,我知道你想问为什么.硫酸铜属盐类,盐酸属酸类.酸和盐反应是复分解反应.复分解反应发生的条件是有气体、水或沉淀生成.显然盐酸和硫酸铜混在一起是没有气体、水、沉淀生成的.1年前查看全部
- 氯化铜和氢硫酸反应的离子方程式是?
 表格格1年前1
表格格1年前1 -
 天马935 共回答了10个问题
天马935 共回答了10个问题 |采纳率80%H2S+Cu2+=CuS↓+2H+1年前查看全部
- 一道有关饱和食盐水的题目在饱和食盐水中存在的离子有 通电时向阴极的离子是用pt电极电解氯化铜,氯化钠的混合溶液,阴极和阳
一道有关饱和食盐水的题目
在饱和食盐水中存在的离子有 通电时向阴极的离子是
用pt电极电解氯化铜,氯化钠的混合溶液,阴极和阳极上分别析出的物质是()
a.氢气和氯气 b,氢气和氧气c.铜和氯气 d.铜和氧气 xueliqin1年前2
xueliqin1年前2 -
 d3221837 共回答了18个问题
d3221837 共回答了18个问题 |采纳率100%在饱和食盐水中存在的离子有(H+,OH-,Na+,Cl-)( 电离方程式为2NaCl+2H2O===电解====2NaOH+H2+Cl2 )通电时向阴极(得电子)的离子是H+
用pt电极电解氯化铜,氯化钠的混合溶液,阴极和阳极上分别析出的物质是
当电解质中含氯化铜,氯化钠两种物质时析出的物质是c.铜(阴)和氯气(阳)
又当电解完氯化铜(由阳离子析出顺序可知氯化铜首先被电离完),剩氯化钠时析出的物质是a.氢气(阴)和氯气(阳),当氯化钠被电解完后电解质中剩下氢氧化钠和水,电解的实质就是电解水,此时析出物为b,氢气(阴)和氧气(阳)
1.要注意水的电离中H+,OH-对电解的影响
2.要熟记电离中阳离子析出的先后顺序Ag+>Hg2+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+1年前查看全部
- 小刚也查阅了一分资料,了解到氯化铜溶液,硝酸铜溶液中均含有铜离子,氯化钠溶液中含有氯离子,硝酸钠溶液含硝酸离子.他于是马
小刚也查阅了一分资料,了解到氯化铜溶液,硝酸铜溶液中均含有铜离子,氯化钠溶液中含有氯离子,硝酸钠溶液含硝酸离子.他于是马上到实验室观察氯化钠,硝酸钠,氯化铜,硝酸铜溶液的颜色,基于这些溶液的颜色他可以作一个判断,若 ,则可以得出结论——铜离子使硫酸铜溶液呈现蓝色.
 我是驹1年前1
我是驹1年前1 -
 riot转圈圈 共回答了19个问题
riot转圈圈 共回答了19个问题 |采纳率89.5%若 氯化铜,硝酸铜溶液为蓝色,氯化钠,硝酸钠溶液为无色 ,则可以得出结论——铜离子使硫酸铜溶液呈现蓝色.1年前查看全部
- 将含有杂质的固体氯化铜13.5g溶于水,加入足量的硝酸银,的28g沉淀,杂志是什么 A cacl2 B Alcl3 CK
将含有杂质的固体氯化铜13.5g溶于水,加入足量的硝酸银,的28g沉淀,杂志是什么 A cacl2 B Alcl3 CKcl D Fecl
 clxgz1231年前1
clxgz1231年前1 -
 怪怪笨笨 共回答了16个问题
怪怪笨笨 共回答了16个问题 |采纳率93.8%13.5g氯化铜与足量的硝酸银反应可以生成28.7克氯化银沉淀,
现在28g沉淀,小于13.5g
说明杂质中含氯的质量分数小于氯化铜,
所以选择氯化钾.
选择:C1年前查看全部
- 氯化铁和氯化铜混合溶液中加入过量铁粉充分反应溶液的质量没有变则原混合溶液三价铁二价铜物质的量之间比
 knight1151年前2
knight1151年前2 -
 oldyan 共回答了14个问题
oldyan 共回答了14个问题 |采纳率85.7%反应完全后溶液中不含有铜离子
2FeCl3+Fe==3FeCl2 增加了56的相对质量
CuCl2+Fe==FeCl2+Cu 减少了8的相对质量
56/8=7
若使反应的量相等则应在第二个方程式前各加系数7
Fe3+:Cu2+ =2:71年前查看全部
大家在问
- 1已知:如图,在平行四边形ABCD中,AE是BC边上的高,将△ABE沿BC方向平移,使点E与点C重合,得△GFC.
- 2人类发展的目的是什么?
- 3SPSS里的多元logistic回归中,如果自变量的系数只在某一响应分类里不显著怎么办呐~
- 4谁帮我写一篇作文要认真读书的不要流水账.想一个写的多的好的.
- 5丑小鸭其中一句的修辞手法“这比被人们打死,被鸭子咬,被鸡群啄,被看管养鸭场的那个女佣人踢和在冬天受苦要好的多!”这一句所
- 6若m是方程x^2+x-1=0的一个根,试求代数式m^3+2m^2+2010的值
- 7三顾频烦天下计,两朝开济老臣心。是指谁???????????
- 8Tony thinks it is easy ______ English. [
- 9认真读下面的字,再按要求写下来.
- 10“31 0000 3200”这个数怎么读?
- 11把have/drink/take /put/get /sit用英语写成正在进行时
- 12monkeys are funny .they always ___(jump)around.
- 13(2012•盐城)某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究.
- 14阅读材料,判断正误,在题后括号内正确的打“√”,错误的打“×”。
- 15在加热时为什么试管口略向下倾斜成大约45度角
