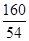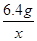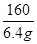张南同学为了测定某黄铜(铜锌合金)中锌的质量分数,他做了如下实验:
 栈弈2022-10-04 11:39:541条回答
栈弈2022-10-04 11:39:541条回答(1)配制溶液:将40g质量分数为98%的浓硫酸稀释成9.8%的稀硫酸,需要加水的体积是______mL.
(2)取26g上述合金粉末,向其中滴入上述配好的稀硫酸,至不再产生气泡为止,过滤,得滤渣和滤液,将滤渣洗涤晾干称重为19.5g,回答下列问题:
①写出发生反应的化学方程式为______;
②根据已知条件列出求解滤液中溶质质量(x)的比例式
③该黄铜样品中锌的质量分数为______;
④向反应后的滤液中加入70.8g水后,得到只含一种溶质的不饱和溶液,则该不饱和溶液中溶质和溶剂的质量比为______.

已提交,审核后显示!提交回复
共1条回复
 无奈爱 共回答了16个问题
无奈爱 共回答了16个问题 |采纳率100%- 解题思路:(1)根据溶液稀释前后溶液中溶质的质量不变来进行解答;
(2)黄铜中的铜不能和稀硫酸反应,锌可以和硫酸反应生成硫酸锌和氢气,可以据此写出该反应的化学方程式;根据反应的化学方程式结合锌的质量可以列出比例式并计算出锌的质量,然后结合求出的硫酸锌的质量求出溶液中溶质和溶剂的质量比即可.(1)设加入水的体积为x
40g×98%=(x•1g/mL+40g)×9.8%
解得:x=360mL
(1)360
(2)①黄铜中的铜不能和稀硫酸反应,锌可以和硫酸反应生成硫酸锌和氢气,所以该反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑
②锌的质量为:26g-19.5g=6.5g
设生成硫酸锌的质量为x,消耗稀硫酸的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 98161
6.5g 9.8%y x
[161/x]=[65/6.5g]
[98/9.8%y]=[65/6.5g]
解得:x=16.1g,y=100g
③该黄铜样品中锌的质量分数为:[6.5g/26g]×100%=25%
④向反应后的滤液中加入70.8g水后,得到只含一种溶质的不饱和溶液,则该不饱和溶液中溶质和溶剂的质量比为16.1g:(100g-100g×9.8%+70.8g)=1:10
故答案为:(1)360;
(2)①Zn+H2SO4═ZnSO4+H2↑;
②[161/x]=[65/6.5g];
③25%;
④1:10.点评:
本题考点: 根据化学反应方程式的计算;用水稀释改变浓度的方法;书写化学方程式、文字表达式、电离方程式.
考点点评: 要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景或图表信息等,结合所学的相关知识按照题目要求进行认真地选择或解答即可. - 1年前
相关推荐
- (2008•南岗区一模)张南同学带着大理石来到实验室做实验,在实验台上有下列仪器及药品,请帮助张南同学解决下列问题:
(2008•南岗区一模)张南同学带着大理石来到实验室做实验,在实验台上有下列仪器及药品,请帮助张南同学解决下列问题:
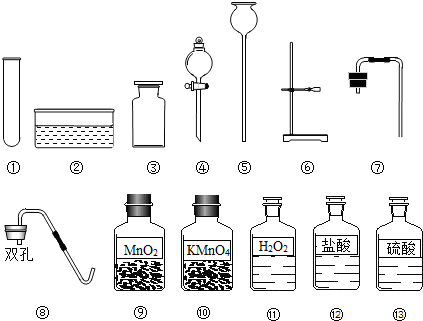
(1)张南想制取C02气体,所用的上述仪器和药品是______;(填序号,以下同)
(2)若选用上述仪器制取氧气,请设计出能控制反应速率的装置,所用上述仪器的标号有______,反应的化学方程式是2H2O2
2H2O+O2↑MnO2 .2H2O2
2H2O+O2↑MnO2 .
(3)若利用KMnO4制取氧气,以上所给仪器中还缺少的是______,缺少必要的用品是______
请将你设计的装置图画在下面:
 飘雪之夜1年前1
飘雪之夜1年前1 -
 hebong87 共回答了23个问题
hebong87 共回答了23个问题 |采纳率87%解题思路:(1)考虑所需反应物除大理石外,还有稀盐酸;用到的图中仪器有试管、单孔橡皮塞、铁架台、集气瓶.据此作出选择;
(2)利用图中的仪器制取氧气,是用二氧化锰做催化剂分解过氧化氢.要用到图中的试管、水槽、集气瓶、铁架台、双孔橡皮塞.又要求能控制反应的速率,所以在选用分液漏斗;
(3)利用KMnO4制取氧气,需要加热,所以还缺少酒精灯;棉花.(1)用大理石制取二氧化碳,需要大理石与稀盐酸反应.所以要用到图中的(12)盐酸;另外还要用到试管作为反应容器,铁架台来固定试管,再用带导管的单孔橡皮塞封闭试管口并输出气体,最后用集气瓶收集气体.故答案为:①③⑥⑦(12);
(2)利用图中的仪器制取氧气,是用二氧化锰做催化剂分解过氧化氢的反应.又因为要设计出能控制反应速率的装置.所以要用到的图中仪器是:①试管,用作反应容器;②水槽作为排水法收集气体的辅助装置;③集气瓶,收集气体用;④分液漏斗,用来滴加过氧化氢溶液,并控制滴加的速度,从而控制反应的速率;⑥用于固体反应容器试管;⑧双孔带导管的橡皮塞,用来封闭试管口并输出气体.反应方程式是:2H2O2
MnO2
.
2H2O+O2↑.故答案为:①②③④⑥⑧、2H2O2
MnO2
.
2H2O+O2↑;
(3)利用KMnO4制取氧气,需要加热,所以还缺少用于加热的酒精灯.防止高锰酸钾粉末进入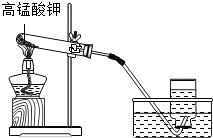 导管,应放一团棉花在试管口.所以还缺少必需品棉花.故答案为:酒精灯、棉花;
导管,应放一团棉花在试管口.所以还缺少必需品棉花.故答案为:酒精灯、棉花;
装置图如右侧,标准如下:
发生装置,下列情况画错扣分:
①酒精灯内酒精的量,药品铺平试管底部;②外焰加热;③试管口略向下倾斜;④铁夹夹在试管的中上部;⑤棉花,木台;⑥伸入试管的导管不能过长.点评:
本题考点: 常用仪器的名称和选用;实验室制取氧气的反应原理;氧气的制取装置;二氧化碳的实验室制法.
考点点评: 本题考查实验仪器的选取、化学反应式的书写、反应装置图的设计与画图,需要同学们熟悉常见气体的制取反应,对常见实验装置也应非常熟悉.此题难度较大.1年前查看全部
- 张南同学为测定某赤铁矿样品中氧化铁的含量,取10g此样品,分五次向其中加入稀硫酸使之充分反应(假设样品中杂质不与稀硫酸反
张南同学为测定某赤铁矿样品中氧化铁的含量,取10g此样品,分五次向其中加入稀硫酸使之充分反应(假设样品中杂质不与稀硫酸反应,也不溶于水)。每次加入的稀硫酸质量及测定剩余固体的质量,记录数据如下表:
第一次 第二次 第三次 第四次 第五次 加入稀硫酸的质量/g l0 l0 l0 l0 l0 剩余固体质量/g 8.4 6.8 5.2 3.6 3.6
请认真分析表中的数据,回答下列问题:
(1)表示样品与稀梳酸恰好完全反应的是上表中第 次操作;
(2)写出样品中氧化铁与稀硫酸反应的化学方程式 ;
(3)列出充分反应后求解生成水质量(X)的比例式为 ;
(4)样品中氧化铁的含量为 ;
(5)假设第四次实验结束后,向所得混合物中入ag水,得到溶质质量分数为10%的硫酸铁溶液,则a的数值为 ;
(6)若实验用98%的浓硫酸配制上述所用稀硫酸(50g),需要浓硫酸的质量为 。 塔山塔山1年前1
塔山塔山1年前1 -
 terui0517 共回答了17个问题
terui0517 共回答了17个问题 |采纳率88.2%1年前查看全部
- (2012•哈尔滨一模)张南同学想测定某赤铁矿样品中氧化铁的质量分数,做法如下.请回答下列问题(假设赤铁矿样品中杂质不与
 (2012•哈尔滨一模)张南同学想测定某赤铁矿样品中氧化铁的质量分数,做法如下.请回答下列问题(假设赤铁矿样品中杂质不与酸反应,也不溶于水).
(2012•哈尔滨一模)张南同学想测定某赤铁矿样品中氧化铁的质量分数,做法如下.请回答下列问题(假设赤铁矿样品中杂质不与酸反应,也不溶于水).
(1)配制稀盐酸,配制400g7.3%的稀盐酸.需要如图标签上标注的浓盐酸的质量是80g80g;
(2)将赤铁矿粉末与稀盐酸混合,反应的化学方程式是Fe2O3+6HCl=2FeCl3+3H2O;Fe2O3+6HCl=2FeCl3+3H2O;;
(3)取20g的赤铁矿粉与300g的7.3%的稀盐酸恰好完全反应,求解生成氯化铁质量X的比例式为
=219 325 21.9g x
=219 325
;21.9g x
(4)此赤铁矿中氧化铁的质量分数为80%80%;
(5)向反应后所得溶液中加入9g水,则最终所得溶液中溶质的质量分数是10%10%;
(6)若用上述赤铁矿冶炼生铁63t,生铁中杂质含量为4%,炼铁过程中生铁的损失率为20%,求解需要此矿石的质量为:120t120t. bmiuo1年前1
bmiuo1年前1 -
 hicky123 共回答了12个问题
hicky123 共回答了12个问题 |采纳率75%(1)需要36.5%的浓盐酸的质量=400g×7.3%÷36.5%=80g.
故答案为:80g;
(2)赤铁矿的主要成分为三氧化二铁,三氧化二铁与盐酸反应生成氯化铁和水;
故答案为:Fe2O3+6HCl=2FeCl3+3H2O;
(3)设生成氯化铁质量x
Fe2O3 +6HCl=2FeCl3 +3H2O
219 325
300g×7.3% x
故答案为:
219
325=
21.9g
x;
(4)设氧化铁的质量为y
Fe2O3 +6HCl=2FeCl3 +3H2O
160 219
y 300g×7.3%
160
219=
y
300g×7.3%
y=16g
赤铁矿样品中氧化铁的质量分数为:
16g
20g×100%=80%.
故答案为:80%;
(5)向反应后所得溶液中加入9g水,则最终所得溶液中溶质的质量分数是
32.5g
300g+20g×80%+9g×100%=10%.
故答案为:10%
(6)需要此矿石的质量为63t÷(1-20%)×(1-4%)÷
56×2
56×216×3÷80%=120t.
故答案为:120t.1年前查看全部
- (4分)张南同学为了验证Na 2 CO 3 溶液中的碳酸根离子,做了如下实验。操作如下:
(4分)张南同学为了验证Na 2 CO 3 溶液中的碳酸根离子,做了如下实验。操作如下:
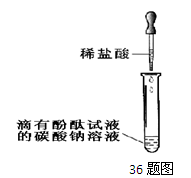
①向一支试管中加入约3mL的Na 2 CO 3 溶液,并滴入2滴酚酞试液,振荡试管,溶液呈均匀的红色;
②再向此试管中逐滴加入稀盐酸,至溶液颜色由红色恰好变为无色。
[提出问题]为什么向Na 2 CO 3 溶液中滴加稀盐酸不产生气泡?
[猜想与假设](提示:试剂没有问题)
①Na 2 CO 3 溶液和稀盐酸没有发生化学反应。
②Na 2 CO 3 溶液和稀盐酸发生化学反应生成的二氧化碳溶于水。
③Na 2 CO 3 溶液和稀盐酸发生化学反应生成的产物不是二氧化碳。
资料:①此Na 2 CO 3 溶液的pH 约为11,NaHCO 3 溶液的pH约为8;
②NaHCO 3 在水溶液中受热不分解;
③酚酞试液在pH≥10时的溶液为红色,在pH≤8.2时溶液为无色;
[设计方案及实验]经过讨论大家首先否定了猜想①,其理由是。
对方案②和③进行研究,决定进行如下实验,首先把上述反应后的溶液分装成3支试管。请完成下列表格。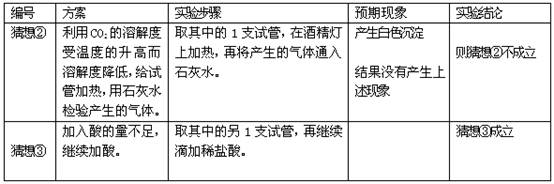
[解释与结论]张南同学开始时的实验,即向Na 2 CO 3 溶液中滴加稀盐酸没有看到气泡的原因是(写方程式)。
[反思与应用](1)在不另取其他试剂的情况下,能够鉴别碳酸钠溶液和稀盐酸两种溶液吗?(填“能’”或“不能”)。(2)有些化学反应的产物与 有关。 dingguangyao1年前1
dingguangyao1年前1 -
 wangyong023 共回答了13个问题
wangyong023 共回答了13个问题 |采纳率92.3%[设计方案及实验]碳酸钠溶液呈碱性,能使酚酞试液变红,而加入盐酸后溶液呈无色,则溶液中不含碳酸钠,说明已与盐酸反应了。有气泡产生
[解释与结论]Na 2 CO 3 +HCl==NaHCO 3 +NaCl(或Na 2 CO 3 +2HCl==2NaCl+H 2 O+CO 2 ↑
CO 2 +Na 2 CO 3 +H 2 O==2NaHCO 3 )
[反思与应用](1)能向Na 2 CO 3 溶液中滴加稀盐酸刚开始不产生气泡,而向稀盐酸中滴加Na 2 CO 3 溶液会产生气泡(或将少量的稀盐酸加入到碳酸钠溶液中不产生气泡,而将少量的碳酸钠加入到稀盐酸中会产生气泡)
(2)反应物的量
Na 2 CO 3 的水溶液呈碱性,含有少量的NaOH;向Na 2 CO 3 与 NaOH的混合溶液中滴入稀盐酸,开始发生的反应是:NaOH+HCl= NaCl+H 2 O,后来发生的反应是:NaHCO 3 +HCl=NaCl+CO 2 +H 2 O;向浓盐酸中滴入Na 2 CO 3 时,由于盐酸量大,Na 2 CO 3 、NaOH与HCl同时发生反应,因此应立即产生大量气泡。1年前查看全部
- (2014•哈尔滨一模)张南同学为了测定某黄铜(铜锌合金)中锌的质量分数,他做了如下实验:
(2014•哈尔滨一模)张南同学为了测定某黄铜(铜锌合金)中锌的质量分数,他做了如下实验:
(1)配制溶液:将40g质量分数为98%的浓硫酸稀释成9.8%的稀硫酸,需要加水的体积是______mL.
(2)取26g上述合金粉末,向其中滴入上述配好的稀硫酸,至不再产生气泡为止,过滤,得滤渣和滤液,将滤渣洗涤晾干称重为19.5g,回答下列问题:
①写出发生反应的化学方程式为______;
②根据已知条件列出求解滤液中溶质质量(x)的比例式[65/6.5g=
=161 x] [65/6.5g161 x];
③该黄铜样品中锌的质量分数为______;
④向反应后的滤液中加入70.8g水后,得到只含一种溶质的不饱和溶液,则该不饱和溶液中溶质和溶剂的质量比为______.赞
麦克小小狼 幼苗
共回答了18个问题采纳率:83.3% 举报
解题思路:(1)根据溶液稀释前后溶液中溶质的质量不变来进行解答;
(2)黄铜中的铜不能和稀硫酸反应,锌可以和硫酸反应生成硫酸锌和氢气,可以据此写出该反应的化学方程式;根据反应的化学方程式结合锌的质量可以列出比例式并计算出锌的质量,然后结合求出的硫酸锌的质量求出溶液中溶质和溶剂的质量比即可.(1)设加入水的体积为z
40g×98%=(z×1g/mL+40g)×9.8%
解得:z=360mL
(2)①黄铜中的铜不能和稀硫酸反应,锌可以和硫酸反应生成硫酸锌和氢气,所以该反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑
②由质量守恒定律可知生成氢气的质量是锌的质量为:26g-19.5g=6.5g
设生成硫酸锌的质量为x,消耗稀硫酸的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 98 161
6.5g 9.8%×y x
[65/6.5g=
98
9.8%×y=
161
x]
解得:x=16.1g,y=100g
③该黄铜样品中锌的质量分数为:[6.5g/26g]×100%=25%
④向反应后的滤液中加入70.8g水后,得到只含一种溶质的不饱和溶液,则该不饱和溶液中溶质和溶剂的质量比为16.1g:(100g-100g×9.8%+70.8g)=1:10
(1)360;(2)①Zn+H2SO4=ZnSO4+H2↑;②[65/6.5g=
161
x];③25%;④1:10.点评:
本题考点: 根据化学反应方程式的计算;用水稀释改变浓度的方法.
考点点评: 要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景或图表信息等,结合所学的相关知识按照题目要求进行认真地选择或解答即可.1年前
2可能相似的问题你能帮帮他们吗
Copyright © 2022 YULUCN.COM - 雨露学习互助 - 17 q. 0.033 s. - webmaster@yulucn.com asdffdsaasdf1年前1
asdffdsaasdf1年前1 -
 麦克小小狼 共回答了18个问题
麦克小小狼 共回答了18个问题 |采纳率83.3%解题思路:(1)根据溶液稀释前后溶液中溶质的质量不变来进行解答;
(2)黄铜中的铜不能和稀硫酸反应,锌可以和硫酸反应生成硫酸锌和氢气,可以据此写出该反应的化学方程式;根据反应的化学方程式结合锌的质量可以列出比例式并计算出锌的质量,然后结合求出的硫酸锌的质量求出溶液中溶质和溶剂的质量比即可.(1)设加入水的体积为z
40g×98%=(z×1g/mL+40g)×9.8%
解得:z=360mL
(2)①黄铜中的铜不能和稀硫酸反应,锌可以和硫酸反应生成硫酸锌和氢气,所以该反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑
②由质量守恒定律可知生成氢气的质量是锌的质量为:26g-19.5g=6.5g
设生成硫酸锌的质量为x,消耗稀硫酸的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 98 161
6.5g 9.8%×y x
[65/6.5g=
98
9.8%×y=
161
x]
解得:x=16.1g,y=100g
③该黄铜样品中锌的质量分数为:[6.5g/26g]×100%=25%
④向反应后的滤液中加入70.8g水后,得到只含一种溶质的不饱和溶液,则该不饱和溶液中溶质和溶剂的质量比为16.1g:(100g-100g×9.8%+70.8g)=1:10
(1)360;(2)①Zn+H2SO4=ZnSO4+H2↑;②[65/6.5g=
161
x];③25%;④1:10.点评:
本题考点: 根据化学反应方程式的计算;用水稀释改变浓度的方法.
考点点评: 要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景或图表信息等,结合所学的相关知识按照题目要求进行认真地选择或解答即可.1年前查看全部
- (6分)张南同学想测定赤铁矿中氧化铁的质量分数,做法如下,请回答下列问题。
(6分)张南同学想测定赤铁矿中氧化铁的质量分数,做法如下,请回答下列问题。
(1)配制稀硫酸。
①配制200g 19.6%的稀硫酸,需要98%的浓硫酸的体积是 ;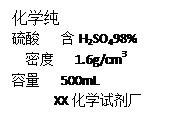
②下图实验过程中出现操作的错误是 。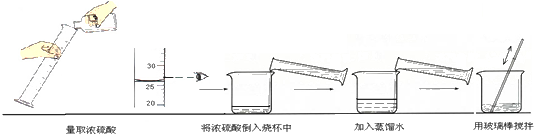
(2)将赤铁矿粉末,用稀硫酸溶解,反应的化学方程式是 ;
(3)取20g的赤铁矿粉末恰好与l50g的19.6%的稀硫酸完全反应,求解生成硫酸铁质量(x)的比例式为 ;
(4)此赤铁矿中氧化铁的质量分数为 ;
(5)向反应后所得溶液中加入34g水,则所得溶液溶质的质量分数是 journeylove1年前1
journeylove1年前1 -
 笔妮 共回答了21个问题
笔妮 共回答了21个问题 |采纳率81%(1)① 26mL②读数的方式错误;浓硫酸和水加入的顺序颠倒。
(2)Fe 2 O 3 +3H 2 SO 4 =Fe 2 (SO 4 ) 3 +3H 2 O
(3)294/400=29.4g/x
(4)80%
(5)20%
(1)①需要98%的浓硫酸的体积是=200g×19.6%÷98%÷1.6g/cm 3 =25mL.
故答案为:25mL;②用量筒量取液体读数时视线要与凹液面的最低处保持水平,稀释浓硫酸时要先加水,然后将浓硫酸注入水中,所以答案为:读数的方式错误;浓硫酸和水加入的顺序颠倒
(2)赤铁矿的主要成分为三氧化二铁,三氧化二铁与硫酸反应生成硫酸铁和水;故答案为:Fe 2 O 3 +3H 2 SO 4 =Fe 2 (SO 4 ) 3 +3H 2 O;
(3)设生成硫酸铁质量x
Fe 2 O 3 +3H 2 SO 4 =Fe 2 (SO 4 ) 3 +3H 2 O
294 400
150g×19.6% x
故答案为:
294:400=50g×19.6%:x;
(4)设氧化铁的质量为y
Fe 2 O 3 +3H 2 SO 4 =Fe 2 (SO 4 ) 3 +3H 2 O
160 294
Y 150g×19.6%
160:294= Y:150g×19.6%
y=16g
赤铁矿样品中氧化铁的质量分数为:16g/20g×100%=80%.
故答案为:80%;
(5)向反应后所得溶液中加入34g水,则最终所得溶液中溶质的质量分数是20%.
故答案为:20%1年前查看全部
- (2008•南岗区二模)张南、棒棒和多多同学学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体.但他在空气中点燃镁条时
(2008•南岗区二模)张南、棒棒和多多同学学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体.但他在空气中点燃镁条时.却发现在生成的白色固体中还夹杂着少量的淡黄色固体及黑色颗粒.
提出问题:为什么固体会有其他颜色?
查阅资料:镁的几种化合物的颜色:
棒棒同学认为不必查阅氯化镁的颜色,理由是______物 质 MgO MgCl2 Mg2N3 Mg(NO3)2 MgCO3 Mg(OH)2 颜 色 白色 白色 淡黄色 白色 白色 白色
提出猜想:分析资料,张南认为淡黄色固体可能是由镁与空气中的______反应生成的;
实验探究:为了确定MgO以外的其他成分,张南、棒棒和多多设计实验证实了自己的猜想.张南设计的方案如图l:
分析:2.4024 g Mg在足量纯氧中燃烧,理论上应生成MgO______g.结合表中数据,可推断所得固体中,除MgO外______(填“存在”或“不存在”)其他物质.反应前镁带的质量 反应的固体产物的质量 第一次 2.4046g 3.8854g 第二次 2.4024g 3.8839g 第三次 2.4063g 3.8857g
棒棒设计的方案如图2:取少量所得样品于试管中,加少量水,出现白色沉淀,微热,发现有使湿润的红色石蕊试纸变蓝的气体生成,则此气体是______(填化学式),继续加足量水,仔细观察发现试管中除白色沉淀外,还有极少量的黑色不溶物.结合空气组成,棒棒推测样品中除MgO外还有______
多多设计的方案如图3:先用足量的红磷做燃烧实验,冷却后,打开止水阀,结果发现烧杯中的水倒流人广口瓶中,倒流人的水的体积与广口瓶容积之比约为______,此时瓶中剩余气体的主要成分为______(填化学式);关闭止水阀,取出连带橡皮塞的燃烧匙.迅速塞上备用橡皮塞.向燃烧匙中加入镁带并引燃,取下备用橡皮塞,将燃烧匙迅速插入瓶中,并将橡皮塞塞紧.发现镁带继续燃烧,产生黄色火焰,冷却后,打开止水阀,结果发现烧杯中的水依然倒流人广口瓶中,多多的结论是______.
实验结论:根据三位同学的实验,最终得出正确结论是:固体由______组成.
反思与评价:通过上述实验,你对燃烧的新认识是______. jayoooeee1年前1
jayoooeee1年前1 -
 小新小小 共回答了13个问题
小新小小 共回答了13个问题 |采纳率100%解题思路:根据空气的成分一般是固定的.它的成分,按体积分:N2占78%,O2占21%,二氧化碳占0.03%,稀有气体占0.94%,其他气体和杂质占0.03%.进行分析解答本题.根据空气的主要成分是按体积分:N2占78%,O2占21%,由此可知不必查阅氯化镁的颜色的理由是:空气中不含有氯元素,根据质量守恒定律,生成物中不能含有氯化镁;故答案为:空气中不含有氯元素,根据质量守恒定律,生成物中不能含有氯化镁;
根据空气的主要成分是氮气和氧气,由此推测生成物淡黄色固体可能是由镁与空气中的氮气反应的产物,故答案为:氮气;
设 2.4024 g Mg在足量纯氧中燃烧,理论上应生成MgO x g
2Mg+O2
点燃
.
2MgO
48 80
2.4024gx 由此可得[48/2.4024g=
80
x]x=4.004g;
结合表中数据,可推断所得固体中,除MgO外还有即存在其他物质; 故答案为:4.004g;存在;
样品于试管中,加少量水,出现白色沉淀,微热,发现有使湿润的红色石蕊试纸变蓝的气体生成,证明该气体为碱性气体,那就说明是氨气;根据空气的成分一般是固定的.它的成分,按体积分:N2占78%,O2占21%,二氧化碳占0.03%,稀有气体占0.94%,其他气体和杂质占0.03%,可推测极少量的黑色不溶物可能是碳;故答案为:NH3;C;
足量的红磷与集气瓶中氧气完全燃烧,根据空气的组成氮气约占体积的[4/5],氧气约占体积的[1/5],冷却后,倒流人的水的体积与广口瓶容积之比约,1:5;则瓶中剩余气体的主要成分为氮气;发现镁带在剩余的气体中继续燃烧,产生黄色火焰,冷却后,打开止水阀,结果发现烧杯中的水依然倒流人广口瓶中,由此推测多多的结论是镁带能在氮气中燃烧;故答案为:NH3;C;1:5;N2;
三位同学的实验,最终得出正确结论是:镁在空气中燃烧后 的固体由氧化镁和氮化镁、C组成;
故答案为:镁带能在氮气中燃烧;氧化镁和氮化镁、C;
通过上述实验,对燃烧的新认识是燃烧不一定有氧气参加.故答案为:燃烧不一定有氧气参加.点评:
本题考点: 质量守恒定律及其应用;猜想与事实验证;科学探究的基本环节;空气的成分及各成分的体积分数;醋酸的性质及醋酸的含量测定;根据化学反应方程式的计算.
考点点评: 本题考查学生对空气的组成成分的掌握,并应用到实际的解题当中.1年前查看全部
- (2008•南岗区三模)张南同学听说在意大利有一个“屠狗洞”,据说:有一位猎人到阿尔卑斯山打猎,为了.避雨,他带领猎犬进
 (2008•南岗区三模)张南同学听说在意大利有一个“屠狗洞”,据说:有一位猎人到阿尔卑斯山打猎,为了.避雨,他带领猎犬进入一个山洞,当雨过天晴之后,猎人走出山洞,但猎狗却没有出来你知道是咋回事吗?‘后来科学家,揭开了这个述,因c02含量过高而导致猎狗死亡.张南同学想自家的菜窖内内应含较多的c02,决定对自家菜窖内co2的含量进行探究.
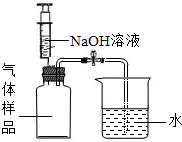
(2008•南岗区三模)张南同学听说在意大利有一个“屠狗洞”,据说:有一位猎人到阿尔卑斯山打猎,为了.避雨,他带领猎犬进入一个山洞,当雨过天晴之后,猎人走出山洞,但猎狗却没有出来你知道是咋回事吗?‘后来科学家,揭开了这个述,因c02含量过高而导致猎狗死亡.张南同学想自家的菜窖内内应含较多的c02,决定对自家菜窖内co2的含量进行探究.
【查阅资料】当空气中co2的体积分数达到1%时,就会使人感到气闷、头昏;达到10%时,使人呼吸逐渐停止.以***亡.
【设计方案】借鉴化学学习中测定______含量的实验探究.用碱溶液完全除去从菜窖内取出的气体样品中的co2设计实验如图.
【实验与事实】用注射器向集气瓶内注入适量的naoh溶液,振荡,充分反应后打开止水夹.观察到烧杯中的水倒流.最后瓶内的液体体积大约占集气瓶体积的[1/10].
【结论与解释】
(1)菜窖内c02含量约为10%,贸然进入容易发生危险.
(2)菜窖内co2,含量过高,原因之一是:c02具有______物理性质.
【反思与评价】实验中用naoh溶液比用石灰水更合理,原因是______
【拓展与迁移】教室内c02含量过高,会使人感到气闷.此时解决c02含量过高的简单措施______. 紫色¤幻想1年前1
紫色¤幻想1年前1 -
 y6010450 共回答了14个问题
y6010450 共回答了14个问题 |采纳率85.7%【设计方案】:测定地窖中二氧化碳的含量,可借鉴测定空气中氧气含量的实验;
【解释与结论】:(2)菜窖内CO2含量过高,原因之一是在通常情况下,CO2的密度比空气大,容易存在在低洼处;
【反思与评价】:实验中用NaOH溶液比用石灰水更合理,原因是
常温下,NaOH易溶于水,而Ca(OH)2微溶于水,NaOH饱和溶液比Ca(OH)2饱和溶液质量分数大得多,NaOH吸收CO2的效果更好;
【拓展与迁移】:通过空气流动降低室内二氧化碳的含量,如打开门窗通风.
故答案为:
【设计方案】:测定空气中氧气含量的实验;
【解释与结论】:(2)在通常情况下,CO2的密度比空气大,;
【反思与评价】:常温下,NaOH易溶于水,而Ca(OH)2微溶于水,NaOH饱和溶液比Ca(OH)2饱和溶液质量分数大得多,NaOH吸收CO2的效果更好;
【拓展与迁移】:打开门窗通风.1年前查看全部
- (2012•南岗区二模)张南同学和小岗同学欲制取一定量氧气,并配制lO0g溶质质量分数为5%氯化钾溶液.有关做法如下:张
(2012•南岗区二模)张南同学和小岗同学欲制取一定量氧气,并配制lO0g溶质质量分数为5%氯化钾溶液.有关做法如下:张南取一定量的氯酸钾和二氧化锰的混合物①加热一段时间后,得到4.8g氧气和混合物②.小岗同学取混合物②继续加热至固体质量不再减少为止.
实验数据如下表:
请回答下列问题:加热前 加热后 实验数据 混合物②和试管的总质量 剩余固体和试管的总质量 37.7g 32.9g
(1)写出反应的化学方程式2KClO3
2KCl+3O2↑MnO2 .△ 2KClO3.
2KCl+3O2↑MnO2 .△
(2)列出求解混合物①中氯酸钾质量(x)的比例式[245/96=
=x 4.8g] [245/96x 4.8g].
(3)向反应后的固体混合物中加入134.1g水.充分溶解后,过滤,得到滤渣3g和只含一种溶质的不饱和溶液,则所得不饱和溶液中溶质的质量分数为______.
(4)小岗同学欲配制lO0g溶质质量分数为5%氯化钾溶液.需要上述得到的氯化钾溶液的质量是______g.
(5)根据上述数据计算混合物①的质量是______.赞
laowang9999 幼苗
共回答了16个问题采纳率:93.8% 举报
解题思路:氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,由题意:混合物①加热一段时间后,得到4.8g氧气;根据质量守恒定律,加热前后质量的减少的质量即混合物②生成的氧气的质量,据此由生成氧气的总质量,根据反应的化学方程式列式计算出混合物①中氯酸钾的质量;根据质量守恒定律计算出生成的氯化钾的质量,进而计算出所得不饱和溶液中溶质的质量分数;根据溶液稀释前后,溶质的质量不变,计算出需要上述得到的氯化钾溶液的质量.(1)氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为:2KClO3
MnO2
.
△2KCl+3O2↑.
(2)加热混合物①产生氧气的质量为4.8g,加热混合物②产生氧气的质量为37.7g-32.9g=4.8g;即混合物①中氯酸钾完全分解产生氧气的总质量为4.8g+4.8g=9.6g;设混合物①中氯酸钾质量为x,
2KClO3
MnO2
.
△2KCl+3O2↑
245 96
x 9.6g
混合物①中氯酸钾质量的比例式为:[245/96=
x
9.6g]
(3)生成氯化钾的质量为24.5g-9.6g=14.9g,
所得不饱和溶液中溶质的质量分数为[14.9g/14.9g+134.1g×100%=10%.
(4)设需要上述得到的氯化钾溶液的质量为x,根据溶液稀释前后,溶质的质量不变,
则100g×5%=x×10% x=50g.
(5)混合物①为氯酸钾和二氧化锰的混合物,(3)中充分溶解后过滤,得到滤渣3g即为二氧化锰的质量,混合物①的质量是24.5g+3g=27.5g.
故答案为:(1)2KClO3
MnO2
.
△]2KCl+3O2↑;(2)[245/96=
x
4.8g];(3)10%;(4)50;(5)27.5g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题难度不是很大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氧气的质量是正确解答本题的前提和关键.1年前
6可能相似的问题-
(2012•南岗区二模)有关能源和资源的说法不正确的是( )
1年前1个回答
-
1年前1个回答
-
1年前1个回答
你能帮帮他们吗
-
下列各句中,没有语病的一句是(2分) A.只要你单位同意,报销车旅费,安排住处,领取大会出席证的问题可由我们解决。 B.
1年前
-
我会把音节补充完整. 我会把音节补充完整. ___ǐ w___ sh___ ___iā ___uài g___ 笔 我
1年前
-
解释下列句中加点的字《范元琰为人善良》里的1):尝出行 尝:2):母问其故,句以实答 具:3):向所以退,畏其愧耻 向:
1年前
-
英语翻译请问里面的例句查询这一功能是什么意思呢?是有怎样的功能?能不能我输入一个中文句子然后直接翻译成英文呢,就像电脑网
1年前
-
这个↓下面把下列句子按一定顺序排成通顺的短文,序号写在前面的括号里. () 就这样,挚友被押解起来,米卢司赶回家乡……
1年前
Copyright © 2022 YULUCN.COM - 雨露学习互助 - 17 q. 0.052 s. - webmaster@yulucn.com chuhan1年前1
chuhan1年前1 -
 laowang9999 共回答了16个问题
laowang9999 共回答了16个问题 |采纳率93.8%解题思路:氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,由题意:混合物①加热一段时间后,得到4.8g氧气;根据质量守恒定律,加热前后质量的减少的质量即混合物②生成的氧气的质量,据此由生成氧气的总质量,根据反应的化学方程式列式计算出混合物①中氯酸钾的质量;根据质量守恒定律计算出生成的氯化钾的质量,进而计算出所得不饱和溶液中溶质的质量分数;根据溶液稀释前后,溶质的质量不变,计算出需要上述得到的氯化钾溶液的质量.(1)氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为:2KClO3
MnO2
.
△2KCl+3O2↑.
(2)加热混合物①产生氧气的质量为4.8g,加热混合物②产生氧气的质量为37.7g-32.9g=4.8g;即混合物①中氯酸钾完全分解产生氧气的总质量为4.8g+4.8g=9.6g;设混合物①中氯酸钾质量为x,
2KClO3
MnO2
.
△2KCl+3O2↑
245 96
x 9.6g
混合物①中氯酸钾质量的比例式为:[245/96=
x
9.6g]
(3)生成氯化钾的质量为24.5g-9.6g=14.9g,
所得不饱和溶液中溶质的质量分数为[14.9g/14.9g+134.1g×100%=10%.
(4)设需要上述得到的氯化钾溶液的质量为x,根据溶液稀释前后,溶质的质量不变,
则100g×5%=x×10% x=50g.
(5)混合物①为氯酸钾和二氧化锰的混合物,(3)中充分溶解后过滤,得到滤渣3g即为二氧化锰的质量,混合物①的质量是24.5g+3g=27.5g.
故答案为:(1)2KClO3
MnO2
.
△]2KCl+3O2↑;(2)[245/96=
x
4.8g];(3)10%;(4)50;(5)27.5g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题难度不是很大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氧气的质量是正确解答本题的前提和关键.1年前查看全部
- (2009•南岗区一模)张南同学用紫甘蓝浸出液做实验,观察紫甘蓝浸出液在不同酸碱度下所显示的颜色,记录如下: pH 1
(2009•南岗区一模)张南同学用紫甘蓝浸出液做实验,观察紫甘蓝浸出液在不同酸碱度下所显示的颜色,记录如下:
下列物质中,能使紫甘蓝汁液变红色的是( )pH 1 2~3 4~6 7~9 10 11 12~14 颜色 深红 紫红 浅紫 蓝 绿 黄绿 黄
A.纯碱溶液
B.食盐水
C.食用醋
D.牛奶 SCHYX11年前1
SCHYX11年前1 -
 恐龙gg手 共回答了13个问题
恐龙gg手 共回答了13个问题 |采纳率92.3%解题思路:本题考查溶液的酸碱性和习题信息处理.由记录信息可知能使紫甘蓝汁液变红色的是酸性溶液.A、纯碱溶液显碱性,故A错误.
B、食盐水显中性,故B错误.
C、食用醋显酸性,故C正确.
D、牛奶为中性,故D错误.
故选C.点评:
本题考点: 溶液的酸碱性与pH值的关系.
考点点评: 要熟悉生活中常见物质的溶液的酸碱性,学会习题信息的抽取和应用.1年前查看全部
- (2012•南岗区二模)张南同学学习了碱的性质之后,知道二氧化碳能与氢氧化钠溶液反应,想从实验现象证明二者能发生化学反应
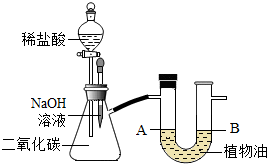 (2012•南岗区二模)张南同学学习了碱的性质之后,知道二氧化碳能与氢氧化钠溶液反应,想从实验现象证明二者能发生化学反应,于是设计了如右图所示装置.请根据实验步骤,回答下列有关问题.
(2012•南岗区二模)张南同学学习了碱的性质之后,知道二氧化碳能与氢氧化钠溶液反应,想从实验现象证明二者能发生化学反应,于是设计了如右图所示装置.请根据实验步骤,回答下列有关问题.
(1)实验①:按图连接好装置,装置的气密性良好,先用胶头滴管将少量氢氧化钠溶液滴入吸滤瓶中,轻轻振荡容器,此过程中发生反应的化学方程式为______.
(2)实验②:过一段时间后,将分液漏斗内的稀盐酸(足量)加入吸滤瓶中,此过程中产生的现象有①______;产生此现象的原因是②______.
(3)上述实验步骤中,最能说明二氧化碳能与氢氧化钠溶液反应的实验是______(填“实验①”或“实验⑦”),另一个实验不能说明二氧化碳能与氢氧化钠溶液的原因是______. 等购1年前1
等购1年前1 -
 _牛奶麦片_ 共回答了17个问题
_牛奶麦片_ 共回答了17个问题 |采纳率100%解题思路:(1)根据氢氧化钠与二氧化碳反应生成碳酸钠和水写出方程式;(2)根据二氧化碳与氢氧化钠溶液反应先使瓶内的气压减小,后盐酸与碳酸钠反应又产生等量的二氧化碳分析;(3)二氧化碳与氢氧化钠溶液反应生成碳酸钠使瓶内的气压变小,但二氧化碳也溶于水且与水反应液会使瓶内气压变小.(1)氢氧化钠与二氧化碳反应生成碳酸钠和水,反应的方程式为:2NaOH+CO2=Na2CO3+H2O;
(2)氢氧化钠与二氧化碳反应生成的碳酸钠会与稀盐酸反应生成二氧化碳气体,同时也会使瓶内的气压变大,故看到的现象是:锥形瓶内液体中有气泡产生;U形管内A液面下降,B液面上升,最后趋于液面相平;产生此现象的原因是:实验①中将少量的氢氧化钠溶液滴入吸滤瓶中,二氧化碳与氢氧化钠溶液反应生成碳酸钠.当把分液漏斗内的稀盐酸加入吸滤瓶时,稀盐酸与碳酸钠反应生成等量的二氧化碳气体,使装置内气体增加,压强变大,大于外界的大气压,在压强差的作用下使U形管内A液面下降,B液面上升,最后液面趋于相平;
(3)因为二氧化碳与氢氧化钠反应生成碳酸钠,通过盐酸看到气泡产生可以证明二者确实反应了,故实验②最能说明二氧化碳能与氢氧化钠溶液反应;而实验①中瓶内气压的变化的原因还可能来自二氧化碳与水的反应,故另一个实验不能说明二氧化碳能与氢氧化钠溶液的原因是;虽然看到U形管内A液面上升,B液面下降,但无法证明是二氧化碳与氢氧化钠溶液反应还是二氧化碳溶于水与水反应产生的现象.
故答案为:(1)2NaOH+CO2=Na2CO3+H2O
(2)锥形瓶内液体中有气泡产生;U形管内A液面下降,B液面上升,最后趋于液面相平; 实验①中将少量的氢氧化钠溶液滴入吸滤瓶中,二氧化碳与氢氧化钠溶液反应生成碳酸钠,使瓶内气压变小,因此A液面上升,B液面下降;当把分液漏斗内的足量稀盐酸加入吸滤瓶时,稀盐酸与碳酸钠反应生成等量的二氧化碳气体,使装置内气体增加,压强变大,大于外界的大气压,在压强差的作用下使U形管内A液面下降,B液面上升,最后趋于相平.
(3)实验②虽然看到U形管内A液面上升,B液面下降,但无法证明是二氧化碳与氢氧化钠溶液反应还是二氧化碳溶于水与水反应产生的现象.点评:
本题考点: 碱的化学性质;酸的化学性质.
考点点评: 本题考查了二氧化碳与氢氧化钠反应使瓶内的气压发生变化而设计的实验,但要考虑到二氧化碳溶于水且与水反应引起的压强变化的影响.1年前查看全部
- (2012•哈尔滨一模)张南同学很爱吃“锅包肉”,这也是许多中学生爱吃一道菜品,“锅包肉”主料一般是猪的瘦肉,如图是一块
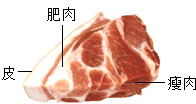 (2012•哈尔滨一模)张南同学很爱吃“锅包肉”,这也是许多中学生爱吃一道菜品,“锅包肉”主料一般是猪的瘦肉,如图是一块猪肉的照片,请回答有关问题.
(2012•哈尔滨一模)张南同学很爱吃“锅包肉”,这也是许多中学生爱吃一道菜品,“锅包肉”主料一般是猪的瘦肉,如图是一块猪肉的照片,请回答有关问题.
(1)图中的猪肉中含蛋白质的是______;
(2)含有油脂的物质是①______,油脂在人体中的作用是②______. 李盈华1年前1
李盈华1年前1 -
 zl721116 共回答了21个问题
zl721116 共回答了21个问题 |采纳率95.2%解题思路:(1)根据蛋白质的食物来源分析即可.
(2)根据油脂的食物来源与功能分析即可.由图片中的内容可以看出:瘦肉与皮中含有蛋白质,肥肉中含有油脂,其作用是为机体活动和维持恒定体温提供能量.
故答案为:(1)瘦肉、皮;(2)肥肉,为机体活动和维持恒定体温提供能量(剩余的可以转化为脂肪做备用能源)(供能和备用能源都给分).点评:
本题考点: 生命活动与六大营养素.
考点点评: 关注生命,呵护健康,是人类不断探求的永恒主题,化学来源于生产生活,也必须服务于生产生活,所以与人类生产生活相关的化学知识也是重要的中考热点之一.1年前查看全部
- (2008•南岗区一模)张南同学取来某种品牌的胃药30g放入烧杯中,再加入82g的稀盐酸,充分反应后所得混合物的质量为1
(2008•南岗区一模)张南同学取来某种品牌的胃药30g放入烧杯中,再加入82g的稀盐酸,充分反应后所得混合物的质量为103.2g,此时溶液的pH为7.若此胃药中只含氢氧化铝、氧化镁、碳酸氢钠等常见的治疗胃病药剂中的一种.且胃药中的其他成分不与盐酸反应也不溶于水.试回答:
(1)此胃药中含有的治疗胃病药剂是______
(2)发生反应的化学方程式是______
(3)列出参加反应的药剂质量(x)的比例式为[84/X =
=44 8.8g] [84/X44 8.8g]
(4)反应后所得溶液溶质的质量分数是______.赞
长风惊天 幼苗
共回答了22个问题采纳率:86.4% 举报
解题思路:理解酸的化学性质及能够和酸反应的常见的物质,并能进行简单的有关的计算.(1)30克胃药与80克盐酸混合,充分反应后只得到103.2克混合物,少了8.8克,说明生成了8.8气体,由于在氢氧化铝、氧化镁、碳酸氢钠,只有碳酸氢钠与盐酸反应能生成气体.故答案为:碳酸氢钠
(2)由于碳酸氢钠与稀盐酸反应生成氯化钠、二氧化碳和水,故答案为:NaHCO3+HCl=NaCl+H2O+CO2↑
(3)该题的具体过程为:设参加反应的药剂即碳酸氢钠的质量为X,生成的氯化钠的质量为Y.
NaHCO3+HCl=NaCl+H2O+CO2↑
8458.5 44
X Y 8.8
[84/x=
44
8.8g][58.5/y=
44
8.8g]
x=[84×8.8g/44]=16.8g y=[58.5×8.8g/44]=11.7g
所的溶液中溶质的质量分数为:[11.7g
103.2g−(30g−16.8g)×100%═13%
故答案为:
84/x=
44
8.8g]
(4)13%点评:
本题考点: 酸的化学性质;碳酸钠、碳酸氢钠与碳酸钙;书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算.
考点点评: 主要考查了酸的化学性质,常见化学方程式的书写,培养学生分析问题、解决问题、计算的能力.1年前
3可能相似的问题-
1年前1个回答
-
1年前1个回答
-
1年前1个回答
-
(2008•南岗区三模)实验室里的实验台上有下列仪器及药品.
1年前1个回答
你能帮帮他们吗
Copyright © 2022 YULUCN.COM - 雨露学习互助 - 17 q. 0.063 s. - webmaster@yulucn.com 血色梦想1年前1
血色梦想1年前1 -
 长风惊天 共回答了22个问题
长风惊天 共回答了22个问题 |采纳率86.4%解题思路:理解酸的化学性质及能够和酸反应的常见的物质,并能进行简单的有关的计算.(1)30克胃药与80克盐酸混合,充分反应后只得到103.2克混合物,少了8.8克,说明生成了8.8气体,由于在氢氧化铝、氧化镁、碳酸氢钠,只有碳酸氢钠与盐酸反应能生成气体.故答案为:碳酸氢钠
(2)由于碳酸氢钠与稀盐酸反应生成氯化钠、二氧化碳和水,故答案为:NaHCO3+HCl=NaCl+H2O+CO2↑
(3)该题的具体过程为:设参加反应的药剂即碳酸氢钠的质量为X,生成的氯化钠的质量为Y.
NaHCO3+HCl=NaCl+H2O+CO2↑
8458.5 44
X Y 8.8
[84/x=
44
8.8g][58.5/y=
44
8.8g]
x=[84×8.8g/44]=16.8g y=[58.5×8.8g/44]=11.7g
所的溶液中溶质的质量分数为:[11.7g
103.2g−(30g−16.8g)×100%═13%
故答案为:
84/x=
44
8.8g]
(4)13%点评:
本题考点: 酸的化学性质;碳酸钠、碳酸氢钠与碳酸钙;书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算.
考点点评: 主要考查了酸的化学性质,常见化学方程式的书写,培养学生分析问题、解决问题、计算的能力.1年前查看全部
- (2013•南岗区一模)张南在实验室发现有一瓶没有标签的白色粉末,可能含有KCl、Na2C03、CaCl2 C
 (2013•南岗区一模)张南在实验室发现有一瓶没有标签的白色粉末,可能含有KCl、Na2C03、CaCl2 CaCO3、无CuSO4 中的一种或几种,为确定白色粉末的成分.取该混合物进行以下实验:
(2013•南岗区一模)张南在实验室发现有一瓶没有标签的白色粉末,可能含有KCl、Na2C03、CaCl2 CaCO3、无CuSO4 中的一种或几种,为确定白色粉末的成分.取该混合物进行以下实验:
[提出问题]这包白色粉末的成分是什么?
[实验探究]
步骤1:张南同学取白色粉末少许加适基的蒸馏水充分溶解后,得到无色透明溶液,张南同学就此得出结论1:白色粉末中一定不含CaSO4 和CuSO4;
请你评价张南同学的实验结论______
步骤2:张南同学取上述所得无色透明溶液于试管中,向其中加入适量的稀盐酸.观察有气泡产生,张南同学就此得出结论2,白色粉末中一定含有______,不含有______,理由是______
步骤3:张南同学取步骤2反应后的溶液,向其中滴加AgNO3 溶液和稀硝酸,生成白色沉淀.
[解释与结论]通过上述实验,张南同学得出总的实验结论,白色粉末中含有确物质是______. 陷阱51年前1
陷阱51年前1 -
 headbank 共回答了20个问题
headbank 共回答了20个问题 |采纳率100%解题思路:在KCl、Na2CO3、CaCl2、CaCO3、无水CuSO4中,硫酸铜溶于水得到溶液呈蓝色,无色溶液中一定不含有硫酸铜;碳酸钙不溶于水,放入水中形成白色沉淀;Na2CO3能与CaCl2形成的白色CaCO3沉淀,不能共存;Na2CO3能与稀盐酸反应放出气体二氧化碳;KCl和反应产生的CaCl2能与AgNO3溶液生成不溶于稀硝酸的白色AgCl沉淀,故无法确定KCl的存在;
利用以上物质间的变化关系,根据实验现象推断白色粉末的组成.步骤1:加蒸馏水溶解后得到无色透明溶液;可以确定粉末中不含CuSO4、CaCO3,因为硫酸铜溶于水得到溶液呈蓝色,无色溶液中一定不含有硫酸铜;碳酸钙不溶于水,放入水中形成白色沉淀;而且不能同时含有Na2CO3与CaCl2;
步骤2:在此溶液中滴加适量的稀盐酸,产生气泡,可以确定粉末中只含有Na2CO3而一定不含CaCl2;
步骤3:在步骤2的滤液中滴加AgNO3溶液和稀硝酸,生成白色沉淀;说明滤液中一定含有Cl-,而溶液中的Cl-可能来自于所加入的HCl,也可能来自于粉末中的KCl,可判断粉末中可能含有KCl;
[解释与结论]白色粉末中一定含有的物质是Na2CO3;可能含有KCl;
故答案为:步骤1:硫酸铜溶于水得到溶液呈蓝色,碳酸钙不溶于水,放入水中形成白色沉淀,所以一定不含有硫酸铜和碳酸钙;
步骤2:Na2CO3;CaCl:;Na2CO3能与CaCl2形成的白色CaCO3沉淀,不能共存;
[解释与结论]Na2CO3.点评:
本题考点: 缺失标签的药品成分的探究;酸的化学性质;盐的化学性质;酸碱盐的溶解性.
考点点评: 本考点属于物质的推断题,根据粉末中可能含有的物质的性质及相互间的反应关系,结合实验过程中所出现的现象,对粉末的组成进行判断.1年前查看全部
- 张南同学想测定赤铁矿中氧化铁的质量分数,请回答有关问题.
张南同学想测定赤铁矿中氧化铁的质量分数,请回答有关问题.
测定方法如下:(假设赤铁矿中杂质不溶于水也不与酸反应).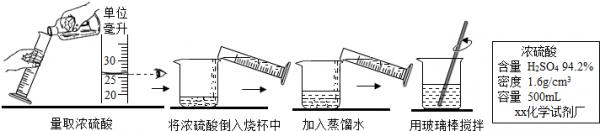
(1)配制硫酸.
①配制200g 19.6%的稀硫酸,需要标签上标注的浓硫酸的体积是______;(结果保留整数)
②上述实验过程中出现操作的错误是______.
(2)将赤铁矿粉末与稀硫酸混合,反应的化学方程式是______
(3)取20g的赤铁矿粉与150g 19.6%的稀硫酸恰好完全反应,求解生成硫酸铁质量(X)的比例式为[294/29.4g]=[400/y][294/29.4g]=[400/y];
(4)此赤铁矿中氧化铁的质量分数为______;
(5)向反应后所得溶液中加入34g水,则所得溶液溶质的质量分数是______. superman931年前1
superman931年前1 -
 adatony 共回答了20个问题
adatony 共回答了20个问题 |采纳率95%解题思路:(1)①根据稀释前后溶液中溶质的质量不变结合密度公式可以完成解答;
②根据浓硫酸的稀释的方法进行解答;
(2)赤铁矿中的主要成分为氧化铁,氧化铁和稀硫酸反应生成硫酸铁和水可以据此写出该反应的化学方程式;
(3)根据氧化铁和稀硫酸反应的化学方程式结合它们的相对分子质量可以列出比例式;
(4)根据反应的化学方程式可以计算出氧化铁的质量,进而计算出氧化铁的质量分数;
(5)反应后得到的溶液为硫酸铁的溶液,可以根据溶液中溶质的质量分数的计算方法进行解答.(1)①设需要标签上标注的浓硫酸的体积是x
x•1.6g/cm3×94.2%=200g×19.6%
解得:x=26mL
②在稀释浓硫酸时应该将浓硫酸慢慢注入水中并不断搅拌,分析图中的过程可以知道图中的错误为先加入浓硫酸后加入水;
(2)赤铁矿中的主要成分为氧化铁,氧化铁和稀硫酸反应生成硫酸铁和水,该反应的化学方程式为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(3)150g19.6%的稀硫酸中含有硫酸的质量为:150g×19.6%=29.4g
设生成硫酸铁的质量为y,
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
160 294 400
z29.4gy
[294/29.4g]=[400/y]
解得:y=40g
(4)设赤铁矿中氧化铁的质量为z
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
160 294
z29.4g
[294/29.4g]=[160/y]
解得:z=16g
赤铁矿中氧化铁的质量分数为:[16g/20g]×100%=80%
(5)向反应后所得溶液中加入34g水,则所得溶液溶质的质量分数是:[40g/150g+16g+34g]×100%=20%
故答案为:(1)26mL;
②先加入浓硫酸后加入水;
(2)Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(3)[294/29.4g]=[400/y];
(4)80%;
(5)20%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 该考点的命题方向主要是通过创设相关问题情景或图表信息等,来考查学生对根据化学反应方程式的计算步骤和格式的理解和掌握情况;以及阅读、分析、推断能力和对知识的迁移能力.1年前查看全部
- 张南同学为了验证铁、铜、银的金属活动性顺序,设计了如下实验方案:①将大小一样的铁片和铜片分别插入到溶质质量分数相同的稀盐
张南同学为了验证铁、铜、银的金属活动性顺序,设计了如下实验方案:①将大小一样的铁片和铜片分别插入到溶质质量分数相同的稀盐酸中;②将铜片插入到硝酸银溶液中.根据实验①②可以判断出金属活动性强弱顺序.根据实验①的现象可以得出的结论是 ______;判断铜的活动性比银强的现象是 ______,反应的化学方程式为 ______.  ErvineWong1年前1
ErvineWong1年前1 -
 mxzxyy 共回答了20个问题
mxzxyy 共回答了20个问题 |采纳率95%铁可以与盐酸反应生成氢气,说明铁在氢前,而铜不能与盐酸反应生成氢气,说明铜在氢后,铜与硝酸银溶液反应生成银和硝酸铜,硝酸铜溶液为蓝色,所以本题答案为:铁的金属活动性比铜强,铜片上覆盖一层银白色固体物质,溶液由无色变为蓝色,Cu+2AgNO 3 =2Ag+Cu(NO 3 ) 2 .1年前查看全部
- (2013•南岗区一模)如图是张南同学正在绘制的实验室用高锰酸钾制取氧气的装置网.
(2013•南岗区一模)如图是张南同学正在绘制的实验室用高锰酸钾制取氧气的装置网.
(1)请你帮他将装置图补充完整: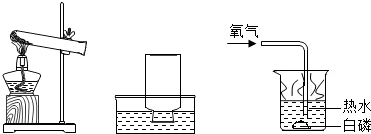
(2)写出用高锰酸钾制取氧气的化学方程式2KMnO4
K2MnO4+MnO2+O2↑△ .2KMnO4
K2MnO4+MnO2+O2↑△ .
(3)用导管对准烧杯中的白磷,通人少量的氧气(如图所示),观察到本来在热水中不燃烧的白磷在热水中却能燃烧,此实验说明可燃物燃烧需要的条件是______. yljhap1年前1
yljhap1年前1 -
 adas362 共回答了21个问题
adas362 共回答了21个问题 |采纳率85.7%解题思路:(1)氧气的制取装置,同时也包含了氧气的收集方法,结合所学知识画出即可.
(2)高锰酸钾在加热的条件下生成锰酸钾和二氧化锰和氧气,配平即可.
(3)根据题中信息分析可燃物燃烧的条件.(1)画图要求:①有棉花;②伸入试管中不能过长;③密封管口,涂黑;④钝角;⑤有胶管,涂黑;⑥弯管口不能超过集气瓶颈部;⑦画出水面实线,中间虚线等;
故答案为: ;
;
(2)高锰酸钾在加热的条件下生成锰酸钾和二氧化锰和氧气,配平即可;
故答案为:2KMnO4
△
.
K2MnO4+MnO2+O2↑;
(3)本来在热水中不燃烧的白磷在温度相同的情况下通入氧气却能燃烧,说明可燃物燃烧需要的条件是和氧气接触;
故答案为:和氧气接触.点评:
本题考点: 氧气的制取装置;氧气的收集方法;燃烧与燃烧的条件.
考点点评: 本考点主要考查氧气的制取装置和收集装置的连接、物质燃烧条件的探究,同时也考查了化学方程式的书写,综合性比较强,要认真把握.1年前查看全部
- (2012•哈尔滨一模)张南同学想测定某赤铁矿样品中氧化铁的质量分数,做法如下.请回答下列问题(假设赤铁矿样品中杂质不与
 (2012•哈尔滨一模)张南同学想测定某赤铁矿样品中氧化铁的质量分数,做法如下.请回答下列问题(假设赤铁矿样品中杂质不与酸反应,也不溶于水).
(2012•哈尔滨一模)张南同学想测定某赤铁矿样品中氧化铁的质量分数,做法如下.请回答下列问题(假设赤铁矿样品中杂质不与酸反应,也不溶于水).
(1)配制稀盐酸,配制400g7.3%的稀盐酸.需要如图标签上标注的浓盐酸的质量是______;
(2)将赤铁矿粉末与稀盐酸混合,反应的化学方程式是______;
(3)取20g的赤铁矿粉与300g的7.3%的稀盐酸恰好完全反应,求解生成氯化铁质量X的比例式为[219/325=
=21.9g x] [219/32521.9g x];
(4)此赤铁矿中氧化铁的质量分数为______;
(5)向反应后所得溶液中加入9g水,则最终所得溶液中溶质的质量分数是______;
(6)若用上述赤铁矿冶炼生铁63t,生铁中杂质含量为4%,炼铁过程中生铁的损失率为20%,求解需要此矿石的质量为:______.赞
dxcp 幼苗
共回答了12个问题采纳率:91.7% 举报
解题思路:(1)使用36.5%的浓盐酸配制7.3%的稀盐酸可采取加水稀释,稀释前后溶质盐酸的质量不变,据此,可由7.3%的稀盐酸的量计算所需36.5%浓盐酸的质量;
(2)赤铁矿的主要成分为氧化铁,氧化铁与盐酸可发生复分解反应,通过交换成分可形成氯化铁和水;
(3)根据反应的化学方程式,可由盐酸的质量计算出氯化铁的质量x;
(4)赤铁矿样品中氧化铁的质量分数=[氧化铁的质量/样品质量20g]×100%;
(5)向溶液中加水,溶液中溶质质量不变,因此,最终得到溶液溶质的质量分数=[氯化铁的质量/所得溶液的质量]×100%,因此需要根据氧化铁质量计算反应生成氯化铁的质量及参加反应的盐酸的质量;溶液的质量利用物质质量守恒定律进行计算.
(6)根据质量守恒定律元素质量不变来求;(1)需要36.5%的浓盐酸的质量=400g×7.3%÷36.5%=80g.
故答案为:80g;
(2)赤铁矿的主要成分为三氧化二铁,三氧化二铁与盐酸反应生成氯化铁和水;
故答案为:Fe2O3+6HCl=2FeCl3+3H2O;
(3)设生成氯化铁质量x
Fe2O3 +6HCl=2FeCl3 +3H2O
219 325
300g×7.3% x
故答案为:[219/325=
21.9g
x];
(4)设氧化铁的质量为y
Fe2O3 +6HCl=2FeCl3 +3H2O
160 219
y 300g×7.3%
[160/219=
y
300g×7.3%]
y=16g
赤铁矿样品中氧化铁的质量分数为:[16g/20g]×100%=80%.
故答案为:80%;
(5)向反应后所得溶液中加入9g水,则最终所得溶液中溶质的质量分数是[32.5g/300g+20g×80%+9g]×100%=10%.
故答案为:10%
(6)需要此矿石的质量为63t÷(1-20%)×(1-4%)÷[56×2/56×216×3]÷80%=120t.
故答案为:120t.点评:
本题考点: 有关溶质质量分数的简单计算;含杂质物质的化学反应的有关计算;书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算.
考点点评: 根据质量守恒定律,最终所得溶液的质量=氧化铁质量+参加反应稀盐酸的质量+所加水的质量.1年前
5可能相似的问题-
1年前1个回答
-
1年前1个回答
你能帮帮他们吗
Copyright © 2022 YULUCN.COM - 雨露学习互助 - 17 q. 0.093 s. - webmaster@yulucn.com hmh958021年前1
hmh958021年前1 -
 dxcp 共回答了12个问题
dxcp 共回答了12个问题 |采纳率91.7%解题思路:(1)使用36.5%的浓盐酸配制7.3%的稀盐酸可采取加水稀释,稀释前后溶质盐酸的质量不变,据此,可由7.3%的稀盐酸的量计算所需36.5%浓盐酸的质量;
(2)赤铁矿的主要成分为氧化铁,氧化铁与盐酸可发生复分解反应,通过交换成分可形成氯化铁和水;
(3)根据反应的化学方程式,可由盐酸的质量计算出氯化铁的质量x;
(4)赤铁矿样品中氧化铁的质量分数=[氧化铁的质量/样品质量20g]×100%;
(5)向溶液中加水,溶液中溶质质量不变,因此,最终得到溶液溶质的质量分数=[氯化铁的质量/所得溶液的质量]×100%,因此需要根据氧化铁质量计算反应生成氯化铁的质量及参加反应的盐酸的质量;溶液的质量利用物质质量守恒定律进行计算.
(6)根据质量守恒定律元素质量不变来求;(1)需要36.5%的浓盐酸的质量=400g×7.3%÷36.5%=80g.
故答案为:80g;
(2)赤铁矿的主要成分为三氧化二铁,三氧化二铁与盐酸反应生成氯化铁和水;
故答案为:Fe2O3+6HCl=2FeCl3+3H2O;
(3)设生成氯化铁质量x
Fe2O3 +6HCl=2FeCl3 +3H2O
219 325
300g×7.3% x
故答案为:[219/325=
21.9g
x];
(4)设氧化铁的质量为y
Fe2O3 +6HCl=2FeCl3 +3H2O
160 219
y 300g×7.3%
[160/219=
y
300g×7.3%]
y=16g
赤铁矿样品中氧化铁的质量分数为:[16g/20g]×100%=80%.
故答案为:80%;
(5)向反应后所得溶液中加入9g水,则最终所得溶液中溶质的质量分数是[32.5g/300g+20g×80%+9g]×100%=10%.
故答案为:10%
(6)需要此矿石的质量为63t÷(1-20%)×(1-4%)÷[56×2/56×216×3]÷80%=120t.
故答案为:120t.点评:
本题考点: 有关溶质质量分数的简单计算;含杂质物质的化学反应的有关计算;书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算.
考点点评: 根据质量守恒定律,最终所得溶液的质量=氧化铁质量+参加反应稀盐酸的质量+所加水的质量.1年前查看全部
- 张南同学学习了碱的性质之后,知道二氧化碳能与氢氧化钠溶液反应,想从实验现象证明二者能发生化学反应,于是设计了如图所示装置
张南同学学习了碱的性质之后,知道二氧化碳能与氢氧化钠溶液反应,想从实验现象证明二者能发生化学反应,于是设计了如图所示装置.请根据实验步骤,回答下列有关问题.
(1)实验①:按图连接好装置,装置的气密性良好,先用胶头滴管将少量氢氧化钠溶液滴入吸滤瓶中,轻轻振荡容器,此过程中发生反应的化学方程式为______;
(2)实验②:过一段时间后,将分液漏斗内的稀盐酸(足量)加入吸滤瓶中,此过程中产生的现象有______;产生此现象的原因是______.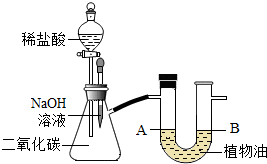
 丹泽尔去了华盛顿1年前1
丹泽尔去了华盛顿1年前1 -
 howbigsea 共回答了19个问题
howbigsea 共回答了19个问题 |采纳率94.7%(1)氢氧化钠与二氧化碳反应生成碳酸钠和水,反应的方程式为:2NaOH+CO 2 =Na 2 CO 3 +H 2 O;
(2)氢氧化钠与二氧化碳反应生成的碳酸钠会与稀盐酸反应生成二氧化碳气体,同时也会使瓶内的气压变大,故看到的现象是:锥形瓶内液体中有气泡产生;U形管内A液面下降,B液面上升,最后趋于液面相平;产生此现象的原因是:实验①中将少量的氢氧化钠溶液滴入吸滤瓶中,二氧化碳与氢氧化钠溶液反应生成碳酸钠.当把分液漏斗内的稀盐酸加入吸滤瓶时,稀盐酸与碳酸钠反应生成等量的二氧化碳气体,使装置内气体增加,压强变大,大于外界的大气压,在压强差的作用下使U形管内A液面下降,B液面上升,最后液面趋于相平;
故答案为:(1)2NaOH+CO 2 =Na 2 CO 3 +H 2 O
(2)吸滤瓶内液体中有气泡产生,U形管内A液面下降,B液面上升,最终A液面和B液面(基本)相平(或A液面略低于B液面).
当把分液漏斗内的稀盐酸加入吸滤瓶时,稀盐酸与碳酸钠反应产生二氧化碳气体,使装置内气体量增加,(1分)压强变大,大于外界气压,在压强差(或内压)的作用(在内压和液柱压强的作用下)下使U形管内A液面下降,B液面上升,最终A液面和B液面(基本)相平(或A液面略低于B液面).1年前查看全部
- (2012•哈尔滨一模)构建知识网络是一种重要的学习力法,如图是张南同学画出的四种物质之间的转化关系.图 中A
 (2012•哈尔滨一模)构建知识网络是一种重要的学习力法,如图是张南同学画出的四种物质之间的转化关系.图 中A、B、C、D四个方框,分别是碳酸钠溶液、氢氧化钠溶液、硝酸钠溶液和硫酸钠溶液四种溶液中的一种,图中方框之间的“→”表示某种物质能和其他物质反应生成箭头所指的物质.请回答下列问题:
(2012•哈尔滨一模)构建知识网络是一种重要的学习力法,如图是张南同学画出的四种物质之间的转化关系.图 中A、B、C、D四个方框,分别是碳酸钠溶液、氢氧化钠溶液、硝酸钠溶液和硫酸钠溶液四种溶液中的一种,图中方框之间的“→”表示某种物质能和其他物质反应生成箭头所指的物质.请回答下列问题:
(1)请根据图中的转化关系,在方框内填写A、B、C、D物质溶质的化学式.
(2)A转化为B发生化学反应的现象是______.
(3)请写出A转化为C反应的化学方程式______. zyxism1年前1
zyxism1年前1 -
 友朋小食 共回答了15个问题
友朋小食 共回答了15个问题 |采纳率86.7%(1)根据四物质间的转化关系可知:NaOH
+CO2
+Ca(OH)2Na2CO3;NaOH
+H2SO4
Ba(OH)2Na2SO4;可知B是氢氧化钠,由于A
H2SO4
B所以A是碳酸钠D是硫酸钠,则C是硝酸钠.
(2)A→B的转化是碳酸钠与氢氧化钙(氢氧化钡)等可溶性碱反应并生成白色沉淀完成的,所以现象是产生白色沉淀;
(3)由A→C的反应是碳酸钠生成硝酸钠的反应,所以依据复分解反应的发生条件可知可以加硝酸完成也可以加入硝酸盐与碳酸钠反应生成沉淀完成(只要合理即可).
故答案为:
(1)A:Na2CO3;B:NaOH;C:NaNO3;D:Na2SO4;
(2)产生白色沉淀;
(3)Ba(NO3)2+Na2CO3═BaCO3↓+2NaNO3.1年前查看全部
- 如图是张南妈妈刚买回来的一些食品及调料,这里蕴含着丰富的化学知识,请按要求回答问题.
如图是张南妈妈刚买回来的一些食品及调料,这里蕴含着丰富的化学知识,请按要求回答问题.
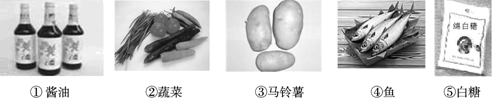
(1)能为人体补充蛋白质的食品有______;能为人体补充糖类的食品有______;维生素在人体中的作用有______ (填序号).
(2)炒菜时能用做调料的有______(填序号).
(3)张南发现妈妈买回来的芹菜叶片发黄,张南认为芹菜在生长过程中土壤中缺少一种化肥,这种化肥是______(填种类). 小伙1111年前1
小伙1111年前1 -
 一苇渡海 共回答了16个问题
一苇渡海 共回答了16个问题 |采纳率93.8%解题思路:(1)鸡蛋中含有丰富的蛋白质;马铃薯富含淀粉,淀粉属于糖类,白糖属于糖类物质;维生素的作用是调节新陈代谢,预防疾病,维持身体健康.
(2)酱油可做调料;
(3)氮肥能使农作物枝叶繁茂、叶色浓绿、还能提高产量.(1)鸡蛋中含有丰富的蛋白质;能为人体补充糖类的食品是马铃薯、白糖;蔬菜中富含的营养素是维生素,维生素的作用是调节新陈代谢,预防疾病,维持身体健康.
(2)酱油是家庭中常用的调料;
(3)氮肥能使农作物枝叶繁茂、叶色浓绿、还能提高产量.
故答案为:(1)④;③⑤;调节新陈代谢,预防疾病,维持身体健康.
(2)①(3)氮肥点评:
本题考点: 生命活动与六大营养素;常见化肥的种类和作用.
考点点评: 解答本题要分析食物中的主要成分,然后再根据营养物质的分类进行分析、判断,从而得出正确的结论.1年前查看全部
- (2010•南岗区二模)张南同学为了验证铁、铜、银的金属活动性顺序,设计了如下实验方案:①将大小一样的铁片和铜片分别插入
(2010•南岗区二模)张南同学为了验证铁、铜、银的金属活动性顺序,设计了如下实验方案:①将大小一样的铁片和铜片分别插入到溶质质量分数相同的稀盐酸中;②将铜片插入到硝酸银溶液中.根据实验①②可以判断出金属活动性强弱顺序.根据实验①的现象可以得出的结论是 ______;判断铜的活动性比银强的现象是 ______,反应的化学方程式为 ______.
 lonlatlee1年前1
lonlatlee1年前1 -
 yaohouyu 共回答了23个问题
yaohouyu 共回答了23个问题 |采纳率87%解题思路:在金属活动性顺序中,氢前的金属能与酸发生置换反应,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.铁可以与盐酸反应生成氢气,说明铁在氢前,而铜不能与盐酸反应生成氢气,说明铜在氢后,铜与硝酸银溶液反应生成银和硝酸铜,硝酸铜溶液为蓝色,所以本题答案为:铁的金属活动性比铜强,铜片上覆盖一层银白色固体物质,溶液由无色变为蓝色,Cu+2AgNO3=2Ag+Cu(NO3)2.
点评:
本题考点: 金属活动性顺序及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- (2011•南岗区一模)张南同学为了验证Na2CO3溶液中的碳酸根离子,做了如下实验.操作如下:①向一支试管中加入约3m
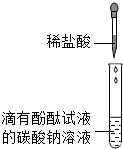 (2011•南岗区一模)张南同学为了验证Na2CO3溶液中的碳酸根离子,做了如下实验.操作如下:①向一支试管中加入约3mL的Na2CO3溶液,并滴入2滴酚酞试液,振荡试管,溶液呈均匀的红色;②再向此试管中逐滴加入稀盐酸,边滴加边振荡,至溶液颜色由红色恰好变为无色.
(2011•南岗区一模)张南同学为了验证Na2CO3溶液中的碳酸根离子,做了如下实验.操作如下:①向一支试管中加入约3mL的Na2CO3溶液,并滴入2滴酚酞试液,振荡试管,溶液呈均匀的红色;②再向此试管中逐滴加入稀盐酸,边滴加边振荡,至溶液颜色由红色恰好变为无色.
[提出问题]为什么向Na2CO3溶液中滴加稀盐酸不产生气泡?
[猜想与假设](提示:试剂没有问题)
①Na2CO3溶液和稀盐酸没有发生化学反应.
②Na2CO3溶液和稀盐酸发生化学反应生成的二氧化碳溶于水.
③Na2CO3溶液和稀盐酸发生化学反应生成的产物中没有二氧化碳.
[搜集资料]①此Na2CO3溶液的pH约为11,NaHCO3溶液的pH约为8;
②NaHCO3在水溶液中受热不分解;
③酚酞试液在,pH≥10时的溶液为红色,在pH≤8.2时溶液为无色;
[设计方案及实验]根据已学知识,经过讨论大家首先否定了猜想①,其理由是______.
对方案②和③进行研究,决定进行如下实验,首先把上述反应后的溶液分装成3支试管.请完成下列探究活动.
[解释与结论]张南同学开始时的实验,即向Na2CO3溶液中滴加稀盐酸没有看到气泡的原因是(用化学方程式表示)______.编号 方案 实验步骤 现象 实验结论 猜想
②利用CO2的溶解度受温度的升高而溶解度降低,给试管加热,用石灰水检验产生的气体. 取其中的1支试管,在酒精灯上加热,再将产生的气体通入石灰水中 石灰水没有变白色浑浊 猜想②
不成立猜想
③加入盐酸的量不足,继续加盐酸. 再取其中的另1支试管,再继续滴加稀盐酸.
______猜想③
成立
[反思与应用](1)归纳总结,有些化学反应产物的种类与______有关.
(2)在不另取其他试剂的情况下,能够鉴别Na2CO3溶液和稀盐酸两种溶液吗?______(填“能或”“不能”),其理由是______. luoluoivy1年前1
luoluoivy1年前1 -
 芭比QQQQQQQ 共回答了24个问题
芭比QQQQQQQ 共回答了24个问题 |采纳率83.3%解题思路:[设计方案及实验]根据实验现象“向此试管中逐滴加入稀盐酸,边滴加边振荡,至溶液颜色由红色恰好变为无色”进行分析;
[解释与结论]当盐酸少量时碳酸钠和稀盐酸反应生成了碳酸氢钠和氯化钠;
[反思与应用](1)当盐酸少量时碳酸钠和稀盐酸反应生成了碳酸氢钠和氯化钠;当盐酸过量时生成氯化钠、水和二氧化碳,因此有些化学反应产物的种类与某一种反应物的质量的多少有关;
(2)取一种试剂少许向另一种试剂里滴加,若一开始就产生气泡,说明滴加的是碳酸钠溶液,另一种就是稀盐酸;若一开始不产生气泡,说明滴加的是稀盐酸,另一种是碳酸钠溶液.[设计方案及实验]根据实验现象“向此试管中逐滴加入稀盐酸,边滴加边振荡,至溶液颜色由红色恰好变为无色”可知Na2CO3溶液和稀盐酸发生了化学反应;
故答案为:溶液颜色由红色恰好变为无色;
[解释与结论]向Na2CO3溶液中滴加稀盐酸没有看到气泡的原因是碳酸钠和稀盐酸反应生成了碳酸氢钠和氯化钠,该反应的化学方程式是Na2CO3+HCl=NaHCO3+NaCl;
故答案为:Na2CO3+HCl=NaHCO3+NaCl;
[反思与应用](1)当盐酸少量时碳酸钠和稀盐酸反应生成了碳酸氢钠和氯化钠;当盐酸过量时生成氯化钠、水和二氧化碳,因此有些化学反应产物的种类与某一种反应物的质量的多少有关;
故答案为:某一种反应物的质量的多少;
(2)取一种试剂少许向另一种试剂里滴加,若一开始就产生气泡,说明滴加的是碳酸钠溶液,另一种就是稀盐酸;若一开始不产生气泡,说明滴加的是稀盐酸,另一种是碳酸钠溶液;
故答案为:能;取一种试剂少许向另一种试剂里滴加,若一开始就产生气泡,说明滴加的是碳酸钠溶液,另一种就是稀盐酸;若一开始不产生气泡,说明滴加的是稀盐酸,另一种是碳酸钠溶液.点评:
本题考点: 证明碳酸盐;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题是一道探究题,主要考查物质的性质和化学方程式的书写等方面的知识,书写化学方程式时要注意遵循质量守恒定律.1年前查看全部
- 张南同学向含有稀盐酸和氯化铁的溶液中加入一定量的氢氧化钠溶液.现对所得的溶液中溶质的组成成分进行探究.(假设FeCl3溶
张南同学向含有稀盐酸和氯化铁的溶液中加入一定量的氢氧化钠溶液.现对所得的溶液中溶质的组成成分进行探究.(假设FeCl3溶液的酸碱性为中性)
[提出问题]该溶液中含有哪些溶质呢?
[猜想与假设]
甲同学猜想:溶液中含有NaCl、FeCl3两种溶质;
乙同学猜想:溶液中含有NaCl、HCl两种溶质;
[表达与交流]甲同学猜想的理由是(1)______;
[反思与评价]请对乙同学的猜想做出评价(2)______;
甲同学为了验证自己的猜想,取少量该有色溶液于试管中,滴入酚酞试液,结果没有看到明显现象,认为自己的猜想一定正确.请对甲同学的实验设计做出评价(3)______;
[解释与结论]若通过实验证明甲同学的猜想是错误的,则有色溶液中溶质的化学式应该是(4)______.
[归纳与总结]在分析化学反应后溶液中溶质成分时,除需要考虑的生成物和剩余的反应物以外,还应考虑(5)______. 极品蓝山1年前1
极品蓝山1年前1 -
 穿梭客 共回答了12个问题
穿梭客 共回答了12个问题 |采纳率83.3%解题思路:表达与交流](1)根据氢氧化钠和盐酸发生中和反应时无明显现象进行分析;【反思与评价】(2)氢氧化钠和盐酸发生中和反应生成氯化钠进行分析;(3)盐酸有剩余不能使酚酞试液变色;【计划与实验】根据氢氧化钠和硫酸铜会生成氢氧化铜沉淀进行分析;【解释与结论】根据甲同学出现的现象进行分析;[归纳与总结]根据反应后的溶质的种类进行分析.[表达与交流]
(1)氢氧化钠和盐酸反应生成氯化钠和水,甲同学的猜想理由是氢氧化钠和跟稀盐酸恰好反应,生成氯化钠;
[反思与评价]
(2)盐酸应先跟氢氧化钠反应,后与氯化铁反应,如果HCl有剩余,说明氢氧化钠被完全消耗,溶液中溶质应该有FeCl3,故乙同学的猜想不正确;
(3)从反应的物质的量的角度考虑,若盐酸有剩余则会含有氯化钠和氯化氢,滴入,结果也看不到明显现象,故答甲同学设计不完整,此现象只能说明没有氢氧化钠钠不能证明盐酸(HCl)是否存在;
[解释与结论]
(4)有色溶液中溶质的化学式应该是FeCl3
[归纳与总结]
(5)在分析化学反应后溶液中溶质成分时,除需要考虑的生成物和剩余的反应物以外,还应考虑溶液的颜色.
答案:
[表达与交流]
(1)氢氧化钠和跟稀盐酸恰好反应,生成氯化钠
(2)盐酸应先跟氢氧化钠反应,后与氯化铁反应,如果HCl有剩余,说明氢氧化钠被完全消耗,溶液中溶质应该有FeCl3,故乙同学的猜想不正确;
(3)从反应的物质的量的角度考虑,若盐酸有剩余则会含有氯化钠和氯化氢,滴入酚酞试液,结果也看不到明显现象,故答甲同学设计不完整,此现象只能说明没有氢氧化钠钠不能证明盐酸(HCl)是否存在;
(4)FeCl3
(5)溶液的颜色点评:
本题考点: 实验探究物质的组成成分以及含量;酸碱指示剂及其性质;碱的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.本题对探究实验分步进行了考查,必须全面分析实验中物质的反应情况,关键看谁有剩余.1年前查看全部
- (2013•南岗区一模)张南同学为了验证铝、铜、银的金属活动性顺序,设计了如下实验方案:将铝丝、银丝分别插入到硝酸铜溶液
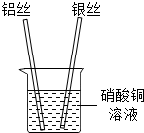 (2013•南岗区一模)张南同学为了验证铝、铜、银的金属活动性顺序,设计了如下实验方案:将铝丝、银丝分别插入到硝酸铜溶液中,如图,根据实验现象可以判断出三种金属的金属活动性强弱顺序.请回答下列问题.
(2013•南岗区一模)张南同学为了验证铝、铜、银的金属活动性顺序,设计了如下实验方案:将铝丝、银丝分别插入到硝酸铜溶液中,如图,根据实验现象可以判断出三种金属的金属活动性强弱顺序.请回答下列问题.
(1)判断铝的活动性比铜强的现象是______;若没有观察到预期现象,其原因是______(不考虑硝酸铜溶液).
(2)上述实验中发生反应的化学方程式为______;由此实验得出三种金属的活动性顺序为______. NICOLE_MAOMAO1年前1
NICOLE_MAOMAO1年前1 -
 mitchboy 共回答了19个问题
mitchboy 共回答了19个问题 |采纳率89.5%解题思路:根据在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来分析现象及结论.(1)铝的活动性比铜强,因此会置换出硫酸铜中的铜,现象为:铝的表面附着一层红色的固体;若铝没有除锈,表面有一层致密的保护膜,就不会和硫酸铜发生反应,因此观察不到预期现象;
(2)铝与硝酸铜反应生成硝酸铝和铜,反应的化学方程式为:2Al+3Cu(NO3)2=2Al(NO3)3+3Cu;由于在银的表面不会出现一层红色的固体,说明银的活动性比铜弱,因此三种金属的活动性顺序为:铝>铜>银;
故答案为:(1)铝的表面附着一层红色的固体;铝没有除锈,表面有一层致密的保护膜;(2)2Al+3Cu(NO3)2=2Al(NO3)3+3Cu;铝>铜>银.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行分析,还要注意化学方程式的书写.1年前查看全部
- 张南同学用紫甘蓝浸出液做实验,观察紫甘蓝浸出液在不同酸碱度下所显示的颜色,记录如下: pH 1 2~3 4~6 7~9
张南同学用紫甘蓝浸出液做实验,观察紫甘蓝浸出液在不同酸碱度下所显示的颜色,记录如下:
下列物质中,能使紫甘蓝汁液变红色的是( )pH 1 2~3 4~6 7~9 10 11 12~14 颜色 深红 紫红 浅紫 蓝 绿 黄绿 黄 A.纯碱溶液 B.食盐水 C.食用醋 D.牛奶  jafaa1年前1
jafaa1年前1 -
 蛋蛋9527 共回答了27个问题
蛋蛋9527 共回答了27个问题 |采纳率96.3%A、纯碱溶液显碱性,故A错误.
B、食盐水显中性,故B错误.
C、食用醋显酸性,故C正确.
D、牛奶为中性,故D错误.
故选C.1年前查看全部
大家在问
- 1居民的投资理财方式是多种多样,下列属于针对风险本身的投资行为的是
- 2“风吹”后面可以跟什么词?如风吹草动 风吹雪舞 风吹云散 .
- 3如图,▱ABCD中,对角线AC,BD相交于O点,AE⊥BD于E,CF⊥BD于F,BG⊥AG于G,DH⊥AC于H.求证:四
- 4如图所示,亮亮书上的三角形被墨迹污染了一部分,很快他就根据所学知识画出一个与书上完全一样的三角形,那么这两个三角形完全一
- 5Lingling and Jane are both good at dancing. Who dances
- 6附加题:编一道可化为一元一次方程的分式方程的应用题,并解答.编题要求:
- 7Becky lives a(n) ( )life in small town ,because she has no (
- 8先化简,再求值:4x的二次方y-【6xy-2(4xy-2)-x的二次方y】+1,其中x=-二分之一,y=1(要过程)
- 9把2.3g钠投入足量水中,充分反应后所得溶液用水稀释至100mL.求:
- 10求英文的简短的《达芬奇密码》的英文故事介绍
- 11THE CHILDREN WENT SWIMMING LAST SUNDY 改为一般疑问句并做肯定回答
- 12关于中考数学的解题规范问题(老师或高手请进)
- 13(2011•巴彦淖尔)分别向两杯蒸馏水中加入冰块和蔗糖,得到冰水和糖水,从化学组成上分析,它们分别属于( )
- 14(2014•威海一模)如图表示细胞呼吸作用的过程,其中1~3代表有关生理过程发生的场所,甲、乙代表有关物质.下列相关叙述
- 15一块橡皮泥把它捏成小正方体棱长3CM现在又把这块橡皮泥捏成一个搞9CM的圆柱 这个圆柱的底面积是多少平方厘