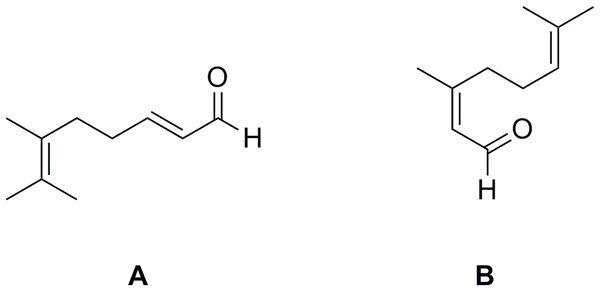
09年高中化学竞赛省赛题目第七题
 winneyliu2022-10-04 11:39:543条回答
winneyliu2022-10-04 11:39:543条回答
09年高中化学竞赛省赛题目第七题
此结构为什么无芳香性啊,
华东师大二附中的施华在在他的书你面说有啊

此结构为什么无芳香性啊,
华东师大二附中的施华在在他的书你面说有啊


已提交,审核后显示!提交回复
共3条回复
 crazywing 共回答了17个问题
crazywing 共回答了17个问题 |采纳率82.4%- 芳香烃不一定都含有苯环.对非芳香烃预见分子芳香性的重要规则是休克尔规则.规则表明,对完全共轭的、单环的、平面多烯来说,具有(4n+2)个 π电子(这里n是大于或等于零的整数)的分子,可能具有特殊芳香稳定性.
随着磁共振实验方法的出现,对决定一化合物是否具有芳香性起了重要的作用,并对芳香性的本质有了进一步的了解.
因此芳香性更广泛的含义为:分子必须是共平面的封闭共轭体系;键发生了平均化;体系较稳定(有较大的共振能);从实验看,易发生环上的亲电取代反应,不易发生加成反应;在磁场中,能产生感磁环流;从微观上看,π电子数符合4n+2规则. - 1年前
 306佩 共回答了1个问题
306佩 共回答了1个问题 |采纳率- 芳香烃不一定都含有苯环。对非芳香烃预见分子芳香性的重要规则是休克尔规则。规则表明,对完全共轭的、单环的、平面多烯来说,具有(4n+2)个 π电子(这里n是大于或等于零的整数)的分子,可能具有特殊芳香稳定性。
因此芳香性更广泛的含义为:分子必须是共平面的封闭共轭体系;键发生了平均化;体系较稳定(有较大的共振能);从实验看,易发生环上的亲电取代反应,不易发生加成反应;... - 1年前
 fei80868 共回答了26个问题
fei80868 共回答了26个问题 |采纳率96.2%- 4n+2)个 π电子
- 1年前
相关推荐
- 高中化学竞赛有那些注意点?顺便请推荐一些书籍.自学的.有过经验的请指教!
 yzlming1年前1
yzlming1年前1 -
 网络阿鸿 共回答了17个问题
网络阿鸿 共回答了17个问题 |采纳率82.4%多读课本,竞赛题的知识大都来自课本,多做习题,找解题技巧和解题感觉,
多看课外书,大学一年级的课本可以看看1年前查看全部
- 吉尔多肽杯2012年高中化学竞赛模拟试题答案 化学与可持续发展 2011年12期 要8张的,
 liuyanlei0281年前1
liuyanlei0281年前1 -
 小妞ル 共回答了21个问题
小妞ル 共回答了21个问题 |采纳率100%1单选BCBAD AACBD AACAD ABBCC CDBCA BDDAC
多选C C A B C D B D CD C AC D AC B B B B C BD B D B C C CD C AC D C CD
2单选DBCCD BDCBC BABDA DCCAC DCACC DADCC
多选D B AC A C BD AC D A AB A D A AC BC A D A A AB BD D D D B BD CD C BD A
3单选BBDCA CDBBB DDCBA CACDC BBBCC CDBAA
多选D CD B BC B C C C AD C AB D BD A C D B C D BC C BC AD C AC D CD C A B
4单选ABBCA DBBCC ABDAB DBABA DCDDC ACABB
多选CD B AD A C AB A C AD BC AD AD B D A CD C BC A AC D D A D AD AB BD BD A CD
5单选DADBB DBBCB DCACA DBDAC AACBD DDDDD
多选C B D C D BD A AD A A AB C B AC AC B A BD C B AC D C A AC CD A C BD AD
6单选CBBCD DCCDC ADBCD DDBDD CDCCB BABCC
多选BC BD B C BD B B B C B CD AD B AC C AC CD B D A D D A D A C BD AC D C
7单选DABDD AACCD CDCCB CBCBD BBBCA DADDD
多选B B BC BC B C A CD CD A AD AD AB A AC BD B C AD B AD AD A AC AC D AC A AC C
8单选ACCDC DAACC BBADD CDCCB BBDDD CCCAC
多选CD BD A A BD B AD AD A D D A B A D AC B AD A C D D C C BD A C D A A1年前查看全部
- 高中化学竞赛的物理化学部分基础很薄弱要看什么书?
高中化学竞赛的物理化学部分基础很薄弱要看什么书?
物化基础很薄弱,如果想快些提高要看什么书?南大傅献彩的物理化学如何?我看很多物化的书都有看不懂的数学符号,那如果涉及高数要怎么办? nkzx1201年前2
nkzx1201年前2 -
 LTSJ520 共回答了16个问题
LTSJ520 共回答了16个问题 |采纳率87.5%把教科书多看几遍!1年前查看全部
- 2009广州市高中化学竞赛详解第七题
 wbw07101年前1
wbw07101年前1 -
 fydw_715 共回答了18个问题
fydw_715 共回答了18个问题 |采纳率83.3%D;
这里就是开始不一定达到了平衡;
考虑SO2还没有完全转化;
A:可能改变温度使得开始的不平衡后来变成平衡了;因为K不同;
B:要是开始平衡了,改变温度,肯定上升;
C:要是没有平衡,而且差很多,那么,SO2会转化;
D:不可能,后面没有条件的改变,不会有SO2下降上升这种情况;1年前查看全部
- 高中化学竞赛考前辅导题目难度知识讲解与例题分析怎样如果不好请推荐几本高中数学竞赛用书
 kkkq101年前4
kkkq101年前4 -
 奶油猪猪 共回答了18个问题
奶油猪猪 共回答了18个问题 |采纳率94.4%竞赛好不.楼上还后熊.
竞赛题目比如林肃浩编的金版奥赛化学教程
当然 参加国初的看 得看无机化学和基础有机化学.1年前查看全部
- 高中化学竞赛结构题原子簇化学是当前化学中最饶有兴趣而又极其活跃的领域之一.当前比较全面的定义是由徐光宪、江元生等人提出的
高中化学竞赛结构题
原子簇化学是当前化学中最饶有兴趣而又极其活跃的领域之一.当前比较全面的定义是由徐光宪、江元生等人提出的:凡以3个或3个以上原子直接键合构成的多面体或笼为核心,连接外围原子或基团而形成的结构单元称原子簇.分子式为CnHn的多面体碳烷是典型的主族簇合物,下面是已经报道的碳烷多面体,请归纳总键数为[(3n/2)+n]=5n/2 ;若多面体边数为l,则总键数用n和l表示为多少(4n-l)
请问总键数怎么求出来的那两个答案 fnaqiuyi1年前4
fnaqiuyi1年前4 -
 lyc_1 共回答了14个问题
lyc_1 共回答了14个问题 |采纳率100%1、总键数:现就一CnHn为例 CnHn中的某一个C原子有4个键 H原子一个键,C原子的一个键是必须跟H原子链接,可知此碳原子有一个碳-氢键;C原子的其他三个键是跟其他碳原子链接,此碳原子只有3/2个碳-碳键.CnHn中有n个此类碳原子 所以就有(1+3/2)n个键即5n/2个键.
2、CnHn中的键都是有碳与碳、碳与氢构成的,每个碳原子都有4根键其中三根键是与其他碳共有的,另一根是碳与氢的;多面体边数L其实就是指的碳跟碳之间的键,CnHn中含有n个C原子,碳原子就有4n个键,其中4n个键中重复计算了碳跟碳之间的键,去除碳跟碳之间的键L ,所以CnHn中含有总键数为4n-L1年前查看全部
- 河北省2013高中化学竞赛初赛试题答案拜托了各位 谢谢
 ScriptSafe1年前1
ScriptSafe1年前1 -
 承诺之初 共回答了24个问题
承诺之初 共回答了24个问题 |采纳率100%AABBA ADDBC BCB 多选AC C A D BD BC AC BD1年前查看全部
- 怎么直观判断原子杂化轨道同题啊···我是高中化学竞赛有什么办法可以直观的来看··一眼就能看过来的?而且根据判断杂化轨道能
怎么直观判断原子杂化轨道
同题啊···我是高中化学竞赛
有什么办法可以直观的来看··一眼就能看过来的?而且根据判断杂化轨道能怎么样?
尽量自己写,就是复制也闹点对题的··谢谢 wbm3441607381年前2
wbm3441607381年前2 -
 fengye_wy 共回答了18个问题
fengye_wy 共回答了18个问题 |采纳率88.9%首先你要能分辨出那个是中心原子,然后根据中心原子核外电子的排布情况以及周边原子的电子云情况确定它的杂化类型.比较复杂的排布就是以碳为中心原子的排布,你要牢记,烷烃碳(一个键的碳)是sp3杂化,烯烃(双键的碳)sp2,炔烃(三键的碳)sp.此外二氧化碳是直线型sp杂化,水是不等性sp3杂化.其实中学竞赛跑不出这三种类型,sp3空间四面体型;sp2三角形;sp直线型;不等性sp3 V字性的水 和 三角锥的氨气 别的三角双锥dsp3 正八面体d2sp3 sp3d2 正方形dsp2 估计你用不上. 根据杂化轨道最基本的是可以知道分子的结构,以及推测它的一些基本性质,比如说 你了解干冰的结构是直线型的非极性分子,那么你就能解释为什么微波炉不能加热干冰了.看看我的回答是否满意,如果还有不明白可以和我联系.1年前查看全部
- 高中化学竞赛需要掌握哪些常用公式定理或是计算方法?
高中化学竞赛需要掌握哪些常用公式定理或是计算方法?
除了克拉伯龙(不带修正值),分压分体积,体积功,扩散定律,clausius-clapeyron方程,亨利定律,raoult定律,渗透压定律,单组分相图,吉布斯-亥姆霍兹方程,等温式,能斯特方程,Arrhenius方程,Boltzmann方程,热一热二,晶体密度计算公式,吉布斯吸附公式,一二级反应计算,微积分基本定理,几种电负性计算,中和当量 menghuanlili1年前1
menghuanlili1年前1 -
 binday 共回答了21个问题
binday 共回答了21个问题 |采纳率85.7%高中无机化学,晶体化学,北京大学出版的,全有记录.例如马氏规则,分压分体积,体积功,扩散定律,clausius-clapeyron方程,亨利定律,raoult定律,渗透压定律,单组分相图,吉布斯-亥姆霍兹方程,路易斯酸碱理论,质子理论1年前查看全部
- 高中化学竞赛有机各类反应条件总结
高中化学竞赛有机各类反应条件总结
例如臭氧化水解,(O3/Zn,H2O);烯烃在B3H3,H2O2,OH-条件下加成;炔烃在HgSO4,H2SO4/H2O条件下的反应规律总结下,马上比赛了, 狂呼吸1年前2
狂呼吸1年前2 -
 yuspecial 共回答了18个问题
yuspecial 共回答了18个问题 |采纳率88.9%1)臭氧化水解,(O3/Zn,H2O)主要是氧化烯烃,双键断裂生成醛或酮,若是酸性高锰酸钾则生成羧酸
2)烯烃在B3H3,H2O2,OH-条件下是反马氏规则的顺势加成
3)炔烃在HgSO4,H2SO4/H2O 是炔烃的水合,就是和水加成生成烯醇,可重排为醛或酮
我想不起来什么反应,你可以多说几个反应条件,我给你说一下怎么反应的1年前查看全部
- 高中化学竞赛有机化学部分不稳定的结构
高中化学竞赛有机化学部分不稳定的结构
列全一点. forever41年前2
forever41年前2 -
 张胖 共回答了16个问题
张胖 共回答了16个问题 |采纳率87.5%1、烯醇式 2、C上有两个-OH 3、C+或C-离子 4、C上有一个卤素和一个-OH 5、重氮盐 等是不能稳定存在的 三、四元环 β为上有吸电子基的羧酸 β羟基醛/酮(羟醛缩合中产物,脂肪族醛/酮可停留在这一步) 等可以稳定存在,但活性较高,容易发生反应(开环、脱羧、脱水)1年前查看全部
- 吉尔多肽杯高中化学竞赛模拟试题. 吉尔多肽杯2012年江苏省化学与可...
吉尔多肽杯高中化学竞赛模拟试题. 吉尔多肽杯2012年江苏省化学与可...
吉尔多肽杯高中化学竞赛模拟试题. 吉尔多肽杯2012年江苏省化学与可持续发展化学活动周 高中化学竞赛模拟试题答案
第一句话是试卷页边上的小标题,后面的是试卷大标题,应该共六份,每份都是六十道选择题 回答得好一定加分 mmddqidao1年前3
mmddqidao1年前3 -
 柳大山 共回答了16个问题
柳大山 共回答了16个问题 |采纳率81.3%你是第几期的啊?我只有第12期的~
话说有八张~1年前查看全部
- 哥哥,我想参加高中化学竞赛但是我不知道买什么教辅书,
 Monday19841年前1
Monday19841年前1 -
 selen 共回答了13个问题
selen 共回答了13个问题 |采纳率100%1.教辅:浙江大学出版的金版奥赛化学教程,共三册,第一是预赛的,讲的内容和高中相似,第二是分章节讲竞赛知识点,第三是综合分册,建议先把高中基础打稳,看看第一册(觉得简单就直接看第二册),然后以第二册为主线,结合大学教材作参考进行系统学习,最后几个月用第三册和真题冲刺
2.大学教材参考:两本无机(武汉大学出版的),两本有机(注重理解机理、邢大本),物化不建议(无机上册的相关知识已足够),结构化学(只看有关晶胞的,用到高数的不用看),分析不用看(竞赛分析题考的是对多过程反应的数据处理,如多过程滴定求某物质量浓度,而不是高等化学的分析方法)1年前查看全部
- 2006年湖北省高中化学竞赛初赛试题24题求解
 鈈酷1年前1
鈈酷1年前1 -
 fenny6 共回答了18个问题
fenny6 共回答了18个问题 |采纳率88.9%结构简式、方程式好难写呀.A是一个环状的结构,有一个双键,双键所连接的两个碳原子,其中一个连接一个氯原子.生成的B是,双键断裂,变成链状——形成两个碳氧双键,一个是碳原子上连接一个氢原子,即醛基,另一个是碳原子上连接一个氯原子,即酰氯.酰氯水解形成羧酸.就是说这个链状分子一端是醛基,一端是羧基.C就是醛基加氢生成醇.一端是羧基,一端是醇羟基.分子内酯化形成E,环状.分子间酯化形成D(缩聚).1年前查看全部
- 【化学】几道高中化学竞赛的题目 请高手解答
【化学】几道高中化学竞赛的题目 请高手解答
请高手解答 1.硫酸根离子中的硫氧键的键长是149pm,比硫氧单键短,请说明原因.
2.三甲基胺是锥形结构,碱性强.三甲基硅烷胺是平面结构,碱性弱.试解释原因.
请尽量说详细点,万分感谢! 隐当绿晦如蓝1年前2
隐当绿晦如蓝1年前2 -
 北堂鳴風 共回答了14个问题
北堂鳴風 共回答了14个问题 |采纳率100%1.硫氧键除了σ键外还存在d-p反馈π键(硫提供d轨道和氧提供p轨道电子对),使硫氧键更接近双键.
也可以用共振式解释,每个硫氧键都分别有3个单键和3个双键的形式的共振式,所以硫氧键介于硫氧单键和硫氧双键之间
2.三甲胺中甲基有推电子效应,并且本身氮电负性高,电子云比较密集,碳也没有d轨道进行离域,所以氮的孤对电子电子云比较密集容易给出,体现较强碱性
三硅甲基烷胺中,氮的电子部分填入硅的d轨道,存在d-p反馈π键,并且是在氮的p轨道和三个硅的d轨道上的离域键,所以呈现平面构型,氮的电子被分散,电子云不密集,碱性变弱1年前查看全部
- 吉尔多肽杯2012年江苏省化学与可持续发展化学活动周 高中化学竞赛模拟试题答案[2011下半月刊12期]
吉尔多肽杯2012年江苏省化学与可持续发展化学活动周 高中化学竞赛模拟试题答案[2011下半月刊12期]
答案能不能发给我~谢谢~ a2634397731年前2
a2634397731年前2 -
 3seaweed 共回答了10个问题
3seaweed 共回答了10个问题 |采纳率100%我知道前7份的 我们讲过了第二份DBCCD BDCBC BABDA DCCAC DCACC DADCC31-40 D B AC A C BD AC D A AB41-50 A D A AC D A D A A AB51-60 B D...1年前查看全部
- 请推荐几本高中化学竞赛的习题书——要高质量的
 孤芳自赏011年前1
孤芳自赏011年前1 -
 deven86 共回答了14个问题
deven86 共回答了14个问题 |采纳率78.6%《结构化学基础》2ed(现在出第三版了).周公度 段连运 北京大学出版社(重在理解) 《立体化学》叶秀林 北京大学出版社(没事儿时看看吧,介绍的化学史挺有意思的)
《有机化学》 胡宏纹 高教 (入门的,推荐) 《基础有机化学》邢其毅 周政 裴伟伟 徐瑞秋 2ed.高等教育出版社(邢先生的书,好!全!想在有机上无敌就靠它了)
《基础有机化学习题解答与解题示例》(对应邢先生的书)
《普通无机化学》2ed.严宣申 王长富 北京大学出版社 (很重视热力学循环,元素类的.推荐听严先生的课)
《普通化学原理》2ed.北京大学出版社 (原理嘛,不学后面就不会了)1年前查看全部
- 高中化学竞赛原子结构的题...1.设一个电子脱离金属钠表面所需的能量为1.8eV,问需何种波长的光照射才能产生光电流,照
高中化学竞赛原子结构的题...
1.设一个电子脱离金属钠表面所需的能量为1.8eV,问需何种波长的光照射才能产生光电流,照射光子的质量和动量分别为多少?
2.1个100W的钠蒸气灯,发射波长为590.0nm的黄光,计算每秒发射的光子数 snoyc1年前1
snoyc1年前1 -
 wwjjzz0618 共回答了11个问题
wwjjzz0618 共回答了11个问题 |采纳率81.8%1、根据光电效应原理,知E=hv.E是能量,h是普朗克常数,v是频率
1eV=1.6*10^(-19)J (^(-19)是负19次方的意思,以下同),普朗克常数h=6.626×10^(34)J·s
所以光子的频率v=E/h=1.8*1.6*10^(-19)/6.626×10^(-34)=4.35*10^14Hz
波长、速度、频率三者之间的关系式为λ=c/v,λ是波长,c是光速,即3*10^8m/s,v是频率
所以需要光的波长λ=3*10^8/4.35*10^14=6.897*10^(-7)m,因为1m=10^9nm,所以λ=6.897*10^(-7)*10^9=689.7nm
根据爱因斯坦的质能方程式E=mc^2,可以求得光子的质量m=E/c^2=1.8*1.6*10^(-19)/(3*10^8)^2=3.2*10^(-36)kg
动量P=mc=3.2*10^(-36)*3*10^8=9.6*10^(-28)kg.m/s
2、一个光子的能量E=hv=hc/λ=6.626×10^(-34)*3*10^8/(590*10^(-9))=3.37*10^(-19)J
而钠蒸气灯每秒发出的能量E'=Pt=100*1=100J
所以光子的数量N=E'/E=100/3.37*10^(-19)=2.97*10^20
因为有效数字没有认真取舍,所以与标准答案可能会有出入,但是数量级肯定是没有问题的1年前查看全部
- 想在高中化学竞赛中取得很好的成绩,是不是在高一就得学完高中所有知识啊?还需要做些什么?请搞过化竞...
想在高中化学竞赛中取得很好的成绩,是不是在高一就得学完高中所有知识啊?还需要做些什么?请搞过化竞...
想在高中化学竞赛中取得很好的成绩,是不是在高一就得学完高中所有知识啊?还需要做些什么?请搞过化竞的前辈们赐教 启超梁1年前1
启超梁1年前1 -
 认真过一生 共回答了17个问题
认真过一生 共回答了17个问题 |采纳率100%看你竞赛是什么级别的.
如果是省级别的,那就如你所说,基本高中的知识要学完,一般高一没有这个能力去考
如果是市级别的,只要把这几年的题目拿来看,仔细弄懂每一题,加点延伸(比如说解题方法),获奖不是问题1年前查看全部
- 我想了解一下近年来四川高中化学竞赛的情况.
我想了解一下近年来四川高中化学竞赛的情况.
比如参赛规模、人数、获奖情况等
〔越详细越好〕 geraint5211年前1
geraint5211年前1 -
 白月牙儿 共回答了17个问题
白月牙儿 共回答了17个问题 |采纳率94.1%我也是四川的
也要参加今年的竞赛
今年一等奖5%
二等奖10%
三等奖15%
去年一等奖3% 81分
二等奖5% 71分
三等奖7% 多少分忘了1年前查看全部
- “冯茹尔”杯2011年江苏省“化学与可持续发展”化学活动周高中化学竞赛试题
 zw30031年前1
zw30031年前1 -
 cailingjue 共回答了10个问题
cailingjue 共回答了10个问题 |采纳率90%我的答案
CACDD-CDCCA-DCDDC-DBCBB-CBADC-BDAAD
D C D A AD CD A AC C A AB A BC BC A D A B AD C
C B D A D B C D CD D1年前查看全部
- 高中化学竞赛电极电势的应用Br2(aq)+2e ---> 2Br- ψ=+0.1087V,HBrO+ H+ +e ---
高中化学竞赛电极电势的应用
Br2(aq)+2e ---> 2Br- ψ=+0.1087V,
HBrO+ H+ +e --->0.5Br2(aq) + H2O ψ=+1.59V
HBrO --->H+ +BrO- Ka=2.4*10^-9
问,当pH等于3时,溴水中Br2的浓度(溶液的酸性由Br2与水反应而来)
还有,这种电极电势和化学平衡常数(K稳、Ksp、Ka Kb等等)夹杂在一起的化学题目怎么解题啊,有没有什么思路或解题模式,拿到这种题目就有点摸不着头脑的感觉…… holyliu2111年前3
holyliu2111年前3 -
 vipvipvip 共回答了17个问题
vipvipvip 共回答了17个问题 |采纳率88.2%可以由能特斯方程,假设Br2(aq)+2e ---> 2Br- ψ=+0.1087V 为标准的电极反应 说以ψ=+0.1087V 为其标准电极电动势.而HBrO+ H+ +e --->0.5Br2(aq) + H2O ψ=+1.59V
中的ψ=+1.59V 为非标准态的电极电动势.来进行计算.
能特斯方程 ψ = ψ(标准) — (0.059/z)lg(氧化型的浓度/还原型浓度)
在这里氧化型是Br2,还原型是H+ .
对于这一类问题,要从啊累尼乌斯,和能特斯方程.可以参考一下《无机化学》.1年前查看全部
- 2013山西省高中化学竞赛初赛试题
2013山西省高中化学竞赛初赛试题

就是第一题, pzasth111年前1
pzasth111年前1 -
 ten_hu 共回答了22个问题
ten_hu 共回答了22个问题 |采纳率86.4%D;
水不是营养物质;
有问题请追问~~1年前查看全部
- 冯茹尔杯2011年江苏省化学与可持续发展化学活动周高中化学竞赛试题答案(不要模拟卷)
 jacky8202121年前1
jacky8202121年前1 -
 fulekai 共回答了17个问题
fulekai 共回答了17个问题 |采纳率100%30:
C A C D D C D D C A
C C D D D B B C D D
B B A A C B B A B B
31~50:
CD C B B AD D AD D C AC
C A BC BC AC AD C A AD BC
51~60:
D B C B A BC BD AD CD D1年前查看全部
- 100分哦!纠结的化学推断题(高中化学竞赛)
100分哦!纠结的化学推断题(高中化学竞赛)
锌能与亚硫酸氢钠按照5:16的质量比反应得到二钠盐X和氢氧化锌.化合物X具有如下图所示的反应关系(图中所有未知物质都含有硫元素)
已知:物质A、B都是钠盐,C是有刺激性气味的无色气体;E是黑色固体,不溶于盐酸,但能溶于浓硝酸;F是淡黄色固体,能在空气中燃烧得到气体C.
写出X、A、B、C、D、E、F的化学式
 三度的冰1年前6
三度的冰1年前6 -
 水日凡 共回答了18个问题
水日凡 共回答了18个问题 |采纳率94.4%C SO2 E Ag2S B Na2S2O3 F S A Na2SO3
D Na3[Ag(S2O3)2]
X Na2S2O4
物质的量比Zn:NaHSO3 ===5/56 :16/104 ==1:2
Zn失去2个电子,2个NaHSO3得到 2个电子 即X 中S 为 +3价 即Na2S2O4
即 Zn +2NaHSO3 ==Na2S2O4 +Zn(OH)21年前查看全部
- 山东省高中化学竞赛预赛的分数线.
山东省高中化学竞赛预赛的分数线.
今年准备参加化学竞赛,不知道预赛考多少分能过?
要注意些什么?
希望有经验的学哥学姐告知下. 影月无心1年前1
影月无心1年前1 -
 一个人跳跳舞 共回答了23个问题
一个人跳跳舞 共回答了23个问题 |采纳率100%话说任何一个合格的高三学生都能过化学初赛(省级赛区不同,很难的,初赛就是看基础).你假如学完了高中化学,高考化学能过90分,不掺杂水分的话,过初赛是没问题的.建议看下五高三模之类的基础书,然后化学竞赛的技巧掌握一些大概都差不多了.加油1年前查看全部
- 请推荐一本高中化学竞赛的书,从最基础开始的.我以前没有学过,想在家里自己做做.本人现在高一.
请推荐一本高中化学竞赛的书,从最基础开始的.我以前没有学过,想在家里自己做做.本人现在高一.
里面是有教新的知识的那种,不要就是题目,那等于没买. lslinxm1年前1
lslinxm1年前1 -
 hope_in_tomorrow 共回答了15个问题
hope_in_tomorrow 共回答了15个问题 |采纳率73.3%1年前查看全部
- 高中化学竞赛中有机常见的反应用R表示烃基表示一类反应,越多越好,特别是在醛 酮 酯 酸的反应
 赢自己我能1年前2
赢自己我能1年前2 -
 gjet 共回答了16个问题
gjet 共回答了16个问题 |采纳率87.5%1年前查看全部
- 以干HCl催化的反应高中化学竞赛范围内除了羟醛缩合,还有哪些反应时需要干HCl催化的催化的机理是什么不用说的太复杂了谢谢
 zhengxuebin99051年前1
zhengxuebin99051年前1 -
 蚂蚁1983 共回答了17个问题
蚂蚁1983 共回答了17个问题 |采纳率88.2%同志……羟醛缩合是稀碱催化……干HCl催化一般是醛酮和醇的亲核加成反应,生成缩醛或缩酮.这两个反应其实一样,都是醛酮的亲核加成反应,只是亲核试剂不一样罢了.
羟醛缩合:首先是碱去结合醛酮的α-H,生成作为强亲核试剂的碳负离子;然后碳负离子进攻另一分子醛酮的羰基,加成上去,电荷转移,羰基O结合质子,最终形成β-羟基醛酮.有些生成物会自动脱水形成α,β-不饱和醛酮.
与醇加成:先是羰基O结合质子,电荷转移形成碳正离子;然后醇羟基O上的孤对电子进攻碳正离子,加成上去,脱去质子,形成半缩醛酮;接下来,半缩醛酮羟基继续结合质子并以H2O分子的形式离去,形成碳正离子,然后第二分子醇加成,脱去质子,形成缩醛酮.一般的半缩醛酮都不稳定,会最终生成缩醛酮,但是五碳、六碳的糖会在水溶液中自发形成稳定的半缩醛酮.1年前查看全部
- 谁有河北省2010年高中化学竞赛初赛试题的答案
谁有河北省2010年高中化学竞赛初赛试题的答案
急求,明天问题作废.
我已经考完了,明天我们开学。并不是想投机取巧,我考试从来没有做过弊,只是有很多题不会,网上找不到答案。这30分给你了,谢谢你的好心提醒,不过对我没用》 阿穷汉1年前1
阿穷汉1年前1 -
 gouchun123 共回答了16个问题
gouchun123 共回答了16个问题 |采纳率93.8%作为竞赛,这是不可能有的,有就要重赛了.别想这些投机取巧的发法,努力学习才是正道.1年前查看全部
- 冯茹尔杯2011年江苏省化学与可持续发展化学活动周高中化学竞赛模拟试题(二)
冯茹尔杯2011年江苏省化学与可持续发展化学活动周高中化学竞赛模拟试题(二)
只要1到32题的答案 残缺的天堂路1年前1
残缺的天堂路1年前1 -
 xwabcde 共回答了16个问题
xwabcde 共回答了16个问题 |采纳率87.5%参考答案
B
B
C
A
D
B
B
A
D
C
B
A
B
D
A
A
C
C
A
C
D
C
D
C
B
B
A
B
C
B
D
B
AC
BC
C
BD
B
D
A
AB
A
D
BD
C
BC
A
D
AD
A
AB
D
D
D
AD
B
BD
CD
C
BD
A1年前查看全部
- 给我看一下高中化学竞赛题好吗?
 我可以问你吗1年前1
我可以问你吗1年前1 -
 飞雪飘落 共回答了17个问题
飞雪飘落 共回答了17个问题 |采纳率94.1%某翠绿色单斜晶体A溶于水难溶于乙醇,对光敏感.下面是一条比较成熟的合成A的工艺路线,方法如下:①称取一定量的硫酸亚铁铵,在烧杯中用适量水溶解,并加适量稀硫酸将所得溶液酸化,再加入一定量的饱和草酸溶液,加热至沸腾,搅拌,析出黄色的草酸亚铁沉淀(FeC2O4•2H2O);②将草酸亚铁沉淀加入适量饱和K2C2O4溶液,在313K温度下逐滴加入适量3% H2O2,即得深棕色的草酸铁与氢氧化铁的混合沉淀;③将混合沉淀再加热至沸腾后立即停止加热,快速搅拌下逐滴加入一定量的饱和草酸溶液,然后加入一定量的95%乙醇,冰水中冷却即得翠绿色晶体A.为了推断A的结构,某同学称取1.000g纯净的A样品于烧杯中,加入足量硫酸溶液溶解,再转移至250mL容量瓶中,摇匀、定容.从容量瓶中移取25.00mL试液于锥形瓶中,用硫酸酸化后,水浴加热,用0.01000mol/L KMnO4溶液滴定至终点,用去24.42mL.在锥形瓶加入足量锌粉,充分反应后加硫酸溶液酸化,然后再用0.01000mol/L KMnO4溶液滴定至终点,用去4.07mL.
1、推断A的结构式.
2、已知A的配阴离子的磁矩为5.88.请回答:
(1)中心离子的杂化轨道类型是什么?
(2)配位原子是什么?
(3)中心离子的配位数是多少?
(4)配离子的空间构型是什么?
3、写出上述制备A的三步过程的化学方程式.1年前查看全部
- 有哪些比较好的和高中物理竞赛有关的微积分应用的书?在高中化学竞赛中有用得到微积分的题么?
 yyyy1年前1
yyyy1年前1 -
 wudongzhan 共回答了16个问题
wudongzhan 共回答了16个问题 |采纳率93.8%物理竞赛不了解 但是你可以看看《大学物理》,买上一本配套的辅导书,把书里面的习题做一做,不会的看一看辅导书.你要是想弄竞赛的话,牛顿力学部分的题(《大学物理》中)在物理知识上应该都能理解.我当初学的时候,大学物理里的物理题都是很好的应用题模版.1年前查看全部
- 吉尔多肽杯2012年高中化学竞赛模拟试题答案(2011年第12期,总第324期)
 ludainy1年前1
ludainy1年前1 -
 精灵E妹 共回答了24个问题
精灵E妹 共回答了24个问题 |采纳率91.7%第二份DBCCD BDCBC BABDA DCCAC DCACC DADCC
31-40 D B AC A C BD AC D A AB
41-50 A D A AC D A D A A AB
51-60 B D D D B BD CD C BD A1年前查看全部
- 一道高中化学竞赛推断题,关于烯烃和高锰酸钾氧化
一道高中化学竞赛推断题,关于烯烃和高锰酸钾氧化
A(C10H16O)与溴水反应褪色,有银镜反应,与酸性高锰酸钾生成丙酮和4-羰基戊酸各1mol,并有气体放出.答案不唯一,只要给我一种就行,不明白的是烯烃的氧化反应如何从产物推断烯烃?如何判断几mol双键生成几molco2或羧基、酮基?(老师当时还说会有乙二酸?丙酮?)
求A的结构简式 2497633251年前1
2497633251年前1 -
 ycyyxlfqm 共回答了13个问题
ycyyxlfqm 共回答了13个问题 |采纳率92.3%1年前查看全部
- 高中化学竞赛有机化学在有机合成中常见的一些官能团的保护和去保护方法.要有详细的例子和说明.最好能有反应方程式.
 alice_qin1年前2
alice_qin1年前2 -
 xtfby 共回答了20个问题
xtfby 共回答了20个问题 |采纳率95%1.易于被保护基团反应,且除被保护基团外不影响其他基团.
2.保护基团必须经受得起在保护阶段的各种反应条件.
3.保护基团易于除去.
化学合成中常用的保护基
碳氢键的保护
羟基的保护
氨基的保护
羰基的保护
羧基的保护
1. 碳氢键的保护
乙炔及末端炔烃中的炔氢较活泼,它可以与活泼金属`强碱`强氧化剂及有机金属化合物反应.
常用的炔氢保护基为三甲硅基.将炔烃转变为格氏试剂后同三甲基氯硅烷作用.即可引入三甲硅基.该保护基对于金属有机试剂`氧化剂很稳定.可在使用这类试剂的场合保护炔基.
2.羟基的保护
醚类
缩醛和缩酮类
酯类
羟基是一个活性基团,它能够分解格氏试剂和其他有机金属化合物,本身易被氧化,叔醇还容易脱水,并可以发生烃基化和酰基化反应.所以在进行某些反应时,若要保留烃基,就必须将它保护起来.
醇羟基常用的保护方法有3类:
2.1 转变成醚
甲醚
用生成甲醚的方法保护羟基是一个经典方法.通常使用硫酸二甲酯,在氢氧化钠或氢氧化钡存在下,在DMF或DMSO溶剂中反应得到.
优点:该保护基很容易引入,且对酸,碱,氧化剂和还原剂都很稳定.
缺点:难于脱保护,用氢卤酸回流脱保护基条件比较剧烈,常使分子遭到破坏,只有当分子中其他部位没有敏感基团时才适用.
2.1 转变成醚
叔丁醚
将醇的二氯甲烷溶液或悬浮液在 硫酸复合物存在下,在室温与过量的异丁烯作用,可得到叔丁醚.
优点:对碱及催化氢化是稳定的.
缺点:对酸敏感,其稳定性低于甲醚.由于脱保护基所用的酸性条件剧烈,当分子中存在对酸敏感的基团时不适用
2.1 转变成醚
三甲硅醚
三甲硅醚广泛用于保护糖类,甾类及其他醇羟基.通常引入三甲基硅基保护基所用的试剂有三甲基氯化硅和碱;六甲基二硅氨烷.在含水醇溶液中加热回流即可除去保护基.
优点:醇的三甲硅醚对催化氢化,氧化还原反应是稳定的,该保护基可在非常温和的条件下引入和去除.
缺点:对酸和碱敏感,只能在中性条件下使用.
2.2 转变成缩醛或缩酮
2,3-二氢-4H-吡喃在酸的催化作用下,与醇类起加成反应,生成四氢吡喃醚衍生物.这是最常用的醇羟基的保护方法之一.此保护基广泛用于炔醇,甾类及核苷酸的合成中.
2.3 转变成酯
醇与酰卤,酸酐作用生成羧酸酯;与氯甲酸作用生成碳酸酯.
所生成的酯在中性和酸性条件下比较稳定,因此可在硝化`氧化和形成酰氯时用成酯的方法保护羟基.保护基团可通过碱性水解除去,或在锌-铜的乙酸溶液中除去.
3.氨基的保护
伯胺和仲胺很容易被氧化,且易发生烃
基化,酰基化以及与醛酮羰基的亲核加成反
应.在合成中常采用:
(1)氨基质子化
(2)变为酰基衍生物
(3)变为烃基衍生物等方法将氨基保护起来
3.1 质子化
此方法仅用于防止氨基的氧化,因为理论上说
采用氨基质子化,即占据氮尚未共用电子对,以阻
止取代反应的放生.这是对氨基保护最简单的法.
3.2 转变为酰基衍生物
将氨基酰化转变成酰胺是保护氨常用的方法.通常伯胺酰基化已足以保护基,防止其被氧化和烃化反应的发生.常用的酰基化试剂为酰卤和酸酐.
保护基可在酸性和碱性条件下水解出去.
3.2 转变为酰基衍生物
邻苯二甲酸酐与伯胺所生成的邻苯二甲酰亚胺非常稳定,不受催化氢化碱性还原,醇解以及氯化氢,溴化氢,乙酸溶液的影响,也适用于保护伯胺.在酸性或碱性条件下水解或用肼解法脱去保护.
3.3 转变为烃基衍生物
用烃基保护氨基主要用三苯甲基或苯甲
基.
三苯甲基衍生物可用胺与溴或氯代三苯
甲烷在碱存在下制备.三苯甲基由于空间位
阻效应对氨基起到很好的保护作用,它对碱
是稳定的.
苯甲基衍生物用胺和氯化苯甲基在碱存
下制得.
4.羰基的保护
羰基具有许多反应性能,是有机化学中
最易发生反应的活性官能团之一.
保护羰基常用的方法:生成缩醛和缩酮
来降低羰基活性而保护羰基.
4.羰基的保护
保护醛酮羰基最常用的方法是通过乙二醇和2-疏基乙醇的反应,生成相应的叫做环缩醛或缩酮的产物.
5.羧基的保护
羰基通常用形成酯的方法保护.常见的有转变为甲酯,乙酯,叔丁酯,苯甲酯.
甲酯和乙酯可以用羧酸直接与甲醇或乙醇发生酯化反应制得,又可以被碱水解.
5.羧基的保护
叔丁酯可由羧酸先变为酰氯,再与叔丁醇作用,或者通过羧酸与异丁烯直接作用而得.它不能氢解,在通常条件下也不被氨解及碱催化水解.
5.羧基的保护
苯甲酯可由羧酸与苯甲基卤在碱性条件下反应而得.它除了可在强酸性或碱性条件下水解,还可以被氢解.1年前查看全部
- 高中化学竞赛题:一金属A常用于铁的保护,A与氯气反应生成一种具有挥发性的液态物质B,A与B反应生成具有还原性的C....
高中化学竞赛题:一金属A常用于铁的保护,A与氯气反应生成一种具有挥发性的液态物质B,A与B反应生成具有还原性的C....并且A有两种硫化物,其中一种看起来像Au。问,A,B,C是什么?
 binbin79021年前1
binbin79021年前1 -
 生产队 共回答了13个问题
生产队 共回答了13个问题 |采纳率84.6%你好,可能是你题目打错了,,,1年前查看全部
- 高中化学竞赛常考的重要化学方程式有哪些?
高中化学竞赛常考的重要化学方程式有哪些?
急 逗妞仕1年前1
逗妞仕1年前1 -
 821002 共回答了17个问题
821002 共回答了17个问题 |采纳率94.1%无机化学部分
非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si)
1. 氧化性:
F2 + H2 === 2HF
2F2 +2H2O===4HF+O2
Cl2 +2FeCl2 ===2FeCl3
Cl2+2NaBr===2NaCl+Br2
Cl2 +2NaI ===2NaCl+I2
Cl2+SO2 +2H2O===H2SO4 +2HCl(2004北京高考)
2. 还原性
S+6HNO3(浓)===H2SO4+6NO2↑+2H2O
3S+4 HNO3(稀)===3SO2+4NO↑+2H2O
PX3+X2===PX5
C+CO2===2CO
(生成水煤气)
(制得粗硅)
Si+2NaOH+H2O===Na2SiO3+2H2↑
3.歧化反应(碱中)
Cl2+H2O===HCl+HClO
(加酸抑制歧化,加碱或光照促进歧化)
Cl2+2NaOH===NaCl+NaClO+H2O
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
金属单质(Na,Mg,Al,Fe)的还原性
4Na+O2===2Na2O
2Na+S===Na2S(爆炸)
2Na+2H2O===2NaOH+H2↑
Mg+H2SO4===MgSO4+H2↑
2Al+6HCl===2AlCl3+3H2↑
2Al+3H2SO4===Al2(SO4)3+3H2↑
2Al+6H2SO4(浓、热)===Al2(SO4)3+3SO2↑+6H2O
(Al,Fe在冷,浓的H2SO4,HNO3中钝化)
Al+4HNO3(稀)===Al(NO3)3+NO↑+2H2O
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
Fe+2HCl===FeCl2+H2↑
Fe+CuCl2===FeCl2+Cu
非金属氢化物(HF,HCl,H2O,H2S,NH3)
1.还原性:
16HCl+2KMnO4==2KCl+2MnCl2+5Cl2↑+8H2O(实验室常用)
2H2S+SO2===3S↓+2H2O
2NH3+3Cl2===N2+6HCl
8NH3+3Cl2===N2+6NH4Cl
4NH3+3O2(纯氧)===2N2+6H2O
4NH3+6NO === 5N2+6H2O(用氨清除NO)
2.酸性:
4HF+SiO2===SiF4↑+2H2O(HF保存在塑料瓶的原因,此反应广泛应用于测定矿样或钢样中SiO2的含量)
H2S+CuCl2===CuS↓+2HCl
H2S+FeCl2===(不反应)
3.碱性:
NH3+HCl===NH4Cl
NH3+HNO3===NH4NO3
2NH3+H2SO4===(NH4)2SO4
NH3+NaCl+H2O+CO2===NaHCO3↓+NH4Cl
(此反应用于工业制备小苏打,苏打)
4.不稳定性:
2H2O2=== 2H2O+O2↑
非金属氧化物
1.低价态的还原性:
2SO2+O2+2H2O===2H2SO4
(这是SO2在大气中缓慢发生的环境化学反应)
SO2+Cl2+2H2O===H2SO4+2HCl
2NO+O2===2NO2
2CO+O2===2CO2
2.氧化性:
NO2+2KI+H2O===NO+I2↓+2KOH
(不能用淀粉KI溶液鉴别溴蒸气和NO2)
(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)
3.与水的作用:
SO2+H2O===H2SO3
SO3+H2O===H2SO4
3NO2+H2O===2HNO3+NO
N2O5+H2O===2HNO3
P2O5+H2O(冷)===2HPO3
P2O5+3H2O(热)===2H3PO4
(P2O5极易吸水,可作气体干燥剂)
4.与碱性物质的作用:
SO2+(NH4)2SO3+H2O===2NH4HSO3
(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,再用H2SO4处理: 2NH4HSO3+H2SO4=== (NH4)2SO4 + 2H2O + 2SO2 生成的硫酸铵作化肥,SO2循环作原料气)
SO2+Ca(OH)2===CaSO3+H2O
(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)
SO3+Ca(OH)2===CaSO4+H2O
CO2+2NaOH(过量)===Na2CO3+H2O
CO2(过量)+NaOH===NaHCO3
CO2+Ca(OH)2(过量)===CaCO3↓+H2O
2CO2(过量)+Ca(OH)2===Ca(HCO3)2
CO2+2NaAlO2+3H2O===2Al(OH)3↓+Na2CO3
CO2+C6H5ONa+H2O===C6H5OH↓+NaHCO3
SiO2+2NaOH===Na2SiO3+H2O (强碱缓慢腐蚀玻璃)
金属氧化物
1.低价态的还原性:
FeO+4HNO3===Fe(NO3)3+NO↑+2H2O
2.氧化性:
MgO,Al2O3很稳定,很难被还原为Mg,Al.,一般通过电解制Mg和Al.
(制还原铁粉
3.与水的作用:
Na2O+H2O===2NaOH
2Na2O2+2H2O===4NaOH+O2↑
4.与酸性物质的作用:
Na2O+CO2===Na2CO3
2Na2O2+2CO2===2Na2CO3+O2
Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2
MgO+SO3===MgSO4
MgO+H2SO4===MgSO4+H2O
Al2O3+3H2SO4===Al2(SO4)3+3H2O
Al2O3+2NaOH===2NaAlO2+H2O (Al2O3是两性氧化物)
FeO+2HCl===FeCl2+3H2O
Fe2O3+6HCl===2FeCl3+3H2O
Fe3O4+8HCl===FeCl2+2FeCl3+4H2O
含氧酸
1.氧化性:
HClO+H2SO3===H2SO4+HCl
HClO+H2O2===HCl+H2O+O2↑
(氧化性:HClO>HClO2>HClO3>HClO4,
但浓,热的HClO4氧化性很强)
H2SO4+Fe(Al) 室温下钝化
H2SO4(浓)+2HBr===SO2↑+Br2↑+2H2O
H2SO4(稀)+Fe===FeSO4+H2↑
4HNO3(浓)+C===CO2↑+4NO2↑+2H2O
6HNO3(浓)+S===H2SO4+6NO2↑+2H2O
5HNO3(浓)+P===H3PO4+5NO2↑+H2O
6HNO3(浓、热)+Fe===Fe(NO3)3+3NO2↑+3H2O
4HNO3(稀)+Fe(不足)===Fe(NO3)3+NO↑+2H2O
8HNO3(稀)+3Fe(过量)===3Fe(NO3)2+2NO↑+4H2O
2.还原性:
H2SO3+X2+H2O===H2SO4+2HX (X表示Cl2,Br2,I2)
2H2SO3+O2===2H2SO4
H2SO3+H2O2===H2SO4+H2O
H2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl
3.酸性:
H2SO4(浓) +CaF2===CaSO4+2HF↑(选学)
H2SO4(浓)+NaCl===NaHSO4+HCl↑
H2SO4(浓) +2NaCl===Na2SO4+2HCl↑
H2SO4(浓)+NaNO3===NaHSO4+HNO3↑
2HNO3+CaCO3===Ca(NO3)2+H2O+CO2↑(用HNO3和浓H2SO4不能制H2S,HI,HBr,SO2等还原性气体)
4H3PO4+Ca3(PO4)2===3Ca(H2PO4)2(重钙)
3. 不稳定性:
2HClO===2HCl+O2↑
碱
1.低价态的还原性:
4Fe(OH)2+O2+2H2O===4Fe(OH)3
2.与酸性物质的作用:
2NaOH+SO2(少量)===Na2SO3+H2O
NaOH+SO2(足量)===NaHSO3
2NaOH+SiO2===Na2SiO3+H2O
2NaOH+Al2O3===2NaAlO2+H2O
NaOH+HCl===NaCl+H2O
NaOH+H2S(足量)===NaHS+H2O
2NaOH+H2S(少量)===Na2S+2H2O
3NaOH+AlCl3===Al(OH)3↓+3NaCl
NaOH+Al(OH)3===NaAlO2+2H2O
NaOH+NH4Cl===NaCl+NH3↑+H2O
Mg(OH)2+2NH4Cl===MgCl2+2NH3•H2O
Al(OH)3+NH4Cl (或NH3•H2O不溶解)
3.不稳定性:
盐
1.氧化性:
2FeCl3+Fe===3FeCl2
2FeCl3+Cu===2FeCl2+CuCl2 (用于雕刻铜线路版)
2FeCl3+H2S===2FeCl2+2HCl+S↓
2FeCl3+2KI===2FeCl2+2KCl+I2↓
FeCl2+Mg===Fe+MgCl2
2.还原性:
2FeCl2+Cl2===2FeCl3
3Na2S+8HNO3(稀)===6NaNO3+2NO↑+3S↓+4H2O
3Na2SO3+2HNO3(稀)===3Na2SO4+2NO↑+H2O
2Na2SO3+O2===2Na2SO4
3.与碱性物质的作用:
MgCl2+2NH3•H2O===Mg(OH)2↓+2NH4Cl
AlCl3+3NH3•H2O===Al(OH)3↓+3NH4Cl
FeCl3+3NH3•H2O===Fe(OH)3↓+3NH4Cl
4. 与酸性物质的作用:
Na2CO3+HCl===NaHCO3+NaCl
NaHCO3+HCl===NaCl+H2O+CO2↑
3Na2CO3+2AlCl3+3H2O==2Al(OH)3↓+3CO2↑+6NaCl
3Na2CO3+2FeCl3+3H2O==2Fe(OH)3↓+3CO2↑+6NaCl
3NaHCO3+AlCl3===Al(OH)3↓+3CO2↑ + 3NaCl
3NaHCO3+FeCl3===Fe(OH)3↓+3CO2↑+ 3NaCl
3NaAlO2+AlCl3+6H2O===4Al(OH)3↓+ 3 NaCl
5. 不稳定性:
Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O
有机化学反应方程式
1. 甲烷与氯气 CH4+Cl2 CH3Cl+HCl CH3Cl+Cl2 CH2Cl2+HCl
CH2Cl2+Cl2 CHCl3+HCl CHCl3+Cl2 CCl4+HCl
2. 乙烯实验室制法(浓硫酸作催化剂,脱水剂) CH3CH2OH H2O + CH2=CH2 ↑
3. 乙烯通入溴水中 CH2=CH2 + Br2 CH2BrCH2Br
4.乙烯和HBr的反应 CH2=CH2 + HBr CH3CH2Br
5. 乙烯水化制乙醇 CH2=CH2 + H2O CH3CH2OH
6. 制取聚乙烯、聚丙烯 n CH2=CH2
n CH3–CH=CH2
CH3
7. 乙炔的制取 CaC2 + 2H2O Ca(OH)2 + ↑
8. 由乙炔制聚氯乙烯
+ HCl H2C=CHCl n H2C=CHCl
9. 苯与液溴反应(需铁作催化剂)
+ Br2 +HBr
10. 苯的硝化反应
+ HNO3 + H2O
11. 苯与氢气加成生成环己烷
+ 3H2
12. 甲苯发生硝化反应
+3HONO2 + 3H2O
13. 溴乙烷水解 CH3CH2Br + NaOH CH3CH2OH + NaBr
14. 溴乙烷消去反应
CH3CH2Br +NaOH CH2=CH2 + NaBr + H2O
15. 乙醇与钠反应 2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
16. 乙醇催化氧化 2CH3CH2OH + O2 2CH3CHO + 2H2O
17.乙醇脱水(分子间、分子内)CH3CH2OH H2O + CH2=CH2 ↑
2CH3CH2OH H2O + CH3CH2O CH2 CH3
18. 苯酚与氢氧化钠溶液反应
+ NaOH + H2O
19. 苯酚钠溶液中通入二氧化碳
+ CO2 + H2O + NaHCO3
20. 苯酚的定性检验定量测定方法:
+ 3Br2 ↓ + 3HBr
21. 丙醛制1-丙醇
CH3CH2CHO + H2 CH3CH2CH2OH
22. 乙醛制乙酸
2CH3CHO + O2 2CH3COOH
23. 乙醛的银镜反应
CH3CHO + 2Ag(NH3)2OH H2O + 2Ag↓+ 3NH3 + CH3COONH4
甲醛的银镜反应 HCHO + 4Ag(NH3)2OH 2H2O + 4Ag↓+6NH3 +(NH4)2CO3
24. 乙醛与新制氢氧化铜悬浊液
CH3CHO + 2Cu(OH)2 Cu2O ↓+ 2H2O + CH3COOH
25. 乙酸与氢氧化铜悬浊液
2CH3COOH + Cu(OH)2 = (CH3COO)2Cu + 2H2O
26. 乙酸乙酯制取(用饱和碳酸钠溶液收集)
CH3COOH + CH3CH2OH CH3COOC2H5 + H2O
27. 葡萄糖与银氨溶液
CH2OH(CHOH)4 CHO +2Ag(NH3)2OH H2O + 2Ag↓+ 3NH3 + CH2OH(CHOH)4 COO NH4
28. 蔗糖水解方程式
C12H22O11 + H2O C6H12O6 + C6H12O6
蔗糖 葡萄糖 果糖
29. 麦芽糖水解方程式
C12H22O11 + H2O 2C6H12O6
麦芽糖 葡萄糖
30. 淀粉水解
(C6H10O5)n + nH2O nC6H12O6
淀粉 葡萄糖
31. 硬脂酸甘油酯皂化反应
+3NaOH 3 C17H35COONa +1年前查看全部
- 求三套高中化学竞赛有机物练习附答案
求三套高中化学竞赛有机物练习附答案
854512203谢谢 iamibm1年前2
iamibm1年前2 -
 niyouzui 共回答了16个问题
niyouzui 共回答了16个问题 |采纳率93.8%三套没有,有一个练习蛮好,留QQ我发给你1年前查看全部
- 求安徽高中化学竞赛初赛,除高中知识还有哪些知识点?谢谢】最好不要我再去查了
 拦月捉鳖1年前1
拦月捉鳖1年前1 -
 cw8112838 共回答了24个问题
cw8112838 共回答了24个问题 |采纳率100%初赛基本要求
1. 有效数字.在化学计算和化学实验中正确使用有效数字.定量仪器(天平、量筒、移液管、滴定管、容量瓶等等)测量数据的有效数字.数字运算的约化规则和运算结果的有效数字.实验方法对有效数字的的制约.
2. 气体.理想气体标准状态.理想气体状态方程.气体常量R.环境标准压力和体系标准压力.气体密度.分压定律.气体相对分子质量测定原理.气体溶解度(亨利定律).
3. 溶液.溶液浓度.溶解度.浓度与溶解度的单位与换算.溶液配制(按浓度的精确度选择仪器的选择).重结晶的方法及溶质/溶剂相对量的估算.过滤与洗涤(洗涤液选择、洗涤方式选择).重结晶和洗涤溶剂(包括混合溶剂)的选择.胶体.分散系的连续相.胶体的形成和破坏.胶体的分类.胶体的基本结构.
4. 容量分析.被测物、基准物质、标准溶液、指示剂、滴定反应等基本概念.酸碱滴定的滴定曲线(酸碱强度、浓度、溶剂极性对滴定突跃影响的定性关系).酸碱滴定指示剂的选择.高锰酸钾、重铬酸钾、硫代硫酸钠、EDTA为标准溶液的基本滴定反应.分析结果的计算.分析结果的准确度和精密度.
5. 原子结构.核外电子运动状态: 用s、p、d等来表示基态构型(包括中性原子、正离子和负离子)核外电子排布.电离能、电子亲合能、电负性.
6. 元素周期律与元素周期系.周期.1—18族.主族与副族.过渡元素.主、副族同族元素从上到下性质变化一般规律;同周期元素从左到右性质变化一般规律.原子半径和离子半径.s、p、d、ds、f-区元素的基本化学性质和原子的电子构型.元素在周期表中的位置与核外电子结构(电子层数、价电子层与价电子数)的关系.最高氧化态与族序数的关系.对角线规则.金属性、非金属性与周期表位置的关系.金属与非金属在周期表中的位置.半金属(类金属).主、副族重要而常见元素的名称、符号及在周期表中的位置、常见氧化态及主要形态.铂系元素的概念.
7. 分子结构.路易斯结构式(电子式).价层电子对互斥模型对简单分子(包括离子)几何构型的预测预言.杂化轨道理论对简单分子(包括离子)几何构型的解释.共价键.配价键(配位键、配键).键长、键角、键能.σ 键和π 键.离域π 键.共轭(离域)的一般概念.等电子体的一般概念.键的极性和分子的极性.相似相溶规律.
8. 配合物.路易斯酸碱的概念.配位键.重要而常见的配合物的中心离子(原子)和重要而常见的配体(水、羟离子、卤离子、拟卤离子、氨分子、酸根离子、不饱和烃等).螯合物及螯合效应.重要而常见的配络合剂及其重要而常见的配合反应.配合反应与酸碱反应、沉淀反应、氧化还原反应的联系(定性说明).配合物几何构型和异构现象基本概念和基本事实.配合物的杂化轨道理论.用杂化轨道理论说明配合物的磁性和稳定性.八面体配合物的晶体场理论说明Ti(H2O)63+的颜色.软硬酸碱的基本概念和重要软酸软碱和硬酸硬碱.
9. 分子间作用力.范德华力.氢键.其他分子间作用力的一般概念的能量及与物质性质的关系.
10. 晶体结构.晶胞.原子坐标.晶格能.晶胞中原子数或分子数的计算及与化学式的关系.分子晶体、原子晶体、离子晶体和金属晶体.配位数.晶体的堆积与填隙模型.常见的晶体结构类型,如NaCl、CsCl、闪锌矿(ZnS)、萤石(CaF2)、金刚石、石墨、硒、冰、干冰、尿素、金红石、钙钛矿、钾、镁、铜等.
11. 化学平衡.平衡常数与转化率.弱酸、弱碱的电离常数.溶度积.利用平衡常数的计算.熵(混乱度)的初步概念及与自发反应方向的关系.
12. 离子方程式的正确书写.
13. 电化学.氧化态.氧化还原的基本概念和反应的书写与配平.原电池.电极符号、电极反应、原电池符号、原电池反应.标准电极电势.用标准电极电势判断反应的方向及氧化剂与还原剂的强弱.电解池的电极符号与电极反应.电解与电镀.电化学腐蚀.常见化学电源.pH、络合剂、沉淀剂对氧化还原反应影响的定性说明.
14. 元素化学.卤素、氧、硫、氮、磷、碳、硅、锡、铅、硼、铝.碱土金属、碱金属、稀有气体.钛、钒、铬、锰、铁、钴、镍、铜、银、金、锌、汞、钼、钨.过渡元素氧化态.氧化物和氢氧化物的酸碱性和两性.常见难溶物盐.氢化物的基本分类和主要性质.常见无机酸碱的形态和基本性质.水溶液中的常见离子的颜色、化学性质、定性检出(不使用特殊试剂)和一般分离方法.制备单质的一般方法.
15. 有机化学.有机化合物基本类型——烷、烯、炔、环烃、芳香烃、卤代烃、醇、酚、醚、醛、酮、酸、酯、胺、酰胺、硝基化合物、磺酸的系统命名、基本性质及相互转化.异构现象.C=C加成.马可尼科夫规则.C=O加成.取代反应.芳环香烃取代反应及定位规则.芳香烃侧链的取代反应和氧化反应.碳链增长与缩短的基本反应.分子的手性及不对称碳原子的R、S构型判断.糖、脂肪、蛋白质的基本概念、通式和典型物质、基本性质、结构特征以及结构表达式.
16. 天然高分子与合成高分子化学初步知识.(单体、主要合成反应、主要类别、基本性质、主要应用).
复习建议
1、看看大学教材.看大学的教材很重要,个人建议一定要把《无机化学》(上下册,本人是蓝色书皮的,这个版本比较好)和《有机化学》(上)看完.
如果时间不够,可以有重点的看:
无机(上):价键理论,分子轨道,晶体,配合物
无机(下):一定要看的元素:Xe、B、C、S、Cl、Ti、Mn、Cr、Fe、Ni、Co、Cu、Hg、Ag、Au,有时间看看:Br、I、F、As、Ca、Mg
有机(上):烯烃、苯的取代(取代基的定位)、醛酮.建议把命名搞熟,有时间看看下册的杂环,反应机理
2、多总结,尤其是有机多而杂,见到不会题就总结.注意反应条件:想NaOH,浓硫酸这些基础的先不说,一些重要的比如AlCl3、LiAlH4、NaNO2,NaNH2,格氏试剂,Hg2+,CrO3等等必须非常熟悉,一见条件就得知道是什么反应就可以了.1年前查看全部
- 求硫代硫酸钠的完整化学性质性质的介绍最好深度大一点,和高中化学竞赛内容有关则更好
 xueas20021年前1
xueas20021年前1 -
 cjj7878 共回答了13个问题
cjj7878 共回答了13个问题 |采纳率92.3%化学式Na2S2O3,俗称海波,也叫大苏打.
1.其中硫元素显+2价,具有较强的还原性,如跟氯气的反应:
Na2S2O3+4Cl2+5H2O=2NaCl+2H2SO4+6HCl
常用于除去织物漂白后残留的氯气,也可作卤素的解毒剂.
2.其化学性质不稳定,受热易分解,如:
Na2S2O3==Na2SO3+S(反应条件为加热)
3.由于硫代硫酸属弱酸,故也能跟一些强酸反应:
Na2S2O3+H2SO4=Na2SO4+H2O+SO2↑+S↓
硫代硫酸钠是无色透明单斜晶体,无嗅,有苦咸味,易溶于氨水,也易溶于水及松节油,不溶于乙醇,水溶液近中性,遇强酸分解.在水中由于温度升高水分子的活动加强,导致海波溶解度的下降.
详细情况可以问专业人员.1年前查看全部
- 高中化学竞赛混合固体推断题(2004年江苏省高中生化学竞赛试题)某白色固体可能由1.氯化铵2.氯化铝3.氯化钠4.硝酸银
高中化学竞赛混合固体推断题
(2004年江苏省高中生化学竞赛试题)
某白色固体可能由
1.氯化铵
2.氯化铝
3.氯化钠
4.硝酸银
5.氢氧化钾
中的一种或几种组成,此固体投入水中的澄清溶液,该溶液能使酚酞变红,若向溶液中加稀硝酸至过量,有白色沉淀产生.则对原固体判断不正确的是()
A.肯定存在1.
B.至少存在2.和5.
C.无法确定是否有3.
D.至少存在1.4.5. 老毒妇1年前7
老毒妇1年前7 -
 tteam 共回答了17个问题
tteam 共回答了17个问题 |采纳率88.2%我 感觉这里没涉及离子共存问题 因为开始都是固体 ..
(若向溶液中加稀硝酸至过量,有白色沉淀产生.)说明 有123就4
(该溶液能使酚酞变红 )说明有NH3 A.对 说明有1 有 5
有1就有4 所以AD 正确啊 .. 2 就不能确定了 ..
所以 我觉得选B哦 ...~1年前查看全部
- 本人参加高中化学竞赛,已经进入复赛,怎么根据宏观对称元素确定晶系,和晶系与晶胞形状的关系
 landiao4201年前1
landiao4201年前1 -
 2000xixi 共回答了23个问题
2000xixi 共回答了23个问题 |采纳率87%这个……有点难说清楚……
建议你看看结构化学方面的书……1年前查看全部
- 熔点降低原理 化学竞赛高中化学竞赛中讲到熔点降低原理,比如电解时加入冰晶石(六氟合铝酸钠)以及电解绿化锂时加入氯化钾等,
熔点降低原理 化学竞赛
高中化学竞赛中讲到熔点降低原理,比如电解时加入冰晶石(六氟合铝酸钠)以及电解绿化锂时加入氯化钾等,具体原理是什么?
希望详尽的回答,好的追加分,谢谢!
溶剂的液态化学势与蒸气压成正比关系吗?如果成此关系的话,蒸气压又与温度成正比,那么要重新达到平衡应该升高温度才对呀,为什么反而降低了呢? 年归1年前3
年归1年前3 -
 slren 共回答了14个问题
slren 共回答了14个问题 |采纳率92.9%在纯物质的正常凝固点(熔点)温度下,固液两相平衡共存,纯物质在两相的化学势相等.而对于溶液而言,若溶质只溶解于液态溶剂而不溶解与固态溶剂时,少量溶质的存在使溶液的蒸汽压降低,且使溶液中溶剂的化学势小于固态纯溶剂的化学势,固态纯溶剂因此熔融进入溶液中,从而改变溶液的浓度.同时固态溶剂熔融时吸热,使体系的温度下降,直至某一温度时,固态纯溶剂与溶液才达到两相平衡.这个平衡温度称为溶液的凝固点,显然它低于纯溶剂的正常凝固点.
这是从化学势的角度来解释凝固点(熔点)的降低,不知道你能不能理解.1年前查看全部
- 跪求求冯茹尔杯2011江苏省高中化学竞赛模拟试题及答案
跪求求冯茹尔杯2011江苏省高中化学竞赛模拟试题及答案
求冯茹尔杯2011江苏省高中化学竞赛模拟试题及答案
发至wendybobo2011@163.com 忧伤的时候去看天1年前2
忧伤的时候去看天1年前2 -
 ulvr 共回答了19个问题
ulvr 共回答了19个问题 |采纳率100%1 BCBADAB CBDAACACA BBCCCDBCA BDDAC
31-50C C BC B C D B D CD C AC D AC B B B B C BD B
51-60D B C C CD C AC D AC CD
(二)B B C A D B B A D C
B A B D A A C C A C
D C D C B B A B C B
31D B AC BC C BD B D A AB
41A D BD C BC A D AD A AB
51D D D AD B BD CD C BD A1年前查看全部
- 有没有卖高中化学竞赛题练习题的
 gh3041年前1
gh3041年前1 -
 寒谷鸣飞 共回答了16个问题
寒谷鸣飞 共回答了16个问题 |采纳率93.8%新华书店一楼高中柜第三排1年前查看全部
- 2010湖北省高中化学竞赛4、已知:2CO(g)+O2(g)=2CO2(g);ΔH=-566kJ•mol-1Na2O2(
2010湖北省高中化学竞赛
4、已知:2CO(g)+O2(g)=2CO2(g);ΔH=-566kJ•mol-1
Na2O2(s)+CO2(g)=Na2CO3(s)+ 1/2O2(g);ΔH=-226 kJ•mol-1
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283 kJ
B.右图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ•mol-1
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
A为什么不对?

 yd19741年前3
yd19741年前3 -
 hyqinfo111 共回答了21个问题
hyqinfo111 共回答了21个问题 |采纳率100%应该有单位的啊kJ/mol,而且根据现在的课本,燃烧热是负值,有-283 kJ/mol1年前查看全部
- 高中化学竞赛需要掌握哪些消去反应
高中化学竞赛需要掌握哪些消去反应
尽量多举一些例子,比方说哪类物质能和哪类物质发生消去反应,再各举一例化学方程式 zhuhexiaoliang1年前1
zhuhexiaoliang1年前1 -
 gzjs 共回答了20个问题
gzjs 共回答了20个问题 |采纳率75%你只要懂消去反应的原理就行,教材书里有最基本啊!因为无论他怎么考都是这么考,别看他考的物质没见过,很复杂,其实都是这个原理,只要你知道在哪个地方消去即可!1年前查看全部
- 2010年湖北省高中化学竞赛初赛试题
2010年湖北省高中化学竞赛初赛试题
8、硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元.硅氧四面体可以用投影图表示成(如下图);其中O表示氧原子,中心黑点硅原子.硅氧四面体通过不同方式的连接可以组成各种不同的硅酸根离子.试确定在无限长的单链阴离子中(见图),
硅原子与氧原子的个数比为
A.1:2 B.1:3 C.2:5 D.2:7
为什么?
这个四面体到底是怎么样的?
一个四面体中有四个氧还是三个氧?

 ly1321年前2
ly1321年前2 -
 kiwen 共回答了28个问题
kiwen 共回答了28个问题 |采纳率92.9%应该是A吧,因为由图中可以看出连接两个三角的氧原子是公用的,所以可视为每一个单元都占有这个氧原子的1/2,而一个四面体中有两个这样的氧原子,再加上还有一个没有被占用的氧原子,所以就是两个氧原子,所以就是1/21年前查看全部
大家在问
- 1用英语怎么说生日快乐经典独特的句子
- 2橡胶的弹性与什么因素相关?
- 3读如图,完成1-4题:关于该国气候的描述,正确的是( )A.四季分明,降水稀少B.冬季寒冷,夏季炎热,大陆性气候显著C
- 4何人为朱元璋提出“高筑墙,广积粮,缓称王”的建议?如...
- 5某+1价金属n克与氧气充分反应,生成金属氧化物m克,则金属氧化物的相对质量分数是多少
- 6阅读下面文章,回答问题。 绿色是多宝贵的啊!它是生命,它是希望,它是慰安,它是快乐 。我怀念着绿色把我的心等焦了。我
- 7Mother: You don’t look happy, Cathy.
- 8二氧化碳的2个π3,4键是怎么酸出来的?
- 9看图计算下列图形的面积.
- 10若4a=5b,则a:b=______.(ab≠0)
- 11像这样的矩阵应该怎样求这个初等变换求矩阵的秩啊
- 12有一篮苹果要分给一组参加活动的小朋友,如果每人分3个,就会剩下5个苹果;如果每人分4个,就会缺1个苹果
- 13排列组合求证题Cm/n-1+Cm/n-2+Cm/n-3...+Cm/m+1+Cm/m=Cm+1/n
- 14期末测试中,明明的语文得了90分,数学比语文和作文的总分少了70,明明的数学比作文高多少分?
- 15一弹簧振子做简谐运动,其振动图象如图所示,那么在([T/2]-△t)和([T/2]+△t)(△t是微小的时间)两时刻,则