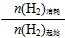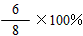甲醇燃料分为甲醇汽油和甲醇柴油.工业上合成甲醇的方法很多.
 至尊勇者2022-10-04 11:39:541条回答
至尊勇者2022-10-04 11:39:541条回答(1)一定条件下发生反应:
CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H1
2CO(g)+O2(g)=2CO2(g)△H2
2H2(g)+O2(g)=2H2O(g)△H3则CO(g)+2H2(g)⇌CH3OH(g)的△H=
(2)在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)⇌CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)与反应时间t的变化曲线如图1所示.该反应的△H______0 (填>、<或=).

(3)若要提高甲醇的产率,可采取的措施有______(填字母).
A.缩小容器体积 B.降低温度C.升高温度
D.使用合适的催化剂E.将甲醇从混合体系中分离出来
(4)CH4和H2O在催化剂表面发生反应CH4+H2O⇌CO+3H2,T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50%,计算该温度下的平衡常数______(结果保留小数点后两位数字).
(5)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,图2是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:
①B极的电极反应式为______.
②若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当电路中转移1mol e-时,实际上消耗的甲醇的质量比理论上大,可能原因是______.
(6)25℃时,草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9.向20mL碳酸钙的饱和溶液中逐滴加入8.0×10-4mol•L-1的草酸钾溶液20mL,能否产生沉淀______(填“能”或“否”).

已提交,审核后显示!提交回复
共1条回复
 斌2006 共回答了21个问题
斌2006 共回答了21个问题 |采纳率85.7%- 解题思路:(1)运用盖斯定律解答,注意分析待求反应中的反应物和生成物在已知反应中的位置,通过加减求得;
(2)在300℃到500℃时,物质的量n(CH3OH)减小,平衡逆向移动;
(3)改变条件平衡正向移动,由此分析;
(4)依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;
(5)①根据原电池原理,负极上甲醇失电子生成二氧化碳;
②根据电池中的能量转化率分析;
(6)根据c(Ca2+)•c (C2O42-)和Ksp(4.0×10-8)相对大小判断,如果c(Ca2+)•c (C2O42-)=<Ksp(4.0×10-8),则无沉淀生成.(1)①CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H1
②2CO(g)+O2(g)=2CO2(g)△H2
③2H2(g)+O2(g)=2H2O(g)△H3
据盖斯定律,①+[1/2]②-[1/2]③得:CO(g)+2H2(g)⇌CH3OH(g)△H=△H1+[1/2]△H2-[1/2]△H3,
故答案为:△H1+[1/2]△H2-[1/2]△H3;
(2)在300℃到500℃时,物质的量n(CH3OH)减小,平衡逆向移动,逆反应是吸热反应,正反应是放热反应,故答案为:<;
(3)A.缩小容器体积,增大压强,平衡正向移动,甲醇的产率增加,故正确;
B.降低温度,平衡正向移动,甲醇的产率增加,故正确;
C.升高温度,平衡逆向移动,甲醇的产率减少,故错误;
D.使用合适的催化剂,平衡不移动,故错误;
E.将甲醇从混合体系中分离出来,有利平衡正向移动,提高甲醇的产量,故正确;
故选:ABE;
(4)CH4和H2O在催化剂表面发生反应CH4+H2O⇌CO+3H2,T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50%,
CH4 +H2O⇌CO+3H2
起始物质的量浓度(mol•L-1) 1.01.000
转化物质的量浓度(mol•L-1) 0.50.50.51.5
平衡物质的量浓度(mol•L-10.50.50.51.5
K=
c3(H2)c(CO)
c(CH4)c(H2O)=
0.5mol/L×(1.5mol/L)3
0.5mol/L×0.5mol/L=6.75mol2/L2;
故答案为:6.75;
(5)①根据原电池原理,负极上甲醇失电子生成二氧化碳,电极反应为:CH3OH+3O2--6e-=CO2+2H2O,故答案为:CH3OH+3O2--6e-=CO2+2H2O;
②甲醇不完全被氧化,生成C或CO或者原电池中发生反应时化学能不去全部转化为电能,即电池能量转化率达不到100%,所以实际上消耗的甲醇的质量比理论上大,
故答案为:甲醇不完全被氧化,生成C或CO或电池能量转化率达不到100%;
(6)碳酸钙溶液中钙离子浓度=
2.5×10−9mol/L=5×10-5mol/L,二者混合后,钙离子浓度=2.5×10-5mol/L,草酸钾的浓度为4.0×10-4 mol/L,混合后c(Ca2+)•c (C2O42-)=2.5×10-5 ×4.0×10-4=1×10-8<Ksp(4.0×10-8),故无沉淀,故答案为:否.点评:
本题考点: 用盖斯定律进行有关反应热的计算;原电池和电解池的工作原理;化学平衡的影响因素;化学平衡的调控作用;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了盖斯定律、化学平衡的移动、化学平衡常数、电化学、难溶物的溶解平衡,明确溶度积常数的运用是解本题关键,难度中等. - 1年前
相关推荐
- (2014•滨州一模)固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料
 (2014•滨州一模)固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
(2014•滨州一模)固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol
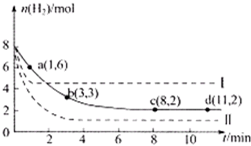
某科学实验小组将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标).回答下列问题:
(1)该反应在0~8min内CO2的平均反应速率是______mol•L-1•min-1
(2)此温度下该反应的平衡常数K的数值为______.
(3)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示.与实线相比,曲线Ⅰ改变的条件可能是______,曲线Ⅱ改变的条件可能是______.若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条件下平衡常数为K2,则K、K1和K2的大小关系是______. 167573391年前0
167573391年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 固定和利用CO 2 能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO 2 来生产甲醇燃料的方法:CO 2 (
固定和利用CO 2 能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO 2 来生产甲醇燃料的方法:CO 2 (g)+3H 2 (g)
 CH 3 OH(g)+H 2 O(g) △H=-49.0 kJ·mol -1
CH 3 OH(g)+H 2 O(g) △H=-49.0 kJ·mol -1
某科学实验将6molCO 2 和8molH 2 充入2L的密闭容器中,测得H 2 的物质的量随时间变化如下图所示(实线)。
(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是___________。
(3)仅改变某一实验条件再进行两次实验,测得H 2 的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是___________,曲线II对应的实验条件改变是___________。A.0~1min B.1~3min C.3~8min D.8~11min  benxiaohai1年前1
benxiaohai1年前1 -
 码头还来 共回答了22个问题
码头还来 共回答了22个问题 |采纳率90.9%(8分)(1)大于(2分)(2)A(2分) (3)升高温度(2分) 增大压强(2分)
1年前查看全部
- 汽油燃料,和甲醇燃料,HC\CO\NO排放对比
 阳光一屡1年前1
阳光一屡1年前1 -
 沥沥雨3313 共回答了20个问题
沥沥雨3313 共回答了20个问题 |采纳率80%这题目可大了,而且涉及到实验比对的问题.
使用清洁甲醇汽油百公里油耗平均降低1.18L,节油率为8.7%.M100全甲醇燃烧装置是对传统汽油发动机的供燃料系统、供热系统、变速箱等进行重大改进,改进后的发动机可100%燃烧甲醇,不用汽油,运行成本比汽油机降低了25%,动力性与普通汽油发动机相当.尾气排放中一氧化碳和碳氢化合物减少55%—90%,环保效果突出.甲醇汽油的成本较低,车辆使用甲醇汽油比传统汽油油耗可降低7%-25%.1年前查看全部
- 固定和利用CO 2 能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO来生产甲醇燃料的方法: CO 2 (g)
固定和利用CO 2 能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO来生产甲醇燃料的方法: CO 2 (g)+3H 2 (g)
 CH 3 OH(g)+H 2 O(g)△H = -49.0 kJ·mol -1 ,
CH 3 OH(g)+H 2 O(g)△H = -49.0 kJ·mol -1 ,
某科学实验将6molCO 2 和8molH 2 充入2L的密闭容器中,测得H 2 的物质的量随时间变化如下图所示(实线)。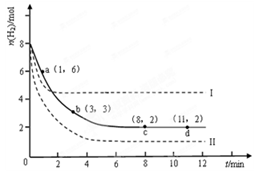
(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是__________。
(3)求平衡时CO 2 的转化率 和该条件下的平衡常数K 。A.0~1min B.1~3min C.3~8min D.8~11min
(4)仅改变某一实验条件再进行两次实验,测得H 2 的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线II对应的实验条件改变是 。 enjoytdl1年前1
enjoytdl1年前1 -
 小白菜丫丫 共回答了23个问题
小白菜丫丫 共回答了23个问题 |采纳率78.3%(1)> (2)A (3)33.3﹪ K=0.5 (4)升高温度 增大压强。
1年前查看全部
- (10分)固定和利用CO 2 能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO 2 来生产甲醇燃料的方法:C
(10分)固定和利用CO 2 能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO 2 来生产甲醇燃料的方法:CO 2 (g)+3H 2 (g)
 CH 3 OH(g)+H 2 O(g)+49kJ。某科学实验将6molCO 2 和8molH 2 充入2L的密闭容器中,测得H 2 的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标.
CH 3 OH(g)+H 2 O(g)+49kJ。某科学实验将6molCO 2 和8molH 2 充入2L的密闭容器中,测得H 2 的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标.
(1)0~a,a~b,b~c,c~d四段中,平均反应速率最大的时间段是___________ ,该时间段内H 2 的平均反应速率是_____________。
(2)平衡时CO 2 的转化率是多少?反应前后容器内的压强比时多少?(请按计算题格式在答题卡上作答)
L)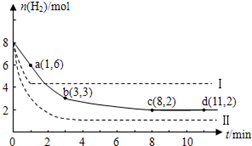
 缇子饼干21年前1
缇子饼干21年前1 -
 经天石 共回答了31个问题
经天石 共回答了31个问题 |采纳率90.3%(1)0~a段;该时间段内H 2 的平均反应速率是1mol/(L·min) (2)33% ;7︰5
1年前查看全部
- (2014•浙江模拟)固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法
 (2014•浙江模拟)固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).
(2014•浙江模拟)固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).
①下列时间段平均反应速率最大的是______,最小的是______.
A.0~1minB.1~3minC.3~8minD.8~11min
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是______,曲线Ⅱ对应的实验条件改变是______.
③根据该反应的特点,此反应自发进行的条件是______(填“高温”、“低温”或“任何温度”) 棋魂1年前1
棋魂1年前1 -
 破碎水杯 共回答了18个问题
破碎水杯 共回答了18个问题 |采纳率88.9%解题思路:①单位时间氢气的物质的量的变化量越大,表明平均速率越大,单位时间氢气的物质的量的变化量越小,平均反应速率越小;
②由图1可知,曲线Ⅰ最先到达平衡,平衡时氢气的物质的量增大,故改变条件应增大反应速率且平衡向逆反应移动;曲线Ⅱ到达平衡的时间比原平衡短,平衡时氢气的物质的量减小,故改变条件应增大反应速率且平衡向正反应移动;结合反应的特征进行分析;
③根据自发进行判断依据判断.①由图1可知,0~1min内氢气的变化量为8mol-6mol=2mol; B.1~3min内氢气的变化量为6mol-3mol=3mol,平均1min变化量为1.5mol; C.3~8min内氢气的变化量为3mol-2mol=1mol,平均1min变化量为0.2mol;D.8~11min达平衡状态,氢气的物质的量不再变化.故1~3min速率增大,8~11min速率最小,
故答案为:A;D;
②对于可逆反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,正反应是体积减小的放热反应;由图1可知,曲线Ⅰ最先到达平衡,平衡时氢气的物质的量增大,故改变条件应增大反应速率且平衡向逆反应移动,可以采取的措施为:升高温度;曲线Ⅱ到达平衡的时间比原平衡短,平衡时氢气的物质的量减小,故改变条件应增大反应速率且平衡向正反应移动,可以采取的措施为:增大压强或者是增大CO2浓度,
故答案为:升高温度;增大压强或者是增大CO2浓度;
③反应前气体体积大于反应后气体体积,即正反应方向为熵增加,根据△H-T•△S<0可知,温度较低有利于反应的自发进行,故答案为:低温.点评:
本题考点: 物质的量或浓度随时间的变化曲线.
考点点评: 本题考查化学平衡图象、反应速率大小判断、外界条件对平衡的影响等,题目难度不大,注意图象1中利用“先拐先平”,即曲线先折拐的首先达到平衡,以此判断温度或压强的高低,再依据外界条件对平衡的影响解答.1年前查看全部
- 固定和利用CO 2 能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO 2 来生产甲醇燃料的方法:CO 2 (
固定和利用CO 2 能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO 2 来生产甲醇燃料的方法:CO 2 (g)+3H 2 (g) 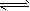 CH 3 OH(g)+H 2 O(g) △H=-49.0 kJ·mol -1 某同学实验将6molCO 2 和8molH 2 充入2L的密闭容器中,测得H 2 的物质的量随时间变化如下图所示(实线)。
CH 3 OH(g)+H 2 O(g) △H=-49.0 kJ·mol -1 某同学实验将6molCO 2 和8molH 2 充入2L的密闭容器中,测得H 2 的物质的量随时间变化如下图所示(实线)。 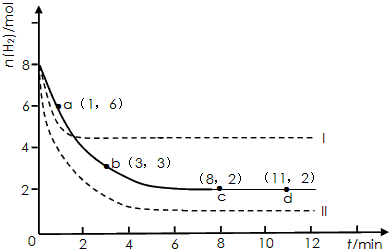
(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是___________。
A.0~1min B.1~3min C.3~8min D.8~11min
(3)仅改变某一实验条件再进行两次实验,测得H 2 的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是___________,曲线II对应的实验条件改变是___________。 微风20051年前1
微风20051年前1 -
 我在这里守侯 共回答了13个问题
我在这里守侯 共回答了13个问题 |采纳率84.6%(1)大于
(2)A
(3)升高温度;增大压强1年前查看全部
- (1)固定和利用CO 2 能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO 2 来生产甲醇燃料的方法:CO
(1)固定和利用CO 2 能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO 2 来生产甲醇燃料的方法:CO 2 (g)+3H 2 (g)
 CH 3 OH(g)+H 2 O(g)△H=-49.0kJ·mol -1 。某科学实验将6molCO 2 和8molH 2 充入2L密闭容器中,测得H 2 的物质的量随时间变化如右图所示(实线)。图中数据a(1,6)代表的意思是:在l min时H 2 的物质的量是6mol。
CH 3 OH(g)+H 2 O(g)△H=-49.0kJ·mol -1 。某科学实验将6molCO 2 和8molH 2 充入2L密闭容器中,测得H 2 的物质的量随时间变化如右图所示(实线)。图中数据a(1,6)代表的意思是:在l min时H 2 的物质的量是6mol。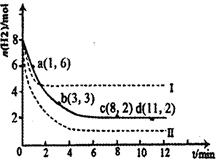
①下列时间段平均反应速率最大的是__________,最小的是______________。
②仅改变某一实验条件再进行两次实验测得H 2 的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验改变的条件是________,曲线Ⅱ对应的实验改变的条件是_________。A.0~1min B.1~3min C.3~8min D.8~11min
(2)利用光能和光催化剂,可将CO 2 和H 2 O(g)转化为CH 4 和O 2 。紫外光照射时,等量的CO 2 和H 2 O(g)在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH 4 产量随光照时间的变化如图所示。在0~30 h内,CH 4 的平均生成速率v(Ⅰ)、v(Ⅱ)和v(Ⅲ)从大到小的顺序为 。反应开始后的12小时内,在第___________种催化剂的作用下,收集的CH 4 最多。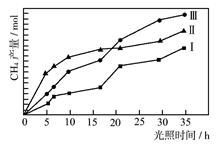
 我要娜娜1年前1
我要娜娜1年前1 -
 822weiwei77 共回答了14个问题
822weiwei77 共回答了14个问题 |采纳率92.9%(12分)(1)①A、D ②升高温度,增大压强或者是增大CO 2 浓度(各2分)
(2)v(Ⅲ)>v(Ⅱ)>v(Ⅰ)(2分);Ⅱ (2分)
1年前查看全部
- 固定和利用CO 2 能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO 2 来生产甲醇燃料的方法:CO 2 (
固定和利用CO 2 能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO 2 来生产甲醇燃料的方法:CO 2 (g)+3H 2 (g)  CH 3 OH(g)+H 2 O(g) △H=-49.0 kJ·mol -1 某科学实验将6molCO 2 和8molH 2 充入
CH 3 OH(g)+H 2 O(g) △H=-49.0 kJ·mol -1 某科学实验将6molCO 2 和8molH 2 充入
2L的密闭容器中,测得H 2 的物质的量随时间变化如下图所示(实线)。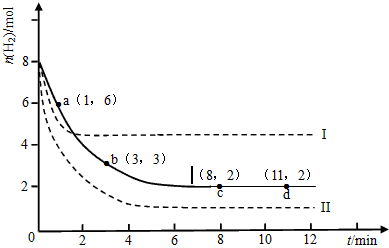
(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是__________,最小的是__________。
A.0~1min B.1~3min C.3~8min D.8~11min
(3)求平衡时氢气的转化率和该条件下反应的平衡常数K。(写出计算过程)
_____________________________________
(4)仅改变某一实验条件再进行两次实验,测得H 2 的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是___________,曲线II对应的实验条件改变是___________。 一只肥猫1年前1
一只肥猫1年前1 -
 77882 共回答了19个问题
77882 共回答了19个问题 |采纳率89.5%1年前查看全部
- 固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线).
(1)a点正反应速率______(填大于、等于或小于)逆反应速率.
(2)下列时间段平均反应速率最大的是______,最小的是______.
A.0~1minB.1~3minC.3~8minD.8~11min
(3)求平衡时氢气的转化率和该条件下反应的平衡常数K.(写出计算过程)
(4)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是______,曲线II对应的实验条件改变是______. frankfurt1年前1
frankfurt1年前1 -
 无语15 共回答了26个问题
无语15 共回答了26个问题 |采纳率92.3%解题思路:(1)a点时还没有达到平衡状态,从反应物的物质的量的变化趋势判断反应进行的方向,依次判断正逆反应速率大小;
(2)根据曲线的斜率判断,斜率越大,说明在单位时间内反应物的变化率越大,反应速率越大,也可分别计算不同时间内的反应速率大小来进行比较;
(3)利用三段式进行计算;
(4)从虚线变化判断达到平衡时反应物的转化的物质的量来分析,曲线I反应速率增大,但转化的氢气的物质的量少,应是升高温度,因该反应放热,升高温度平衡逆向移动,曲线Ⅲ反应速率增大,转化的氢气的物质的量多,平衡正向移动,应是增大压强.(1)a点时还没有达到平衡状态,反应物氢气的物质的量继续减小,平衡向正向移动,所以正反应速率大于逆反应速率,故答案为:大于;
(2)分别计算不同时间内的反应速率:0~1min内,v(H2)=
(8−6)mol
2L•1min=1mol/(L•min);1~3min内,v(H2)=
(6−3)mol
2L•(3−1)min=0.75mol/(L•min);3~8min内,v(H2)=
(3−1)mol
2L•(8−3)min=0.1mol/(L•min);8min后达到化学平衡状态,正逆反应速率相等,综合速率为零;所以0~1min内反应速率最大,8~11min反应速率最小,故答案为:A;D;
(3)CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
起始物质的量/mol680 0
物质的量变化/mol262 2
平衡物质的量/mol422 2
氢气的转化率为:
n(H2)转化
n(H2)起始×100%=[6/8×100%=75%,K=
c(CH3OH)•c(H2O)
c(CO2)•c3(H2)]=
2mol
2L×
2mol
2L
4mol
2L×(
2mol
2L)3=0.5L2•mol-2,
答:平衡时氢气的转化率为75%,该条件下反应的平衡常数为0.5L2•mol-2;
(4)曲线I反应速率增大,但转化的氢气的物质的量少,应是升高温度,因该反应放热,升高温度平衡逆向移动,不利于氢气的转化,故曲线I是升高温度;曲线Ⅲ反应速率增大,转化的氢气的物质的量多,因增大压强平衡正向移动,故应是增大压强.故答案为:升高温度;增大压强.点评:
本题考点: 物质的量或浓度随时间的变化曲线;反应速率的定量表示方法;化学平衡的计算.
考点点评: 此题考查化学反应速率或平衡的图象和热化学反应方程式,考查计算反应速率的大小比较以及反应物转化的多少,注意把握对题目图象的分析.题目较为综合,具有一定难度.1年前查看全部
- 甲醇燃料的燃烧的原电池反应方程式
甲醇燃料的燃烧的原电池反应方程式
酸性 碱性 还有 中性的都写出来 天天336381年前2
天天336381年前2 -
 cybcybcyb003 共回答了18个问题
cybcybcyb003 共回答了18个问题 |采纳率94.4%1、碱性:负极:CH4+10OH-+ 8e-=CO32-+7H2O
正极:2O2+4H2O+8e-=8OH-
2、酸性:负极:CH4+2H2O-8e-=CO2+8H+
正极:2O2+8H++8e-=4H2O
3、中性:负极:CH4+2H2O-8e-=CO2+8H+
正极:2O2+4H2O+8e-=8OH-1年前查看全部
- 固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).

(1)a点正反应速率______(填大于、等于或小于)逆反应速率.
(2)下列时间段平均反应速率最大的是______,最小的是______.
A.0~1minB.1~3minC.3~8minD.8~11min
(3)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是______,曲线II对应的实验条件改变是______. heshubo0031年前1
heshubo0031年前1 -
 非洲婴儿 共回答了22个问题
非洲婴儿 共回答了22个问题 |采纳率81.8%解题思路:(1)a点时还没有达到平衡状态,从反应物的物质的量的变化趋势判断反应进行的方向,依次判断正逆反应速率大小;
(2)根据曲线的斜率判断,斜率越大,说明在单位时间内反应物的变化率越大,反应速率越大,也可分别计算不同时间内的反应速率大小来进行比较;
(3)从虚线变化判断达到平衡时反应物的转化的物质的量来分析,曲线I反应速率增大,但转化的氢气的物质的量少,应是升高温度,因该反应放热,升高温度平衡逆向移动,曲线Ⅲ反应速率增大,转化的氢气的物质的量多,平衡正向移动,应是增大压强.(1)a点时还没有达到平衡状态,反应物氢气的物质的量继续减小,平衡向正向移动,所以正反应速率大于逆反应速率,故答案为:大于;
(2)分别计算不同时间内的反应速率:0~1min内,v(H2)=
8mol-6mol
2L
1min=1mol/(L•min);1~3min内,v(H2)=
6mol-3mol
2L
3min-1min=0.75mol/(L•min);3~8min内,v(H2)=
3mol-1mol
2L
8min-3min=0.1mol/(L•min);8min后达到化学平衡状态,正逆反应速率相等,综合速率为零;所以0~1min内反应速率最大,8~11min反应速率最小,故答案为:A;D;
(3)曲线I反应速率增大,但转化的氢气的物质的量少,应是升高温度,因该反应放热,升高温度平衡逆向移动,不利于氢气的转化,故曲线I是升高温度;曲线Ⅲ反应速率增大,转化的氢气的物质的量多,因增大压强平衡正向移动,故应是增大压强.故答案为:升高温度;增大压强.点评:
本题考点: 物质的量或浓度随时间的变化曲线.
考点点评: 此题考查化学反应速率或平衡的图象和热化学反应方程式,考查计算反应速率的大小比较以及反应物转化的多少,注意把握对题目图象的分析.题目较为综合,具有一定难度.1年前查看全部
大家在问
- 1求y=(e^x-e^-x)/2的反函数,并写出它的定义域
- 2fetch 这个词的用法 是fetch sth.for sb.
- 3_____________ there any flowers in the nature park? [ &
- 4.超市以每千克2.8元的价格购回一批苹果,经过挑选把这批苹果分成了甲乙两等,甲乙的重量比是5:3,乙只能以
- 5(2011•曲阜市模拟)在探究“杠杆的平衡条件”实验中,有一组同学猜想杠杆的平衡条件可能是“动力+动力臂=阻力+阻力臂”
- 6我有一些易错字不会,希望有高人能指迷津!*^_^*(Thank you)
- 7小天鹅封闭型贮水式电热水器可以加热 但加热到一定温度(45度左右)就上不去了,
- 83千米30米+15千米600米=()千米?3千米5米--1千米900米=()千米
- 9只有羊肉面里才有卷心菜 Only the mutton noodles ___ ___ some cabbages.
- 10光速会放大吗?天文上说的某星球距地球多少亿光年,那么现在看到的这颗星球的光是几亿年前发出的吗?
- 11下列词语中加点的字,读音全都正确的一项是
- 12已知有理数a,b在数轴上表示的点如图所示,则下列式子中正确的是( )
- 13按课文内容和你积累的知识填空。
- 14遵守诺言的一篇300左右的作文!
- 15按正确的顺序排列下列句子。