标状况下,将22.4L氯化氢气体溶于563.5ml的
 ff咕客2022-10-04 11:39:542条回答
ff咕客2022-10-04 11:39:542条回答标状况下,将22.4L氯化氢气体溶于563.5ml的水(密度为1g/cm^3)中,所得盐酸密度为1.2g/cm^3 计算1中所得盐酸的溶液的物质的量浓度.2.如果向所得盐酸中加入物质量之比为1:2的氧化铁和氢氧化铝混合物,则刚好能完全溶解的混合物中氢氧化铝是多少克?计算题要全解题过程
好人一生平安

已提交,审核后显示!提交回复
共2条回复
 WL1214wl 共回答了21个问题
WL1214wl 共回答了21个问题 |采纳率85.7%- (1)
n(HCl) = 22.4L/22.4L/mol = 1mol
c(HCl) = n(HCl) / V[HCl(aq)] = 1mol / [ (1mol * 36.5g/mol + 563.5ml * 1g/mL) / 1.2g/mL] = 2mol/L
(2)
设刚好能完全溶解的混合物中含氧化铁amol,则含氢氧化铝2amol:
Fe2O3---------- 6HCl Al(OH)3 ---- 3HCl
1 6 1 3
amol = 6amol 2amol =6amol
得:6amol + 6amol = 1mol
得:a = 0.083
m[Al(OH)3] = 0.083mol * 78g/mol = 6.5g - 1年前
 ygp12 共回答了9540个问题
ygp12 共回答了9540个问题 |采纳率0.2%- c=1/0.6=1.7mol/L
m=78*2*1/4=39g - 1年前
相关推荐
- 在标准状况下,由co和co2组成的混合气体13.44升,质量为二十克,此混合气体c和o两种原子的个数之比为?
 lesn0079421年前1
lesn0079421年前1 -
 秦之韵 共回答了19个问题
秦之韵 共回答了19个问题 |采纳率84.2%设CO x mol,CO2 y mol
因为标况下,由co和co2组成的混合气体13.44升
所以混合气体物质的量为:13.44 / 22.4 = 0.6 mol
所以
x + y = 0.6
28x + 44y = 20
解得:
x=0.4mol
y=0.2mol
所以
C原子数=0.4 + 0.2= 0.6 mol
O原子数=0.4 + 2×0.2= 0.8mol
混合气体c和o两种原子个数之比为:
C :O = 3 :41年前查看全部
- 在标准状况下,4g氮气的体积是?
 wind8584831年前1
wind8584831年前1 -
 云天饰界 共回答了22个问题
云天饰界 共回答了22个问题 |采纳率90.9%先求物质的量
N2 摩尔质量为 28 g/mol
则 4g N2物质的量==质量/摩尔质量== 4/28==1/7 mol
则体积==物质的量*22.4 ==22.4/7==3.2 L1年前查看全部
- 紧急啊标准状况下状况 24g氧气体积求过程
 Leo_臭虫1年前1
Leo_臭虫1年前1 -
 翱翔小鸟 共回答了18个问题
翱翔小鸟 共回答了18个问题 |采纳率72.2%24g氧气.物质的量0.75摩尔,标准状况下状况气体摩尔体积22.4L/mol
所以体积=22.4*0.75=16.8L1年前查看全部
- 英语翻译1经过长期的和平谈判,两国最终达成协议2,请读一下这份介绍今年财务状况的报告3,要做出这样的实验,就需要付出最大
英语翻译
1经过长期的和平谈判,两国最终达成协议
2,请读一下这份介绍今年财务状况的报告
3,要做出这样的实验,就需要付出最大的努力和耐心. babyblue-cq1年前2
babyblue-cq1年前2 -
 ajsoft 共回答了17个问题
ajsoft 共回答了17个问题 |采纳率88.2%1. 经过长期的和平谈判,两国最终达成协议
The two countries finally reached an agreement after long and peaceful talks.
2. 请读一下这份介绍今年财务状况的报告
Please read this annual financial report.
3. 要做出这样的实验,就需要付出最大的努力和耐心.
It takes maximum effort and patience to perform such a test.1年前查看全部
- 鲁滨逊出去航海了几次,分别去了哪些地方,遇到了什么状况?简要概括.
 aoxiang9tian1年前3
aoxiang9tian1年前3 -
 新海盗船长 共回答了22个问题
新海盗船长 共回答了22个问题 |采纳率81.8%从前,有一个人叫鲁滨逊,是个英国人.他喜欢航海和冒险,到过世界上的很多地方,碰到过许多危险,但他一点儿也不畏(wèi)惧,希望走遍天涯海角.有一次,鲁滨逊乘船前往南美洲,途中遇上大风,船上的桅(wéi)杆吹断了,船也...1年前查看全部
- 在标准状况下,1体积水中溶解了700体积NH 3 气,所得溶液的密度为0.9g/cm 3 ,此氨水的物质的量浓度约为(
在标准状况下,1体积水中溶解了700体积NH 3 气,所得溶液的密度为0.9g/cm 3 ,此氨水的物质的量浓度约为( ) A.18.4 mol/L B.20.4 mol/L C.0.0446 mol/L D.31.25 mol/L  1tc7nnkjtivy31年前1
1tc7nnkjtivy31年前1 -
 nixihs 共回答了19个问题
nixihs 共回答了19个问题 |采纳率89.5%假定水为1L,氨气为700L,则:
1L水的质量为:1000mL×1g/mL=1000g,
氨气的物质的量为
700L
22.4L/mol =
700
22.4 mol,氨气的质量为
700
22.4 mol×17g/mol=
17×700
22.4 g
所以氨水的体积为:
1000g+
17×700
22.4 g
900g/L =
224+17×7
9×22.4 L,
故氨水的物质的量浓度为
700
22.4 mol
224+17×7
9×22.4 L =18.4 mol/L,
故选A.1年前查看全部
- .影响财务风险的因素,主要有( ) A.资本供求状况的变化 B.利率的变动 C.盈利能力的变动 D.资本结构
 serene2131年前1
serene2131年前1 -
 skylove7000 共回答了17个问题
skylove7000 共回答了17个问题 |采纳率94.1%B1年前查看全部
- 标准状况下CO2气体的密度是1.96g/L,求
标准状况下CO2气体的密度是1.96g/L,求
CO2气体的相对分子质量.
相同条件下,CO2气体对H2的相对密度.
都要有过程
 白风衣不白1年前1
白风衣不白1年前1 -
 arongao 共回答了22个问题
arongao 共回答了22个问题 |采纳率81.8%CO2气体的相对分子质量=1.96×22.4=44
相同条件下,CO2气体对H2的相对密度=44/2=221年前查看全部
- 在标准状况下,112ml气态氮的氧化物质量为0.38g.该氧化物中氧元素的质量分数是63.10%求该氧化物的化学式
在标准状况下,112ml气态氮的氧化物质量为0.38g.该氧化物中氧元素的质量分数是63.10%求该氧化物的化学式
A NO2 B N2O C N2O5 D N2O3【本人化学实在不好,如有学好化学的的一些方法,也请教教我, renata_yu1年前1
renata_yu1年前1 -
 tsui_shine 共回答了19个问题
tsui_shine 共回答了19个问题 |采纳率94.7%该气态氮的氧化物的摩尔质量=m/n=m/(v/Vm)=0.38/(0.112/22.4)=76g/mol
因为氧占其质量分数的63.1%=76*0.631=48所以n=3mol,nN=2mol 所以选D
学好化学的话,做笔记非常重要1年前查看全部
- 已知常温下,硝酸浓度越稀,其还原产物的价态越低.(本题气体数据均已折算至标准状况)
已知常温下,硝酸浓度越稀,其还原产物的价态越低.(本题气体数据均已折算至标准状况)
(1)实验室欲用70%的浓硝酸(密度1.41g/mL)配制1.0mol/L的稀硝酸(密度1.04g/mL)500mL.求:70%浓硝酸的物质的量浓度______mol/L(保留1位小数,下同),配制时需浓硝酸______mL.
(2)将9.65克某铜锌合金加入到足量的浓硝酸中,得到气体 6.72L(假设不含N2O4),则该合金中铜与锌的物质的量之比为______.
(3)向100mL某浓度的硝酸溶液中加入足量的铁粉,铁粉部分溶解,却无气体产生.向反应后的溶液中加入过量的氢氧化钠溶液,过滤后对滤渣进行洗涤后灼烧得到固体物质4.8g,写出铁与硝酸反应的化学方程式______,该硝酸溶液的物质的量浓度______.
(4)将13克锌加入到200mL 3.6mol/L的硝酸溶液中,锌全部溶解,得到无色气体2.464L(已知常温下N2O3为液体),测得反应后的溶液pH=0(假设反应前后溶液体积无变化).取少量反应后的溶液加入足量的氢氧化钠溶液并加热,无刺激性气味的气体生成.试求该无色气体的组成及其物质的量. 扭曲的小圈儿1年前1
扭曲的小圈儿1年前1 -
 83648364 共回答了19个问题
83648364 共回答了19个问题 |采纳率84.2%解题思路:(1)根据c=[1000ρw/M]计算浓硝酸的浓度,根据稀释定律计算所需浓硝酸的体积;
(2)6.72LNO2的物质的量为0.3mol,设Cu为xmol,Zn为ymol,根据质量9.65g与生成NO2的物质的量0.3mol列式计算;
(3)铁粉部分溶解,说明生成Fe(NO3)2,却无气体产生说明即生成NH4NO3;
(4)由加入NaOH没有刺激性气体产生,得到没有生成NH3,则得到的无色气体为NO、N2,根据原子守恒和得失电子守恒计算物质的量.(1)浓硝酸的物质的量浓度c=[1000ρw/M]=[1000×1.41×70%/63]mol/L=15.7 mol/L,
由稀释定律可得:15.7 mol/L×V浓硝酸 =1.0mol/L×500mL,解得:V浓硝酸 =31.8ml,
故答案为:15.7;31.8;
(2)标准状况下,6.72LNO2的物质的量为[6.72L/22.4L/mol]=0.3mol,设Cu为xmol,Zn为ymol,则
①xmol×64g/mol+ymol×65g/mol=9.65g
②2xmol+2ymol=0.3mol,
①②联立解得:x=0.1,y=0.05,
因此该合金中铜与锌的物质的量之比为0.1mol:0.05mol=2:1,
故答案为:2:1;
(3)铁粉部分溶解,说明生成Fe(NO3)2,却无气体产生说明即生成NH4NO3,所以方程式为10HNO3+4Fe=4Fe(NO3)2+NH4NO3+3H2O,
再加NaOH,Fe(NO3)2都转化成Fe(OH)2,并进一步转化成Fe(OH)3,再灼烧,则生成Fe2O3为4.8g,Fe2O3的物质的量为[4.8g/160g/mol]=.03mol,
所以Fe为0.03mol×2=0.06mol,HNO3为0.06mol×[10/4]=0.15mol,因此该硝酸溶液的物质的量浓度为[0.15mol/0.1L]=1.5mol/L,
故答案为:10HNO3+4Fe=4Fe(NO3)2+NH4NO3+3H2O;1.5mol/L;
(4)13g锌的物质的量为[13g/65g/mol]=0.2mol,2.464L气体共[2.464L/22.4L/mol]=0.11mol,HNO3的物质的量为0.2L×3.6mol/L=0.72mol,测得反应后的溶液pH=0,则剩余H+的物质的量为1mol/L×0.2L=0.2mol,因此有0.72mol-0.2mol=0.52mol硝酸发生了反应,
由加入NaOH没有刺激性气体产生,得到没有生成NH3,NO2为红棕色气体,因此得到的无色气体为NO、N2;
化学方程式为20Zn+52HNO3=20Zn(NO3)2+26H2O+10NO(g)+N2(g),
因此无色气体为NO 0.1mol和N2 0.01mol,
答:无色气体有NO和N2组成,NO 0.1mol,N2 0.01mol.点评:
本题考点: 化学方程式的有关计算;物质的量浓度的相关计算.
考点点评: 本题考查了化学方程式的计算,侧重于化学性质、原子守恒、电荷守恒的应用,题目难度较大,熟悉物质的性质及物质之间的转化是解题的关键.1年前查看全部
- (2010•安徽)11月22日,某地理研究性学习小组在观测房屋采光状况时,发现甲楼阴影恰好遮住乙楼三层中部(如图所示),
(2010•安徽)11月22日,某地理研究性学习小组在观测房屋采光状况时,发现甲楼阴影恰好遮住乙楼三层中部(如图所示),在甲楼顶层GPS测得纬度为31.8366°、经度为117.2179°、高度为96m.回答7~8题.

7.隔25小时再次观测时,甲楼阴影可遮挡乙楼( )
8.此后一个月内( )
A.法国进入冷饮畅销期
B.广东省进入雨季
C.澳大利亚播种冬小麦
D.云南省昼短夜长 junehorse1年前1
junehorse1年前1 -
 百合预 共回答了19个问题
百合预 共回答了19个问题 |采纳率89.5%解题思路:主要考查了太阳直射点的回归运动,11月22日,太阳直射点位于南半球,此后一个月内,太阳直射点位于南半球并向南回归线移动,此时北半球为冬季,由此判断地理现象的正确性.A、北半球夏半年,法国冷饮畅销,故不符合题意;
B、北半球夏半年,广东省进入雨季,故不符合题意;
C、澳大利亚播种季节为北半球春季,故不符合题意;
D、云南省昼短夜长为北半球冬季,故正确.
故选:D.点评:
本题考点: 地球公转的方向、轨道、周期和速度.
考点点评: 本题难度适中,属于知识性试题,解题的关键是掌握太阳直射点的回归运动及地理现象的判断.1年前查看全部
- 现有Na2CO3和NaHCO3的混合物与100ml 3mol/L的盐酸恰好完全反应,产生标准状况下4.48LCO2气体.
现有Na2CO3和NaHCO3的混合物与100ml 3mol/L的盐酸恰好完全反应,产生标准状况下4.48LCO2气体.计算混合物中Na2CO3和NaHCO3的物质的量是多少
请把过程写的仔细一些 戴银镯的丫头1年前0
戴银镯的丫头1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 标准状况下 0.2g氢气于2.8g氮气混合气体 体积 密度分别是多少?
标准状况下 0.2g氢气于2.8g氮气混合气体 体积 密度分别是多少?
只要公式和带入数值 不用算 lz_20081年前3
lz_20081年前3 -
 我是一个大西瓜 共回答了18个问题
我是一个大西瓜 共回答了18个问题 |采纳率83.3%0.2g氢气物质的量n1 = 0.2/2 = 0.1 mol
2.8g氮气物质的量n2 = 2.8/28 = 0.1 mol
一共:0.1+0.1 = 0.2mol
标准状况下体积:0.2*22.4 = 4.48 L
密度:(0.2+2.80/4.48 = 0.67g/L1年前查看全部
- (2011•株洲模拟)如图是小汽车上一个显示车门关闭状况的电路,每个车门相当于一个开关,D是一个功率很小的发光二极管,把
(2011•株洲模拟)如图是小汽车上一个显示车门关闭状况的电路,每个车门相当于一个开关,D是一个功率很小的发光二极管,把它装在仪表盘上作指示灯.当所有车门都关闭时,指示灯不发光,只要有一个车门未关闭时,指示灯就发光.下列电路图正确的是( )
A.
B.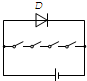
C.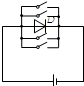
D.
 三十之后是tt1年前1
三十之后是tt1年前1 -
 修道院cc 共回答了19个问题
修道院cc 共回答了19个问题 |采纳率84.2%解题思路:根据题意可以知道,四个车门中只要有一个门没关好,也就是说只要一个开关断开,指示灯就发光,开关全部闭合,灯泡不发光,对各选项逐一分析.A、当开关都闭合时发光二极管被短路不发光,当任何一个开关断开时发光二极管不会被短路灯泡发光,符合题意;
B、任何一个开关断开时发光二极管会发光,当四个门都闭合时发光二极管不发光,但会造成电源短路,不符合题意;
C、闭合任何一个开关发光二极管都会短路、不发光、且造成电源短路,当四个开关都断开时发光二极管发光,不符合题意;
D、闭合任何一个开关发光二极管都会短路、不发光,当四个开关都断开时发光二极管发光,不符合题意.
故选A.点评:
本题考点: 电路图设计.
考点点评: 此类题目是结合开关在电路中的作用,进行实际分析,要根据题意进行理解.1年前查看全部
- 化学中标准状况与非标准状况的转换公式
 davyhuang1年前1
davyhuang1年前1 -
 superloverkiki 共回答了16个问题
superloverkiki 共回答了16个问题 |采纳率87.5%克拉珀龙方程式PV=nRT
P表示压强,单位Pa;
V表示气体体积,单位立方米;
n表示物质的量,单位mol;
T表示热力学温度,单位K(开尔文);
R表示气体常数,R=8.314帕米3/摩尔·K.
将物质的各项性质转换为上述标准单位即可
推论:
1)同温同压时:①V1:V2=n1:n2=N1:N2
②ρ1:ρ2=M1:M2
③ 同质量时:V1:V2=M2:M1
(2)同温同体积时:④ p1:p2=n1:n2=N1:N2
⑤ 同质量时:p1:p2=M2:M1
(3)同温同压同体积时:⑥ ρ1:ρ2=M1:M2=m1:m2
如果你是学习高中化学,常用的是下面的推论
如果你学物理或者物化,上面的克拉伯龙方程比较实用,当然条件简单的话也可以用下面的推论1年前查看全部
- 标准状况下,5.6L某气体的质量为11g,其摩尔质量是_____
 hntianlin11年前1
hntianlin11年前1 -
 小妖人 共回答了14个问题
小妖人 共回答了14个问题 |采纳率57.1%44g/mol
气体的物质的量是n=V/Vm=5.6/22.4=0.25mol
摩尔质量M=m/n=11/0.25=44g/mol1年前查看全部
- 标准状况下,在四个干燥的烧瓶中分别充入标准状况下,在四个干燥的烧瓶中分别充入
标准状况下,在四个干燥的烧瓶中分别充入标准状况下,在四个干燥的烧瓶中分别充入
标准状况下,在四个干燥的烧瓶中分别充入:①纯净的氨气 ②混有1/3体积空气的氯化氢气体 ③纯净的NO2气体 ④混有少量O2的NO2气体,然后各做喷泉实验.实验后,四个烧瓶中溶液的物质的量浓度大小关系是?(假设溶质不扩散) 请说明计算过程
请务必分析每个烧瓶内的变化以及最终结果!
答案是1=2=3>4,无法理解 九月的常春藤1年前3
九月的常春藤1年前3 -
 bluetu 共回答了11个问题
bluetu 共回答了11个问题 |采纳率72.7%① = ② = ③ > ④
①②③都是消耗的气体体积与形成溶液的体积相同;浓度相同.
④消耗的气体体积中只有部分得到溶质(O2 + 4NO2 + 2H2O = 4HNO3)1年前查看全部
- 标准状况下,5.6升的氢气所含的分子数与原子数为多少?
 hgdfjhk1年前3
hgdfjhk1年前3 -
 西街长安 共回答了19个问题
西街长安 共回答了19个问题 |采纳率89.5%n=5.6/22.4=0.25mol分子
0.5mol原子1年前查看全部
- 甲图中阴影表示水稻种植业的主要分布范围,乙图表示甲图中相应区域的农业生产状况,回答2题。
甲图中阴影表示水稻种植业的主要分布范围,乙图表示甲图中相应区域的农业生产状况,回答2题。

小题1:关于水稻种植业的叙述,正确的是( )
小题2:乙图所表示的甲图中相应地区的农业地域类型是( )A.主要分布在西亚和中亚 B.主要生产玉米、小麦等谷物 C.以家庭经营为主,单产低,商品率高 D.是精耕细作的集约农业,需投入大量劳动力 A.商品谷物农业 B.乳畜业 C.混合农业 D.水稻种植业  魔咯叉1年前1
魔咯叉1年前1 -
 qiuling_wang 共回答了11个问题
qiuling_wang 共回答了11个问题 |采纳率90.9%小题1:D
小题2:C
本题考查世界主要的农业地域类型。
小题1:A项水稻种植业主要分布于东亚、东南亚和南亚;错误;B项水稻种植业主要生产水稻;错误;C项以家庭经营为主,精耕细作,故单产高,商品率低;错误。选D项。小题2:乙图所示种植业和养殖业并重,为混合农业。1年前查看全部
- (2013•黄冈模拟)已知通常状况下甲、乙、丙、丁等为气体单质,A、B、C、D、E、F、G、H等为化合物,其中A、B、E
(2013•黄冈模拟)已知通常状况下甲、乙、丙、丁等为气体单质,A、B、C、D、E、F、G、H等为化合物,其中A、B、E、G均为气体,C为常见液体.反应①②③都是重要的化工反应,反应④是重要的实验室制取气体的反应.有关的转化关系如下图所示(反应条件均已略去):

请回答下列问题:
(1)反应④的化学方程式为2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O△ .2NH4Cl+Ca(OH)2.
CaCl2+2NH3↑+2H2O△ .
(2)B和E在一定条件下可发生反应,这是一个具有实际意义的反应,可消除E对环境的污染,该反应氧化产物与还原产物的物质的量之比为______.
(3)0.1mol•L-1A溶液和0.1mol•L-1B溶液等体积混合,溶液呈______性,原因是______(用离子方程式说明).
(4)请设计实验检验D晶体中的阳离子:______.
(5)pH相同的A、D、H三种溶液,由水电离出的c(OH-)的大小关系是(用A、D、H表示):______.
(6)向一定量的Fe、FeO、Fe3O4的混合物中,加入1mol•L-1A的溶液100mL,恰好使混合物全部溶解,且放出336mL(标准状况下)的气体,向所得溶液中加入KSCN溶液,溶液无红色出现;若取同质量的Fe、FeO、Fe3O4混合物,加入1mol•L-1H溶液,也恰好使混合物全部溶解,且向所得溶液中加入KSCN溶液,溶液也无红色出现,则所加入的H溶液的体积是______mL. 撅起嘴吻你1年前1
撅起嘴吻你1年前1 -
 fokistar 共回答了14个问题
fokistar 共回答了14个问题 |采纳率92.9%解题思路:C为常见液体,应为H2O,则丙、丁应为H2、O2中的物质,而B能和丙反应生成C,说明B应为氢化物,则丁为H2,丙为O2,由反应①②③可知,单质乙所含元素存在多种化合价,且E、G都为氧化物,其中G能与水反应生成E,说明发生氧化还原反应,则可知乙为N2,B为NH3,E为NO,G为NO2,H为HNO3,反应④是重要的实验室制取气体的反应,且生成NH3,应为NH4Cl和Ca(OH)2的反应,则D为NH4Cl,F为Ca(OH)2,I为CaCl2,则甲为Cl,A为HCl,结合对应物质的性质以及题目要求解答该题.C为常见液体,应为H2O,则丙、丁应为H2、O2中的物质,而B能和丙反应生成C,说明B应为氢化物,则丁为H2,丙为O2,由反应①②③可知,单质乙所含元素存在多种化合价,且E、G都为氧化物,其中G能与水反应生成E,说明发生氧化还原反应,则可知乙为N2,B为NH3,E为NO,G为NO2,H为HNO3,反应④是重要的实验室制取气体的反应,且生成NH3,应为NH4Cl和Ca(OH)2的反应,则D为NH4Cl,F为Ca(OH)2,I为CaCl2,则甲为Cl,A为HCl,
(1)反应④为实验室制备氨气的反应,方程式为2NH4Cl+Ca(OH)2
△
.
CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2
△
.
CaCl2+2NH3↑+2H2O;
(2)B为NH3,E为NO,由题给信息可知反应的方程式为4NH3+6NO=5N2+6H2O,由方程式可知氧化产物与还原产物的物质的量之比为2:3,故答案为:2:3;
(3)0.1mol•L-1A溶液和0.1mol•L-1B溶液等体积混合,反应生成NH4Cl,为强酸弱碱盐,水解呈酸性,方程式为NH4++H2O⇌NH3•H2O+H+,
故答案为:酸;NH4++H2O⇌NH3•H2O+H+;
(4)D为NH4Cl,NH4+的检验是利用气体法,即取一试管加入适量的D晶体,然后加入氢氧化钠溶液,加热,在试管口放置湿润的红色石蕊试纸,若试纸变蓝,说明D中含有NH4+,故答案为:取一试管加入适量的D晶体,然后加入氢氧化钠溶液,加热,在试管口放置湿润的红色石蕊试纸,若试纸变蓝,说明D中含有NH4+;
(5)pH相同的HCl、NH4Cl、HNO3,由于HCl、HNO3抑制水的电离,NH4Cl因水解而促进水的电离,则pH相同时由水电离出的c(OH-)的大小关系是D>A=H,
故答案为:D>A=H.
(6)向一定量的Fe、FeO、Fe3O4的混合物中,加入1mol•L-1HCl的溶液100mL,恰好使混合物全部溶解,且放出336mL(标准状况下)的气体,向所得溶液中加入KSCN溶液,溶液无红色出现,说明溶液溶质为FeCl2,由Cl元素守恒可知n(FeCl2)=0.05mol,同时转移电子为2×[0.336L/22.4L/mol]=0.03mol,
若取同质量的Fe、FeO、Fe3O4混合物,加入1mol•L-1HNO3溶液,也恰好使混合物全部溶解,且向所得溶液中加入KSCN溶液,溶液也无红色出现,则生成0.05molFe(NO3)2,同时生成NO[0.03mol/5−2]=0.01mol,由N元素守恒可知需要的HNO3物质的量为0.05mol×2+0.01mol=0.11mol,则硝酸的体积为[0.11mol/1mol/L]=0.11L=110mL,
故答案为:110.点评:
本题考点: 无机物的推断.
考点点评: 本题考查无机物的推断,侧重于学生的分析能力和计算能力的考查,为高考常见题型,注意把握题目推断的突破口,以C和反应的转化关系采用逆推的方法进行推断,题目难度较大.1年前查看全部
- 取标准状况下2.24L某气态烃置于密闭容器中,再通入足量O2,用电火花点燃,燃烧产物的定量测定实验数据如下
取标准状况下2.24L某气态烃置于密闭容器中,再通入足量O2,用电火花点燃,燃烧产物的定量测定实验数据如下
烃→(燃烧)燃烧产物→(浓H2SO4)增重9g→(碱石灰)增重17.6g
请回答下列问题
(1)该烃的分子式为_______
(2)写出该烃的所有同分异构体的结构简式_____________________________ 不上望京楼1年前3
不上望京楼1年前3 -
 冷傲天骄 共回答了26个问题
冷傲天骄 共回答了26个问题 |采纳率96.2%解析:
(1)烃的燃烧方程式:
CxHy + (x+y/4)O2 ―(点燃)→ xCO2 + (y/2)H2O
浓H2SO4为干燥剂,增重9g为水的质量,
从而得到水的物质的量 = 9g / 18g/mol = 0.5mol
水中的H元素与水物质的量比 = 2:1,所以H元素物质的量 = 0.5mol*2 = 1mol
氢元素全部来源于烃.
碱石灰增重17.6g为CO2质量,
从而得到CO2的物质的量 = 17.6g / 44g/mol = 0.4mol
CO2中的C元素与CO2物质的量比 = 1:1,所以C元素物质的量 = 0.4mol*1 = 0.4mol
碳元素全部来源于烃,
所以C:H物质的量比 = 0.4mol:1mol = 4:10
所以该烃为C4H10
(2)可能的结构简式:
正丁烷:CH3-CH2-CH2-CH3
异丁烷(2-甲基丙烷):CH3-CH-CH3
|
CH31年前查看全部
- 镁条有一部分被氧化,用这种镁条0.4克与足量稀盐酸反应,在标准状况下收集到0.336 升氢气.求此
镁条有一部分被氧化,用这种镁条0.4克与足量稀盐酸反应,在标准状况下收集到0.336 升氢气.求此
镁条有一部分被氧化,用这种镁条0.4克与足量稀盐酸反应,在标准状况下收集到0.336
升氢气.求此镁条的纯度 ljyyyyyyy1年前1
ljyyyyyyy1年前1 -
 ggld096c 共回答了15个问题
ggld096c 共回答了15个问题 |采纳率93.3%Mg+2HCl=H2+MgCl2
24 22.4
X 0.336
24/X=22.4/0.336 x=0.36g
0.36/0.4X100%=90%1年前查看全部
- 标准状况下 44.8L的二氧化碳质量及物质质量是
 hhej11131年前1
hhej11131年前1 -
 zz灌水专用之K 共回答了10个问题
zz灌水专用之K 共回答了10个问题 |采纳率90%物质的量 n = V/Vm = 44.8 L ÷ 22.4 L/mol = 2 mol
质量 m = n*M = 2 mol × 44 g/mol = 88 g1年前查看全部
- 将生长状况相同的轮藻叶片分成4等份,在不同的温度下先暗处理1h,再光照lh(光照强度相同),前后共两小时。得到如下的数据
将生长状况相同的轮藻叶片分成4等份,在不同的温度下先暗处理1h,再光照lh(光照强度相同),前后共两小时。得到如下的数据,以下说法正确的是  [ ]
[ ]A.催化轮藻呼吸作用的酶的最适温度约为29℃
B.第三组轮藻释放的氧气量最多
C.第四组轮藻光合作用制造的有机物总量为2mg
D.四个组中的轮藻光合作用强度都大于呼吸作用强度 x8zd4p1年前1
x8zd4p1年前1 -
 yuning0511 共回答了26个问题
yuning0511 共回答了26个问题 |采纳率96.2%ABD1年前查看全部
- 在标准状况下,0.5mol任何气体的体积都约为______.
 stockking11211年前3
stockking11211年前3 -
 cjppbb 共回答了24个问题
cjppbb 共回答了24个问题 |采纳率91.7%解题思路:标准状况气体摩尔体积为22.4L/mol,结合n=
计算得到.V Vm 在标准状况下,气体摩尔体积为22.4L/mol,0.5mol任何气体的体积都约11.2L,故答案为:11.2L.
点评:
本题考点: 气体摩尔体积.
考点点评: 本题考查了气体摩尔体积的概念分析判断,掌握实质是关键,题目较简单.1年前查看全部
- 等于零的状况,k≠i 完全不会啊啊啊啊啊,大神跟我讲解下,老师自己都讲昏了 线性代数 高数
 cdytuo1年前1
cdytuo1年前1 -
 lddfxx 共回答了10个问题
lddfxx 共回答了10个问题 |采纳率90%第一个讲的是,一行的元素分别乘以本身这一行元素的代数余子式的和,结果等于行列式的值,乘以其它行元素的代数余子式的和,结果等于0.
第一个讲的是,一列的元素分别乘以本身这一列元素的代数余子式的和,结果等于行列式的值,乘以其它列元素的代数余子式的和,结果等于0.1年前查看全部
- 在标准状况下,4.4LCH4和C2H4的混合气体的质量是4.6g,在混合气体中CH4的质量是1.2g,C2H4的体积是多
在标准状况下,4.4LCH4和C2H4的混合气体的质量是4.6g,在混合气体中CH4的质量是1.2g,C2H4的体积是多少升?
 jhlh1年前1
jhlh1年前1 -
 菩_萨_蛮 共回答了15个问题
菩_萨_蛮 共回答了15个问题 |采纳率86.7%1.2g CH4 其物质的量n=1.2g÷16g/mol其体积V=22.4L/mol×n=1.68L
说以C2H4的体积=4.4-1.68=2.721年前查看全部
- 标准状况下,在O3发生器中装入100MLO2,最后体积变为95ML.则最终状态时,混合气体(O2和03)的密度在标准状况
标准状况下,在O3发生器中装入100MLO2,最后体积变为95ML.则最终状态时,混合气体(O2和03)的密度在标准状况下是--- 504
 玲珑硕桃1年前2
玲珑硕桃1年前2 -
 xinxian_ 共回答了12个问题
xinxian_ 共回答了12个问题 |采纳率83.3%100mlO2的质量为0.1/22.4*32
密度=0.1/22.4*32/95=0.001504759g/ml=1.504kg/m3
质量是不便的,体积已经知道,密度就可以算了!11年前查看全部
- 标准状况下,将44.8升hcl溶于100毫升水中,所得盐酸的密度为1.153克每毫升,其物质的量
标准状况下,将44.8升hcl溶于100毫升水中,所得盐酸的密度为1.153克每毫升,其物质的量
度是多少? apple001xx1年前1
apple001xx1年前1 -
 赤裸男孩 共回答了24个问题
赤裸男孩 共回答了24个问题 |采纳率91.7%n(HCl) = 44.8/22.4 = 2 mol
m(溶液) = 100 + 73 = 173 g
V(溶液) = 173/1.153 = 150 mL
c(HCl) = 2/0.15 = 13.3 mol/L1年前查看全部
- 标准状况下,5.1克氨气所具有的体积是 多少
 tushidong1年前2
tushidong1年前2 -
 尼沙比亚 共回答了16个问题
尼沙比亚 共回答了16个问题 |采纳率87.5%标准状态下,1mol理想气体体积22.4L,而5.1gNH3物质的量为0.3摩尔,所以最后答案为22.4*0.3=6.72升1年前查看全部
- 标准状况下游H2和O2的混合气体44.8升,点燃完全反应后恢复至原状况余气体11.2升
标准状况下游H2和O2的混合气体44.8升,点燃完全反应后恢复至原状况余气体11.2升
求原混气中H2和O2各占多少升? 下相男人1年前2
下相男人1年前2 -
 zp2zp 共回答了15个问题
zp2zp 共回答了15个问题 |采纳率100%余气体11.2升是过量的H2或O2
1.如果H2过量:
H2与O2反应的体积比是2:1
那么参加反应的H2有(44.8-11.2)*2/3=22.4L
O2有11.2L
原来有H2:33.6L ; O2 11.2L
2.如果O2过量
那么原来有H2 22.4L; O2 22.4L1年前查看全部
- 食用菌固体培养的发展状况?
 杜心1年前2
杜心1年前2 -
 abc90 共回答了18个问题
abc90 共回答了18个问题 |采纳率94.4%食用菌本来就是用固体培养的,如果你字没打错的话,你问的这个问题就是来闹着玩的.食用种在菌种培养的时候会有两种培养方式,一种就是我们常规的培养方式(也就是固体培养),另一种才是液体培养,前着的就不用说了,一般从事本行业的人都会.而液体培养方式才是要有一定条件的,需要大量的专业设备和相当的专业技术,现在专业化的食用菌工厂,大部分都是用的液体菌种,关于液体菌种的培养前景那就不用说了,可谓是一片光明大道.固体的发展作为传统的生产方式,他是稳定的,而且是一直要发展下去的必不可少的一种生产方式.1年前查看全部
- 在标准状况下,11.2LNO与11.2LO2混合后气体分子数为0.75NA
在标准状况下,11.2LNO与11.2LO2混合后气体分子数为0.75NA
为什么不对啊? 一江春雨半船风1年前2
一江春雨半船风1年前2 -
 adam_de 共回答了16个问题
adam_de 共回答了16个问题 |采纳率93.8%2NO+O2=2NO2
标况下NO2是液态,而非气态.
二氧化氮 (NO2)在21.1℃温度时为红棕色刺鼻气体.有毒气体.密度比空气大易液化.易溶于水;在21.1℃以下时呈暗褐色液体.在-ll℃以下温度时为无色固体,加压液体为四氧化二氮.分子量92,熔点-11.2℃,沸点 21.2℃,蒸气压101.3lkPa(2l℃),溶于碱、二硫化碳和氯仿,易溶于水.性质较稳定.1年前查看全部
- 在标准状况下,1体积H2和多少体积CO气体混合,才能配成密度为1g/L的混合气体?
在标准状况下,1体积H2和多少体积CO气体混合,才能配成密度为1g/L的混合气体?
麻烦详细过程.. 234lkjlk23jlkfj1年前1
234lkjlk23jlkfj1年前1 -
 我是何未 共回答了18个问题
我是何未 共回答了18个问题 |采纳率88.9%解假设和x体积的CO混合密度为1g/L则:
CO的质量为x/22.4*28
H2的质量为1/22.4*2
所以(1/22.4*2+x/22.4*28)/(1+x)=1
x=3.641年前查看全部
- 取标准状况下含有SO2的废气1升,缓慢通过足量溴水(SO2+Br2+2H2O=2HBr+H2SO4)
取标准状况下含有SO2的废气1升,缓慢通过足量溴水(SO2+Br2+2H2O=2HBr+H2SO4)
在所得溶液中加入过量BaCl2溶液生成白色沉淀,将沉淀过滤,洗条,干燥,称得其质量为0.233g.
问:若在滤液中加入硫酸钠溶液,有白色沉淀生成,说明?
过滤后,一般要用蒸馏水洗涤2-3次,以除去附着在沉淀上的可溶性物质.请说明应通过何种方法证明可溶性物质是否已被除尽?
 清风独钓1年前1
清风独钓1年前1 -
 忍不住SO浮出水面 共回答了27个问题
忍不住SO浮出水面 共回答了27个问题 |采纳率85.2%若在滤液中加入硫酸钠溶液,有白色沉淀生成,由于氯化钡是大过量的所以生成白色沉淀是很正常的,要是说明的话只能是SO2已经被完全吸收.
附着在沉淀上的可溶性物质可能是HBr,H2SO4这种酸可以通过PH试纸直接测下PH就行.另外还有可能有氯化钡残留如果非要证明它的存在只能用钡离子的焰色反应了,因为不能再继续加硫酸钠生成沉淀了,因为这样你就白洗涤了1年前查看全部
- 将0.1mol铜与40ml10mol/LHNO3充分反应后,溶液中含有amolH+,由此可知生成的气体标准状况下的体积是
将0.1mol铜与40ml10mol/LHNO3充分反应后,溶液中含有amolH+,由此可知生成的气体标准状况下的体积是多少?
 lclclc009101年前2
lclclc009101年前2 -
 渔阳鼓动 共回答了20个问题
渔阳鼓动 共回答了20个问题 |采纳率80%这题可以运用守恒思想:硝酸在反应中起两个作用:一是显酸性,一是显氧化性.则可以得到:反应的硝酸=显酸性的 + 显氧化性的
显酸性的硝酸,也就是生成盐的硝酸.根据对应关系可以计算:
Cu------2NO3- -----2HNO3
1------------------------2
0.1mol-----------------x=0.2mol
因此,被还原的硝酸=0.04*10-a-0.2=(0.2-a) mol
又知,10mol/LHNO3浓硝为浓硝酸,还原产物为NO2.
则NO2的物质的量=被还原的硝酸=(0.2-a) mol
所以体积=22.4*(0.2-a)1年前查看全部
- 同时在的两棵杨树,他们的生长状况有明显的不同:一棵树高大,另一棵树矮小 ,为什么?
 李不拉多1年前1
李不拉多1年前1 -
 走or不走 共回答了19个问题
走or不走 共回答了19个问题 |采纳率89.5%杨树品种间的差异是非常巨大的,不同的品种在长势、树形、抗病性、材质、寿命、抗虫性方面具有显著不同.现在速生杨里边“107”“108”是两个最优秀的品种,表现为生长迅速、树干通直、材质细腻,老品种隔里边毛白杨很不错,但要防止蛀干虫害,否则会影响树干通直和材质,也影响美化效果.1年前查看全部
- 在标准状况下,6.72L的甲烷和CO的混合气体的质量为6g,求混合气体中有甲烷的物资的量,CO的质量
 shanghaicw1年前1
shanghaicw1年前1 -
 flowaters 共回答了19个问题
flowaters 共回答了19个问题 |采纳率94.7%n(CH4)=6.72/22.4=0.3mol,m(CH4)=0.3 x 16=4.8g m(CO)=6-4.8=1.2g,n(CO)=1.2/28=3/70 mol1年前查看全部
- 在含有碳酸钠和硫酸钠的溶液里加入足量的氯化钡溶液,生成43g沉淀.把沉淀用足量的盐酸处理,在标准状况下放出2.24L二氧
在含有碳酸钠和硫酸钠的溶液里加入足量的氯化钡溶液,生成43g沉淀.把沉淀用足量的盐酸处理,在标准状况下放出2.24L二氧化碳气体,则原溶液中含有碳酸钠和硫酸钠的物质的量的比值是多少.
 lili3101年前1
lili3101年前1 -
 zhutous 共回答了23个问题
zhutous 共回答了23个问题 |采纳率87%解题思路:沉淀43g为BaCO3、BaSO4的质量,沉淀用盐酸溶解,碳酸钡反应生成二氧化碳,根据碳元素守恒计算n(Na2CO3),进而计算m(BaSO4),再计算n(BaSO4),根据硫元素守恒计算n(Na2SO4),据此解答.沉淀43g为BaCO3、BaSO4的质量,沉淀用盐酸溶解,碳酸钡反应生成二氧化碳,根据碳元素守恒:n(Na2CO3)=n(BaCO3)=n(CO2)=[2.24L/22.4L/mol]=0.1mol,
故m(BaSO4)=43g-0.1mol×197g/mol=23.3g,n(BaSO4)=[23.3g/233g/mol]=0.1mol,根据硫元素守恒:n(Na2SO4)=n(BaSO4)=0.1mol,
故n(Na2CO3):n(Na2SO4)=0.1mol:0.1mol=1:1,
答:原溶液中含有碳酸钠和硫酸钠的物质的量的比值是1:1.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物计算,难度不大,注意利用守恒思想进行计算.1年前查看全部
- 标准状况下,盛满HCl的烧杯与用排空气法收集的HCl(HCl占烧杯体积的75%)将烧杯倒置于水中.求其物质的量浓度关系.
 烟_云1年前1
烟_云1年前1 -
 马修-巴尼 共回答了18个问题
马修-巴尼 共回答了18个问题 |采纳率77.8%设烧杯的体积为v,则盛满HCl的烧杯的物质的量为v/22.4mol,则HCl的物质的量浓度为(v/22.4)/v=1/22.4mol/L.
排空气法收集的也是这样计算,只是HCl的物质的量变了.1年前查看全部
- 现有化合物A和三种单质B、C、D,通常状况下,A、D是无色气体,B是红色非金属,C是黑色粉末,现在进行下列实验:1 在D
现有化合物A和三种单质B、C、D,通常状况下,A、D是无色气体,B是红色非金属,C是黑色粉末,现在进行下列实验:1 在D中点燃B,生成一中白色的固体物质;2 在高温下炙热的C与A反应,生成一中无色气体;3 C在D中燃烧时在一定条件下可得到一种和2 的生成物相同的无色气体.
根据以上实验,推断这四种物质(用化学式回答):
A__________B____________C___________D___________. 金陵童话1年前1
金陵童话1年前1 -
 aa一世 共回答了8个问题
aa一世 共回答了8个问题 |采纳率62.5%A______CO2____B______P______C______C_____D_______O2____.1年前查看全部
- 标准状况下,1L氧气的物质的量是多少?1L氢气的呢?它们的分子数分别是?
 神京远1年前1
神京远1年前1 -
 梦醒的风筝 共回答了15个问题
梦醒的风筝 共回答了15个问题 |采纳率80%氧气物质的量是1/22.4mol,分子数为1/22.4mol*NA
氢气物质的量也是1/22.4mol,分子数为1/22.4mol*NA1年前查看全部
- 在标准状况下,1120mL某气体的质量为1.60g,则该气体的相对分子质量为多少?
 路行者1年前1
路行者1年前1 -
 凌蓁儿 共回答了27个问题
凌蓁儿 共回答了27个问题 |采纳率92.6%标准状况下,Vm=22.4mol/l,由题可知
n=v/Vm
=1120ml/(22.4mol/l)
=0.05mol
相对分子质量M=m/n
=1.6g/0.05mol
=8g/mol1年前查看全部
- 在标准状况下1mol的气体有多少个分子?
 云来云起1年前1
云来云起1年前1 -
 liwei0710 共回答了18个问题
liwei0710 共回答了18个问题 |采纳率94.4%任何情况下1mol气体都有NA即阿佛加德罗常数个分子,6.02*10^23是个约数.1年前查看全部
- 标准状况下,A,B两种气态烷烃的混合气体的质量为9.8g,体积为7.84L,相对分子质量A
 fairy_韩雪1年前1
fairy_韩雪1年前1 -
 feelingzdj 共回答了17个问题
feelingzdj 共回答了17个问题 |采纳率94.1%混合气体的物质的量n=V/Vm=7.84L/22.4L/mol=0.35mol
混合气体的平均摩尔质量=m/n=9.8g/0.35mol=28g/mol
则混合气体中一种烷烃的相对分子质量小于28、一种相对分子质量大于28,相对分子质量A1年前查看全部
- 在标准状况下,2.24L的某气态烷烃和具有一个双键的烯烃的混合气体完全燃烧后,将高温下产生的气体缓慢通过浓硫酸,浓硫酸增
在标准状况下,2.24L的某气态烷烃和具有一个双键的烯烃的混合气体完全燃烧后,将高温下产生的气体缓慢通过浓硫酸,浓硫酸增重4.05g,剩余气体通过碱石灰,碱石灰增重6.60g.另再取2.24L标准状况下的该混合气体,将它通入过量的溴水中,溴水增重1.05g.
问:(1)混合气体由哪两种烃组成,写出它们的结构简式.
(2)混合气体中两种烃的体积分数各为多少? 82895721年前0
82895721年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 标准状况下,2.24LH2和C2H2的混合气体所含分子数是多少
 寒冰磐岩1年前1
寒冰磐岩1年前1 -
 sisyx 共回答了17个问题
sisyx 共回答了17个问题 |采纳率76.5%2.24LH2和C2H2的混合气体为0.1mol
0.1mol*6.02*10^23=6.02*10^22
所含分子数是6.02*10^221年前查看全部
- 取含有80g碳酸钙的石灰石与足量的稀盐酸反应,可得到二氧化碳多少克?这些气体在标准状况下的体积是多少升?(已知:标准状况
取含有80g碳酸钙的石灰石与足量的稀盐酸反应,可得到二氧化碳多少克?这些气体在标准状况下的体积是多少升?(已知:标准状况下CO2的密度为1.977g/L)
 吧啦咕噜嗒1年前2
吧啦咕噜嗒1年前2 -
 吮指鸡块 共回答了19个问题
吮指鸡块 共回答了19个问题 |采纳率73.7%解题思路:碳酸钙与盐酸反应,生成氯化钙、水和二氧化碳,由于200g碳酸钙完全反应,可利用碳酸钙的质量根据反应的化学方程式,计算生成气体二氧化碳的质量;
利用V=[m/ρ],根据二氧化碳质量计算出标准状况下气体的体积.设生成二氧化碳的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
80g x
[100/80g=
44
x]
x=35.2g
标准状况下CO2的体积V=[35.2g/1.977g/L]=17.8L
答:可生成二氧化碳气体35.2g;在标准状况下体积为17.8L.
故答案为:35.2g;17.8L.点评:
本题考点: ["根据化学反应方程式的计算"]
考点点评: 本题是根据反应的化学方程式进行的基础计算,需要注意正确的书写格式及完整的步骤,特别是还需要使用质量与体积的关系式计算出气体的体积.1年前查看全部
- 简述半坡氏族时期人们的生活生产状况如何?
 红黄谷1年前1
红黄谷1年前1 -
 似水 共回答了29个问题
似水 共回答了29个问题 |采纳率89.7%半坡人 距今时间:五六千年
地点:陕西西安的半坡村(黄河流域)
作物:粟,(世界最早种植)鱼,肉,蔬菜
工具:磨制的石器,木制的耒耜(lei si )石刀,箭头,鱼钩,骨头制品,补鱼工具
生活;饲养动物,半地穴式房子,彩陶,会防线,织布,制衣1年前查看全部
大家在问
- 1英语翻译他进办公室和商店有什么关系
- 2碘离子不能和哪些物质共存?求解.
- 3天平两托盘上的烧杯中,分别放有50克、溶质质量分数9.8%的稀硫酸,调整天平至平衡后天平左端烧杯中加入4.4g铁锈
- 4不能用P2O5干燥氯化氢气体的原因是:1gP2O5能和237ml(标况)氯化氢气体反应生成两种产物,其中一种是HPO3.
- 5两个刺的左边,念什么字.
- 6妈妈的体重是55千克是爸爸体重12分之11小明体重正好是爸爸体重的2分之1小明体重是多少千克
- 7爸爸妈妈小明三人体重和为142千克,爸爸的体重是小明的3倍,妈妈的体重是小明两倍还多4千克.爸爸妈妈小明三人体重分别是
- 8设光滑曲线y=k(x)过原点,且当x>0时,k(x)>0.对应于[0,x]一段曲线的弧长为(e^x)-1,求k(x).
- 9某地区重视环境保护,绿色植被面积呈上升趋势
- 10Das Wasser ist
- 11AB4型分子,若A分子为氢分子,那B可以是,答案上写的说B元素的最外层电子数应为4,那是不是ABn
- 121.铁的吸氧腐蚀是在中性或弱酸性环境下发生的么?那么如果是碱性呢?
- 13能与氢形成AB4型分子的为什么是硫啊啊啊
- 14写一篇关于demographic structure的英语作文
- 15生物必修一38页第二章自我检测答案
