肼-空气燃料电池是一种碱性电池,该电池放电时,负极的反应为(求快速回)
 liuyuan832022-10-04 11:39:542条回答
liuyuan832022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 戴川子 共回答了15个问题
戴川子 共回答了15个问题 |采纳率93.3%- 负极是肼,发生氧化反应
N2H4 - 4e + 4OH- ——> N2 + H2O
满意请点好评o(∩_∩)o - 1年前
 抗阳 共回答了5个问题
抗阳 共回答了5个问题 |采纳率- 由总反应N2H4+O2=N2↑+2H2O可得:负极反应为N2H4+4OH--4e-=4H2O+N2↑
- 1年前
相关推荐
- (2012•绵阳模拟)铝空气燃料电池具有广阔的应用前景,通常以铝合金作负极,NaOH溶液为电解质溶液.下列说法正确的是(
(2012•绵阳模拟)铝空气燃料电池具有广阔的应用前景,通常以铝合金作负极,NaOH溶液为电解质溶液.下列说法正确的是( )
A.正极的电极反应为O2+2H2O+2e-=4OH-
B.负极的电极反应为Al+3OH---3e-═AI(OH)3↓
C.电池工作过程中,电解液的pH保持不变
D.电池使用时可能析出H2并放热 conkyyang6171年前1
conkyyang6171年前1 -
 latinman 共回答了26个问题
latinman 共回答了26个问题 |采纳率88.5%解题思路:铝空气燃料电池中负极反应为Al+4OH---3e-═AlO2-+2H2O,正极反应为O2+2H2O+4e-=4OH-,总反应为4Al+4OH--+3O2═4AlO2-+2H2O,以此解答该题中A、B、C各项,铝为活泼金属,既能与酸反应,又能与碱反应.A、电解质溶液显碱性或中性,该燃料电极的正极发生反应为:O2 +2H2O+4e-=4OH-,故A错误;
B、铝作负极,负极反应应该是铝失去电子变为铝离子,在氢氧化钠的溶液中铝离子继续与过量的碱反应生成偏铝酸根,因此负极反应为:Al+4OH--3e-=AlO2-+2H2O,故B错误;
C、该电池在碱性条件下消耗了碱,反应式为4Al+3O2+4OH-=4AlO2-+2H2O,溶液pH降低,故C错误;
D、铝能与碱反应生成氢气,反应的离子方程式为2Al+2OH-+2H2O═3H2↑+2AlO2-,该反应为放热反应,故D正确.
故选D.点评:
本题考点: 化学电源新型电池;电极反应和电池反应方程式.
考点点评: 本题考查化学电源新型电池,本题难度不大,注意电极反应式的书写.1年前查看全部
- (2013•河南一模)如图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极.下列叙述中正确的
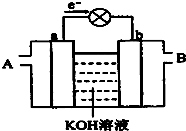 (2013•河南一模)如图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极.下列叙述中正确的是( )
(2013•河南一模)如图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极.下列叙述中正确的是( )
A.A处通入空气,B处通入水煤气
B.a电极的反应式包括:CO+4OH--2e-=CO32-+2H2O
C.a电极发生还原反应,b电极发生氧化反应
D.如用这种电池电镀铜,当镀件增重6.4g,则消耗标准状况下的水煤气2.24L gyaq1年前1
gyaq1年前1 -
 chenxu184587480 共回答了13个问题
chenxu184587480 共回答了13个问题 |采纳率84.6%解题思路:A.燃料电池中,通入燃料的电极失电子、通入氧化剂的电极得电子;
B.a电极上CO和氢气都失电子发生氧化反应;
C.a电极发生氧化反应、b电极发生还原反应;
D.根据转移电子相等进行计算.A.电子的流向可知,电子从a极出来,回到b极,所以a是负极(燃料失电子),b极是正极(O2得电子),故A错误;
B.负极电极反应式:不仅CO失电子,还有H2失电子,CO失电子后变成+4价(以CO2形式存在),而电解质溶液是碱性溶液,所以CO2会与OH-发生反应生成CO32-,故电极反应为:CO+4OH--2e-=CO32-+2H2O,同理可写出H2的反应:H2+2OH--2e-=2H2O,所以漏了H2的反应式,故B错误;
C.a电极是负极,发生氧化反应,b电极是正极,得到电子,发生还原反应,故C错误;
D.如用这种电池电镀铜,当镀件增重6.4gCu,说明n(Cu)=0.1mol.转移n(e-)=0.2mol,1molCO转移2mol e-,1mol H2转移2mol e-,1molCO和H2的混合气体也是转移2mol e-,现增重6.4gCu,转移0.2mol e-,所以消耗CO0.1mol或0.1mol H2或CO和H2的混合气体0.1mol,故D正确;
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池的工作原理及应用,明确电极反应的判断和电极反应式的书写即可解答,易错选项是D,根据转移电子相等计算,题目难度不大.1年前查看全部
- 镁燃料电池作为一种高能化学电源,具有良好的应用前景。下图是镁—空气燃料电池工作原理示意图。下列有关该电池的说法正确的是(
镁燃料电池作为一种高能化学电源,具有良好的应用前景。下图是镁—空气燃料电池工作原理示意图。下列有关该电池的说法正确的是()
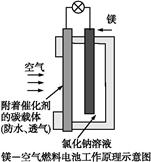
A.该电池Mg作负极,发生还原反应 B.该电池的正极反应式为:O 2 +2H 2 O+4e - =4OH - C.电池工作时,电子通过导线由碳电极流向Mg电极 D.当电路中通过0.2 mol电子时,消耗的O 2 体积为1.12 L  火着呢鸟1年前1
火着呢鸟1年前1 -
 fangashuaia 共回答了21个问题
fangashuaia 共回答了21个问题 |采纳率95.2%B 电解质溶液为NaCl中性溶液,所以正极反应类似吸氧腐蚀的正极反应,为O 2 +2H 2 O+4e - =4OH - ,B正确;负极反应为:2Mg-4e - +4OH - 2Mg(OH) 2 ,Mg被氧化,A错;原电池中,电子由负极流向正极,C错;D中O 2 ...1年前查看全部
- 可用于电动汽车的铝-空气燃料电池,通常以Nacl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极,当以NaOH溶
可用于电动汽车的铝-空气燃料电池,通常以Nacl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极,当以NaOH溶液为电解液时,电池在工作过程中电解液的pH为什么减小?
 andersen1年前2
andersen1年前2 -
 boowahcheung 共回答了18个问题
boowahcheung 共回答了18个问题 |采纳率88.9%铝失去3个电子 消耗4个氢氧根生成偏铝酸根
氧气得到4个电子 才能生成四个氢氧根 所以电池工作过程中消耗的氢氧根比生成的氢氧根多 所以PH减小1年前查看全部
- 铝-空气燃料电池总反应、电极反应.(帮忙在网上查一查,准确的,
 尽力了1年前1
尽力了1年前1 -
 水中望人 共回答了17个问题
水中望人 共回答了17个问题 |采纳率94.1%在碱性溶液总式应该是
4Al+4NaOH+3O2=4NaAlO2+2H2O
负极是Al+(4OH-)-(3e-)=(ALO2-)+2H2O1年前查看全部
- 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运等特点。研究的燃料电池可分为镁—空气燃料电池,
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运等特点。研究的燃料电池可分为镁—空气燃料电池,镁—海水燃料电池,镁—过氧化氢燃料电池,镁—次氯酸盐燃料电池。如图为镁—次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )。
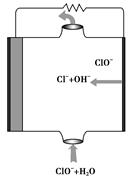
A.放电过程中OH - 移向正极 B.电池的总反应式为Mg+ClO - +H 2 O=Mg(OH) 2 ↓+Cl - C.镁电池中镁均为负极,发生氧化反应 D.镁—过氧化氢燃料电池,酸性电解质中正极反应为:H 2 O 2 +2H + +2e - =2H 2 O  HaiZie1年前1
HaiZie1年前1 -
 qiong3535 共回答了20个问题
qiong3535 共回答了20个问题 |采纳率95%A
根据图像判断反应过程,判断正、负极,正确书写电极反应式。镁燃料电池,镁作负极失电子,产物由电解质溶液决定,若为酸性溶液生成Mg 2 + ,碱性溶液生成Mg(OH) 2 。ClO - 在正极反应,由图可知有Cl - 和OH - 生成,OH - 向负极移动,生成Mg(OH) 2 。1年前查看全部
- 甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图.下列有关叙述正确的是( )
甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图.下列有关叙述正确的是( ) 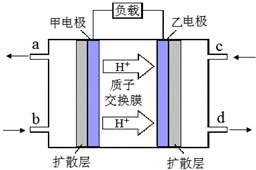
A.H + 从正极区通过交换膜移向负极区 B.负极的电极反应式为:CH 3 OH(l)+H 2 O(l)-6e - =CO 2 (g)+6H + C.d导出的是CO 2 D.图中b、c分别是O 2 、甲醇  ye98711年前1
ye98711年前1 -
 新烟缸 共回答了18个问题
新烟缸 共回答了18个问题 |采纳率100%A.原电池工作时,阳离子移向原电池的正极,故A错误;
B.负极甲醇失电子被氧化,电极方程式为CH 3 OH(l)+H 2 O(l)-6e - =CO 2 (g)+6H + ,故B正确;
C.乙为燃料电池的正极,导入的为空气,氧气在正极被还原生成水,导出的为氮气和水蒸汽,故C错误;
D.图中b、c分别是甲醇、O 2 ,故D错误.
故选B.1年前查看全部
- 天然气-空气燃料电池(电解质溶液是H2SO4)的负极反应式,
 songdm20041年前1
songdm20041年前1 -
 像疯一样 共回答了21个问题
像疯一样 共回答了21个问题 |采纳率95.2%负极:CH4-8e^-+2H2O=CO2+8H^+
正极:2O2+8e^-+8H^+=4H2O
总反应:CH4 + 2O2 = CO2 + 2H2O
分析:正极氧气得到电子变成氧离子,氧离子在酸性条件下结合氢离子生成水.正极消耗氢离子,负极就要生成氢离子,所以负极是甲烷失去电子与水结合生成二氧化碳和氢离子.
希望我的回答能对学习有帮助!1年前查看全部
- 铝-空气燃料电池,通常以NaOH溶液为电解液,铝合金为负极,空气电极为正极.负极反应是生成AlO2-还是Al(OH)3?
 wwq120031年前2
wwq120031年前2 -
 有多少本事 共回答了20个问题
有多少本事 共回答了20个问题 |采纳率90%我觉得应该是偏铝酸根 因为溶液中已经有碱性氢氧根 肯定会转换1年前查看全部
- (2011•南开区二模)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电
(2011•南开区二模)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极.下列说法正确的是( )
A. 电池工作时,电子通过外电路从正极流向负极
B. 以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-═Al(OH)3↓
C. 以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-═4OH-
D. 以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 meatballhuan1年前2
meatballhuan1年前2 -
 欣雨0123 共回答了19个问题
欣雨0123 共回答了19个问题 |采纳率94.7%解题思路:铝空气燃料电池中负极反应为Al+4OH--3e-═AlO2-+2H2O,正极反应为O2+2H2O+4e-=4OH-,总反应为4Al+4OH--+3O2═4AlO2-+2H2O,铝为活泼金属,既能与酸反应,又能与碱反应.A.电池工作时,电子从负极出来经过外电路流到正极,故A错误;
B.铝作负极,负极反应应该是铝失去电子变为铝离子,在氢氧化钠的溶液中铝离子继续与过量的碱反应生成偏铝酸根,因此负极反应为:Al+4OH--3e-=AlO2-+2H2O,故B错误;
C.电解质溶液显碱性或中性,该燃料电极的正极发生反应为:O2 +2H2O+4e-=4OH-,故C正确;
D.该电池在碱性条件下消耗了碱,反应式为4Al+3O2+4OH-=4AlO2-+2H2O,溶液pH降低,故D错误;
故选C.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查化学电源新型电池,注意电极反应式的书写要结合电解质溶液的酸碱性,为易错点.1年前查看全部
- 下列叙述正确的是( ) A.可用于电动汽车的铝-空气燃料电池,通常用NaOH溶液做电解液,其正极反应为:O 2 +2H
下列叙述正确的是( ) A.可用于电动汽车的铝-空气燃料电池,通常用NaOH溶液做电解液,其正极反应为:O 2 +2H 2 O+4e - ═4OH - B.常温下,pH均为5的醋酸和硫酸铝两种溶液中,由水电离出的氢离子浓度均为1×10 -9 mol•L -1 C.溴化钠溶液中加入少量新制氯水充分反应后,再加入少量苯振荡静置后上层颜色变浅,下层颜色变为橙红色 D.导电、缓慢氧化、品红褪色和久置浓硝酸变黄都一定属于化学变化  ebichan1年前1
ebichan1年前1 -
 龙龙9270 共回答了18个问题
龙龙9270 共回答了18个问题 |采纳率100%A、铝-空气燃料电池中,电解质是NaOH溶液,在负极上发生氧化反应,在正极上发生还原反应,通入氧气的一极为原电池的正极,由于溶液呈碱性,发生反应为:O 2 +2H 2 O+4e - ═4OH - ,故A正确;B、pH为5的醋酸溶液...1年前查看全部
- 可用于电动汽车的铝-空气燃料电池,通常用氢氧化钠做电解液,其正极反应是什么
 风纪天天1年前1
风纪天天1年前1 -
 蜜蜂产蜂蜜 共回答了21个问题
蜜蜂产蜂蜜 共回答了21个问题 |采纳率71.4%既然是铝-空气电池,说明正极上是空气中的氧气得电子,电极反应:O2+4e+2H2O==4OH-1年前查看全部
- (2009•张湾区模拟)空气燃料电池具有高效、安全、成本低等许多优点,电池内发生的总反应为:2Zn+O2=2ZnO,下列
(2009•张湾区模拟)空气燃料电池具有高效、安全、成本低等许多优点,电池内发生的总反应为:2Zn+O2=2ZnO,下列关于该种电池的说法错误的是( )
A. 发生的反应属于化合反应
B. 电池是把化学能转化为电能的装置
C. 反应所需的氧气来源于空气
D. 电池废旧后即可丢弃 sunnyjimmy5151年前1
sunnyjimmy5151年前1 -
 人生恰如初见 共回答了16个问题
人生恰如初见 共回答了16个问题 |采纳率93.8%解题思路:A、此反应属于多变一的化学变化,根据化合反应的特点进行分析.
B、电池内发生的是化学变化而生成电能.
C、空气电池就是利用的空气中的氧气.
D、废旧电池会对环境造成污染.A、此反应属于多变一的化学变化,符合化合反应的特点,故此选项错误.
B、电池内发生的是化学变化而生成电能,是化学能转化为电能,故此选项错误.
C、空气电池就是利用的空气中的氧气,预料很易得到,故此选项错误.
D、废旧电池会对环境造成污染,因此不能随意丢弃,故此选项正确.
故选D点评:
本题考点: 物质发生化学变化时的能量变化;空气的成分及各成分的体积分数;废弃金属对环境的污染;反应类型的判定.
考点点评: 此题是对空气电池的有关知识的考查,解题时结合有关的化学常识对所提供的选项进行分析探讨即可.1年前查看全部
- 下图是水煤气(成分为CO、H 2 )、空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中正确的是
下图是水煤气(成分为CO、H 2 )、空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中正确的是
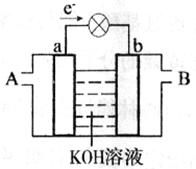
A.A处通入的是空气,B处通入的是水煤气 B.a电极发生还原反应,b电极发生氧化反应 C.如用这种电池电镀铜,待镀金属增重6.4 g,则至少消耗标准状况下的水煤气2.24 L D.a电极的反应式包括:CO+4OH - +2e - =CO 3 2- +2H 2 O  lihbxb1年前1
lihbxb1年前1 -
 Kill_Me 共回答了20个问题
Kill_Me 共回答了20个问题 |采纳率75%C
1年前查看全部
- (2011•南开区二模)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电
(2011•南开区二模)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极.下列说法正确的是( )
A. 电池工作时,电子通过外电路从正极流向负极
B. 以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-═Al(OH)3↓
C. 以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-═4OH-
D. 以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 gxjzy1年前1
gxjzy1年前1 -
 快乐小芽 共回答了23个问题
快乐小芽 共回答了23个问题 |采纳率95.7%解题思路:铝空气燃料电池中负极反应为Al+4OH--3e-═AlO2-+2H2O,正极反应为O2+2H2O+4e-=4OH-,总反应为4Al+4OH--+3O2═4AlO2-+2H2O,铝为活泼金属,既能与酸反应,又能与碱反应.A.电池工作时,电子从负极出来经过外电路流到正极,故A错误;
B.铝作负极,负极反应应该是铝失去电子变为铝离子,在氢氧化钠的溶液中铝离子继续与过量的碱反应生成偏铝酸根,因此负极反应为:Al+4OH--3e-=AlO2-+2H2O,故B错误;
C.电解质溶液显碱性或中性,该燃料电极的正极发生反应为:O2 +2H2O+4e-=4OH-,故C正确;
D.该电池在碱性条件下消耗了碱,反应式为4Al+3O2+4OH-=4AlO2-+2H2O,溶液pH降低,故D错误;
故选C.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查化学电源新型电池,注意电极反应式的书写要结合电解质溶液的酸碱性,为易错点.1年前查看全部
- 图是水煤气(成分为CO、H 2 )空气燃料电池的工作原理示意图,a、b均为惰性电极.下列叙述中正确的是( ) A.A处
图是水煤气(成分为CO、H 2 )空气燃料电池的工作原理示意图,a、b均为惰性电极.下列叙述中正确的是( ) A.A处通人的是空气,B处通人的是水煤气 B.a电极发生还原反应,b电极发生氧化反应 C.a电极的反应式包括:CO+4OH - +2e - =CO 3 2- +2H 2 O D.如用这种电池电镀铜,待镀金属增重6.4g,则至少消耗标准状况下的水煤气2.24L 
 hqltxq1年前1
hqltxq1年前1 -
 三无居 共回答了15个问题
三无居 共回答了15个问题 |采纳率93.3%A.由电子流向可知a为负极,b为正极,则A处通入水煤气,B处通入空气,故A错误;
B.a为负极,a电极发生氧化反应,b为正极,b电极发生还原反应,故B错误;
C.a电极的反应式包括:CO+4OH - -2e - =CO 3 2- +2H 2 O,故C错误;
D.如用这种电池电镀铜,待镀金属增重6.4g,n=0.1mol,得电子0.2mol,需要水煤气0.1mol,体积为2.24L,故D正确.
故选D.1年前查看全部
- 铝,空气燃料电池为什么不是铝,水,氢氧化钠的反应
铝,空气燃料电池为什么不是铝,水,氢氧化钠的反应
以氢氧化钠为电解液的铝,空气燃料电池的总反应式是铝,O2,H2O生成氢氧化铝,但我觉得写成铝,水,氢氧化钠生成氢氧化铝和H2也没错,这样写为什么不对呢?怎么判断正极是否参加反应? senduo1年前1
senduo1年前1 -
 ljg1983 共回答了15个问题
ljg1983 共回答了15个问题 |采纳率93.3%不管是何种燃料电池,在总反应式中电解质一定不发生反应,这个要先记住.就是说总反应中反应物和生成物中没有电解质这种物质.
写总反应之前,先考虑去写电极反应
先看阳极(燃料端)反应
一定是Al发生电极反应,既然你知道是生成氢氧化铝,那么一定是:
Al+OH- ——> Al(OH)3
再看阴极(氧化气端)反应
一定是氧气发生电极反应,阳极反应消耗了OH-离子,这里一定要补回来的,因为总反应中电解质一定不参加反应.所以阴极反应为:
O2+H2O ——> OH-
自己配平吧1年前查看全部
- (2011•漳州一模)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图.下列有关叙述正确的是
 (2011•漳州一模)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图.下列有关叙述正确的是( )
(2011•漳州一模)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图.下列有关叙述正确的是( )
A.H+从正极区通过交换膜移向负极区
B.负极的电极反应式为:CH3OH(l)+H2O(l)-6e-=CO2(g)+6H+
C.d导出的是CO2
D.图中b、c分别是O2、甲醇 凤阁宁鸣1年前1
凤阁宁鸣1年前1 -
 碧落泪凌硝 共回答了17个问题
碧落泪凌硝 共回答了17个问题 |采纳率88.2%解题思路:由质子的定向移动可知甲为燃料电池的负极,乙为燃料电池的正极,负极电极反应式为CH3OH(l)+H2O(l)-6e-=CO2(g)+6H+,正极反应式为O2+4e-+4H+=2H2O.A.原电池工作时,阳离子移向原电池的正极,故A错误;
B.负极甲醇失电子被氧化,电极方程式为CH3OH(l)+H2O(l)-6e-=CO2(g)+6H+,故B正确;
C.乙为燃料电池的正极,导入的为空气,氧气在正极被还原生成水,导出的为氮气和水蒸汽,故C错误;
D.图中b、c分别是甲醇、O2,故D错误.
故选B.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查甲醇燃料电池,题目难度不大,注意把握原电池的工作原理以及电极反应式的书写,解答本题的关键是根据质子移动方向判断原电池的正负极.1年前查看全部
- 铝-空气燃料电池,氯化钠或氢氧化钠为电解质. 负极反应: Al-3e +4OH-===AlO2- +
铝-空气燃料电池,氯化钠或氢氧化钠为电解质. 负极反应: Al-3e +4OH-===AlO2- +
铝-空气燃料电池,氯化钠或氢氧化钠为电解质.
负极反应: Al-3e +4OH-===AlO2- +2H2O
正极反应 O2+4e +2H2O===4OH-
1)为什么正极不是氢离子得到电子生成氢气?
 gyx_kg_211年前1
gyx_kg_211年前1 -
 淡淡的温柔 共回答了16个问题
淡淡的温柔 共回答了16个问题 |采纳率100%碱性溶液中木有氢离子1年前查看全部
- 铝 空气燃料电池通常以NaCl溶液或NaOH溶液为电解液 铝合金为负极,空气电极为正极,以NaOH溶液为电解液时 负极反
铝 空气燃料电池通常以NaCl溶液或NaOH溶液为电解液 铝合金为负极,空气电极为正极,以NaOH溶液为电解液时 负极反应是什么? 总反应式是什么?
NaCl溶液为电解液负极反应是什么? 总反应式是什么?
主要说说您是怎么想的 天再高鸟也飞飞1年前2
天再高鸟也飞飞1年前2 -
 绿茶0519 共回答了11个问题
绿茶0519 共回答了11个问题 |采纳率90.9%1.Al - 3e + 3OH- =Al(OH)3
4Al + 3O2 + 4NaOH = 4NaAlO2 + 2H2O
2.Al - 3e + =Al3+
4Al + 3O2 + 6H2O = 4Al(0H)31年前查看全部
- 一种超级锌空气燃料电池技术已悄然在美国开花,并在上海结果.这句话怎么翻译成英文,急,
 ldq2941361年前1
ldq2941361年前1 -
 虫儿飞18 共回答了26个问题
虫儿飞18 共回答了26个问题 |采纳率88.5%A kind of super-zinc-air fuel cell technology has been quietly blossoming in the United States, and the results in Shanghai1年前查看全部
- 肼——空气燃料电池工作时溶液PH值为什么减小
肼——空气燃料电池工作时溶液PH值为什么减小
肼(N2H4)-空气燃料电池,电解液是20%~30%的KOH溶液.电池总反应为N2H4+O2=N2+2H2O. sissilake1年前1
sissilake1年前1 -
 cwcw0909 共回答了18个问题
cwcw0909 共回答了18个问题 |采纳率83.3%KOH溶液是碱性的,虽然两级不断消耗和再生成OH- ,但同时H2O的量也增加了,使得OH-的浓度相对当初减小,PH向7靠近.1年前查看全部
- (2010•宜宾模拟)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极
(2010•宜宾模拟)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极.下列说法错误的是( )
A.以NaCl溶液为电解液时,负极反应为:Al+3OH--3e-═Al(OH)3↓
B.以NaOH溶液为电解液时,负极反应为:Al+4OH--3e-═AlO2-+2H2O
C.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-═4OH-
D.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持降低 tt花下人1年前1
tt花下人1年前1 -
 加长加粗 共回答了20个问题
加长加粗 共回答了20个问题 |采纳率95%解题思路:铝空气燃料电池中负极反应为Al+4OH---3e-═AlO2-+2H2O,正极反应为O2+2H2O+4e-═4OH-,总反应为4Al+4OH-+3O2═4AlO2-+2H2O,铝为活泼金属,既能与酸反应,又能与碱反应.A、以NaCl溶液为电解液时,该燃料电极的正极发生反应为:O2+2H2O+4e-═4OH-,所以负极反应为:Al+4OH--3e-═AlO2-+2H2O,故A错误;
B、铝作负极,负极反应应该是铝失去电子变为铝离子,在氢氧化钠的溶液中铝离子继续与过量的碱反应生成偏铝酸根,因此负极反应为:Al+4OH--3e-═AlO2-+2H2O,故B正确;
C、电解质溶液显碱性或中性时,正极氧气得电子生成氢氧根离子,该燃料电极的正极发生反应为:O2+2H2O+4e-═4OH-,故C正确;
D、该电池在碱性条件下消耗了碱,反应式为4Al+3O2+4OH-═4AlO2-+2H2O,所以溶液pH降低,故D正确.
故选:A.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查化学电源新型电池,本题难度不大,注意电极反应式的书写,及溶液的酸碱性对电极反应的影响.1年前查看全部
- (2009•张湾区模拟)空气燃料电池具有高效、安全、成本低等许多优点,电池内发生的总反应为:2Zn+O2=2ZnO,下列
(2009•张湾区模拟)空气燃料电池具有高效、安全、成本低等许多优点,电池内发生的总反应为:2Zn+O2=2ZnO,下列关于该种电池的说法错误的是( )
A.发生的反应属于化合反应
B.电池是把化学能转化为电能的装置
C.反应所需的氧气来源于空气
D.电池废旧后即可丢弃 skysobeautiful1年前1
skysobeautiful1年前1 -
 amyf100 共回答了14个问题
amyf100 共回答了14个问题 |采纳率85.7%解题思路:A、此反应属于多变一的化学变化,根据化合反应的特点进行分析.
B、电池内发生的是化学变化而生成电能.
C、空气电池就是利用的空气中的氧气.
D、废旧电池会对环境造成污染.A、此反应属于多变一的化学变化,符合化合反应的特点,故此选项错误.
B、电池内发生的是化学变化而生成电能,是化学能转化为电能,故此选项错误.
C、空气电池就是利用的空气中的氧气,预料很易得到,故此选项错误.
D、废旧电池会对环境造成污染,因此不能随意丢弃,故此选项正确.
故选D点评:
本题考点: 物质发生化学变化时的能量变化;空气的成分及各成分的体积分数;废弃金属对环境的污染;反应类型的判定.
考点点评: 此题是对空气电池的有关知识的考查,解题时结合有关的化学常识对所提供的选项进行分析探讨即可.1年前查看全部
- 可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为点解液,铝合金为负极,空气电极为正极.下
 chensunzhen1年前1
chensunzhen1年前1 -
 目的地7098 共回答了21个问题
目的地7098 共回答了21个问题 |采纳率100%题目是不是高考题?
)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为点解液,铝合金为负极,空气电极为正极.下列说法正确的是
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
AAAAAAAA1年前查看全部
- 镁燃料电池作为一种高能化学电源,具有良好的应用前景。下图是镁一空气燃料电池工作原理示意图。下列有关该电池的说法正确的是
镁燃料电池作为一种高能化学电源,具有良好的应用前景。下图是镁一空气燃料电池工作原理示意图。下列有关该电池的说法正确的是
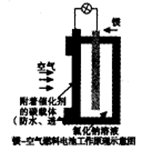
A.该电池Mg作负极,发生还原反应 B.该电池的正极反应式为: 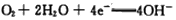
C.电池工作时,电子通过导线由碳电极流向Mg电极 D.当电路中通过0.2mol电子时,消耗的O 2 体积为1.12L  水林子1年前1
水林子1年前1 -
 碧潭映月 共回答了19个问题
碧潭映月 共回答了19个问题 |采纳率100%B
1年前查看全部
- 阱—空气燃料电池电极反应式**碱性条件
 liuyuan19821年前1
liuyuan19821年前1 -
 ligao159 共回答了19个问题
ligao159 共回答了19个问题 |采纳率84.2%负极:N2H4 + 4OH- = N2 + 4H2O + 4e-
正极:O2+ 4e- + 2H2O = 4OH-
N2H4 + O2 = N2 + 2H2O1年前查看全部
- 为什么铝做负极,碳做正极,氢氧化钠为电解质溶液电极反应和铝-空气燃料电池的电极
 此名字已经有人用1年前1
此名字已经有人用1年前1 -
 hh5a 共回答了22个问题
hh5a 共回答了22个问题 |采纳率86.4%空气燃料电池中电解质不发生反应啊
然后看负极是铝发生氧化反应那就应该是Al + OH- → AlO2-
同样的负极消耗OH- 那正极就产生OH-
那就是 O2+H2O→OH-
配平就自己配啦?1年前查看全部
- 假设使用CH3CH2OH空气燃料电池作为电解CuSO4溶液的电源(惰性电极)
假设使用CH3CH2OH空气燃料电池作为电解CuSO4溶液的电源(惰性电极)
1.写出电解时电极反应式 阴极:___阳极:___
2.总反应的离子方程式:
3.当析出12.8gCu时,电路上小号的电子__mol
4CH3CH2OH空气燃料电池理论上消耗标准状况下的氧气_L 爱情已经到来1年前2
爱情已经到来1年前2 -
 qq87aa 共回答了14个问题
qq87aa 共回答了14个问题 |采纳率92.9%阴极:Cu2++2e-=Cu
阳极:2H2O-4e-=4H++O2
总:2Cu2++2H2O通电=2Cu+4H++O2↑
Cu2+~2e-
64 2
12.8g 0.4mol
假设是酸性电池
正极:O2+4H++4e-=2H2O
22.4 4
2.24L 0.4mol1年前查看全部
- (2010•烟台一模)(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%~30%的KOH溶液.电池总
(2010•烟台一模)(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%~30%的KOH溶液.电池总反应为:N2H4+O2=N2+2H2O.下列关于该燃料电池工作时的说法正确的是( )
A.负极的电极反应式是:N2H4+4OH-→4H2O+N2↑+4e-
B.正极的电极反应式是:O2+4H++4e-→2H2O
C.溶液中阴离子向正极移动
D.电解后电解质溶液的碱性增强 观棋莫语1年前1
观棋莫语1年前1 -
 lw_108573 共回答了24个问题
lw_108573 共回答了24个问题 |采纳率87.5%解题思路:肼(N2H4)一空气燃料电池中,负极反应为:N2H4+4OH--4e-=4H2O+N2↑,正极反应为:O2+2H2O+4e-=4OH-,电池总反应为:N2H4+O2=N2↑+2H2O,以此解答题中A、B、C各问,原电池中,阴离子向负极移动,阳离子向正极移动.A、原电池中负极发生氧化反应,正极发生还原反应,负极反应为N2H4+4OH--4e-=4H2O+N2↑,故A正确;
B、在碱性环境下,正极反应为:O2+2H2O+4e-=4OH-,故B错误;
C、原电池中,阴离子向负极移动,阳离子向正极移动,故C错误;
D、电池总反应为N2H4+O2=N2↑+2H2O,原电池反应生成水,溶液浓度降低,故D错误;
故选A.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池的工作原理,题目难度不大,本题注意把握电极反应式的书写,正确判断离子的定向移动.1年前查看全部
- 铝-空气燃料电池,氯化钠或氢氧化钠为电解质时,总反应方程式是 还有铝和氧气和水反应生成物原因
 乔治中1年前1
乔治中1年前1 -
 香香的祸水 共回答了18个问题
香香的祸水 共回答了18个问题 |采纳率94.4%阴极Al-3e===Al3+阳极:2H2O+O2+4e===4OH-电极总反应:4Al+3O2+6H2O=4Al3++12OH-(在氯化钠稀溶液中)
阴极Al-3e+4OH-===[Al(OH)4]-阳极:2H2O+O2+4e===4OH-电极总反应:4Al+3O2+6H2O+16OH-=4[Al(OH)4]-+12OH-(在氢氧化钠溶液中)
在中性溶液中,标准电极电势:
Al(III)-(0) Al3++3e-=Al -1.662(阴极电势-1.662)
O(0)-(-II) O2+2H2O+4e-=4OH- 0.401(阳极电势0.401)
在碱性溶液中Al(III)-(0) H2AlO3-+H2O+3e-=Al+OH- -2.33(阴极电势:-2.23)
O(0)-(-II) O2+2H2O+4e-=4OH- 0.401(阳极电势0.401)
阳极电势远大于阴极电势,因此反应在外界不提供电能的情况下能进行.
若氯化钠溶液浓度过高(接近饱和),可能会发生副反应(阳极:2Cl--2e===Cl2↑),直到氯离子浓度较低.
若氢氧化钠浓度较低,可能会发生副反应(阴极:Al-3e+3OH-===Al(OH)3↓),直到氢氧根离子浓度过高.
1年前查看全部
- 铝-空气燃料电池,通常以Nacl溶液为电解液,铝合金为负极,空气电极为正极.下列说法中:
铝-空气燃料电池,通常以Nacl溶液为电解液,铝合金为负极,空气电极为正极.下列说法中:
选A:以Nacl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-==4OH-
我想问,1.当空气电极为正极,是否就不考虑电解质了 直接氧得电子?
2.能不能一下就看出是空气做电极,还是电解质溶液中离子做电极?
希望能帮我详细说明, 温柔的小薇1年前1
温柔的小薇1年前1 -
 newene 共回答了16个问题
newene 共回答了16个问题 |采纳率81.3%1,不是,若电解质溶液为酸性,那么正极反应就不能写成O2+2H2O+4e-==4OH-,因为酸性条件下,氢离子和氢氧根会发生反应
2,燃料电池中,正极上都是空气中的氧气得电子1年前查看全部
- N2H4-空气燃料电池放电时负极点的电极反应式是
 看世界呼啸而过1年前1
看世界呼啸而过1年前1 -
 adrenalinrush 共回答了28个问题
adrenalinrush 共回答了28个问题 |采纳率100%N2h4 - 4e == N2 + 4 H+1年前查看全部
- 铂做电极,以氢氧化钾溶液做电解质溶液的肼——空气燃料电池的负极反应方程式
 爱深处不经意1年前1
爱深处不经意1年前1 -
 skybear69 共回答了26个问题
skybear69 共回答了26个问题 |采纳率84.6%解析:
负极:N2H4 - 4e- + 4OH-= N2 + 4H2O1年前查看全部
- 关于铝-空气燃料电池的电极反应求解……
关于铝-空气燃料电池的电极反应求解……
铝-空气燃料电池,铝合金做负极,NaOH为电解质溶液 负极反应是Al+(3OH-)-(3e-)=Al(OH)3↓吧?但是考试试卷上这个答案是错的,哪里错了呢? ad161年前1
ad161年前1 -
 张良辰 共回答了9个问题
张良辰 共回答了9个问题 |采纳率100%你想想,在碱性溶液,还会有Al(OH)3↓吗?当然不会了是吧,总式应该是
4Al+4(NAOH)+3O2=4(NAALO2)+2H2O
负极是Al+(4OH-)-(3e-)=(ALO2-)+2H2O1年前查看全部
大家在问
- 1I will go to school还是 I will be go to school正确?
- 2“你们在家喜欢做什么?用英语翻译
- 3什么元素是活泼的给你一副周期表,如何判断哪些是最活泼的
- 4解释面心立方晶体和密排六方晶体结构不同、致密度相同的原因?
- 5英语:你正在做什么 怎么说
- 6有三车堆煤共重748吨,已知甲、乙两堆煤的质量比是10:8,丙堆煤是甲、乙两堆煤质量和的8分之三,问这三堆煤分别重多少吨
- 7建筑工人在砌房子时,用水平仪R来检查所砌的墙面是否水平,当液体中空气泡——,表示墙面水平
- 8124除124又125分之124=?
- 9如图,在Rt△ABC中,∠BAC=90°,E,F分别是BC,AC的中点,延长BA到点D,使AD=[1/2]AB.连接DE
- 103.89^2-1.78*3.89+0.89^2=?
- 113.49 * x(1) = y(1)
- 12两个一样动物其中一个问另一个叫什么名字用一成语形容
- 13化学碰撞与物理碰撞有什么区别
- 14一杯糖水的质量比是500克,其中糖的质量是水的12.5%,这杯糖水中糖与糖水质量的比是( )
- 15为什么有的物质溶于水会放热
