3.01×10^23个甲烷分子是多少摩尔甲烷分子?含多少摩尔氢原子?多少摩尔碳原子?
 xiaosaner2022-10-04 11:39:541条回答
xiaosaner2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 Ych_guo 共回答了23个问题
Ych_guo 共回答了23个问题 |采纳率87%- 0.5mol甲烷分子
2mol氢原子
0.5mol碳原子 - 1年前
相关推荐
- 用化学用语表示下列物质:(1)单质铜______;(2)两个硝酸根离子______;(3)两个甲烷分子______;(4
用化学用语表示下列物质:
(1)单质铜______;
(2)两个硝酸根离子______;
(3)两个甲烷分子______;
(4)H 2 O中的“2”表示______. linfeilai1年前1
linfeilai1年前1 -
 力大如牛 共回答了17个问题
力大如牛 共回答了17个问题 |采纳率82.4%(1)单质铜,为金属,用元素符号表示,故Cu;
(2)若表示多个离子,就在其元素符号前加上相应的数字.故两个硝酸根离子2NO 3 - ;
(3)表示多个分子,就在其化学式前加上相应的数字,故两个甲烷分子2CH 4 ;
(4)H 2 O中的“2”表示:一个水分子中有两个氢原子
故答为:(1)Cu;(2)2NO 3 - ;(3)2CH 4 ;(4)一个水分子中有两个氢原子1年前查看全部
- 3、甲烷分子是以碳原子为中心的正四面体结构,而不是正方形的平面结构,理由是( )
3、甲烷分子是以碳原子为中心的正四面体结构,而不是正方形的平面结构,理由是( )
(A)CH3Cl只有一种 (B)CH2Cl2只有一种
(C)CHCl3只有一种 (D)CH4中的键角和键长都相等
为什么是B? eva_11年前3
eva_11年前3 -
 我可没来aa 共回答了13个问题
我可没来aa 共回答了13个问题 |采纳率92.3%因为如果是正方形平面结构,一氯甲烷和三氯甲烷都仍然只有一种,键角键长也都相等,但是二氯甲烷就有两种,同边和对角两种1年前查看全部
- 下列关于甲烷性质说法中错误的是甲烷是一中非极性分子甲烷分子具有极性键甲烷分子具有正四面踢结构甲烷分子中 H-C-H的键角
下列关于甲烷性质说法中错误的是
甲烷是一中非极性分子
甲烷分子具有极性键
甲烷分子具有正四面踢结构
甲烷分子中 H-C-H的键角为90° sck10271年前1
sck10271年前1 -
 390122951 共回答了23个问题
390122951 共回答了23个问题 |采纳率87%键角并不是90°,其余三项正确.1年前查看全部
- 甲烷分子中四个共价键完全相同吗?
 快乐ii1年前2
快乐ii1年前2 -
 love_pipo 共回答了19个问题
love_pipo 共回答了19个问题 |采纳率73.7%是一样的,因为甲烷的空间构型是正四面体型,其中碳在体心上,四个氢是正四面体的四个顶点,所以四个共价键完全相同.1年前查看全部
- 一个甲烷分子和一个二氧化碳贩子的不同点是什么
 yulinglong21年前1
yulinglong21年前1 -
 乞_丐 共回答了16个问题
乞_丐 共回答了16个问题 |采纳率100%甲烷 二氧化碳
CH4 CO2
分子为正四面体形 直线形
10个电子 22个电子
易燃 不支持燃烧1年前查看全部
- 下列关于甲烷分子的说法中错误的是( )
下列关于甲烷分子的说法中错误的是( )
A.甲烷分子中的化学键均不是非极性键
B.CH2Cl2只有一种分子结构能说明甲烷分子是以C原子为中心的正四面体结构
C.甲烷分子中碳元素的化合价为+4价
D.甲烷分子中4个C-H键的化学性质完全相同 72df1年前1
72df1年前1 -
 相思虎 共回答了20个问题
相思虎 共回答了20个问题 |采纳率85%解题思路:甲烷为正四面体结构,含有极性键,C元素的化合价为-4价.A.甲烷中只含有C-H键,为极性键,故A正确;
B.甲烷分子是以C原子为中心的正四面体结构,对应的CH2Cl2只有一种分子结构,故B正确;
C.C元素的化合价为-4价,故C错误;
D.甲烷为正四面体结构,对应的4个C-H键的化学性质完全相同,故D正确.
故选C.点评:
本题考点: 甲烷的化学性质;有机物的结构和性质.
考点点评: 本题考查甲烷的结构,题目难度不大,注意相关基础知识的积累,注意选项B,为证明甲烷结构的重要方法.1年前查看全部
- “可燃冰”是天然气的固体状态,深埋于海底和陆地永久冻土层中,它的主要成分是甲烷分子与水分子,是极具发展潜力的新能源.已知
“可燃冰”是天然气的固体状态,深埋于海底和陆地永久冻土层中,它的主要成分是甲烷分子与水分子,是极具发展潜力的新能源.已知1m3可燃冰可释放164m3的天然气(标准状况下),标准状况下1mol气体的体积为2.24×10-2 m3,阿伏加德罗常数取NA=6.02×1023mol-1.则1m3可燃冰所含甲烷分子数为多少?(结果保留一位有效数字)
 yt49361年前1
yt49361年前1 -
 haishaf 共回答了16个问题
haishaf 共回答了16个问题 |采纳率68.8%解题思路:1m3可燃冰可释放164m3的天然气,结合标准状况下1mol气体的体积为2.24×10-2 m3算出物质的量,进而可得1m3可燃冰所含甲烷分子数.1m3可燃冰可释放164m3的天然气,结合标准状况下1mol气体的体积为2.24×10-2 m3算出物质的量为:n=
V
VM=
164
2.24×10−2mol
则1m3可燃冰所含甲烷分子数为:N=nNA=
164
2.24×10−2×6.02×1023≈4×1027
答:1m3可燃冰所含甲烷分子数为4×1027.点评:
本题考点: 阿伏加德罗常数.
考点点评: 可燃冰变成气体前后,甲烷分子的总量是守恒的,有阿伏加德罗常数可得到宏观量与微观量之间的关系.1年前查看全部
- “可燃冰”是天然气的固体状态,深埋于海底和陆地永久冻土层中,它的主要成分是甲烷分子与水分子,是极具发展潜力的新能源.已知
 解答注册问题1年前1
解答注册问题1年前1 -
 燃放2000 共回答了23个问题
燃放2000 共回答了23个问题 |采纳率87%解题思路:建立分子占据空间的立方体模型;摩尔数乘以阿伏加德罗常数取即为分子数.已知am3 可燃冰可释放bm3的天然气(标准状况下),标准状况下1mol天然气的体积为VA m3,故甲烷分子数为:
N=n•NA=[b
VA•NA
标准状况下1mol天然气的体积为VA m3,故:
NA•d3=VA
解得:
d=
3
VA
NA/]
故答案为:[b
VA•NA,
3
VA
NA/].点评:
本题考点: 阿伏加德罗常数.
考点点评: 可燃冰变成气体前后,甲烷分子的总量是守恒的,由阿伏加德罗常数可得到宏观量与微观量之间的关系.1年前查看全部
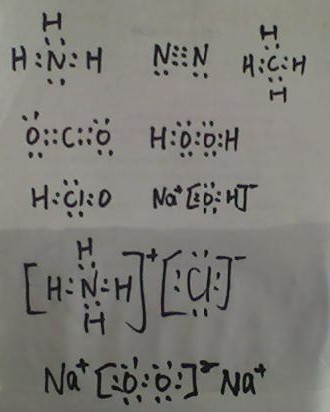
- 1)写出下列微粒的电子式 氨气 N2 甲烷分子 CO2 H2O2 HClO NaOH 氯化铵 Na2O2
1)写出下列微粒的电子式 氨气 N2 甲烷分子 CO2 H2O2 HClO NaOH 氯化铵 Na2O2
今天晚自习要交卷子了, dd天空1年前4
dd天空1年前4 -
 qiaoer330 共回答了23个问题
qiaoer330 共回答了23个问题 |采纳率69.6%1年前查看全部
- 能够证明甲烷分子的空间结构为正四面体而不是平面正方形的事实是( )
能够证明甲烷分子的空间结构为正四面体而不是平面正方形的事实是( )
A. 甲烷的4个碳氢键的键能相等
B. 甲烷的4个碳氢键的键长相等
C. 甲烷的一氯代物只有1种
D. 甲烷的二氯代物只有1种 我爱AV1年前3
我爱AV1年前3 -
 zjjqq 共回答了16个问题
zjjqq 共回答了16个问题 |采纳率81.3%解题思路:A.若是平面正方形结构,甲烷的4个碳氢键的键长、键能也相等;
B.甲烷如果是平面结构,甲烷的4个碳氢键的键长也相等;
C.甲烷若是平面结构,甲烷中的四个氢原子位置也相同;
D.如果甲烷是正方形的平面结构,而CH2Cl2有两种结构:相邻或者对角线上的氢被Cl取代,而实际上,其二氯取代物只有一种结构,因此只有正四面体结构才符合.A.由于甲烷为平面正方形结构时,甲烷的4个碳氢键的键能也相等,所以无法判断甲烷为正四面体结构,故A错误;B.甲烷无论是正四面体结构,还是正方形,甲烷的4个碳氢键的键长都相等,无法判断甲烷的结构,故B错误;C...
点评:
本题考点: 常见有机化合物的结构.
考点点评: 本题考查甲烷的分子结构,题目难度不大,注意掌握常见有机物的结构与性质,明确二氯甲烷没有同分异构体说明甲烷是正四面体结构.1年前查看全部
- 设N A 为阿伏加德罗常数,下列叙述中正确的是 A.常温下,11.2L甲烷气体含有甲烷分子数为0.5N A B.14g乙
设N A 为阿伏加德罗常数,下列叙述中正确的是
A.常温下,11.2L甲烷气体含有甲烷分子数为0.5N A B.14g乙烯和丙烯的混合物中总原子数为3N A C.0.1mol/L的氢氧化钠溶液含钠离子数为 0.1N A 个 D.5.6g铁与足量稀硫酸失去电子数为0.3N A  alodada1年前1
alodada1年前1 -
 yyy196 共回答了17个问题
yyy196 共回答了17个问题 |采纳率88.2%B
A项中所给的条件并不是标准状况下,故甲烷的物质的量不是0.5 mol,故A项错误;B项中乙烯和丙烯的最简式为CH 2 ,其最简式的物质的量为14g/14g·mol -1 =1mol,故其总原子数为3N A ,B项正确;由于不知道氢氧化钠溶液的体积,故无法确定钠离子的数目,C项错误;Fe与稀硫酸反应生成的是Fe 2+ ,D项错误。故本题应选B。1年前查看全部
- 甲烷分子中的一个,两个,三个,四个氢原子被氯原子取代后分别有几种结构?是否都是正四面体结构?
甲烷分子中的一个,两个,三个,四个氢原子被氯原子取代后分别有几种结构?是否都是正四面体结构?
如何证明甲烷是正四面体结构而不是平面正方形结构? ligenyu1年前2
ligenyu1年前2 -
 五岳岿来不看山 共回答了18个问题
五岳岿来不看山 共回答了18个问题 |采纳率94.4%有四种,正四面体有一种,四氯化碳.当有两个氢被取代时只有一种产物,即可证明其结构.1年前查看全部
- 和2.8g氮气含有相同分子数的是:A:16g氧气 B:0.1mol甲烷分子 B:1.8g水
 jimmyczy1年前4
jimmyczy1年前4 -
 1a_2b_3c_4d 共回答了17个问题
1a_2b_3c_4d 共回答了17个问题 |采纳率100%选0.1mol甲烷分子和1.8g水
2.8g氮气物质的量是0.1mol,与其物质的量相等的物质所含分子数相同.1年前查看全部
- 下列有关化学观念的叙述正确的是( ) A.吃鱼后,鱼肉中的钙元素可能会留在人体骨骼内 B.外星球上甲烷分子与地球上甲烷
下列有关化学观念的叙述正确的是( ) A.吃鱼后,鱼肉中的钙元素可能会留在人体骨骼内 B.外星球上甲烷分子与地球上甲烷分子的化学性质不同 C.冰中的水分子被冻住了,分子不再运动 D.剪断铜导线时,铜原子可能被剪成两半  樱佳1年前1
樱佳1年前1 -
 guozhi43 共回答了21个问题
guozhi43 共回答了21个问题 |采纳率95.2%A、从元素守恒的角度来看,鱼肉中的钙元素可能会留在人体骨骼内,说法正确,故A正确;
B、因都是甲烷,组成元素相同,结构相同,则外星球与地球上甲烷分子的化学性质相同,故B错误;
C、冰中的水分子具有微观粒子的性质,分子是不断运动的,故C错误;
D、剪断铜导线时,宏观上被剪成两半,但原子很小,是微观粒子不会被剪成两半,故D错误;
故选A.1年前查看全部
- 一卤代物只有一种的烷烃,分子结构有球形(A)和椭圆(B)两类,A是以甲烷分子为母体
一卤代物只有一种的烷烃,分子结构有球形(A)和椭圆(B)两类,A是以甲烷分子为母体
接标题:将甲烷分子中所有的氢原子用甲基取代,B是以乙烷为母体,用甲基多次取代后制得.
A类物质得通式是_______
B类物质得通式是_______ linknet1年前2
linknet1年前2 -
 王路99 共回答了17个问题
王路99 共回答了17个问题 |采纳率94.1%A类物质前几个是
C5H12、C17H36、C53H108
通式为C(2*3^n-1)H(4*3^n),n=1,2,3······
B类物质前几个是
C8H18、C26H54、C80H162
通式为C(3*3^n-1)H(6*3^n),n=1,2,3······1年前查看全部
- 甲烷分子中碳元素和氢元素的质量分数各为多少?
 tianyahhh1年前1
tianyahhh1年前1 -
 假面ζ魔鬼 共回答了20个问题
假面ζ魔鬼 共回答了20个问题 |采纳率90%CH4
C 12/16*100%=75%
H 4/16*100%=25%1年前查看全部
- 一种甲烷水合物晶体中,平均每46个水 分子构成8个分子笼,每个分子笼可容 纳1个甲烷分子或水分子,若这8个分子 笼中有6
一种甲烷水合物晶体中,平均每46个水 分子构成8个分子笼,每个分子笼可容 纳1个甲烷分子或水分子,若这8个分子 笼中有6个容纳的是甲烷分子,另外2个 被水分子填充,这种可燃冰的平均组成 可表示成什么,详细,详细的给好评
 断刀流水16881年前1
断刀流水16881年前1 -
 hulala123456 共回答了18个问题
hulala123456 共回答了18个问题 |采纳率88.9%平均每46个水分子构成8个笼,晶体中每8个笼中有6个容纳了CH4分子,另外2个被2个游离的H2O分子所填充
天然气水合物的构成中含6个CH4分子、46+2=48个H2O分子
则CH4分子与H2O分子粒子数比= 6:48 = 1:8
则天然气水合物的平均组成可表示为CH4•8H2O1年前查看全部
- 0.5molCH4中含有_个甲烷分子,_molH,在标准状况下的体积为_ .
0.5molCH4中含有_个甲烷分子,_molH,在标准状况下的体积为_ .
88gCO2的物质的量为_,所含二氧化碳分子数为_,在标准状况下的体积为_. woaiygy1年前2
woaiygy1年前2 -
 萍周相逢 共回答了13个问题
萍周相逢 共回答了13个问题 |采纳率84.6%0.5molCH4中含有_0.5个甲烷分子,2_molH,在标准状况下的体积为11.2_ .0.5*4=2 0.5*22.4=11.2
88gCO2的物质的量为2mol_,所含二氧化碳分子数为_2NA个,在标准状况下的体积为_44.8.
88/44=2
NA即阿伏伽德罗常数
2*22.4=44.81年前查看全部
- 甲烷的二氯代物只有一种,为什么能够证明甲烷分子的空间结构是正四面体?
 地方放1年前1
地方放1年前1 -
 zjpdw 共回答了12个问题
zjpdw 共回答了12个问题 |采纳率83.3%因为如果是正方形结构,会有两种,一种是两个Cl相邻,另一种是两个Cl相间.
如果是正四面体则不存在这个问题.1年前查看全部
- 能够证明甲烷分子的空间结构为正四面体的事实是( ) A甲烷的4个碳氢键的键能相等 B甲烷的4个碳氢键
能够证明甲烷分子的空间结构为正四面体的事实是( ) A甲烷的4个碳氢键的键能相等 B甲烷的4个碳氢键
能够证明甲烷分子的空间结构为正四面体的事实是( )
A甲烷的4个碳氢键的键能相等
B甲烷的4个碳氢键的键长相等
C甲烷的一氯代物只有1种
D甲烷的二氯代物只有1种 renhw6011年前1
renhw6011年前1 -
 海豚抱枕 共回答了14个问题
海豚抱枕 共回答了14个问题 |采纳率92.9%妥妥的D.
举个反例就可以排出ABC:假定这个分子是正方形,四个H原子是顶点,C原子在正方形中心,那么C-H键能,键长也都相等,这种结构的一氯代物也只有一种.所以ABC排除1年前查看全部
- 请问,0.1摩尔的甲烷所含的电子数为什么是1NA,一个甲烷分子不是只有八个电子吗
请问,0.1摩尔的甲烷所含的电子数为什么是1NA,一个甲烷分子不是只有八个电子吗
谢谢各位详细帮我解答啊
甲烷分子式只有四个共用电子对,即八个电子啊,怎么不能这么看啊 绝世强人1年前1
绝世强人1年前1 -
 你是什么玩意儿 共回答了19个问题
你是什么玩意儿 共回答了19个问题 |采纳率94.7%甲烷CH4 C有6个电子啊 H有1个电子 和起来就是6+1*4=10
就是10个电子啊1年前查看全部
- 关于甲烷分子甲烷分子的轨道和氢原子的轨道是什么!
 fhm231年前2
fhm231年前2 -
 折翼天使yaya 共回答了17个问题
折翼天使yaya 共回答了17个问题 |采纳率94.1%甲烷分子成键时,碳是以SP3杂化轨道与氢原子的1s轨道成σ键,成键后甲烷的分子轨道是σ分子轨道.1年前查看全部
- CH4的摩尔质量在数值上等于 NA个甲烷分子的质量(单位为克)之和
 xiaoxinyiyi991年前3
xiaoxinyiyi991年前3 -
 絮雪儿 共回答了13个问题
絮雪儿 共回答了13个问题 |采纳率92.3%你问的问题是:对的.
因为甲烷的相对分子质量是16(碳单位),而一摩尔
甲烷的质量(以克为单位)是16克,一摩尔甲烷的分
子个数为 6.022*10²³(个).1年前查看全部
- 为什么甲烷分子的键角比乙烯分子的键角大
为什么甲烷分子的键角比乙烯分子的键角大
甲烷不是空间正四面体结构,键角是109.5°吗
而乙烯的键角应该在120°啊,为什么错了呢? 好坏的孩子1年前2
好坏的孩子1年前2 -
 辰言 共回答了13个问题
辰言 共回答了13个问题 |采纳率92.3%题目错了吧1年前查看全部
- 水分子,氨分子,苯,甲烷分子的键长键角
 挖地1年前3
挖地1年前3 -
 没有爱的我 共回答了21个问题
没有爱的我 共回答了21个问题 |采纳率85.7%水 O-H键长0.99Å ,键角为104.5°
苯 C-H键长为1.08Å,C-C键长为1.40Å,分子中所有键角均为120°
氨 键长约为1.01Å,N—H键之间夹角为107°18’
甲烷 键长约为1.09Å,H—C—H 键角:109°28′1年前查看全部
- 怎么证明甲烷分子为正四面体结构
 binxl1年前1
binxl1年前1 -
 如风影子 共回答了16个问题
如风影子 共回答了16个问题 |采纳率87.5%二氯取代物只有一种.1年前查看全部
- 甲烷分子含量超过99%的天然气水合物.
甲烷分子含量超过99%的天然气水合物.
什么时候是质量分数,什么时候体积分数?
不是针对上面文字,是说化学中,百分比什么时候是质量分数,什么时候体积分数?
轻质液体是什么啊? lauralyx1年前1
lauralyx1年前1 -
 爱已散尽 共回答了14个问题
爱已散尽 共回答了14个问题 |采纳率92.9%化学中,根据组成该混合物的成分来判断:如果是由固体或者液体组成,百分比是质量分数,如果是由气体组成,百分比是体积分数.
轻质液体是指含有碳原子数较少的液体燃料,比如汽油.1年前查看全部
- 8g甲烷含( )个甲烷分子,4g甲烷与( )g水分子数相等.回答并写出过程.
 41姨贺事务所百日1年前1
41姨贺事务所百日1年前1 -
 ccff108 共回答了19个问题
ccff108 共回答了19个问题 |采纳率100%CH4 8/16=0.5mol 甲烷分子:0.5*6.02*10^23=3.01*10^23
CH4 4/16=0.25mol
H2O 0.25*18=4.5g1年前查看全部
- 怎样说明甲烷分子的正四面体结构?
 titii1年前1
titii1年前1 -
 jy19777 共回答了13个问题
jy19777 共回答了13个问题 |采纳率92.3%怎么说明?
这个简单,根据甲烷CH4的结构式
1个C跟4个H组和的化合价是完全相同的,
4个H之间带有相同的电荷,
他们之间的作用力完全相同.
所以是正四面体的
中间一个C原子处于正四面体的中心,
四个H原子分别处于正四面体的四个顶点上,
各H原子与C原子之间以键连接,
键与过顶点并与它相对的面垂直的线重叠1年前查看全部
- 甲烷分子中至少有3个氢原子在同一平面上为什么是错的?不是三点确定一个平面吗?
甲烷分子中至少有3个氢原子在同一平面上为什么是错的?不是三点确定一个平面吗?
(标准答案是错的)说明理由. 孤独的独孤1年前1
孤独的独孤1年前1 -
 dd地方灭青妖 共回答了18个问题
dd地方灭青妖 共回答了18个问题 |采纳率83.3%我觉得题目应该是和C在同一平面的吧
要是只有氢就是三个1年前查看全部
- 一个甲烷分子和一个二氧化碳分子的不同点是什么
 cafdsg1年前5
cafdsg1年前5 -
 我爱fantasy 共回答了20个问题
我爱fantasy 共回答了20个问题 |采纳率90%不同点是:
1、分子种类不同,一个是甲烷分子,另一个是二氧化碳分子
2、组成分子的原子种类不同,一个是由碳原子和氢原子构成,另一个是由碳原子和氧原子构成.1年前查看全部
- 氨分子是不是四面体构型如题.注意 不是指“正”四面体.现在做一题.说下列不是正四面体构型的是①甲烷分子②氨分子③白磷分子
氨分子是不是四面体构型
如题.注意 不是指“正”四面体.现在做一题.说下列不是正四面体构型的是
①甲烷分子②氨分子③白磷分子④氯仿分子⑤四氯化碳分子⑥二氧化碳分子
我判断只有⑥.但是选项A①③ B③⑤ C①⑤ D②⑥.
求救. 三度的冰1年前0
三度的冰1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 甲烷分子中的4个氢原子全部被苯基取代后所生成的产物,所有原子可能处于同一平面吗?
 xinjiexing1年前1
xinjiexing1年前1 -
 独自演绎对角戏 共回答了18个问题
独自演绎对角戏 共回答了18个问题 |采纳率94.4%不对.
甲烷中碳原子的四个成键电子的电子轨道在空间中为正四面体排列,因而无论是什么取代基,都不可能发生甲烷的衍生物的所有原子处于同一平面这个现象.1年前查看全部
- 甲烷分子中至少有3个氢原子一定在同一平面上
甲烷分子中至少有3个氢原子一定在同一平面上
这句话对吗?说明理由 回复xx1年前1
回复xx1年前1 -
 山水的天空 共回答了18个问题
山水的天空 共回答了18个问题 |采纳率100%对的啊,不管什么物质,学过数学就知道,三个不共线的点确定一个平面,所以任何三个原子一定在一个平面上1年前查看全部
- 甲烷的摩尔质量与NA个甲烷分子的质量在数值上一定相等正确吗
 xz_gusheng1年前1
xz_gusheng1年前1 -
 ysi7gl 共回答了17个问题
ysi7gl 共回答了17个问题 |采纳率88.2%正确
因为 NA个甲烷分子就是 1mol 甲烷分子
而1mol 甲烷分子质量就是 甲烷的摩尔质量1年前查看全部
- 可燃冰的构成"可燃冰是由水分子和甲烷分子构成的."请问,这句话对吗?我想问对还是不对.
 茜瓜不乖1年前2
茜瓜不乖1年前2 -
 半人半兽 共回答了16个问题
半人半兽 共回答了16个问题 |采纳率87.5%不对,还有其他物质1年前查看全部
- 若晶体中每8个笼只有3个容纳了甲烷分子
若晶体中每8个笼只有3个容纳了甲烷分子
,另外5个笼被游离H2O分子填充,则天然气水水合物得平均组成可表示为A CH4 .14H2O
B CH4.17H2O
C CH4. 23/3 H2O
D CH4.6H2O
求详解.不要只有一个答案,因为我有答案 whhdlb1年前1
whhdlb1年前1 -
 ww5000年 共回答了13个问题
ww5000年 共回答了13个问题 |采纳率92.3%有多少个水分子构成的这8个笼子?1年前查看全部
- 甲烷分子 氧原子 二氧化碳分子 水分子 哪个是单质 哪个是化合物
 saqi20051年前1
saqi20051年前1 -
 令狐正雄 共回答了27个问题
令狐正雄 共回答了27个问题 |采纳率88.9%氧原子是单质,其他三种都是化合物1年前查看全部
- 跟2.8gN2含有相同分子数的下列物质是( ) A.16g氧气 B.0.1mol甲烷分子 C.1.8g水 D.3.01X
跟2.8gN2含有相同分子数的下列物质是( ) A.16g氧气 B.0.1mol甲烷分子 C.1.8g水 D.3.01X10^22个磷酸分子
 durian_li1年前2
durian_li1年前2 -
 7644lu 共回答了18个问题
7644lu 共回答了18个问题 |采纳率100%你选C的吧?是分子数.
2.8g N2 含分子数:0.1mol
故选 B1年前查看全部
- 3个硝酸根离子,2个甲烷分子,葡萄糖分子的化学符号分别怎样写?
 feng81801年前2
feng81801年前2 -
 XJ泥土 共回答了11个问题
XJ泥土 共回答了11个问题 |采纳率100%3NO3-、2CH4、C6H12O61年前查看全部
- 找一个高手帮我做化学群论的题在甲烷分子的电子光谱中,哪些电子状态之间的偶极跃迁是对称性禁阻的?这些禁阻是否源自宇称的限制
找一个高手帮我做化学群论的题
在甲烷分子的电子光谱中,哪些电子状态之间的偶极跃迁是对称性禁阻的?这些禁阻是否源自宇称的限制? 紫枫01261年前1
紫枫01261年前1 -
 r1428 共回答了14个问题
r1428 共回答了14个问题 |采纳率100%甲烷归属Td群,属中心对称群.
凡是那些电子态属于心对称的(centre symmetric)就只能跃迁到不是心对称的(centre asymmetric)态.反过来一样.
态(g) 态(g) 禁阻跃迁
态(u) 态(u) 禁阻跃迁
态(u) 态(g) 可允跃迁
态(g) 态(u) 可允跃迁
在甲烷分子,T(u)态到 A*(g)可允跃迁;A(g)到T*(u)可允跃迁;...1年前查看全部
- 一卤代物只有一种的烷烃,其分子结构有“球形”(A)和“椭球形”(B)两类,它们的组成有一定的规律性,A类是以甲烷分子为母
一卤代物只有一种的烷烃,其分子结构有“球形”(A)和“椭球形”(B)两类,它们的组成有一定的规律性,A类是以甲烷分子为母体,用甲基经过多次循环处理后制得的; B类是以乙烷分子为母体,用甲基多次循环处理后制得的.
(1)写出碳原子数在10个之内,一卤代烃只有一种的烷烃的结构简式.______;
(2)A与B之间是否存在同分异构体?为什么?______. 石清12281年前2
石清12281年前2 -
 Iverson999 共回答了14个问题
Iverson999 共回答了14个问题 |采纳率92.9%解题思路:(1)烷烃的一氯取代物只有一种,说明该烷烃中只有一种等效氢原子,根据等效氢原子的判断方法来回答;
(2)注意分子式是否相同.(1)烷烃分子中,同一个碳上的氢原子等效,连在同一个碳原子上的氢原子等效,具有镜面对称的碳原子上的氢原子等效,烷烃的一氯取代物只有一种,说明该烷烃中只有一种等效氢原子,在碳原子数n≤10的所有烷烃的同分异构体中,其一氯取代物只有一种的烷烃分别是:甲烷、乙烷、2,2-二甲基丙烷以及2,2,3,3-四甲基丁烷,
故答案为:CH4、CH3CH3、C(CH3)4、(CH3)3C-C(CH3)3;
(2)A与B分子式不可能相同,A类物质中碳原子数为奇数,B类物质中碳原子数为偶数.
故答案为:不可能有同分异构体存在,因为A类物质中碳原子数为奇数.点评:
本题考点: 同分异构现象和同分异构体.
考点点评: 本题考查学生同分异构体的概念和应用知识,要求学生具有整合知识的能力,难度较大.1年前查看全部
- 下列事实中能证明甲烷分子是以碳原子为中心的正四面体结构的是( )
下列事实中能证明甲烷分子是以碳原子为中心的正四面体结构的是( )
A. CH3Cl只代表一种物质
B. CH2Cl2只代表一种物质
C. CHCl3只代表一种物质
D. CCl4只代表一种物质 丽君沙1年前1
丽君沙1年前1 -
 flowerface 共回答了20个问题
flowerface 共回答了20个问题 |采纳率90%解题思路:若是正四面体,则只有一种结构,因为正四面体的两个顶点总是相邻关系.CH4分子中有四个等同的CH键,可能有两种对称的结构:正四面体结构和平面正方形结构.甲烷无论是正四面体结构还是正方形结构,一氯代物均不存在同分异构体.而平面正方形中,四个氢原子的位置虽然也相同,但是相互间存在相邻和相间的关系,其二氯代物有两种异构体:两个氯原子在邻位和两个氯原子在对位.若是正四面体,则只有一种,因为正四面体的两个顶点总是相邻关系.由此,由CH2Cl2只代表一种物质,可以判断甲烷分子是空间正四面体结构,而不是平面正方形结构.
故选B.点评:
本题考点: 常见有机化合物的结构.
考点点评: 本题考查常见有机化合物的结构,题目难度中等,注意CH2Cl2只代表一种物质,可以证明甲烷分子是空间正四面体结构,而不是平面正方形结构.1年前查看全部
- 请用化学符号填空:(1)空气中含量最多的元素______; (2)3个硝酸根离子______;(3)甲烷分子______
请用化学符号填空:
(1)空气中含量最多的元素______; (2)3个硝酸根离子______;
(3)甲烷分子______;(4)+2价的钡元素+2 Ba .+2 Ba  qianbaby1年前1
qianbaby1年前1 -
 WZSLWD1314 共回答了23个问题
WZSLWD1314 共回答了23个问题 |采纳率82.6%解题思路:本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目.(1)空气中各成分及体积分数为:氮气:78%、氧气:21%、稀有气体:0.94%、二氧化碳0.03%、水蒸气和杂质:0.03%.所以说空气中含量最多的元素是氮元素,其元素符号为:N;
(2)根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字;因此3个硝酸根离子表示为:3NO3-;
(3)根据有机物的书写规则,甲烷分子可表示为:CH4;
(4)表示元素的化合价的数字写在元素符号的正上方,且正负号在前,数字在后,因此+2价的钡元素表示为:
+2
Ba;
故答案为:(1)N;(2)3NO3-;(3)CH4;(4)
+2
Ba;点评:
本题考点: 化学符号及其周围数字的意义.
考点点评: 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.1年前查看全部
- 甲烷分子中C.H间是非极性键为什么是错的
 含蓄蓄1年前4
含蓄蓄1年前4 -
 本本世界11 共回答了19个问题
本本世界11 共回答了19个问题 |采纳率94.7%楼上是错解,真正的原因是C原子最外层4个电子,而H最外层只有1个电子,C的的电子能力较强,H的的电子能力较弱,即使是C和H共用一对电子对,但是共用的电子围绕C原子的可能性大于H,因为C的吸引电子能力比H强,所以C和H之间形成的是极性共价键1年前查看全部
- 现有10MOL甲烷有多少个甲烷分子
 暖烘电影1年前1
暖烘电影1年前1 -
 hh刀 共回答了18个问题
hh刀 共回答了18个问题 |采纳率100%1mol CH4 含有 6.02×10^23 个CH4 分子,则 10 mol CH4 就含有 6.02×10^24 个CH4分子.1年前查看全部
- 有机物的分子式都是通过实验定方法确定的.实验测得甲烷分子中碳的质量分数为75%,氢的质量分数为25%,在标准状况下定密度
有机物的分子式都是通过实验定方法确定的.实验测得甲烷分子中碳的质量分数为75%,氢的质量分数为25%,在标准状况下定密度是0.717g/L,试根据这些数据推断甲烷的分子式和结构式.
 prbinghuo1年前1
prbinghuo1年前1 -
 ujlnujlnkc 共回答了18个问题
ujlnujlnkc 共回答了18个问题 |采纳率94.4%甲烷的摩尔质量=22.4L/mol*0.717g/L=16克/摩尔.这个会吗?p=m/v 标准状况下n=v /22.4
带入即可 标准状况下p=M/22.4 结论很重要,记住!1年前查看全部
- 下列关于甲烷结构的说法错误的是( ) A.甲烷分子中的化学键都是共价键 B.甲烷分子为正四面体结构 C.甲烷分子为正四
下列关于甲烷结构的说法错误的是( ) A.甲烷分子中的化学键都是共价键 B.甲烷分子为正四面体结构 C.甲烷分子为正四边形结构 D.CH 2 C1 2 不存在同分异构体  制作ll1年前1
制作ll1年前1 -
 万里独行007 共回答了16个问题
万里独行007 共回答了16个问题 |采纳率93.8%A、甲烷中存在的化学键是碳氢单键,均是共价键,故A正确;
B、甲烷的空间结构为正四面体结构,故B正确;
C、甲烷的空间结构为正四面体结构,故C错误;
D、甲烷分子中,碳原子采取sp 3 杂化,4个碳氢键完全相同,CH 2 C1 2 不存在同分异构体,故D正确.
故选C.1年前查看全部
- 以下关于甲烷的说法中错误的是 ( ) A.甲烷分子是由极性键构成的分子 B.甲烷分子具有正四面体结构 C.甲烷分子中四
以下关于甲烷的说法中错误的是 ( )
A.甲烷分子是由极性键构成的分子 B.甲烷分子具有正四面体结构 C.甲烷分子中四个C—H键是完全等价的键 D.甲烷分子中具有非极性键  ncspider1年前1
ncspider1年前1 -
 喜欢樱桃的女巫 共回答了23个问题
喜欢樱桃的女巫 共回答了23个问题 |采纳率95.7%D
甲烷是极性键构成的非极性分子,正四面体结构,四个C—H键是完全等价的键,D错误。1年前查看全部
大家在问
- 1证明面面平行的题目,我把“垂直于同一平面的两个平面互相平行”当做真命题来做题,但的确两个面平行,...
- 2We offered him our congratulations___his passing the college
- 3AB与CD异面 求证:AC与BD异面 要图像
- 4假如两个物体运动的时间和路程都不相同,物理学中用什么来表示物体运动快慢
- 5一段彩带长14.6米,被剪成3段.第一二段共9.4米.三段彩带各长多少米?
- 6小李同学在探究摩擦力与哪些因素有关
- 7求一个点关于一条直线对称点坐标的公式
- 8成考数学选择题怎么考40分
- 9teacher's desk 中tecaher's 的“ ' ” 怎么拼读
- 10它在书的里面 上面 下面的英文句型
- 11将下列单词改成相应的职业名称 work teach sing drive dance clean farm wait
- 12翻译英文:No one would call what happened over those weeks a wast
- 13围魏救赵这个计策是孙膑提出的还是段干纶提出的?
- 14一个正方形容器棱长为3dm容器中水深14cm把一块石头放进水中这时水深16cm这石头体积多少
- 15请教复合函数求导法则证明中的的疑问