精盐(NaCI)与碱面(NaCO3)如何区别
 love赞2022-10-04 11:39:544条回答
love赞2022-10-04 11:39:544条回答说出现象和结论

已提交,审核后显示!提交回复
共4条回复
 顶级ee222 共回答了20个问题
顶级ee222 共回答了20个问题 |采纳率95%- 加稀盐酸,冒泡(CO2)的是碱面(NaCO3),无明显现象的是精盐(NaCI).
- 1年前
 xiao5501 共回答了4个问题
xiao5501 共回答了4个问题 |采纳率- 要分情况,若在实验室:1、加稀盐酸,有气泡产生的是碱面Na2CO3,无明显现象的是精盐NaCl。2、加水溶解,用PH试纸检验,若呈碱性则为Na2CO3,若为中性则为NaCl;若在厨房中:加醋酸有气泡产生的是碱面Na2CO3,无明显现象的是精盐NaCl。
- 1年前
 讨厌那把锁 共回答了2个问题
讨厌那把锁 共回答了2个问题 |采纳率- 加HCl NaCO3 会冒泡
食盐不反应 - 1年前
 易扣2005 共回答了69个问题
易扣2005 共回答了69个问题 |采纳率- 厨房中加醋酸
实验室中加稀盐酸 - 1年前
相关推荐
- 海水中含有丰富的资源.海水经风吹日晒可获得含有泥沙的粗盐,然后经过加工得到精盐.下面是某兴趣小组进行粗盐提纯实验的流程图
海水中含有丰富的资源.海水经风吹日晒可获得含有泥沙的粗盐,然后经过加工得到精盐.下面是某兴趣小组进行粗盐提纯实验的流程图,请回答下列问题:
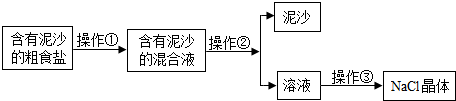
(1)实验操作①、②、③依次为下图中的(填字母)______.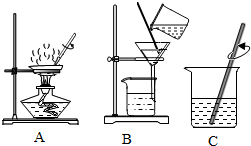
(2)在上述三个实验操作中,均需用到的仪器是______(填写仪器名称),其中在B操作中的作用是______;
(3)在B操作后,下面烧杯中的液体还是浑浊,原因是______.(写一条) 阿苇1年前1
阿苇1年前1 -
 失去理想的男人 共回答了14个问题
失去理想的男人 共回答了14个问题 |采纳率100%解题思路:(1)操作①为:粗盐溶解;操作②含有泥沙的混合液经过过滤,得较纯净的氯化钠溶液;操作③蒸发滤液,得氯化钠晶体.
(2)根据实验室制取粗盐的步骤及操作过程中所用到的仪器分析即可;
(3)根据过滤的基本操作分析回答.(1)图中:A、液体蒸发,B、过滤,C、溶解.故:操作①与C对应,操作②与B对应,操作③与A对应.(2)在上述三个实验操作中,均需用到的仪器是玻璃棒,其中在B操作中的作用是引流液体;(3)滤液浑浊可能的原因:滤...
点评:
本题考点: 氯化钠与粗盐提纯;过滤的原理、方法及其应用.
考点点评: 本题从多个角度对氯化钠的提纯实验进行了全面考察,灵活性强.掌握溶解、过滤、蒸发等实验的操作技能;理解过滤法分离混合物的化学原理;体会过滤的原理在生活生产等社会实际中的应用.1年前查看全部
- (2009•海南)请把精盐(NaCl)和纯碱(Na2CO3)两种白色固体物质区分出来,简述操作过程.
 众星罗1年前1
众星罗1年前1 -
 uu荆棘鸟 共回答了20个问题
uu荆棘鸟 共回答了20个问题 |采纳率85%解题思路:氯化钠和碳酸钠两种物质都是白色固体,所以不能通过观察颜色来判断.但它们两种物质所含的阴离子不同,所以可以根据阴离子不同来鉴别.精盐(NaCl)和纯碱(Na2CO3)均溶于纯净水,现象相同,故不能用溶解法来区分.化学反应的现象是多种多样的,所以可以根据化学反应的现象不同来区分.
故答案为:
各取少许精盐和纯碱于试管中,滴入2毫升稀盐酸,如果有能使澄清石灰水变浑浊的气体产生,证明该物质是纯碱,而另一种物质是精盐.点评:
本题考点: 物质的鉴别、推断;化学性质与物理性质的差别及应用.
考点点评: 氯化钠和纯碱若是在厨房中的,我们可以选择用品尝的方法来区分.但没有指明时,不能用品尝的方法.只能用化学方法.1年前查看全部
- 从海水晒盐而得到的粗盐中常含有泥沙,为提纯粗盐得到精盐而进行的主要操作,顺序正确的是( )
从海水晒盐而得到的粗盐中常含有泥沙,为提纯粗盐得到精盐而进行的主要操作,顺序正确的是( )
A.过滤、溶解、蒸发
B.溶解、蒸发、过滤
C.蒸发、溶解、过滤
D.溶解、过滤、蒸发 红火柴1年前1
红火柴1年前1 -
 menghaitao1978 共回答了18个问题
menghaitao1978 共回答了18个问题 |采纳率88.9%解题思路:海水晒盐得到的是粗盐.提纯含有少量泥沙的粗盐,首先要除去不溶性泥沙,正确步骤为溶解、过滤、蒸发,据此分析解答.用海水晒盐得到的是粗盐.要提纯含有少量泥沙的粗盐,首先要除去不溶性泥沙,除去不溶性固体可用过滤的方法,因此正确步骤为溶解、过滤、蒸发得到其晶体;
故选D.点评:
本题考点: 氯化钠与粗盐提纯.
考点点评: 本题考查氯化钠与粗盐提纯,探究实验的步骤,难度不大.1年前查看全部
- 粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥砂等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通
粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥砂等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①放置酒精灯 ; ②固定铁圈位置 ;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌; ⑤停止加热。
其正确的操作顺序为______________。
(2)如何运用最简方法检验溶液中SO 4 2- 离子是否除净?________________________。
(3)在粗盐经过溶解→过滤后的溶液中最后滴加饱和Na 2 CO 3 溶液,直至不再产生沉淀为止。请问这步操作的目的是_________________ 。
(4)将经过操作(3)后的溶液过滤。写出在滤液中除去过量NaOH和Na 2 CO 3 的化学方程式:_____________________。 lucy120231年前1
lucy120231年前1 -
 独流2008 共回答了12个问题
独流2008 共回答了12个问题 |采纳率100%(1)①②③④⑤
(2)静止片刻取少量上层清液于试管中,往试管中滴加一滴BaCl 2 溶液,如果出现白色浑浊或者沉淀,则溶液中有SO 4 2- ,不出现浑浊就说明SO 4 2- 已经除尽
(3)除去Ca 2+ 和过量Ba 2+
(4)NaOH+HCl=NaCl+H 2 O;Na 2 CO 3 +2HCl=2NaCl+H 2 O+CO 2 ↑1年前查看全部
- 某同学用提取的精盐配制100g质量分数为11.7%的氯化钠溶液,请你参与完成:
某同学用提取的精盐配制100g质量分数为11.7%的氯化钠溶液,请你参与完成:
(1)计算:氯化钠的质量为______g,水为______g.
(2)称量:用托盘天平称量,氯化钠应放在______(填“左盘”或“右盘”).
(3)溶解:用量筒来量取所需的水(水的密度为1g/cm3),量筒的规格是______(从下列中选用:10mL、25mL、50mL、100mL).量取液体时,量筒必须放平,视线与液体的______保持水平.溶解氯化钠要用到玻璃棒,其作用是______. fengfei_11年前1
fengfei_11年前1 -
 ocelot753 共回答了20个问题
ocelot753 共回答了20个问题 |采纳率95%解题思路:(1)计算:根据一定溶液的溶质质量分数飞计算公式来计算所需要的氯化钠的质量;由溶液质量=溶质质量+溶剂质量来计算所需的水的质量;
(2)使用托盘天平时应该是左物右码;
(3)用量筒量取液体要选择与所需液体体积接近且略大的量筒,量取液体时视线要与量筒内凹液面的最低处保持水平,溶解过程中玻璃棒的作用为搅拌一加速溶解,可以据此解答该题.(1)氯化钠的质量=100g×11.7%=11.7g;水的质量=100g-11.7g=88.3g;
(2)使用托盘天平时应该是左物右码,所以应该将氯化钠放在左盘;
(3)用量筒量取液体要选择与所需液体体积接近且略大的量筒,所以量取88.3mL水,应该选择100mL的量筒;量取液体时视线要与量筒内凹液面的最低处保持水平,溶解过程中玻璃棒的作用为搅拌以加速溶解.
故答案为:(1)11.7;88.3;
(2)左盘;
(3)100 mL;凹液面最低处;搅拌以加速溶解.点评:
本题考点: 一定溶质质量分数的溶液的配制.
考点点评: 本考点考查了配制溶液的步骤、量筒的读数、实验方案的评价等,考查的知识点比较多,要加强记忆,理解应用.本考点主要出现在实验题和填空题中.1年前查看全部
- 精盐的精制请说明1.实验步骤(最好概括一点,共有3个空格可填)2三步中都要用到的玻璃仪器3.操作分别是什么(一共3个空格
精盐的精制
请说明
1.实验步骤(最好概括一点,共有3个空格可填)
2三步中都要用到的玻璃仪器
3.操作分别是什么(一共3个空格可填) 清华我来了1年前1
清华我来了1年前1 -
 niexuan814 共回答了23个问题
niexuan814 共回答了23个问题 |采纳率95.7%1.实验步骤溶解、过滤、蒸发
2三步中都要用到的玻璃仪器玻璃棒
3.操作分别是什么
加适量水用玻璃棒搅拌溶解
过滤:用玻璃棒引流过滤
蒸发:用玻璃棒搅拌使受热均匀1年前查看全部
- 粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥砂等不溶性杂质.我们食用的精盐是用粗食盐提纯而得到的.通
粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥砂等不溶性杂质.我们食用的精盐是用粗食盐提纯而得到的.通过教材中“粗盐的提纯”及你做过的该实验回答下列问题.
(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①放置酒精灯;②固定铁圈位置;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌; ⑤停止加热.其正确的操作顺序为______.
(2)如何运用最简方法检验溶液中有无SO42-离子?______.如果有,应该如何除去SO42-离子?______.
(3)在粗盐经过溶解→过滤后的溶液中滴加饱和Na2CO3溶液,直至不再产生沉淀为止.请问这步操作的目的是______.
(4)将经过操作(3)后的溶液过滤.请问这一操作能除掉哪些杂质?______.
(5)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的;
溶解时:______.过滤时:______.蒸发时:______. 雷神艾米1年前1
雷神艾米1年前1 -
 6371208 共回答了24个问题
6371208 共回答了24个问题 |采纳率75%解题思路:(1)组装仪器的一般顺序是采用先下后上,先左后右的原则,利用本规则即可解答;
(2)加入氯化钡溶液检验硫酸根离子是否除尽;
(3)在粗盐提纯的过程中需要滴加饱和Na2CO3溶液除去钙离子以及过量的钡离子;
(4)过滤可把溶液和不溶于水的物质除去;
(5)溶解时为加快溶解、过滤时为防止液体外洒、冲破滤纸而引流、蒸发时为防止液体溅出都要使用玻璃棒.(1)组装仪器时要从下向上组装,酒精灯在铁圈和蒸发皿的下方,所以要先放酒精灯;然后再固定铁圈,放置蒸发皿;然后再点燃酒精灯加热,并搅拌,当有较多晶体析出时,停止加热,借余热蒸干.正确的操作顺序为①②③④⑤,故答案为:①②③④⑤;
(2)加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽,如果还有,可以在溶液中继续加入过量的氯化钡,
故答案为:静置片刻后,取上层清液于试管中,继续滴加氯化钡,若出现浑浊或白色沉淀,说明溶液中含有硫酸根,否则不含硫酸根;在溶液中继续加入过量的氯化钡;
(3)碳酸钠与镁离子生成碳酸镁沉淀、与钙离子生成碳酸钙沉淀、与钡离子生成碳酸钡沉淀,所以滴加饱和碳酸钠溶液,可以除去钙离子、镁离子和过量的钡离子,
故答案为:除去Ca2+、Mg2+及加入过量的Ba2+;
(4)过滤可把溶液和不溶于水的物质除去,可以除去硫酸钡、碳酸钙、碳酸镁、碳酸钡和泥沙等不溶性杂质,故答案为:BaSO4、BaCO3、CaCO3、MgCO3等杂质.
(5)在溶解操作中,玻璃棒起到搅拌以加快食盐的溶解的作用;
过滤操作中,玻璃棒用以引流而防止液体外洒,冲破滤纸;
蒸发操作中,玻璃棒起到搅拌而使液体受热均匀,防止因局部过热液滴或晶体飞溅,
故答案为:搅拌,加速溶解;使待滤液体沿玻璃棒流入漏斗,防止外洒;搅拌,防止因局部过热液滴或晶体飞溅.点评:
本题考点: 蒸发和结晶、重结晶;常见离子的检验方法;过滤.
考点点评: 本题考查在粗盐提纯的过程中所选用除杂和净化的方法,难度不大,除去杂质不要引入新的杂质,对于实验过程中过量的试剂都要除去.1年前查看全部
- 海水“晒盐”得到的粗盐中含有少量的泥沙等不溶性杂质,可通过下列步骤制取精盐:溶解→过滤→______(填写操作步骤).如
海水“晒盐”得到的粗盐中含有少量的泥沙等不溶性杂质,可通过下列步骤制取精盐:溶解→过滤→______(填写操作步骤).如果一次过滤后滤液仍浑浊,原因可能是______(写出一种即可),粗盐提纯实验中,先称取5.0g粗盐,最终得到3.6g精盐,则精盐的产率是______.(用百分数表示)  superman0081年前1
superman0081年前1 -
 冰惜 共回答了19个问题
冰惜 共回答了19个问题 |采纳率84.2%粗盐提纯的步骤:溶解→过滤→蒸发,根据过滤时的注意事项:“一贴,二低,三靠”,可以知道若滤液高于滤纸上边缘则可能导致滤液仍然浑浊;因为溶解5.0g粗盐,最终得到3.6g精盐,所以精盐的产率为
3.6g
5.0g ×100%=72%.
故答案为:蒸发;滤液高于滤纸边缘;72%.1年前查看全部
- 工业上制取精盐的步骤
 hkboy1年前1
hkboy1年前1 -
 泪的琥珀 共回答了23个问题
泪的琥珀 共回答了23个问题 |采纳率95.7%海水--晒盐(利用阳光进行蒸发结晶),得到粗盐(主要成分NaCl,还含有Mg2+、Ca2+、SO4^2-等其它离子)--精制得到精盐
精制:加入过量BaCl2溶液(沉淀SO4^2-),加入过量Ca(OH)2(沉淀Mg2+),加入过量Na2CO3(沉淀Ca2+、Ba2+),最后加适量盐酸,调节pH=7,再蒸发结晶过滤,即得到精盐
加入试剂除杂质的顺序可以有多种,但要保证几点:
(1)盐酸一定在最后
(2)除去SO4^2-的Ba2+要一定在Na2CO3前面,保证多余的Ba2+被Na2CO3沉淀
(3)沉淀Mg2+一般是转化为Mg(OH)2更好,用的试剂可以是NaOH,但Ca(OH)2更便宜1年前查看全部
- 粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥砂等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通
粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥砂等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程
①放置酒精灯 ;②固定铁圈位置 ;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌; ⑤停止加热。其正确的操作顺序为__________________。
(2)在粗盐经过溶解→过滤后的溶液中滴加饱和Na 2 CO 3 溶液,直至不再产生沉淀为止。请问这步操作的目的是__________________。
(3)将经过操作(2)后的溶液过滤。请问这一操作能除掉哪些杂质?__________________。
(4)回答下列问题:中学化学实验中,在过滤器上洗涤沉淀的操作是__________________。 珍珠珊1年前1
珍珠珊1年前1 -
 zhaoxian03 共回答了21个问题
zhaoxian03 共回答了21个问题 |采纳率90.5%(1)①②③④⑤
(2)除尽溶液中的钙离子
(3)除去Ca 2+ 和Ba 2+
(4)过滤后,沿玻璃棒向过滤器中注入蒸馏水没过沉淀物,待水流尽后,重复操作2-3次1年前查看全部
- 精盐(NaCL)和纯盐(na2co3)是家庭厨房中两种常见物质.现有精盐和纯碱两种固体混合物53克
精盐(NaCL)和纯盐(na2co3)是家庭厨房中两种常见物质.现有精盐和纯碱两种固体混合物53克
加入足量的稀硫酸,充分反应后,生成4.4克二氧化碳气体,则该固体混合物中纯碱的质量是多少克?该固体混合物中氯化钠的质量分数是多少? cyndi_cy1年前1
cyndi_cy1年前1 -
 子兔子 共回答了23个问题
子兔子 共回答了23个问题 |采纳率95.7%Na2CO3+H2SO4=Na2SO4+H2O+CO2106 44 X 4.4g x=10.6g混合物中氯化钠的质量分数=(53-10.6)/53=80%...1年前查看全部
- 在备制精盐的过程中,氯化钡和碳酸钠溶液的添加顺序是否可以颠倒?
在备制精盐的过程中,氯化钡和碳酸钠溶液的添加顺序是否可以颠倒?
去除海水中的可溶性杂志,备制精盐的过程中,氯化钡和碳酸钠溶液的添加顺序是否可以颠倒? 金龙大1年前3
金龙大1年前3 -
 七琴 共回答了18个问题
七琴 共回答了18个问题 |采纳率100%坚决不可以
必须先+氯化钡,再+碳酸钠,
+碳酸钠的目的除去溶液中的钙离子,还要除去上一步中加入的过量的钡离子.1年前查看全部
- 现有精盐(NaCl)和纯碱 (Na2CO3)两种固体混合物53克,加入足量的稀硫酸,充分反应后,生成4. 4克二氧化碳气
现有精盐(NaCl)和纯碱 (Na2CO3)两种固体混合物53克,加入足量的稀硫酸,充分反应后,生成4. 4克二氧化碳气体,则该固体混台物中纯碱(Na2CO3)的质量是多少克? 该固体混合物中氯化钠的质量分数是多少?
标准格式!
 胖胖叶子1年前1
胖胖叶子1年前1 -
 舜之伊人 共回答了24个问题
舜之伊人 共回答了24个问题 |采纳率91.7%设固体中碳酸钠的质量为x
Na2CO3+2HCl====2NaCl+H2O+CO2|
106 44
x 4.4g
106:44=x:4.4g
x=10.6g
NaCl的质量分数为(53g-10.6g)/53X100%=80%
答:略1年前查看全部
- 电解饱和食盐水时,电解之前食盐水需要精制,目的是除去精盐中含有的钙离子、镁离子、硫酸根离子等杂质离子,使用的试剂有:a.
电解饱和食盐水时,电解之前食盐水需要精制,目的是除去精盐中含有的钙离子、镁离子、硫酸根离子等杂质离子,使用的试剂有:a.Na2CO3溶液 b.Ba(OH)2溶液 c.稀盐酸,其合理的加入顺序为______
答案是bac请问为什么不能abc? 莞儿99021年前3
莞儿99021年前3 -
 晴晴666 共回答了20个问题
晴晴666 共回答了20个问题 |采纳率90%加入Ba(OH)2溶液使硫酸根以硫酸钡沉淀形式除去,但又引入新的杂质钡离子.再加入过量Na2CO3溶液可以让钡离子也除去1年前查看全部
- (1)反应I2+2S2O32-=2I-+S4O62-常用于精盐中碘含量测定.某同学利用该反应探究浓度对反应速率的影响.实
(1)反应I2+2S2O32-=2I-+S4O62-常用于精盐中碘含量测定.某同学利用该反应探究浓度对反应速率的影响.实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择______ (填序号).
①1mL0.01mol•L-1的碘水 ②1mL0.001mol•L-1的碘水
③4mL0.01mol•L-1的Na2S2O3溶液④4mL0.001mol•L-1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算υ(S2O32-)=______. 紫云轩1年前1
紫云轩1年前1 -
 mao_123 共回答了21个问题
mao_123 共回答了21个问题 |采纳率90.5%解题思路:(1)用淀粉溶液做指示剂,通过褪色时间判断浓度与反应速率的关系,I2应完全反应,蓝色褪去,采取控制变量法,碘水的浓度不变,改变Na2S2O3溶液浓度,进行对比试验;
(2)根据v=[△c/△t]计算v(I2),再根据速率之比等于化学计量数之比计算v(S2O32-),注意混合后c(I2)=[1mL× 0.01mol/L/1mL+1mL+4mL]=[1/6]×0.01mol/L.(1)用淀粉溶液做指示剂,通过褪色时间判断浓度与反应速率的关系,I2应完全反应,蓝色褪去,采取控制变量法,碘水的浓度不变,改变Na2S2O3溶液浓度,②1mL0.001mol•L-1的碘水与③4mL0.01mol•L-1的Na2S2O3溶液、④4mL 0.001mol•L-1的Na2S2O3溶液反应,I2都能完全反应;①1mL0.01mol•L-1的碘水与④4mL 0.001mol•L-1的Na2S2O3溶液反应,I2不能完全反应,蓝色不能褪去,无法判断,
答案为:②③④;
(2)混合后c(I2)=[1mL× 0.01mol/L/1mL+1mL+4mL]=[1/6]×0.01mol/L.所以v(I2)=
1
6×0.01mol/L
4s=[1/6]×0.0025mol/(L•s),根据速率之比等于化学计量数之比,所以v(S2O32-)=2v(I2)=2×[1/6]×0.0025mol/(L•s)=8.33×10-4mol/(L•ms),
故答案为:8.33×10-4mol/(L•s).点评:
本题考点: 浓度、温度、催化剂对化学反应速率的影响.
考点点评: 本题考查化学速率的测定,化学速率计算等,难度较大,计算v(S2O32-)是易错点,容易忽略混合后,起始浓度变化.1年前查看全部
- 将含泥沙的粗盐提纯,并用制得的精盐配制15%的氯化钠溶液,下列说法错误的( )
将含泥沙的粗盐提纯,并用制得的精盐配制15%的氯化钠溶液,下列说法错误的( )
A.过滤时搅拌漏斗中的液体可以加快过滤速度
B.蒸发滤液时,不断用玻璃棒搅拌蒸发皿中的液体
C.配制过程的步骤是:计算、称量、溶解
D.配制时常用的仪器是:托盘天平、量筒、烧杯、玻璃棒 梦与翼1年前1
梦与翼1年前1 -
 麻木 共回答了16个问题
麻木 共回答了16个问题 |采纳率100%解题思路:根据粗盐提纯及配制溶液的步骤分析,过滤时玻璃棒引流是防止液体外流,蒸发时玻璃棒搅拌是防止液滴飞溅,用食盐和水配制食盐水步骤是计算,称量量取,溶解.A、过滤时不能搅拌漏斗中的液体,防止划破滤纸,故A错误;
B、蒸发滤液时,不断用玻璃棒搅拌蒸发皿中的液体,防止液体局部受热,造成液滴飞溅,B正确;
C、配制时先计算,然后用托盘天平称量食盐,再用量筒量取水,然后放在烧杯内溶解,故C正确;
D、配制时用到的仪器有托盘天平、量筒、烧杯和玻璃棒,正确
故选A点评:
本题考点: 氯化钠与粗盐提纯;一定溶质质量分数的溶液的配制.
考点点评: 记住并会操作粗盐提纯及配制溶液是解答本题关键.1年前查看全部
- 怎么鉴别白醋,苏打粉,精盐
 YARU1191年前5
YARU1191年前5 -
 wutianda1986 共回答了29个问题
wutianda1986 共回答了29个问题 |采纳率79.3%分别用水溶解,制取三种无色溶液,用紫色石蕊溶液检验,变红色的是白醋,变蓝色的是苏打粉【苏打粉:Na2CO3,它的水溶液显碱性】,无变色(仍是紫色)的是精盐.1年前查看全部
- 制备精盐过程中,氯化钡碳酸钠顺序为什么不能颠倒?
 yaneryu55881年前1
yaneryu55881年前1 -
 xtzf006 共回答了13个问题
xtzf006 共回答了13个问题 |采纳率92.3%加入氯化钡会混入钡离子,要用碳酸钠中的碳酸根离子去除1年前查看全部
- 有一台天平,丢失了一些砝码,现在只有1个2克的砝码,2颗分别重7克和8克的珠子.你能一次就称出13克的精盐吗?说说你的做
有一台天平,丢失了一些砝码,现在只有1个2克的砝码,2颗分别重7克和8克的珠子.你能一次就称出13克的精盐吗?说说你的做法.
 虾米果1年前1
虾米果1年前1 -
 江中月Y 共回答了18个问题
江中月Y 共回答了18个问题 |采纳率88.9%把两克的砝码放在天平的一端,把7克和8克的珠子放在天平的另一端.然后在放了2克砝码的那一端倒入精盐,直到天平平衡.这个时候,取下砝码,就得到了13克精盐.1年前查看全部
- (2014•营口三模)某同学用提取的精盐配制100g质量分数为11.7%的氯化钠溶液,请你参与完成:
(2014•营口三模)某同学用提取的精盐配制100g质量分数为11.7%的氯化钠溶液,请你参与完成:
(1)计算:需氯化钠的质量为______g,水为______g.
(2)称量:托盘天平调平完成后,接下来的操作应该是______(填字母序号)
A 左盘纸片上添加氯化钠B 右盘纸片上添加砝码
(3)溶解:用量筒来量取所需的水(水的密度为1g/cm3),量筒的规格是______(从下列
规格中选用:10mL、25mL、50mL、100mL).溶解氯化钠要用到玻璃棒,其作用是______.
(4)反思:若称取的氯化钠中含有水分,则所配制的溶液溶质质量分数会______(填“偏大”、“偏小”或“无影响”).
(5)称量和量取过程中,一定要正确操作,否则都会导致实验失败,如,量取液体时,俯视读数,导致所配制的溶液的溶质质量分数______,称量固体时,物品和砝码放反了,导致所配制的溶液的溶质的质量分数______.在正确放置砝码和物品的前提下,若称量中发现指针偏右,应该进行的操作是______. 我想泡你1年前1
我想泡你1年前1 -
 w326761002 共回答了21个问题
w326761002 共回答了21个问题 |采纳率66.7%解题思路:(1)利用溶质质量=溶液质量×溶质的质量分数,可根据溶液的质量和溶质的质量分数计算配制溶液所需要的溶质的质量;再根据溶剂质量=溶液质量-溶质质量即可求得水的质量.
(2)根据托盘天平的使用方法进行分析解答.
(3)从减小实验误差的角度去选择量筒的量程,结合溶解操作中玻璃棒的作用进行分析解答.
(4)称取的氯化钠中含有水分,会造成实际所取的溶质的质量偏小,据此进行分析解答.
(5)量取液体时,俯视读数,读数比实际液体体积大,会造成实际量取的水的体积偏小;指针偏右,说明药品质量小于砝码质量.(1)溶质质量=溶液质量×溶质的质量分数,配制100g质量分数为11.7%的氯化钠溶液,需氯化钠的质量=100g×11.7%=11.7g;溶剂质量=溶液质量-溶质质量,则所需水的质量=100g-11.7g=88.3g.
(2)托盘天平调平完成后,接下来的操作应该是右盘纸片上添加砝码,然后再向左盘纸片上添加氯化钠.
(3)所需水的质量为88.3g(合88.3mL),选取量筒时,尽量选用能一次量取的最小规格的量筒.量取88.3mL水时,应选择量100mL的量筒.
溶解氯化钠要用到玻璃棒,其作用是搅拌,加速氯化钠的溶解速率.
(4)称取的氯化钠中含有水分,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小.
(5)量取液体时,俯视读数,读数比实际液体体积大,会造成实际量取的水的体积偏小,导致所配制的溶液的溶质质量分数偏大;
称量固体时,物品和砝码放反了,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小.
在正确放置砝码和物品的前提下,若称量中发现指针偏右,说明药品质量小于砝码质量,故应继续向左盘添加氯化钠,直至天平平衡.
故答案为:(1)11.7;88.3;(2)B;(3)100mL;搅拌,加速氯化钠的溶解速率;(4)偏小;(5)偏大;偏小;继续向左盘添加氯化钠.点评:
本题考点: 一定溶质质量分数的溶液的配制;测量容器-量筒;称量器-托盘天平.
考点点评: 本题难度不大,明确配制一定溶质质量分数的溶液实验步骤、注意事项等即可正确解答本题.1年前查看全部
- 实验室里由粗盐制备精盐的实验中,必需的操作步骤有( )
实验室里由粗盐制备精盐的实验中,必需的操作步骤有( )
A. 溶解
B. 过滤
C. 分液
D. 萃取 fqyying1年前2
fqyying1年前2 -
 jimoshamo 共回答了25个问题
jimoshamo 共回答了25个问题 |采纳率92%解题思路:实验室里由粗盐制备精盐的实验中,首先将粗盐溶解,然后加入除杂试剂将杂质离子变成沉淀,然后通过过滤除去难溶物,最后对滤液进行蒸发浓缩达到纯净的氯化钠,以此解答该题.粗盐中含有不溶性的杂质,因此正确的操作应该是溶解后过滤,最后蒸发浓缩结晶即可,不需要萃取、分液,
故选AB.点评:
本题考点: 物质的分离、提纯的基本方法选择与应用.
考点点评: 本题考查物质的分离、提纯,为高频考点,侧重于学生的分析能力和实验能力的考查,题目难度不大,注意掌握粗盐提纯过程中除杂试剂的选用及除杂试剂的加入顺序,明确除杂原则:除去多种杂质时,要考虑加入试剂的顺序,为了保证将杂质除尽,所加试剂必须过量,因此为了不引进新的杂质,后面加入的试剂要能够除去前面所进入的过量试剂.1年前查看全部
- 请把精盐(NaCl)和纯碱(Na2CO3)两种白色固体物质区分出来,简述操作过程.
 mmo密密麻麻1年前3
mmo密密麻麻1年前3 -
 水乳交溶 共回答了27个问题
水乳交溶 共回答了27个问题 |采纳率96.3%解题思路:氯化钠和碳酸钠两种物质都是白色固体,所以不能通过观察颜色来判断.但它们两种物质所含的阴离子不同,所以可以根据阴离子不同来鉴别.精盐(NaCl)和纯碱(Na2CO3)均溶于纯净水,现象相同,故不能用溶解法来区分.化学反应的现象是多种多样的,所以可以根据化学反应的现象不同来区分,例如碳酸钠能与盐酸、氢氧化钙等反应.
故答案为:
各取少许白色固体物质于试管中,滴入2毫升稀盐酸,如果有能使澄清石灰水变浑浊的气体产生,证明该物质是纯碱,而另一种物质是精盐.
各取少许白色固体物质于试管中,分别加入2少量的水,再加入澄清的石灰水,产生浑浊的是碳酸钠,而另一种物质是精盐.点评:
本题考点: 物质的鉴别、推断;化学性质与物理性质的差别及应用.
考点点评: 氯化钠和纯碱若是在厨房中的,我们可以选择用品尝的方法来区分.但没有指明时,不能用品尝的方法.只能用化学方法.1年前查看全部
- 怎样从不纯的精盐中提取出纯的氯化钠?
怎样从不纯的精盐中提取出纯的氯化钠?
怎样除去精盐中的氯化镁和氯化钙? ybopt1年前2
ybopt1年前2 -
 小米米1 共回答了15个问题
小米米1 共回答了15个问题 |采纳率80%首先,加入足量的水,滤除杂质;
第二部,加入足量氢氧化纳溶液,
将沉淀,滤除
第三部,加入足量的稀盐酸
第四步,加热,将水分蒸发,就是精盐1年前查看全部
- 提取精盐时杂质检验方法
 娃哈哈o4991年前1
娃哈哈o4991年前1 -
 rr之父 共回答了19个问题
rr之父 共回答了19个问题 |采纳率84.2%硫酸根:氯化钡溶液
钙离子:饱和草酸钠溶液
镁离子:氢氧化钠+镁试剂,显蓝色说明有镁离子存在1年前查看全部
- 海水晒盐是因为食盐的海水晒盐是因为食盐的________,海水晒的盐常有杂质,如泥沙____,______等,要得到精盐
海水晒盐是因为食盐的
海水晒盐是因为食盐的________,海水晒的盐常有杂质,如泥沙____,______等,要得到精盐必须经过_____,_______,_______三个主要操作。 maldmald1年前1
maldmald1年前1 -
 甜蜜笑脸 共回答了13个问题
甜蜜笑脸 共回答了13个问题 |采纳率92.3%可容性水蒸发了 盐出来了1年前查看全部
- .怎样将粗盐中的不溶性杂质(泥沙)除去,如何从溶液中得到精盐(提示:要从溶解度的角度考虑)?
 newbie_seagate1年前4
newbie_seagate1年前4 -
 海洋的甲甲134 共回答了19个问题
海洋的甲甲134 共回答了19个问题 |采纳率94.7%先溶于水,过滤即可除去泥沙.
再将滤液蒸发即可得精盐.氯化钠的溶解度随温度的升高而增大,但变化不大.所以用蒸发溶剂1年前查看全部
- 为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42+以及泥沙等杂质,某同学设计了一种制备精盐的实验方案.
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42+以及泥沙等杂质,某同学设计了一种制备精盐的实验方案.
(1)判断BaCl2已过量的方法是_________________________________ 鹊1511年前1
鹊1511年前1 -
 小伟的伟 共回答了15个问题
小伟的伟 共回答了15个问题 |采纳率100%不在有白色沉淀生成1年前查看全部
- 用氯化钠饱和溶液反复冲洗可去除食盐中的杂质以达到制取精盐 为什么
 canric1年前3
canric1年前3 -
 sd240324 共回答了20个问题
sd240324 共回答了20个问题 |采纳率85%因为氯化钠饱和溶液不能溶解氯化钠但能融氯化镁氯化钙等杂质,所以最后留下的就是比较纯的氯化钠咯1年前查看全部
- 1.精盐和纯碱 可以用下列哪种物质区分 白酒 米醋 纯净水 酱油
1.精盐和纯碱 可以用下列哪种物质区分 白酒 米醋 纯净水 酱油
2.精盐中不小心掺和了纯碱 应该用稀盐酸 还是稀硫酸 来重新得到精盐 为什么? songhe6661年前1
songhe6661年前1 -
 何为_ 共回答了19个问题
何为_ 共回答了19个问题 |采纳率94.7%1.米醋
2.稀盐酸,稀盐酸和纯碱反应生成氯化钠,不引入新的杂质
上楼的氢氧化钠是哪来的,别把人教错了1年前查看全部
- 粗盐经溶解蒸发过滤可制得精盐这句为什么错?
 中原过客1年前1
中原过客1年前1 -
 liwdqih 共回答了21个问题
liwdqih 共回答了21个问题 |采纳率95.2%因为粗盐中含有很多杂质经溶解蒸发过滤只是去除了不可溶的杂质,而其中还含有可溶性盐等杂质所以粗盐经溶解蒸发过滤可制得精盐这句是错的1年前查看全部
- 粗盐制精盐中有哪些方程式?
 SOSO看过来1年前2
SOSO看过来1年前2 -
 sally313 共回答了23个问题
sally313 共回答了23个问题 |采纳率91.3%粗盐提纯:
先将粗盐溶于水,
再过滤(注意一贴二低三靠),
然后加入过量的BaCl2溶液,除去Na2SO4:BaCl2+Na2SO4==BaSO4↓+2NaCl
然后加入过量的NaOH溶液,除去MgCl2:MgCl2+2NaOH==Mg(OH)2↓+2NaCl
然后加入过量的Na2CO3溶液,除去CaCl2和BaCl2(两个反应方程式):Na2CO3+CaCl2==CaCO3↓+2NaCl Na2CO3+BaCl2==BaCO3↓+2NaCl
过滤
最后滴加适量盐酸至恰好不再产生气体,除去NaOH和Na2CO3(可以用PH试纸检测酸碱度,也有两个反应方程式):HCl+NaOH==NaCl+H2O
2HCl+Na2CO3==2NaCl+H2O+CO2↑
蒸发溶液,析出NaCl晶体.1年前查看全部
- 精盐提纯过程中,是否可用Ca(OH)2、、Ba(OH)2代替NaOH除去粗盐中的氯化镁?
 一只完美xx的猪1年前2
一只完美xx的猪1年前2 -
 喜雨纷飞 共回答了24个问题
喜雨纷飞 共回答了24个问题 |采纳率91.7%当然不行啦 NaOH和粗盐中的氯化镁反应生成NaCL和沉淀,不引入新杂质.用Ca(OH)2、、Ba(OH)2代替则会有新杂质,还怎么提纯?1年前查看全部
- Nacl 制精盐,所加试剂顺序?
Nacl 制精盐,所加试剂顺序?
粗食盐中常含CaCl2,MgCl2,Na2SO4杂质,需加入NaOH溶液,Na2CO3溶液,BaCl2溶液和盐酸(均过量),然后过滤,蒸发,可制得精盐,所加四种溶液的顺序正确的是( )
A.NaOH,BaCl2,Na2CO3,HCl B.BaCl2,Na2CO3,HCl ,NaOH
C.Na2CO3,BaCl2,NaOH,HCl D.BaCl2,NaOH,Na2CO3,HCl 原来的ll1年前1
原来的ll1年前1 -
 xinyu_deng 共回答了26个问题
xinyu_deng 共回答了26个问题 |采纳率84.6%BaCl2用于除Na2SO4,因为过量,所以引入了钡离子,碳酸根可以除掉钡离子,所以碳酸根一定要在钡离子加入后加入.而BaCl2和NaOH谁先加入没有区别,盐酸最后加入是为了出去过量的氢氧根和碳酸根.1年前查看全部
- 英语翻译制作原料;羊肉、鸡蛋1个、大葱、精盐、酱油.制作方法:将羊肉切成片,放入碗内加盐、鸡蛋.将大葱一剖为二,切成段,
英语翻译
制作原料;羊肉、鸡蛋1个、大葱、精盐、酱油.制作方法:将羊肉切成片,放入碗内加盐、鸡蛋.将大葱一剖为二,切成段,取一空碗放入精盐、酱油.炒锅内放入食用油,在旺火上烧至六成热(约150℃)时,放入羊肉,再放入葱段搅散迅速捞出.锅内留少量油,用旺火烧热后放入羊肉丁、葱段爆炒.最后倒入碗内. 山庄hhcc1年前1
山庄hhcc1年前1 -
 brinneyhk 共回答了19个问题
brinneyhk 共回答了19个问题 |采纳率78.9%···翻译成什么语言?1年前查看全部
- 英语翻译笼汤包原料:仔发面团750克 猪肥瘦肉400克 猪肉皮250克 生姜10克 大葱50克 精盐3克 胡椒粉3克 料
英语翻译
笼汤包原料:仔发面团750克 猪肥瘦肉400克 猪肉皮250克 生姜10克 大葱50克 精盐3克 胡椒粉3克 料酒15克 酱油25克 葱姜汁30克 白糖15克 鸡精5克 味精5克 香油10克 鲜汤少许制法:猪肉皮刮洗净,切成条,放入清水锅中,加入生姜、大葱?均拍破 、料酒,用大火烧沸后,撇净浮沫,转用小火熬至汤汁浓稠,打去料渣不用,调入胡椒粉、鸡精、酱油,待其冷却后,即成皮冻,切成细粒待用.猪肥瘦肉剁细,放入盆中,加入精盐、白糖、味精、香油、姜葱汁及少许鲜汤搅拌均匀,再加入皮冻粒和匀,即成馅料.将仔发面团搓成条,下成40个剂子,用手按成中间厚边上薄的圆形皮坯后,分别放上馅料,再包起收拢,将收口捏成褶皱,即成小笼汤包生坯,放入垫有松针的小笼内,用沸水旺火蒸约8分钟,即成.特点:皮薄馅嫩,汤多汁鲜包. pscs281年前2
pscs281年前2 -
 asksky010 共回答了18个问题
asksky010 共回答了18个问题 |采纳率83.3%Cage soup packets of raw materials:Tsai-fat dough 750 grams of lean meat 400 grams of pork fat pig skin 250 grams of ginger 10 grams onion 50 grams of salt 3 grams pepper 3 grams cooking wine 15 grams of soy sauce 25 grams onion ginger juice,30 grams sugar 15 grams Chicken 5 g MSG 5 grams of sesame oil 10 grams of soup a little system of law:1 pork skin scraping washed,cut into section and put it into clean water pot,add ginger,green onions were shot broken,cooking wine,use the fire Shaofei,the net charge-off floating foam,transfer Small Thermal Aozhi thick soup,playing to the material residue No,transferred pepper,chicken,soy sauce,cooled after the skin Serve cold,cut into fine-grained stand-by.2 Pig fat lean meat chopped fine and put it into pot,add salt,sugar,MSG,sesame oil,spring onion,ginger juice and a little soup mix evenly,then add cold tablets and skin absorption,Serve fillings.3 the dough twist of Aberdeen,the next into 40 sub-agent by hand into the middle of thick according to the circular edge of a thin skin blank after the fillings were placed,and then wrapped Shoulong,will be shut and shape into folds,Serve dumplings steamed dumpling Green,the dumplings into the pad inside the pine needles,using boiling water,stir steam about 8 minutes,Serve.Features:thin tender stuffing,soup,juicy fresh package.1年前查看全部
- (12分)粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗食盐提纯而
(12分)粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通常经过以下步骤:①加入稍过量的BaCl 2 溶液;②加入稍过量的NaOH溶液;③加入稍过量的Na 2 CO 3 溶液;④过滤;⑤滴入稀盐酸至无气泡产生;
回答下列问题。
(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程①放置酒精灯;②固定铁圈位置;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌;⑤停止加热。其正确的操作顺序为
(2)如何运用最简单方法检验步骤①后溶液中有无SO 4 2 - 离子? 。如果有,应该如何除去SO 4 2 - 离子? 。
(3)步骤③加入稍过量Na 2 CO 3 溶液,直至不再产生沉淀为止。请问这步操作的目的是 。
(4)将经过步骤④过滤操作后。请问这一操作能除掉哪些杂质?
。
(5)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,使用玻璃棒的目的: 。 sksniper1年前1
sksniper1年前1 -
 幻想泡泡0302 共回答了21个问题
幻想泡泡0302 共回答了21个问题 |采纳率85.7%(12分)(1)①②③④⑤
(2)静止片刻在上层清液处,滴加一滴BaCl 2 溶液,如果出现白色浑浊,则溶液中有SO 4 2 - 。除去SO 4 2 - 的方法是在溶液中加入过量的BaCl 2 溶液。
(3)除去Ca 2+ 及过量Ba 2+
(4)BaSO 4 、CaCO 3 、Mg(OH) 2 、BaCO 3 、泥沙(5)搅拌,引流。
考查物质的分离和提纯。
(1)蒸发时如果出现大量晶体时,即应该停止加热,所以正确的顺序是①②③④⑤。
(2)检验溶液中有无SO 4 2 - 离子的方法是继续滴加氯化钡溶液,即静止片刻在上层清液处,滴加一滴BaCl 2 溶液,如果出现白色浑浊,则溶液中有SO 4 2 - 。除去SO 4 2 - 的方法是在溶液中加入过量的BaCl 2 溶液。
(3)由于溶液中含有钙离子及过量的钡离子,所以碳酸钠的作用是除去Ca 2+ 及过量Ba 2+
。
(4)由于钙离子转化为碳酸钙,镁离子转化为氢氧化镁,SO 4 2 - 转化为硫酸钡,因此过滤除去的物质是BaSO 4 、CaCO 3 、Mg(OH) 2 、BaCO 3 及泥沙。
(5)在溶解和蒸发时都需要玻璃棒搅拌,而过滤时则起引流的作用。1年前查看全部
- 精盐制得粗盐过程溶解——过滤——蒸发——转移,
 135119994301年前1
135119994301年前1 -
 yzg5618 共回答了24个问题
yzg5618 共回答了24个问题 |采纳率91.7%即将完全粗盐溶解在水中
过滤:将上面制得的溶液用滤纸过滤,收集滤液
蒸发:将上述的滤液加入蒸发掉水分、结晶,此过程不能直接加热到水分全干
转移:将上述蒸发结晶得到的固体转移至干的容器中存放1年前查看全部
- 已知粗盐质量是5g,提纯实验得到的精盐质量是3.9g,则该粗盐的纯度为?
 zeroxenof1年前7
zeroxenof1年前7 -
 jujiezhang 共回答了16个问题
jujiezhang 共回答了16个问题 |采纳率93.8%纯度=精致后的质量/最初质量*100%
可以直接代入数据,3.9/5*100%=78%1年前查看全部
- 如何鉴别厨房中的精盐和碱面请利用家庭中现有的条件将它们区分开来,简述实验步骤,实验现象和结论要利用化学性质不要利用物理性
如何鉴别厨房中的精盐和碱面
请利用家庭中现有的条件将它们区分开来,简述实验步骤,实验现象和结论
要利用化学性质不要利用物理性质! xiaolaoxia1234561年前1
xiaolaoxia1234561年前1 -
 水源头 共回答了11个问题
水源头 共回答了11个问题 |采纳率90.9%将少许白醋分别滴入两种白色粉末中,有气泡产生的是面碱(即纯碱或小苏打),没有明显变化的一个是食盐1年前查看全部
- 若在蒸发过程中有少量液体溅出,则对精盐的产率产生什么样的影响
 大vv来了1年前1
大vv来了1年前1 -
 苏27ss0028 共回答了21个问题
苏27ss0028 共回答了21个问题 |采纳率95.2%精盐的产率会降低,原因是:溅出的液体中,溶解有一定的食盐,最后得到的食盐肯定比原来溶液中的要少,所以产率减小.1年前查看全部
- 溶解时未充分搅拌;,为什么会使精盐产率偏低
 ailaure1年前1
ailaure1年前1 -
 上玄之月 共回答了12个问题
上玄之月 共回答了12个问题 |采纳率91.7%未充分搅拌,融入水中的盐的质量就少了 精致后m小了,除以最开始时的质量,除下来的数就小了 所以 精盐产率偏低1年前查看全部
- 粗食盐中常常含有杂质CaCl 2 、MgCl 2 、Na 2 SO 4 和.用粗盐制备精盐时,通常采取溶解、除杂、过滤和
粗食盐中常常含有杂质CaCl 2 、MgCl 2 、Na 2 SO 4 和.用粗盐制备精盐时,通常采取溶解、除杂、过滤和蒸发的操作.其中往粗盐溶液中加入NaOH溶液、Na 2 CO 3 溶液、BaCl 2 溶液和盐酸(均可过量)的目的就是除杂.所加四种溶液的顺序不正确的是( ) A.BaCl 2 、NaOH、Na 2 CO 3 、HCl B.NaOH、BaCl 2 、Na 2 CO 3 、HCl C.Na 2 CO 3 、BaCl 2 、NaOH、HCl D.BaCl 2 、Na 2 CO 3 、NaOH、HCl  yuanyuan7909291年前1
yuanyuan7909291年前1 -
 千机 共回答了13个问题
千机 共回答了13个问题 |采纳率92.3%A、先加氯化钡,除去硫酸根,再加氢氧化钠,除去镁离子,再加碳酸钠,除去多余的钡离子和钙离子,最后加盐酸,除去多余的碳酸钠和氢氧化钠,故A正确;
B、先加氢氧化钠,除去镁离子,再加氯化钡,除去硫酸根,再加碳酸钠,除去钙离子和多余的钡离子,最后加盐酸,除去多余的碳酸钠和氢氧化钠,故B正确;
C、先加过量的碳酸钠,再加过量的氯化钡溶液,多余的钡离子不能被除去,故不能达到目的,故C错误;
D、先加入氯化钡,除去硫酸根,再加碳酸钠,能把钙离子和多余钡离子除去,再加氢氧化钠,除去镁离子,最后加盐酸,除去多余的碳酸钠和氢氧化钠,故D正确.
故选C.1年前查看全部
- 根据生活经验,区分下列物质,写出区分所在 1、精盐与白糖 2、水和酒精 3、金和银 4、蔗糖和面粉
 XFHM1年前3
XFHM1年前3 -
 Andyzhao125 共回答了11个问题
Andyzhao125 共回答了11个问题 |采纳率100%1、精盐与白糖味道不同;
2、水和酒精味道不同,水在常温下是无味的,而酒精是有味的;
3、金和银颜色不同;
4、蔗糖和面粉味道不同.1年前查看全部
- (2012•惠城区模拟)某同学用提取的精盐配制100g质量分数为11.7%的氯化钠溶液,请你参与完成:
(2012•惠城区模拟)某同学用提取的精盐配制100g质量分数为11.7%的氯化钠溶液,请你参与完成:
①计算:氯化钠的质量为______g,水为______g.
②称量:用托盘天平称量氯化钠的质量,用量筒来量取所需的水,量取液体时,量筒必须放平,视线与液体的______保持水平.
③溶解:溶解氯化钠时,用玻璃棒搅拌至全部溶解,即得到所需溶液.
④反思:若称取的氯化钠中含有水分,则所配制的溶液溶质质量分数会______(填“偏大”、“偏小”或“无影响”). 文飞山1年前1
文飞山1年前1 -
 4mmc 共回答了18个问题
4mmc 共回答了18个问题 |采纳率94.4%解题思路:①计算:根据一定溶液的溶质质量分数=[溶质质量/溶液质量]来计算所需要的氯化钠的质量;由溶液质量=溶质质量+溶剂质量来计算所需的水的质量;
②称量:观察时视线与凹液面最低处保持水平;
④若称取的氯化钠中含有水分说明溶质少了.①氯化钠的质量=100g×11.7%=11.7g;水的质量=100g-11.7g=88.3g;
故填:11.7;88.3;
②使用量筒量度液体体积时,正确读数的方法为:量筒必须放平,视线要与量筒内液体的凹液面的最低处保持水平;如果仰视则读数偏低,如果俯视则读数偏高.
故填:凹液面最低处;
④若称取的氯化钠中含有水分说明溶质的质量少了,溶质质量分数会偏小.
故填:偏小.点评:
本题考点: 一定溶质质量分数的溶液的配制.
考点点评: 本考点考查了配制溶液的步骤、量筒的读数、实验方案的评价等,考查的知识点比较多,要加强记忆,理解应用.本考点主要出现在实验题和填空题中.1年前查看全部
- 盐酸:氯化氢A.石墨:金刚石B.硫酸:硫C.石灰水:氢氧化钙D.精盐:钠
 wang341年前3
wang341年前3 -
 来逛逛就走 共回答了20个问题
来逛逛就走 共回答了20个问题 |采纳率95%选C,其实就是水溶液对原物质1年前查看全部
- 某位同学提纯后计算出的精盐产厉比同期适应的其他同学的都低的多,请你帮他分析,产生原因可能是
 senddh1年前2
senddh1年前2 -
 sunjie235 共回答了25个问题
sunjie235 共回答了25个问题 |采纳率88%1.溶解过滤时,尚未完全溶解就过滤
2.蒸发结晶时,析出大量固体时未停止加热,导致食盐飞溅1年前查看全部
- 反应原理部分的一个题20.(13分)Ⅰ.(1)反应I2+2S2O32—=2I—+S4O62—常用于精盐中碘含量测定.某同
反应原理部分的一个题
20.(13分)Ⅰ.(1)反应I2+2S2O32—=2I—+S4O62—常用于精盐中碘含量测定.某同学利用该反应探究浓度对反应速率的影响.实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择______(填序号).
①1mL 0.01 mol•L—1的碘水 ②1mL 0.001 mol•L—1的碘水
③4mL 0.01 mol•L—1的Na2S2O3溶液 ④4mL 0.001 mol•L—1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算v(S2O32—)=_______________.
能给个详细分析么 我有答案但是不知道怎么得到的 fengyun82411年前2
fengyun82411年前2 -
 小烧一族 共回答了24个问题
小烧一族 共回答了24个问题 |采纳率91.7%(1)②③④
我提供下自己的意见把 第一问不太好肯定
因为用1mL淀粉做指示剂 是定量的淀粉 假设我们固定Na2S2O3溶液的浓度来改变I2的浓度 会因为i2浓度不同使得褪色时间变化很大 因为0.001mol.l-1浓度太小了 很快就会褪色
然后换做选取两种浓度的Na2S2O3溶液 确定碘水的浓度 如果选择1的话 当1和4做反应的时候
会因为4Na2S2O3太少使得淀粉几乎不变化褪色
综上选择234
第二问给我点时间 我在想下.
啊 想到了 没注意淀粉存在.0.01*10^-3*2/(6*10^-3*4)=8.3*10^-41年前查看全部
- 如何将粗盐变成精盐?请给出一个实验设计。包括原理、所用到的用品、步骤还有预期。
 cmecty1年前1
cmecty1年前1 -
 千﹎雨凡 共回答了22个问题
千﹎雨凡 共回答了22个问题 |采纳率90.9%过滤,然后加氢氧化钠出去镁离子,过滤,再加入碳酸钡出去硫酸根,然后加入碳酸钠出去钡离子和钙离子,过滤,再加入过量稀盐酸除去碳酸根,过滤蒸馏.1年前查看全部
大家在问
- 1如何鉴别厨房中的精盐和碱面请利用家庭中现有的条件将它们区分开来,简述实验步骤,实验现象和结论要利用化学性质不要利用物理性
- 229.下列细胞中不进行有氧呼吸的是(A)C
- 3静态文字,动态文字,
- 4求V字开头的单词要有含义,最好能搭配“能源”这个词,比如“V~能源”,求给力!我有个域名,是VNL(不知道用什么名字好,
- 5修路队修一条公路,如果由甲队单独修要15天,而乙队每天可以修44米,当两队共同修完这段公路时,甲队修了全长的60%,这段
- 6函数Y=-2cos(x+π/3)+3的值域
- 7假定某商品销售难计划规定2007年将比2002年增长120%,问每年平均增长百分之几才能达到这个目标.若2004年该
- 8甲乙丙3位同学进行立定跳远比赛,每人轮流跳一次称为1轮,每轮按名次从高到分别得3鳞冷?
- 9在春季运动会上,一名同学的立定跳远成绩是2.4米,相当于去年的150%,这名同学立定跳远的成绩是多少米?
- 10下列细胞中不进行有氧呼吸的是1神经细胞 2心肌细胞 3哺乳动物成熟的红细胞 4小肠上皮细胞
- 11来大神给证一下这个线代题
- 12下列反应,(铁块的形状,质量均相同)产生氢气的速率最快的是 A,3摩尔每升的盐酸 B,5摩尔每升的硝酸 C,18.4摩尔
- 13楚辞 渔父通过对话表现内心矛盾,有什么好处
- 14若函数f (x )对任意的x ∈R,均有f (x -1)+f (x+1)≧2 f (x ),则函数f (x)具有性质p,
- 15程稼夫力学习题3-12怎么做啊,看不懂诶,跪求大虾正解
