“案前常备工具书,___;用词造句要斟酌,写诗作文须___。”老师的教导我一直铭记着,真是时光易逝___啊!
 penzhu2022-10-04 11:39:542条回答
penzhu2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 kacui 共回答了564个问题
kacui 共回答了564个问题 |采纳率80.1%- 案前常备工具书, 读书莫放“拦路虎”;用词造句要斟酌,写诗作文须推敲。” 2、老师的教导我一直铭记着,真是时光易逝,师恩难忘啊! 同学您好,如果问题已解决,记得采纳哦~~~您的采纳是对我的肯定~谢谢哦
- 1年前
 xjspxg 共回答了1个问题
xjspxg 共回答了1个问题 |采纳率- 读书从未有过的拦路虎。 用上优美佳句佳词。 同学难忘美好回忆。
- 1年前
相关推荐
- 计算题: ⒈高锰酸钾(俗称PP粉)溶夜是一种强氧化剂,是家庭常备的消毒药.现需配制0.1%的高锰酸钾水溶液1000g,
计算题:
⒈高锰酸钾(俗称PP粉)溶夜是一种强氧化剂,是家庭常备的消毒药.现需配制0.1%的高锰酸钾水溶液1000g,需要高锰酸钾和水各多少克?
⒉厨房蒸馒头用的纯碱中常含有少量的氯化钠,现欲测定纯碱中碳酸钠的含量,取纯碱样品12g,加入足量稀盐酸充分反应,产生了4.4g气体.试计算纯碱样品中碳酸纳的质量分数. 绝版神话1年前1
绝版神话1年前1 -
 wlx63081045 共回答了23个问题
wlx63081045 共回答了23个问题 |采纳率87%1.0.1%*1000g=1g,所需的高锰酸钾即为1g,水为1000—1=999g
2.Na2CO3+2HCl=====2NaCl+CO2+H2O二氧化碳4 .4g,碳酸钠即为10.6g,质量分数为10.6/12=88.33%.1年前查看全部
- 食盐、蔗糖、醋酸、漂白粉、明矾等是灾后常备物质,下列有关说法正确的是 A.食盐中阳离子的结构示意图为 B.蔗糖和醋酸都是
食盐、蔗糖、醋酸、漂白粉、明矾等是灾后常备物质,下列有关说法正确的是
A.食盐中阳离子的结构示意图为 
B.蔗糖和醋酸都是电解质 C.漂白粉的有效成分Ca(ClO) 2 是一种含氧酸盐 D.明矾水解所得Al(OH) 3 胶体可用于杀菌消毒  雀巢加可乐1年前1
雀巢加可乐1年前1 -
 dage123 共回答了25个问题
dage123 共回答了25个问题 |采纳率84%C
1年前查看全部
- 据《江南都市报》载:随着手机、平板电脑等成为人们的常备装备,利用各类电子终端阅读电子书已被越来越多的年轻人所接受。但对于
据《江南都市报》载:随着手机、平板电脑等成为人们的常备装备,利用各类电子终端阅读电子书已被越来越多的年轻人所接受。但对于一些真正爱书的人来说,在读有意义的书时还是愿意选择纸质版。他们认为,读纸质书才能让人享受慢慢思考的乐趣。这说明( )
①纸质书更有利于文化的传播
②电子传媒将取代印刷媒体成为文化传播的主要手段
③现代情息技术促进了文化的传播
④各种传媒都在文化传播中发挥着重要作用A.①④ B.②④ C.①③ D.③④  紫瞳鬼娃娃1年前1
紫瞳鬼娃娃1年前1 -
 eyesblue 共回答了15个问题
eyesblue 共回答了15个问题 |采纳率86.7%D
1年前查看全部
- (2003•邵阳)硝化甘油是心脏病人常备的急救药物,它也可以作为烈性炸药.硝化甘油的化学式为C3H5N3O9,该物质中各
(2003•邵阳)硝化甘油是心脏病人常备的急救药物,它也可以作为烈性炸药.硝化甘油的化学式为C3H5N3O9,该物质中各元素的质量之比为______,其中碳元素的质量分数为______.
 ruoyuedong1年前1
ruoyuedong1年前1 -
 温水泡澡 共回答了20个问题
温水泡澡 共回答了20个问题 |采纳率85%解题思路:(1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(2)根据化合物中元素的质量分数=[相对原子质量×原子个数/相对分子质量]×100%,进行分析解答.(1)硝化甘油的化学式为C3H5N3O9,硝化甘油中碳、氢、氮、氧四种元素的质量比为(12×3):(1×5):(14×3):(16×9)=36:5:42:144.
(2)硝化甘油的化学式为C3H5N3O9,硝化甘油中碳元素的质量分数为[12×3/12×3+1×5+14×3+16×9]×100%=15.86%.
故答案为;(1)36:5:42:144;(2)15.86%.点评:
本题考点: 元素质量比的计算;元素的质量分数计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- (2006•宣武区二模)文具盒中常备有塑料直尺,它一般是由热塑性塑料制成的,下列有关塑料尺的描述,属于化学性质的是(
(2006•宣武区二模)文具盒中常备有塑料直尺,它一般是由热塑性塑料制成的,下列有关塑料尺的描述,属于化学性质的是( )
A.是透明的
B.容易折断
C.受热熔化
D.点燃能燃烧 hot烈火之炎1年前1
hot烈火之炎1年前1 -
 hym3 共回答了25个问题
hym3 共回答了25个问题 |采纳率72%解题思路:物质的化学性质是需要通过化学变化才能表现出来的性质,物理性质是不需要发生化学变化就能表现出来的性质,包括物质的颜色、状态、气味、熔点、沸点、密度、溶解性等,化学性质一般包括可燃性、氧化性、稳定性、还原性等.A、是透明的,不需要通过化学变化就能表现出来,属于物理性质,故选项错误.
B、容易折断,不需要通过化学变化就能表现出来,属于物理性质,故选项错误.
C、受热容易熔化,不需要通过化学变化就能表现出来,属于物理性质,故选项错误.
D、点燃能够燃烧,需要通过化学反应才能表现出来,属于化学性质,故选项正确.
故选D.点评:
本题考点: 化学性质与物理性质的差别及应用.
考点点评: 本题难度不大,区分物质的性质属于物理性质还是化学性质,关键是看这条性质是否需要通过化学变化表现出来.1年前查看全部
- (2006•长宁区二模)如图所示是汽车驾驶员常备用的一种y型“千斤顶”,在换汽车轮胎时起顶升作用.顺时针摇手柄E,使水平
 (2006•长宁区二模)如图所示是汽车驾驶员常备用的一种y型“千斤顶”,在换汽车轮胎时起顶升作用.顺时针摇手柄E,使水平螺旋杆转动,BC间距变小,平台就将车身顶升起来,反之可使车身下降.顶升其它重物时原理也相同.现用y型“千斤顶”顶起重为G的物体,这时螺旋杆与 CD、BD间的夹角均为θ.设杆AB长为L,所有部件的重力均可不计.
(2006•长宁区二模)如图所示是汽车驾驶员常备用的一种y型“千斤顶”,在换汽车轮胎时起顶升作用.顺时针摇手柄E,使水平螺旋杆转动,BC间距变小,平台就将车身顶升起来,反之可使车身下降.顶升其它重物时原理也相同.现用y型“千斤顶”顶起重为G的物体,这时螺旋杆与 CD、BD间的夹角均为θ.设杆AB长为L,所有部件的重力均可不计.
某同学认为①图示装置中(不包括手柄E)共有四个转动轴;②C处受到的力有三个,其中螺旋杆对C处的拉力为Fc,经计算得到Fc=Gctgθ;③在重物升降过程中C不一定始终在A的正上方;④螺旋杆拉力Fc对A轴具有顺时针的力矩M,经计算其大小为
M=FcLcosθ=[GLcos2θ/sinθ]
请你在表格中对以上四个认识及计算作出评价:是否正确?理由?若不正确,请予纠正.
某同学
认为是否正确
(“是”“否”)叙述理由并纠正
(正确的不必叙述理由和纠正)① ② ③ ④  牟喜1年前1
牟喜1年前1 -
 名不好取 共回答了20个问题
名不好取 共回答了20个问题 |采纳率70%解题思路:根据共点力平衡求出螺旋杆对C处的拉力,通过力矩平衡判断A、C两点的关系,根据力矩的公式求出螺旋杆拉力Fc的力矩.①图示装置中(不包括手柄E)共有五个转动轴,分别为A、B、C、D、P处.

②C处受到的力有三个,如图所示,根据共点力平衡得,Fc=Gctgθ;
③因为整个装置受到的合力矩为零,C点一定在A点的正上方.
④因为Fc=Gctgθ,顺时针力矩为M=FcLsinθ=GLcosθ.
故答案为:
某同学
认为 是否正确
(“是”“否”) 叙述理由并纠正
(正确的不必叙述理由和纠正)
① 否 漏掉一处,共有A、B、C、D、及固定螺杆的P处
② 是
③ 否 因为整个装置受到的合力矩为零,C点一定在A点的正上方
④ 否 因为Fc=Gctgθ,顺时针力矩为M=FcLsinθ=GLcosθ点评:
本题考点: 力矩的平衡条件.
考点点评: 本题考查了共点力平衡和力矩平衡,关键受力分析,知道受力分析是解决力学问题的基础.1年前查看全部
- 如图所示,在实验台上摆放着供你选择的如下药品(①稀盐酸②稀硫酸③双氧水④石灰石⑤二氧化锰⑥高锰酸钾)和仪器(实验室常备用
如图所示,在实验台上摆放着供你选择的如下药品(①稀盐酸②稀硫酸③双氧水④石灰石⑤二氧化锰⑥高锰酸钾)和仪器(实验室常备用品图中略):

(1)写出标号仪器的名称:a______b______
(2)请你设计一种制取某气体的实验方案,填写实验报告中的以下几项:
气体名称 实验药品(填写序号) 实验仪器(填写序号) 实验原理(用方程式表示)  ejun20041年前1
ejun20041年前1 -
 5em5gl 共回答了21个问题
5em5gl 共回答了21个问题 |采纳率85.7%解题思路:在设计实验时,要注意药品的选择、反应所用仪器,反应原理,然后再组装仪器,进行实验.(1)长颈漏斗、集气瓶
(2)
气体名称 制取CO2 或制取O2 或制取O2
实验药品 ①④ ③⑤ ⑥
实验仪器 ACDH或GDH或ACBEH或GBEH 与制取CO2的仪器相同 ACFHIK
实验原理 (可用文字表示或化学方程式)
CaCO3+2HCl=CaCl2+H2O+CO2↑ 2H2O2
MnO2
.
△2H2O+O2↑ 2KMnO4
△
.
K2MnO4 +MnO2 +O2↑点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;常用仪器的名称和选用;实验室制取氧气的反应原理;氧气的制取装置;二氧化碳的实验室制法.
考点点评: 根据实验的反应原理可来选择有关的实验仪器和组装实验仪器,进行实验.同时在做实验时应明确各仪器的用途.1年前查看全部
- 化学是一门以实验为基础的自然学科,试剂的纯度是影响实验结果的一个重要因素.氢氧化钠是实验室的常备试剂,但因受空气的影响而
化学是一门以实验为基础的自然学科,试剂的纯度是影响实验结果的一个重要因素.氢氧化钠是实验室的常备试剂,但因受空气的影响而含有碳酸钠杂质.学会从不同角度去分析问题一直是我们努力的方向,某化学研究性小组为测定混有碳酸钠的氢氧化钠样品的纯度提出如下几种实验方案. 
方案一称取m 1 g样品溶于水,滴加足量BaC1 2 溶液至沉淀完全,过滤、洗涤、干燥、称重得固体m 2 g,计算NaOH的纯度.
(1)如何证明沉淀已洗涤干净______
方案二 将m 1 g样品放入圆底烧瓶中,分液漏斗中装入足量试剂X,测量产生CO 2 的量有多种方式,该组甲、乙两位同学提出了不同方法.
甲同学利用图1装置测量产生CO 2 的体积
乙同学利用图2装置测量产生CO 2 的质量,乙同学的具体操作是:称量整个装置的质量为m 2 g,加入足量试剂X使样品完全反应,然后通入足量的空气后称量整个装置的质量为m 3 g.
(2)装置中的试剂分别是X:______Y:______Z:______
图1装置反应后烧瓶中总会留有CO 2 ______ (填“是”、“否”)影响测出的CO 2 的体积.
图2装置中若没有通空气的操作,则测得NaOH的纯度______(填“偏高”、“偏低”)
方案三称取m g样品配成 V mL溶液,取V 1 mL溶液滴加过量的BaCl 2 溶液和几滴酚酞,再用标准盐酸(浓度用c(HCl)表示)滴定,测出消耗盐酸的体积为V 2 mL,用m、V、V 1 、V 2 、c(HCl)计算NaOH的纯度.
(3)根据方案三计算NaOH的纯度的表达式为(不必简化):______. 猫猫派1年前1
猫猫派1年前1 -
 郁闷吧斑猪 共回答了15个问题
郁闷吧斑猪 共回答了15个问题 |采纳率100%(1)反应生成是碳酸钡沉淀,沉淀会附着氯化钠、氯化钡等物质,检验最后的滤液中是否含有钡离子或氯离子即可,检验方法是:取最后的滤液少许与试管内,滴加硝酸银溶液,若无白色沉淀生成,说明洗涤干净.(或取最后的滤液少许与试管内,滴加硫酸钠溶液,若无白色沉淀生成,说明洗涤干净),
故答案为:取最后的滤液少许与试管内,滴加硝酸银溶液,若无白色沉淀生成,说明洗涤干净.(或取最后的滤液少许与试管内,滴加硫酸钠溶液,若无白色沉淀生成,说明洗涤干净);
(2)甲同学利用X与样品反应生成二氧化碳,通过测定二氧化碳的体积计算样品中碳酸钠的质量,进而计算纯度.乙同学利用X与样品反应生成二氧化碳,将生成的二氧化碳从装置中完全排出,通过反应前后整套装置的质量差,测定二氧化碳的质量,计算样品中碳酸钠的质量,进而计算纯度.
故使用的试剂X不能具有挥发性,否则会影响乙同学方案中二氧化碳质量的测定,导致测定二氧化碳的质量偏大,故试剂X应选择稀硫酸;图2中干燥管是吸收二氧化碳中的水蒸气,防止影响二氧化碳质量的测定,故应固体Z具有吸水性,且不能吸收二氧化碳,故Z以选用无水CaCl 2 ,图1中利用排液体法测定二氧化碳的体积,故试剂Y不能溶解二氧化碳,故可以选择饱和的碳酸氢钠溶液;
图1装置反应后烧瓶中总会留有CO 2 ,二氧化碳排出空气,占有原来空气的体积,不影响测出的CO 2 的体积;
图2装置中若没有通空气的操作,二氧化碳部分残留在装置内,二氧化碳排出空气,占有原来空气的体积,但二氧化碳的摩尔质量比空气大,导致排出气体的质量减小,即测定二氧化碳的质量偏小,计算碳酸钠的质量偏小,氢氧化钠的纯度偏高,
故答案为:稀硫酸;饱和的碳酸氢钠溶液;无水CaCl 2 ;否;偏高;
(3)V 1 mL溶液中加过量的BaCl 2 溶液和几滴酚酞,再用标准盐酸(浓度用c(HCl)表示)滴定,滴定反应为OH - +H + =H 2 O,
消耗盐酸的物质的量为c(HCl)×V 2 ×10 -3 mol,故V 1 mL溶液中n(NaOH)=c(HCl)×V 2 ×10 -3 mol,m g样品中含有氢氧化钠为
V
V 1 ×c(HCl)×V 2 ×10 -3 mol,mg样品中氢氧化钠的质量为
V
V 1 ×c(HCl)×V 2 ×10 -3 mol×40g/mol=
V
V 1 ×c(HCl)×V 2 ×10 -3 ×40g,故样品中氢氧化钠纯度为
V
V 1 ×c(HCl) ×V 2 ×10 -3 ×40
m ×100%,
故答案为:
V
V 1 ×c(HCl) ×V 2 ×10 -3 ×40
m ×100%.1年前查看全部
- (2013•昆山市一模)硫酸是基础化学工业的重要产品和原料,也是我们实验室常用常备的化学试剂.工业生产硫酸的主要流程为:
(2013•昆山市一模)硫酸是基础化学工业的重要产品和原料,也是我们实验室常用常备的化学试剂.工业生产硫酸的主要流程为:
①煅烧黄铁矿(主要反应为:4X+11O2
2Fe2O3+8SO2)煅烧 .
②SO2转化为SO3
③用浓H2SO4吸收SO3.请回答下列问题:
(1)流程①主要反应中X的化学式是______.
(2)流程①中形成的炉渣可再利用的方法是______.
(3)生产中会有部分SO2随尾气排入大气中,这会造成对环境的污染.SO2是一种酸性氧化物,具有与CO2相似的化学性质,有人设计用消石灰吸收尾气中的SO2,请写出该反应的化学方程式______.
(4)工业生产得到的是浓硫酸,若要将它稀释成稀硫酸,则正确的操作方法是:______.
(5)SO3溶于水生成硫酸,查阅资料可知H2SO4的酸性强于H2CO3,请设计一个较简单的实验来证明硫酸的酸性强于碳酸(简要说出实验方法、现象):______. 半月河1年前1
半月河1年前1 -
 iceesse 共回答了14个问题
iceesse 共回答了14个问题 |采纳率92.9%解题思路:(1)根据反应前后原子种类和原子个数不变分析
(2)根据炉渣的成分分析用途
(3)根据酸性氧化物与碱反应的反应规律分析
(4)根据浓硫酸稀释方法解答
(5)根据验证酸性强弱的方法分析(1)根据化学反应前后原子种类、原子个数不变,生成物中铁原子4个,氧原子22个,硫原子8个,反应物中已有氧原子个数22个,故4X中含有4个铁原子、8个硫原子,因此一个X中含有一个铁原子和两个硫原子,化学式为FeS2
(2)煅烧黄铁矿后生成的炉渣是氧化铁,可用来炼铁.
(3)二氧化硫与氢氧化钙反应生成亚硫酸钙和水,化学方程式为:SO2+Ca(OH)2═CaSO3+H20
(4)浓硫酸的密度比水的密度大,稀释浓硫酸时应将浓硫酸沿着玻璃棒或器壁慢慢倒入水中,并用玻璃棒不断搅拌
(5)酸能与碳酸盐反应产生二氧化碳气体,要证明硫酸比碳酸酸性强,可将等量等浓度的硫酸和碳酸中加入碳酸钠,稀硫酸中产生气泡,碳酸溶液中无明显现象,说明硫酸酸性强于碳酸;或向向碳酸钠(或碳酸氢钠)中滴加稀硫酸,有气体产生,说明硫酸的酸性强于碳酸;
故答案为:(1)FeS2.
(2)将炉渣用来炼铁.
(3)SO2+Ca(OH)2═CaSO3+H20.
(4):将浓硫酸沿着玻璃棒或器壁慢慢倒入水中,并用玻璃棒不断搅拌.
(5)向碳酸钠(或碳酸氢钠)中滴加稀硫酸,有气体产生,说明硫酸的酸性强于碳酸;(或取硫酸和碳酸两溶液,分别加入碳酸钠或碳酸氢钠,稀硫酸中有气泡产生,碳酸溶液中无明显现象,说明硫酸的酸性强于碳酸)点评:
本题考点: 物质的相互转化和制备;浓硫酸的性质及浓硫酸的稀释;溶液的酸碱性测定;质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题综合考查了质量守恒定律、方程式的书写、浓硫酸的稀释以及实验方案的设计,考查了学生的基础知识的熟练程度以及知识的灵活运用能力.1年前查看全部
- (2004•宁安市)在实验台上摆放着供你选择的如下药品和仪器(实验常备用品图中略):
(2004•宁安市)在实验台上摆放着供你选择的如下药品和仪器(实验常备用品图中略):

(1)请设计一种制备某气体的实验方案,填写实验报告中的以下几项:
(2)实际生产中,若要制备大量的该气体,应考虑哪些因素?(至少写出两点)实验名称 实验药品(填写序号) 实验仪器(填写序号) 实验原理 收集方法 反思与评价
(3)利用上述仪器和药品,你还能写出几种制备气体的反应原理?(用化学方程式表示). baolin31121年前1
baolin31121年前1 -
 清鹤上马 共回答了15个问题
清鹤上马 共回答了15个问题 |采纳率100%解题思路:制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.以二氧化碳为例,实际生产中,若要制备大量的该气体,应考虑的因素有:药品是否容易获得,操作是否方便,是否环保等因素.(1)如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;反思评价:制取气体前要检查装置的气密性,或用排水法收集气体时,要先移出导管,再熄灭酒精灯等,故答案为:
制取CO2 制取02 制取02 制取02
实验药品 ①④ ③⑤ ⑥ ③
实验仪器 一组:A、D、E、I
二组:A,D、E、I、C
三组:H、E、I
四组:H、E、I、C
五组:A,D,B,F.I
六组:H、B、F、I 与制CO2仪器相同 A、D、G、I、J、L 一组:A、D、E、I、L或二组:A、H、E、I、Lk
实验原理 CaCO3+2HCl=CaCl2+H2O+CO2↑(可用化学方程式或文字表示均可) 2H2O2
MnO2
.
2H2O+O2↑(可
用化学方程式
或文字表示均可) 2KMnO4
△
.
K2MnO4+MnO2+O2↑(可用化学方程式或文字表示均可) 2H2O2
△
.
2H2O
+O2↑(可用化学方程式或文字表示均可)
收集方法 向上排空气法 向上排空气法
或排水法 排水法 向上排空气法
反思评价 制取气体前要检查装置的气密性等.(2)以二氧化碳为例,实际生产中,若要制备大量的该气体,应考虑的因素有:药品是否容易获得,操作是否方便,是否环保等因素;故答案为:药品是否容易获得,操作是否方便;
(3)根据题目给出的药品可知,如果设计的实验方案是制二氧化碳,那么其它的反应原理可以是制氧气的原理;过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,要注意配平;或过氧化氢在加热的条件下生成水和氧气;或高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,要注意配平;故答案为:2H2O2
MnO2
.
2H2O+O2↑;2H2O2
△
.
2H2O+O2↑;2KMnO4
△
.
K2MnO4+MnO2+O2↑;点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;实验室制取气体的思路;实验室制取氧气的反应原理;二氧化碳的实验室制法;书写化学方程式、文字表达式、电离方程式.
考点点评: 本考点主要考查了仪器的选择和连接、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和注意事项等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.1年前查看全部
- 如下图所示,投影仪是教学中常备的设备
如下图所示,投影仪是教学中常备的设备 的作用是改变光的传播方向;屏幕表面粗糙,有利于发生光的 。 
 yjfmbso1年前1
yjfmbso1年前1 -
 zz夸我射得好 共回答了20个问题
zz夸我射得好 共回答了20个问题 |采纳率90%平面镜;漫反射。1年前查看全部
- 关于小药箱中常备药物的作用叙述错误的是( )
关于小药箱中常备药物的作用叙述错误的是( )
A.板蓝根冲剂用于预防感冒
B.氟哌酸用于退热止痛
C.阿司匹林用于退热解痛
D.胃舒平用于抑酸止胃痛 _ee主1年前1
_ee主1年前1 -
 二當家 共回答了22个问题
二當家 共回答了22个问题 |采纳率86.4%解题思路:A.服用板蓝根,有利于增强免疫,杀灭体内病毒和致病菌;
B.氟哌酸是抗生素;
C.阿司匹林具有解热镇痛作用;
D.胃舒平的主要成分为氢氧化铝.A.感冒期间服用板蓝根,有利于增强免疫,杀灭体内病毒和致病菌,有利于康复,故A正确;
B.氟哌酸适用于肠道感染、尿路感染及其它沙门菌感染,故B错误;
C.阿司匹林化学式为C9H8O4,也叫乙酰水杨酸,具有解热镇痛作用,故C正确;
D.胃酸过多引起的胃痛,是由于胃酸过多,胃酸的主要成分为盐酸,胃舒平的主要成分为氢氧化铝,盐酸和氢氧化铝发生中和反应,生成氯化铝和水,故D正确.
故选B.点评:
本题考点: 药物的主要成分和疗效.
考点点评: 本题主要考查了家庭小药箱常用药物分类和使用方法,平时可以注意了解一些常用药的药效和用法,题目较简单.1年前查看全部
- 初三物理题。急啊急啊一般来说,用电器的实际电压与额定电压不相等。家庭中不常备有电压表,但可借助电能表来测用电器的实际工作
初三物理题。急啊急啊
一般来说,用电器的实际电压与额定电压不相等。家庭中不常备有电压表,但可借助电能表来测用电器的实际工作电压。现在电路中只接入一个电热水壶,水壶和电能表的规格分别如下图甲.乙所示,测得电能表的转盘在121秒内转了125圈。请计算:
--------------------------------------------------------
三星牌电热水壶
额定电压220伏 额定功率1500瓦
容量4.5升
---------------------------------------------------------
KW*h
3 2 4 0 N 8
单项电度表
Dd10 220V 2A 50Hz
3000转/KW*h
---------------------------------------------------------
1.电热水壶的电阻;
2.电热水壶消耗的电能;
3.电热水壶的实际功率;
4.电热水壶的实际电压。
 aixueping1年前1
aixueping1年前1 -
 苞米须须 共回答了12个问题
苞米须须 共回答了12个问题 |采纳率83.3%1、电热水壶的电阻 R=U2/P=(220伏*220伏 )/1500瓦 =484/15=32.3欧
2、电热水壶消耗的电能 w=125圈/3000转/KW*h =0.042KW*h =150000焦耳
3.电热水壶的实际功率 P=W/t =150000焦耳/121秒=150000/121=1240瓦
4、电热水壶的实际电压 U=根号PR=根号(484/15*150000/121)=200伏1年前查看全部
- (2008•娄底)钳子是我们家中常备的电工工具,它的设计和使用应用了很多物理知识.如:钳把包了一层表面很粗燥的胶皮这是为
(2008•娄底)钳子是我们家中常备的电工工具,它的设计和使用应用了很多物理知识.如:钳把包了一层表面很粗燥的胶皮这是为了______摩擦(填“增大”或“减小”).
 chenmei6731年前1
chenmei6731年前1 -
 紅塔山 共回答了24个问题
紅塔山 共回答了24个问题 |采纳率87.5%解题思路:根据增大摩擦或减小摩擦的方法进行分析钳把包了一层表面很粗燥的胶皮的作用.钳把包了一层表面很粗燥的胶皮,这是在压力一定时,增大接触面的粗糙程度来增大摩擦力.
故答案为:增大.点评:
本题考点: 增大或减小摩擦的方法.
考点点评: 一把小小的电工钳包含了导体、绝缘体、压强、摩擦力,杠杆等多个知识点.一定留心生活,在生活工具上寻找物理知识,这是中考的热点.1年前查看全部
- 随着手机、平板电脑等成为人们的常备装备,利用各类电子终端阅读电子书已被越来越多的年轻人所接受。但对于真正爱书的人来说,除
随着手机、平板电脑等成为人们的常备装备,利用各类电子终端阅读电子书已被越来越多的年轻人所接受。但对于真正爱书的人来说,除了纯粹消遣的小说和找不到纸质版的早期工具书外,读有意义的书还是选择纸质版。他们普遍认为,读纸质书才能让人享受慢慢思考的乐趣。这说明
①纸质书更有利于文化的传播
②现代信息技术促进了文化的传播
③各种传媒都在文化传播中发挥着重要作用
④电子传媒将取代印刷媒体成为文化传播的主要手段A.①④ B.②④ C.①③ D.②③  ii航班1年前1
ii航班1年前1 -
 依哲 共回答了22个问题
依哲 共回答了22个问题 |采纳率100%D
1年前查看全部
- (2012•济宁)硫酸是化学工业的重要产品和原料,也是我们实验室常用常备的化学试剂.某同学为鉴定某一无色溶液是否为稀硫酸
(2012•济宁)硫酸是化学工业的重要产品和原料,也是我们实验室常用常备的化学试剂.某同学为鉴定某一无色溶液是否为稀硫酸,进行了以下实验:
①取少量溶液于试管中,滴加石蕊试液,溶液变红色,表明溶液中一定有氢离子;
②用玻璃棒蘸取少量溶液,滴到pH试纸上,测得pH=0,表明溶液呈酸性;
③取少量溶液于试管中,滴加氯化钡溶液,振荡,有白色沉淀生成,证明溶液中一定有硫酸根离子;
④取少量溶液于试管中,滴加硝酸钡溶液,振荡,有白色沉淀生成,滴加稀硝酸,沉淀不溶解.证明溶液中一定有硫酸根离子
若确定该溶液为硫酸,能达到目的实验组合是( )
A.①②
B.②③
C.①④
D.③④ mkfd1年前1
mkfd1年前1 -
 tutu2003 共回答了16个问题
tutu2003 共回答了16个问题 |采纳率93.8%解题思路:判断某一无色溶液是否为稀硫酸,就需要验证溶液中是否含有氢离子和硫酸根离子,从提供的信息可知①②均能验证溶液中含有氢离子,③和④的差别在于对实验产生的白色沉淀是否进行了验证,由所学可知这种情况下只有白色沉淀不溶于硝酸才可以证明该白色沉淀是硫酸钡,据此分析即可.①取少量溶液于试管中,滴加石蕊试液,溶液变红色,说明溶液呈酸性,从而能表明;
②用玻璃棒蘸取少量溶液,滴到pH试纸上,测得pH=0的数值在该方法的实验过程中无法得到;
③取少量溶液于试管中,滴加氯化钡溶液,振荡,有白色沉淀生成,该白色沉淀可以是硫酸钡,也可以是碳酸钡、氯化银等,所以不能证明溶液中一定有硫酸根离子;
④取少量溶液于试管中,滴加硝酸钡溶液,振荡,有白色沉淀生成,滴加稀硝酸,沉淀不溶解,说明该白色沉淀是硫酸钡,从而可证明溶液中一定有硫酸根离子;
所以若确定该溶液为硫酸,能达到目的实验组合是①④或②④,
故选:C.点评:
本题考点: 物质的鉴别、推断;常见离子的检验方法及现象.
考点点评: 此题是对硫酸鉴定的考查,解题的关键是掌握氢离子与硫酸根离子的鉴定,属基础性知识的考查题.1年前查看全部
- 化学是一门以实验为基础的自然学科,试剂的纯度是影响实验结果的一个重要因素.氢氧化钠是实验室的常备试剂,但因受空气的影响而
化学是一门以实验为基础的自然学科,试剂的纯度是影响实验结果的一个重要因素.氢氧化钠是实验室的常备试剂,但因受空气的影响而含有碳酸钠杂质.学会从不同角度去分析问题一直是我们努力的方向,某化学研究性小组为测定混有碳酸钠的氢氧化钠样品的纯度提出如下几种实验方案.

方案一称取m1g样品溶于水,滴加足量BaC12溶液至沉淀完全,过滤、洗涤、干燥、称重得固体m2g,计算NaOH的纯度.
(1)如何证明沉淀已洗涤干净______
方案二 将m1g样品放入圆底烧瓶中,分液漏斗中装入足量试剂X,测量产生CO2的量有多种方式,该组甲、乙两位同学提出了不同方法.
甲同学利用图1装置测量产生CO2的体积
乙同学利用图2装置测量产生CO2的质量,乙同学的具体操作是:称量整个装置的质量为m2g,加入足量试剂X使样品完全反应,然后通入足量的空气后称量整个装置的质量为m3g.
(2)装置中的试剂分别是X:______Y:______Z:______
图1装置反应后烧瓶中总会留有CO2______ (填“是”、“否”)影响测出的CO2的体积.
图2装置中若没有通空气的操作,则测得NaOH的纯度______(填“偏高”、“偏低”)
方案三称取m g样品配成 V mL溶液,取V1 mL溶液滴加过量的BaCl2溶液和几滴酚酞,再用标准盐酸(浓度用c(HCl)表示)滴定,测出消耗盐酸的体积为V2mL,用m、V、V1、V2、c(HCl)计算NaOH的纯度.
(3)根据方案三计算NaOH的纯度的表达式为(不必简化):
×100%
×c(HCl)×V2×10−3×40V V1 m .
×100%
×c(HCl)×V2×10−3×40V V1 m  菠萝皮皮1年前1
菠萝皮皮1年前1 -
 water460 共回答了14个问题
water460 共回答了14个问题 |采纳率92.9%解题思路:(1)反应生成是碳酸钡沉淀,沉淀会附着氯化钠、氯化钡等物质,检验最后的滤液中是否含有钡离子或氯离子即可;
(2)甲同学利用X与样品反应生成二氧化碳,通过测定二氧化碳的体积计算样品中碳酸钠的质量,进而计算纯度.乙同学利用X与样品反应生成二氧化碳,将生成的二氧化碳从装置中完全排出,通过反应前后整套装置的质量差,测定二氧化碳的质量,计算样品中碳酸钠的质量,进而计算纯度;
故使用的试剂X不能具有挥发性,否则会影响乙同学方案中二氧化碳质量的测定,导致测定二氧化碳的质量偏大,故试剂X应选择稀硫酸;图2中干燥管是吸收二氧化碳中的水蒸气,防止影响二氧化碳质量的测定,故应固体Z具有吸水性,且不能吸收二氧化碳;图1中利用排液体法测定二氧化碳的体积,故试剂Y不能溶解二氧化碳,故可以选择饱和的碳酸氢钠;
图1装置反应后烧瓶中总会留有CO2,二氧化碳排出空气,占有原来空气的体积,不影响测出的CO2的体积;
图2装置中若没有通空气的操作,二氧化碳部分残留在装置内,二氧化碳排出空气,占有原来空气的体积,但二氧化碳的摩尔质量比空气大,导致排出气体的质量减小,即测定二氧化碳的质量偏小;
(3)V1 mL溶液中加过量的BaCl2溶液和几滴酚酞,再用标准盐酸(浓度用c(HCl)表示)滴定,滴定反应为OH-+H+=H2O,
消耗盐酸的物质的量为c(HCl)×V2×10-3mol,故V1 mL溶液中n(NaOH)=c(HCl)×V2×10-3mol,m g样品中含有氢氧化钠为
×c(HCl)×V2×10-3mol,据此计算mg样品中氢氧化钠的质量,根据纯度定义计算.V V1 (1)反应生成是碳酸钡沉淀,沉淀会附着氯化钠、氯化钡等物质,检验最后的滤液中是否含有钡离子或氯离子即可,检验方法是:取最后的滤液少许与试管内,滴加硝酸银溶液,若无白色沉淀生成,说明洗涤干净.(或取最后的滤液少许与试管内,滴加硫酸钠溶液,若无白色沉淀生成,说明洗涤干净),
故答案为:取最后的滤液少许与试管内,滴加硝酸银溶液,若无白色沉淀生成,说明洗涤干净.(或取最后的滤液少许与试管内,滴加硫酸钠溶液,若无白色沉淀生成,说明洗涤干净);
(2)甲同学利用X与样品反应生成二氧化碳,通过测定二氧化碳的体积计算样品中碳酸钠的质量,进而计算纯度.乙同学利用X与样品反应生成二氧化碳,将生成的二氧化碳从装置中完全排出,通过反应前后整套装置的质量差,测定二氧化碳的质量,计算样品中碳酸钠的质量,进而计算纯度.
故使用的试剂X不能具有挥发性,否则会影响乙同学方案中二氧化碳质量的测定,导致测定二氧化碳的质量偏大,故试剂X应选择稀硫酸;图2中干燥管是吸收二氧化碳中的水蒸气,防止影响二氧化碳质量的测定,故应固体Z具有吸水性,且不能吸收二氧化碳,故Z以选用无水CaCl2,图1中利用排液体法测定二氧化碳的体积,故试剂Y不能溶解二氧化碳,故可以选择饱和的碳酸氢钠溶液;
图1装置反应后烧瓶中总会留有CO2,二氧化碳排出空气,占有原来空气的体积,不影响测出的CO2的体积;
图2装置中若没有通空气的操作,二氧化碳部分残留在装置内,二氧化碳排出空气,占有原来空气的体积,但二氧化碳的摩尔质量比空气大,导致排出气体的质量减小,即测定二氧化碳的质量偏小,计算碳酸钠的质量偏小,氢氧化钠的纯度偏高,
故答案为:稀硫酸;饱和的碳酸氢钠溶液;无水CaCl2;否;偏高;
(3)V1 mL溶液中加过量的BaCl2溶液和几滴酚酞,再用标准盐酸(浓度用c(HCl)表示)滴定,滴定反应为OH-+H+=H2O,
消耗盐酸的物质的量为c(HCl)×V2×10-3mol,故V1 mL溶液中n(NaOH)=c(HCl)×V2×10-3mol,m g样品中含有氢氧化钠为[V
V1×c(HCl)×V2×10-3mol,mg样品中氢氧化钠的质量为
V
V1×c(HCl)×V2×10-3mol×40g/mol=
V
V1×c(HCl)×V2×10-3×40g,故样品中氢氧化钠纯度为
V
V1×c(HCl)×V2×10−3×40/m]×100%,
故答案为:
V
V1×c(HCl)×V2×10−3×40
m×100%.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查学生对实验原理及装置理解、对操作的评价、物质含量的测定、中和滴定、化学计算等,难度中等,清楚实验原理是解题的关键,是对所学知识的综合运用,需要学生具备扎实的基础与运用知识分析问题解决问题的能力.1年前查看全部
- 找一种家庭常备药品,其主要成分有几种元素组成?
 houxbao1年前1
houxbao1年前1 -
 zycwt 共回答了21个问题
zycwt 共回答了21个问题 |采纳率81%感冒药,对乙酰氨基酚片,或称扑热息痛,含元素碳氢氧氮.1年前查看全部
- 使用中学常备器材,试设计一个实验证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应.要求作出有关的实验原理、过程、现
使用中学常备器材,试设计一个实验证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应.要求作出有关的实验原理、过程、现象的说明.
 与梦相约1年前2
与梦相约1年前2 -
 hhong0516 共回答了25个问题
hhong0516 共回答了25个问题 |采纳率92%用检验物质导电性实验.在稀硫酸中插入两根石墨电极,在连接一个灯泡,接通直流电向烧杯中加入氢氧化钡溶液,观察灯泡的亮度,若灯泡变暗,说明溶液中的离子间发生反应了.
2BaOH →2Ba+ + 2OH-
H2SO4= 2H+ +SO4 2-
2H+ + 2OH- = 2H2O
2Ba+ + SO4 2- =Ba2SO41年前查看全部
- (2006•静安区模拟)如图所示是汽车内常备的两种类型的“千斤顶”.图(a)中是“y”形的,图(b)中是“菱”形的,逆时
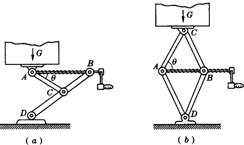 (2006•静安区模拟)如图所示是汽车内常备的两种类型的“千斤顶”.图(a)中是“y”形的,图(b)中是“菱”形的,逆时针摇动手柄,使螺旋杆转动(螺旋杆保持水平),A、B间距离变小,重物G就被顶升起来,反之则可使重物G下降.若物重为G,AB与AC之间的夹角为θ,则“y”形千斤顶螺旋杆AB的拉力大小为______,“菱”形千斤顶螺旋杆AB的拉力大小为______.(不计顶升机杆件自重)
(2006•静安区模拟)如图所示是汽车内常备的两种类型的“千斤顶”.图(a)中是“y”形的,图(b)中是“菱”形的,逆时针摇动手柄,使螺旋杆转动(螺旋杆保持水平),A、B间距离变小,重物G就被顶升起来,反之则可使重物G下降.若物重为G,AB与AC之间的夹角为θ,则“y”形千斤顶螺旋杆AB的拉力大小为______,“菱”形千斤顶螺旋杆AB的拉力大小为______.(不计顶升机杆件自重)  骑猪飞奔1年前1
骑猪飞奔1年前1 -
 webson 共回答了17个问题
webson 共回答了17个问题 |采纳率82.4%解题思路:对A点受力分析,由平衡条件,求AB的作用力;将物重G对千斤顶的压力分解沿两臂的两个分力,根据对称性可知,两臂受到的压力大小相等.根据几何知识求解两臂受到的压力大小,在对A点受力分析,由平衡条件,求AB的作用力.根据题意,对“y”形千斤顶A点受力分析如图,由平衡条件得:F=Gcotθ 对“菱”形千斤顶C点受到的压力G分解沿两臂的两个分力F1,根据对称性可知,两臂受到的压力大小相等. 由2F...
点评:
本题考点: 共点力平衡的条件及其应用;力的合成与分解的运用.
考点点评: 本题应用平衡条件分析实际问题,采用的是力的分解法,也可以以O点为研究对象,应用正交分解法或合成法分析.1年前查看全部
- (2012•安庆一模)液压千斤顶是汽车等运输机械常备的维修工具.如图所示的是液压千斤顶的原理剖面图.只要对小活塞施加一个
 (2012•安庆一模)液压千斤顶是汽车等运输机械常备的维修工具.如图所示的是液压千斤顶的原理剖面图.只要对小活塞施加一个不大的作用力使小活塞下降距离h1,就可以利用大活塞上升距离h2把一辆汽车顶起来而便于更换和修理轮胎.如果活塞、液体本身所受的重力及摩擦可以忽略不计,试根据功的原理和液体的不可压缩性推导出:作用在大、小活塞上的力和大、小活塞的面积有以下关系
(2012•安庆一模)液压千斤顶是汽车等运输机械常备的维修工具.如图所示的是液压千斤顶的原理剖面图.只要对小活塞施加一个不大的作用力使小活塞下降距离h1,就可以利用大活塞上升距离h2把一辆汽车顶起来而便于更换和修理轮胎.如果活塞、液体本身所受的重力及摩擦可以忽略不计,试根据功的原理和液体的不可压缩性推导出:作用在大、小活塞上的力和大、小活塞的面积有以下关系
=F1 F2
.S1 S2  qqgasdh1年前1
qqgasdh1年前1 -
 淡而着色 共回答了16个问题
淡而着色 共回答了16个问题 |采纳率81.3%解题思路:根据功的原理可知,大、小活塞上的力做的功相等,根据W=Fs得出等式;再根据液体的不可压缩性可知小活塞下推液体的体积和大活塞上推时的体积相等,根据V=Sh得出等式,联立两个等式,即可得出关系式.证明:由题意知小活塞下降的距离为h1时,大活塞上升的距离为h2,
由功的原理:F1h1=F2h2,
又由液体的不可压缩性V1=V2,即S1h1=S2h2,
综合有:
F1
S1=
F2
S2,
所以
F1
F2=
S1
S2.点评:
本题考点: 帕斯卡原理及其应用;功的原理.
考点点评: 本题考查了做功公式和体积公式的应用,关键是利用好功的原理和液体的不可压缩性这两个条件.1年前查看全部
- 如左上图所示,投影仪是教学中常备的设备.______的作用是改变光的传播方向;屏幕表面粗糙,有利于发生光的______.
 sgf8881年前1
sgf8881年前1 -
 fk_dna 共回答了23个问题
fk_dna 共回答了23个问题 |采纳率87%解题思路:(1)平面镜的作用是改变光的传播方向,使射向天花板的光能在屏幕上成像;
(2)屏幕做的粗糙,这样光可以在其表面发生漫反射,能够让各个方向的人看到屏幕上的像.投影仪成像时,按照光沿直线传播,会竖直向上射出,投不到幕布上;加上平面镜,改变了光的传播方向,从而使像能成在幕布上.屏幕做的粗糙,这样光可以在其表面发生漫反射,能够让各个方向的人看到屏幕上的像.
故答案为:平面镜;漫反射.点评:
本题考点: 平面镜的应用;漫反射.
考点点评: 关于投影仪,还应掌握:
(1)投影仪的原理:当物体到凸透镜大于一倍焦距小于二倍焦距时,在屏幕上成一个倒立放大的实像;
(2)注意物距是透镜和投影片之间的距离,像距是投影机与幕布之间的距离,要注意区分;
(3)凸透镜成实像时,物距减小,像距增大,像增大,要使屏幕上的像大一些,像距要增大,物距要减小.1年前查看全部
- 请问一道初二物理浮力题请你用下面给定的要求和数据来设计游艇上常备的救生衣:1.人的质量为80千克;2.穿上该救生衣的人有
请问一道初二物理浮力题
请你用下面给定的要求和数据来设计游艇上常备的救生衣:1.人的质量为80千克;2.穿上该救生衣的人有10%的体积露出水面;3.发泡材料的密度为0.01×1000千克/立方米;4.救生衣的面料和辅料质量不计;5.人的密度为1000千克/立方米.请计算做一件的发泡材料最小质量. zjdzjdzjd1年前5
zjdzjdzjd1年前5 -
 wangyonghu 共回答了21个问题
wangyonghu 共回答了21个问题 |采纳率90.5%(m人+p材V材)g=0.9pgV人+pgV材
V人=m人/p人=80/1000=0.08m^3
(80+10V材)=0.9*1000*0.08+1000V材
990V材=80-72=8
V材=0.0081m^3
m材=p材V材=0.081kg1年前查看全部
- 硫酸是化学工业的重要产品也是我们实验室常用常备的化学试剂.
硫酸是化学工业的重要产品也是我们实验室常用常备的化学试剂.
某同学为鉴定某一无色溶液是否为稀硫酸,进行了以下实验:
①取少量溶液于试管中,滴加石蕊试液,溶液变红色,表明溶液中一定有氢离子;
②用玻璃棒蘸取少量溶液,滴到pH试纸上,测得pH=0,表明溶液呈酸性;
③取少量溶液于试管中,滴加氯化钡溶液,振荡,有白色沉淀生成,证明溶液中一定有硫酸根离子;
④取少量溶液于试管中,滴加硝酸钡溶液,振荡,有白色沉淀生成,滴加稀硝酸,沉淀不溶解.证明溶液中一定有硫酸根离子
若确定该溶液为硫酸,能达到目的实验组合是( )
A.①② B.②③ C.①④ D.③④ hp101022511年前1
hp101022511年前1 -
 513385995 共回答了20个问题
513385995 共回答了20个问题 |采纳率80%应该是1、4或者2、4,但是题目只有C.①④,所以选C【1、2是检验溶液显酸性,3是检验SO42-离子的存在.3中加入没有酸化的氯化钡溶液,会有CO32-或者SO32-或者Ag+离子的干扰,所以错误.】1年前查看全部
- 请翻译以下一句成英文:供应不会断开,因为我们有常备的库存
 九百碗1年前2
九百碗1年前2 -
 river159 共回答了21个问题
river159 共回答了21个问题 |采纳率95.2%we have regular inventories to ensure no breakdown for supply.1年前查看全部
大家在问
- 110块乒乓球拍用英语怎么写?
- 2maybe your parents are right.改为同义句,
- 3200欧姆的两相加热管电流多大如何换算
- 4为什么3次本原单位根ξ满足ξ+1/2=(√-3)/2?
- 51.一架飞机在A、B两城市间飞行,顺风时需要5.5h,逆风需要6h,风速为24km/h,则A、B两城市之间的距离为多少?
- 6如图所示,在真空中半径为r=3×10-2m的圆形区域内,有一匀强磁场,磁场的磁感应强度B=0.2T,方向垂直纸面向外.一
- 7有一堆粗细均匀的圆木,堆梯形,最上面的一层有5跟圆木,每向下一层增加1根,一共堆了28层,最下面一层有多少根
- 8i have never been to pairs
- 9解分式方程x/(x-1)=x^2/(x^2-1)
- 10英语翻译整个句子是:there is no such thing as a small act of kindness.
- 11电路选择,不麻烦中间的两道题,左边线电压是380v,z=3+j4,求负载消耗的有功功率是多少,答案是17.4,为什么右边
- 12在试验室里怎样将一大瓶一氧化碳和二氧化碳混合气体分离成两小瓶一氧化碳和二氧化碳气体?
- 13函数y=e^x(x–1)在点(1,0)处的切线方程是
- 14有一个长方体形状的玻璃缸长3分米宽和高都是2分米厘米盛有水水深1分米
- 15一袋大米120千克,第一天吃去了4分之1,第二天吃下了余下的3分之1,第二天吃了多少千克
