酸、碱、盐溶解性表是学习化学的重要工具,下表列出了部分酸、碱、盐在20℃时的溶解性,利用此表完成下列各小题: 离子 OH
 凤临坊2022-10-04 11:39:541条回答
凤临坊2022-10-04 11:39:541条回答| 离子 | OH- | Cl- | SO42- |
| H+ | 溶、挥 | 溶 | |
| Na+ | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 溶 | 微 |
| Ba2+ | 溶 | 溶 | 不 |
(2)写出表中空格处物质的化学式______.
(3)从表中选择,写出一个生成沉淀且属于中和反应的化学方程式______.
(4)打开装有浓盐酸的试剂瓶盖,可观察到大量的白雾,其原因是______.

已提交,审核后显示!提交回复
共1条回复
 小f_ 共回答了14个问题
小f_ 共回答了14个问题 |采纳率92.9%- 解题思路:(1)利用溶解性表,查出指定物质的溶解性;
(2)根据表中单元格的意义,完成表中的空格所对应物质的化学式;
(3)利用溶解性表,查找不溶的盐,完成化学方程式的书写;
(4)解释打开浓盐酸的瓶子时,瓶口出现白雾的原因.(1)查找硫酸钙的溶解性,硫酸根与钙离子相交的格内写着“微”,即硫酸钙微溶于水;
故答案为:微溶;
(2)空格为氢氧根与氢离子的交点,因此此格内的物质为水;
故答案为:H2O;
(3)中和反应生成盐和水,溶解性表中不溶性的盐只有硫酸钡,所以反应为:硫酸与氢氧化钡反应;
故答案为:H2SO4+Ba(OH)2═BaSO4↓+2H2O;
(4)浓盐酸有较强的挥发性,打开瓶口时,挥发出的HCl气体遇空气中的水又形成盐酸的小液滴,故看到白雾;
故答案为:有挥发性,挥发出HCI气体.点评:
本题考点: 溶质的质量分数、溶解性和溶解度的关系;酸的物理性质及用途;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 溶解性表中,“溶”字表示物质可溶;“不”字表示所对应物质不溶于水;“挥”字表示物质有挥发性. - 1年前
相关推荐
- 谁知道高中酸碱盐溶解性表中所有不溶性碳酸盐的颜色?
谁知道高中酸碱盐溶解性表中所有不溶性碳酸盐的颜色?
还有氢氧化银、碳酸铝、碳酸铁的颜色.
那氢氧化银、碳酸铝、碳酸铁到底是什么颜色? 爬山虎1年前1
爬山虎1年前1 -
 liyawang 共回答了24个问题
liyawang 共回答了24个问题 |采纳率83.3%氢氧化银生成即分解为黑色的氧化银,碳酸根遇到铝离子和3价铁离子会发生双水解反应,不会生成相应的碳酸盐沉淀的.
你应该把金属离子列出来的,不然大家都不好回答.1年前查看全部
- 酸、碱、盐溶解性表是学习化学的重要工具,右表列出了部分酸、碱、盐在20℃时的溶解性,我能利用此表完成以下任务:
酸、碱、盐溶解性表是学习化学的重要工具,右表列出了部分酸、碱、盐在20℃时的溶解性,我能利用此表完成以下任务:
(1)查:Ba(OH) 2 的溶解性______.OH - NO 3 - Cl - CO 3 2- SO 4 2- H + -- 溶、挥 溶、挥 溶、挥 溶 Na + 溶 溶 溶 溶 溶 Ca 2+ 微 溶 溶 不 微 Ba 2+ 溶 溶 溶 不 不 Cu 2+ 不 溶 溶 不 溶
(2)写化学式:一种酸______;一种不溶于水的盐______.
(3)判断:氯化钠溶液与硝酸钙溶液能否发生反应及其______.
(4)写化学方程式:铝与表中的可溶性盐发生的反应(只写1个)______.
表中物质发生的有沉淀生成的复分解反应(只写1个)______. lololo9991年前1
lololo9991年前1 -
 cspm2008 共回答了14个问题
cspm2008 共回答了14个问题 |采纳率92.9%(1)氢氧化钡溶于水,故答案为:可溶;(2)酸有盐酸、硫酸、硝酸、碳酸;不溶于水的盐有碳酸钙、碳酸钡、硫酸钡、碳酸铜,故答案为:HCl(或H 2 SO 4 、H 2 CO 3 、HNO 3 ),CaCO 3 (或BaCO 3 、BaSO 4 、Cu...1年前查看全部
- 阅读部分酸、碱、盐溶解性表,试回答:
阅读部分酸、碱、盐溶解性表,试回答:
(1)从表中找出一种不溶性的碱______(写化学式).
(2)HCl、Ca(NO3)2两种溶液能否发生反应______(填“能”或“否”).
(3)完成Na2CO3与表中的一种碱反应制取烧碱的化学方程式______.OH- NO3- Cl- SO42- CO32- H+ 溶 溶 溶 溶 Na+ 溶 溶 溶 溶 溶 Ca2+ 微 溶 溶 微 不 Ba2+ 溶 溶 溶 不 不 Cu2+ 不 溶 溶 溶 不  henhao1年前1
henhao1年前1 -
 8380125 共回答了28个问题
8380125 共回答了28个问题 |采纳率92.9%解题思路:(1)阴阳离子的交叉点所显示的字即表示该物质的溶解性,根据复分解反应的条件来判断两种物质是否能够反应来完成(2)和(3)(1)根据分析可以知道铜离子和氢氧根离子的交叉点为不,所以不溶的碱为氢氧化铜
(2)根据复分解反应发生的条件可以知道盐酸和硝酸钙不能生成沉淀气体或水,故不能反应
(3)与碳酸钠反应生成烧碱,可以知道反应物应该为碱,而生成的烧碱可有溶于水,所以生成碳酸盐应该是沉淀,故可以选用氢氧化钙与碳酸钠反应制取.
故答案为:
(1)Cu(OH)2
(2)否
(3)Na2CO3+Ca(OH)2═2NaOH+CaCO3↓点评:
本题考点: 酸碱盐的溶解性;复分解反应及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 能够根据所给的溶解性表,并结合所学复分解反应发生的条件来判断酸碱盐之间是否能够反应并能熟练的写出反应的化学方程式.1年前查看全部
- 酸、碱、盐溶解性表是学习化学的重要工具.下表列出了“部分酸、碱、盐在20℃时的溶解性”.试一试你能利用此表完成以下任务:
酸、碱、盐溶解性表是学习化学的重要工具.下表列出了“部分酸、碱、盐在20℃时的溶解性”.试一试你能利用此表完成以下任务:
(1)说出碳酸溶液与硝酸钡溶液能发出反应的理由.OH- NO3- Cl- CO32- SO42- H+ -- 溶、挥 溶、挥 溶、挥 溶 Na- 溶 溶 溶 溶 溶 Ca2+ 微 溶 溶 不 微 Ba2+ 溶 溶 溶 不 不
(2)实验室制取二氧化碳用石灰石和稀盐酸反应,一般不用稀硫酸的原因是什么? fan_t1年前1
fan_t1年前1 -
 林佳 共回答了23个问题
林佳 共回答了23个问题 |采纳率95.7%解题思路:根据表格可以判断物质的溶解性,酸碱盐之间发生复分解反应须符合复分解反应的条件,即有气体、沉淀或水生成.(1)因为碳酸盐溶液中有CO32-而硝酸钡易溶于水,溶液中有Ba2+,两种物质反应生成不溶物是碳酸钡;根据表格及酸碱盐之间发生复分解反应须符合复分解反应的条件,即有气体、沉淀或水生成判断.
(2)因为石灰石和稀硫酸反应是生成微溶于水的物质硫酸钙,会覆盖在诗会是表面上,阻止反应进行.
故答案为:
(1)两种物质反应生成不溶物是碳酸钡,符合复分解反应的条件;
(2)因为石灰石和稀硫酸反应是生成微溶于水的物质硫酸钙,会覆盖在诗会是表面上,阻止反应进行.点评:
本题考点: 复分解反应及其应用;二氧化碳的实验室制法;酸碱盐的溶解性.
考点点评: 本题考查了表格的应用以及复分解反应的条件,完成此题,可以依据已有的知识结合表格进行.1年前查看全部
- 酸、碱、盐溶解性表是学习化学的重要工具。下表列出了部分酸、碱、盐在20℃时的溶解性。利用此表完成下列各小题:
酸、碱、盐溶解性表是学习化学的重要工具。下表列出了部分酸、碱、盐在20℃时的溶解性。利用此表完成下列各小题:
(1)查:CaSO 4 的溶解性______;离子 OH - Cl - SO 4 2 - H + 溶、挥 溶 Na + 溶 溶 溶 Ca 2+ 微 溶 微 Ba 2+ 溶 溶 不
(2)写出表中空格处物质的化学式______;
(3)从表中选择,写出一个生成不溶物且属于中和反应的化学方程式_________________。 蓝色的弦1年前1
蓝色的弦1年前1 -
 hncdpxk 共回答了20个问题
hncdpxk 共回答了20个问题 |采纳率80%(1)微溶 (2)H 2 O (3)Ba(OH) 2 + H 2 SO 4 ="=" BaSO 4 ↓+ 2H 2 O
:(1)查找硫酸钙的溶解性,硫酸根与钙离子相交的格内写着“微”,即硫酸钙微溶于水;
故答案为:微溶;
(2)空格为氢氧根与氢离子的交点,因此此格内的物质为水;
故答案为:H 2 O;
(3)中和反应生成盐和水,溶解性表中不溶性的盐只有硫酸钡,所以反应为:硫酸与氢氧化钡反应;
故答案为:H 2 SO 4 +Ba(OH) 2 ═BaSO 4 ↓+2H 2 O;1年前查看全部
- 酸、碱、盐溶解性表是学习化学的重要工具,下表列出了部分酸、碱、盐在20 0 C时的溶解性,利用此表完成下列各小题:
酸、碱、盐溶解性表是学习化学的重要工具,下表列出了部分酸、碱、盐在20 0 C时的溶解性,利用此表完成下列各小题:
(1)查CaSO 4 的溶解性为______.离子 OH - Cl - SO 4 2- H + 溶、挥 溶 Na + 溶 溶 溶 Ca 2+ 微 溶 微 Cu 2+ 不 溶 溶
(2)写出表中空格处物质的化学式:______.
(3)从表中选择离子组成物质,写出一个属于中和反应的化学方程式:______. suan171年前1
suan171年前1 -
 风行之无忌 共回答了20个问题
风行之无忌 共回答了20个问题 |采纳率85%(1)查找硫酸钙的溶解性,硫酸根与钙离子相交的格内写着“微”,即硫酸钙微溶于水;
故答案为:微溶;
(2)空格为氢氧根与氢离子的交点,因此此格内的物质为水;
故答案为:H 2 O;
(3)中和反应为酸和碱反应生成盐和水,溶解性表中酸有盐酸和硫酸,碱有氢氧化钠、氢氧化钙和氢氧化铜,任选一种如氢氧化钠与盐酸的反应;
故答案为:HCl+NaOH═NaCl+H 2 O;1年前查看全部
- 阅读部分酸、碱、盐溶解性表,试回答:
阅读部分酸、碱、盐溶解性表,试回答:
(1)从表中找出一种不溶性的碱______(写化学式).
(2)HCl、Ca(NO 3 ) 2 两种溶液能否发生反应______(填“能”或“否”).
(3)完成Na 2 CO 3 与表中的一种碱反应制取烧碱的化学方程式______.OH - NO 3 - Cl - SO 4 2- CO 3 2- H + 溶 溶 溶 溶 Na + 溶 溶 溶 溶 溶 Ca 2+ 微 溶 溶 微 不 Ba 2+ 溶 溶 溶 不 不 Cu 2+ 不 溶 溶 溶 不  quanfuweizhuang1年前1
quanfuweizhuang1年前1 -
 fancy_free 共回答了26个问题
fancy_free 共回答了26个问题 |采纳率88.5%(1)根据分析可以知道铜离子和氢氧根离子的交叉点为不,所以不溶的碱为氢氧化铜
(2)根据复分解反应发生的条件可以知道盐酸和硝酸钙不能生成沉淀气体或水,故不能反应
(3)与碳酸钠反应生成烧碱,可以知道反应物应该为碱,而生成的烧碱可有溶于水,所以生成碳酸盐应该是沉淀,故可以选用氢氧化钙与碳酸钠反应制取.
故答案为:
(1)Cu(OH) 2
(2)否
(3)Na 2 CO 3 +Ca(OH) 2 ═2NaOH+CaCO 3 ↓1年前查看全部
- 化学酸碱盐溶解性初中化学酸碱盐溶解性表的背诵口诀
化学酸碱盐溶解性初中化学酸碱盐溶解性表的背诵口诀
要把表上的都包括进去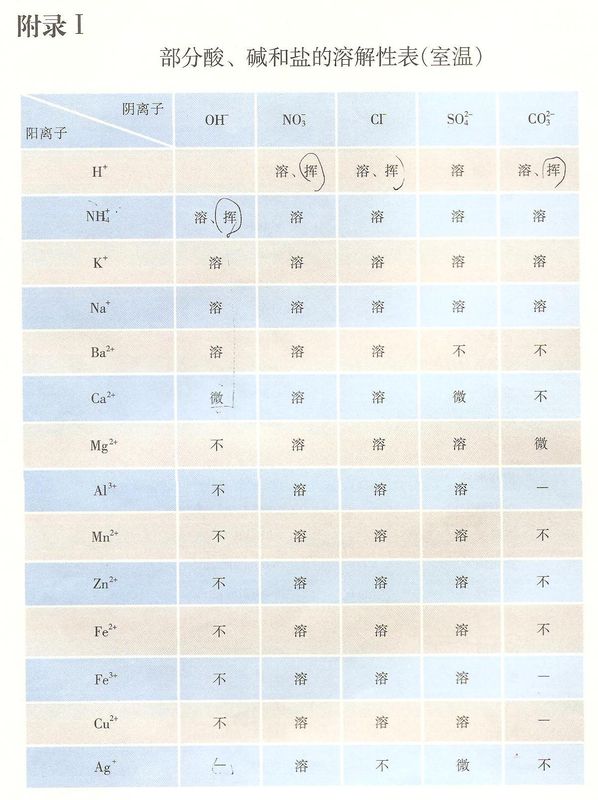
 xcboyosidfoisaud1年前4
xcboyosidfoisaud1年前4 -
 gzqjc 共回答了23个问题
gzqjc 共回答了23个问题 |采纳率95.7%钾钠铵盐硝酸盐,全都溶于水中间.
盐酸盐除去硝酸银,其余都溶完.
硫酸盐除了硫酸钡,碳酸盐多数是沉淀.
最后说碱类,溶有钾钠钡.1年前查看全部
- 酸、碱、盐溶解性表是学习化学的重要工具.下表列出了部分酸、碱、盐在20℃时的溶解性.
酸、碱、盐溶解性表是学习化学的重要工具.下表列出了部分酸、碱、盐在20℃时的溶解性.
请依据上表,按要求回答下列问题:阴离子
阳离子OH- NO3- Cl- SO42- CO32- H+ 溶、挥 溶、挥 溶 溶、挥 Na+ 溶 溶 溶 溶 溶 Ca2+ 微 溶 溶 微 不 Ba2+ 溶 溶 溶 不 不 Cu2+ 不 溶 溶 溶 不
(1)BaSO4的溶解性为不溶于水不溶于水.
(2)写出一种挥发性酸的化学式HCl或HNO3或H2CO3HCl或HNO3或H2CO3.
(3)氯化钙溶液与硝酸钠溶液不能不能(填“能”或“不能”)发生反应,理由是没有沉淀、水或气体生成,不符合复分解反应发生的条件没有沉淀、水或气体生成,不符合复分解反应发生的条件.
(4)碱和盐反应时,反应物必须都是可溶的.请写出一个碱和盐反应的化学方程式:Ba(OH)2+Na2SO4═BaSO4↓+2NaOHBa(OH)2+Na2SO4═BaSO4↓+2NaOH. 蓝色旋冰1年前1
蓝色旋冰1年前1 -
 s_xlli 共回答了17个问题
s_xlli 共回答了17个问题 |采纳率94.1%解题思路:(1)由表中信息可知硫酸钡不溶于水;(2)具有挥发性的酸包括硝酸、盐酸、碳酸;(3)根据复分解反应发生的条件进行分析,复分解反应要求两种物质交换成分后有水、气体或沉淀生成,而氯化钙和硝酸钠交换成分后没有沉淀、水、气体生成,所以不能发生复分解反应;(4)碱和盐反应也属于复分解反应,也要符合复分解反应发生的条件,所以选择反应物时应选择可溶物,同时需要保证交换成分后有沉淀生成.(1)硫酸钡不溶于水,故答案为:不溶于水;
(2)具有挥发性的酸包括硝酸、盐酸、碳酸,故答案为:HCl或HNO3或H2CO3(任写一种);
(3)复分解反应要求两种物质交换成分后有水、气体或沉淀生成,而氯化钙和硝酸钠交换成分后没有沉淀、水、气体生成,所以不能发生复分解反应,故答案为:不能,没有沉淀、水、气体生成,不符合复分解反应发生的条件;
(4)碱和盐反应时要求反应都可溶,且生成物中有沉淀,所以可以选择氢氧化钡和硫酸钠反应,生成硫酸钡沉淀和氢氧化钠;也可以选择氢氧化钡和碳酸钠反应生成碳酸钡沉淀和氢氧化钠;还可以选择氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠;故答案为:Ba(OH)2+Na2SO4═BaSO4↓+2NaOH(只要合理都正确)点评:
本题考点: 酸碱盐的溶解性;复分解反应的条件与实质;书写化学方程式、文字表达式、电离方程式.1年前查看全部
- (2007•宣武区一模)酸、碱、盐溶解性表是学习化学的重要工具.下表为部分酸、碱、盐在水中的溶解性(20℃).试回答:
(2007•宣武区一模)酸、碱、盐溶解性表是学习化学的重要工具.下表为部分酸、碱、盐在水中的溶解性(20℃).试回答:
(1)从上表中找出一种不溶盐______.OH- NO3- Cl- SO42- CO32- H+ 溶 溶 溶 溶 Na+ 溶 溶 溶 溶 溶 Ca2+ 微溶 溶 溶 微溶 不溶 Ag+ -- 溶 不溶 微溶 不溶 Ba2+ 溶 溶 溶 不溶 不溶 Cu2+ 不溶 溶 溶 溶 不溶
(2)某碱溶液和某盐溶液混合生成两种难溶物质,请你从上表找出物质写出该反应的化学方程式______.
(3)有A、B、C、D四种物质的稀溶液,右图为常温时上述溶液两两混合的实验现象,其中“↓”表示生成沉淀,“↑”表示生成气体,“-”表示无明显现象或生成微溶物.请你结合上表,将推断的可能情况填写出来.
①写出A、D的化学式:A______、C______;
②B可能是______.
③写出A和D反应的化学方程式______. lzm5501211年前1
lzm5501211年前1 -
 feidaowen 共回答了22个问题
feidaowen 共回答了22个问题 |采纳率90.9%解题思路:(1)根据盐是电离生成金属离子和酸根离子的化合物及表中信息进行解答;
(2)碱溶液和盐溶液的反应属于复分解反应,两两交换成分生成沉淀;
(3)观察四种物质两两反应的现象AD反应生成气体,可知二者是酸和碳酸盐的反应,然后根据复分解反应发生的条件(生成物中有沉淀、气体或水)进行推断.(1)根据盐的判断方法,由上表可知,不溶于水的盐很多,如氯化银、硫酸钡和碳酸钙等;
(2)碱和盐反应生成新的碱和盐,反应时要求反应物都可溶,并要生成两种沉淀,可以选择氢氧化钡和硫酸铜反应,生成硫酸钡沉淀和氢氧化铜沉淀;
(3)AD反应生成气体,可知二者是酸和碳酸盐的反应,若A为碳酸钠,D可以是稀盐酸、稀硝酸或稀硫酸,AB反应生成沉淀,则B可能是可溶性钡盐,如硝酸钡、氯化钡或可溶性碱氢氧化钡,又BC反应生成沉淀,AC不反应,C可能是硫酸钠;
故答案为:
(1)AgCl(合理均可);
(2)Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓;
(3)①A:Na2CO3; C:Na2SO4;②Ba(OH)2或BaCl2或Ba(NO3)2;③Na2CO3+2HCl=2NaCl+CO2↑+H2O(答案合理即可).点评:
本题考点: 复分解反应及其发生的条件;物质的鉴别、推断;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题综合性较强,考查了酸碱盐的溶解性、复分解反应发生的条件物质的推断和化学方程式的书写等,要求学生能根据复分解反应发生的条件并结合表中信息选择物质进行反应,并要注意方程式的书写.1年前查看全部
- 酸、碱、盐溶解性表是学习化学的重要工具.下表列出了部分酸、碱、盐在20℃时的溶解性.利用此表完成下列各小题: 阴离子 O
酸、碱、盐溶解性表是学习化学的重要工具.下表列出了部分酸、碱、盐在20℃时的溶解性.利用此表完成下列各小题:
(1)查:CaSO4的溶解性______;阴离子 OH- NO3- Cl- SO42- CO32- 阳离子 H+ 溶、挥 溶、挥 溶 溶、挥 Na+ 溶 溶 溶 溶 溶 Ca2+ 微 溶 溶 微 不 Ba2+ 溶 溶 溶 不 不 Cu2+ 不 溶 溶 溶 不
(2)写出表中空格处物质的化学式______;
(3)从表中选择,写出一个生成不溶物且属于中和反应的化学方程式:______. _突然的自我1年前1
_突然的自我1年前1 -
 木马克星7 共回答了14个问题
木马克星7 共回答了14个问题 |采纳率71.4%解题思路:(1)利用溶解性表,查出指定物质的溶解性;
(2)根据表中单元格的意义,完成表中的空格所对应物质的化学式;
(3)利用溶解性表,查找不溶的盐,根据中和反应的特征完成化学方程式的书写.(1)查找硫酸钙的溶解性,硫酸根与钙离子相交的格内写着“微”,即硫酸钙微溶于水;
故答案为:微溶;
(2)空格为氢氧根与氢离子的交点,因此此格内的物质为水;
故答案为:H2O;
(3)中和反应生成盐和水,溶解性表中不溶性的盐只有硫酸钡,所以反应为:硫酸与氢氧化钡反应;
故答案为:Ba(OH)2+H2SO4═BaSO4↓+2H2O;点评:
本题考点: 酸碱盐的溶解性;化学式的书写及意义;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查酸碱盐的溶解性和化学性质,要求我们能根据溶解性表和复分解反应发生的条件选择反应物进行反应.1年前查看全部
- (2007•黔东南州)酸、碱、盐溶解性表是学习化学的工具.下表为20℃时部分酸、碱、盐在水中的溶解性.
(2007•黔东南州)酸、碱、盐溶解性表是学习化学的工具.下表为20℃时部分酸、碱、盐在水中的溶解性.
(1)请从表中找出一种不溶性盐______;不溶性碱______(填化学式).阴离子
溶解性
阳离子OH- NO3- Cl- SO42- CO32- H+ - 溶、挥 溶、挥 溶 溶、挥 Na+ 溶 溶 溶 溶 溶 Ca2+ 微 溶 溶 微 不 Ba2+ 溶 溶 溶 不 不 Cu2+ 不 溶 溶 溶 不
(2)HCl、Ca(NO3)2两种溶液能否发生反应(填“能”或“否”),理由是______.
(3)完成Na2SO4与表中一种盐反应的化学方程式______. lxy316664021年前1
lxy316664021年前1 -
 sess_may 共回答了16个问题
sess_may 共回答了16个问题 |采纳率93.8%解题思路:根据表格可以判断物质的溶解性,酸碱盐之间发生复分解反应须符合复分解反应的条件,即有气体、沉淀或水生成.(1)根据表格可知不溶性碱为氢氧化铜,不溶性盐有硫酸钡、碳酸钙、碳酸钡、碳酸铜,所以本题答案为:Cu(OH)2;BaSO4(或CaCO3、BaCO3、CuCO3)
(2)HCl、Ca(NO3)2相互结合,如果反应生成氯化钙和硝酸,没有沉淀、气体或水生成,不符合复分解反应的条件,故不能发生反应,所以本题答案为:否,不符合复分解反应发生的条件;
(3)Na2SO4与表中的一种盐反应,此盐需为可溶性盐,且两种盐接触能生成沉淀,可以与氯化钡反应,所以本题答案为:Na2SO4+BaCl2=BaSO4↓+2NaCl.
故答案为:(1)BaSO4(或CaCO3、BaCO3、CuCO3);Cu(OH)2;(2)否,不符合复分解反应发生的条件;(3)Na2SO4+BaCl2=BaSO4↓+2NaCl.点评:
本题考点: 复分解反应及其发生的条件;酸碱盐的溶解性.
考点点评: 本题考查了表格的应用以及复分解反应的条件,完成此题,可以依据已有的知识结合表格进行.1年前查看全部
- 初中酸碱盐溶解性表中的所有物质颜色
初中酸碱盐溶解性表中的所有物质颜色
紧急 liki零1年前2
liki零1年前2 -
 cc有臀部 共回答了14个问题
cc有臀部 共回答了14个问题 |采纳率85.7%KMnO4---紫黑色
Fe2+---浅绿色
Fe3+---黄色
Cu2+---蓝色
K2Cr2O7---红色
其他大多是无色的1年前查看全部
- 酸、碱、盐溶解性表是学习化学的重要工具.下表列出了“部分酸、碱、盐在20°C时的溶解性”.请利用此表完成下列任务:
酸、碱、盐溶解性表是学习化学的重要工具.下表列出了“部分酸、碱、盐在20°C时的溶解性”.请利用此表完成下列任务:
(1)查BaCO3溶解性______;OH- NO3- Cl- CO32- SO42- H+ 溶、挥 溶、挥 溶、挥 溶 Na+ 溶 溶 溶 溶 溶 Ca2+ 微 溶 溶 不 溶 Ba2+ 溶 溶 溶 不 不 Cu2+ 不 溶 溶 不 溶
(2)写化学式:一种不溶于水的盐______;
(3)判断:氯化钠溶液与硝酸钙溶液能否发生反应及其理由是______;
(4)写出铁或铝与表中的一种盐反应的化学方程式:______. amyokay1年前1
amyokay1年前1 -
 laji121 共回答了18个问题
laji121 共回答了18个问题 |采纳率94.4%解题思路:根据表格提供的知识进行分析,碳酸钡是不溶于水的物质,盐是指由金属离子和酸根离子组成的物质,复分解反应的条件是两种化合物互相交换成分后得到的物质能得到气体、沉淀或水,在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.(1)查表可知,碳酸钡是不溶于水的物质,故填:不溶;
(2)碳酸钡是由金属离子和酸根离子组成的不溶于水的盐,故填:BaCO3;
(3)氯化钠溶液与硝酸钙溶液相互交换成分后没有沉淀、气体或水生成,故填:相互交换成分后没有沉淀、气体或水生成;
(4)铁能与硫酸铜溶液反应生成硫酸亚铁和铜,故填:Fe+CuSO4=FeSO4+Cu.点评:
本题考点: 酸碱盐的溶解性;复分解反应及其发生的条件.
考点点评: 本题考查了常见的酸碱盐的溶解性以及复分解反应的条件,完成此题,可以依据已有的知识进行.1年前查看全部
- 碱.盐溶解性表 口诀
 琥珀和紫dd1年前1
琥珀和紫dd1年前1 -
 FILEXWYF 共回答了14个问题
FILEXWYF 共回答了14个问题 |采纳率100%盐的溶解性
钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶.
氢硫溶四位,钾钠和镁钡.多数酸溶碱少溶、只有钾钠铵钡溶.1年前查看全部
- 酸、碱、盐溶解性表是学习化学的重要工具.下表是晓娜同学列出的部分酸、碱、盐在20℃时的溶解性,利用此表完成下列问题:
酸、碱、盐溶解性表是学习化学的重要工具.下表是晓娜同学列出的部分酸、碱、盐在20℃时的溶解性,利用此表完成下列问题:
(1)查:BaCl 2 的溶解性:______;不溶于水的物质有BaSO 4 和______.离子 OH - Cl - SO 4 2- H + 溶、挥 溶 K + 溶 溶 溶 Mg 2+ 不 溶 溶 Ba 2+ 溶 溶 不
(2)从表中选择合适的物质,写出有沉淀生成的中和反应的化学方程式______. 乌鹊北飞1年前1
乌鹊北飞1年前1 -
 yanghuanhuan123 共回答了11个问题
yanghuanhuan123 共回答了11个问题 |采纳率100%(1)查找BaCl 2 的溶解性,氯离子与钙离子相交的格内写着“溶”,即BaCl 2 溶于水;不溶于水的物质除BaSO 4 外,还有氢氧根与镁离子的相交的格,此格内的物质为氢氧化镁.
(2)中和反应是酸与碱作用生成盐和水的反应,溶解性表中不溶性的盐只有硫酸钡,该中和反应只能是硫酸和氢氧化钡的反应,硫酸与氢氧化钡反应生成硫酸钡沉淀和水,反应的化学方程式为:H 2 SO 4 +Ba(OH) 2 ═BaSO 4 ↓+2H 2 O.
故答案为:(1)溶于水;Mg(OH) 2 ;
(2)H 2 SO 4 +Ba(OH) 2 ═BaSO 4 ↓+2H 2 O.1年前查看全部
- 酸、碱、盐溶解性表是学习化学的重要工具。下表列出了部分酸、碱、盐在20℃时的溶解性。利用此表完成下列各小题: (1)查:
酸、碱、盐溶解性表是学习化学的重要工具。下表列出了部分酸、碱、盐在20℃时的溶解性。利用此表完成下列各小题: 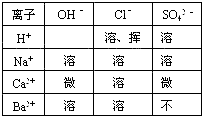
(1)查:CaSO 4 的溶解性_____;
(2)写出表中空格处物质的化学式______;
(3)从表中选择,写出一个生成不溶物且属于中和反应的化学方程式:_____________。 hrykcqk3vn1年前1
hrykcqk3vn1年前1 -
 ilovytj 共回答了18个问题
ilovytj 共回答了18个问题 |采纳率94.4%(1)微溶
(2)H 2 O
(3)Ba(OH) 2 +H 2 SO 4 ==BaSO 4 ↓+2H 2 O1年前查看全部
- 酸、碱、盐溶解性表是学习化学的重要工具,下表列出了部分酸、碱、盐在200C时的溶解性,利用此表完成下列各小题:
酸、碱、盐溶解性表是学习化学的重要工具,下表列出了部分酸、碱、盐在200C时的溶解性,利用此表完成下列各小题:
(1)查CaSO4的溶解性为______.离子 OH- Cl- SO42- H+ 溶、挥 溶 Na+ 溶 溶 溶 Ca2+ 微 溶 微 Cu2+ 不 溶 溶
(2)写出表中空格处物质的化学式:______.
(3)从表中选择离子组成物质,写出一个属于中和反应的化学方程式:______. 49770474181年前1
49770474181年前1 -
 走遍zz是我家 共回答了17个问题
走遍zz是我家 共回答了17个问题 |采纳率94.1%解题思路:(1)利用溶解性表,查出指定物质的溶解性;
(2)根据表中单元格的意义,完成表中的空格所对应物质的化学式;
(3)根据表中氢离子和酸根离子构成的酸有盐酸和硫酸,金属离子和氢氧根离子组成的碱有氢氧化钠、氢氧化钙和氢氧化铜,中和反应为酸和碱生成盐和水的反应,任选一种酸和一种碱即可完成此题.(1)查找硫酸钙的溶解性,硫酸根与钙离子相交的格内写着“微”,即硫酸钙微溶于水;
故答案为:微溶;
(2)空格为氢氧根与氢离子的交点,因此此格内的物质为水;
故答案为:H2O;
(3)中和反应为酸和碱反应生成盐和水,溶解性表中酸有盐酸和硫酸,碱有氢氧化钠、氢氧化钙和氢氧化铜,任选一种如氢氧化钠与盐酸的反应;
故答案为:HCl+NaOH═NaCl+H2O;点评:
本题考点: 化学式的书写及意义;化合价规律和原则;书写化学方程式、文字表达式、电离方程式.
考点点评: 溶解性表中,“溶”字表示物质可溶;“不”字表示所对应物质不溶于水;“挥”字表示物质有挥发性;“微”字表示物质微溶于水.1年前查看全部
- 谁有酸、碱、盐溶解性表的顺口溜?
谁有酸、碱、盐溶解性表的顺口溜?
就是人教版初三(下学期)化学书109页的那张表,有什么好的办法记住它? liujack881年前4
liujack881年前4 -
 月影晨曦 共回答了23个问题
月影晨曦 共回答了23个问题 |采纳率95.7%说变化
物理变化不难辨,没有新物质出现 ;化学变化则不然,物质本身没改变;两种变化有区别,
有无新物作判断;两种变化有关联,化变中间有物变;变化都由性质定,物性化性是关键.
化合价
钾钠银氢正一价,钙镁钡锌正二价;铝是正三氧负二 ,氯负一价最常见;硫有负二正四六,
正二正三铁可变;正一二铜二四碳,单质零价永不变;
其它元素有变价,先死后活来计算.
化合价要记准,一价钾钠氯氢银,二价氧钙钡镁锌,三硅四铝五价磷;
谈变价也不难,二三铁二四碳,二四六硫都齐全,铜汞二价最常见;
原子团不要分,一价铵根氢氧根,二价硫酸碳酸根,三价就是磷酸根.
一价氟氯溴碘氢 还有金属钾钠银 二价氧钡钙镁锌 铝三硅四都固定
氯氮变价要注意 一二铜汞一三金 二四碳铅二三铁 二四六硫三五磷
氟氯溴碘负一价;正一氢银与钾钠.氧的负二先记清;正二镁钙钡和锌.
正三是铝正四硅;下面再把变价归.全部金属是正价;一二铜来二三铁.
锰正二四与六七;碳二四要牢记.非金属负主正不齐;氯负一正一五七.
氮磷负三与正五;不同磷三氮二四.硫有负二正四六;边记边用就会熟.
常见根价口诀
一价铵根硝酸根;氢卤酸根氢氧根.高锰酸根氯酸根;高氯酸根醋酸根.
二价硫酸碳酸根;氢硫酸根锰酸根.暂记铵根为正价;负三有个磷酸根.
一价金属银钠钾,还有亚铜亚汞是一价, 二价金属锌钡铜,还有钙镁亚铁汞, 氟氯溴碘常显一,
有时还显三五七, 氢一价,氧二价,铁三铝三记住它, 硫有二四和六价,氮磷三五是常规.
一般在口诀中不会编入正价与负价,因此还有以下规律:
金属元素一般是正价,非金属中氢元素是正价,其余的就只有具体情况具体分析了,比如锰有七个化合价,在不同的化合物中都不一样,这些只有死记硬背.
短周期元素化合价与原子序数的关系
价奇序奇,价偶序偶.
化学式
一排顺序二标价,价数交叉写右下,约简价数作角码,化合价规则去检查.
化学方程式
左写反应物,右边写生成;写对化学式,系数来配平;
中间连等号,条件要注清;生成沉淀气,箭头来标明.
一找元素见面多,二将奇数变成偶,三按连锁先配平,四用观察配其它;
有氢找氢无氢找氧,奇数配偶变单成双,出现分数去掉分母,调整系数使支配平.
离子方程式
客观事实要遵从,书写形式分异同,生成符号要写对,质量电荷要守恒.
干燥气体
酸干酸,碱干碱,氧化不能干还原,
中性干燥剂,使用较普遍,
只有不反应,干燥就能成.
空气组成
空气组成别忘记,主要成分氮氧气,氮七八氧二一,零点九四是稀气;还有两个零点三,
二氧化碳和杂气;体积分数要记清,莫要当成质量比,还要注意防污染,环保意识要树立.
碳硫磷铁在氧气中燃烧的现象
红热木炭剧烈燃烧,发出白光温度很高;燃硫入氧燃烧变旺,火焰紫色美丽漂亮,生成气体气味够“呛”;
燃磷入氧现象难忘,浓厚白烟冷却粉状;铁丝燃烧火星四射,生成熔物固态黑色.
氧中燃烧的特点
氧中余烬能复烯,磷燃白色烟子漫,
铁烯火星四放射,硫蓝紫光真灿烂.
氯中燃烧的特点
磷燃氯中烟雾茫,铜燃有烟呈棕黄,
氢燃火焰苍白色,钠燃剧烈产白霜.
实验室制氧气(氯酸钾分解)
七步: 茶庄定点收利息(查装定点收离熄)
十步:茶房禁鼓捣(查放紧固倒),夜深取衣洗(热伸取移熄).
排水法收集气体
满水无泡倒立水中,放空充气撤管撤灯.
盐的溶解性
钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶.
氢硫溶四位,钾钠和镁钡.多数酸溶碱少溶、只有钾钠铵钡溶.
防止铁生锈
铁氧水等互作用,发生复杂之反应,主要生成氧化铁,还有复杂的成分;
铁锈疏松易吸水,加快生锈的过程,要想防止铁生锈,保持干燥和洁净;
隔绝空气又防水,表面涂上保护层,镀金属刷油漆,涂油烤蓝都可以.
硫的物理性质
黄晶脆,水两倍,微溶于酒精,易溶于二硫化碳,不溶于水,溶点一一二,沸点四四四.(密度是水的两倍).
硫化氢的性质
无色有臭还有毒,二点六,分氢硫,还可性蓝火头,燃烧不全产生硫.(1体积水溶解2.6体积的H2S,一定条件下分解为单质氢和硫,有还原性,可燃性,蓝色火焰).
苯的化学性质
取卤硝,磺加烧.
卤代烃的化学性质
碱水取,醇碱消.
托盘天平的使用
左物右码先调零,天平一定要放平,砝码大小顺序夹,完毕归零放盒中.
容量瓶的使用
精确配液容量瓶,用前查洗记心中,溶解药品用烧杯,静置片刻移瓶中,
转移溶液洗三遍,溶剂一次勿加成,快到刻度滴管加,摁塞倒立再摇动.
固体药品的取用与溶解
粉末固体用药匙,量多大匙少小匙,块状固体镊子夹,平放药匙再直立.
过滤
过滤操作要知道,一贴二低三紧靠,一次过滤不澄清,重复操作可奏效.
仪器装配
下上左右顺序定,装好检验气密性,固液小大装药品,拆卸仪器反进行.
加热
用前检查灯芯平,烧焦过长都不行,酒精可加三分二,燃着不能加酒精,
点灯要用火柴点,不能用灯去点灯,熄灯要用灯帽盖,用嘴吹灯货易生.
氢是H氧是O,磷P钾K金AU,NA钠CA钙,CU是铜碘是I.
铅PB镁MG,BA为钡银AG.
所有的,多记点没坏处1年前查看全部
- (2009•宁夏)酸、碱、盐溶解性表是学习化学的重要工具.下表列出了部分酸、碱、盐在20℃时的溶解性.
(2009•宁夏)酸、碱、盐溶解性表是学习化学的重要工具.下表列出了部分酸、碱、盐在20℃时的溶解性.
OH- NO3- Cl- SO42- CO32- H+ 溶、挥 溶、挥 溶 溶、挥 Na+ 溶 溶 溶 溶 溶 Ca2+ 微 溶 溶 微 不 Ba2+ 溶 溶 溶 不 不 Cu2+ 不 溶 溶 溶 不
请依据上表,按要求回答下列问题:
(1) BaS04的溶解性为______.
(2)写出一种挥发性酸的化学式______.
(3)氯化钙溶液与硝酸钠溶液______ (填“能”或“不能”)发生反应.理由是______.
(4)碱和盐反应时,反应物必须都是可溶的.请写出一个碱和盐反应的化学方程式:______.
(5) NaOH和Ba(OH)2是两种可溶性碱,其溶液均为无色.简要写出鉴别这两种物质的实验步骤及现象______. ii_661年前1
ii_661年前1 -
 梦雪 共回答了17个问题
梦雪 共回答了17个问题 |采纳率100%解题思路:(1)根据溶解性表中的信息回答.
(2)根据溶解性表中的信息回答.
(3)根据复分解反应的条件回答.
(4)根据碱和盐反应的条件回答.
(5)根据NaOH和Ba(OH)2的化学性质回答.(1)根据溶解性表可知,硫酸钡为不溶性物质.
(2)根据溶解性表可知,硝酸、盐酸、碳酸为挥发性的酸,化学式分别为HNO3或HCl或H2CO3.
(3)氯化钙溶液与硝酸钠溶液混合后,不能生成气体或沉淀或水,不符合复分解反应发生的条件,所以二者不能反应.
(4)碱和盐反应的条件是:一、碱和盐必须可溶,二、生成物中有沉淀或气体或水,符合条件的反应很多,如2NaOH+CuSO4=Cu(OH)2↓+Na2SO4.
(5)NaOH和Ba(OH)2的鉴别,可看成是钡离子的检验,如:分别取少量两种无色溶液于试管中,分别通入二氧化碳,变浑浊的是Ba(OH)2,无现象的是NaOH;或分别取少量两种无色溶液于试管中,分别滴加H2SO4或Na2SO4溶液,有白色沉淀生成的是Ba(OH)2,无现象的是NaOH.
故答案为:(1)不溶;(2)HNO3或HCl或H2CO3;(3)不能;没有沉淀生成,不符合复分解反应发生的条件;(4)2NaOH+CuSO4=Cu(OH)2↓+Na2SO4(答案合理均得分);(5)分别取少量两种无色溶液于试管中,分别通入二氧化碳,变浑浊的是Ba(OH)2,无现象的是NaOH(或分别取少量两种无色溶液于试管中,分别滴加H2SO4或Na2SO4溶液,有白色沉淀生成的是Ba(OH)2,无现象的是NaOH).点评:
本题考点: 酸碱盐的溶解性;复分解反应及其发生的条件;酸、碱、盐的鉴别;书写化学方程式、文字表达式、电离方程式.
考点点评: 酸、碱、盐的溶解性表是初中化学最重要的工具,对于判断复分解反应能否发生有重要作用,因此要熟练记忆,并能灵活应用.1年前查看全部
- 酸、碱、盐溶解性表是学习科学的重要工具,下表列出了部分酸、碱、盐在20℃的溶解性.请利用此表完成下列任务
酸、碱、盐溶解性表是学习科学的重要工具,下表列出了部分酸、碱、盐在20℃的溶解性.请利用此表完成下列任务
(1)查Zn(OH)2的溶解性______(填“溶”或“不溶”)OH- Cl- CO32- SO42- H+ 溶挥 溶挥 溶 Na+ 溶 溶 溶 溶 Zn2+ 不 溶 不 溶 Cu2+ 不 溶 不 溶
(2)请用表中物质写出一条中和反应的化学方程式______. 水中勇士1年前1
水中勇士1年前1 -
 梅仁兴 共回答了19个问题
梅仁兴 共回答了19个问题 |采纳率89.5%解题思路:(1)利用部分酸、碱、盐在20℃时的溶解性,查出指定Zn(OH)2的溶解性即可.
(2)根据中和反应的原理,利用溶解性表,确定参加反应的反应物,写出反应的化学方程式即可.(1)查找Zn(OH)2的溶解性,锌离子与氢氧根离子相交的格内写着“溶”,即Zn(OH)2不溶于水.(2)中和反应是酸与碱作用生成盐和水的反应,氢氧化钠与盐酸反应生成氯化钠和水,反应的化学方程式为:NaOH+HCl=NaCl+...
点评:
本题考点: 酸碱盐的溶解性;书写化学方程式、文字表达式、电离方程式.
考点点评: 酸碱盐的溶解性表是初中化学重要的工具之一,会查阅酸碱盐溶解性表、掌握复分解反应发生的条件并能灵活运用是正确解答此类题的关键.1年前查看全部
- 酸、碱、盐溶解性表是学习化学的重要工具.右表列出了“部分酸、碱、盐在20℃时的溶解性”.利用此表完成以下任务:
酸、碱、盐溶解性表是学习化学的重要工具.右表列出了“部分酸、碱、盐在20℃时的溶解性”.利用此表完成以下任务:
(1)查:Ba(OH)2的溶解性______
(2)写出表中一种含氧酸与表中的一种盐溶液反应的化学方程式______.
(3)工业生产和日常生活中燃烧煤时都有造成酸雨形成的二氧化硫产生.请你写出用上表中的某种溶液吸收二氧化硫的化学方程式______.
OH- NO3- Cl- CO32- SO42- H+ -- 溶、挥 溶、挥 溶、挥 溶 Na+ 溶 溶 溶 溶 溶 Ca2+ 微 溶 溶 不 微 Ba2+ 溶 溶 溶 不 不 Cu2+ 不 溶 溶 不 溶  干萌生1年前1
干萌生1年前1 -
 heyiweimy 共回答了23个问题
heyiweimy 共回答了23个问题 |采纳率91.3%解题思路:(1)查阅图表信息可知氢氧化钡的溶解性;
(2)先从表中找出常见的含氧酸:硝酸、碳酸、硫酸,然后根据复分解反应发生的条件要求生成物中有水、气体、或沉淀,选择另一种盐溶液.例如:硫酸和硝酸钡或氯化钡等反应会生成硫酸钡沉淀;硝酸会和碳酸盐生产二氧化碳和水等.答案只要合理即可.
(3)工业上常用氢氧化钠溶液吸收二氧化硫气体.(1)从表中可知氢氧化钡溶于水;
(2)本题答案具有开放性,只要是含氧酸和盐溶液反应生成沉淀或气体或水的反应都正确,
如:H2SO4+BaCl2═BaSO4↓+2HCl;H2SO4+Na2CO3═Na2SO4+H2O+CO2↑;2HNO3+CaCO3═Ca(NO3)2+H2O+CO2↑;(只要合理都可)
(3)用氢氧化钠溶液可以吸收二氧化硫气体,化学反应方程式为:SO2+2NaOH═Na2SO3+H20.
故答案为:(1)溶于水;(2)H2SO4+BaCl2═BaSO4↓+2HCl;(3)SO2+2NaOH═Na2SO3+H20.点评:
本题考点: 酸碱盐的溶解性;酸雨的产生、危害及防治;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查酸碱盐的溶解性和化学性质,要求我们能根据溶解性表和复分解反应发生的条件选择反应物进行反应.1年前查看全部
- 中学酸碱盐溶解性表都包括什么物质
中学酸碱盐溶解性表都包括什么物质
比如H+NO3是什么物质 上面只写了一个溶、挥,我不明白他们组成的是什么化学式. 米米说1年前1
米米说1年前1 -
 今夜金枪鱼 共回答了23个问题
今夜金枪鱼 共回答了23个问题 |采纳率87%把正电荷的放前面,如HNO3就是硝酸了,溶、挥表示它们可溶,易挥发1年前查看全部
- 初中酸碱盐溶解性表怎么用最近老师让我们背酸碱盐溶解性表,但是我完全不知道有什么用,是用来干什么的,1、溶解性表是用来干什
初中酸碱盐溶解性表怎么用
最近老师让我们背酸碱盐溶解性表,但是我完全不知道有什么用,是用来干什么的,
1、溶解性表是用来干什么的?怎么用?【请详细一点】
2、表格里面的化学式又是什么……
3、看那个溶解性表的背诵口诀完全看不懂,什么叫酸除硅酸全可溶,碱溶钾钠铵钡钙.钾钠铵盐硝酸盐,全部溶解不困难.氯化银和硫酸钡,两种沉淀记心间.碳酸盐除钾钠铵,其余皆不溶于水. vanillacoffe1年前1
vanillacoffe1年前1 -
 chang8225 共回答了9个问题
chang8225 共回答了9个问题 |采纳率66.7%①复分解反应的条件是有水,气体,或沉淀生成对吧,有沉淀生成就用这个判断.
再有就是溶液中离子能否共存的问题,如果横行对竖行是不容或微溶就有沉淀生成,不能共存.
②化学式是组成一种分子的原子团或离子,横着和竖着对起来就组成一种物质.(方格里写的是它容还是不容)
③硅酸不溶,钾盐,铵盐,和含有硝酸根的盐全都是可以溶的.不必逐一记忆.
氯化银和硫酸钡在酸和水中都不溶解,另外加一个,硫酸银也和他们一样在酸和水中都不溶解.
最后一句话可以结合 钾钠铵盐硝酸盐,全部溶解不困难 这句记忆,只需记住碳酸盐中只有碳酸钾,碳酸钠,碳酸铵可溶,其他都不溶就可以了.
O(∩_∩)O1年前查看全部
- (2007•昌平区二模)酸、碱、盐溶解性表是学习化学的重要工具.下表为部分酸、碱、盐在水中的溶解性(20℃).试回答:
 (2007•昌平区二模)酸、碱、盐溶解性表是学习化学的重要工具.下表为部分酸、碱、盐在水中的溶解性(20℃).试回答:
(2007•昌平区二模)酸、碱、盐溶解性表是学习化学的重要工具.下表为部分酸、碱、盐在水中的溶解性(20℃).试回答:
(1)某碱溶液和某盐溶液混合生成两种难溶物质,请你从上表找出物质写出该反应的化学方程式______.阴离子 Ba2+ Ca2+ Mg2+ Zn2+ Fe2+ Cu2+ Ag+ OH- 溶 微 不 不 不 不 -- SO42- 不 微 溶 溶 溶 溶 微 CO32- 不 不 微 不 不 不 不 Cl- 溶 溶 溶 溶 溶 溶 不
(2)有A、B、C、D四种物质的稀溶液,如图为常温时上述溶液两两混合的实验现象,其中“↓”表示生成沉淀,“↑”表示生成气体,“-”表示无明显现象或生成微溶物.请你结合上表,将推断的可能情况填写出来.
①写出A、D的化学式:A______、C______;
②B可能是______.
③写出A和D反应的化学方程式______. 幽幽05041年前1
幽幽05041年前1 -
 sibo99 共回答了18个问题
sibo99 共回答了18个问题 |采纳率88.9%解题思路:(1)碱和盐反应生成新的碱和盐,且反应物须可溶,生成物均为沉淀,然后结合溶解性表进行分析;
(2)AD反应生成气体,所以二者可能是碳酸盐与酸的反应,然后结合复分解反应的条件和四种物质之间的反应现象进行分析,并写出反应方程式.(1)碱和盐反应生成新的碱和盐,且反应物须可溶,生成物均为沉淀,由表中信息可知氢氧化钡和硫酸铜、或硫酸镁、硫酸铁均可;
故答案为:Ba(OH)2+CuSO4═Cu(OH)2↓+BaSO4↓(答案不唯一)
(2)AD反应生成气体,所以二者可能是碳酸盐与酸的反应,A可能是碳酸镁,D是稀盐酸,AB反应生成沉淀,可以是盐和盐的反应,也可以是碱和盐的反应,反应物须可溶,故B可能是氯化钡或氢氧化钡,BC反应生成沉淀沉淀是硫酸钡,C可能是硫酸铜、硫酸锌等可溶性硫酸盐;
故答案为:①MgCO3CuSO4;②BaCl2 ;③MgCO3+2HCl═MgCl2+CO2↑H2O(答案合理即可).点评:
本题考点: 复分解反应及其发生的条件;物质的鉴别、推断.
考点点评: 本题综合性较强,通过物质的推断和复分解反应条件利用能较好的考查学生分析能力和对知识的应用能力,解答时一定要抓住反应现象的不同,细心辨别、推断.1年前查看全部
- 酸、碱、盐溶解性表是学习自然科学的重要工具,下表列出了“部分酸、碱、盐在20℃时的溶解性。”请利用表完成下列任务。 (1
酸、碱、盐溶解性表是学习自然科学的重要工具,下表列出了“部分酸、碱、盐在20℃时的溶解性。”请利用表完成下列任务。 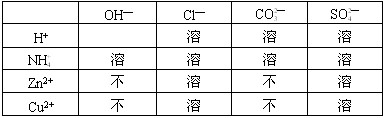
(1)查Zn(OH) 2 的溶解性:_______(选填“溶”或“不溶”);
(2)用化学方程式表示铁与表中的一种盐溶液的反应:____________________。 baihehua99211年前1
baihehua99211年前1 -
 绍兴E网 共回答了18个问题
绍兴E网 共回答了18个问题 |采纳率94.4%(1)不溶
(2)Fe+CuCl 2 ==FeCl 2 +Cu1年前查看全部
- 酸、碱、盐溶解性表是学习化学的重要工具.下表列出了“部分酸、碱、盐在20℃时的溶解性”,请利用此表完成以下任务:
酸、碱、盐溶解性表是学习化学的重要工具.下表列出了“部分酸、碱、盐在20℃时的溶解性”,请利用此表完成以下任务:
(1)查:Ba(OH)2的溶解性______.OH- NO3- Cl- CO32- SO42- H+ - 溶、挥 溶、挥 溶、挥 溶 Na+ 溶 溶 溶 溶 溶 Ca2+ 微 溶 溶 不 微 Ba2+ 溶 溶 溶 不 不 Cu2+ 不 溶 溶 不 溶 Ag+ - 溶 不 不 微
(2)写化学式:一种酸______,一种不溶于水的盐______.
(3)判断:氯化钠溶液与硝酸钙溶液能否发生反应______,理由是______.
(4)写化学方程式:铁与表中的一种盐反应______. 慵懒的睡猫1年前1
慵懒的睡猫1年前1 -
 潘毛毛 共回答了15个问题
潘毛毛 共回答了15个问题 |采纳率100%解题思路:(1)查表可知氢氧化钡溶于水;
(2)表中酸有盐酸、硫酸、硝酸、碳酸;不溶于水的盐有碳酸钙、碳酸钡、硫酸钡、碳酸铜;
(3)根据复分解反应发生的条件进行分析,两种物质互换成分后必须有水、气体或沉淀生成,反应才能发生;
(4)根据金属活动性顺序中排在前面的金属能把后面的金属从它的盐溶液中置换出来,从表中所给金属可知,铁只能置换出金属铜,所以可以写铁和硫酸铜或铁和氯化铜的反应方程式;(1)氢氧化钡溶于水,
(2)酸有盐酸、硫酸、硝酸、碳酸;不溶于水的盐有碳酸钙、碳酸钡、硫酸钡、碳酸铜,
(3)氯化钠溶液和硝酸钙溶液互换成分后没有水、气体或沉淀生成,所以反应不会发生,
(4)铝排在铜之前,所以铁能置换出硫酸铜或氯化铜中的铜;只要合理均可,
故答案为:(1)可溶;
(2)HCl(或H2SO4、H2CO3、HNO3),CaCO3(或BaCO3、BaSO4、CuCO3);
(3)不能反应,因为互换成分无沉淀、气体或水产生,不满足复分解反应的条件;
(4)Fe+CuSO4═FeSO4+Cu;Fe+CuCl2═FeCl2+Cu(或其它合理答案).点评:
本题考点: 酸碱盐的溶解性;复分解反应及其发生的条件;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了常见酸碱盐的溶解性以及物质间的反应,完成此题,可以依据已有的知识进行,书写反应的化学方程式要注意配平.1年前查看全部
- 酸、碱、盐溶解性表是学习化学的重要工具,右表列出了部分酸、碱、盐在20℃时的溶解性,我能利用此表完成以下任务:
酸、碱、盐溶解性表是学习化学的重要工具,右表列出了部分酸、碱、盐在20℃时的溶解性,我能利用此表完成以下任务:
(1)查:Ba(OH)2的溶解性______.OH- NO3- Cl- CO32- SO42- H+ -- 溶、挥 溶、挥 溶、挥 溶 Na+ 溶 溶 溶 溶 溶 Ca2+ 微 溶 溶 不 微 Ba2+ 溶 溶 溶 不 不 Cu2+ 不 溶 溶 不 溶
(2)写化学式:一种酸______;一种不溶于水的盐______.
(3)判断:氯化钠溶液与硝酸钙溶液能否发生反应及其______.
(4)写化学方程式:铝与表中的可溶性盐发生的反应(只写1个)______.
表中物质发生的有沉淀生成的复分解反应(只写1个)______. 憨包包1年前1
憨包包1年前1 -
 133ok 共回答了16个问题
133ok 共回答了16个问题 |采纳率87.5%解题思路:(1)查表可知氢氧化钡溶于水;
(2)表中酸有盐酸、硫酸、硝酸、碳酸;不溶于水的盐有碳酸钙、碳酸钡、硫酸钡、碳酸铜;
(3)根据复分解反应发生的条件进行分析,两种物质互换成分后必须有水、气体或沉淀生成,反应才能发生;
(4)根据金属活动性顺序中排在前面的金属能把后面的金属从它的盐溶液中置换出来,从表中所给金属可知,铝只能置换出金属铜,所以可以写铝和硫酸铜或铝和氯化铜的反应方程式;复分解反应可以写生成碳酸钡、硫酸钡、碳酸钙等沉淀的反应,只要合理都正确.(1)氢氧化钡溶于水,故答案为:可溶;
(2)酸有盐酸、硫酸、硝酸、碳酸;不溶于水的盐有碳酸钙、碳酸钡、硫酸钡、碳酸铜,故答案为:HCl(或H2SO4、H2CO3、HNO3),CaCO3(或BaCO3、BaSO4、CuCO3);
(3)氯化钠溶液和硝酸钙溶液互换成分后没有水、气体或沉淀生成,所以反应不会发生,故答案为:不能反应,因为互换成分无沉淀、气体或水产生,不满足复分解反应的条件;
(4)铝排在铜之前,所以铝能置换出硫酸铜或氯化铜中的铜;表中沉淀有碳酸钡、硫酸钡、碳酸钙等,所以可以写氯化钡和硫酸反应生成硫酸钡和盐酸,也可以写氯化钙和碳酸钠反应生成碳酸钙和氯化钠,只要合理均可,故答案为:2Al+3CuSO4═Al2(SO4)3+3Cu;BaCl2+H2SO4═BaSO4↓+2HCl(或其它合理答案).点评:
本题考点: 酸碱盐的溶解性;复分解反应及其发生的条件;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查复分解反应发生的条件,要求我们能从表中所给物质中选择恰当的物质进行反应.1年前查看全部
大家在问
- 1空之轨迹里的resist是什么意思
- 2下面是陈毅元帅为鲁迅先生逝世十四周年撰写的一副对联。上下联各抽出了部分句子并打乱了顺序,请将正确的序号填入空格处。
- 3已知以二为底三的对数等于a,以三为底七的对数等于b,试用a,b表示以十四为底五十六的对数?
- 4英语翻译准确一点,最好不是用翻译工具翻译的
- 5下图中大正方体凌长是6dm,小正方体凌长是2dm,要给这个组合体的外表刷上油漆,刷油漆的面积是多少?
- 6一件事明明不是很严重 把它说的比较严重 成语怎么说 如果更严重了 成语怎么说 哪个有学识有见识的朋友帮我
- 7中文翻成英文(1)这个问题必须马上处理(deal with) (2) 在昨天的篮球比赛中,我们赢了2班(beat) (3
- 8Having a bake sale is a good idea 改为同义句 ___a good idea____ _
- 9一个靶子的最内环(靶心)的半径是2厘米,各环宽相等,都等于最内半径.求最外环的面积
- 10将烧红的铁块放进冷水中,会听到嗤的一身,同时看到白气上升,一会儿白气又消失了,在上面所描述的现象中,先后发生了哪些物态变
- 11Be原形用法.In order to be in time we hurried
- 12求解一次函数与反比例函数的解已知一次函数Y=2分之三+2的图像分别与坐标轴相交于A.B两点(如图所示),与反比例函数Y=
- 13"门" 这个字,第一笔先写什么?
- 14上午我们八点开始上课.英文翻译
- 15汽车行驶10千米要耗油6分之5升,照这样计算,这辆汽车装满10升油,油最多能行驶几千米?
