6.02×10^22个OH—中质子的物质的量为_mol,电子的物质的量为_mol
 望破天空2022-10-04 11:39:541条回答
望破天空2022-10-04 11:39:541条回答详答!

已提交,审核后显示!提交回复
共1条回复
 searsea 共回答了20个问题
searsea 共回答了20个问题 |采纳率90%- 质子的物质的量为:8*6.02*10^22/6.02*10^23=0.8mol
电子的物质的量为:(8+1+1)*6.02*10^22/6.02*10^23=1mol - 1年前
相关推荐
- (1)某元素的原子结构示意图如图,则该元素原子核内有______质子,它属于______(填“金属或非金属”),原子核外
 (1)某元素的原子结构示意图如图,则该元素原子核内有______质子,它属于______(填“金属或非金属”),原子核外有______个电子层,在化学反应中易______(填“得”、“失”电子,形成______
(1)某元素的原子结构示意图如图,则该元素原子核内有______质子,它属于______(填“金属或非金属”),原子核外有______个电子层,在化学反应中易______(填“得”、“失”电子,形成______
(2)用化学用语填空:
①两个氧分子______ ②一个铝离子______ ③3个碳酸根离子______
④水中氧元素显-2价H2−2 O H2⑤三氧化二铁______.−2 O  xiaoxiao75751年前1
xiaoxiao75751年前1 -
 liweiguang111 共回答了23个问题
liweiguang111 共回答了23个问题 |采纳率87%解题思路:原子结构示意图的表示法:小圆圈和圈内的数字表示原子核和核内质子数;弧线表示电子层,弧线上的数字该电子层上的电子数;离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字;化合物化学式的书写步骤:归类→定序→标价→交叉→约简,据此进行解答.(1)由元素的原子结构示意图可知,则该元素原子核内有11质子,属于钠元素,元素的名称中带有金字旁,它属于金属,原子核外有3个电子层,最外层有1个电子,小于4,在化学反应中易失电子,形成钠离子,符号为:Na+.
(2)①两个氧分子,在氧气的化学式的前边加计量数2,符号为:2O2;
②由离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.可知,一个铝离子符号为:Al3+;
③3个碳酸根离子的符号为:3CO32-;
④水中氧元素显-2价,在水的化学式中氧的元素符号的正上放标出“-2”,符号为:H2
−2
O;
⑤三氧化二铁中.氧-2价,铁为+3价,化学式是:Fe2O3.
故答为:(1)11,金属,3,失,Na+;(2)(5分)①2O2,②Al3+,③3CO32-;④H2
−2
O;⑤Fe2O3;点评:
本题考点: 原子结构示意图与离子结构示意图;化学符号及其周围数字的意义.
考点点评: 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础.1年前查看全部
- 关于阿伏伽德罗常数的疑问阿伏伽德罗综合应用的“物质组成方面”中的易错点:特殊物质中所含微粒(分子·原子·电子·质子·中子
关于阿伏伽德罗常数的疑问
阿伏伽德罗综合应用的“物质组成方面”中的易错点:
特殊物质中所含微粒(分子·原子·电子·质子·中子等)的数目:如Ne,D2O,18O2,H37Cl,-OH,OH-等.
到底这是要注意哪里? tzm2911年前2
tzm2911年前2 -
 lpt_lpq 共回答了11个问题
lpt_lpq 共回答了11个问题 |采纳率81.8%它是想说明有些特殊但相像的物质中所含微粒(分子·原子·电子·质子·中子等)的数目是不同的.
比如:
D2O(重水)和H2O(普通水)
18O2(氧的同位素)和O2(普通的氧)
-OH(羟基)和OH-(氢氧根)
这些相似的物质中所含微粒的数目是不同的,答题时注意区分(易错点)1年前查看全部
- 1摩尔水有几个电子几个质子
 gsbab1年前5
gsbab1年前5 -
 云烟990919 共回答了16个问题
云烟990919 共回答了16个问题 |采纳率100%10Na、10Na.
∵质子数=电子数=荷电核数=原子序数
∴都是10Na个!1年前查看全部
- 关于夸克的问题夸克踞离越远~其相互作用力越大,夸克踞离越近~其相互作用力越小...质子中子组成原子..夸克组成质子中子.
关于夸克的问题
夸克踞离越远~其相互作用力越大,夸克踞离越近~其相互作用力越小...
质子中子组成原子..夸克组成质子中子.
设一原子含质子中子若干~则不同质子中子中含有的夸克会因踞离近..相互作用力很小
但我们能分开质子中子~却无法分开夸克.
相邻的质子与中子之间应该会因为各自都含有夸克而不能分开~
那为啥我们能分开质子中子~却无法分开夸克. 红了眼眶1年前1
红了眼眶1年前1 -
 050128 共回答了13个问题
050128 共回答了13个问题 |采纳率100%楼上的有点胡搅蛮缠,夸克跟四维空间没有任何对应关系,跟广义相对论的联系也不大.夸克包含六种(由轻到重分别记为:上夸克u、下夸克d、奇异夸克s、粲夸克c、底夸克b 和顶夸克t),每一种夸克包含三种色,再加上对应的反...1年前查看全部
- Fe3+和Fe2+什么相同A核外电子数B质子数C电荷数
 xaqvf1年前1
xaqvf1年前1 -
 泪干在黎明 共回答了19个问题
泪干在黎明 共回答了19个问题 |采纳率94.7%B
理由,一个是铁离子,一个是亚铁离子,因为都是铁元素,所以质子数相同 .
A,C它们的核外电子数和电荷数都不同,因为它们是不同的离子.
D化学性质取决于最外层电子数,两者不一样,化学性质当然也不同1年前查看全部
- 某元素的原子结构示意图为,该元素原子核内有______个质子,核外共有______个电子层,最外电子层上有______个
某元素的原子结构示意图为
 ,该元素原子核内有______个质子,核外共有______个电子层,最外电子层上有______个电子,在化学反应中易______电子,形成了______离子,符号为______.该元素属于______元素.
,该元素原子核内有______个质子,核外共有______个电子层,最外电子层上有______个电子,在化学反应中易______电子,形成了______离子,符号为______.该元素属于______元素.  天宇飞弹1年前1
天宇飞弹1年前1 -
 liuminleo 共回答了13个问题
liuminleo 共回答了13个问题 |采纳率100%解题思路:原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层.若原子的最外层电子数为8,则为稀有气体元素,属于相对稳定结构;若最外层电子数≥4,则一般为非金属元素,在化学反应中易得电子,若最外层电子数<4,则一般为金属元素,在化学反应中易失去电子.由某元素的原子结构示意图可以看出:圆圈内的数字是13,该元素原子核内有13个质子;原子核外有3个电子层,最外层弧线上的数字是2,原子最外电子层上有3个电子,小于4,在化学反应中易失去3个电子而形成阳离子,其离子符号为Al3+;该元素属于金属元素.
故答案为:13;3;3;失去;阳;Al3+;金属.点评:
本题考点: 原子结构示意图与离子结构示意图.
考点点评: 本题难度不大,考查学生对原子结构示意图及其意义的理解,了解原子结构示意图的意义是正确解题的关键.1年前查看全部
- 下列叙述中正确的是( ) A.原子核由质子和电子组成 B.煤、天然气、石油等属于不可再生能源 C.电磁波的传播需要介质
下列叙述中正确的是( ) A.原子核由质子和电子组成 B.煤、天然气、石油等属于不可再生能源 C.电磁波的传播需要介质 D.波长越长的电磁波,频率越高  ymerej1年前1
ymerej1年前1 -
 zxb1202 共回答了13个问题
zxb1202 共回答了13个问题 |采纳率84.6%A、原子核由质子和中子组成,集中了原子的大部分质量及全部正电荷,故A错误;
B、煤、天然气、石油等能源被人开发利用后,在相当长的时间内不能再生,故为不可再生能源;故B正确;
C、电磁波的传播不需要介质,可以在真空中传播,故C错误
D、由C=λf得:波长越长的电磁波,频率越低,故D错误.
故选B.1年前查看全部
- 分子、原子、原子核、电子、质子、中子、夸克,按从小到大排列的正确的是( )
分子、原子、原子核、电子、质子、中子、夸克,按从小到大排列的正确的是( )
A. 分子、原子、原子核、质子、夸克
B. 原子核、原子、中子、质子、分子
C. 夸克、质子、原子核、原子、分子
D. 夸克、中子、原子、原子核、分子 猫鱼catfish1年前1
猫鱼catfish1年前1 -
 Fan_Wei 共回答了23个问题
Fan_Wei 共回答了23个问题 |采纳率100%解题思路:物体由物质组成的,物质由分子组成的;分子由原子组成,原子由位于中心的原子核和核外电子组成;原子核由质子和中子组成,质子由夸克组成.根据质量的大小,微粒由小到大依次为:夸克、质子、原子核、原子、分子.
故选C.点评:
本题考点: 物理常识.
考点点评: 此题考查分子、原子等微粒的质量大小及组成关系,属基本的物理常识.1年前查看全部
- 在“分子、原子、原子核、质子、中子、电子”等粒子中,找出符合下列条件的粒子:
在“分子、原子、原子核、质子、中子、电子”等粒子中,找出符合下列条件的粒子:
质量和氢原子质量相等的是_______,质量最小的是__________.
2、一个水分子由2个氢原子和1个氧原子构成,氧原子有8个质子,氢原子的构成最简单.那么1个水分子种的之子总数为:
A、1 B、3 C、8 D、10 miss_fantastic1年前1
miss_fantastic1年前1 -
 zjbjzhc 共回答了27个问题
zjbjzhc 共回答了27个问题 |采纳率92.6%1.第1个空有2个答案 ( 质子,中子); 因为质子质量等于中子的质量
第2个空:(电子)
2.( D )
氧原子8个+2个氢原子=10个1年前查看全部
- 卢瑟福通过如图所示的实验装置发现了质子.
卢瑟福通过如图所示的实验装置发现了质子.
(1)卢瑟福用α粒子轰击______核,第一次实现了原子核的______.
(2)关于该实验,下列说法中正确的是______
A.通过显微镜来观察荧光屏上α粒子所产生的闪光
B.银箔可以吸收产生的新粒子
C.实验必须在真空、密封容器内进行
D.测出新产生的粒子的质量和电量,明确这就是氢原子核.
 longlongago1231年前1
longlongago1231年前1 -
 hgjhgkjh 共回答了22个问题
hgjhgkjh 共回答了22个问题 |采纳率95.5%(1)卢瑟福用α粒子轰击氮核发现质子,并首次实现原子核的人工转变
(2)卢瑟福第一次完成了原子核的人工转变并发现了质子,实验装置中银箔的作用是刚好阻挡α粒子打到荧光屏,但是不能阻挡其它粒子的穿过,这样可判断是否有新的粒子产生试验中根据质量数和电荷数守恒,明确了新产生的粒子就是氢原子核.故ABC错,D正确.
故选D
故答案为:(1)氮,人工转变;(2)D1年前查看全部
- (2013•大理州模拟)日本福岛核泄漏危机发生后,福岛土壤首现剧毒放射性钚元素.原子序数为94的钚元素的一种原子中,质子
(2013•大理州模拟)日本福岛核泄漏危机发生后,福岛土壤首现剧毒放射性钚元素.原子序数为94的钚元素的一种原子中,质子数和中子数之和为239,下列关于该原子的说法不正确的是( )
A.中子数为145
B.核电荷数为239
C.质子数为94
D.核外电子数为94 深圳之无名小子1年前1
深圳之无名小子1年前1 -
 地理老师的耳朵 共回答了24个问题
地理老师的耳朵 共回答了24个问题 |采纳率91.7%解题思路:根据在原子中,原子序数=质子数=核电荷数=核外电子数,结合质子数加中子数的数值进行解答;A、在原子中质子数=核电荷数=核外电子数=原子序数,钚的原子序数为94,则其质子数为94,质子数+中子数=239,则其中子数为239-94=145,所以正确.
B、在原子中质子数=核电荷数=核外电子数=原子序数,钚的原子序数为94,则其核电荷数为94,所以错误.
C、在原子中质子数=核电荷数=核外电子数=原子序数,钚的原子序数为94,则其质子数为94,所以正确.
D、在原子中质子数=核电荷数=核外电子数=原子序数,钚的原子序数为94,则其核外电子数为94,所以正确.
故选B.点评:
本题考点: 原子的有关数量计算.
考点点评: 此题是对原子内部微粒的考查,解题的关键是利用了原子中:①原子序数等于质子数等于核电荷数等于核外电子数②相对原子质量等于质子数加中子数,进行解答问题1年前查看全部
- 相距8cm的两块平行金属板间有2400V的电势差,从负极板静止释放一个电子, 同时从正极板静止释放一个质子.
相距8cm的两块平行金属板间有2400V的电势差,从负极板静止释放一个电子, 同时从正极板静止释放一个质子.
在相距为8cm的两块平行金属板间有2400V的电势差,从负极板静止释放一个电子,与此同时从正极板静止释放一个质子.
(1)它们会在离正极板多远处相遇而过?
(2)当它们抵达对面极板时,速度之比是多少?
(3)当它们抵达对面极板时,动能之比是多少? 新光饰品虞美人1年前1
新光饰品虞美人1年前1 -
 尘扬_yy 共回答了21个问题
尘扬_yy 共回答了21个问题 |采纳率85.7%题目很简单,数据很恶心,我排下公式吧
E=U/d=2400/0.08=30000v/m
F=EQ=30000N
a电=F/m电
a质=F/m质
(a电+a质)T1^2/2=0.08m
a电T2^2/2=0.08m
a质T3^2/2=0.08m
a电a质m电m质分别是电子质子加速度和质量
T1 T2 T3分别是相遇时间,电子全程时间,质子全程时间
1. S1=a电T1^2/2
2. a电T2:a质T3
3. m电a电T2:m质a质T31年前查看全部
- 已知R2-离子与M+离子含有相同数目的电子,若m原子含有19个质子,则R原子的核电荷数为
 红花村1年前1
红花村1年前1 -
 青醒 共回答了24个问题
青醒 共回答了24个问题 |采纳率95.8%m原子中含有19个质子即m原子含有19个核外电子,则m+离子有19-1=18个电子
而R原子含有的电子则为18-2=16个电子.即为R原子的核电荷数1年前查看全部
- 在①分子 ②原子 ③质子 ④电子 ⑤离子 ⑥原子核 ⑦中子 ⑧元素中,选择合适的概念填空:
在①分子 ②原子 ③质子 ④电子 ⑤离子 ⑥原子核 ⑦中子 ⑧元素中,选择合适的概念填空:
(1)构成物质的基本粒子是______、______、______,______是化学变化中的最小微粒,它是由______和______构成的;
(2)元素的种类由______数决定;质量很小,可以忽略的粒子是______;原子的质量由______数和______数决定;
(3)钠原子和钠离子因具有相同的______数,故属于同种______;
(4)氯化钠是由钠______和氯______构成的;
(5)带电的基本粒子是______. 变冷的咖啡1年前1
变冷的咖啡1年前1 -
 大大富翁 共回答了17个问题
大大富翁 共回答了17个问题 |采纳率94.1%解题思路:(1)根据构成物质的微粒有分子、原子、离子以及原子的结构进行解答;
(2)根据元素的种类由质子数决定以及电子的质量很小进行解答;
(3)根据钠原子和钠离子因具有相同的质子数进行解答;
(4)根据氯化钠是由钠离子和氯离子构成进行解答;
(5)根据微粒的带电情况进行解答.(1)构成物质的微粒有分子、原子、离子;原子是化学变化中的最小微粒,它是由核外电子和原子核构成的;
(2)元素的种类由质子数决定,电子的质量很小,所以原子的质量由质子数和中子数决定;
(3)钠原子和钠离子因具有相同的质子数,故属于同种元素;
(4)氯化钠是由钠离子和氯离子构成;
(5)分子、原子、中子不带电,而质子和原子核带正电,电子带负电,离子也带有电荷.
故答案为:(1)分子;原子;离子;原子;原子核;核外电子;
(2)质子;电子;质子;中子;
(3)质子;元素;
(4)离子;离子;
(5)质子、电子、离子、原子核.点评:
本题考点: 分子、原子、离子、元素与物质之间的关系;原子的定义与构成;元素的概念.
考点点评: 本题难度不大,主要考查了构成物质的微观粒子方面的知识,掌握常见物质的粒子构成、原子的概念、构成等是正确解答本题的关键.1年前查看全部
- 电子的能量是哪来的?我知道是它与质子的吸引力维持着它的圆周运动,但是,它初始的能量是哪来的?
 LOVE-WIND1年前3
LOVE-WIND1年前3 -
 asialoveyt 共回答了20个问题
asialoveyt 共回答了20个问题 |采纳率95%初始的能量应该是电势能,因为质子周围的电场会驱使电子运动,而电子从无穷远处(实际上就是质子电场很弱的地方)进入质子附近的轨道,此过程电势能降低了,减少的电势能转变为动能.
如果是核反应产生的电子,其具有初始动能,来源于核反应产生的能量.
此外在原子的激发过程中,电子还可以吸收光子得到能量.1年前查看全部
- 在分子、原子、原子核、质子、中子、电子等粒子中,找出符合下列条件的粒子,并填在相应的横线上.
在分子、原子、原子核、质子、中子、电子等粒子中,找出符合下列条件的粒子,并填在相应的横线上.
⑴ 有些物质由()构成,如氧气等,有些物质则由()构成如铁等
⑵ 能保持氧气的化学性质的是氧(),能保持铁的化学性质的是铁()
⑶ 化学变化中最小的粒子是()
⑷ 带正电荷的是(),带负电荷的是(),不显电性的是()
⑸ 质量与一个氢原子质量约相等的是()
⑹ 在同一个原子中数目一定相等的是() 醉亦醒1年前4
醉亦醒1年前4 -
 wishmerill 共回答了14个问题
wishmerill 共回答了14个问题 |采纳率92.9%1、 有些物质由(分子)构成,如氧气等,
有些物质则由(原子)构成如铁等
2、 能保持氧气的化学性质的是氧(分子),
能保持铁的化学性质的是铁(原子)
3、 化学变化中最小的粒子是(原子)
4、 带正电荷的是(质子、原子核),
带负电荷的是(电子),
不显电性的是(原子、分子、中子).
5、 质量与一个氢原子质量约相等的是(质子)
6、 在同一个原子中数目一定相等的是(质子与电子)1年前查看全部
- 在分子,原子,质子,中子,电子,原子核中 能直接构成物质微粒; 能保持物质化学性质;
 不可能不爱你1年前1
不可能不爱你1年前1 -
 c122039 共回答了23个问题
c122039 共回答了23个问题 |采纳率95.7%分子,原子能直接构成物质,离子也行
分子,原子能保持物质的化学性质,后面的不行,因为原子是保持物质化学性质的最小粒子1年前查看全部
- 下列有关化学用语表示正确的是 A. 的结构示意图: B.原子核内有10个中子,8个质子的原子: C. 离子的电离方程式:
下列有关化学用语表示正确的是
A.  的结构示意图:
的结构示意图:
B.原子核内有10个中子,8个质子的原子: 
C. 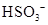 离子的电离方程式:
离子的电离方程式:
D.2g  在25℃ 101kpa下燃烧,生成液态的水放出285.8
在25℃ 101kpa下燃烧,生成液态的水放出285.8 U的热量,则该反应的热化学方程式为:
U的热量,则该反应的热化学方程式为:
 yoyoyan_198301061年前1
yoyoyan_198301061年前1 -
 gtdx 共回答了15个问题
gtdx 共回答了15个问题 |采纳率86.7%1年前查看全部
- 氧的同位素18 8 O的质子数是多少?
 联翩1年前1
联翩1年前1 -
 13518090127 共回答了15个问题
13518090127 共回答了15个问题 |采纳率100%氧元素有三种不同的同位素,但它的质子数是不会变的,就是8,标在元素的左下标,左上标的18是它的质量数,也就是说它的中子数为10.1年前查看全部
- 某离子核外有18个电子是不是意思是某离子有18个质子,核电荷数为18
 永远的菊树1年前3
永远的菊树1年前3 -
 shinesand 共回答了18个问题
shinesand 共回答了18个问题 |采纳率88.9%离子,可以得电子,也可以失去电子.质子数 = 电子数 + 价态
质子数 = 核电荷数
原子的质子数等于电子数,离子的就不相等了.
例如
Cl- 电子数18,价态 -1,质子数 17
S2- 18 -2 16
K+ 18 +1 19
Ca2+ 18 +2 201年前查看全部
- 一些中子和质子结合在一起(原子核)为何要放出能量?
一些中子和质子结合在一起(原子核)为何要放出能量?
那为什么有些原子核(也是一堆质子中子)有足够能量靠近后不做功放出能量?
三楼答者,我再问一步,为啥有质量亏损
如果是因为强相互作用使核子放出能量,那如果有两个在铁后的原子核,让它们靠近为啥不放出能量?(强相互作用哪去了?) 千叶百合子1年前4
千叶百合子1年前4 -
 haojie83 共回答了19个问题
haojie83 共回答了19个问题 |采纳率89.5%用经典的图像来看:结合在一起后强相互作用做功,其势能转化为核的动能,然后通过辐射(放出光子)或者与其他粒子碰撞放出能量,使得核稳定存在.
用量子图像来看:结合在一起后强相互作用做功,使得核处于激发态(不是最稳定的),然后然后通过辐射(放出光子)或者与其他粒子碰撞放出能量跃迁到基态,根据质能关系从而有质量亏损.
关于问题补充:从因果关系来说应该是因为直接合成的核不稳定的激发态,需要放出能量,从而有质量亏损.
当然我们也可以反过来通过质量亏损来计算所放出的能量.
除了强相互作用外,还有电磁相互作用.而核都带正电,所以把核靠近是要提供相当大的能量来实现的.只有强相互作用放出的能量大于需要的能量才有实用价值,比如在实验室也可以实现让铁核与其他核融合形成金子,真正的点石成金,不过估计会入不敷出:).而铁核估计就是能量收支平衡点.具体还是那句话,需要强相互作用理论计算.这个就不是我所了解的了.btw,把质子结合到一起同样要先提供能量抵抗电场斥力再放出能量,比如氢弹.1年前查看全部
- A、B、C三种元素的原子核里都有几个质子,中子数分别为n-1,n,n+1,下列说法正确的是( )(说理由)
A、B、C三种元素的原子核里都有几个质子,中子数分别为n-1,n,n+1,下列说法正确的是( )(说理由)
A、它们属于同种元素
B、它们是同一种原子
C、它们是不同元素的微粒
D、它们是不同种分子 joogger1年前1
joogger1年前1 -
 sevening 共回答了15个问题
sevening 共回答了15个问题 |采纳率100%应该是都有一样的质子数吧?
首先质子数相同就表示他们是同一种元素的原子,元素的分类就是按原子核里的质子数分,A是对的
B不对,同一种原子必须质子数和中子数一样
C,不对,他们是同一元素的微粒
D,这个,错的啦……
所以选A1年前查看全部
- 氢核(质子)与电子所带的电荷量相同?书上说相同,不是符号不同吗?
 ctl1472583691年前2
ctl1472583691年前2 -
 轻烟着色 共回答了20个问题
轻烟着色 共回答了20个问题 |采纳率100%电荷量都是一,但是符号不同,电荷量只是指带电的数量而没有正电荷负电荷之分1年前查看全部
- 氦原子核和质子带电量和质量之比分别是多少?
氦原子核和质子带电量和质量之比分别是多少?
是1:1和2:1么? lo5341年前2
lo5341年前2 -
 zaiqi 共回答了18个问题
zaiqi 共回答了18个问题 |采纳率88.9%氦原和和质子带电量:2::1
质量比:4:11年前查看全部
- 原来静止的质子和a粒子(氦核),要使加速后速度大小相等,求加速电压比应为多少
 不披羊皮了1年前2
不披羊皮了1年前2 -
 caigua 共回答了17个问题
caigua 共回答了17个问题 |采纳率94.1%电场力做功,动能增加
qU=(1/2)m*V²
U=(1/2)m*V²/q
U1/U2=(m1/m2)*(q2/q1)=(1/4)*(2/1)=1/21年前查看全部
- 有关物质的量计算的问题已知Mg元素的核内中子数为12,求47.5克的MgCl2中所含质子的物质的量是多少?就是不知道“所
有关物质的量计算的问题
已知Mg元素的核内中子数为12,求47.5克的MgCl2中所含质子的物质的量是多少?
就是不知道“所含质子的物质的量”是什么意思,然后就无从下手了.
请附上分析、计算过程, 疯了20081年前3
疯了20081年前3 -
 SnowChen11 共回答了24个问题
SnowChen11 共回答了24个问题 |采纳率87.5%Cl的质子数为17
Mg的质子数为12
Cl的相对原子质量为35.5
Mg的相对原子质量为12+12=24
47.5克的MgCl2的物质的量为47.5/(24+35.5+35.5)
47.5克的MgCl2中所含质子的物质的量=47.5克的MgCl2的物质的量*(12+17+17)
只有分析,没有答案.嘿嘿1年前查看全部
- 写出下列溶液的质子条件 c1(mol/l)NaoH+c2(mol/l)H3B
写出下列溶液的质子条件 c1(mol/l)NaoH+c2(mol/l)H3B
写出下列溶液的质子条件
c1(mol/l)NaoH+c2(mol/l)H3BO3 duannor1年前1
duannor1年前1 -
 云上太阳7024 共回答了27个问题
云上太阳7024 共回答了27个问题 |采纳率88.9%解析:
c1(mol/l)NaOH,氢氧化钠溶液存在下列平衡
(OH)- + (H)+ = H2O(=表示可逆符号)
因为NaOH溶于水电力出氢氧根,显碱性,所以抑制水的电离
又因为室温下[H+][OH-]=10^-14
即pH + pOH = 14
由水电离出的[OH-]相对于氢氧化钠提供的[OH-],可忽略不计,
所以溶液中的[H+]只可能由水的电离提供,即[H+] = 10^-14 / [OH-]
c2(mol/l)H3BO3,硼酸溶液存在下列平衡
H3BO3 + H2O = B(OH)4- + (H)+ (=表示可逆符号)
硼酸中B原子最外层只有6个与O原子共用的电子,不满足最外层8电子稳定结构,急需得到一个OH-配位而形成最外层8电子稳定结构
而又因为室温下[H+][OH-]=10^-14
即pH + pOH = 14
由水电离出的[H+]相对于硼酸电离提供的[H+],可忽略不计,
所以溶液中的[OH-]只可能由水的电离提供,即[H+] = 10^-14 / [OH-]1年前查看全部
- 已知一种碳原子(含6个质子和6个中子的碳原子)的质量是1.993×10-26KG,若镁的相对原子质量是24.035,那么
已知一种碳原子(含6个质子和6个中子的碳原子)的质量是1.993×10-26KG,若镁的相对原子质量是24.035,那么
已知一种碳原子(含6个质子和6个中子的碳原子)的质量是1.993×10-26KG,若镁的相对原子质量是24.035,那么一个镁原子的实际质量为多少? yp199005161年前3
yp199005161年前3 -
 wendy100 共回答了15个问题
wendy100 共回答了15个问题 |采纳率86.7%此C的相对原子数是12
m=1.993×10-26KG
12/1.993×10-26KG=24.035/m(Mg)
m=3.986×10-26KG1年前查看全部
- 铜-63的中子数、质子数、核电荷数?
铜-63的中子数、质子数、核电荷数?
貌似我这个练习题上的一个答案是:中子数是29诶? VIIdays1年前1
VIIdays1年前1 -
 背着蛋壳 共回答了18个问题
背着蛋壳 共回答了18个问题 |采纳率100%质子数是29,中子数是63-29=34,核电荷数是291年前查看全部
- 有几个化学题1 科学家发现一种新元素,它的原子核内有111个质子161个中子则该元素原子核外电子数是2 空气中含量最多的
有几个化学题
1 科学家发现一种新元素,它的原子核内有111个质子161个中子则该元素原子核外电子数是
2 空气中含量最多的元素 用元素符号表示
3 人体中含量最多的元素 用元素符号表示
4 地壳中含量最多的元素
5 计算硝酸铵中各元素的质量比 湘非州1年前5
湘非州1年前5 -
 hrjyz 共回答了25个问题
hrjyz 共回答了25个问题 |采纳率92%1、核外电子数=质子数=111
2、空气中含量最多的是氮元素,元素符号 N
3、人体中含量最多的是氧元素,元素符号 O
4、地壳中含量最多的是氧元素,元素符号 O
5、硝酸铵化学式:NH4NO3
氮元素:氧元素:氢元素=14×2:16×3:1×4=7:12:11年前查看全部
- 帮忙写一下Na2CO3,NaHCO3,Na3PO4,AlCl3水溶液的电荷守恒,原子守恒,和质子守恒的式子
 辣子鱼儿1年前0
辣子鱼儿1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 各元素的质子数和原子数比如:元素(质子数,原子数)H(1,0)He(2.2)Li(3,4)C(6,6)N(7,7)...
各元素的质子数和原子数
比如:元素(质子数,原子数)
H(1,0)
He(2.2)
Li(3,4)
C(6,6)
N(7,7)
.
.
.
.
.
.
越多越好, djf25227771年前4
djf25227771年前4 -
 日aa人不长命 共回答了16个问题
日aa人不长命 共回答了16个问题 |采纳率100%应该是中子数吧?
相对原子质量(取整数)=质子数+中子数
相对原子质量书后附表中有
质子数在元素周期表中查.
所以几乎所有的常见原子都可以估算出来了1年前查看全部
- 原子核外的电子轨道中通常有2个电子,也就是说原子核中至少2个质子,有小于2个存在吗?举个例子?
原子核外的电子轨道中通常有2个电子,也就是说原子核中至少2个质子,有小于2个存在吗?举个例子?
写错了。是最内层的轨道上通常有两个电子 维有顶你1年前3
维有顶你1年前3 -
 dengchen971127 共回答了19个问题
dengchen971127 共回答了19个问题 |采纳率94.7%氢能算一个吧!不过电子数大于2的,原子核内质子数也应该与其相等!否则就不平衡了!也就不稳定了!1年前查看全部
- HCN溶液中质子守恒是的等式怎么样的?
 wz52146871年前3
wz52146871年前3 -
 AA11BB22CC33 共回答了19个问题
AA11BB22CC33 共回答了19个问题 |采纳率89.5%HCN在水溶液中电离的方程式为:HCN = H+ + CN-(部分电离;可逆号);
CN-在水溶液中水解的方程式为:CN- + H2O = HCN + OH-(部分水解;可逆号);
所以HCN溶液的质子守恒等式为:C(H+)=C(CN-)+C(OH-).1年前查看全部
- 原子的种类是由质子数决定的,但氕氘氚质子数相同但不是同种原子啊
 山道年ee1年前2
山道年ee1年前2 -
 旭鸿wolf 共回答了20个问题
旭鸿wolf 共回答了20个问题 |采纳率70%质子数决定了原子核的电荷数,也就决定了这个原子的化学性质.
氕氘氚质子数相同,所以化学性质相同,都是氢原子,但是原子的质量大不相同,叫做同位素.
所以严格来说氕氘氚不是同种原子,但是从化学性质的角度来说,是同种原子,看怎么理解“同种原子”这四个字了.1年前查看全部
- 高一化学必修一第一章怎么计算5克的CH4的电子数,质子数,分子数,原子数.
 -evenline-1年前1
-evenline-1年前1 -
 ss男爵 共回答了14个问题
ss男爵 共回答了14个问题 |采纳率85.7%CH4的相对分子质量为16 5gCH4的物质的量为 n=m/M=5/16=0.3125mol CH4的总电子数为 6+1*4=10(电子数和质子数=序号数) 所以电子数为 0.3125*10=3.125mol 质子数和电子数一样 0.3125*10=3.125MOL 分子数 一个CH4就是一个CH4分子 所以分子数=物质的量 为0.3125mol 原子数 一个CH4有1个C原子和4个H 总有5个原子 所以原子数为 0.3125*5=1.5625mol1年前查看全部
- α粒子散射实验结果能不能表明原子核由带正电的质子和不带电的中子组成?
 xiaoding20031年前1
xiaoding20031年前1 -
 edisonrei13 共回答了16个问题
edisonrei13 共回答了16个问题 |采纳率100%因为α粒子散射后,有小部分被反射了,所以可以证明原子中有一个质量很大、体积很小的带正电的粒子(即质子).就命名为原子核.中子是不带电的,后面知道的,但不能证明.1年前查看全部
- 有A、B、C、D四种粒子,A整体不带电,原子核内只有一个质子;B带有两个单位正电荷的离子核外有两个电子层,其原子的第二层
有A、B、C、D四种粒子,A整体不带电,原子核内只有一个质子;B带有两个单位正电荷的离子核外有两个电子层,其原子的第二层电子数为第一层电子数的四倍;C带有一个负电荷的离子比B的离子多8个电子;D∧-离子具有与氩原子相同的核外电子排布.
(1)A、B、C、D的名称;
(2)A的原子中有一个中子,它的相对原子质量为______;
(3)B的相对原子质量为24,其中子数为______. kkvvcccc1年前0
kkvvcccc1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 二氧化硫硫是正四价是不是意味着共用电子对偏向氧可硫的质子不是多于氧么为什么共用电子对不偏向硫
二氧化硫硫是正四价是不是意味着共用电子对偏向氧可硫的质子不是多于氧么为什么共用电子对不偏向硫
从而使硫变成负四价呢? 贝以蒙1年前2
贝以蒙1年前2 -
 youranzi 共回答了18个问题
youranzi 共回答了18个问题 |采纳率88.9%你不能就考虑质子数的.
硫原子和氧原子相比:
1、原子核质子数增加,原子核所带正电荷总数增加,有对核外电子引力增强从而使原子半径减小的趋势;
2、核外电子总数和电子层数也增加,电子和电子相互排斥,内层电子会将外层电子往外推,有对最外层电子引力减小从而使原子半径增大的趋势.
两种因素中后者占主导因素.所以硫原子核对最外层电子引力要比氧原子核对最外层电子引力小,得电子能力弱,共用电子对时电子对偏离硫原子,偏向氧原子.1年前查看全部
- Na2CO3溶液的质子守恒,C(OH-)水=C(H+) +C(HCO3-) +2C(H2CO3) ,这里的C(H+)是什
Na2CO3溶液的质子守恒,C(OH-)水=C(H+) +C(HCO3-) +2C(H2CO3) ,这里的C(H+)是什么?
由水电离出的H+ =OH-,可得 C( H+)水=C(H+) +C(HCO3-) +2C(H2CO3),如果C(H+)是溶液里面的总的氢离子浓度,那岂不是水电离出的氢离子浓度还大于溶液里面的总的氢离子浓度? 小小的穷人1年前1
小小的穷人1年前1 -
 milk_milk_milk 共回答了16个问题
milk_milk_milk 共回答了16个问题 |采纳率87.5%水电离出的c(H+)=c(OH-) H2O=OH- +H+
碳酸钠水溶液中 水电离出 的氢离子有3种去处
一种保持原样就是H+形态,
一种是与CO32-结合成HCO3- 结合比例1:1
就是1个碳酸氢根离子中有1个水电离出的氢离子
一种是与CO32-结合成H2CO3 结合比例2:1
就是1个碳酸分子中有2个水电离出的氢离子
这样c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
H2O=OH- +H+
1 1 1
水的电离和其他物质的电离是完全一样的机理和性质,
要分清楚纯水,和溶液中的水的电离,
溶液中因为溶质电离或水解出的H+或者OH-会影响溶液中水的电离,使其平衡发生移动
但溶液的离子积和纯水的离子积是相同的Kw (OH-)x(H+)=10-14,
水电离出的OH-与H+按其电离方程都是1:1
比方NaOH溶液,OH-完全电离出,
溶液中的OH-加大 H2O=OH- +H+ 逆向进行.
溶液的离子积和纯水的离子积是相同的Kw不变
(OH-)x(H+)=10-14 OH-加大 水电离出的H+ 一定变小
H2O=OH- +H+ ,OH-与H+按其电离方程都是1:1
这样水电离出的OH-变小但依然等于H+
定量说1升 NaOH浓度1molL-
溶液中OH-完全电离,浓度为1molL-
Kw=(OH-)(H+)=10-14
那么溶液中的H+的浓度等于10-14,这就是水电离出的H+浓度
H2O = OH- + H+
1 1 1
10-14 10-14 10-14
这样水电离出的OH- = H+ =10-14
你说的问题在于溶液中的OH- 和 H+ 与水电离的OH- H+ 是相关的但完全不同的数值.1年前查看全部
- 某+2价金属元素的氯化物汇中含氯64%,又知其原子核内质子数等于中子数,求该金属元素的相对原子质量及其氯化物的化学式
 羊咩咩20031年前1
羊咩咩20031年前1 -
 消失的鼠子 共回答了18个问题
消失的鼠子 共回答了18个问题 |采纳率83.3%M/71=36/64 解M=40 20号元素-CaCl21年前查看全部
- 硫酸铜的电荷,物料,质子守恒式
 永远的夏天1年前1
永远的夏天1年前1 -
 夕109 共回答了19个问题
夕109 共回答了19个问题 |采纳率94.7%一、物料守恒(微粒数守恒):1、纯碱溶液 C(Na+)=2C(CO32-)+2C(HCO3-)+2C(H2CO3) 2、NaH2PO4溶液 C(Na+)=C(H2PO4-)+C(HPO42-)+C(PO43-)+C(H3PO4) 二、电荷守恒:1、纯碱溶液 C(Na+)+C(H+)=2C(CO32-)+C(HCO3-)+C(OH-) 2、NaH2PO4溶液 C(Na+)+C(H+)=C(H2PO4-)+2C(HPO42-)+3C(PO43-)+C(OH-) 三、质子守恒(水电离离子数平衡,电解质溶液中水电离产生的H+和OH-的数目始终相等):1、纯碱溶液 C(OH-)=C(H+)+C(HCO3-)+2C(H2CO3) 2、Na3PO4溶液 C(OH-)=C(H+)+C(HPO42-)+2C(H2PO4-)+C(H3PO4) 常见的有很多,上面就你的每个问题举了两例,希望对你的学习有所帮助,1年前查看全部
- 分子,原子,粒子,质子,量子...还有什么"...子"?并按体积从大到小的顺序排列.
 龙城小一1年前2
龙城小一1年前2 -
 byebyebirdie 共回答了11个问题
byebyebirdie 共回答了11个问题 |采纳率100%分子是由两个或多个原子构成;原子含有原子核,核内有质子与中子,质子带正电位,中子不带电,中子与质子大小相同,中子与质子数目相等或略有差异,核外有电子围绕原子核做不规则圆周运动的微粒,带负电位,数目与质子数相等.
离子:当一个原子得到或失去电子时称为离子,得到电子的原子称为负离子,失去电子的为正离子.
量子:在微观领域中,某些物理量的变化是以最小的单位跳跃式进行的,而不是连续的,这个最小的单位叫做量子 也是对对原子、电子、光子等物质基本单元的统称.
分子、原子、质子、中子、电子、量子、离子都是粒子.
排序:分子>原子>负离子>正离子>质子=中子>电子1年前查看全部
- 各种粒子与质子的关系例如,氚核的质量是质子的三倍,电荷量为一个元电荷.a粒子即氦原子核,质量约为质子的四倍,带正电荷,电
各种粒子与质子的关系
例如,氚核的质量是质子的三倍,电荷量为一个元电荷.a粒子即氦原子核,质量约为质子的四倍,带正电荷,电荷量是元电荷的两倍.那么氕,氘,氚,电子,氢核的类似关系是什么呢? fdgsht1年前1
fdgsht1年前1 -
 xujiake 共回答了17个问题
xujiake 共回答了17个问题 |采纳率94.1%氕核就是质子,带一个元电荷;
氘核是由一个质子加一个中子组成,由于只含有一个质子,而中子又是不带电的,所以氘核也是带一个元电荷;
氚核是由一个质子加两个中子组成,带一个元电荷,氚核具有贝塔衰变性.1年前查看全部
- 1molNa+中共有几个质子,几摩尔电子?
 qingtao9991年前11
qingtao9991年前11 -
 zht5353710 共回答了19个问题
zht5353710 共回答了19个问题 |采纳率94.7%1个 Na+ 中共有11个质子,10个电子
所以
1mol Na+中共有11*6.02*10^23个质子,10mol 电子1年前查看全部
- 试说明分子原子原子核质子中子电子正离子负离子
试说明分子原子原子核质子中子电子正离子负离子
其中哪几种带电粒子能参与导电形成电流?它们的运动方向和规定的电流方向有什么关系? F12TT1年前2
F12TT1年前2 -
 杨敏君 共回答了18个问题
杨敏君 共回答了18个问题 |采纳率94.4%1、通常所说的导线中的电流是由电子参与形成的.其方向与电子运动方向相反.
2、阴阳离子也可以形成电流,不过这主要发生在电池中.在电池中阴阳离子在正负极之间发生对流,电流方向为阳离子的流向,也是阴离子流动方向的相反方向.
3、若用电解液导电,则电流流向同2中情况.1年前查看全部
- 一个质子的相对质量是1,那么质子的相对质量的数值就等于质子个数的数值.对不对?
 嘬了一大口1年前1
嘬了一大口1年前1 -
 漂泊的鱼zz 共回答了15个问题
漂泊的鱼zz 共回答了15个问题 |采纳率86.7%是对的
有的时候注意一下中子的质量1年前查看全部
- D形盒半径R、磁感应强度B不变,若加速电压U越高,质子的在加速器中的运动时间将越短
D形盒半径R、磁感应强度B不变,若加速电压U越高,质子的在加速器中的运动时间将越短
这句话对,那周期变短对吗? 樱雨泽子的大xx1年前0
樱雨泽子的大xx1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
大家在问
- 1英语动词填空1.–You speak very good Chinese.–Thank you.It’s not sur
- 2弓形的面积问题如图:已知圆半径为20 弦长30 求阴影部分面积
- 3翻译:Experts say they can protect themselves by putting the ca
- 4某地区的手机收费标准有两种方式,用户可任选其一:
- 58.002t=()t()kg8.002吨=()吨()千克
- 6七年级下语文《狼》在文章结尾卒章显志,这样写有什么好处
- 7小学四年级数学题目王老师到体育用品商店为学校买球,他计算了一下,买5个足球和3个篮球要付244元,而买4个足球和6的篮球
- 8一个草字头一个今怎么念?一个草字头,下面一个“今”,怎么念?
- 9英语翻译wrapped up in this phrase is the thought you are your pr
- 10she is a good student.改为复数形式怎么改
- 11设计一道有理数混合运算的计算题,使其满足下述四个条件.
- 12棋子若干颗,恰好可以排成五层的实心方正,求一共有多少棋子?
- 13如下图所示U形管中间被一种允许水分子通过而单糖、二糖不能透过的半透膜隔开,现在两侧分别加入0.1mol/L的蔗糖溶液和麦
- 14考研概率论的一个小问题.F1(x)=1-F(-x)为何不是分布函数?
- 15(2口口4•江苏)植物学家在培育抗虫棉时,对目t基因作了适当t修饰,使得目t基因在棉花植株t整个生长发育期都表达,以防止






