4Cr13比3Cr13的含碳量高,故4Cr13钢的耐腐蚀性好.对还是错啊?
 变身南瓜饼2022-10-04 11:39:541条回答
变身南瓜饼2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 hmlyy 共回答了16个问题
hmlyy 共回答了16个问题 |采纳率93.8%- 错.
含碳量高不等于耐腐蚀性好. - 1年前
相关推荐
- Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.某化学兴趣小组的同学为了测定某黄铜的组成,取20
Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于下表:
试回答下列问题:加入稀硫酸的质量(g) 充分反应后剩余固体的质量(g) 第1次 20 17.4 第2次 20 14.8 第3次 20 12.2 第4次 20 12.0 第5次 20 m
(1)网上述表格中m的值为 ___ ;
(2)黄铜样品中锌的质量分数为 ___ ;
(3)所用稀硫酸中硫酸的质量分数是多少?
 紅云1年前1
紅云1年前1 -
 可我 共回答了15个问题
可我 共回答了15个问题 |采纳率73.3%解题思路:(1)分析反应及实验数据:根据金属活动性,合金中只有锌可以与硫酸反应;根据质量守恒定律,由第1次实验数据可知,每加入20g稀硫酸完全反应可放出20g-17.4g=2.6g,据此分析,第4次加入20g稀硫酸时放出氢气质量12.2g-12.0g=0.2g<2.6g,可判断此时合金中金属锌已完全反应,所以,第5次加入的稀硫酸不再放出氢气;
(2)使用金属锌完全反应时剩余固体铜的质量,计算样品中金属锌的质量,利用锌的质量与样品的质量比计算黄铜样品中锌的质量分数;
(3)使用第1次实验数据,由生成氢气的质量,根据反应的化学方程式,计算参加反应硫酸的质量,利用硫酸的质量与所加稀硫酸的质量比计算所用稀硫酸中硫酸的质量分数.(1)根据质量守恒定律,由第1次实验数据可知,每加入20g稀硫酸完全反应消耗锌20g-17.4g=2.6g,据此分析,第4次加入20g稀硫酸时小寒心质量12.2g-12.0g=0.2g<2.6g,可判断此时合金中金属锌已完全反应,所以,第5次加入的稀硫酸不再消耗金属而不再放出氢气,因此充分反应后剩余固体的质量仍为12g;
故答案为:12.0(或12);
(2)黄铜样品中锌的质量分数=[20g-12g/20g]×100%=40%;
故答案为:40%;
(3)设所用稀硫酸中硫酸的质量分数为x,据题意得:
H2SO4 +Zn═ZnSO4+H2↑(1分)
98 65
20g×x 20g-17.4g=2.6g
[98/20g×x]=[65/2.6g] x=19.6%
答:所用稀硫酸中溶质的质量分数为19.6%.(合理解法均给分)点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 计算所用稀硫酸的溶质质量分数时,注意选取稀硫酸完全反应时的实验数据即前三次实验的数据进行计算.1年前查看全部
- 不锈钢耐腐蚀性能标准304和409不锈钢有没有耐腐蚀性标准,到底要盐雾实验多久生锈算合格,还是说不能有红锈?材料厂会不会
不锈钢耐腐蚀性能标准
304和409不锈钢有没有耐腐蚀性标准,到底要盐雾实验多久生锈算合格,还是说不能有红锈?
材料厂会不会有各种材料的盐雾实验测试报告书?能说明一种材料能耐腐蚀多久?
304盐雾实验多久无红绣? 俏皮小幽灵1年前1
俏皮小幽灵1年前1 -
 我是朵猫猫 共回答了25个问题
我是朵猫猫 共回答了25个问题 |采纳率88%具体到材料牌号对某种腐蚀性介质或工况的耐腐蚀性,应该不会有国家或行业标准进行规定.有的只是对腐蚀性试验方法进行规定的标准.
通常的方法是查相关行业的耐腐蚀手册.1年前查看全部
- 请问不锈钢和铝合金哪个抗氧化,耐腐蚀性强.
 雪凝沧海1年前1
雪凝沧海1年前1 -
 礼貌后 共回答了17个问题
礼貌后 共回答了17个问题 |采纳率94.1%铝的活性强,因此很容易被氧化,产生钝化层!所以它的抗氧化性强!
很多介质里面没有氧的存在,所以铝没法产生钝化,因此不锈钢的耐腐蚀性强!1年前查看全部
- Cu与Zn 称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.某化学兴趣小组的同学为了测定某黄铜的组成,
Cu与Zn 称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.某化学兴趣小组的同学为了测定某黄铜的组成,取40g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于下表:
试回答下列问题:加入稀硫酸的质量(g) 充分反应后剩余固体的质量(g) 第1次 40 34.8 第2次 40 29.6 第3次 40 24.4 第4次 40 24.0 第5次 40 m
(1)上述表格中m的值为______,
(2)黄铜样品中锌的质量分数是多少? 圆月S弯刀1年前1
圆月S弯刀1年前1 -
 huanj 共回答了14个问题
huanj 共回答了14个问题 |采纳率100%解题思路:(1)分析反应及实验数据:根据金属活动性,合金中只有锌可以与硫酸反应;根据质量守恒定律,由第1次实验数据可知,每加入40g稀硫酸完全反应可消耗金属的质量为:40g-34.8g=5.2g,据此分析,第4次加入40g稀硫酸时消耗金属的质量为24.4g-24.0g=0.4g<5.2g,可判断此时合金中金属锌已完全反应,所以,第5次加入的稀硫酸不再发生反应,故可以判断出m的值;
(2)使用金属锌完全反应时剩余固体铜的质量,计算样品中金属锌的质量,利用锌的质量与样品的质量比计算黄铜样品中锌的质量分数.(1)根据质量守恒定律,由第1次实验数据可知,每加入40g稀硫酸完全反应可消耗金属的质量为:40g-34.8g=5.2g,据此分析,第4次加入40g稀硫酸时消耗金属的质量为24.4g-24.0g=0.4g<5.2g,可判断此时合金中金属锌已完全反应,所以,第5次加入的稀硫酸不再发生反应,因此充分反应后剩余固体的质量仍为24.0g;
(2)黄铜样品中锌的质量分数=[40g−24g/40g]×100%=40%;
答:黄铜样品中锌的质量分数是40%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查合金中金属与酸的反应及合金中金属质量分数的计算等,学生应能利用表格进行数据分析和应用.1年前查看全部
- (2010•娄底)Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.某化学兴趣小组的同学为了测定某
(2010•娄底)Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于下表:
试回答下列问题:加入稀硫酸的质量(g) 充分反应后剩余固体的质量(g) 第1次 20 17.4 第2次 20 14.8 第3次 20 12.2 第4次 20 12.0 第5次 20 m
(1)网上述表格中m的值为______;
(2)黄铜样品中锌的质量分数为______;
(3)所用稀硫酸中硫酸的质量分数是多少? 树茂盛1年前1
树茂盛1年前1 -
 吴钩已断 共回答了16个问题
吴钩已断 共回答了16个问题 |采纳率87.5%(1)根据质量守恒定律,由第1次实验数据可知,每加入20g稀硫酸完全反应可放出20g-17.4g=2.6g,据此分析,第4次加入20g稀硫酸时放出氢气质量12.2g-12.0g=0.2g<2.6g,可判断此时合金中金属锌已完全反应,所以,第5次加入的稀硫酸不再消耗金属而不再放出氢气,因此充分反应后剩余固体的质量仍为12g;
故答案为:12.0(或12);
(2)黄铜样品中锌的质量分数=[20g−12g/20g]×100%=40%;
故答案为:40%;
(3)设所用稀硫酸中硫酸的质量分数为x,据题意得:
H2SO4 +Zn═ZnSO4+H2↑(1分)
98 65
20g×x 20g-17.4g=2.6g
[98/20g×x]=[65/2.6g] x=19.6%
答:所用稀硫酸中溶质的质量分数为19.6%.(合理解法均给分)1年前查看全部
- 橡胶这种密封层为什么可以承受巨大的压力,替物体抵挡高温环境,并且耐腐蚀性很强?
 三本太郎1年前2
三本太郎1年前2 -
 kuqam 共回答了15个问题
kuqam 共回答了15个问题 |采纳率93.3%因为橡胶是一种具有很好的柔韧性的材料,能够替元件承受一定的压力从而起到保护作用;因为橡胶是绝缘体 导热慢,所以橡胶可以替物体抵挡高温环境;包裹元件可以隔离开外界因素对金属器件的腐蚀,如空气和水便能腐蚀铁一样.因此会用到橡胶这样的材料.1年前查看全部
- 下列金属中,具有耐腐蚀性,受大气和海水影响很小的是 A.铜 B.锌 C.铝 D.钛
 dawenjie1年前3
dawenjie1年前3 -
 cherry349696246 共回答了19个问题
cherry349696246 共回答了19个问题 |采纳率89.5%锌和铝肯定不耐腐蚀的,因为本身就比较活泼.铜比较耐腐蚀,但是在海水作用下还是会慢慢氧化.只有钛耐腐蚀性最强,基本上不和一般酸类反映,也不受大气和海水影响1年前查看全部
- 为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.其反应原理如下:电
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.其反应原理如下:电池Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l),电解池2Al+3O2=Al2O3+3H2,对该电解过程,以下判断正确的是( )
电池 电解池 A H+移向Pb电极 H+移向Pb电极 B 每消耗3mol Pb 生成1mol Al2O3 C 正极:PbO2+4H++2e-=Pb2++2H2O 阳极:2Al+3H2O-6e-=Al2O3+6H+ D Pb电极反应质量不变 Pb电极反应质量不变
A.A
B.B
C.C
D.D 燕雀安知鸿鹄1年前1
燕雀安知鸿鹄1年前1 -
 djc83 共回答了24个问题
djc83 共回答了24个问题 |采纳率95.8%解题思路:A.原电池放电时,溶液中阳离子向正极移动;
B.串联电池中转移电子数相等;
C.原电池正极上生成硫酸铅;
D.原电池中铅电极上生成硫酸铅,电解池中阴极生成氢气.A.原电池中,溶液中氢离子向正极二氧化铅电极移动,故A错误;
B.串联电池中转移电子数相等,每消耗3molPb,根据电子守恒生成lmolAl2O3,故B正确;
C.原电池正极上二氧化铅得电子生成硫酸铅,则正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O,故C错误;
D.原电池中铅作负极,负极上铅失电子和硫酸根离子反应生成难溶性的硫酸铅,所以质量增加,在电解池中,Pb阴极,阴极上氢离子得电子生成氢气,所以铅电极质量不变,故D错误;
故选B.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池和电解池原理,根据电极上得失电子、离子放电顺序来分析解答即可,难度中等.1年前查看全部
- (2014•衡阳二模)“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度是判
(2014•衡阳二模)“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度是判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮镀锌层的厚度,设计了下面的实验方案.

(1)讨论:在铁皮表面镀锌是为了______.(填字母)
a 锌没有铁活泼,镀在铁的表面可防止生锈
b 锌比铁活泼,并且在空气中容易形成致密的氧化膜,防止生锈
(2)甲同学的方案是:如图1,将镀锌铁皮浸泡在盐酸中,先用盐酸将镀锌铁皮表面的锌反应掉,通过测量因产生气体而形成差量计算出锌的质量,然后再计算得到锌层的厚度.但是乙同学回顾起上课时老师演示的“用足量盐酸除铁锈”的实验现象,马上对甲同学的方案的可行性提出了***,乙同学的理由是______.
(3)乙同学查阅资料:zncl2、fecl2都能与naoh溶液反应,生成难溶于水zn(oh)2和
fe(oh)2,而zn(oh)2既可以溶于酸也可以溶于碱,fe(oh)2则只能溶于酸,于是设计了如图3方案:
步骤②中加入足量氢氧化钠的目的是______.
(4)丙同学设计通过测量镀锌铁皮与酸反应产生气体的体积来计算锌层的厚度,他设计了如图2所示装置.其中仪器a中盛放的是镀锌铁皮,仪器b中盛放的是稀硫酸.
①选择用稀硫酸而不用浓盐酸的原因是______.
②检查量气装置气密性:连接好装置,关闭弹簧夹,从量气管注水,若观察到______,说明该量气装置气密性良好.
③若分液漏斗上方不连接导管a,则测出气体体积会______(选填“偏小”、“偏大”或“没有影响”). 上帝的女人8881年前1
上帝的女人8881年前1 -
 leozhang85 共回答了18个问题
leozhang85 共回答了18个问题 |采纳率83.3%解题思路:(1)锌比铁活泼,通常情况下能和空气中的氧气反应生成一层致密的氧化膜;
(2)锌能和稀盐酸反应生成氯化锌和氢气,铁能和稀盐酸反应生成氯化亚铁和氢气;
(3)在足量的氢氧化钠溶液中不能产生氢氧化锌沉淀;
(4)浓盐酸易挥发,挥发出的氯化氢气体会干扰实验;
凡是有气体参加或产生的实验,实验前一定要检查装置的气密性,以防装置漏气影响实验结果;
若分液漏斗上方不连接导管a,则测出气体体积会偏大.(1)在铁皮表面镀锌是因为锌比铁活泼,并且在空气中容易形成致密的氧化膜,防止生锈.故填:b.(2)乙同学的理由是:因为铁也能和稀盐酸反应生成气体,因此很难控制只让锌反应,不让铁反应.故填:铁...
点评:
本题考点: 实验探究物质的组成成分以及含量;金属的化学性质;金属锈蚀的条件及其防护;碱的化学性质.
考点点评: 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.1年前查看全部
- "白铁皮“既镀锌铁皮,镀锌层犹如铁皮的保护层,具有很强的耐腐蚀性,这层膜的厚度是判断白铁皮质量的重要
"白铁皮“既镀锌铁皮,镀锌层犹如铁皮的保护层,具有很强的耐腐蚀性,这层膜的厚度是判断白铁皮质量的重要
某研究性学习小组为了测定镀膜厚度,设计了下面的试验方案,已知锌与强碱溶液反应的离子方程式:Zn+2OH-=ZnO2-+H2 锌的密度为dg/cm3.某学习小组同学设计了下图装置,是单侧面积为Scm2,质量为mg,的镀锌铁皮完全浸入6mol.L-1NaOH溶液中,充分反应.本题是2010-2011学年度上学期期末考试高一年纪化学试卷,东北育才出的题 hazilin1年前1
hazilin1年前1 -
 gocer 共回答了10个问题
gocer 共回答了10个问题 |采纳率90%反应过程中有氢气产生,镀膜上生成的ZnO会是疏松态,经过充分放置Zn转化为ZnO,然后用一定浓度的氨水溶解生成的ZnO,待残留的氨水挥发后称重计算Zn的质量,再由密度、表面积计算出Zn层的厚度.1年前查看全部
- 一种金属由于其密度小、延展性好、耐腐蚀性强,它和它的合金在航空、航海和化学工业中正逐步取代铝和铝合金而被广泛使用,该金属
一种金属由于其密度小、延展性好、耐腐蚀性强,它和它的合金在航空、航海和化学工业中正逐步取代铝和铝合金而被广泛使用,该金属是( ) A.镁 B.锌 C.钛 D.铜  完蛋乐1年前1
完蛋乐1年前1 -
 台山土著 共回答了17个问题
台山土著 共回答了17个问题 |采纳率88.2%钛的密度小、延展性好、耐腐蚀性强,它和它的合金在航空、航海和化学工业中正逐步取代铝和铝合金而被广泛使用.
故选C.1年前查看全部
- 化学性质稳定与耐腐蚀性有直接关系吗
化学性质稳定与耐腐蚀性有直接关系吗
拿铁来说,我认为铁的化学性质比较活泼所以才容易与空气中的氧气缓慢氧化导致生锈.所以我认为有关系, 行走天下之唯一1年前2
行走天下之唯一1年前2 -
 fww001 共回答了12个问题
fww001 共回答了12个问题 |采纳率75%百度之:耐腐蚀性是金属材料抵抗周围介质腐蚀破坏作用的能力称为耐腐蚀性.由材料的成分、化学性能、组织形态等决定的.楼主说的应该是一般情况的化学腐蚀吧,就是和酸啊碱啊空气啊水啊的发生腐蚀,那个一般和活泼性,也就是你说的稳定性有关.但是腐蚀有很多种吧,还有电化腐蚀啊之类的,那个就要具体看反应条件了吧.而且在讨论耐腐蚀性的时候一般谈的比较多的是合金,也就是说怎样在生产中给材料加入其它物质使其变的耐腐.
耐腐蚀性的东西包含太宽泛,楼主所说的腐蚀应该更像是化学性质活泼与否的一种证明方法,通过同样条件下哪种金属的反应能进行就说明那种金属的活泼性较强.
或许 此“腐蚀“非彼”腐蚀“1年前查看全部
- (2009•通州区二模)金属钛有银白色金属光泽,密度为4.5g/cm3,熔点为1725℃,具有良好的耐腐蚀性和延展性,你
(2009•通州区二模)金属钛有银白色金属光泽,密度为4.5g/cm3,熔点为1725℃,具有良好的耐腐蚀性和延展性,你认为下列制品不能用钛制作的是( )
A.眼镜架
B.保险丝
C.医疗器械
D.潜艇外壳 beckysusu1年前1
beckysusu1年前1 -
 04687863987 共回答了26个问题
04687863987 共回答了26个问题 |采纳率96.2%解题思路:A、眼镜框应该具有良好的延展性和耐腐蚀性;B、保险丝的熔点应该比较低;C、医疗器械应该具有良好的耐腐蚀性;D、制造潜艇外壳的材料应该具有良好的延展性和耐腐蚀性;因为钛具有良好的延展性和耐腐蚀性,可以用来制作医疗器械、潜艇外壳、眼镜框;因为钛的熔点很高,不能用来制作保险丝.
故选B.点评:
本题考点: 金属的物理性质及用途.
考点点评: 本题主要考查物质的性质和用途,解答时要充分理解各种物质的性质,然后再根据物质的性质方面进行分析、判断,从而确定物质的用途.1年前查看全部
- 防腐涂层的耐腐蚀性(盐雾实验)和化学稳定性有什么区别 各自原理如何
防腐涂层的耐腐蚀性(盐雾实验)和化学稳定性有什么区别 各自原理如何
百度知道里有类似问题
但是我说说我听到的解释
化学稳定性,面对的是酸碱 酸碱腐蚀是与表面层层反应 使原来的防腐涂层变成另一种物质,则不具有防腐性能,即防腐涂层被破坏
耐腐蚀性面对的是,盐 氯化钠,盐腐蚀是通过钻透防腐的方式腐蚀涂层下的金属
如果不对 通俗易懂点 xinghai9991年前3
xinghai9991年前3 -
 yatao313143 共回答了20个问题
yatao313143 共回答了20个问题 |采纳率85%化学稳定性是对涂料自身而言的,是涂料本身在腐蚀环境下的稳定性,比如有些涂料在酸性条件下会分解,有些涂料在紫外线下很容易老化;
烟雾试验是涂层对要保护的物项而言的,能说明在盐雾的条件下,既极端的大气腐蚀情况下,涂层对材料的保护性能.1年前查看全部
- 为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.其反应原理如下:电
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.其反应原理如下:电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O
Al2O3+3H2↑,电解过程中,以下判断正确的是( )电解 .电池 电解池 A H+移向Pb电极 H+移向Pb电极 B 每消耗3molPb 生成1molAl2O3 C 正极:PbO2+4H++2e-=Pb2++2H2O 阳极:2Al+3H2O-6e-=Al2O3+6H+ D Pb电极质量减少 Pb电极质量不变
A.A
B.B
C.C
D.D fairy_韩雪1年前1
fairy_韩雪1年前1 -
 ghost_zl 共回答了22个问题
ghost_zl 共回答了22个问题 |采纳率81.8%解题思路:A.原电池放电时,溶液中阳离子向正极移动;
B.串联电池中转移电子数相等;
C.原电池正极上生成硫酸铅;
D.原电池中铅电极上生成硫酸铅,电解池中阴极生成氢气.A.原电池中,溶液中氢离子向正极二氧化铅电极移动,故A错误;
B.串联电池中转移电子数相等,每消耗3molPb,根据电子守恒生成lmolAl2O3,故B正确;
C.原电池正极上二氧化铅得电子生成硫酸铅,则正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O,故C错误;
D.原电池中铅作负极,负极上铅失电子和硫酸根离子反应生成难溶性的硫酸铅,所以质量增加,在电解池中,Pb阴极,阴极上氢离子得电子生成氢气,所以铅电极质量不变,故D错误;
故选B.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池和电解池原理,根据电极上得失电子、离子放电顺序来分析解答即可,难度中等.1年前查看全部
- Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.某化学兴趣小组的同学为了测定某黄铜的组成,取20
Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于下表:
试回答下列问题:加入稀硫酸的质量(g) 充分反应后剩余固体的质量(g) 第1次 20 17.4 第2次 20 14.8 第3次 20 12.2 第4次 20 12.0 第5次 20 m
(1)网上述表格中m的值为 ___ ;
(2)黄铜样品中锌的质量分数为 ___ ;
(3)所用稀硫酸中硫酸的质量分数是多少?
 唯我随风1年前1
唯我随风1年前1 -
 sd7104865 共回答了21个问题
sd7104865 共回答了21个问题 |采纳率85.7%解题思路:(1)分析反应及实验数据:根据金属活动性,合金中只有锌可以与硫酸反应;根据质量守恒定律,由第1次实验数据可知,每加入20g稀硫酸完全反应可放出20g-17.4g=2.6g,据此分析,第4次加入20g稀硫酸时放出氢气质量12.2g-12.0g=0.2g<2.6g,可判断此时合金中金属锌已完全反应,所以,第5次加入的稀硫酸不再放出氢气;
(2)使用金属锌完全反应时剩余固体铜的质量,计算样品中金属锌的质量,利用锌的质量与样品的质量比计算黄铜样品中锌的质量分数;
(3)使用第1次实验数据,由生成氢气的质量,根据反应的化学方程式,计算参加反应硫酸的质量,利用硫酸的质量与所加稀硫酸的质量比计算所用稀硫酸中硫酸的质量分数.(1)根据质量守恒定律,由第1次实验数据可知,每加入20g稀硫酸完全反应消耗锌20g-17.4g=2.6g,据此分析,第4次加入20g稀硫酸时小寒心质量12.2g-12.0g=0.2g<2.6g,可判断此时合金中金属锌已完全反应,所以,第5次加入的稀硫酸不再消耗金属而不再放出氢气,因此充分反应后剩余固体的质量仍为12g;
故答案为:12.0(或12);
(2)黄铜样品中锌的质量分数=[20g-12g/20g]×100%=40%;
故答案为:40%;
(3)设所用稀硫酸中硫酸的质量分数为x,据题意得:
H2SO4 +Zn═ZnSO4+H2↑(1分)
98 65
20g×x 20g-17.4g=2.6g
[98/20g×x]=[65/2.6g] x=19.6%
答:所用稀硫酸中溶质的质量分数为19.6%.(合理解法均给分)点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 计算所用稀硫酸的溶质质量分数时,注意选取稀硫酸完全反应时的实验数据即前三次实验的数据进行计算.1年前查看全部
- 金具有很好的耐腐蚀性且色泽美观,但为什么一般不将他镀在铁制品的表面?
 5118405461年前1
5118405461年前1 -
 jackyhaoge 共回答了17个问题
jackyhaoge 共回答了17个问题 |采纳率82.4%即使有钱也不能这样镀.
金是耐腐蚀,但金不一定能对里面的铁进行保护,如果把金镀在铁的外面,金是一个阴极镀层,就也和我们的马口铁一样,金那么软,一但金层破坏,就会形成原电池,这时做负极的就是铁,首先被腐蚀,耐腐蚀的金在这里起不到对内层金属的保护作用.其实主要原因是金太软.所以镀金一般只是装饰性的,没有功能性的.1年前查看全部
- 为什么说铝对浓硝酸等有耐腐蚀性?为什么说铝在高温时还原性很强?
 grifva1年前4
grifva1年前4 -
 健健猪 共回答了23个问题
健健猪 共回答了23个问题 |采纳率95.7%浓硫酸会钝化铝,所以不会被腐蚀.金属本来就具有还原性1年前查看全部
- (2013•栖霞区一模)Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.
(2013•栖霞区一模)Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.
(1)不法分子常用黄铜制成金光闪闪的“假元宝”蒙骗人们.下列鉴别方法中错误的是______
A. 看颜色 B. 灼烧
C. 加硝酸银溶液D. 加盐酸
(2)为了测定某铜锌合金的组成,校化学课外活动小组利用该合金粉末与稀硫酸反应,设计了如图所示的实验装置进行实验.
①检查装置气密性的方法是:连接好装置,从漏斗注水,量气管两边形成高度差,做好标记,一段时间后,高度差______,说明气密性良好.
②正确读取量气管内液面的初始、最终读数前都需进行的操作是______.
③该小组进行了三次实验,所得相关的实验数据处理如下:
a、列式计算2g合金中,锌的质量:______合金的质量/g 稀硫酸的体积/mL 生成氢气的质量/g 第1次 2 15 0.04 第2次 2 20 0.04 第3次 4 15 0.04
b、分析上表数据,第______次实验,合金中的锌与稀硫酸恰好完全反应.稀硫酸的溶质质量分数为______(结果保留到0.1%).(实验温度下,ρH2SO4=1.08g/cm3) LONGROCK1年前1
LONGROCK1年前1 -
 凯萨 共回答了11个问题
凯萨 共回答了11个问题 |采纳率90.9%解题思路:(1)根据Cu与Zn、Au的化学性质和物理性质铜锌合金制成的假金元宝,虽然外观上与黄金无异,但合金中的金属铜和锌活动性都比黄金强,因此外观相似的两者化学性质相差较大:铜锌合金能与酸发生置换反应而放出氢气,在空气中灼热会变成黑色等,能与硝酸银溶液发生置换反应;利用这些性质上的差异可以很方便地区别它们.(2)①根据出现液面差后,如装置严密,装置内的气压不变的情况回答;
②根据连通器的原理可知应该调节两边液面相平在进行操作进行解答;
③分析表格中数据可以知道:铜、锌合金中铜和稀硫酸不反应只有锌和稀硫酸反应,第二次和第一次所取的合金质量相同,第二次所用的稀硫酸比第一次多,而两次生成的气体质量相同,说明两次所取的合金中的锌都完全反应了,由此可以知道2g合金只能生成0.04g氢气;第三次所取的合金是前两次的2倍,如果合金中的锌完全反应,应该产生0.08g气体,而实际上产生的气体和前两次相同只有0.04g,说明第三次反应中合金过量,而稀硫酸反应完全,由此可以知道15ml稀硫酸只能产生0.04g氢气,从而可以判断出稀硫酸和合金恰好完全反应的质量比;根据氢气的质量可以计算出锌的质量;根据氢气的质量可以计算出15ml稀硫酸中溶质的质量,从而计算出稀硫酸的质量分数.(1)A、观察颜色,由于二者的颜色基本一致,所以难于比较为真假,故错误;
B、铜锌合金中的铜和氧气会生成黑色的氧化铜,而金不会与氧气反应,现象不同,可以区别真伪;
C、放入硝酸银中,铜锌排在银的前面,能置换出硝酸银中的银,表面有一层银白色物质者为假,可以区别真伪;
D、放入盐酸中,锌与盐酸反应生成氢气,有气体放出者为假;可以区别真伪;
故选项为:A.
(2)①检查装置气密性的方法是:连接好装置,从漏斗注水,量气管两边形成高度差,做好标记,一段时间后,高度差不变,说明气密性良好;
②读取量气管内最终液面刻度前,需要进行的操作是调节量气管高度,使左右液面相平,否则管中的液柱能产生压强,对管中的气体进行压缩或拉伸,影响气体的体积测定,因而正确读取量气管内液面的初始、最终读数前都需进行的操作是调节两边液面相平;
③比较三组数据可以知道,2g合金只能生成0.04g氢气,而由第三次可知生成0.04g氢气只消耗15ml稀硫酸,所以2g合金中的锌和15ml稀硫酸可恰好完全反应,即第一次合金和稀硫酸恰好完全反应;
设2g铜锌合金中含有锌的质量为x,反应硫酸的质量为y
Zn+H2SO4═ZnSO4+H2↑
6598 2
xy 0.04g
65/x=2/0.04g x=1.3g
98/y=2/0.04g y=1.96g
s所以硫酸的质量分数为:1.96g/(15ml×1.08g/cm3)×100%=12.1%.
答:稀硫酸的溶质质量分数为12.1%.
故答案为:(1)A(2)①不变②调节两边液面相平
③设2g铜锌合金中含有锌的质量为x,反应硫酸的质量为y
Zn+H2SO4═ZnSO4+H2↑
6598 2
xy 0.04g
65/x=2/0.04g x=1.3g
98/y=2/0.04g y=1.96g
s所以硫酸的质量分数为:1.96g/(15ml×1.08g/cm3)×100%=12.1%.
答:2g合金中,锌的质量1.3g,第一次实验,合金中的锌与稀硫酸恰好完全反应,稀硫酸的溶质质量分数为12.1%.点评:
本题考点: 金属的化学性质;实验探究物质的组成成分以及含量;有关溶质质量分数的简单计算;根据化学反应方程式的计算.
考点点评: 此题考查的是合金的性质及根据化学方程式的有关计算,学会运用控制变量法来正确的分析处理表中的数据是解答此题的关键.1年前查看全部
- 铜锌的合金为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.
铜锌的合金为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.
Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于下表:
计算所用稀硫酸中硫酸的质量分数是多少?
 怎么假装1年前1
怎么假装1年前1 -
 zhangjian1979814 共回答了21个问题
zhangjian1979814 共回答了21个问题 |采纳率90.5%稀硫酸不能和Cu反应,只能和Zn反应
H2SO4 + Zn= ZnSO4+ H2↑
X 8.8
2+32+16*4 65
X得13.27
溶剂等于40+40+40+40
溶质质量分数等于13.27除以160约等于8.3%1年前查看全部
- 关于不锈钢耐腐蚀性,304L 、316L 、904L、321 、347H,各自对哪种酸的耐腐蚀性最好(最好是个人经验见解
关于不锈钢耐腐蚀性,304L 、316L 、904L、321 、347H,各自对哪种酸的耐腐蚀性最好(最好是个人经验见解)
304L说耐硝酸比较好,但是事实上放到硝酸和氢氟酸混合的酸缸里只要时间久一点很容易发生过酸,产生晶间腐蚀,不知道原因是什么,还有就是铁素体(405,410)和马氏体(420,430)说是不锈钢,为什么放在潮湿空气里一会就锈掉了,他的防锈主要表现在哪 sadfgwqgwui1年前3
sadfgwqgwui1年前3 -
 woly_wu 共回答了13个问题
woly_wu 共回答了13个问题 |采纳率84.6%耐腐蚀性有分很多种,但基本上是取决与Cr含量,Cr含量越多,耐腐蚀性越好,但在相同的Cr含量下304L比304的耐腐蚀性要好是因为在低C的情况下,在晶间的碳化铬越少,这样敏化的情况比较好,耐腐蚀性就好,其他钢种400S,一般来说Cr含量都低于300S,但是有些钢种为了保证一定的耐腐蚀性(443 445),做超低的碳含量,这样也可以,405,410 ,420,430的Cr又低,碳又高,耐腐蚀性当然会比较差,总而言之,耐腐蚀性一个和Cr有关系 另外一个和敏化的程度有关.1年前查看全部
- 英语翻译超细氧化铝(Al2O3)具有很高的化学稳定性、热稳定性、高硬度及耐腐蚀性等一系列优良特性,目前已得到广泛应用.因
英语翻译
超细氧化铝(al2o3)具有很高的化学稳定性、热稳定性、高硬度及耐腐蚀性等一系列优良特性,目前已得到广泛应用.因此,研究超细氧化***末的制备,选择最佳的优化方案,对制备出产率高,疏松性好,粒径小且分布均匀的超细氧化***末有着重要意义.本研究采用沉淀法,以氯化铝和各沉淀剂为原料制备超细氧化***体,通过研究各沉淀剂对氧化***末的影响,发现碳酸氢铵可以为最佳沉淀剂.对煅烧后样品进行xrd和激光粒度测定,检测结果表明;采用沉淀法以氯化铝和碳酸氢铵为原料制备得到超细氧化***末具有分散性较好、粒径较小以及纯度较高的优点.该工艺技术具有流程简单,操作方便,生成成本低,易于实现工业生产.
里面的专有名词可以到中国知网里查,只要语法和句式通顺就可以,急用. 能否鬼画符1年前1
能否鬼画符1年前1 -
 山城二郎 共回答了17个问题
山城二郎 共回答了17个问题 |采纳率94.1%Ultrafine alumina (Al2O3) has a series
of excellent features such as the very high chemical stability, thermal
stability, high hardness and corrosion resistance etc. It has been widely used
at present. Therefore, the research of ultrafine aluminum oxide powder and the
choice of the best optimization scheme have important significance for the
manufacturing of ultrafine aluminum oxide powder of the high yield, good loose,
small particle size and uniform distribution. Precipitation is applied in this
study, and manufacture ultrafine alumina powder with aluminium chloride and the
precipitating agent preparation as raw material. Through researching the
influence of the precipitant on alumina powder, we find ammonium bicarbonate can
be taken as the best precipitant. After the XRD and laser particle size
measurement of calcination samples, test results show that; aluminum oxide
powder manufactured with aluminium chloride and ammonium bicarbonate as raw
material by precipitation method has the advantages of the good dispersivity,
the smaller particle size and high purity. The technology has the characters of
simple process, convenient operation and low cost. Therefore, it is easy to
realize industrial production.
纯手工翻译,相信楼主雪亮的眼睛可以看出谁是机器翻译的,谁是人工翻译的,机器翻译的害人不浅啊,望楼主采纳!1年前查看全部
- 盐雾试验96小时相当于多少年的耐腐蚀性
盐雾试验96小时相当于多少年的耐腐蚀性
请教高手
 dcq198111201年前1
dcq198111201年前1 -
 漫山枫叶红 共回答了18个问题
漫山枫叶红 共回答了18个问题 |采纳率88.9%目前还没有一个规范可以定量的测算出相当于实际使用多少年,比较常用的盐雾试验评级标准是GB6461,不过它也只是根据腐蚀的面积来评级.1年前查看全部
- Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.某化学兴趣小组的同学为了测定某黄铜的组成,取10
Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.某化学兴趣小组的同学为了测定某黄铜的组成,取10g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于下表:
试回答下列问题:加入稀硫酸的质量(g) 充分反应后剩余固体的质量(g) 第1次 10 m 第2次 10 7.4 第3次 10 6.1 第4次 10 5.6 第5次 10 5.6
(1)从以上数据可知,最后剩余的5.6g固体的成分是______;表格中,m=______.
(2)黄铜样品中锌的质量分数为______.
(3)计算所用稀硫酸中硫酸的质量分数是多少? roweluo051年前1
roweluo051年前1 -
 ydjsf 共回答了21个问题
ydjsf 共回答了21个问题 |采纳率85.7%解题思路:根据已有的知识进行分析,黄铜样品与稀硫酸混合,铜与稀硫酸不反应,锌与稀硫酸反应,根据表格提供的数据可以看出,每10g稀硫酸与1.3g锌完全反应,据此解答即可.(1)黄铜样品与稀硫酸混合,铜与稀硫酸不反应,锌与稀硫酸反应,第四次和第五次加入稀硫酸固体质量不再改变,故5.6g是铜的质量,第四次加入稀硫酸,固体质量减少,说明第三次加入硫酸时锌没有完全反应,根据第二次加入稀硫酸和第三次加入稀硫酸的固体质量差为:7.4g-6.1g=1.3g,说明每10g稀硫酸恰好与1.3g锌完全反应,故m=7.4g+1.3g=8.7g.固体:Cu,8.7;
(2)黄铜样品的质量为:8.7g+1.3g=10g
黄铜样品中锌的质量分数为[10g−5.6g/10g×100%=44%,故填:44%;
(3)设10g稀硫酸中所含硫酸的质量为x
Zn+H2SO4 =ZnSO4 +H2↑
65 98
1.3g x
65
1.3g=
98
x] x=1.96g
所用稀硫酸中硫酸的质量分数为:
1.96g
10g×100%=19.6%
答:所用稀硫酸中硫酸的质量分数是19.6%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题考查了根据化学方程式的计算,要求同学们加强对数据的分析能力,以便从提供的数据中得出有用的信息.1年前查看全部
- Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种电器零件和日用品.某化学兴趣小组的同学为了测定某黄铜样品中
Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种电器零件和日用品.某化学兴趣小组的同学为了测定某黄铜样品中锌的质量分数,将150g稀硫酸分三次加入到50g黄铜样品中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
请回答下列问题:第一次 第二次 第三次 加入稀硫酸的质量(g) 50 50 50 生成氢气的质量(g) 0.4 m 0.2
(1)m=______;
(2)该黄铜样品中锌的质量分数为______;
(3)所用稀硫酸中溶质的质量分数为______. 凉爽山城1年前1
凉爽山城1年前1 -
 tyf_tom 共回答了21个问题
tyf_tom 共回答了21个问题 |采纳率90.5%解题思路:根据金属活动顺序表可知铜和锌的合金中只有锌能与硫酸反应生成氢气;由表格数据可知第三次加50g稀硫酸时,锌已经反应完全,总共收集到氢气为三次之和;再根据化学方程式,利用氢气的质量求出锌的质量,然后再求出合金中铜的质量分数.(1)根据表格可以发现,第一次加入50g硫酸生成0.4g氢气,第三次加入50g硫酸还能生成并且只生成0.2g氢气,说明直到第三次反应才结束,并且硫酸有剩余(按照比例,正好剩余一半);同时说明第二次加入50g硫酸时完全反应,生成氢气的质量可按照第一次的数量关系(50g对应0.4g)类推,而得出m为0.4g.
故答案为:0.4;
(2)根据表格可知,共生成氢气的质量为1.0g,设需要锌的质量为x,则有
Zn+H2SO4=ZnSO4+H2↑
65 2
x 1.0g
[65/x]=[2/1g]
x=32.5g
所以此黄铜样品中锌的质量分数为:[32.5g/50g]×100%=65%.
(3)设硫酸的质量分数是y
Zn+H2SO4=ZnSO4+H2↑
98 2
50g×y0.4g
[98/2]=[50g×y/0.4g]
y=39.2%
故答案为:39.2%点评:
本题考点: 金属活动性顺序及其应用;有关溶质质量分数的简单计算.
考点点评: 本题以信息的方式来考查合金中金属与酸的反应及合金中金属质量分数的计算,学生应能利用表格进行数据分析和应用,要注意利用化学方程式计算的格式规范.1年前查看全部
- 一种新兴的金属由于其密度小、延展性好、耐腐蚀性强,它和它的合金在航空、航海和化学工业中正逐步取代铝和铝合金而被广泛使用,
一种新兴的金属由于其密度小、延展性好、耐腐蚀性强,它和它的合金在航空、航海和化学工业中正逐步取代铝和铝合金而被广泛使用,该金属是( )
A.锌
B.镁
C.铜
D.钛 yaoaihua1231年前1
yaoaihua1231年前1 -
 3n173 共回答了15个问题
3n173 共回答了15个问题 |采纳率86.7%解题思路:钛的密度小、延展性好、耐腐蚀性强,应用前景具有很大的空间.钛的密度小、延展性好、耐腐蚀性强,它和它的合金在航空、航海和化学工业中正逐步取代铝和铝合金而被广泛使用.
故选:D.点评:
本题考点: 金属的物理性质及用途.
考点点评: 本题主要考查物质的性质和用途,解答时要充分理解各种物质的性质,然后再根据物质的性质方面进行分析、判断,从而确定物质的用途.1年前查看全部
- 铝在常温下具有耐腐蚀性的原因是什么,
 53260231年前4
53260231年前4 -
 mysifa 共回答了15个问题
mysifa 共回答了15个问题 |采纳率100%铝在常温下氧化的化学方程式:4Al + 3O2 = 2Al2O3
Al2O3是一层致密的氧化膜1年前查看全部
- 一种新兴的金属由于其密度小、延展性好、耐腐蚀性强,它和它的合金在航空、航海和化学工业中正逐步取代铝和铝的合金而被广泛应用
一种新兴的金属由于其密度小、延展性好、耐腐蚀性强,它和它的合金在航空、航海和化学工业中正逐步取代铝和铝的合金而被广泛应用,该金属是( )
A. 铜
B. 锌
C. 钛
D. 锰 chuangzhen1年前1
chuangzhen1年前1 -
 HAPPYKANONG 共回答了13个问题
HAPPYKANONG 共回答了13个问题 |采纳率84.6%解题思路:物质的性质决定物质的用途.钛的密度小、延展性好、耐腐蚀性强,应用前景具有很大的空间.由于钛的密度小、延展性好、耐腐蚀性强,它和它的合金在航空、航海和化学工业中正逐步取代铝和铝合金而被广泛使用.所以C正确,A、B、D错误.
故选:C.点评:
本题考点: 金属的物理性质及用途.
考点点评: 本题主要考查物质的性质和用途,解答时要充分理解各种物质的性质,然后再根据物质的性质方面进行分析、判断,从而确定物质的用途.1年前查看全部
- 请问如果用于高温反应容器,铝合金,镍合金,不锈钢谁的耐腐蚀性最强?
 卓狼1年前3
卓狼1年前3 -
 yuye8 共回答了24个问题
yuye8 共回答了24个问题 |采纳率95.8%镍合金1年前查看全部
- 请问氟塑料具有腐蚀性吗?顺便问下,是不是具有耐腐蚀性的塑料都是具有腐蚀性呢?全部分数奉献了
 xiongyue1年前1
xiongyue1年前1 -
 81453210 共回答了17个问题
81453210 共回答了17个问题 |采纳率100%塑料本身都没有腐蚀性,但如分解则可能有腐蚀性气体放出.1年前查看全部
- 下列说法正确的是( )A.铝制品的耐腐蚀性强,说明铝的化学性质不活泼B.煤的气化和液化是使煤变成清洁能源的有效途径C.
下列说法正确的是( )
A.铝制品的耐腐蚀性强,说明铝的化学性质不活泼
B.煤的气化和液化是使煤变成清洁能源的有效途径
C.光导纤维和光电池的主要成分都是二氧化硅
D.淀粉、油脂和蛋白质都是高分子化合物 YAKULT1年前1
YAKULT1年前1 -
 i1000 共回答了24个问题
i1000 共回答了24个问题 |采纳率87.5%A、铝表面生成一层致密的氧化物保护膜,阻止内部金属继续被氧化,故A错误;
B、煤的气化和液化可以有效降低氮、硫氧化物的排放、固体烟尘排放等,提高燃烧效率,是使煤变成清洁能源的有效途径,故B正确;
C、光导纤维的主要成分是二氧化硅,硅是制备光电池的主要原料,故C错误;
D、淀粉、蛋白质是高分子化合物,油脂相对分子质量减小,不是高分子化合物,故D错误.
故选:B.1年前查看全部
- 金的密度大且耐腐蚀性好,但不用它来镀在铁制品表面是因为/
 fang60695521年前2
fang60695521年前2 -
 心有魔 共回答了17个问题
心有魔 共回答了17个问题 |采纳率94.1%金硬度小,易磨损,且磨损后与铁形成原电池加速铁腐蚀.
主要不是因为贵,镀的一般很薄.暖瓶里都镀银也没见贵到哪去.1年前查看全部
- 不锈钢的耐化学腐蚀性304与316L 在各种介质中的耐腐蚀性(不同温度与浓度),有没有详细一点的呢
 寻乐人1年前1
寻乐人1年前1 -
 墨枫_koo 共回答了20个问题
墨枫_koo 共回答了20个问题 |采纳率95%查《腐蚀数据手册》 左景伊著 ,
里面有两章专门介绍铬18镍9钢和铬18镍12钼钢的腐蚀性能
够详细了
这儿地方太小写不全1年前查看全部
- cu与zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种电器零件和日用品.
cu与zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种电器零件和日用品.
某化学兴趣小组的同学为了测定某黄铜样品中锌的质量分数,将150g稀硫酸分三次加入到50g黄铜样品中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
第一次 第二次 第三次加入稀硫酸的质量(g)
50 50 50
生成氢气的质量(g)
0.4 m 0.2
1)m=
;
(2)该黄铜样品中锌的质量分数为
(3)所用稀硫酸中溶质的质量分数为 乞丐yy1年前1
乞丐yy1年前1 -
 daocaoren914823 共回答了21个问题
daocaoren914823 共回答了21个问题 |采纳率90.5%1.求每次的质量差
前两次的质量差都是2.6g
第三次和第四次的质量差是0.2g
即从第四次开始H2SO4过量了
第四次留下来的固体都是Cu,已经没有了Zn
所以m=12.0g
2.减少的质量是Zn为17.4-12=5.4g
所以Zn的质量分数是5.4/17.4=31.03%
3.加入了20g稀硫酸反应了2.6gZn
Zn--H2SO4
65 98
2.6g x
解得x=3.92g
即硫酸的质量分数是3.92/20=19.6%1年前查看全部
- Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种电器零件和日用品.某化学兴趣小组的同学为了测定某黄铜样品中
Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种电器零件和日用品.某化学兴趣小组的同学为了测定某黄铜样品中锌的质量分数,将150g稀硫酸分三次加入到50g黄铜样品中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
请回答下列问题:第一次 第二次 第三次 加入稀硫酸的质量(g) 50 50 50 生成氢气的质量(g) 0.4 m 0.2
(1)m=______;
(2)该黄铜样品中锌的质量分数为______;
(3)所用稀硫酸中溶质的质量分数为______. 不动明王v1年前1
不动明王v1年前1 -
 主恩浩荡 共回答了18个问题
主恩浩荡 共回答了18个问题 |采纳率100%解题思路:根据金属活动顺序表可知铜和锌的合金中只有锌能与硫酸反应生成氢气;由表格数据可知第三次加50g稀硫酸时,锌已经反应完全,总共收集到氢气为三次之和;再根据化学方程式,利用氢气的质量求出锌的质量,然后再求出合金中铜的质量分数.(1)根据表格可以发现,第一次加入50g硫酸生成0.4g氢气,第三次加入50g硫酸还能生成并且只生成0.2g氢气,说明直到第三次反应才结束,并且硫酸有剩余(按照比例,正好剩余一半);同时说明第二次加入50g硫酸时完全反应,生成氢气的质量可按照第一次的数量关系(50g对应0.4g)类推,而得出m为0.4g.
故答案为:0.4;
(2)根据表格可知,共生成氢气的质量为1.0g,设需要锌的质量为x,则有
Zn+H2SO4=ZnSO4+H2↑
65 2
x 1.0g
[65/x]=[2/1g]
x=32.5g
所以此黄铜样品中锌的质量分数为:[32.5g/50g]×100%=65%.
(3)设硫酸的质量分数是y
Zn+H2SO4=ZnSO4+H2↑
98 2
50g×y0.4g
[98/2]=[50g×y/0.4g]
y=39.2%
故答案为:39.2%点评:
本题考点: 金属活动性顺序及其应用;有关溶质质量分数的简单计算.
考点点评: 本题以信息的方式来考查合金中金属与酸的反应及合金中金属质量分数的计算,学生应能利用表格进行数据分析和应用,要注意利用化学方程式计算的格式规范.1年前查看全部
- (9分)日常生活中常见的金属材料有铝合金、钢铁等,某化学实验小组欲测定几种金属材料的耐腐蚀性,所用药品和试剂有:铝合金、
(9分)日常生活中常见的金属材料有铝合金、钢铁等,某化学实验小组欲测定几种金属材料的耐腐蚀性,所用药品和试剂有:铝合金、钢铁、CO 2 、SO 2 、水。
(1)请完成以下实验设计表,并在实验目的的一栏中填入对应的实验编号:(2)在10%的盐酸中温度对铝合金的腐蚀速率影响关系见下图:铝合金在40℃时的腐蚀速率是20℃的 倍.实验编号 金属材料 溶 液 实验目的 ① 铝合金 CO 2 + H 2 O Ⅰ.探究不同溶液对金属材料的腐蚀速率;
Ⅱ.探究不同金属材料的腐蚀速率;② ③ 
(3)请在上题图象中,画出铝合金在CO 2 溶液和SO 2 溶液中腐蚀速率随温度变化关系的预期结果示意图(都从a点开始)。 rillita1年前1
rillita1年前1 -
 佐岸and佑转 共回答了20个问题
佐岸and佑转 共回答了20个问题 |采纳率80%(9分)(1)(2分/个)②铝合金 SO 2 + H 2 O ③钢铁 CO 2 + H 2 O (②钢铁 SO 2 + H 2 O  ...1年前查看全部
- (2013•天津)为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.
(2013•天津)为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O (l)
电解池:2Al+3H2O
Al2O3+3H2↑电解 .
电解过程中,以下判断正确的是( )
电池 电解池 A H+移向Pb电极 H+移向Pb电极 B 每消耗3mol Pb 生成2mol Al2O3 C 正极:PbO2+4H++2e-═Pb2++2H2O 阳极:2Al+3H2O-6e-═Al2O3+6H+ D 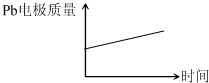
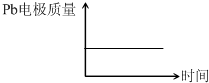
A.A
B.B
C.C
D.D 悠悠心情1年前1
悠悠心情1年前1 -
 renqishi 共回答了19个问题
renqishi 共回答了19个问题 |采纳率89.5%解题思路:A.原电池放电时,溶液中阳离子向正极移动;
B.串联电池中转移电子数相等;
C.原电池正极上生成硫酸铅;
D.原电池中铅电极上生成硫酸铅.A.原电池中,溶液中氢离子向正极二氧化铅电极移动,故A错误;
B.串联电池中转移电子数相等,每消耗3molPb,根据电子守恒生成lmolAl2O3,故B错误;
C.原电池正极上二氧化铅得电子生成硫酸铅,故C错误;
D.原电池中铅作负极,负极上铅失电子和硫酸根离子反应生成难溶性的硫酸铅,所以质量增加,在电解池中,Pb阴极,阴极上氢离子得电子生成氢气,所以铅电极质量不变,故D正确;
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池和电解池原理,根据电极上得失电子、离子放电顺序来分析解答即可,难度中等.1年前查看全部
- (2014•吉安模拟)Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.某化学兴趣小组的同学为了测
(2014•吉安模拟)Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.某化学兴趣小组的同学为了测定某黄铜的组成,取10g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于下表:
试回答下列问题:加入稀硫酸的质量(g) 充分反应后剩余固体的质量(g) 第1次 10 m 第2次 10 7.4 第3次 10 6.1 第4次 10 5.6 第5次 10 5.6
(1)从以上数据可知,最后剩余的5.6g固体的成分是______;表格中,m=______.
(2)黄铜样品中锌的质量分数为______.
(3)计算所用稀硫酸中硫酸的质量分数是多少? 修ee息1年前1
修ee息1年前1 -
 霹雳行者 共回答了17个问题
霹雳行者 共回答了17个问题 |采纳率94.1%解题思路:根据已有的知识进行分析,黄铜样品与稀硫酸混合,铜与稀硫酸不反应,锌与稀硫酸反应,根据表格提供的数据可以看出,每10g稀硫酸与1.3g锌完全反应,据此解答即可.(1)黄铜样品与稀硫酸混合,铜与稀硫酸不反应,锌与稀硫酸反应,第四次和第五次加入稀硫酸固体质量不再改变,故5.6g是铜的质量,第四次加入稀硫酸,固体质量减少,说明第三次加入硫酸时锌没有完全反应,根据第二次加入稀硫酸和第三次加入稀硫酸的固体质量差为:7.4g-6.1g=1.3g,说明每10g稀硫酸恰好与1.3g锌完全反应,故m=7.4g+1.3g=8.7g.固体:Cu,8.7;
(2)黄铜样品的质量为:8.7g+1.3g=10g
黄铜样品中锌的质量分数为[10g−5.6g/10g×100%=44%,故填:44%;
(3)设10g稀硫酸中所含硫酸的质量为x
Zn+H2SO4 =ZnSO4 +H2↑
65 98
1.3g x
65
1.3g=
98
x] x=1.96g
所用稀硫酸中硫酸的质量分数为:
1.96g
10g×100%=19.6%
答:所用稀硫酸中硫酸的质量分数是19.6%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题考查了根据化学方程式的计算,要求同学们加强对数据的分析能力,以便从提供的数据中得出有用的信息.1年前查看全部
- 建造航母需要大量的金属材料,一种新兴的金属由于其密度小、强度高、耐腐蚀性强,它和它的合金在航空、航海和化学工业正逐步取代
建造航母需要大量的金属材料,一种新兴的金属由于其密度小、强度高、耐腐蚀性强,它和它的合金在航空、航海和化学工业正逐步取代铝和铝合金而被广泛应用,该金属是( ) A.锌 B.钛 C.镁 D.锰  Vivian_he1年前1
Vivian_he1年前1 -
 柯南17bt 共回答了14个问题
柯南17bt 共回答了14个问题 |采纳率85.7%在航空航海领域有着广泛的应用的新兴金属是钛,观察选项,故选B.1年前查看全部
- Ni201与316L材质,哪个耐腐蚀性强?
 流星心泪1年前1
流星心泪1年前1 -
 xljt 共回答了16个问题
xljt 共回答了16个问题 |采纳率106.3%楼上几个都是半吊子,不懂装懂,误人子弟!看了令人揪心!Ni201是纯镍的牌号啊,和201不锈钢完全就是两码事!对于任何一个专业人员来说这就是常识!另外,比较耐腐蚀性一定不能脱离具体的腐蚀介质和环境,没有材料能在任何介质中都是“常胜将军”!例如,在氢氧化钠溶液中,纯镍的耐腐蚀性比316L好的多,而在硝酸溶液中却相反!1年前查看全部
- 钛单质和金单质哪个耐腐蚀性最强化学书本上的金属活动顺序表 即 K Ca Na Mg Al Zn Fe Sn Pb (H)
钛单质和金单质哪个耐腐蚀性最强
化学书本上的金属活动顺序表 即 K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 其中金是位于最后面的 老师说金的化学性质十分不活泼 耐腐蚀性十分强 但化学书上说钛和钛的合金也有十分强的耐腐蚀性 用于宇宙飞船等尖端技术领域 是二十一世纪的重要金属 但金属活动顺序表中又没有钛 因此 想问下哪个耐腐蚀性更强 顺便问下世界上已知耐腐蚀性最强的金属是哪个? 有多强?
 Xiaoyy19861年前1
Xiaoyy19861年前1 -
 bananana 共回答了16个问题
bananana 共回答了16个问题 |采纳率100%耐腐蚀性一定要指名腐蚀环境,在大部分腐蚀环境中,黄金的耐腐蚀性要优于钛,例如高温氧化性气体,比较纯的盐酸,硫酸,硝酸,熔融碱等等,但金在含强氧化剂的高浓度氯离子的酸性溶液能被腐蚀,而钛虽然电位只有-1.6V左右,对这种环境却具有高度的耐蚀性.在一般的腐蚀环境中,目前已知最耐腐蚀的金属是铱,但铱在高温下会被氧化,这一点比不过黄金1年前查看全部
- 下列是某种金属的部分性质. 颜色状态 硬度 密度 熔点 延展性 导电、导热性 耐腐蚀性 该金属加入到稀盐酸中 银白色固体
下列是某种金属的部分性质.
①试推断该金属的化学性质______.颜色状态 硬度 密度 熔点 延展性 导电、导热性 耐腐蚀性 该金属加入到稀盐酸中 银白色固体 较硬 4.5g/cm3 高 好 好 好 无气泡产生
②该金属可能有的几种用途是______.
③请自选化学试剂设计实验,探究该金属的化学活动性与铁比较的强弱.
你的猜想 验证方法 现象 结论  heiam1年前1
heiam1年前1 -
 天天向上2000 共回答了26个问题
天天向上2000 共回答了26个问题 |采纳率84.6%解题思路:可以根据物质的性质和用途方面进行分析、判断,从而得出正确的结论.①该金属耐腐蚀性好,则说明该金属的化学性质有:化学性质稳定,不能和盐酸反应.
②该金属具有导电性、导热性和硬度大的性质,可能有的几种用途是:制导线、制作炊具、制作机件等.
③设计实验如表中所示.
你的猜想 验证方法 现象 结论
铁的活泼性强 把铁丝伸入该金属的盐溶液中 铁丝表面有银白色固体生成 铁的活泼性强点评:
本题考点: 化学性质与物理性质的差别及应用;金属活动性的探究;反应现象和本质的联系.
考点点评: 解答本题是要掌握各种物质的性质,只有掌握了物质的性质才能确定物质的用途.1年前查看全部
- 用砂纸将铝制品打磨后,铝制品仍有较强的耐腐蚀性,原因是
 窝子何1年前1
窝子何1年前1 -
 chexiong1969 共回答了22个问题
chexiong1969 共回答了22个问题 |采纳率100%又迅速地生成了氧化膜1年前查看全部
- 塑料的耐腐蚀性比玻璃强吗
 jiangh11231年前1
jiangh11231年前1 -
 canlandeyanhua 共回答了25个问题
canlandeyanhua 共回答了25个问题 |采纳率88%不一定,塑料抗酸碱较好,抗高温及各种有机溶剂相对较差.抗光老化(氧化还原)差.
玻璃抗有机溶剂特别好,抗除了氢氟酸之外的无机溶剂也很出色,抗强碱稍差,抗氧化还原特别好,抗电腐蚀优异.1年前查看全部
- Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种电器零件和日用品.某化学兴趣小组的同学为了测定某黄铜样品中
Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种电器零件和日用品.某化学兴趣小组的同学为了测定某黄铜样品中锌的质量分数,将150g稀硫酸分三次加入到50g黄铜样品中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
请回答下列问题:第一次 第二次 第三次 加入稀硫酸的质量(g) 50 50 50 生成氢气的质量(g) 0.4 m 0.2
(1)m=______;
(2)该黄铜样品中锌的质量分数为______;
(3)所用稀硫酸中溶质的质量分数为______. 维娜斯1年前1
维娜斯1年前1 -
 yunhai6688 共回答了26个问题
yunhai6688 共回答了26个问题 |采纳率84.6%解题思路:根据金属活动顺序表可知铜和锌的合金中只有锌能与硫酸反应生成氢气;由表格数据可知第三次加50g稀硫酸时,锌已经反应完全,总共收集到氢气为三次之和;再根据化学方程式,利用氢气的质量求出锌的质量,然后再求出合金中铜的质量分数.(1)根据表格可以发现,第一次加入50g硫酸生成0.4g氢气,第三次加入50g硫酸还能生成并且只生成0.2g氢气,说明直到第三次反应才结束,并且硫酸有剩余(按照比例,正好剩余一半);同时说明第二次加入50g硫酸时完全反应,生成氢气的质量可按照第一次的数量关系(50g对应0.4g)类推,而得出m为0.4g.
故答案为:0.4;
(2)根据表格可知,共生成氢气的质量为1.0g,设需要锌的质量为x,则有
Zn+H2SO4=ZnSO4+H2↑
65 2
x 1.0g
[65/x]=[2/1g]
x=32.5g
所以此黄铜样品中锌的质量分数为:[32.5g/50g]×100%=65%.
(3)设硫酸的质量分数是y
Zn+H2SO4=ZnSO4+H2↑
98 2
50g×y0.4g
[98/2]=[50g×y/0.4g]
y=39.2%
故答案为:39.2%点评:
本题考点: 金属活动性顺序及其应用;有关溶质质量分数的简单计算.
考点点评: 本题以信息的方式来考查合金中金属与酸的反应及合金中金属质量分数的计算,学生应能利用表格进行数据分析和应用,要注意利用化学方程式计算的格式规范.1年前查看全部
- 什么塑料耐腐蚀性比较好有一款新产品,是一个桶,用来装绘画颜料的,客人要求所用的塑料耐颜料的腐蚀性要好且易于清洗,我之前没
什么塑料耐腐蚀性比较好
有一款新产品,是一个桶,用来装绘画颜料的,客人要求所用的塑料耐颜料的腐蚀性要好且易于清洗,我之前没接触过此类型的产品,所以不懂,
急用!
备注:此桶是注塑成型的.
再次说明一下:此产品为注塑成型,而非压铸成型,另外,材料的选用也需要考虑经济性及易加工性.
再次补充一下:我做产品结构设计大概有6年多时间了,对于一般常用的工程塑料的性能也略知一二,比如说塑料王是耐腐蚀最好的热成型塑料我也了解,关键是成本啊,又不是做高科技产品,材料成本是必须严格限制的,所以请各位帮忙出主意的也要考虑一下. 0miqi1年前1
0miqi1年前1 -
 如歌的行板119 共回答了16个问题
如歌的行板119 共回答了16个问题 |采纳率93.8%PP塑料:Polypropylene,全称“聚丙烯塑料”
所谓耐腐蚀只是相对于一般材料而言(如金属材料),世界上不存在可完全不被腐蚀的材料.
即使在塑料家族中,PP塑料也不以耐腐蚀著称.常见的耐腐蚀塑料为PTFE(聚四氟乙烯),PTFE塑料常用于化工生产中,可在强酸强碱下工作较长时间(几年甚至十几年),但是也免不了会被其他物质腐蚀(变色等).1年前查看全部
- 1cr18ni9ti与304不锈钢哪个耐腐蚀性强
 努力学做饭1年前1
努力学做饭1年前1 -
 54ardell 共回答了18个问题
54ardell 共回答了18个问题 |采纳率88.9%321(0Cr18Ni10Ti)适用于高温,能耐强腐蚀性介质
304不锈钢具有良好的耐热性、耐蚀性、低温强度和机械性能,冲压、弯曲等热加工性能好,无热处理感化现象(无磁性,使用温度-96℃-800℃).1年前查看全部
- 金属活动性与耐腐蚀性有什么关系吗
 mylovekk1年前1
mylovekk1年前1 -
 xiaosong1130 共回答了12个问题
xiaosong1130 共回答了12个问题 |采纳率100%有的,一般来说,金属活动性强的金属很容易和其他物质起反应,尤其是氧化性物质以及酸,因此当然不耐腐蚀,而活动性差的金属很不容易起反应,这也是为什么金银可以做货币以及电极等的原因.不过例外是铝、铁和冷的浓酸反应表面会起一层致密的氧化膜,阻止反应继续发生.这种情况下反而“耐腐蚀”了1年前查看全部
- 硬铝与制造飞机外壳有什麽关系关于化学问题,有四个选项供参考A.导电性较好 B.密度较小 C.耐腐蚀性较强 D.硬度较大
 阿弥陀佛31221年前1
阿弥陀佛31221年前1 -
 357361536 共回答了26个问题
357361536 共回答了26个问题 |采纳率96.2%密度小 重量轻飞机飞得快1年前查看全部
大家在问
- 1look _______ (wonder)
- 2k为何值时,多项试X+2Xy+ky+3x-5y+2能分解成两个一次因式的积
- 3(2014•松江区三模)多彩的“碳”,多姿的生活,让我们一起走进“碳”的世界.
- 4英语翻译Many people are waiting for the train.Some are reading n
- 5做测量小灯泡电功率的实验(小灯泡标有“2.0V”字样).
- 6已知三角形ABC,BC=1,∠A=120°,∠B=θ既f(θ)=向量BA乘以向量AC 求 f(θ)关于θ的表达式 求f(
- 7我的小发明 作文
- 8put on a shirt=dress a shirt还是dress up a shirt
- 94分之3加18分之11减9分之1
- 10用一个数除以4,5,6 它的余数都是3 这个数是多少
- 11Y=(x的平方-4x+13)/(x-1),x属于[2,5]的最值
- 12数学老师布置10道选择题作为课堂练习,课代表将全班同学的答题情况绘制成条形统计图(如图),根据此图求每位同学答对的题数所
- 13一个圆锥和一个圆柱的体积相等,底面半径比是3:2,圆锥的高是8厘米,圆柱的高是______厘米.
- 14已知函数f(x)=3x^2+2X,求f(a),f(-a),f(a)+f(-a)的值,你能从中发现什么结论?对函数
- 15关于风雨的开头和结尾大神们帮帮忙
