为回收利用废钒催化剂(含有V 2 O 5 、VOSO 4 及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺
 一个传说2022-10-04 11:39:541条回答
一个传说2022-10-04 11:39:541条回答| 为回收利用废钒催化剂(含有V 2 O 5 、VOSO 4 及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下: 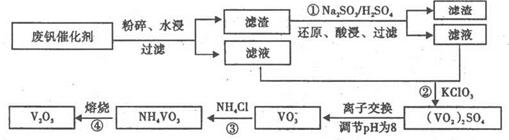 部分含钒物质在水中的溶解性如下:  回答下列问题: (1)工业上由V 2 O 5 冶炼金属钒常用铝热法,该反应的化学方程式为_______ (2)为了提高钒的浸出率,用酸浸使催化剂中的V 2 O 5 转变成可溶于水的VOSO 4 ,与水浸液合并,再用KClO 3 氧化,使+4价的V氧化成易溶于水的(VO 2 ) 2 SO 4 。反应①的离子方程式为_______;反应②的离子方程式为ClO 3 - +6VO 2 + +3H 2 O=6VO 2 + +6H + +Cl - 。 (3)该工艺中反应③的沉淀率是回收钒的关键之一,该步反应的离子方程式为_______。 (4) 实验室用的原料中V 2 O 5 占6%(原料中的所有钒已换算成V 2 O 5 )。取100g该废钒催化剂按工业生产的步骤进行实验,当加入100 mL 0.1 mol·L -1 的KC1O 3 溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该实验中钒的回收率是_______ (已知V 2 O 5 的相对分子质量为182)。 (5)全钒液储能电池是利用不同价态的离子对之间的氧化还原反应来实现化学能和电能相互转化的装置,其原理如右下图所示。已知电池的总反应式为VO 2 + +V 2 + +2H +  VO 2 + +V 3 + +H 2 O VO 2 + +V 3 + +H 2 O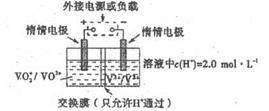 ①放电时的正极反应式为______________。 ②放电过程中氢离子的作用是______________,充电时若转移的电子为2mol,则左槽溶液中n(H + )的变化量为______________。 |

已提交,审核后显示!提交回复
共1条回复
相关推荐
- 随着计算机的日益普及和不断更新,废电脑中材料的回收利用逐渐引起人们的重视.写出电脑配件中两种常用材料的类别(填“金属材料
随着计算机的日益普及和不断更新,废电脑中材料的回收利用逐渐引起人们的重视.写出电脑配件中两种常用材料的类别(填“金属材料”“矿物质材料”“高分子材料”):
材料 铜 塑料 类别  ws009353121年前1
ws009353121年前1 -
 天_笑涯 共回答了20个问题
天_笑涯 共回答了20个问题 |采纳率90%解题思路:根据物质的类别进行分析,铜属于金属材料,塑料属于高分子材料.答铜属于金属材料,塑料属于高分子材料,所以本题答案为:
材料 铜 塑料
类别 金属材料 高分子材料点评:
本题考点: 金属元素的存在及常见的金属矿物;金属材料及其应用;物质的简单分类;有机高分子材料的分类及鉴别.
考点点评: 本题考查了材料的类别,完成此题,可以依据已有的知识进行.1年前查看全部
- 2014年1月19日,我省举办节能减排暨建筑垃圾回收利用论坛,支招建筑垃圾“变废为宝”.建筑垃圾中废塑料、废橡胶制品属于
2014年1月19日,我省举办节能减排暨建筑垃圾回收利用论坛,支招建筑垃圾“变废为宝”.建筑垃圾中废塑料、废橡胶制品属于( )
A.金属材料
B.有机合成材料
C.无机非金属材料
D.复合材料 仙兔1年前1
仙兔1年前1 -
 废话可以少说两句 共回答了21个问题
废话可以少说两句 共回答了21个问题 |采纳率90.5%解题思路:根据已有的知识进行分析,塑料、合成橡胶属于有机合成材料,据此解答.塑料、合成橡胶属于有机合成材料,观察选项,故选B.
点评:
本题考点: 合成材料的使用及其对人和环境的影响.
考点点评: 本题考查了常见材料的类别,完成此题,可以依据其成分进行.1年前查看全部
- 废旧物的回收利用既有利于节约资源,又有利于保护环境.某研究小组同学以废旧锌锰干电池为原料,将废旧电池含锌部分转化成ZnS
废旧物的回收利用既有利于节约资源,又有利于保护环境.某研究小组同学以废旧锌锰干电池为原料,将废旧电池含锌部分转化成ZnSO4•7H2O,含锰部分转化成纯度较高的MnO2,将NH4Cl溶液应用于化肥生产中,实验流程如下:
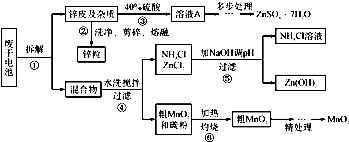
(1)操作②中所用的加热仪器应选______(填“蒸发皿”或“坩埚”).
(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe3+和Zn2+ 沉淀,请写出氨水和Fe3+反应的离子方程式:______.
(3)操作⑤是为了除去溶液中的Zn2+.已知25℃时,一些数据见下表:
由上表数据分析应调节溶液pH最好为______(填字母).NH3•H2O的Kb Zn 2+完全沉淀的pH Zn(OH)2溶于碱的pH 1.8×10-5 8.9 >11
a.9 b.10 c.11
(4)MnO2精处理的主要步骤:
步骤1:用3%H2O2和6.0mol•L-1的H2SO4的混合液将粗MnO2溶解,加热除去过量H2O2,得MnSO4溶液(含少量Fe3+ ).反应生成MnSO4的离子方程式为______.
步骤2:冷却至室温,滴加10%氨水调节pH为6,使Fe 3+ 沉淀完全,再加活性炭搅拌,抽滤.加活性炭的作用是______.
步骤3:向滤液中滴加0.5mol•L-1的Na2CO3溶液,调节pH至7,滤出沉淀、洗涤、干燥,并在空气中灼烧至黑褐色,生成MnO2.灼烧过程中反应的化学方程式为2MnCO3+O2
2MnO2+2CO2△ .2MnCO3+O2.
2MnO2+2CO2△ .
(5)查文献可知,粗MnO2的溶解还可以用盐酸或者硝酸浸泡,然后制取MnCO3固体.
①在盐酸和硝酸溶液的浓度均为5mol•L-1、体积相等和最佳浸泡时间下,浸泡温度对MnCO3产率的影响如图1,由图看出两种酸的最佳浸泡温度都在______℃左右.
②在最佳温度、最佳浸泡时间和体积相等下,酸的浓度对MnCO3产率的影响如图2,由图看出硝酸的最佳浓度应选择______mol•L-1左右.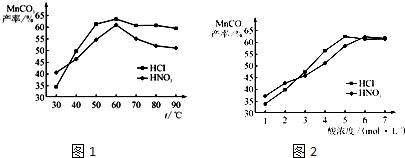
 kafeiduo1年前1
kafeiduo1年前1 -
 133521wy 共回答了18个问题
133521wy 共回答了18个问题 |采纳率88.9%解题思路:(1)根据物质的熔融需要较高的温度来回答;
(2)三价铁离子和氨水反应的实质是和氨水电离出的氢氧根离子之间的反应;
(3)根据表中的数据结合实际来回答;
(4)二氧化锰具有氧化性,能将双氧水氧化;活性碳的作用:吸附性,碳酸锰在氧气存在下,受热反应生成二氧化锰;
(5)根据碳酸锰的最高产率来确定浸泡的温度;酸锰的最高产率时的浓度即为最佳浓度.(1)物质的熔融需要较高的温度,操作②中所用的加热仪器应选坩埚,故答案为:坩埚;
(2)三价铁离子和氨水反应的离子方程式为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,故答案为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+;
(3)由上表数据知道Zn2+完全沉淀的pH为8.9,所以应调节溶液pH最好为9,除去溶液中的Zn2+,故答案为:9;
(4)将MnO2溶解,加热除去过量H2O2,得MnSO4溶液的离子方程式为:MnO2+H2O2+2H+=Mn2++2H2O+O2↑,pH为6,使Fe3+沉淀完全,再加活性炭搅拌,加活性炭的作用是吸附聚沉,有利于氢氧化铁形成较大沉淀颗粒,碳酸锰在氧气存在下,受热反应生成二氧化锰,即2MnCO3+O2
△
.
2MnO2+2CO2,
故答案为:MnO2+H2O2+2H+=Mn2++2H2O+O2↑;吸附聚沉,有利于氢氧化铁形成较大沉淀颗粒;2MnCO3+O2
△
.
2MnO2+2CO2;
(5)①根据图示内容,碳酸锰的最高产率为65%左右,可以确定浸泡的温度的温度是60℃左右,故答案为:60;
②碳酸锰的产率最高时,盐酸和硝酸的最佳浓度是6mol/L左右,故答案为:6.点评:
本题考点: 物质分离、提纯的实验方案设计.
考点点评: 本题是一道关于物质的分离提纯的实验方案设计题目,考查学生分析和解决问题的能力,难度大.1年前查看全部
- 随意丢弃的废旧电池会造成环境污染,废旧电池中的许多物质是可以回收利用的.请根据废旧电池中的物质(如右图所示),选用适当物
 随意丢弃的废旧电池会造成环境污染,废旧电池中的许多物质是可以回收利用的.请根据废旧电池中的物质(如右图所示),选用适当物质用化学式填空.
随意丢弃的废旧电池会造成环境污染,废旧电池中的许多物质是可以回收利用的.请根据废旧电池中的物质(如右图所示),选用适当物质用化学式填空.
(1)金属活动性相对较强的金属是______;
(2)在实验室制取氧气的反应中用作催化剂的是______;
(3)用作氮肥的是______;
(4)用碳棒做电极主要利用了石墨的______性. joinbin1年前1
joinbin1年前1 -
 春喜如意心 共回答了21个问题
春喜如意心 共回答了21个问题 |采纳率85.7%解题思路:(1)根据金属活动性顺序表中锌、铜排列的顺序来比较活动性的强弱;
(2)实验室制取氧气的操作中常用二氧化锰作催化剂;
(3)氮肥是指含有氮元素的化合物,可以根据化学式中含有氮元素的物质来确定;
(4)根据石墨的性质进行解答.(1)废旧电池中含有的金属有铜和锌,其中活动性较强的是锌,化学式为:Zn;
(2)废旧电池中含有的二氧化锰常用作制取氧气的催化剂,化学式为:MnO2;
(3)植物生长所必需的营养元素是氮、磷、钾,化学上把含有这些元素的物质叫做化肥.废旧电池中的氯化铵含有氮元素可作氮肥,化学式为:NH4Cl;
(4)碳棒能做电极主要利用了石墨的导电性.
故答案为:(1)Zn;(2)MnO2;(3)NH4Cl;(4)导电.点评:
本题考点: 金属活动性顺序及其应用;实验室制取氧气的反应原理;催化剂的特点与催化作用;常见化肥的种类和作用;碳单质的物理性质及用途.
考点点评: 此题是考查常见物质的性质,并通过废旧电池的回收利用的考查增加学生节约资源爱护环境的意识.1年前查看全部
- (10分)废旧印刷电路板的回收利用可实现资再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(10分)废旧印刷电路板的回收利用可实现资再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)(2分)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
(2)(2分)用A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋 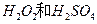 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知: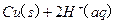 ====
====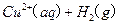
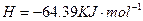
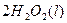 ====
====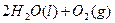
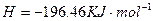
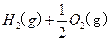 ="==="
="===" 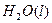
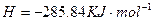
在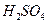 溶液中
溶液中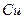 与
与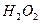 反应生成
反应生成 和
和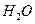 的热化方程式为 。
的热化方程式为 。
(3)(3分)控制其他条件相同,印刷电路板的金属粉末用10℅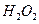 和3.0
和3.0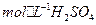 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。温度(℃) 20 30 40 50 60 70 80 铜平均溶解速率
(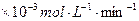 )[:.....]
)[:.....]7.34 8.01 9.25 7.98 7.24 6.73 5.76
(4)(3分)在提纯后的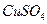 溶液中加入一定量的
溶液中加入一定量的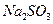 和
和 溶液,加热,生成
溶液,加热,生成 沉淀。制备
沉淀。制备 的离子方程式是 。
的离子方程式是 。 伊军1年前1
伊军1年前1 -
 爱炒面的6 共回答了22个问题
爱炒面的6 共回答了22个问题 |采纳率86.4%1年前查看全部
- 废旧金属的回收利用. 途径: 意义:
废旧金属的回收利用. 途径: 意义:
废旧金属的回收利用.
途径:
意义: 幸福村的不幸福哦1年前1
幸福村的不幸福哦1年前1 -
 江东浪子 共回答了19个问题
江东浪子 共回答了19个问题 |采纳率89.5%废旧金属的回收利用.途径:防锈和回收废旧金属都是保护金属资源的重要途径;意义:资源再利用,减少金属对污染环境.1年前查看全部
- (2013•湖北)垃圾的分类处理与回收利用,可以减少污染,节省资源.某城市环保部门为了提高宣传实效,抽样调查了部分居民小
(2013•湖北)垃圾的分类处理与回收利用,可以减少污染,节省资源.某城市环保部门为了提高宣传实效,抽样调查了部分居民小区一段时间内生活垃圾的分类情况,其相关信息如下:

根据图表解答下列问题:
(1)请将条形统计图补充完整;
(2)在抽样数据中,产生的有害垃圾共______吨;
(3)调查发现,在可回收物中塑料类垃圾占[1/5],每回收1吨塑料类垃圾可获得0.7吨二级原料.假设该城市每月产生的生活垃圾为5 000吨,且全部分类处理,那么每月回收的塑料类垃圾可以获得多少吨二级原料? 墨雪飞扬1年前1
墨雪飞扬1年前1 -
 清扫一切装嫩者 共回答了12个问题
清扫一切装嫩者 共回答了12个问题 |采纳率91.7%解题思路:(1)根据D类垃圾量和所占的百分比即可求得垃圾总数,然后乘以其所占的百分比即可求得每个小组的频数从而补全统计图;
(2)求得C组所占的百分比,即可求得C组的垃圾总量;
(3)首先求得可回收垃圾量,然后求得塑料颗粒料即可;(1)观察统计图知:D类垃圾有5吨,占10%,∴垃圾总量为5÷10%=50吨,故B类垃圾共有50×30%=15吨,故统计表为:(2)∵C组所占的百分比为:1-10%-30%-54%=6%,∴有害垃圾为:50×6%=3吨;(3)5000×54%×15×0.7=3...
点评:
本题考点: 条形统计图;扇形统计图.
考点点评: 本题考查了条形统计图的应用,读懂统计图,从统计图中得到必要的信息是解决问题的关键,条形统计图能清楚地表示出每个项目的数据.1年前查看全部
- (2014•金牛区模拟)某金属加工厂生产过程中的废液含有少量的硝酸银和硝酸铜,为回收利用资源和防止污染,该厂向废液中加入
(2014•金牛区模拟)某金属加工厂生产过程中的废液含有少量的硝酸银和硝酸铜,为回收利用资源和防止污染,该厂向废液中加入一定量的铁粉,反应停止后过滤,向滤液中加入少量的稀盐酸,无沉淀产生,则下列有关说法正确的是( )
A.滤出的固体中一定含有银和铜
B.滤出的固体中一定含有银,一定不含铁
C.滤液中一定含有硝酸亚铁,一定不含硝酸银
D.滤液中一定含有硝酸亚铁,可能含有硝酸银和硝酸铜 如梦幽幽1年前1
如梦幽幽1年前1 -
 betterstone 共回答了17个问题
betterstone 共回答了17个问题 |采纳率94.1%解题思路:在金属活动性顺序中,铁排在铜和银的前边,可以和硝酸银及硝酸铜溶液反应,生成银和铜以及硝酸亚铁,向滤液中加入少量的稀盐酸,无沉淀产生,说明滤液中没有硝酸银.由题意可知,在金属活动性顺序中,铁排在铜和银的前边,可以和硝酸银及硝酸铜溶液反应,生成银和铜以及硝酸亚铁.向滤液中加入少量的稀盐酸,无沉淀产生,说明滤液中一定没有硝酸银.滤出的固体中一定有银.滤液中一定有硝酸亚铁.由以上分析可知:
A、滤出的固体中一定含有银,可能有铜.A错误;
B、滤出的固体中一定含有银,可能含有铜和铁.B错误;
C、滤液中一定有硝酸亚铁,一定没有硝酸银.C正确;
D、滤液中一定有硝酸亚铁,一定没有硝酸银,可能含有硝酸铜.D错误.
故选:C.点评:
本题考点: 金属的化学性质.
考点点评: 本题考查的金属与混合盐溶液的反应,完成此题,可以依据金属活动性顺序以及题干提供的信息进行.所以要求同学们在平时的学习中加强基础知识的记忆,以便能够灵活应用.1年前查看全部
- (2012•崇川区一模)将垃圾分类并回收利用,既节约自然资源,又减轻环境污染.
(2012•崇川区一模)将垃圾分类并回收利用,既节约自然资源,又减轻环境污染.
(1)废玻璃、废钢筋、废旧轮胎等废垃圾中,从分类的角度属于有机回收物的是______.
(2)回收的废弃塑料中,有一类可以通过加热熔融的方法,使其重新塑造成为塑料制品,该过程发生的变化属于______变化.
(3)废家用电器、电脑等多含有金、铂等贵重金属,一般采用酸泡或火烧等方法直接回收,这是利用了金、铂的______性质.
(4)工业上常利用废铜生产硫酸铜晶体(CuSO4•5H2O).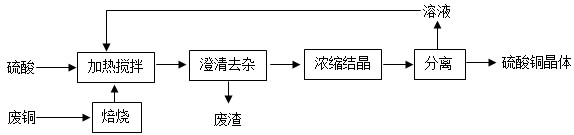
试回答以下问题:
①反应过程中加热搅拌的作用是______.
②重复利用分离所得溶液的目的是______.
③向分离所得饱和溶液中加入无水CuSO4,会析出硫酸铜晶体,这是因为______.
(5)对于不可回收的垃圾,如食物垃圾可利用微生物对其中的有机物进行分解,获得的含氮等元素的化合物,在农业生产上可用作______.垃圾可还采用焚烧工艺处理并发电,该过程中化学能转化为______能,最终转化为电能. lmlovebahx1年前1
lmlovebahx1年前1 -
 wang5651 共回答了24个问题
wang5651 共回答了24个问题 |采纳率91.7%解题思路:玻璃属于无机非金属材料,钢筋属于金属材料,废旧轮胎属于有机回收物;通过加热熔融的方法,使其重新塑造成为塑料制品,此过程没有新物质生成,因此属于物理变化;金、铂等贵重金属,化学性质稳定,一般采用酸泡或火烧等方法直接回收,这是利用了金、铂的Au、Pt通常不与酸、氧气反应的性质.反应过程中加热搅拌的作用是:加快反应速率,使氧化铜与硫酸充分反应;重复利用分离所得溶液的目的是提高原料的利用率;向分离所得饱和溶液中加入无水CuSO4,会析出硫酸铜晶体,这是因为CuSO4与H2O形成CuSO4•5H2O,溶剂减少;获得的含氮等元素的化合物,属于化肥中的氮肥,采用焚烧工艺处理并发电,该过程中化学能转化为热能,最终转化为电能.(1)玻璃属于无机非金属材料,钢筋属于金属材料,废旧轮胎属于有机回收物;故答案为:废旧轮胎
(2)通过加热熔融的方法,使其重新塑造成为塑料制品,此过程没有新物质生成,因此属于物理变化;故答案为:物理
(3)金、铂等贵重金属,化学性质稳定,一般采用酸泡或火烧等方法直接回收,这是利用了金、铂的Au、Pt通常不与酸、氧气反应的性质;故答案为:Au、Pt通常不与酸、氧气反应
(4)反应过程中加热搅拌的作用是:加快反应速率,使氧化铜与硫酸充分反应;重复利用分离所得溶液的目的是提高原料的利用率;向分离所得饱和溶液中加入无水CuSO4,会析出硫酸铜晶体,这是因为CuSO4与H2O形成CuSO4•5H2O,溶剂减少;故答案为:①加快反应速率,使之充分反应 ②提高原料的利用率;③CuSO4与H2O形成CuSO4•5H2O,溶剂减少
(5)获得的含氮等元素的化合物,属于化肥中的氮肥,采用焚烧工艺处理并发电,该过程中化学能转化为热能,最终转化为电能;故答案为:肥料;热点评:
本题考点: 纯净物和混合物的概念;金属的物理性质及用途;合金与合金的性质;化学变化和物理变化的判别;物质发生化学变化时的能量变化.
考点点评: 本考点考查了化学与材料、物理变化和化学变化的辨别、金属的性质、合金的性质等,考查的知识点比较多,要加强记忆,理解应用,本考点主要出现在选择题和填空题中.1年前查看全部
- 废旧电池集中处理的主要原因是 [ ] A、回收利用电池金属外壳
废旧电池集中处理的主要原因是 [ ]
A、回收利用电池金属外壳
B、回收利用电池中的石墨电极
C、防止电池中渗出液腐蚀其他物品
D、防止电池中汞、镉等重金属污染土壤和水源 hzxujh1年前1
hzxujh1年前1 -
 六百1 共回答了11个问题
六百1 共回答了11个问题 |采纳率100%D1年前查看全部
- (1997•广州)矿物燃料燃烧和工厂废气含有的二氧化硫,可利用吸收剂使其回收利用.有关反应的化学方程式是:
(1997•广州)矿物燃料燃烧和工厂废气含有的二氧化硫,可利用吸收剂使其回收利用.有关反应的化学方程式是:
SO2+2NH3+H2O=(NH4)2SO4(亚硫酸铵)
(NH4)2SO4+SO2+H2O=2NH4HSO3(亚硫酸氢铵)
这两个反应属分解、化合、置换、复分解反应中的______反应. 飞舞的妖蛾子1年前1
飞舞的妖蛾子1年前1 -
 hong0417 共回答了18个问题
hong0417 共回答了18个问题 |采纳率83.3%解题思路:依据四种基本反应类型进行判断分析即可(1)化合反应:指的是由两种或两种以上的物质生成一种新物质的反应;可简记为A+B=AB,即“多变一”;
(2)置换反应:一种单质和一种化合物生成另一种单质和另一种化合物的反应;可简记为A(单质)+BC=C(单质)+AB;
(3)复分解反应:由两种化合物互相交换成分,生成另外两种化合物的反应;可简记为AB+CD=AD+CB;即“化合物+化合物→新化合物+新化合物”,如氢氧化钠与盐酸反应.
(4)分解反应是由一种物质参与反应生成两种或两种以上,其变化特征是“一变多”利用此知识解决此题.两个反应都符合“多变一”的特点,属于化合反应;
故答案为:化合点评:
本题考点: 反应类型的判定.
考点点评: 要求学生能能够熟练判断四种基本化学反应类型:化合反应(多变一)、分解反应(一变多)、置换反应(单质换单质)、复分解反应(头尾结合、双交换价不变)是这类题目的考查重点.1年前查看全部
- 某金属加工厂生产过程中的废液含有少量硝酸银和硝酸镁,为回收利用资源和防止污染,该厂向废液中加入一定量的锌粉,反应停止后过
某金属加工厂生产过程中的废液含有少量硝酸银和硝酸镁,为回收利用资源和防止污染,该厂向废液中加入一定量的锌粉,反应停止后过滤,向滤出的固体中加入少量稀盐酸,无气泡产生.则下列有关说法中,正确的是( ) A.滤出的固体中一定含有银和镁,一定不含锌 B.滤出的固体中一定含有银,可能含有镁和锌 C.滤液中一定含有硝酸锌、硝酸镁,一定没有硝酸银 D.滤液中一定含有硝酸锌、硝酸镁,可能有硝酸银  gyhaosiluaa1年前1
gyhaosiluaa1年前1 -
 zmq408 共回答了20个问题
zmq408 共回答了20个问题 |采纳率85%加入锌粉与硝酸银反应生成硝酸锌,若恰好完全反应,则滤液中不含硫酸银,所以,滤液中一定含有硝酸锌;固体中一定有银,固体硝酸镁不与锌粉反应,所以滤液中一定含的硝酸镁;但向滤出的固体中加入少量稀盐酸,无气泡产生,说明锌已完全反应,由于锌量无法确定所以溶液中的银是否被完全置换出来无法确定,观察选项只有D是正确的,其它说法均错误.
故选D1年前查看全部
- 钢铁是重要的金属材料。(1)目前世界上已有50%以上的废旧钢铁得到回收利用,其目的是____(填字母序号)。A.节约金属
钢铁是重要的金属材料。
(1)目前世界上已有50%以上的废旧钢铁得到回收利用,其目的是____(填字母序号)。
A.节约金属资源B.合理开采矿物C.防止钢铁生锈
(2)高层建筑的楼顶常装有用钢铁做的避雷针,其作用是将雷电引导到地下,这说明钢铁具有良好的____性(填一物理性质)。处于楼顶的避雷针生锈了,铁生锈需要的条件是要有____(填名称)的参与。
(3)为防止水龙头生锈,可以采取的措施是____(任写一种)。
(4)将生锈的铁制品放入盛有稀盐酸的洗槽巾,观察到溶液由无色变为黄色。写出此反应的化学方程式___________________。 下辈子天使-1年前1
下辈子天使-1年前1 -
 rao841222 共回答了17个问题
rao841222 共回答了17个问题 |采纳率88.2%(1)A
(2)导电;氧气和水
(3)刷漆(或镀耐腐蚀的铬等金属、或使用合金材料等)
(4)Fe 2 O 3 +6HCl==2FeCl 3 +3H 2 O1年前查看全部
- 某金属加工厂生产过程中的废液含有少量硝酸银和硝酸铜,为回收利用资源和防止污染,该厂向废液中加入一定量的铁粉,反应停止后过
某金属加工厂生产过程中的废液含有少量硝酸银和硝酸铜,为回收利用资源和防止污染,该厂向废液中加入一定量的铁粉,反应停止后过滤,向滤出的固体中加入少量稀盐酸,无气体产生.则下列有关说法中,正确的是( )
A.滤出的固体中一定含有银和铜,一定不含铁
B.滤出的固体中一定含有银,可能含有铁和铜
C.滤液中一定有硝酸亚铁,一定没有硝酸银和硝酸铜
D.滤液中一定有硝酸亚铁,可能有硝酸银和硝酸铜 ccat0021年前1
ccat0021年前1 -
 schg010 共回答了17个问题
schg010 共回答了17个问题 |采纳率88.2%解题思路:在金属活动性顺序中,铁排在铜和银的前边,可以和硝酸银及硝酸铜溶液反应,生成银和铜以及硝酸亚铁,向滤出的固体中加入少量稀盐酸,无气体产生,说明剩余的固体中无铁.A、向滤出的固体中加入少量稀盐酸,无气体产生,说明固体中一定不含铁,铁在与硝酸银和硝酸铜反应时,首先和硝酸银反应,所以一定含有银,可能含有铜,故A错;
B、由上面的分析可知一定含有银,可能含有铜,一定不含铁,故B错;
C、铁在与硝酸银和硝酸铜反应时,都生成硝酸亚铁,所以滤液中一定含有硝酸亚铁,由于铁的量不固定,所以滤液中是否含硝酸银和硝酸铜不能确定,故C错;
D、铁在与硝酸银和硝酸铜反应时,都生成硝酸亚铁,所以滤液中一定含有硝酸亚铁,由于铁的量不固定,所以滤液中是否含硝酸银和硝酸铜不能确定,所以滤液中一定有硝酸亚铁,可能有硝酸银和硝酸,故D正确.
故选D.点评:
本题考点: 金属的化学性质.
考点点评: 本题考查的金属与混合盐溶液的反应,完成此题,可以依据金属活动性顺序以及题干提供的信息进行.所以要求同学们在平时的学习中加强基础知识的记忆,以便能够灵活应用.1年前查看全部
- 做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废
 做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废液,同学们决定利用该废液,测定一种Na2CO3溶液中溶质的质量分数,于是向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如右图所示.
做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废液,同学们决定利用该废液,测定一种Na2CO3溶液中溶质的质量分数,于是向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如右图所示.
(1)在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,说明滤液中的溶质除含有CaCl2外,还含有其它溶质,请写出它的名称或化学式.
(2)计算Na2CO3溶液中溶质的质量分数.(计算结果精确到0.1%) jhhuang1年前1
jhhuang1年前1 -
 ztw2844 共回答了15个问题
ztw2844 共回答了15个问题 |采纳率93.3%解题思路:(1)根据已知条件可知,开始时没有发现沉淀生成,说明滤液中除了CaCl2还有其它物质,由第一个实验可以推断,这种物质是稀盐酸,可以据此解答;
(2)分析图意可知,有20gNa2CO3溶液与氯化钙溶液全部反应,生成5g碳酸钙沉淀,根据反应的化学方程式,得出各物质之间的质量比,列出比例式,就可计算出20gNa2CO3溶液中溶质的质量,然后根据溶质的质量分数公式计算即可.(1)开始时没有发现沉淀生成,说明Na2CO3溶液没有和CaCl2溶液反应,根据题意可以知道废液中还含有没有反应的稀盐酸,即滤液中所含溶质除了含有CaCl2外,还有HCl;
(2)分析图意,(25g-5g)Na2CO3溶液与氯化钙溶液全部反应,生成5g碳酸钙沉淀,
设20gNa2CO3溶液中溶质的质量为x,
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 5g
[106/100=
x
5g],
解之得:x=5.3g,
则该Na2CO3溶液中溶质的质量分数为:[5.3g/25g−5g]×100%=26.5%.
答:Na2CO3溶液中溶质的质量分数为26.5%.
故答案为:(1)HCl或氯化氢;(2)26.5%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 《汉译英》翻译一下:“回收利用旧课本可以将低碳生活进行到底.
 leftear7804131年前1
leftear7804131年前1 -
 ruozhiyihao 共回答了15个问题
ruozhiyihao 共回答了15个问题 |采纳率93.3%ecycling the used books and reuse them can keep developing The low-carbon lifestyle1年前查看全部
- 订奶的玻璃瓶奶站还回收利用吗?还是就给订奶用户了?
订奶的玻璃瓶奶站还回收利用吗?还是就给订奶用户了?
如题.
那是每天喝完放进奶箱里面吗,那要万一当天没喝呢?是不是喝完了再把瓶子放回去呢,还是每天必须把瓶子放回去? xhxhbzbz1年前3
xhxhbzbz1年前3 -
 zhangcaisheng 共回答了24个问题
zhangcaisheng 共回答了24个问题 |采纳率91.7%会回收,清洗,杀毒后装瓶送奶,没有次序.1年前查看全部
- 废旧干电池中许多物质应该是可以回收利用的.某种型号干电池的剖面如右图所示.请回答下列问题:
废旧干电池中许多物质应该是可以回收利用的.某种型号干电池的剖面如右图所示.请回答下列问题:
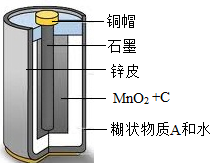
(1)提取干电池内填充物中的MnO2:取填充物溶于水、过滤、洗涤,得到黑色不溶物.再经过______的处理,即得到MnO2.
(2)取(1)中过滤得到的滤液,分为两份,一份加入烧碱溶液,加热产生一种刺激性气味的气体,该气体的水溶液pH>7,且常用作化肥,则该气体的化学式为______;另一份加入AgNO3溶液,产生白色沉淀,滴加稀HNO3沉淀不溶解,则可推知A物质的化学式为______. 覃情1年前1
覃情1年前1 -
 灞柳风雪 共回答了11个问题
灞柳风雪 共回答了11个问题 |采纳率81.8%解题思路:(1)根据填充物的组成和性质分析得到得到MnO2的方法;
(2)根据反应的现象、气体的性质,分析判断气体,根据实验的现象分析判断滤液中物质.(1)由图示可知,填充物主要是二氧化锰和碳,碳具有可燃性,利用灼烧的方法可将碳除去,得到二氧化锰;
(2)由滤液中加入烧碱溶液,加热产生一种刺激性气味的气体,该气体的水溶液pH>7,且常用作化肥,则该气体为氨气,化学式为:NH3; 同时说明滤液中含有铵盐;由另一份滤液中加入AgNO3溶液,产生白色沉淀,滴加稀HNO3沉淀不溶解,说明了滤液中含有氯离子,综合以上实验现象可知,滤液中含有氯化铵,化学式是:NH4Cl.
故答为:(1)灼烧 (2)NH3;NH4Cl.点评:
本题考点: 混合物的分离方法;常见化肥的种类和作用;常见离子的检验方法及现象.
考点点评: 本题主要考查了离子的检验,要理解和熟记常见离子的检验方法及现象1年前查看全部
- 某化工厂排除的废液中含有少量的CuSO4 和 FeSO4,为了防止污染环境,回收利用,将废液进行如下
 某化工厂排除的废液中含有少量的CuSO4 和 FeSO4,为了防止污染环境,回收利用,将废液进行如下处理,如图所示.请回答:
某化工厂排除的废液中含有少量的CuSO4 和 FeSO4,为了防止污染环境,回收利用,将废液进行如下处理,如图所示.请回答:
(1)滤液A和滤液B中含有相同的溶质名称是______.
(2)固体A与固体B中含有相同的物质是______.(填化学式)
(3)分离固体A中的物质,可以用一种最简单的物理方法是______.
(4)步骤①和②发生的化学反应属于______反应.
(5)写出步骤①或②反应中的一个化学方程式______. 挖凼凼找我1年前1
挖凼凼找我1年前1 -
 kk水如悠 共回答了12个问题
kk水如悠 共回答了12个问题 |采纳率83.3%解题思路:依据金属活动性顺序表的意义解决,活动性排在前面的金属可以把活动性比它弱的金属从其盐溶液中置换出来,氢前金属能与酸反应放出氢气,据此分析即可;由于铁的活动性比铜强,所以铁可以置换出硫酸铜中的铜同时生成硫酸亚铁,所以滤液A中含有的溶质是硫酸亚铁,固体A中含有的金属是剩余的铁和置换出的铜,固体A加入硫酸后铜的活动性在氢后铁在氢前,所以铁可以与硫酸反应生成硫酸亚铁,而铜不能,因此滤液B中含有硫酸亚铁,固体B是铜,另外金属铁能被磁铁吸引而铜不能,①和②过程发生的反应方程式为:Fe+CuSO4═Cu+FeSO4 和 Fe+H2SO4═H2↑+FeSO4,两者均是一种单质与一种化合物反应生成一种单质与一种化合物,是置换反应.
故答案为:(1)硫酸亚铁(2)Cu.(3)磁铁吸出铁粉.(4)置换.(5)Fe+CuSO4═Cu+FeSO4或Fe+H2SO4═H2↑+FeSO4.点评:
本题考点: 金属的化学性质;常见金属的特性及其应用;酸的化学性质;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题是对物质回收分离的考察题,解题的关键是充分的利用金属活动性顺序的意义,属基础性知识考查题.1年前查看全部
- 英语翻译关键词 废旧干电池的回收利用 废旧干电池的危害
 风外妖娆1年前1
风外妖娆1年前1 -
 生yy攸关会议 共回答了25个问题
生yy攸关会议 共回答了25个问题 |采纳率88%关键词 Key words
废旧干电池的回收利用 The recycling uses of dry battery
废旧干电池的危害The harms of dry battery1年前查看全部
- 发展低碳经济,保护生态环境,是我们共同的责任。下列说法中错误的是 A.研究开发二氧化碳回收利用技术,减缓大气温室效应 B
发展低碳经济,保护生态环境,是我们共同的责任。下列说法中错误的是
A.研究开发二氧化碳回收利用技术,减缓大气温室效应 B.开发风能、氢能等新能源,减少使用化石燃料 C.提倡家用汽车替代公交车 D.利用垃圾发电,变废为宝  dyui89wid5ms21年前1
dyui89wid5ms21年前1 -
 飘过123456 共回答了17个问题
飘过123456 共回答了17个问题 |采纳率76.5%C
分析:A、二氧化碳气体是造成温室效应的主要气体,减少二氧化碳就可减缓温室效应;
B、风能、氢能使用过程不产生二氧化碳,化石燃料使用中产生大量二氧化碳;
C、公交车的使用可减少对化石燃料的消耗,减少二氧化碳排放;
D、垃圾处理不当不但造成浪费还会形成污染.
A、回收二氧化碳可减少空气中二氧化碳含量,从而减缓大气温室效应,符合低碳的要求;故A正确;
B、化石燃料的使用产生大量的二氧化碳,减少它们的使用就可以减少二氧化碳排放;风能、氢能使用过程不产生二氧化碳;符合低碳理念;故B正确;
C、家用车代替公交车会大量消耗汽油,排放更多二氧化碳;不符合低碳要求;故C错误;
D、利用垃圾发电,可减少垃圾对环境靠造成的污染,也可减少化石燃料的燃烧;又环保又低碳;故D正确;
故选C.1年前查看全部
- 溶液类型题某金属加工厂生产过程中的废液中含有少量硝酸银和硝酸铜.为回收利用资源和防止污染.该厂向废液中加入一定量的锌粉.
溶液类型题
某金属加工厂生产过程中的废液中含有少量硝酸银和硝酸铜.为回收利用资源和防止污染.该厂向废液中加入一定量的锌粉.反映停止后过滤.向滤出的固体中加入少量稀盐酸.无气泡产生.则滤出的固体中一定含有____.滤液中一定含有的溶质是_____.要求理由 hua97301年前1
hua97301年前1 -
 chenxushu 共回答了14个问题
chenxushu 共回答了14个问题 |采纳率78.6%一定有Ag 溶质是zn(no3)2 锌能把铜银置换出来 ,铜能置换出银,如果有铜就一定没锌,这中美什么和锌盐反应,而铜盐和银盐不能确定1年前查看全部
- 废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
(1)写出工业上制备印刷电路板原理的离子方程式:______
(2)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是______(填字母).
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料D.直接填埋
(3)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.
写出在H2SO4溶液中Cu与H2O2 反应生成Cu2+ 和H2O的离子方程式______.
(4)控制其他条件相同,印刷电路板的金属粉末用10% H2O2和3.0mol•L-1 H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______.温度(℃) 20 30 40 50 60 70 80 铜平均溶解速率(×10-3 mol•L-1•min-1) 7.34 8.01 9.25 7.98 7.24 6.73 5.76
(5)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是2Cu2++SO32-+2Cl-+H2O
2CuCl↓+SO42-+2H+△ .2Cu2++SO32-+2Cl-+H2O.
2CuCl↓+SO42-+2H+△ . stone22581年前1
stone22581年前1 -
 厌倦oo 共回答了19个问题
厌倦oo 共回答了19个问题 |采纳率100%解题思路:(1)金属铜可以和氧化性的三价铁之间发生氧化还原反应;
(2)根据环境保护时不会产生污染环境的因素来判断;
(3)酸性环境下双氧水具有氧化性,能将金属铜氧化;
(4)根据图示信息,当温度升高时反应速率加快来回答;
(5)根据反应物和生成物来书写离子反应.(1)金属铜可以和氧化性的三价铁之间发生氧化还原反应,其离子方程式为:Cu+2Fe3+=Cu2++2Fe2+,故答案为:Cu+2Fe3+=Cu2++2Fe2+;
(2)露天焚烧会产生污染环境的气体,直接填埋时会引起水体和土壤的污染,故选:BD;
(3)金属铜在酸性环境下和双氧水的反应为:Cu+H2O2+2H+=Cu2++2H2O,故答案为:Cu+H2O2+2H+=Cu2++2H2O;
(4)根据测得不同温度下铜的平均溶解速率的数据,会发现随着温度的升高,铜的平均溶解速率,当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,因为双氧水受热易分解,导致金属铜的反应速率减慢,故答案为:H2O2分解速率加快;
(5)根据题干信息,可知发生的反应为2Cu2++SO32-+2Cl-+H2O
△
.
2CuCl↓+SO42-+2H+,故答案为:2Cu2++SO32-+2Cl-+H2O
△
.
2CuCl↓+SO42-+2H+.点评:
本题考点: 铜金属及其重要化合物的主要性质.
考点点评: 本题考查学生铜的化合物的性质,是一道综合题目,难度较大,要求学生具有分析和解决问题的能力.1年前查看全部
- (8分)废旧印刷电路板经粉碎分离能得到非金属粉末和金属粉末,回收利用可实现资源再生,减少污染。
(8分)废旧印刷电路板经粉碎分离能得到非金属粉末和金属粉末,回收利用可实现资源再生,减少污染。
⑴下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋  iMiki1年前0
iMiki1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2009•浦东新区二模)随意丢弃废旧干电池会造成环境污染,而废旧干电池中的许多物质都是可以回收利用的.请根据右图回答下
 (2009•浦东新区二模)随意丢弃废旧干电池会造成环境污染,而废旧干电池中的许多物质都是可以回收利用的.请根据右图回答下列问题:
(2009•浦东新区二模)随意丢弃废旧干电池会造成环境污染,而废旧干电池中的许多物质都是可以回收利用的.请根据右图回答下列问题:
(1)图示中的物质属于非金属单质的是______,属于氧化物的是______,属于盐的是______.(写化学式)
(2)干电池用石墨和锌皮做电极,是利用了它们的______性.
(3)取干电池内的填充物溶于水,过滤,得到NH4Cl溶液和黑色不溶物,灼烧黑色不溶物可得到MnO2,实验室制氧气常用MnO2作______剂;氯化铵溶液可用来浇花,它能为植物提供的营养元素是______. 颖syi1年前1
颖syi1年前1 -
 angie898 共回答了13个问题
angie898 共回答了13个问题 |采纳率84.6%解题思路:(1)根据单质和氧化物、盐的概念考虑;
(2)锌、石墨都具有优良的导电性来考虑本题;
(3)①根据催化剂的作用回答,可以根据化学式中含有氮元素的物质来确定.(1)单质是由同种元素组成的纯净物,氧化物是由两种元素组成,一种是氧元素的化合物,有铵根离子和酸根离子组成的化合物叫铵盐;所以碳属于非金属单质;二氧化锰属于氧化物;NH4Cl属于盐故答案为:C;MnO2;NH4Cl
(2)锌、石墨都具有优良的导电性可用作电极故答案为:导电
(3)催化剂所起的作用叫催化作用,植物生长所必需的营养元素是氮、磷、钾,化学上把含有这些元素的物质叫做化肥.废旧电池中的氯化铵含有氮元素可作氮肥.故答案为:催化;氮点评:
本题考点: 物质的简单分类;金属的物理性质及用途;酸碱盐的应用;碳单质的物理性质及用途.
考点点评: 通过废旧电池的回收利用的考查增加学生节约资源爱护环境的意识.1年前查看全部
- 随意丢弃的废旧电池会造成环境污染,废旧电池中的许多物质是可以回收利用的.请根据废旧电池中的物质(如图所示),选用适当物质
随意丢弃的废旧电池会造成环境污染,废旧电池中的许多物质是可以回收利用的.请根据废旧电池中的物质(如图所示),选用适当物质用化学式填空.
(1)金属活动性相对较强的金属是______
(2)在实验室制取氧气的反应中用作催化剂的是______;
(3)含氮元素的物质且可作氮肥的是______.
 摩托女郎1年前1
摩托女郎1年前1 -
 FTHRT 共回答了18个问题
FTHRT 共回答了18个问题 |采纳率88.9%(1)废旧电池中含有的金属有铜和锌,其中活动性较强的是锌.
故答案为为:Zn.
(2)废旧电池中含有的二氧化锰常用作制取氧气的催化剂.
故答案为:MnO 2 .
(3)植物生长所必需的营养元素是氮、磷、钾,化学上把含有这些元素的物质叫做化肥.废旧电池中的氯化铵含有氮元素可作氮肥.
故答案为:NH 4 Cl.1年前查看全部
- 在实验室中经常会得到许多的废弃物,为了对其进行回收利用,小青和他们实验小组的同学采用了以下方法.其中错误的是
在实验室中经常会得到许多的废弃物,为了对其进行回收利用,小青和他们实验小组的同学采用了以下方法.其中错误的是
( )
A.氯化钠中含有少量的碳酸钠,加入稀硫酸后蒸发结晶得到氯化钠
B.氧化铜和铜的混合物中加入过量盐酸,过滤后、洗涤后得到铜
C.制取氢气后留下的硫酸锌溶液,使其蒸发得到硫酸锌晶体
D.过氧化氢和二氧化锰混合制取氧气后的废弃物可用过滤、洗涤、烘干的方法得到二氧化锰 5oid5dys91年前1
5oid5dys91年前1 -
 松鼠00 共回答了20个问题
松鼠00 共回答了20个问题 |采纳率90%A、碳酸钠与硫酸反应生成的是硫酸钠,使氯化钠中混有硫酸钠,得不到纯净的氯化钠,故A操作错误;
B、氧化铜能与盐酸反应生成易溶于水的氯化铜,而铜不与盐酸反应,经过过滤、洗涤可以得到铜,故B操作正确;
C、制取氢气后留下的硫酸锌溶液,能通过蒸发获得硫酸锌晶体,故C操作正确;
D、二氧化锰是不溶于水的物质,可以通过过滤的方法分离出来,经过洗涤、干燥获得,故D操作正确;
故选A.1年前查看全部
- 废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.(1)下列处理
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是______(填字母).
A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋
(2)用q2O2和q2SOw的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
C得(s)+2q+(a它)=C得2+(a它)+q2(g)△q=一w.得9kJ•mol-1
2q2O2(l)=2q2O(l)+O2(g)△q=-19一.w一kJ•mol-1
q2(g)+[1/2]O2(g)=q2O(l)△q=-28w.8wkJ•mol-1
在 q2SOw溶液中C得与q2O2反应生成C得2+和q2O的热化学方程式为______.
(得)控制其他条件相同,印刷电路板的金属粉末用14%q2O2和得.4mol•L-1q2SOw的混合溶液处理,测得不同温度下铜的平均溶解速率(见表).
当温度高于w4℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______.温度(℃) 24 得4 w4 w4 一4 中4 84 铜平均溶解
速率(×14-得
mol•L-1•m五n-1)中.得w 8.41 9.2w 中.98 中.2w 一.中得 w.中一
(w)在提纯后的C得SOw溶液中加入一定量的Na2SO得和NaCl溶液,加热,生成C得Cl沉淀.制备C得Cl的离子方程式是2C得2++SO得2-+2Cl-+q2O
2C得Cl↓+SOw2-+2q+△ .2C得2++SO得2-+2Cl-+q2O.
2C得Cl↓+SOw2-+2q+△ .
(w)已知相同条件下:
wCaw(POw)得F(s)+得S五O2(s)=一Ca得(POw)2(s)+2CaS五O得(s)+S五Fw(g);△q1
2Ca得(POw)2(s)+14C(s)=Pw(g)+一CaO(s)+14CO(g);△q2
S五O2(s)+CaO(s)=CaS五O得(s);△q得
wCaw(POw)得F(s)+21S五O2(s)+得4C(s)=得Pw(g)+24CaS五O得(s)+得4CO(g)+S五Fw(g); q
用△q1、△q2和△q得表示 q,q=______.
(一)已知1g FeS2(s)完全燃烧生成放出中.1 kJ热量,FeS2燃烧反应的热化学方程式为wFeS2(s)+11O2(g)
2Fe2O得(s)+8SO2(g)△q=-得w48kJ/mol高温 .wFeS2(s)+11O2(g).
2Fe2O得(s)+8SO2(g)△q=-得w48kJ/mol高温 . 爱情这个东西1年前1
爱情这个东西1年前1 -
 ddxs204g 共回答了18个问题
ddxs204g 共回答了18个问题 |采纳率100%解题思路:(1)根据资源的回收利用可实现资源再生,并减少污染来分析;
(2)根据已知的热化学反应方程式和盖斯定律来分析Cu与H2O2反应生成Cu2+和H2O的热化学方程式;
(3)根据双氧水的性质来分析化学反应速率的变化;
(4)根据反应物与生产物来书写离子方程式;
(5)根据已知的热化学反应方程式和盖斯定律来计算;
(6)黄铁矿(主要成分为FeS2)其燃烧产物为SO2和Fe2O3,1g FeS2完全燃烧放出7.1kJ热量,480gFeS2完全燃烧放出3408kJ热量,写出热化学方程式.(一)因热裂解形成燃油及作为有机复合建筑材料的原料都可实现资源的再利用,露天焚烧能生成有害气体则污染空气,直接填埋则废旧印刷电路板中的重金属离子会污染土壤,故答案为:BD;(2)已知:①Cu(s)+25+(aq)...
点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查的知识比较散,覆盖面比较多,注重了对盖斯定律、热化学方程式、离子方程式、Ksp等高考中常考考点的考查,要熟练掌握常考知识点的解题思路和方法方法.1年前查看全部
- 开发可再生资源和清洁能源 回收利用废弃物的英文翻译
 痛彻心底1年前1
痛彻心底1年前1 -
 wonderful882 共回答了21个问题
wonderful882 共回答了21个问题 |采纳率81%开发可再生资源Development of renewable resources
清洁能源Clean Energy
回收利用废弃物Recycling of waste1年前查看全部
- 废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是__________(填字母)。
A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H 2 O 2 和H 2 SO 4 的混合溶液可溶出印刷电路板金属粉末中的铜。已知
在H 2 SO 4 溶液中Cu与H 2 O 2 反应生成Cu 2+ 和H 2 O的热化学方程式为__________________________。
(3)控制其他条件相同,印刷电路板的金属粉末用10℅H 2 O 2 和3.0mol/L H 2 SO 4 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是___________________。
(4)在提纯后的 溶液中加入一定量的
溶液中加入一定量的 溶液,加热,生成
溶液,加热,生成 沉淀。制备
沉淀。制备 的离子方程式是______________________________。
的离子方程式是______________________________。  娃哈哈m291年前1
娃哈哈m291年前1 -
 发展中的第三条腿 共回答了18个问题
发展中的第三条腿 共回答了18个问题 |采纳率77.8%1年前查看全部
- 两道有难度的数学题1.2010年,北京实行分类垃圾制.某垃圾处理场平均每天收到30车生活垃圾,平均每车垃圾中可回收利用的
两道有难度的数学题
1.2010年,北京实行分类垃圾制.某垃圾处理场平均每天收到30车生活垃圾,平均每车垃圾中可回收利用的垃圾约是三分之一吨,每天收到的可回收利用的垃圾多少吨?
2.某粮店运来大米五分之二吨,运来的面粉是大米的四分之一,运来面粉多少吨? v2ling1年前1
v2ling1年前1 -
 zenith2001 共回答了22个问题
zenith2001 共回答了22个问题 |采纳率95.5%30*1/3=10
2/5×1/4=1/101年前查看全部
- 矿物的储量有限,而且不可再生,我们必须保护金属资源并进行金属的回收利用,某兴趣小组同
矿物的储量有限,而且不可再生,我们必须保护金属资源并进行金属的回收利用,某兴趣小组同
( ) ( ),充分反映后过滤,废渣中含有( ),继续处理可以得到纯净的金属铜和硫酸亚铁固体 习习马也1年前1
习习马也1年前1 -
 外表坚强内心脆弱 共回答了26个问题
外表坚强内心脆弱 共回答了26个问题 |采纳率100%某兴趣小组同学欲从含有硫酸,硫酸亚铁和硫酸铜的废液中,回收全部金属铜,应先加入(铁 ),反映的化学方程式为(Fe+CuSO4=FeSO4+Cu ) ( Fe+H2SO4=FeSO4+H2),充分反映后过滤,废渣中含有(Cu ),继续处理可以得到纯净的金属铜和硫酸亚铁固体1年前查看全部
- ...-某化工厂排放的废水中含有一定量的氢氧化钾,为了回收利用,欲用2%的稀盐酸测定废水中的氢氧化钾含量(废水中其它杂质
...-
某化工厂排放的废水中含有一定量的氢氧化钾,为了回收利用,欲用2%的稀盐酸测定废水中的氢氧化钾含量(废水中其它杂质不与盐酸反应).试计算:
(1)用10克30%的浓盐酸配制成2%的稀盐酸,需加水多少克?
(2)取20克废水于锥形瓶中,逐滴加入2%的稀盐酸,至恰好完全反应时,消耗稀盐酸7.3克,求废水中氢氧化钾的质量分数. cyssbt1年前1
cyssbt1年前1 -
 bdvliq1x 共回答了25个问题
bdvliq1x 共回答了25个问题 |采纳率84%10g*30%=(10g+x)*2%
x=140g
需加水 140克
KOH + HCl=KCl+H2O
56 36.5
20g*y 7.3g*2%
56/(20g*y)=36.5/(7.3g*2%)
y=1.12%
废水中氢氧化钾的质量分数 1.12%1年前查看全部
- 矿物的储量有限,而且不可再生,我们必须保护金属资源并进行金属的回收利用,某兴趣小组同学欲从含有硫酸,硫酸亚铁和硫酸铜的废
矿物的储量有限,而且不可再生,我们必须保护金属资源并进行金属的回收利用,某兴趣小组同学欲从含有硫酸,硫酸亚铁和硫酸铜的废液中,回收全部金属铜,应先加入( ),反映的化学方程式为
 喜欢忧郁的眼神1年前1
喜欢忧郁的眼神1年前1 -
 jidibinglong 共回答了18个问题
jidibinglong 共回答了18个问题 |采纳率88.9%( ) ( ),充分反映后过滤,废渣中含有( ),继续处理可以得到纯净的金属铜和硫酸亚铁固体1年前查看全部
- 我们应该给垃圾分类,以便回收利用用英语怎么说?
 拉拉队1年前1
拉拉队1年前1 -
 未末青藤子 共回答了20个问题
未末青藤子 共回答了20个问题 |采纳率100%we should sort garbages to recycle them.1年前查看全部
- 在处理垃圾方面,我们应该分类收集和回收利用用英语怎么说
 刚果河畔的孤独1年前1
刚果河畔的孤独1年前1 -
 信缘XC 共回答了18个问题
信缘XC 共回答了18个问题 |采纳率88.9%In the dealing with garbage, we should be classified collection and recycling
In the treatment of waste, we should be classified collection and recycling1年前查看全部
- 谁产出建筑废弃物谁回收利用 怎么翻译 已成英语 谢谢
 浪遢酋长1年前2
浪遢酋长1年前2 -
 wdpl 共回答了14个问题
wdpl 共回答了14个问题 |采纳率78.6%The factories ,which discard the waste,must make use of them by their own.1年前查看全部
- 能够多次融化成形,回收利用,能够减少环境污染的是()A金属B纸C玻璃D塑料 大气的臭氧层多人体是有益的
能够多次融化成形,回收利用,能够减少环境污染的是()A金属B纸C玻璃D塑料 大气的臭氧层多人体是有益的
因为它能A吸收红外线B吸收紫外线C防止酸雨
从源头上解决垃圾问题的办法是A填埋B焚烧C减少数量 最想解答的问号1年前1
最想解答的问号1年前1 -
 scg3vs 共回答了7个问题
scg3vs 共回答了7个问题 |采纳率85.7%能够多次融化成形,回收利用,能够减少环境污染的是()A金属B纸C玻璃D塑料
选择C
大气的臭氧层多人体是有益的 因为它能A吸收红外线B吸收紫外线C防止酸雨
选择B,臭氧的主要作用是吸收紫外线,
从源头上解决垃圾问题的办法是A填埋B焚烧C减少数量
选择C,注意是从源头上
希望对你有所帮助,亲!1年前查看全部
- 一个垃圾处理场平均每天收到80车生活垃圾,平均每车垃圾中可回收利用垃圾约是3分之1吨.18天共收到多少吨可回收利用的垃圾
一个垃圾处理场平均每天收到80车生活垃圾,平均每车垃圾中可回收利用垃圾约是3分之1吨.18天共收到多少吨可回收利用的垃圾?
 hyz100105511年前1
hyz100105511年前1 -
 油炸生活 共回答了25个问题
油炸生活 共回答了25个问题 |采纳率80%80*1/3*18=480吨1年前查看全部
- 高锰酸钾制氧气与双氧水制氧气那个的产物更易回收利用
 来富是头猪1年前3
来富是头猪1年前3 -
 yubing998 共回答了22个问题
yubing998 共回答了22个问题 |采纳率90.9%当然是高锰酸钾了,双氧水往往分解不充分,高锰酸钾分解到无氧气释放时,残渣中只有二氧化锰和锰酸钾,把残渣溶于水,过滤,干燥得到纯净的二氧化锰,把溶液蒸干得到纯净的锰酸钾,好好学化学,加油1年前查看全部
- 随着计算机的日益普及和不断更新,废电脑材料的回收利用逐渐引起人们的重视.写出电脑配件中两种常用材料的类别(在表中填“金属
随着计算机的日益普及和不断更新,废电脑材料的回收利用逐渐引起人们的重视.写出电脑配件中两种常用材料的类别(在表中填“金属材料”、“矿物质材料”、“高分子合成材料”)
材料 铜 塑料 类别 ______ ______  含元优子1年前1
含元优子1年前1 -
 200y 共回答了14个问题
200y 共回答了14个问题 |采纳率64.3%解题思路:根据已有的知识进行分析解答,铜属于金属元素,塑料属于有机合成材料,据此解答.铜属于金属材料,塑料属于有机高分子合成材料,故填:金属材料,高分子合成材料.
点评:
本题考点: 金属材料及其应用;合成材料的使用及其对人和环境的影响.
考点点评: 本题考查了常见材料的类别,完成此题,可以依据已有的知识进行.1年前查看全部
- 垃圾处理场平均每天收70吨垃圾平均每天垃圾中可回收利用的垃圾约占3分之115天收到多少吨可回收利用的垃圾
垃圾处理场平均每天收70吨垃圾平均每天垃圾中可回收利用的垃圾约占3分之115天收到多少吨可回收利用的垃圾
是3分之1,15天回收可利用多少吨垃圾 ki3s7uz1年前2
ki3s7uz1年前2 -
 qg034j 共回答了23个问题
qg034j 共回答了23个问题 |采纳率91.3%70*15*1/3=3501年前查看全部
- (2012•河西区一模)某同学探究发酸性干电池内黑色固体物质的组成并回收利用,实验过程如下图所示.
(2012•河西区一模)某同学探究发酸性干电池内黑色固体物质的组成并回收利用,实验过程如下图所示.
下列有关叙述正确的是( )
A.①、②、③、④中玻璃棒均起到搅拌作用
B.取少许②所得滤液于试管中,滴加硝酸银溶液,产生白色沉淀,可推知黑色固体中含有氯化钠
C.取少许②所得滤液于试管中,滴加氢氧化钠溶液,试管口处湿润的红色石蕊试纸未变蓝色,可推知黑色固体中不含铵盐
D.取少许④所得滤渣于试管中,现象如图⑤所示,可推知黑色固体中含有MnO2 4g5fg1年前1
4g5fg1年前1 -
 yuzhiwei1985 共回答了24个问题
yuzhiwei1985 共回答了24个问题 |采纳率91.7%解题思路:A.根据玻璃棒的作用判断;
B.能和硝酸银反应生成白色沉淀的物质中含有氯元素;
C.向含有铵根离子的溶液中滴加氢氧化钠溶液,如果不加热,则氮元素以一水合氨形式存在;
D.二氧化锰是黑色固体,能作双氧水的催化剂.A.②、③中玻璃棒起引流作用,故A错误;
B.能和硝酸银反应生成白色沉淀,说明滤液中含有氯离子,而不能确定黑色固体中含氯化钠,故B错误;
C.向含有铵根离子的溶液中滴加氢氧化钠溶液,如果不加热,则氮元素以一水合氨形式存在,所以取少许②所得滤液于试管中,滴加氢氧化钠溶液,试管口处湿润的红色石蕊试纸未变蓝色,不能推知黑色固体中不含铵盐,故C错误;
D.二氧化锰是黑色固体,能作双氧水的催化剂,灼烧后的滤渣能加快双氧水分解产生氧气,所以黑色固体是二氧化锰,故D正确;
故选D.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了基本实验操作及离子的检验,难度不大,熟悉中学阶段常见阴阳离子的检验方法,如氯离子、硫酸根离子、钠离子、钾离子、铵根离子等.1年前查看全部
- 一个垃圾处理场平均每天收到70吨生活垃圾,其中可回收利用的垃圾占三分之一.15天收到的垃圾中有多少吨可回收利用?
 pvc1231年前1
pvc1231年前1 -
 yonghuminga 共回答了24个问题
yonghuminga 共回答了24个问题 |采纳率87.5%(70×3分之1)×15
=70×(3分之1×15)
=70×5
=350(吨)
答:15天收到的垃圾中有350吨可以回收利用!1年前查看全部
- 一个垃圾处理场平均每天收到70吨生活垃圾,其中可回收利用的垃圾占3分之1.15天收到的垃圾中有多少可以
 ppod1年前3
ppod1年前3 -
 wangyutao22 共回答了18个问题
wangyutao22 共回答了18个问题 |采纳率88.9%(70×3分之1)×15
=70×(3分之1×15)
=70×5
=350(吨)
答:15天收到的垃圾中有350吨可以回收利用!1年前查看全部
- 『汉译英』求翻译一下:回收利用旧课本可以节约纸张减少浪费.这句话能不能表述成英语的两句话!
 蓝魂幻影1年前1
蓝魂幻影1年前1 -
 julialina 共回答了21个问题
julialina 共回答了21个问题 |采纳率81%可以
If the second-hand text-books can be recycled and put it into use again, people can avoid wasting moneyand in this waythey savthe paper
Recyclethe second-hand text-books and money and paper can be saved1年前查看全部
- 保护金属资源的有效途径是①防止金属腐蚀②回收利用废旧金属③禁止生产易造成金属腐蚀的化工产品④合理有效地开采矿物⑤寻找金属
保护金属资源的有效途径是
①防止金属腐蚀
②回收利用废旧金属
③禁止生产易造成金属腐蚀的化工产品
④合理有效地开采矿物
⑤寻找金属的代用品A.①②③ B.①②③④⑤ C.②④⑤ D.①②④⑤  km8lyf1a1年前1
km8lyf1a1年前1 -
 over718 共回答了16个问题
over718 共回答了16个问题 |采纳率93.8%D
常见的保护金属资源的有效途径有防止金属腐蚀、回收利用废旧金属、合理有效地开采矿物、寻找金属的代用品等,不能因为保护金属资源就禁止生产易造成金属腐蚀的化工产品。1年前查看全部
- 废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
(1)写出工业上制备印刷电路板原理的离子方程式:______
(2)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是______(填字母).
A.热裂解形成燃油B.露天焚烧
C.作为有机复合建筑材料的原料D.直接填埋
(3)用H 2 O 2 和H 2 SO 4 的混合溶液可溶出印刷电路板金属粉末中的铜.
写出在H 2 SO 4 溶液中Cu与H 2 O 2 反应生成Cu 2+ 和H 2 O的离子方程式______.
(4)控制其他条件相同,印刷电路板的金属粉末用10% H 2 O 2 和3.0mol•L -1 H 2 SO 4 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______.温度(℃) 20 30 40 50 60 70 80 铜平均溶解速率(×10 -3 mol•L -1 •min -1 ) 7.34 8.01 9.25 7.98 7.24 6.73 5.76
(5)在提纯后的CuSO 4 溶液中加入一定量的Na 2 SO 3 和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是______. 天行罪星1年前1
天行罪星1年前1 -
 妫子 共回答了21个问题
妫子 共回答了21个问题 |采纳率90.5%(1)金属铜可以和氧化性的三价铁之间发生氧化还原反应,其离子方程式为:Cu+2Fe 3+ =Cu 2+ +2Fe 2+ ,故答案为:Cu+2Fe 3+ =Cu 2+ +2Fe 2+ ;
(2)露天焚烧会产生污染环境的气体,直接填埋时会引起水体和土壤的污染,故选:BD;
(3)金属铜在酸性环境下和双氧水的反应为:Cu+H 2 O 2 +2H + =Cu 2+ +2H 2 O,故答案为:Cu+H 2 O 2 +2H + =Cu 2+ +2H 2 O;
(4)根据测得不同温度下铜的平均溶解速率的数据,会发现随着温度的升高,铜的平均溶解速率,当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,因为双氧水受热易分解,导致金属铜的反应速率减慢,故答案为:H 2 O 2 分解速率加快;
(5)根据题干信息,可知发生的反应为2Cu 2+ +SO 3 2- +2Cl - H 2 O
△
.
2CuCl↓+SO 4 2- +2H + ,故答案为:2Cu 2+ +SO 3 2- +2Cl - +H 2 O
△
.
2CuCl↓+SO 4 2- +2H + .1年前查看全部
- 某硫酸厂废气中SO2的回收利用方案如图所示.下列说法不正确的是( )
某硫酸厂废气中SO2的回收利用方案如图所示.下列说法不正确的是( )
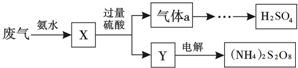
A. X可能含有2种盐
B. a是SO3
C. Y可能含有(NH4)2SO4
D. (NH4)2S2O8中S的化合价不可能为+7 离去以后1年前1
离去以后1年前1 -
 珂雅 共回答了24个问题
珂雅 共回答了24个问题 |采纳率83.3%解题思路:二氧化硫与氨水反应生成X,则X中含有亚硫酸铵或亚硫酸氢铵中的一种或两种盐,在X中加过量硫酸生成硫酸铵或硫酸氢铵和二氧化硫气体,二氧化硫经氧化、水合等科的硫酸,气体a为二氧化硫,Y为硫酸铵;电解硫酸铵溶液可得(NH4)2S2O8;A.X中含有亚硫酸铵或亚硫酸氢铵中的一种或两种盐,故A正确;
B.气体a为二氧化硫,故B错误;
C.X中加过量硫酸生成硫酸铵或硫酸氢铵,故C正确;
D.S的最高化合价是+6,不可能为+7,故D正确;故选B.点评:
本题考点: 二氧化硫的污染及治理.
考点点评: 本题考查了二氧化硫的污染与防治、元素化合物等问题,把握物质的主要性质是关键,难度一般.1年前查看全部
大家在问
- 1如图所示3×4的正方形网格中,网格线的交点称为格点。已知A、B是两格点,如果C也是图中的格点,且使得△ABC为等腰三角形
- 2下列各组的两个式子是同类项的一组是:(A)ab^2和ab^2c (B)-x^2y^3和x^3y^2 (C)5和-6^2
- 3用描述法表示集合(2.4.6.8)要有分析过程.急,
- 4含有丹字的成语。这个成语的意思是用来写字的。
- 5英语的谜语I have two eyes,one mouth..And I have two legs,I like s
- 6(一)Directions:This part is to test your ability in doing pra
- 7已知三角形ABC~三角形AED,其中角B=角AED,AD=5cm,BD7cm,AC=8cm,求AE的长和三角形ABC与三
- 8去年圣诞节你去了哪里?英文翻译
- 9】】】】如图,ABCD-A1B1C1D1是长方体,O是B1D1的中点,直线A1C交平面AB1D1于点M,则证明A,M,O
- 10求作文800字有个手艺出众的老木匠准备退休,他告诉老板,说要离开建筑行业,回家与妻子儿女享受天伦之乐。
- 11检查视力时,要求眼睛与视力表之间的距离为5m.现在视力表AB对面3m处竖有一面镜子MN,那么检查视力时( )
- 12什么颜色和什么颜色叠加到一起是紫色
- 13下列物质中氧原子数目于4.8gO2中氧原子数一定相等的是() A.6.72LCO B.6.6gCO2 C.16gSO3
- 14日记题材、题目,要新颖好写的(这个很重要),大概能写200~300字这样的题材
- 15arctanx/3的导数是多少?