孔雀石制备五水硫酸铜孔雀石里含有铁,硅杂质,先加稀硫酸,后二氧化硅,硫酸铜,二氧化碳,后来加双氧水得到溶液A,加氧化铜过
 冰可鲜橙2022-10-04 11:39:541条回答
冰可鲜橙2022-10-04 11:39:541条回答孔雀石里含有铁,硅杂质,先加稀硫酸,后二氧化硅,硫酸铜,二氧化碳,后来加双氧水得到溶液A,加氧化铜过滤,得到氢氧化铁,和溶液B,溶液B得到五水硫酸铜.
问题是给加入双氧水后日哦溶液发生的化学方程式,后来溶液B加氧化铜的化学方程式,

已提交,审核后显示!提交回复
共1条回复
 喜欢网上做 共回答了13个问题
喜欢网上做 共回答了13个问题 |采纳率76.9%- 2FeSO4 + H2SO4 + H2O2 -----> Fe2(SO4)3 + 2H2O
CuO + H2SO4 -----> CuSO4 + H2O - 1年前
相关推荐
- 写出孔雀石Cu2(OH)2CO3加热分解的化学方程式
 joytwan1年前1
joytwan1年前1 -
 日翻南昌航院 共回答了20个问题
日翻南昌航院 共回答了20个问题 |采纳率85%分解成氧化铜,水,和二氧化铜1年前查看全部
- 孔雀石的住要成分cuco3*cu(oh)2.某同学设计从孔雀石中冶炼铜的方案如下:
孔雀石的住要成分cuco3*cu(oh)2.某同学设计从孔雀石中冶炼铜的方案如下:
1:将孔雀石粉碎后加过量的稀硫酸
2:将反应后的混合物过滤
3:想滤液中加入一种金属粉末
根据上述实验方案,试回答:
(1)第三部假如的金属粉末可以是什么?说明理由
(2)设计从滤液中获得铜的另为一种方案
请问第二步骤要过滤什么.为什么、 画船听雨1年前2
画船听雨1年前2 -
 ntac 共回答了18个问题
ntac 共回答了18个问题 |采纳率88.9%1,可以是铝、锌、铁等比铜活泼的金属,原理是置换反应.;2,可以用石墨作阳极,铜棒作阴极,滤液作电解液.电解池电解制得.3,过滤是为了过滤残渣,得到清液,便于实验观察.1年前查看全部
- (2013•黄石)小红同学在实验室发现了一块绿色的孔雀石样品,他查阅资料知道其成分为Cu2(OH)2CO3.小红以孔雀石
(2013•黄石)小红同学在实验室发现了一块绿色的孔雀石样品,他查阅资料知道其成分为Cu2(OH)2CO3.小红以孔雀石(不考虑其中的杂质参与反应)为原料设计了两种途径制取铜,其制备流程如图所示(部分生成物略去),请回答下列问题:
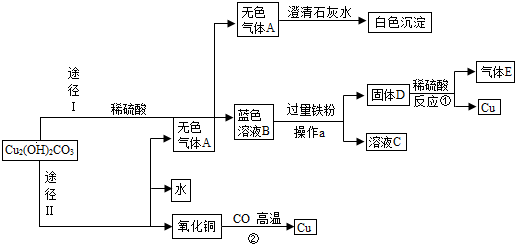
(1)无色气体A是______(填化学式),固体D的成分为______(用符号表示).
(2)写出下列反应的化学方程式:反应①______;反应②:CuO+CO
Cu+CO2高温 .CuO+CO.
Cu+CO2高温 .
(3)操作a的名称是______;
(4)小红同学设计的两种途径中,你认为途径______更合理(填“Ⅰ”或“Ⅱ”),其理由是______. 游戏币借支1年前1
游戏币借支1年前1 -
 我的密码 共回答了22个问题
我的密码 共回答了22个问题 |采纳率86.4%解题思路:(1)依据碱式碳酸铜加热后的产物或与硫酸反应的产物分析解答;
(2)依据过量的铁与硫酸铜反应后的固体情况找到反应的情况;
(3)依据该操作后会得到固体和液体分析解答;
(4)依据两种途径的过程中的有关问题分析解答;(1)由于碱式碳酸铜加热会生成氧化铜、水和二氧化碳,与硫酸反应会生成水、硫酸铜和二氧化碳,所以A是二氧化碳,B是蓝色的硫酸铜,硫酸铜能与铁反应生成硫酸亚铁和铜,而由于铁过量,所以固体是铁和铜;
(2)由于硫酸不能铜与反应但能与铁反应生成硫酸亚铁和氢气,所以①的反应方程式为Fe+H2SO4=FeSO4+H2↑;反应②是氧化铜和一氧化碳的反应,方程式为CuO+CO
△
.
Cu+CO2;
(3)操作a分离的是固体和液体,所以该过程是过滤操作;
(4)小红同学设计的两种途径中途径I更合理,因为途径Ⅱ需要加热,消耗较多的能量;
故答案为:(1)CO2;Fe、Cu;(2)Fe+H2SO4=FeSO4+H2↑;CuO+CO
△
.
Cu+CO2;(3)过滤;(4)Ⅰ;途径Ⅱ需要加热,消耗较多的能量;点评:
本题考点: 物质的鉴别、推断;常见气体的检验与除杂方法;酸的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了利用碱式碳酸铜制备铜,完成此题,可以依据物质的性质进行.1年前查看全部
- 下列物质主要成分的化学式:毒重石,孔雀石,绿柱石,萤石,天青石
 fingering1161年前1
fingering1161年前1 -
 海南时讯笔记本 共回答了15个问题
海南时讯笔记本 共回答了15个问题 |采纳率73.3%BaSO4,Cu(OH)2*CuCO3,Be3Al2(SiO3)6,CaF2,SrSO41年前查看全部
- 某科研小组采集到两种铜矿标本,经地理老师辨认为孔雀石和石青,老实说其化学组成均可表示为xCuCO3.yCu(OH)2,属
某科研小组采集到两种铜矿标本,经地理老师辨认为孔雀石和石青,老实说其化学组成均可表示为xCuCO3.yCu(OH)2,属于天然碳酸类铜矿.
(1)为了准确测定两种矿石的化学组成,该小组同学将两种矿石分别与足量盐酸反应,孔雀石耗用的盐酸的物质的量与生成的二氧化碳的物质的量之比是4:1,石青则为3:1.
请确定他们的化学组成.
(2)现取两份等质量的两种矿石的混合物样品,一份加入过量盐酸,生成二氧化碳6.6克;对另一份样品加热使其完全分解,得到氧化铜20克,则混合物中孔雀石和石青的物质的量之比为?
..好的会加分...急用!)
解决一个问是一个问... 向往飞的鱼1年前1
向往飞的鱼1年前1 -
 MaxGage 共回答了19个问题
MaxGage 共回答了19个问题 |采纳率78.9%第一问
孔雀石 x为1 y为1 也就是1:1
因为一个碳酸铜 生成1co2 需要2hcl 氢氧化铜 消耗2hcl 对比可知
石青 2:1
第二问
6.6gco2 说明为0.15mol cuco3 氧化铜20g 说明0.25mol cu 所以结果是cuco3 :cu(oh)2 为3:2 结合第一问 所以是1:11年前查看全部
- (2003•宿迁)某学生在报刊上看到:孔雀石(主要成份为Cu2(OH)2CO3,假设其它成份不参加反应)在熊熊燃烧的木碳
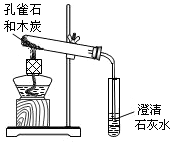 (2003•宿迁)某学生在报刊上看到:孔雀石(主要成份为Cu2(OH)2CO3,假设其它成份不参加反应)在熊熊燃烧的木碳上灼烧后,灰烬中有红色固体生成.他想在实验室利用右图装置来验证此现象,将少量孔雀石和木碳粉放入试管,然后加热.试回答下列问题
(2003•宿迁)某学生在报刊上看到:孔雀石(主要成份为Cu2(OH)2CO3,假设其它成份不参加反应)在熊熊燃烧的木碳上灼烧后,灰烬中有红色固体生成.他想在实验室利用右图装置来验证此现象,将少量孔雀石和木碳粉放入试管,然后加热.试回答下列问题
①写出试管内可能发生的化学反应方程式(最少写两个)Cu2(OH)2CO3
2CuO+H2O+CO2↑△ .Cu2(OH)2CO3;
2CuO+H2O+CO2↑△ .2CuO+C
2Cu+CO2↑△ .2CuO+C.
2Cu+CO2↑△ .
②实验结束取出导气管后,空气往往会进入试管使红色物质又被氧化.为防止空气进入,对此装置可以改进的措施为______
③请你猜想一下导出的气体中可能含有的有害气体是______,为防止它污染环境一般用______方法进行处理. herodayu1年前1
herodayu1年前1 -
 爱的好痛苦 共回答了15个问题
爱的好痛苦 共回答了15个问题 |采纳率100%解题思路:①根据碱式碳酸铜受热分解成氧化铜、水、二氧化碳,碳再与氧化铜发生反应;②在导管上接上橡皮管,放上止水夹,再考虑;①碱式碳酸铜受热分解生成氧化铜、水、二氧化碳,用观察法配平,二氧化碳后面标上上升符号,反应条件是加热,所以方程式是Cu2(OH)2CO3
△
.
2CuO+H2O+CO2↑;碳与氧化铜反应生成铜和二氧化碳,用观察法配平,二氧化碳后面标上上升符号,反应条件是加热,所以方程式是:2CuO+C
△
.
2Cu+CO2↑;
②在导管上接上橡皮管,放上止水夹,先将导管从石灰水中取出,然后用弹簧夹夹紧胶皮管,让产物自然冷却;
③碳与氧化铜反应生成铜和二氧化碳,碳再与二氧化碳反应生成一氧化碳,所以导出的气体中可能含有的有害气体是一氧化碳;为防止它污染环境一般用点燃的方法,将一氧化碳转化为二氧化碳,所以防止它污染环境一般用点燃的方法进行处理.
故答案为:①Cu2(OH)2CO3
△
.
2CuO+H2O+CO2↑;2CuO+C
△
.
2Cu+CO2↑;②在导管上接上橡皮管,放上止水夹,先将导管从石灰水中取出,然后用弹簧夹夹紧胶皮管,让产物自然冷却;③一氧化碳;点燃.点评:
本题考点: 盐的化学性质;碳的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题考查了碱式碳酸铜加热分解产物水与二氧化碳、氧化铜,碳和氧化铜黑色混合物成分反应的生成物,还需要熟悉化学方程式的书写注意事项.1年前查看全部
- 孔雀石炼铜的方程式
 joy_hee1年前1
joy_hee1年前1 -
 钱的前身2 共回答了20个问题
钱的前身2 共回答了20个问题 |采纳率100%Cu2(OH)2CO3=2CuO+H20+CO2
条件为加热.
CuO再和某些还原剂反应(如CO,H2)生成铜.
CuO+CO=CO2+Cu
或者你可以直接写成
Cu2(OH)2CO3=2Cu+02+H20+CO2
注意要打气体向上符号.1年前查看全部
- 绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.孔雀石主要含Cu2(OH)2CO3,还含有Fe、Si的化合物
绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.孔雀石主要含Cu2(OH)2CO3,还含有Fe、Si的化合物(含硅物质不溶于酸).某工厂设计以孔雀石、废铁屑、稀硫酸等为原料制备CuSO4•5H2O与FeSO4•7H2O,流程如图所示.请回答下列问题:
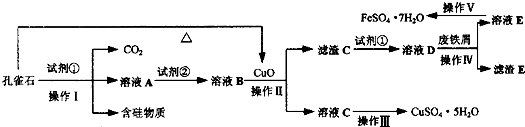
(1)试剂①为______,孔雀石与试剂①反应的主要化学方程式为______.
(2)溶液A中的金属阳离子除Cu2+外,还可能含有Fe2+和Fe3+中的一种或两种,检验Fe3+存在的最佳试剂为______.为了确定溶液A中是否含有Fe2+并测定其浓度大小,设计以下实验方案:
①配制溶液.取A溶液10mL,配成250mL,配制溶液所需的仪器除了量筒、烧杯、玻璃棒、胶头滴管外,还需要的仪器是______.
②滴定检测.取25mL所配溶液于锥形瓶中,滴加a mol•L-1酸性KMnO4溶液V ml时,溶液恰好变为淡紫色且半分钟内不变色.
③分析计算.A溶液中是否含有Fe2+?______(填“含有”或“不含有”,若填“不含有”,则下列空白不用填写),则A溶液中C(Fe2+)为______.
(3)从以下试剂中选择:试剂②为______(填序号),选择原因是______.
a.KMnO4
b.(NH4)2S
c.H2O2
d.Cl2
(4)已知滤渣C为Fe(OH)3,试解释向溶液B中加入CuO的作用:______.
(5)由溶液C获得CuSO4•5H2O,需要经过加热蒸发、______、过滤等操作.除烧杯、漏斗外,过滤操作还需用到另一玻璃仪器,该仪器在此操作中的主要作用是______.
(6)操作V得到的绿矾晶体用少量液体洗涤,该液体可以是______(填序号).
A.冰水
B.蒸馏水
C.80%酒精溶液
D.CCl4. adslwlqq1年前1
adslwlqq1年前1 -
 sdrg2 共回答了19个问题
sdrg2 共回答了19个问题 |采纳率89.5%解题思路:(1)根据反应物、生成物以及反应原理书写反应方程式;
(2)检验Fe3+存在的最佳试剂为KSCN溶液;
①配250mL溶液还需要250ml容量瓶;
③原溶液被稀释后,Cu2+呈浅蓝色,Fe3+呈浅黄色,两者都不与高锰酸钾溶液反应,所以滴定时参加反应的离子是Fe2+,故A溶液中含有Fe2+;
(3)能将Fe2+氧化而又不引入新杂质;
(4)加入试剂和酸反应调节溶液PH使铁离子全部沉淀,加入的试剂不能引入新的杂质;
(5)从溶液中要析出晶体,采用冷却结晶法;过滤时要用到玻璃棒引流;
(6)洗涤晶体表面的杂质离子时,既不能使主要物质减少,又能把杂质离子洗去.(1)制备的产物为硫酸盐,碱式碳酸铜又不溶于水,试剂①为稀硫酸,反应方程式为:Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑,
故答案为:稀硫酸;Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑;
(2)检验Fe3+选择KSCN溶液,Fe3+遇KSCN溶液变血红色,故答案为:KSCN溶液;
①一般用量筒量取溶液,在烧杯中溶解(可用量筒量取水),用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀.
所以需要的仪器为:托盘天平、药匙、烧杯、筒量(可用、也可不用)、玻璃棒、250ml容量瓶、胶头滴管.
故答案为:250ml容量瓶;
③原溶液被稀释后,Cu2+呈浅蓝色,Fe3+呈浅黄色,两者都不与高锰酸钾溶液反应,所以滴定时参加反应的离子是Fe2+,故A溶液中含有Fe2+;由关系式:5Fe2+~MnO4-,可得A溶液中C(Fe2+)为=5aVmol/L,故答案为:含有;5aVmol/L;
(3)为使Fe2+、Fe3+一块沉淀,要加氧化剂将Fe2+氧化而又不引入新杂质,选H2O2,故答案为:C;既能将Fe2+氧化而又不引入新杂质;
(4)氧化铜和酸反应调节溶液PH使铁离子全部沉淀,加入的试剂不能引入新的杂质,故答案为:除去多余的稀硫酸,调节溶液的PH;
(5)从溶液中要析出晶体,采用冷却结晶法;过滤时要用到玻璃棒引流,故答案为:冷却结晶;引流;
(6)冰水和蒸馏水均使晶体损耗较多,四氯化碳不能洗去杂质,故选80%酒精溶液,故答案为:C.点评:
本题考点: 铜金属及其重要化合物的主要性质;硫酸亚铁的制备.
考点点评: 本题考查金属及其重要化合物的主要性质,题目难度中等,注意(4)中沉淀铁离子时不能引入新的杂质.1年前查看全部
- (2012•天津)某同学在实验室发现了一块绿色的孔雀石标本,他查阅资料知其主要成分是Cu 2 (OH) 2 CO 3 .
(2012•天津)某同学在实验室发现了一块绿色的孔雀石标本,他查阅资料知其主要成分是Cu 2 (OH) 2 CO 3 .他以Cu 2 (OH) 2 CO 3 为原料制取铜,实验流程如下图所示(部分生成物已省略)
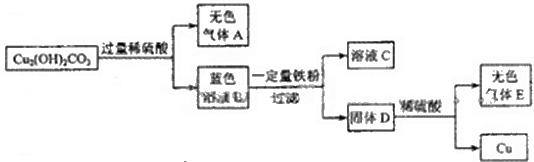
(1)溶液C中所含的溶质是 。
(2)固体D中所含的物质是 。
(3)Cu 2 (OH) 2 CO 3 与稀硫酸发生的化学方程式为 。 袅烟小dd1年前1
袅烟小dd1年前1 -
 痞子郭晶晶 共回答了17个问题
痞子郭晶晶 共回答了17个问题 |采纳率94.1%(1)FeSO 4 (2)Fe、Cu(3)Cu 2 (OH) 2 CO 3 +2H 2 SO 4 ═2CuSO 4 +CO 2 ↑+3H 2 O
根据题干提供的信息结合物质的性质进行分析,碱式碳酸铜能与硫酸反应生成硫酸铜、水和二氧化碳,硫酸铜能与铁反应生成硫酸亚铁和铜,溶液C是硫酸亚铁,固体D能与硫酸反应生成无色气体E,则D中除了含有铜,还含有铁。(1)铁能与硫酸铜反应生成硫酸亚铁和铜,得到的固体D与硫酸反应后有气体生成,说明有铁剩余,硫酸铜全部参加反应,溶液C中只含有硫酸亚铁;(2)得到的固体D与硫酸反应后有气体生成,说明有铁剩余,铁与硫酸铜反应生成了铜,固体D中含有铁和铜;(3)碱式碳酸铜能与稀硫酸反应生成硫酸铜、水和二氧化碳。1年前查看全部
- 已知碱式碳酸铜[Cu 2 (OH) 2 CO 3 ]受热易分解、能与酸反应。孔雀石主要含Cu 2 (OH) 2 CO 3
已知碱式碳酸铜[Cu 2 (OH) 2 CO 3 ]受热易分解、能与酸反应。孔雀石主要含Cu 2 (OH) 2 CO 3 ,还含少量Fe、Si的化合物。某学校化学研究小组以孔雀石为原料制备CuSO 4 ·5H 2 O的流程如下: 
请回答下列问题:
(1)流程中,X的化学式是 ;由溶液B获得CuSO 4 ·5H 2 O,需要经过加热蒸发、 、过滤等操作。
(2)若通过置换反应由溶液B制备金属铜,反应的化学方程式是 。 若选用下列物质与氧化铜反应制备铜,写出反应的化学方程式:
①选用非金属单质 :
②选用氧化物 。
(3)工业上用焦炭在高温电炉中还原SiO 2 :可得到含有少量杂质的Si和CO,反应的化学方程式是 , 该反应类型为 。 vv铺王掌柜1年前1
vv铺王掌柜1年前1 -
 dday1944 共回答了19个问题
dday1944 共回答了19个问题 |采纳率94.7%1年前查看全部
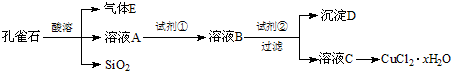
- 氯化铜晶体(CuCl2•xH2O)是重要的化工原料,可用作催化剂、消毒剂等.用孔雀石[主要含Cu2(OH)2CO3,还含
氯化铜晶体(CuCl2•xH2O)是重要的化工原料,可用作催化剂、消毒剂等.用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如图:
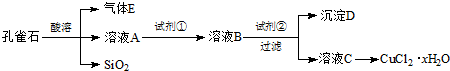
已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
(1)若溶液A含有的金属离子有Cu2+、Fe2+、Fe3+,则试剂①可选用______(填字母).Fe3+ Cu2+ Fe2+ 开始沉淀的pH 2.7 5.4 8.1 沉淀完全的pH 3.7 6.9 9.6
A.Ca(ClO)2B.H2O2C.HNO3D.KMnO4
反应的离子方程式为______.
(2)加入试剂②的目的是调节pH至a,a的范围是______.由溶液C获得CuCl2•xH2O,包含4个基本实验操作,这4个基本实验操作依次是______、过滤、用无水乙醇洗涤和风干等操作,使用无水乙醇代替水进行洗涤的主要原因是______.
(3)为了测定制得的氯化铜晶体(CuCl2•xH2O)中x值,有同学设计了如下实验方案:称取一定质量的晶体加热使其失去结晶水,称量所得无水CuCl2的质量.该方案存在的问题是______. kimikojun1年前1
kimikojun1年前1 -
 xphxc 共回答了18个问题
xphxc 共回答了18个问题 |采纳率88.9%解题思路:(1)由工艺流程转化关系可知,实现由溶液A至溶液B转化,目的是将Fe2+氧化为Fe3+,试剂①应为氧化剂,且不能引入新的杂质;(2)由工艺流程转化关系可知,试剂②应为调节溶液pH值,使Fe3+转化为Fe(OH)3,除去Fe3+,不能沉淀Cu2+,结合金属离子从开始沉淀到沉淀完全时溶液的pH选择pH的范围.由溶液到晶体需要蒸发浓缩、冷却结晶、过滤、洗涤等.使用无水乙醇代替水进行洗涤,防止CuCl2•xH2O晶体溶解损失;(3)CuCl2•xH2O晶体加热时会发生水解.(1)由工艺流程转化关系可知,实现由溶液A至溶液B转化,目的是将Fe2+氧化为Fe3+,试剂①应为氧化剂,且不能引入新的杂质,都是氧化剂,但是只有双氧水是绿色氧化剂,不会引进杂质离子,其余三个都会引进杂质离子,双氧水和亚铁离子之间的反应为:2Fe2++2H++H2O2=2Fe3++2H2O,
故答案为:B;2Fe2++2H++H2O2=2Fe3++2H2O;
(2)由工艺流程转化关系可知,试剂②应为调节溶液pH值,使Fe3+转化为Fe(OH)3,除去Fe3+,不能沉淀Cu2+,由金属离子从开始沉淀到沉淀完全时溶液的pH可知,Fe3+从pH=2.7开始沉淀,在pH=3.7沉淀完全,Cu2+从pH=5.4开始沉淀,所以应该可知pH范围为3.7~5.4.由溶液获得CuCl2•xH2O晶体需要蒸发浓缩、冷却结晶、过滤、洗涤等.氯化铜易溶于水,使用无水乙醇代替水进行洗涤,防止CuCl2•xH2O晶体溶解损失.
故答案为:3.7~5.4;蒸发浓缩、冷却结晶;防止CuCl2•xH2O晶体溶解损失.
(3)①CuCl2•xH2O晶体加热时会发生水解CuCl2+2H2O⇌Cu(OH)2+2HCl,有HCl气体放出,CuCl2质量偏小,测得x值偏大.
故答案为:CuCl2•xH2O晶体加热时会发生水解.点评:
本题考点: 铜金属及其重要化合物的主要性质;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查学生阅读获取信息能力、对工艺流程理解与实验条件控制、实验方案的评价、化学计算、物质分离提纯除杂等有关实验操作以及在新情境下综合运用知识解决问题的能力.题目难度中等,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,注意基础知识的全面掌握.1年前查看全部
- (2014•宜宾)已知农业上可用石灰乳与硫酸铜溶液配制成具有杀菌作用的波尔多液.如图呈现的是一种以石灰石和孔雀石[主要成
(2014•宜宾)已知农业上可用石灰乳与硫酸铜溶液配制成具有杀菌作用的波尔多液.如图呈现的是一种以石灰石和孔雀石[主要成分为Cu2(OH)2CO3]为原料制备波尔多液的流程.其中A、C、D均属氧化物.(注:不考虑矿石中的主要成分外的其他杂质的反应,部分反应产物已略去)
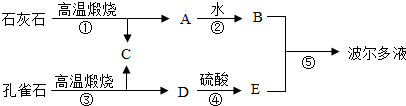
请回答下列问题:
(1)写出物质的化学式:A______;B______;C______;D______.
(2)写出反应③的化学反应方程式Cu2(OH)2CO3
2CuO+CO2↑+H2O高温 .Cu2(OH)2CO3.
2CuO+CO2↑+H2O高温 . raywayne1年前1
raywayne1年前1 -
 玉米味月饼 共回答了13个问题
玉米味月饼 共回答了13个问题 |采纳率100%解题思路:石灰石高温煅烧生成二氧化碳和氧化钙;孔雀石高温煅烧生成二氧化碳、水和氧化铜;所以C是二氧化碳,A是氧化钙,氧化钙与水反应生成B氢氧化钙;又由于D可以与硫酸反应,所以D为氧化铜,E为硫酸铜.(1)石灰石高温煅烧生成二氧化碳和氧化钙;孔雀石高温煅烧生成二氧化碳、水和氧化铜;所以C是二氧化碳,A是氧化钙,氧化钙与水反应生成B氢氧化钙;又由于D可以与硫酸反应,所以D为氧化铜,E为硫酸铜;
(2)孔雀石高温煅烧生成二氧化碳、水和氧化铜,方程式为:Cu2(OH)2CO3
高温
.
2CuO+CO2↑+H2O.
故答案为:(1)CaO;Ca(OH)2;CO2;CuO;
(2)Cu2(OH)2CO3
高温
.
2CuO+CO2↑+H2O.点评:
本题考点: 物质的鉴别、推断;盐的化学性质;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题为框图式物质推断题,完成此题,关键是找准解题突破口,直接得出有关物质的化学式,然后根据框图结合物质的性质,得出其他物质的化学式.1年前查看全部
- 孔雀石受热分解
 吉木乃1年前1
吉木乃1年前1 -
 我是虹虹呀 共回答了24个问题
我是虹虹呀 共回答了24个问题 |采纳率91.7%孔雀石是主要化学成分为Cu2(OH)2CO3
受热分解
Cu2(OH)2CO3=2CuO+CO2+H2O1年前查看全部
- 在一定条件下可实现下图所示的物质之间的变化.明矾的主要成分是KAl(SO4)2•12H2O,孔雀石的主要成分是CuCO3
在一定条件下可实现下图所示的物质之间的变化.明矾的主要成分是KAl(SO4)2•12H2O,孔雀石的主要成分是CuCO3•Cu(OH)2(碱式碳酸铜),受热易分解.其中B是两性氧化物,D是一种金属单质,F是一种气体,G是一种黑色金属氧化物.
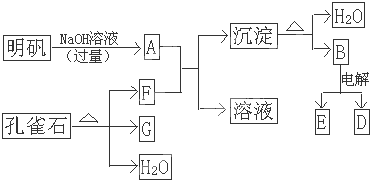
(1)写出A-G的化学式:
A是______;B是______;D是______;E是______;F是______;G是______.
(2)写出明矾溶液和过量NaOH溶液反应的离子方程式______;
(3)金属单质D可以跟黑色的金属氧化物G在高温下反应生成另一种金属单质,写出该反应的方程式2Al+3CuO
Al2O3+3Cu高温 .2Al+3CuO.
Al2O3+3Cu高温 . fl4183880041年前1
fl4183880041年前1 -
 luohuafeixu 共回答了15个问题
luohuafeixu 共回答了15个问题 |采纳率86.7%解题思路:明矾的主要成分是KAl(SO4)2•12H2O,与过量碱反应生成A,CuCO3•Cu(OH)2(碱式碳酸铜),受热易分解生成CuO、CO2、H2O,G是一种黑色金属氧化物,G为CuO,F是一种气体,A+F反应生成沉淀,则A为KAlO2,F为CO2,B是两性氧化物,B为Al2O3,B电解生成D,D是一种金属单质,则D为Al,E为O2,然后结合单质及化合物的性质来解答.明矾的主要成分是KAl(SO4)2•12H2O,与过量碱反应生成A,CuCO3•Cu(OH)2(碱式碳酸铜),受热易分解生成CuO、CO2、H2O,G是一种黑色金属氧化物,G为CuO,F是一种气体,A+F反应生成沉淀,则A为KAlO2,F为CO2,B是两性氧化物,B为Al2O3,B电解生成D,D是一种金属单质,则D为Al,E为O2,
(1)由上述分析可知,A为KAlO2,B为Al2O3,D为Al,E为O2,F为CO2,G为CuO,故答案为:KAlO2;Al2O3;Al;O2;CO2;CuO;
(2)明矾溶液和过量NaOH溶液反应的离子方程式为Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O;
(3)D可以跟黑色的金属氧化物G在高温下反应生成另一种金属单质为Cu,该反应为2Al+3CuO
高温
.
Al2O3+3Cu,故答案为:2Al+3CuO
高温
.
Al2O3+3Cu.点评:
本题考点: 无机物的推断;常见金属元素的单质及其化合物的综合应用.
考点点评: 本题考查无机物的推断,物质的推断是解答本题的关键,注意结合物质的性质及转化关系来分析解答,题目难度不大.1年前查看全部
- 写出下列物质的主要成分的化学式1.铜绿、铜锈、孔雀石2.干冰3.金刚石4.石墨5.盐酸6.生石灰7.熟石灰、消石灰、澄清
写出下列物质的主要成分的化学式
1.铜绿、铜锈、孔雀石
2.干冰
3.金刚石
4.石墨
5.盐酸
6.生石灰
7.熟石灰、消石灰、澄清石灰水
8.大理石,石灰石
9.纯碱
10.食盐
11.水垢,鸡蛋壳
12.赤铁矿
13.磁铁矿
14.铁锈
15.天然气,沼气
16.酒精(乙醇)
17.醋酸(乙酸)
18.胆矾,蓝矾
19.明矾
20.草木灰
21.水煤气
22.煤气 gaoxingme1年前3
gaoxingme1年前3 -
 lang222143 共回答了13个问题
lang222143 共回答了13个问题 |采纳率100%cu(oh)2co3
co2
c
c
hcl
cao
ca(oh)2
caco3
na2co3
nacl
caco3
fe2o3
fe3o4
fe2o3*xH2o
ch4
c2h5oh
ch3cooh
cuso4*5h2o
kal(so4)2*12h2o
k2co3
co和h2
co1年前查看全部
- 加热孔雀石的反应的类型
 we15861年前1
we15861年前1 -
 32372456 共回答了22个问题
32372456 共回答了22个问题 |采纳率90.9%分解反应,非氧化还原反应
Cu2(OH)2CO3=(△)2CuO+H2O+CO2↑
Cu2(OH)2CO3也可写为CuCO3·Cu(OH)21年前查看全部
- 孔雀石加热分解的化学方程式,最后的水,要加气体符号嘛?
孔雀石加热分解的化学方程式,最后的水,要加气体符号嘛?
孔雀石和盐酸反应的水呢?要加气体符号嘛? luick20031年前4
luick20031年前4 -
 slslxa 共回答了19个问题
slslxa 共回答了19个问题 |采纳率89.5%很高兴为你解答问题
Cu2(OH)2CO3=点燃=2CuO+CO2↑+H2O
孔雀石和盐酸反应的水不要加气体符号1年前查看全部
- 孔雀石的主要成分是碱式碳酸铜 化学式为Cu2(OH)2CO3,碱式碳酸铜受热会分解生成二氧化碳等三种氧化物,
孔雀石的主要成分是碱式碳酸铜 化学式为Cu2(OH)2CO3,碱式碳酸铜受热会分解生成二氧化碳等三种氧化物,
(1)写出该反应的化学方程式Cu2(OH)2CO3
2CuO+H2O+CO2↑△ .Cu2(OH)2CO3
2CuO+H2O+CO2↑△ .
(2)某同学为测定一种孔雀石中铜元素的质量分数,称取20g样品充分加热后,生成 1.1gCO2(假设样品中杂质加热不分解,不溶于水也不与酸反应).请你帮助计算该样品中铜元素的质量分数.(请写出计算过程)
(3)该同学向上述剩余固体混合物中加入一定质量分数的稀硫酸,恰好完全反应时,共用去稀硫酸96g,试计算反应后所得溶液中溶质的质量分数,(请写出计算过程) yinjifu1年前1
yinjifu1年前1 -
 aa咻咻 共回答了19个问题
aa咻咻 共回答了19个问题 |采纳率89.5%解题思路:(1)氧化物为一种元素与氧元素组成的只含两种元素且含氧元素的化合物,根据碱式碳酸铜的组成元素,判断分解所生成的氧化物,写出反应的化学方程式;
(2)根据反应的化学方程式,可由生成二氧化碳的质量计算出反应生成氧化铜的质量,再利用该化合物中铜元素的质量分数,计算样品中铜元素质量,从而求得样品中铜元素的质量分数;
(3)碱式碳酸铜完全分解后的固体为氧化铜,氧化铜能与硫酸反应生成硫酸铜,利用氧化铜的质量计算恰好完全反应所生成硫酸铜的质量,并利用质量守恒定律求得反应后所得溶液的质量,即可解得反应后所得溶液中溶质的质量分数.(1)根据碱式碳酸铜受热会分解生成二氧化碳等三种氧化物,可知分解生成氧化铜、水、二氧化碳,该反应的化学方程式为Cu2(OH)2CO3
△
.
2CuO+H2O+CO2↑;
故答案为:Cu2(OH)2CO3
△
.
2CuO+H2O+CO2↑;
(2)设反应生成的CuO的质量为x
Cu2(OH)2CO3
△
.
2CuO+H2O+CO2↑
160 44
x1.1g
[160/x=
44
1.1g]
x=4g
4g×[64/64+16]×100%=3.2g
样品中铜元素的质量分数=[3.2g/20g]×100%=16%
(3)设反应生成的CuSO4的质量为y
CuO+H2SO4═CuSO4+H2O
80160
4gy
[80/4g=
160
y]
y=8g
所得溶液的溶质质量分数=[8g/4g+96g]×100%=8%
答:(2)样品中铜元素的质量分数为16%;(3)所得溶液的溶质质量分数为8%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 由于样品中杂质加热不分解,不溶于水也不与酸反应,因此根据质量守恒定律,与硫酸反应后所得溶液质量=参加反应氧化铜的质量+所加稀硫酸的质量.1年前查看全部
- (7分)孔雀石主要成分是碱式碳酸铜[Cu 2 (OH) 2 CO 3 ],绿色并具有浓淡的条状花纹(见右图),是矿物中最
(7分)孔雀石主要成分是碱式碳酸铜[Cu 2 (OH) 2 CO 3 ],绿色并具有浓淡的条状花纹(见右图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料。某校课外小组同学欲在实验室验证碱式碳酸铜制铜的反应原理。

【查阅资料】
1.Cu 2 (OH) 2 CO 3 2CuO+CO 2 + H 2 O
2CuO+CO 2 + H 2 O
2CuO+C 2Cu + CO 2 ↑
2Cu + CO 2 ↑
2.CuO为黑色固体,化学性质和氧化铁相似。
(1)实验l:加热分解碱式碳酸铜。装置如图所示。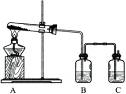
①A中固体的变化为____。
②欲证明反应后有水生成,B中所盛试剂为____。
③反应结束时的操作应该是____,理由是____。
(2)实验2:木炭和氧化铜反应。
将木炭粉末和氧化铜粉末混合均匀,放进试管加热,反应后将试管中的粉末倒出,有铜生成,还有少量黑色粉末剩余。该小组同学设计方案验证黑色粉末的成分。
【作出猜想】
剩余黑色粉末可能是:①氧化铜;②木炭;③木炭和氧化铜。
【实验验证】填写下表。
(3)某同学探究在实际反应中,木炭和氧化铜反应生成铜时反应物的最佳质量比,设计方案如下:实验操作及现象 实验结论 该黑色粉末为氧化铜
上述设计方案的主要研究方法是__________________。配方l 配方2 配方3 配方4 木炭质量(g) 0.4 0.5 0.6 0.7 氧化铜质量(g) 8 8 8 8  lxchzh1年前1
lxchzh1年前1 -
 Surgicenter 共回答了9个问题
Surgicenter 共回答了9个问题 |采纳率100%(1)①绿色固体变黑 ②浓硫酸
③先将试管上的胶塞拔下(或先将两个试剂瓶上的胶塞拔出),再撤酒精灯防止水倒流,引起试管炸裂
(2)取少量剩余粉末于试管中加入稀硫酸,黑色粉末全部溶解,红色固体剩余,溶液变为蓝色。(2分)
(3)对比
1年前查看全部
- 已知孔雀石加热分解的三种分解产物是氧化铜,水和二氧化碳.请根据以上信息,试用化学方程式
已知孔雀石加热分解的三种分解产物是氧化铜,水和二氧化碳.请根据以上信息,试用化学方程式
已知孔雀石加热分解的三种分解产物是氧化铜,水和二氧化碳.请根据以上信息,试用化学方程式表示铜的腐蚀变化
孔雀石化学式Cu2(OH)2CO3 娃哈哈bn491年前0
娃哈哈bn491年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2010•潍坊)已知碱式碳酸铜[Cu2(OH)2CO3]受热易分解、能与酸反应.孔雀石主要含Cu2(OH)2CO3,还
(2010•潍坊)已知碱式碳酸铜[Cu2(OH)2CO3]受热易分解、能与酸反应.孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物.某学校化学研究小组以孔雀石为原料制备CuSO4•5H2O的流程如下:
请回答下列问题:
(1)流程中,X的化学式是______;由溶液B获得CuSO4•5H2O,需要经过加热蒸发、______、过滤等操作.
(2)若通过置换反应由溶液B制备金属铜,反应的化学方程式是______.
若选用下列物质与氧化铜反应制备铜,写出反应的化学方程式:
①选用非金属单质2CuO+C
2Cu+CO2↑或CuO+H2高温 .
Cu+H2O△ .2CuO+C:
2Cu+CO2↑或CuO+H2高温 .
Cu+H2O△ .
②选用氧化物CuO+CO
Cu+CO2△ .CuO+CO.
Cu+CO2△ .
(3)工业上用焦炭在高温电炉中还原SiO:可得到含有少量杂质的Si和CO,反应的化学方程式是SiO2+2C
Si+2CO↑高温 .SiO2+2C,该反应类型为______.
Si+2CO↑高温 . seaman8209131年前1
seaman8209131年前1 -
 小小豆芽菜 共回答了18个问题
小小豆芽菜 共回答了18个问题 |采纳率77.8%解题思路:本题属于一道综合性的解答题,包括的知识点比较多,由孔雀石制备五水硫酸铜的原理不难知道X为稀硫酸,因为需要利用重结晶技术对制备的五水硫酸铜进行提纯,所以离不开冷却结晶.根据金属活性顺序及氧化-还原反应和置换反应原理不难解决金属铜的制备和还原氧化硅的问题.(1)①孔雀石的主要成分是Cu2(OH)2CO3,其主要杂质为Fe、Si等,是以铁盐或者铁的氧化物形式存在,而S是以二氧化硅的形式存在,二氧化硅不溶解于酸.所以用稀硫酸浸取孔雀石粉,其中铜、铁以硫酸盐的形式进入溶液,SiO2作为不溶物而分离出来.故X的化学式为:H2SO4;
②溶液中残留的少量Fe3+及其它可溶性杂质则可利用CuSO4•5H2O的溶解度随温度升高而增大的性质,通过重结晶的方法除去.重结晶后,杂质留在母液中,从而达到纯化CuSO4•5H2O的目的.故答案为:冷却结晶或结晶.
(2)在金属活动顺序中,金属的位置越靠前它的活动性就越强;排在氢前面的金属能与酸反应放出氢气,而且位置在前的金属可以把位于其后的金属从他们的盐溶液中置换出来.故答案为:Zn+CuSO4═ZnSO4+Cu(其他合理答案也可).
利用非金属单质碳或氢气及一氧化碳与氧化铜反应制铜,利用的是它们的还原性质,在这一反应中,氧化铜中的氧被夺去,铜被还原出来,所以答案为:
①2CuO+C
高温
.
2Cu+CO2↑或CuO+H2
△
.
Cu+H2O
②CuO+CO
△
.
Cu+CO2
(3)SiO2与C在高温下的反应原理和氧化铜与碳的反应原理相同,是还原反应.因为SiO2是氧化物,但同时它又是化合物的一种,所以他们之间的反应又是置换反应.故答案为:SiO2+2C
高温
.
Si+2CO↑,置换反应.点评:
本题考点: 探究金属铜的冶炼原理;金属活动性顺序及其应用;碳、一氧化碳、氢气还原氧化铜实验;酸的化学性质;化学式的书写及意义;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题属于一道制备物质的综合性解答题,解此类问题关键要抓住主要知识点.比如本题,一要清楚由孔雀石制备五水硫酸铜的原理和过程,二要牢牢掌握金属活性顺序,此外还要明白还原反应和置换反应的原理.总之,同学们在学习中要善于综合运用所学知识,理清知识之间的联系和区别.1年前查看全部
- (2007•海淀区二模)孔雀石[碱式碳酸铜,主要成分是Cu2(OH)2CO3]具有色彩浓淡的条状花纹(如图),是矿物中最
 (2007•海淀区二模)孔雀石[碱式碳酸铜,主要成分是Cu2(OH)2CO3]具有色彩浓淡的条状花纹(如图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料.
(2007•海淀区二模)孔雀石[碱式碳酸铜,主要成分是Cu2(OH)2CO3]具有色彩浓淡的条状花纹(如图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料.
冶炼铜的反应原理为:Cu(OH)2CO3
2CuO+CO2↑+H2O△ .
2CuO+C
2Cu+CO2↑高温 .
某校课外小组同学在实验室验证上述反应.
(1)加热分解碱式碳酸铜,生成氧化铜.装置如下图所示.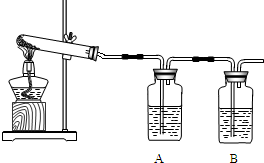
①瓶A中盛有的试剂是______,用来吸收水,证明碱式碳酸铜加热分解的产物中有水.
②瓶B中盛有的试剂是澄清石灰水,用来______,反应的化学方程式为______.
③反应结束,熄灭酒精灯前,应______.
(2)木炭和氧化铜反应,生成铜.
将木炭粉末和氧化铜粉末混合均匀,放进试管,加热充分反应.将试管中的粉末倒出,有铜生成,还有少量黑色粉末剩余.该小组同学设计方案验证黑色粉末的成分.
查阅资料:部分内容如下:木炭和氧化铜都是黑色粉末.氧化铜与稀硫酸反应生成硫酸铜,木炭与稀硫酸不反应.
猜想与验证:操作和药品 现象 分析和结论 方案Ⅰ 取少量剩余黑色粉末,充分灼烧 ①______________
________________原剩余黑色粉末是
氧化铜方案Ⅱ ②_______________
__________________③_____________
_________________原剩余黑色粉末是
氧化铜
(3)某同学探究在实际反应中,木炭和氧化铜反应生成铜时反应物的最佳质量比.设计方案如下:
上述设计方案的主要研究方法是______.配方1 配方2 配方3 配方4 木炭质量(g) 0.4 0.5 0.6 0.7 氧化铜质量(g) 8 8 8 8  匠心之心1年前1
匠心之心1年前1 -
 诃郎 共回答了28个问题
诃郎 共回答了28个问题 |采纳率85.7%解题思路:(1)①吸收水的液体一般是浓硫酸②检验有二氧化碳存在一般是澄清石灰水
(2)证明黑色固体是氧化铜而不是碳可以从碳和氧化铜两方面考虑
(3)找到最佳质量比可通过一种物质的量不变,而改变另一种物质进行探究(1)A装置是吸收水分的装置因其为液体,故是浓硫酸;而检验二氧化碳的存在一般用到的是澄清石灰水.
故应填:①浓硫酸②碱式碳酸铜加热分解的产物中有二氧化碳,Ca(OH)2+CO2=CaCO3↓+H2O
(2)此实验分别是从两方面入手的①是给固体加热固体无变化说明没有碳,因为碳在加热时会生成二氧化碳;而加入稀硫酸全部反应,说明无碳,因为碳不与硫酸反应,氧化铜与硫酸反应生成硫酸铜的溶液.
故应填①黑色粉末没有变化(黑色粉末灼烧前后质量没有变化等) ②取少量剩余黑色粉末,加入足量稀硫酸,充分反应
③黑色粉末消失,生成蓝色溶液
(3)找到最佳质量比可通过一种物质的量不变,而改变另一种物质进行探究.故可填:具有控制变量的意识(使用控制变量法等)点评:
本题考点: 探究金属铜的冶炼原理;实验探究物质的组成成分以及含量;实验步骤的探究;二氧化碳的检验和验满;碳的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题考查了碱式碳酸铜加热分解产物水与二氧化碳的鉴定,并进行了黑色固体混合物成分的鉴定,碳和氧化铜黑色混合物成分的鉴定可采用加热或加入酸的方式进行,还进行了反应物最佳质量比的鉴定.1年前查看全部
- 一道初三化学试题孔雀石的主要成分是Cu2(OH)2CO3,也可以表示成CuCO3•Cu(OH)2。与孔雀石相
一道初三化学试题
孔雀石的主要成分是Cu2(OH)2CO3,也可以表示成CuCO3•Cu(OH)2。
与孔雀石相似,还有许多矿物可用xCuCO3•yCu(OH)2(x、y都是正整数)表示,石青就是其中的一种。
为了验证石青的组成成分,他们设计了如下实验,请你共同参与探究。 实验操作 实验现象 结论
步骤l取少量石青样品置于大试管中加入足量稀硫酸 (1)产生大量气体
(2)溶液呈蓝色 (1)石青中含有 离子
(2)石青中含有 离子
步骤2
取少量石青样品置于大试管中加热 (1)残留固体呈 ▲ 色
(2)大试管内壁 ▲
石青加热易分解
【反思与拓展】
①确定步骤1中产生气体成分的实验方法是 ▲ 。
②根据以上探究,只要测定出参加反应的石青的质量、生成的氧化铜的质量和 ▲ 的质量,就可确定石青的化学式(即确定x、y的值)。
③防止金属锈蚀的方法很多,如制成不锈钢、在金属表面 ▲ (任写一种方法)。
我自己有答案,谁能告诉我为什么这样写啊?
表有些乱,重打一下
实验操作 实验现象 结论
取少量石青样品置于大试管中加入足量稀硫酸 (1)产生大量气体 (1)石青中含有 ___ 离子
(2)溶液呈蓝色 (2)石青中含有 ____离子
取少量石青样品置于大试管中加热 1)残留固体呈_____色 石青加热易分解
2)大试管内壁 _____ wu心伤害1年前4
wu心伤害1年前4 -
 细雨看斜阳 共回答了17个问题
细雨看斜阳 共回答了17个问题 |采纳率88.2%我把分析过程说一下,看对你有无帮助!
题目已经说了,石青的组成也是类似孔雀石的,而且也类似xCuCO3•yCu(OH)2。加硫酸,就会生成CO2和CuSO4。验证有CO2的当然是将生成气体通入澄清石灰水啦。石青加热分解,水分和二氧化碳都会逸出,残留物是CuO。
根据原始质量、CuO质量和CO2的量(体积或物质的量)就能判断石青样本中,x、y的值了。列方程的问题,不多说啦...1年前查看全部
- 孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成均可表示为:xCuCO3•yCu(OH)2(x,y
孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成均可表示为:xCuCO3•yCu(OH)2(x,y为正整数,且x≤2,y≤2)
孔雀石和石青分别与过量的盐酸反应时,孔雀石耗用的盐酸中氯化氢的质量与生成CO2的质量之比为36.5:11;石青则为109.5:44,经测算可知,它们的化学组成分别为孔雀石( ),石青( ). shunshun06241年前1
shunshun06241年前1 -
 笑得精彩 共回答了18个问题
笑得精彩 共回答了18个问题 |采纳率83.3%孔雀石与石青与盐酸反应的化学方程式通式:
xCuCO3•yCu(OH)2 +(2x+2y) HCl = (x+y)CuCl2 + xCO2 +(x+2y) H2O
对孔雀石有:[(2x+2y)*36.5]/44x = 36.5:11 得:x:y = 1:1
对石青有:[(2x+2y)*36.5]/44x = 109.5:44 得:x:y = 2:1
所以孔雀石是:CuCO3•Cu(OH)2
石青是:2CuO3•Cu(OH)21年前查看全部
- 某校化学兴趣小组在老师指导下探究孔雀石(一种铜矿石)的组成元素.他们取50克孔雀
某校化学兴趣小组在老师指导下探究孔雀石(一种铜矿石)的组成元素.他们取50克孔雀
某校化学兴趣小组在老师指导下探究孔雀石(一种铜矿石)的组成元素.他们取50克孔雀石粉末,在密闭容器中加热,观察到孔雀石分解过程中有水和能使澄清石灰水变浑浊的气体产生,绿色的孔雀石逐渐变为黑色粉末(假设:孔雀石中的杂质不反应,生成的二氧化碳全部被石灰水吸收).在此过程中他们测定了五次,相关数据如下表:
测定次数x05生成沉淀的质量(g)x05生成水的质量(g)
1x055x050.9
2x0510x051.8
3x05Xx052.7
4x0520x053.6
5x0520x053.6
(3)实验最终生成二氧化碳的质量是多少克(写出计算过程)? 77所求1年前1
77所求1年前1 -
 yizuiqianri 共回答了14个问题
yizuiqianri 共回答了14个问题 |采纳率92.9%设二氧化碳质量为x
02+CU2(OH)2CO3----(点燃)2CU+CO2+H2O
然后带进去
44 18
—=—
x 3.6g
解出来x=2.2g1年前查看全部
- 非诚勿扰CuFeS2Cu5FeS4Cu2SCuCO3 Cu(OH)2(孔雀石)上述所列的铜的化合物中,铜的质量百分含量最
非诚勿扰
CuFeS2
Cu5FeS4
Cu2S
CuCO3 Cu(OH)2(孔雀石)
上述所列的铜的化合物中,铜的质量百分含量最高的是
写出计算过程(不要一般方法 就是相对分子量一比 要简单方法) lillersmo1年前1
lillersmo1年前1 -
 ayablear 共回答了28个问题
ayablear 共回答了28个问题 |采纳率100%首先你写成这样
CuFeS2
CuFe0.2S0.8
CuS0.5
Cu(CO3)0.5 (OH)
你看哪个最多呢~一目了然~1年前查看全部
- 孔雀石怎么读?受热分解的方程式是什么,明矾与氢氧化钠溶液反应生成什么?
 飞花轻似梦791年前1
飞花轻似梦791年前1 -
 jhkhask 共回答了12个问题
jhkhask 共回答了12个问题 |采纳率91.7%Cu2[CO3](OH)2碱式碳酸铜
Cu2[CO3](OH)2→2CuO +CO2 +H2O
2KAl(SO4)2+8NaOH→2NaAlO2+4H2O+K2SO4+3Na2SO4 氢氧化钠过
2KAl(SO4)2+6NaOH→2Al(OH)3+K2SO4+3Na2SO4 氢氧化钠少1年前查看全部
- 孔雀石和石青到底化学组成是什么?
 私语11年前2
私语11年前2 -
 叶子820 共回答了14个问题
叶子820 共回答了14个问题 |采纳率92.9%孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:
xCuCO3·yCu(OH)2
孔雀石、石青的区别只是x、y的值不同
孔雀石 CuCO3·Cu(OH)2
石青 2CuCO3· Cu(OH)21年前查看全部
- 简单的化学题目 ``急啊``1、某科学家在森林中发现一块孔雀石(碱式碳酸铜).某次森林大火后,孔雀石不见了,但在余烬中发
简单的化学题目 ``急啊``
1、某科学家在森林中发现一块孔雀石(碱式碳酸铜).某次森林大火后,孔雀石不见了,但在余烬中发现了光亮的红色固体,它是____,用化学方程式表示红色固体产生的原因______.
2、C在氧气中燃烧反应后所得气体有哪几种情况?写出每中情况中各气体的化学式.
3、写出碳在高温时还原氧化铜的化学方程式,并计算要使80克氧化铜完全还原,需要碳的质量至少是多少? 浮云飘散21年前1
浮云飘散21年前1 -
 千寻琥珀 共回答了12个问题
千寻琥珀 共回答了12个问题 |采纳率91.7%1、某科学家在森林中发现一块孔雀石(碱式碳酸铜).某次森林大火后,孔雀石不见了,但在余烬中发现了光亮的红色固体,它是__Cu__,用化学方程式表示红色固体产生的原因___Cu2(OH)2CO3=加热=2CuO+CO2+H2O__
C+2CuO=高温==CO2+2Cu_.
2、C在氧气中燃烧反应后所得气体有哪几种情况?写出每中情况中各气体的化学式.
氧气不足时生成一氧化碳CO,氧气足量时生成二氧化碳CO2.
3、写出碳在高温时还原氧化铜的化学方程式,并计算要使80克氧化铜完全还原,需要碳的质量至少是多少?
C+2CuO=高温==CO2+2Cu
12---160
x----80
x=6g1年前查看全部
- 有一种矿石称为孔雀石,已知他的主要化学成分时“碱式碳酸铜”现向你提供少量碱式碳酸铜固体、部分实验器材和所需试剂,完成下表
有一种矿石称为孔雀石,已知他的主要化学成分时“碱式碳酸铜”现向你提供少量碱式碳酸铜固体、部分实验器材和所需试剂,完成下表
实验内容 实验现象 结论
1.观察
2.取少量固体溶于水,搅拌后静置
3.取少量固体加入白醋
4.取少量固体加热 苦了今天还有1年前1
苦了今天还有1年前1 -
 magice_uk 共回答了19个问题
magice_uk 共回答了19个问题 |采纳率100%实验现象 结论
1.绿色固体
2.无 不溶于水
3.固体溶解 有气泡放出 能溶于酸
4.固体由绿变白色和 碱式碳酸铜加热能分解为碳酸铜、水和氧化铜
蓝色 然后蓝色
固体变黑 有水珠产生1年前查看全部
- 孔雀石是什么,化学式
 worship20061年前1
worship20061年前1 -
 886898 共回答了15个问题
886898 共回答了15个问题 |采纳率86.7%Cu2(OH)2CO31年前查看全部
- 由孔雀石制备五水硫酸铜加双氧水氧化亚铁离子时,为什么要逐滴加入?加完双氧水后,为什么要将溶液加热至沸腾?
 我不拽1年前1
我不拽1年前1 -
 ff卫士 共回答了21个问题
ff卫士 共回答了21个问题 |采纳率95.2%1、保证合适的pH值.
2、加速溶解是反应更完全、充分.1年前查看全部
- 溶液A含什么 为什么有si02孔雀石主要含Cu2(OH)2CO3〔也可认为是Cu(OH)2·CuCO3〕,还含少量Fe、
溶液A含什么 为什么有si02
孔雀石主要含Cu2(OH)2CO3〔也可认为是Cu(OH)2·CuCO3〕,还含少量Fe、Si的化合物.实验室以孔雀石为原料制备CuSO4·5H2O,
请回答下列问题:
(1)气体E的化学式是______________.
(2)由溶液C获得CuSO4·5H2O,需要经过蒸发浓缩、冷却结晶、___________和干燥等操作.
(3)写出孔雀石主要成分与稀硫酸反应的化学方程式______________.

 zengfeihan1年前1
zengfeihan1年前1 -
 wansandqinraz 共回答了15个问题
wansandqinraz 共回答了15个问题 |采纳率93.3%单质硅在自然界中是不会单独存在的,一般以二氧化硅以及硅酸盐的形式存在,此题把硅的化合物视为二氧化硅,这只是题目的设计(一种假定),并不用深究为何而来,
溶液A为CuSO4,和少量的FeSO4
CO2,减压过滤,Cu2(OH)2CO3+2H2SO4==2CuSO4+CO2(g)+3H2O1年前查看全部
- 孔雀石与石青的化学式?
 lip_forever1年前3
lip_forever1年前3 -
 三甲黄主任 共回答了22个问题
三甲黄主任 共回答了22个问题 |采纳率95.5%Cu2(OH)2CO31年前查看全部
- 孔雀石的化学式是什么
 嘟囔囔格子1年前3
嘟囔囔格子1年前3 -
 montnice 共回答了19个问题
montnice 共回答了19个问题 |采纳率78.9%孔雀石是含铜的碳酸盐矿物(碱式碳酸铜),化学成分为Cu2(OH)2CO3,1年前查看全部
- 人类很早就发现,孔雀石在熊熊燃烧的树木中灼烧后,余烬里有一种红色光亮的金属显露出来,使用化学式表示以上变化的两个主要产物
人类很早就发现,孔雀石在熊熊燃烧的树木中灼烧后,余烬里有一种红色光亮的金属显露出来,使用化学式表示以上变化的两个主要产物:
请说明为什么答案是氧化铜和铜 真的就是假的1年前8
真的就是假的1年前8 -
 麥色心情 共回答了17个问题
麥色心情 共回答了17个问题 |采纳率88.2%孔雀石(Cu2[CO3](OH)2)加热后分解为CuO,CO2,H2O.
树木燃烧后产生木炭,木炭将氧化铜还原得铜.
所以答案是氧化铜和铜,1年前查看全部
- 孔雀石加热分解的化学方程式及推理
 罗芳书1年前5
罗芳书1年前5 -
 oigg22 共回答了27个问题
oigg22 共回答了27个问题 |采纳率92.6%孔雀石的主的成分是Cu2CO3(OH)2,碱式碳酸铜.加热分解方程式如下:
Cu2CO3(OH)2=2CuO+CO2+H2O
推理:将生成是气体通入无水硫酸铜,变蓝,说明有水生成,通入澄清石灰水,有沉淀生成,说明有二氧化碳生成.
剩下的是黑色的物质,加热并且通入氢气,物质变红,则说明生成的黑色物质为是氧化铜.1年前查看全部
- ________色的孔雀石主要成分是________________(俗称_________).
________色的孔雀石主要成分是________________(俗称_________).
________色的孔雀石主要成分是________________(俗称_________)
硫酸铜晶体(俗称_________、__________),无水硫酸铜是________色的.1nm=_____m e819052531年前1
e819052531年前1 -
 遇雨微微 共回答了23个问题
遇雨微微 共回答了23个问题 |采纳率91.3%翠绿色,碱式碳酸铜,铜绿
胆矾、蓝矾,蓝色,10的-9次方1年前查看全部
- 在孔雀石中加入过量的稀硫酸,过滤后,从滤液中获取铜的方法
在孔雀石中加入过量的稀硫酸,过滤后,从滤液中获取铜的方法
不加入铁粉,用另一种方法来解决 dpyoph1年前1
dpyoph1年前1 -
 浮華背後 共回答了25个问题
浮華背後 共回答了25个问题 |采纳率92%加铁粉!孔雀石(碱式碳酸铜)加稀硫酸生成硫酸铜,硫酸铜加铁生成硫酸铁和铜
加入铁粉,用另一种方法来解决?
除加铁之外只要金属活动性强于铜的金属放入硫酸铜溶液都可以置换出铜,还有电解,电极上生产铜,和电镀铜反应一样!2CuSO4 + 2H2O = 2Cu+ 2H2SO4 + O2↑1年前查看全部
- 孔雀石主要含Cu 2 (OH) 2 CO 3 ,还含少量Fe、Si的化合物,实验室以孔雀石为原料制备CuSO 4 •5H
孔雀石主要含Cu 2 (OH) 2 CO 3 ,还含少量Fe、Si的化合物,实验室以孔雀石为原料制备CuSO 4 •5H 2 O及CaCO 3 ,步骤如下:
试回答下列问题: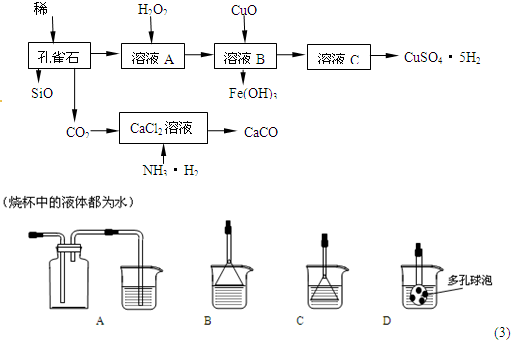
(1)在未加入H 2 O 2 的溶液A中,存在的金属离子有Cu 2+ 、Fe 2+ 、Fe 3+ .若检验该溶液中Fe 3+ ,选择最合适的试剂是______(填代号).
A.KMnO 4 溶液 B.Fe粉C. Na 2 CO 3 溶液D.KSCN溶液
向溶液A中加入H 2 O 2 ,H 2 O 2 在该反应中作氧化剂.实验室选用H 2 O 2 而不用Cl 2 作氧化剂.除考虑环保因素外,另一原因是不引入杂质______离子.
(2)由溶液C获得CuSO 4 •5H 2 O,需要经过加热浓缩,______,过滤等操作.除烧杯、漏斗外,过滤操作还需用到另一玻璃仪器,该仪器在此操作中的主要作用是______.
(3)制备CaCO 3 时,发生反应的化学方程式是______;若实验过程中有氨气逸出,可选用下列装置中的______(填代号)装置吸收氨气.
(4)欲测定溶液A中Fe 2+ 的浓度,需配制100mL 0.1mol∕LKMnO 4 标准溶液.配制该溶液时:除烧杯、玻璃棒、胶头滴管外,还需的一种玻璃仪器是______;当往该玻璃仪器中加蒸馏水至接近刻度线1-2cm时,应改用______滴加蒸馏水至溶液的凹液面正好与刻度线相平. 哦豁1年前1
哦豁1年前1 -
 可怕威胁 共回答了10个问题
可怕威胁 共回答了10个问题 |采纳率90%(1)若检验溶液中Fe 3+ ,使用的试剂是KSCN溶液,溶液变成血红色,是Fe 3+ 的特征反应,由
H 2 O 2 +2Fe 2+ +2H + =2Fe 3+ +2H 2 0、Cl 2 +2Fe 2+ =2Fe 3+ +2Cl - ,H 2 O 2 与Fe 2+ 反应生成的H 2 0为溶剂,Cl 2 与Fe 2+ 反应
生成的Cl - 是杂质离子,故答案为:D;Cl - ;
(2)由溶液制取晶体,需经过加热浓缩,冷却结晶才可得到,在过滤操作中,除烧杯、玻璃棒、胶头滴管外,还需的一种玻璃仪器是玻璃棒,它的作用是引流.故答案为:冷却结晶;引流;
(3)二氧化碳和氯化钙不反应,氨气极易溶于水,使溶液呈碱性,和酸性氧化物二氧化碳反应生成碳酸铵,碳酸铵和氯化钙发生复分解反应,生成碳酸钙沉淀;氨气极易溶于水,且氨气有刺激性气味,防止污染大气,要有尾气处理装置,选用倒置的漏斗且紧贴水面,目的是防止倒吸.故答案为:CO 2 +CaCl 2 +2NH 3 •H 2 O=CaCO 3 ↓+2NH 4 Cl+H 2 O;B;
(4)一定物质的量浓度溶液的配置,除烧杯、玻璃棒、胶头滴管外,还需的一种玻璃仪器是容量瓶,容量瓶的规格有100ml、250ml、500ml、1000ml,选取容量瓶的规格应大于等于配置溶液的体积,当往该玻璃仪器中加蒸馏水至接近刻度线1-2cm时,应改用胶头滴管滴加蒸馏水,故答案为:100mL容量瓶; 胶头滴管.1年前查看全部
- 区分孔雀石和铜是不是同一种物质?
区分孔雀石和铜是不是同一种物质?
孔雀石和铜是不是同一种物质?你是根据什么来猜想的?你可以通过哪些途径来验证你的猜想? kelly_ylp1年前5
kelly_ylp1年前5 -
 薰石 共回答了18个问题
薰石 共回答了18个问题 |采纳率94.4%不是.孔雀石的主要成分是碱式碳酸铜Cu2(OH)2CO3;
根据两者颜色不同猜想(铜是红色,孔雀石是绿色);
可将孔雀石灼烧,收集产生气体,将气体通入品红试液,无变化(排除二氧化硫干扰),再通入澄清石灰水,变混浊,证明产生CO2;而烧铜无变化.
方程式:Cu2(OH)2CO3====2CuO+H2O+CO21年前查看全部
- 我们的祖先很早就掌握了炼铜的工艺,他们将孔雀石,主要成分Cu2(OH)2CO3和木炭一起加热就可得到红色的金属铜.请你写
我们的祖先很早就掌握了炼铜的工艺,他们将孔雀石,主要成分Cu2(OH)2CO3和木炭一起加热就可得到红色的金属铜.请你写出化学反应原理.提示:孔雀石受热易分解,得到氧化铜、二氧化碳和水,加热时,用木炭作还原剂就能把氧化铜中的铜还原出来.
 见谁抽谁1年前2
见谁抽谁1年前2 -
 232345 共回答了15个问题
232345 共回答了15个问题 |采纳率93.3%解题思路:充分运用提示的信息,分析出反应物生成物和反应条件,从而写出正确的化学方程式.由提示知:孔雀石加热时分解,生成氧化铜、二氧化碳和水,故方程式为:Cu2(OH)2CO3
△
.
2CuO+H2O+CO2↑;加热时,用木炭作还原剂把氧化铜中的铜还原出来,根据反应物的组成,还应生成二氧化碳,但条件应是加热,故方程式为:C+2CuO
高温
.
2Cu+CO2↑.
故选Cu2(OH)2CO3
△
.
2CuO+H2O+CO2↑;C+2CuO
高温
.
2Cu+CO2↑.点评:
本题考点: 探究金属铜的冶炼原理;金属的化学性质;碳的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 解题时要充分利用信息,不能对不熟悉的反应无所适从,同时掌握基础知识,提高知识的衍生能力.1年前查看全部
- 把少量 色的孔雀石粉末装入试管中加热一段时间后( ),发现试管内固体变 色,试管口出现 ,产生的气体
把少量 色的孔雀石粉末装入试管中加热一段时间后( ),发现试管内固体变 色,试管口出现 ,产生的气体
把少量 色的孔雀石粉末装入试管中加热一段时间后( ),发现试管内固体变 色,试管口出现 ,产生的气体经湿润的pH试纸测定为 性. werdscg1年前2
werdscg1年前2 -
 yanshixxou 共回答了19个问题
yanshixxou 共回答了19个问题 |采纳率84.2%孔雀石是碱式碳酸铜,受热分解成黑色的氧化铜,水和二氧化碳,二氧化碳遇湿润的ph试纸成酸性,二氧化碳溶入水后形成碳酸,弱酸性1年前查看全部
- 火烧孔雀石【Cu2(OH)2CO3】也属还原法 这句话对吗?
 彼岸野花1年前2
彼岸野花1年前2 -
 wangxh0798 共回答了18个问题
wangxh0798 共回答了18个问题 |采纳率77.8%这句话是对的.燃烧法制取铜使价态降低,属于还原反应,所以可以认为是还原法.
Cu2(OH)2CO3 ══2CuO + CO2↑+ H2O (加热)
CuO + CO ══Cu + CO2 (加热)
整体是还原法1年前查看全部
- 氯化铜晶体(CuCl2•xH2O)是重要的化工原料,可用作催化剂、消毒剂等.用孔雀石[主要含Cu2(OH)2CO3,还含
氯化铜晶体(CuCl2•xH2O)是重要的化工原料,可用作催化剂、消毒剂等.用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如下:
已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
(1)若溶液A含有的金属离子有Cu2+、Fe2+、Fe3+,则试剂①选用______(填字母).Fe3+ Cu2+ Fe2+ 开始沉淀的pH 2.7 5.4 8.1 沉淀完全的pH 3.7 6.9 9.6
A.CuB.Cl2C.NH3•H2OD.NaOH
(2)加入试剂②的目的是调节pH至a,a的范围是______.由溶液C获得CuCl2•xH2O,包含4个基本实验操作,这4个基本实验操作依次是______、______过滤和无水乙醇洗涤等操作,使用无水乙醇代替水进行洗涤的主要原因是______.
(3)为了测定制得的氯化铜晶体(CuCl2•xH2O)中x值,有同学设计了如下两种实验方案:
①称取一定质量的晶体加热使其失去结晶水,称量所得无水CuCl2的质量.该方案存在的问题是______.
②称取a g晶体、加入足量氢氧化钠溶液,过滤、洗涤、加热沉淀至质量不再减轻为止,称量所得固体的质量为b g.则x=[80a−135b/18b][80a−135b/18b](用含a、b的代数式表示). 香如玉1年前1
香如玉1年前1 -
 vcactor 共回答了19个问题
vcactor 共回答了19个问题 |采纳率100%解题思路:(1)由工艺流程转化关系可知,实现由溶液A至溶液B转化,目的是将Fe2+氧化为Fe3+,试剂①应为氧化剂,且不能引入新的杂质.
(2)由工艺流程转化关系可知,试剂②应为调节溶液pH值,使Fe3+转化为Fe(OH)3,除去Fe3+,不能沉淀Cu2+,结合金属离子从开始沉淀到沉淀完全时溶液的pH选择pH的范围.
由溶液到晶体需要蒸发浓缩、冷却结晶、过滤、洗涤等.使用无水乙醇代替水进行洗涤,防止CuCl2•xH2O晶体溶解损失.
(3)①CuCl2•xH2O晶体加热时会发生水解.
②加热沉淀至质量不再减轻为止,b g为CuO质量,根据铜元素守恒可知,n(CuO)=n(CuCl2•xH2O),再结合m=nM计算x的值.(1)由工艺流程转化关系可知,实现由溶液A至溶液B转化,目的是将Fe2+氧化为Fe3+,试剂①应为氧化剂,且不能引入新的杂质.
A.Cu不能与Fe2+反应,故A错误;
B.Cl2可以将Fe2+氧化为Fe3+,且不引入新杂质,故B正确;
C.NH3•H2O可以沉淀Cu2+、Fe2+、Fe3+,引入铵根离子,故C错误;
D.NaOH可以沉淀Cu2+、Fe2+、Fe3+,引入钠离子,故D错误.
故选:B.
(2)由工艺流程转化关系可知,试剂②应为调节溶液pH值,使Fe3+转化为Fe(OH)3,除去Fe3+,不能沉淀Cu2+,由金属离子从开始沉淀到沉淀完全时溶液的pH可知,Fe3+从pH=2.7开始沉淀,在pH=3.7沉淀完全,Cu2+从pH=5.4开始沉淀,所以应该可知pH范围为3.7~5.4.
由溶液获得CuCl2•xH2O晶体需要蒸发浓缩、冷却结晶、过滤、洗涤等.
氯化铜易溶于水,使用无水乙醇代替水进行洗涤,防止CuCl2•xH2O晶体溶解损失.
故答案为:3.7~5.4;蒸发浓缩、冷却结晶;防止CuCl2•xH2O晶体溶解损失.
(3)①CuCl2•xH2O晶体加热时会发生水解CuCl2+2H2O⇌Cu(OH)2+2HCl,有HCl气体放出,CuCl2质量偏小,测得x值偏大.
故答案为:CuCl2•xH2O晶体加热时会发生水解.
②b g为CuO质量为[bg/80g/mol]=[b/80]mol,根据铜元素守恒可知,n(CuO)=n(CuCl2•xH2O),所以ag=[b/80]mol×(135+18x)g/mol,解得,x=[80a−135b/18b].
故答案为:[80a−135b/18b].点评:
本题考点: 制备实验方案的设计;化学方程式的有关计算;常见阳离子的检验;探究物质的组成或测量物质的含量.
考点点评: 考查阅读获取信息能力、对工艺流程理解与实验条件控制、实验方案的评价、化学计算、物质分离提纯除杂等有关实验操作以及在新情境下综合运用知识解决问题的能力.题目难度中等,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,注意基础知识的全面掌握.1年前查看全部
- 孔雀石的主要成分为碱式碳酸铜[Cu2 (OH)2CO3],化学小组的同学利用 Cu2 (OH)2CO3+4HCl=2Cu
孔雀石的主要成分为碱式碳酸铜[Cu2 (OH)2CO3],化学小组的同学利用 Cu2 (OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O,测定某孔雀石中碱式碳酸铜的质量分数.称取该铜矿样品30g于烧杯中,逐滴加入溶质质量分数为10%的稀盐酸至恰好完全反应,共用去稀盐酸146g(假设铜矿中的其他成分不与稀盐酸反应,也不溶于水).则该孔雀石样品中碱式碳酸铜的质量分数是多少?反应后所得溶液中溶质的质量分数是多少?
 不爱理你1年前1
不爱理你1年前1 -
 歪脑袋 共回答了19个问题
歪脑袋 共回答了19个问题 |采纳率100%解题思路:根据碱式碳酸铜与稀酸反应的方程式,由稀盐酸溶液质量和溶质质量分数求出碱式碳酸铜的质量,再除以孔雀石样品的质量即可得出碱式碳酸铜的质量分数,根据碱式碳酸铜与稀盐酸反应的方程式可知,反应后所得溶液中溶质是氯化铜,根据质量守恒定律反应后溶液的质量等于盐酸溶液的质量加上参加反应的碱式碳酸铜的质量减去生成的二氧化碳的质量,根据氯化铜和溶液的质量就可求出反应后所得溶液中溶质的质量分数.设孔雀石样品中碱式碳酸铜的质量为x,生成的二氧化碳的质量为y
Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O
222 14627044
X146g×10%y
[222/146=
x
146g×10%] X=22.2g
[146/44=
146g×10%
y] Y=27g
该孔雀石样品中碱式碳酸铜的质量分数是:[22.2/30]×100%=74%
反应后所得溶液中溶质的质量分数是[27/146+22.2−4.4]×100%=16.5%
答:孔雀石样品中碱式碳酸铜的质量分数是74%,反应后所得溶液中溶质的质量分数是16.5%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查了根据化学方程式的计算,解题的关键是会根据质量守恒定律由参加反应的碱式碳酸铜和稀盐酸的质量以及生成的二氧化碳的质量求出反应后生成的溶液的质量.1年前查看全部
- 初三徐汇区统考化学卷子最后一题孔雀石与石青的化学组成均可表示为xCuCO3·yCu(OH)2 (X Y为最间正整数)孔雀
初三徐汇区统考化学卷子最后一题
孔雀石与石青的化学组成均可表示为xCuCO3·yCu(OH)2 (X Y为最间正整数)
孔雀石与过量盐酸反应生成的CO2的物质的量只比为4比1.推算化学式组成(xCuCO3·yCu(OH)2+2(x+y)HCl→(x+y)CuCl2+xCO2↑+(x+2y)H2O
1.X= Y=
2.现有孔雀石和石青混合样品,取两份质量相等的样品,在一份加入过量的盐酸,生成0.15molCO2,加热另一份样品使其完全分解.得到0.25mol CuO ,(孔雀石月石青混合受热分解的化学方程式为:xCuCO3·yCu(OH)2→(x+y)CuO+xCO2↑+yH2O).则混合样品中x:y为
第一小题已经做出来了.答案是1:1.第2小题只知道答案 又谁教教我啊 项雪莲1年前1
项雪莲1年前1 -
 逆流的鱼0702 共回答了18个问题
逆流的鱼0702 共回答了18个问题 |采纳率88.9%顶起来 !1年前查看全部
- 碱式碳酸铜 孔雀石 铜绿 Cu2(OH)2CO3是混合物?
碱式碳酸铜 孔雀石 铜绿 Cu2(OH)2CO3是混合物?
为什么混合物能用化学式表示?
还有,写出相关化学反应方程式 yimeng13201年前2
yimeng13201年前2 -
 寒星飘零 共回答了15个问题
寒星飘零 共回答了15个问题 |采纳率86.7%1、碱式碳酸铜、Cu2(OH)2CO3为纯净物(单一物质为纯净物),孔雀石、铜绿为混合物.一般来讲,自然界天然有的物质,大多为混合物.少数物质能视为纯净物(如黄金).此处既然碱式碳酸铜可以受热分解,那么在自然环境中,温度较高,同样会分解,铜绿或孔雀石则会含有部分杂质氧化铜.同时,大部分铜器本身就含有其他金属,生锈后其他金属依旧存在,因而不能视为纯净物.
2、混合物如果进行化学反应,其各组分,有参与反应的,有不参与反应的,参与反应的各种物质会有相应的化学式,如果各组分化学反应无相互间的干扰,则是多个化学反应方程式.如只有单一物质参与反应,则只写参与反应物质的化学反应方程式.那么不参与反应的物质则不写入化学反应方程式中.
3、Cu2(OH)2CO3--->2CuO+CO2+H2O1年前查看全部
大家在问
- 1相同状况下电解相同物质的量的D2O和H2O时产生的气体体积比为______,产生的氢气的质量比______
- 2把下面的成语按感情色彩的不同,分两类写下来.
- 3写出与下列意思相近感情色彩不同的成语
- 4为什么做变速运动的电荷会在空间内产生电磁波?如果是做匀变速呢?
- 5一个问题 书架上的书借出5分之8后,又放14本,这时书架上的图书与原有的本数之比为2:3,问原来有多
- 6“哟”这个字念什么?读音或者告诉我“yo"这个拼音叫什么?
- 71公倾等于多少平方
- 84个8算24点.只用加减乘除,不用根号.
- 9合成DNA聚合酶和胰岛素场所分别是 求解答,必给好评...
- 10一个数的百分之70与60的百分之35是相等的,这个数是多少
- 11把下面的成语按感情色彩的不同,分两类写下来.
- 12细菌分裂过程中会出现DNA的复制吗?
- 13歳字旁边加个羽字怎么读
- 14谁知道 这字怎么读 上面是 合 下面是 羽 怎么拼
- 15它的腿 翻译英文




