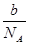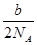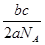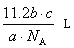NA为阿伏加得罗常数.25度时,1g水中含有H+离子个数约为.NA?
 林凯俞2022-10-04 11:39:541条回答
林凯俞2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 蓝天QQ 共回答了16个问题
蓝天QQ 共回答了16个问题 |采纳率93.8%- 1/18*NA*2=NA/9
- 1年前
相关推荐
- (2013•江西模拟)以NA代表阿伏罗德常数,则下列关于热化学方程式:
(2013•江西模拟)以NA代表阿伏罗德常数,则下列关于热化学方程式:
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=-2600kJ•mol-1的说法正确的是( )
A.有10NA个电子转移时,该反应吸收1300kJ的能量
B.有NA个水分子生成且为液体时,吸收1300kJ的能量
C.有2NA个碳氧共用电子对生成时,放出1300kJ的能量
D.有8NA个碳氧共用电子对生成时,放出1300kJ的能量 jas_1111年前1
jas_1111年前1 -
 vipcindy 共回答了18个问题
vipcindy 共回答了18个问题 |采纳率88.9%解题思路:根据转移的电子数目、水分子的个数、共用电子对数分别判断参加反应的物质的物质的量,进而判断反应热大小,并根据该反应放热来判断.A、该反应为放热反应,故A错误;
B、该反应为放热反应,故B错误;
C、1个CO2分子中含有4个共用电子对,有2NA个碳氧共用电子对生成时,说明有0.5molCO2生成,放出325KJ的能量,故C错误;
D、1个CO2分子中含有4个共用电子对,有8NA个碳氧共用电子对生成时,说明有2molCO2生成,放出1300KJ的能量,故D正确.
故选D.点评:
本题考点: 热化学方程式;阿伏加德罗常数;氧化还原反应的电子转移数目计算.
考点点评: 本题考查热化学反应的能量的计算,做题时注意反应时吸热还是放热,正确从微观结构判断参加反应物质的物质的量是做本题的关键.1年前查看全部
- 阿伏加得罗定律是理想气体状态方程的必然推论.
 freeflyshu1年前2
freeflyshu1年前2 -
 笨笨的椰子 共回答了18个问题
笨笨的椰子 共回答了18个问题 |采纳率88.9%根据理想气体状态方程
PV=nRT
V=(RT/P)*n
当外界的温度、压强不变时
V体积是物质的量的一次函数
]
因此我们说阿伏加德罗定律是.的必然推论
从理论上可以推倒1年前查看全部
- 用NA表示阿伏加罗德常数的数值.下列说法正确的是?
用NA表示阿伏加罗德常数的数值.下列说法正确的是?
A.分子数均为NA的N2和CO的质量比为1:1
B.水的摩尔质量等于2NA个水分子相对分子质量之和
C.1mol O2的质量等于2NA个氧原子的质量
D.SO3的摩尔质量是80g. funny_6141年前3
funny_6141年前3 -
 limusy 共回答了23个问题
limusy 共回答了23个问题 |采纳率95.7%c1年前查看全部
- 物质的量 阿伏伽德罗常数.阿伏伽德罗常数 为什么带单位 它表示什么 它是怎么推导出来的:1mol任何粒子的粒子数叫做阿伏
物质的量 阿伏伽德罗常数
.阿伏伽德罗常数 为什么带单位 它表示什么 它是怎么推导出来的
:1mol任何粒子的粒子数叫做阿伏伽德罗常数,符号为NA,通常用6.02×10^23mol-表示
6.02×10^23mol- 表示什么 意义? feiyingzbd1年前3
feiyingzbd1年前3 -
 hartmman 共回答了15个问题
hartmman 共回答了15个问题 |采纳率80%“阿伏加德罗常数”=“6.02×10^23”,阿伏加德罗常数的单位就是“个”,它就表示6.02×10^23这个数字
它是测量出来的不是推导出来的~
看你说的课本上那句话啊,“1mol任何粒子的粒子数”,特别强调了是粒子的个数,这个“粒子”包括原子包括分子包括离子
也就是说1molFe就有阿伏伽德罗常数个(就是6.02×10^23个)Fe原子
1molNaCl就有阿伏伽德罗常数个(6.02×10^23个)NaCl分子
同样1阿伏加德罗常数个Fe原子就是1molFe~1年前查看全部
- 已知阿伏加得罗常数,物质摩尔质量,气体摩尔体积,下列物理量尚不能全部计算出近似值的是_____
已知阿伏加得罗常数,物质摩尔质量,气体摩尔体积,下列物理量尚不能全部计算出近似值的是_____
A)固体物质分子的大小和质量
B)液态物质分子的大小和质量
C)气体物质分子的质量
D)气体物质分子的大小和质量
详细介绍下过程和分子大小的计算. kzld61年前4
kzld61年前4 -
 everblue0989 共回答了22个问题
everblue0989 共回答了22个问题 |采纳率77.3%求物质的质量:
m=n·M
=(N/NA)·M ① 任何物质
=(V/VM)·M ② 气体
=(cV)·M ③ 溶液
对于任意物质可以用①计算,气体物质可以用①②计算,水溶液中可以用①③计算.
现在已知的是NA M VM 而不知道 N(分子数) V(气体的体积),所以ABCD都不能计算出.
对于分子大小的计算:
①固体分子和液体分子,分子间的间距比较小(近似于紧密排列),他们的分子大小就可以用体积除以分子的个数来近似表示.
即(4/3)πr^3=V(每个分子的体积)=V总(总体积)/N(总分子数)
②气体分子,分子间的间距比较大,他们的大小就不能用体积近似表示了1年前查看全部
- 以N A 代表阿伏罗德常数,则下列关于热化学方程式:
以N A 代表阿伏罗德常数,则下列关于热化学方程式:
2C 2 H 2 (g)+5O 2 (g)═4CO 2 (g)+2H 2 O(l);△H=-2600kJ•mol -1 的说法正确的是( )A.有10N A 个电子转移时,该反应吸收1300kJ的能量 B.有N A 个水分子生成且为液体时,吸收1300kJ的能量 C.有2N A 个碳氧共用电子对生成时,放出1300kJ的能量 D.有8N A 个碳氧共用电子对生成时,放出1300kJ的能量  hainanlongmao1年前1
hainanlongmao1年前1 -
 haityuu 共回答了16个问题
haityuu 共回答了16个问题 |采纳率100%A、该反应为放热反应,故A错误;
B、该反应为放热反应,故B错误;
C、1个CO 2 分子中含有4个共用电子对,有2N A 个碳氧共用电子对生成时,说明有0.5molCO 2 生成,放出325KJ的能量,故C错误;
D、1个CO 2 分子中含有4个共用电子对,有8N A 个碳氧共用电子对生成时,说明有2molCO 2 生成,放出1300KJ的能量,故D正确.
故选D.1年前查看全部
- 某元素1个原子的质量为ag ,1个碳12原子质量为bg,NA表示阿伏加
某元素1个原子的质量为ag ,1个碳12原子质量为bg,NA表示阿伏加
德罗常数,则这种原子的相对原子质量是()A.12aNA/b;B.12b/a;C.a/NA;D.a*NA
原因? 梦也非1年前2
梦也非1年前2 -
 色神我也 共回答了10个问题
色神我也 共回答了10个问题 |采纳率100%相对原子质量=某原子实际质量/碳原子质量的十二分之一=12a/b N/NA=m/M可得M=a*NA 所以选择D1年前查看全部
- 《《化学发展简史》》一书中介绍的科学家,哪位发现了“元素周期律”和“元素周期表”( ) A.牛顿 B.道尔顿 C.阿伏
《《化学发展简史》》一书中介绍的科学家,哪位发现了“元素周期律”和“元素周期表”( )
A.牛顿 B.道尔顿 C.阿伏加德罗 D.门捷列夫  我狂我拽我嚣张1年前1
我狂我拽我嚣张1年前1 -
 let-it-be 共回答了18个问题
let-it-be 共回答了18个问题 |采纳率83.3%D
A、牛顿的主要贡献是发现了运动三大定律和万有引定律,是力学奠基人,故选项错误.
B、道尔顿在化学上的主要贡献是提出了原子学说,故选项错误.
C、阿伏加德罗在化学上的主要贡献是提出了分子的概念,并创立了分子学说,故选项错误.
D、门捷列夫在化学上的主要贡献是发现了元素周期律,并编制出元素周期表,故选项正确.
故选D.1年前查看全部
- 这个作业怎么做?如图是可用于测量阿伏
这个作业怎么做?如图是可用于测量阿伏
如图是可用于测量阿伏加德罗常数的装置示意图,其中A是纯铜片、B是石墨,插在100mLCuSO 4 稀溶液中,铜片、石墨与引出导线相连,引出端分别为X、Y.
(1) 当以IA的电流电解6min后,测得铜片A的质量减少了2.56g, 则图装置中的X端应与直流电的________极相连.
(2)电解后将电源反接,2IA的电流电解6min后,假设溶液体积不变,测得溶液中CuSO 4 物质的量浓度为0.1mol/L,则原溶液中CuSO 4 物质的量浓度________mol/L.溶液中H + 的物质的量浓度为_______mol/L.
(3)列式计算实验测得的阿伏加德罗常数N A (用I表示)_________mol -1 .(已知电子电量e=1.60×10 -19 C)
 ujdf21年前1
ujdf21年前1 -
 himanzhao5515 共回答了18个问题
himanzhao5515 共回答了18个问题 |采纳率88.9%(1)正.
(2)0.5;0.8
(3)2.8I×10 221年前
61年前查看全部
- 1g氮气含n个氮气分子,阿伏加得罗常数NA可表示为?
1g氮气含n个氮气分子,阿伏加得罗常数NA可表示为?
为什么是28n啊?n=m/M 不是28n/28吗?哪来的28n? lx007deity1年前1
lx007deity1年前1 -
 gjsalm 共回答了16个问题
gjsalm 共回答了16个问题 |采纳率93.8%NA = N(N2)/n(N2) = N(N2) ÷ m(N2)/M(N2)=n÷ 1g/28g/mol =28n
你的公式:n=m/M是正确的,但m是质量,M是摩尔质量,求出来的n是1mol N2 的物质的量.
n = 1g÷28g/mol = 1/28 mol.
其实这个题目可以简单的理解成这样.NA表示1mol物质所含的粒子数,1molN2的质量为28g,而题目中告诉你1gN2 中含有n个N2,则1molN2 含有28n个N2,NA等于28n
不懂追问.1年前查看全部
- 快高考了 化学选择题阿伏伽罗常数题目总错 大家帮我总结下列几个例子讲一下吧 谢谢了
 babyldm1年前1
babyldm1年前1 -
 亲卿爱卿吧 共回答了15个问题
亲卿爱卿吧 共回答了15个问题 |采纳率100%先给你概念:
1.物质的量(n)是七个基本物理量之一,其意义是表示含有一定量数目的粒子的集体.符号为:【n】 ,单位为:【摩尔(mol)】.
2.物质的量的基准(NA):以0.012kg12C所含的碳原子数即【阿伏加德罗常数】作为物质的量的基准.阿伏加德罗常数可以表示为NA,其近似值为【6.02×1023 】mol-1
3.明确物质的量(n)、摩尔(mol)、物质的量的基准(NA)等概念的区别、联系:
⑴“物质的量”和“质量”、“长度”、“时间”、“电流强度”、“热力学温度”、“发光强度”等一样,是七个基本物理量之一,是一个整体名词,“物质的量”四个字不得简化或增添或改变任何字.
⑵物质的量是用来计量原子、分子、离子或一些特定组合等粒子的一种基本物理量
⑶物质的量用摩尔(mol)作单位
⑷0.012kg12C所含的碳原子数目就是阿伏加德罗常数(NA),近似值为6.02×1023
⑸1mol任何粒子所含的粒子数就是阿伏加德罗常数
⑹粒子数=物质的量(mol)×6.02×1023(mol-1)
二、摩尔质量(M)
1摩尔物质的质量,就是该物质的摩尔质量,单位是【g/mol 】.1mol任何物质均含有【阿伏加德罗】常数个粒子,但由于不同粒子的质量不同,因此,1 mol不同物质的质量也不同;12C的相对原子质量为12,而12 g 12C所含的碳原子为阿伏加德罗常数,即1 mol 12C的质量为12g.同理可推出1 mol其他物质的质量.
注意:摩尔质量是指1摩尔物质(分子、离
子等)的质量,其单位是g/mol或kg/mol等,仅当指明单位为g/mol时,其数值才与该物质的式量相等.
有关关系式:【n =N/NA】;【n =m/M】
再是两个例题
1、用NA表示阿伏加德罗常数,下列说法正确的是( )
A、0℃、1.01×105Pa时,22.4L SO3含有NA个分子
B、含有5.3gNa2CO3的溶液中,有0.05NA个CO32-离子
C、32gCu作还原剂时转移的电子数为NA或0.5NA
D、1mol FeCl3完全转化为氢氧化铁胶体后,胶体粒子数为NA
解析:因为标准状况下SO3为固体,不能用气体摩尔体积计算,故A不能;而CO32-在水中会发生水解,故含0.05mol碳酸钠的水溶液中,所含CO32-离子的物质的量应小于0.05mol,所以B 不对;铜在化学反应中可以呈+1价,(如铜和硫单质共热时生成Cu2S),1mol Cu失出1mol e-,也可以呈+2价,(如铜在氯气中燃烧生成CuCl2),1mol Cu失出2mol e-,故C正确;因为胶体粒子是许多分子的集合体,故1mol Fe(OH)3形成的胶体粒子数远小于NA,所以D错误.
答案:C
2、设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是( )
A.1molCl2与足量Fe反应,转移的电子数为3nA
B.1.5 mol NO2与足量H2O反应,转移的电子数为nA
C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3nA
D.0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10nA
解析:阿伏加德罗常数是微粒的集合体,其近似值为6.02×1023mol-1,常用符号NA来表示.化学微粒指的是分子、原子、离子、质子、中子、电子等微观粒子.
Fe过量可使Fe3+还原为Fe2+,故A不正确;3NO2+H2O==2HNO3+NO,易知B正确;C中, 可把N2O4看作2NO2,则有1moLNO2,所以有3mol原子;也可以用极端方法,看作全部NO2或全部N2O4考虑,也可得出结果.由方程式3Fe+4H2O===Fe3O4+4H2↑可知D不正确.
答案:B C
祝高考顺利!1年前查看全部
- 阿伏加德常数约为6.02×10 23 mol,下列说法中正确的是 ( )。 A.
阿伏加德常数约为6.02×10 23 mol,下列说法中正确的是 ( )。
A.4.2 g丙烯(CH 3 CH===CH 2 )和乙烯的混合物中所含的碳原子数为0.3×6.02×10 23 B.4.48 L N 2 O与CO 2 的混合气体所含电子数为0.2×22×6.02×10 23 C.1 mol HCl和NH 3 的混合气体所含分子数为6.02×10 23 D.100 mL 1 mol·L - 1 醋酸溶液中CH 3 COO - 数目为0.1×6.02×10 23  kelly-niuniu1年前0
kelly-niuniu1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在标准状况下,m升二氧化碳中含有n个氧原子,则阿伏加得罗常数为.
 liyu123771年前2
liyu123771年前2 -
 潜川之子 共回答了17个问题
潜川之子 共回答了17个问题 |采纳率94.1%二氧化碳的物质的量n(CO2)==V/22.4==(m/22.4)mol
每个二氧化碳分子中含有两个氧原子,根据微粒数N==n*NA有
N==2*n(CO2)*NA==2*(m/22.4)*NA==n (n个氧原子)
所以阿伏伽德罗常数NA==11.2n/m1年前查看全部
- 对于液体和固体来说,如果用M表示摩尔质量,m表示分子质量,ρ表示物质的密度,V表示摩尔体积,v表示分子体积,NA表示阿伏
对于液体和固体来说,如果用M表示摩尔质量,m表示分子质量,ρ表示物质的密度,V表示摩尔体积,v表示分子体积,NA表示阿伏伽德罗常数,那么,下列关系式中正确的是( )
A.NA=[V/v]
B.NA=[v/V]
C.m=[MNA  小舟犹渡1年前1
小舟犹渡1年前1 -
 唐朝汉子 共回答了18个问题
唐朝汉子 共回答了18个问题 |采纳率83.3%解题思路:1mol任何物体的分子个数都是相同的;
固体与液体间的分子间隙较小,可以忽略不计;
摩尔质量等于密度乘以摩尔体积.A、B、摩尔体积是1mol分子的体积,故NA=[V/ v],故A正确,B错误;
C、m表示分子质量,M表示摩尔质量,N表示阿伏伽德罗常数,则m=[M
NA,故C正确;
D、摩尔质量等于密度乘以摩尔体积,故M=ρV,即V=
M/ρ],故D正确;
故选:ACD.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题关键明确阿佛加德罗常数的物理意义,明确摩尔质量等于摩尔体积与密度的乘积.1年前查看全部
- 1g氮气含n个氮气分子,阿伏加得罗常数NA可表示为?
 pgho_0011年前3
pgho_0011年前3 -
 sunbeautyqq 共回答了19个问题
sunbeautyqq 共回答了19个问题 |采纳率100%1g氮气含n个氮气分子
28g氮气含28n个氮气分子,为1mol,所以阿伏加得罗常数NA可表示为28n1年前查看全部
- 若一克氮气N2中含有x个原子,则阿伏·加德罗常数是( )
若一克氮气N2中含有x个原子,则阿伏·加德罗常数是( )
A.x/28 mol -| B.x/14 mol-| C.14x mol-| D.28X mol-| 答案是c为啥不是D呢?答案有个步骤是NA=N(N)/n(N)=x/1/14 mol=14x mol-| .为什么不是Na=N(N)/n(N)=x/1/28 mol=28X mol-| 要讲解,详细点让我明白.感激不尽 黄后彬1年前2
黄后彬1年前2 -
 追风老头 共回答了13个问题
追风老头 共回答了13个问题 |采纳率84.6%1g氮气的物质的量是1/28mol
1mol氮气分子有2mol氮原子.
所以在这道题氮原子的物质的量是2/28=1/14mol
NA=X/(1/14)=14X1年前查看全部
- 将FeCl3饱和溶液滴加到沸水中生成0.1mol/LFe(OH)3胶体时,该体系中的胶体粒子数目为0.1NA(NA为阿伏
将FeCl3饱和溶液滴加到沸水中生成0.1mol/LFe(OH)3胶体时,该体系中的胶体粒子数目为0.1NA(NA为阿伏伽德
如题.
打错了,是0.1molFe(OH)3胶体。 赵小伶1年前1
赵小伶1年前1 -
 商人是311 共回答了16个问题
商人是311 共回答了16个问题 |采纳率87.5%因为胶体形态的Fe(OH)3不电离,每一个Fe(OH)3形成一个胶体粒子1年前查看全部
- 用NA表示阿伏加罗德常数的数值.下列说法正确的是
用NA表示阿伏加罗德常数的数值.下列说法正确的是
A.50℃时,pH=1的1.0L H2SO4溶液中含有的H+ 数目为0.1NA
B.标准状况下,2.24L Cl2 与过量稀NaOH溶液反应,转移的电子总数为0.2NA
C.室温下,21.0g乙烯和丁烯的混合气体中含有的氢原子数目为1.5NA
D.3.4g NH3中含N-H键数目为0.2NA
我怎么觉得没一个对啊..
有人知道么? woshixiaozhang1年前5
woshixiaozhang1年前5 -
 爆米花香甜 共回答了11个问题
爆米花香甜 共回答了11个问题 |采纳率72.7%A 是对的,pH为1,表示H+离子浓度为0.1mol/L,所以氢离子数目就是0.1NA
B错 应该为0.1NA
C 乙烯丁烯的最简式都为CH2,21g混合气体有1/7mol氢原子,所以答案为3NA
D 应该是0.6NA1年前查看全部
- 已知a g气体X 2 中含有b个X原子,那么c g该气体在0℃、1.01×10 5 Pa条件下的体积是(N A 表示阿伏
已知a g气体X 2 中含有b个X原子,那么c g该气体在0℃、1.01×10 5 Pa条件下的体积是(N A 表示阿伏加德罗常数的值)

 mengmengmeimei1年前1
mengmengmeimei1年前1 -
 colourless 共回答了18个问题
colourless 共回答了18个问题 |采纳率94.4%1年前查看全部
- 一道化学打星号的题设N为阿伏加得罗常数的植,下列有关叙述不正确的是(AB)A 标准状况下,1L庚烷完全燃烧所生成的气态氢
一道化学打星号的题
设N为阿伏加得罗常数的植,下列有关叙述不正确的是(AB)
A 标准状况下,1L庚烷完全燃烧所生成的气态氢化物的分子数为7/22.4N
B 1mol甲基(-CH3)所含的电子总数为7N
C 0.5mol 的(CH2=CHCH=CH2)分子中含有C=C双键数为M
D 1mol碳正离子(CH3+)所含的电子总数为8N
这里的每个选项都是怎么思考的啊,尽量的讲详细些啊 爱趴趴的井宝儿1年前2
爱趴趴的井宝儿1年前2 -
 欧哦 共回答了21个问题
欧哦 共回答了21个问题 |采纳率95.2%A
庚烷分子式,C7H16
所以生成的气态氢化物应该是8/22.4N
烷的通项是CnH(2n+2)
B
题目幷没有说是外围电子数目
而C含有6个,每个H含有1个电子,所有总电子数应该是9个
C
每个CH2=CHCH=CH2中有2个C=C双键,
所以计算的时候要乘2,因此0.5mol中有1M
D
这个和B额考虑方法相同
但是因为他是+1价,就是说失去一个电子,所以是8M1年前查看全部
- agO2含有N个氧原子,阿伏家加德罗常数为多少
 sweetpig111年前2
sweetpig111年前2 -
 jiang123hu123 共回答了14个问题
jiang123hu123 共回答了14个问题 |采纳率100%a g O2的物质的量 = a/32 mol
氧原子的物质的量 = a/32 ×2 = a/16 mol
根据N=NA*n,得到N = NA × a/16
所以阿伏加德罗常数NA=16N/a1年前查看全部
- V表示标准状态下水蒸气的摩尔体积,ρ为标准状态下水蒸气的密度,N A 为阿伏加德罗常数,m表示每个水分子的质量,则阿伏加
V表示标准状态下水蒸气的摩尔体积,ρ为标准状态下水蒸气的密度,N A 为阿伏加德罗常数,m表示每个水分子的质量,则阿伏加德罗常数N A =________,标准状态下水蒸气分子间的平均距离d=________。  蝶恋庭芳1年前0
蝶恋庭芳1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- a mol的氮气中氮原子的个数为b,则阿伏加得罗常数为?救救我吧
 skwss1年前1
skwss1年前1 -
 ymqrx99 共回答了20个问题
ymqrx99 共回答了20个问题 |采纳率100%a*NA*2=b
则NA=b/(2a)1年前查看全部
- 1mol 1mol nacl中有钠离子和氯离子各6.02*10^23个,那么加起来不就大于阿伏加德勒常数了吗?为什么还说
1mol 1mol nacl中有钠离子和氯离子各6.02*10^23个,那么加起来不就大于阿伏加德勒常数了吗?为什么还说1mol任何粒子集体都有6.02*10^23个粒子呢?
 贪吃不怕胖1年前1
贪吃不怕胖1年前1 -
 但使风俗淳 共回答了14个问题
但使风俗淳 共回答了14个问题 |采纳率92.9%1mol=6.02*10^23,没错,你指的是NaCl分子,1mol NaCl中有6.02*10^23个NaCl分子.NaCl分子由Cl离子和Na离子构成.你问的是1mol NaCl中的分子数,答案是6.02*10^23.如果问题是1mol NaCl中有多少离子,那答案就是2*6.02*10^23.
不够专业,1年前查看全部
- 设NA表示阿伏加得德罗常数的数值,下列叙述中正确的是( )
设NA表示阿伏加得德罗常数的数值,下列叙述中正确的是( )
A. 1molNH3所含有的氢原子数为3NA
B. 常温常压下,22.4L氧气所含的原子数为2NA
C. 常温常压下,48gO3所含的氧原子数为3NA
D. 1L0.1mol/LNaCl溶液中所含的Na+为NA felicia_89621年前1
felicia_89621年前1 -
 enqiu0000 共回答了17个问题
enqiu0000 共回答了17个问题 |采纳率82.4%解题思路:A、根据物质的量、分子数、原子数、阿伏伽德罗常数之间的关系式计算;
B、根据温度压强对气体摩尔体积的影响判断;
C、根据质量、摩尔质量、原子数、分子数、阿伏伽德罗常数之间的关系式计算;
D、根据化学式与离子个数之间的关系判断;A、一个氨分子中含有3个氢原子,所以1molNH3所含有的氢原子数为3NA,故A正确.
B、相同压强下,温度越高,气体摩尔体积越大,所以常温常压下,22.4L氧气的物质的量小于1mol,含有的原子数小于2NA,故B错误.
C、一个臭氧分子中含有3个氧原子,48g臭氧的物质的量是1mol,所以48gO3所含的氧原子数为3NA,故C正确.
D、氯化钠的物质的量是0.1mol,一个氯化钠分子中含有一个钠离子,所以钠离子的个数是0.1NA,故D错误.
故选AC.点评:
本题考点: 阿伏加德罗常数.
考点点评: 阿伏伽德罗常数有关的计算,题目在注重对计算关系的考查的同时,又隐含对物质状态、物质结构、氧化还原反应、电离、水解知识的考查.1年前查看全部
- 定量研究的方法是化学发展为一门科学的重要标志。关于化学常用计量的说法正确的是 A.物质的量符号为N,单位为摩尔 B.阿伏
定量研究的方法是化学发展为一门科学的重要标志。关于化学常用计量的说法正确的是
A.物质的量符号为N,单位为摩尔 B.阿伏加德罗定律适用任何状况下的气体 C.摩尔质量就是相对原子量或相对分子量 D.1 mol/L NaOH溶液指的是1升水中溶解了1 mol NaOH  我爱小胖子1年前1
我爱小胖子1年前1 -
 龙才子 共回答了18个问题
龙才子 共回答了18个问题 |采纳率100%B
1年前查看全部
大家在问
- 1翻译:###请给她一把勺子,###请帮她买一份粥
- 2眼前的这幅优美画面,多么像 --------------------[把句子补充完整]
- 3用直径为4cm的圆钢,铸造三个直径为2cm,高为16cm的圆柱形零件,则需要截取的圆钢长______cm.
- 4这个题目我有没有做错了!错的话请你们写出正确解题过程!
- 5梯形ABCD中,AD‖BC,下底BC=80,腰AB=CD=20,梯形的高是10,E在DC上,设DE=x,△BCE的面积为
- 61.要在20米长的水泥阳台上放11盆花,不管怎么放,至少有多少盆之间的距离不超过2米?为什么?(个人认为条件不足或根本不
- 7一张课桌有四条腿,一立方木材可做50个桌面或300个桌腿,现在有15立方米木材,设计用多少木材做桌腿与桌面
- 8已知直线y=x+3的图像x,y轴交于A,B两点,直线l经过原点
- 9词组knock him down中的代词him必须放在中间;take Sam home.前要省略介词to,这是为什么?还
- 102008长宁区闸北区化学模拟考答案
- 11请问buy有ing的形式吗?
- 12春夏秋冬四季节的诗句
- 13英语翻译1.人们用鸽子传递信息
- 14英语翻译Lucy和他的爸爸妈妈住在一起吗?(live with)__________________________.邮
- 15点燃乙醇后,怎样减少一氧化碳的生成