铝盐中铝含量的测定实验步骤在化工中运用到的,关于铝盐中铝的测定步骤.有没有这个的实验步骤?
 0orchid02022-10-04 11:39:541条回答
0orchid02022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 cyhcyhcyh 共回答了17个问题
cyhcyhcyh 共回答了17个问题 |采纳率88.2%- 铝盐中铝含量的测定是配位滴定中一个非常典型的应用示例,但在实验教学中经常出现这样那样的问题直接影响了课堂教学的正常进行.因此本人结合教学中出现的问题,在课下进行了认真的理论分析及实验研究,总结出了本实验中容易出现的问题及原因并找出了解决的方法.
本实验的测定原理是:在试样中加入过量的EDTA,调节溶液的pH=3~4,加热煮沸使Al与EDTA完全配合.冷却后,加入缓冲溶液调节溶液的pH=5~6,以二甲酚橙做指示剂,此时溶液的颜色呈现黄色,用锌标准溶液滴定剩余的EDTA,稍过量的Zn2+与二甲酚橙指示剂配位形成红色配合物显示终点,不记录此次消耗锌标准溶液的体积.然后在此溶液中加入过量的氟化铵,加热至沸腾后1~2分钟,使AlY-与F-完全反应,置换出等物质量的EDTA,用锌标准溶液滴定置换出的EDTA至终点.由消耗锌标准溶液的体积和浓度计算铝的含量.其反应为:
Al3+ + H2Y2-(过量) AlY- + 2H+
H2Y2- + Zn2+ ZnY2- + 2H+ (滴定剩余的EDTA)
AlY- + 6 F- + 2H+ AlF63- + H2Y2-
H2Y2- + Zn2+ ZnY2- + 2H+ (滴定置换出的EDTA)[1]
Zn2+ + In2- Zn In[2]
(黄色) (红色)
该实验中EDTA加入量的多少、pH如何调整、缓冲溶液怎样选择、终点的正确判断是保证分析结果准确与否的关键,而恰恰是在这些步骤上容易出现问题,导致实验的失败.下面就针对上述问题进行分析和研究,找出解决问题的方法.
EDTA加入量
本实验是通过EDTA与样品中的Al3+完全配位生成AlY-,再由F-置换出AlY-中的EDTA确定铝盐的含量.所以加入EDTA的量一定要合适,才能保证分析结果的准确性.EDTA加入量太少,一部分Al3+没有参与反应,加入二甲酚橙指示剂后,指示剂先与Al3+形成红色配合物,从而没有终点颜色的变化,导致实验的失败;EDTA加入量太多,达第一个终点时消耗锌标液太多,不仅浪费试剂而且往往会滴过量,使测定结果不准确.那么加入多少EDTA是合适的呢?要通过下面计算来确定.
式中:m ——称取试样的质量(g)
ω——样品的估计质量分数(%)
M——铝盐的摩尔质量(g/mol)
c——EDTA的大致浓度(mol/L)
V——EDTA的体积(mL)
根据上式计算出EDTA的体积再过量5-10mL,就可以满足要求,既能准确的测出实验结果又不浪费试剂.
pH的调整
本实验所用的金属指示剂二甲酚橙只有在pH=5-6时,才能用Zn2+直接滴定EDTA,溶液的颜色由黄色转变为红色指示终点的到达.当溶液的pH>6时加入指示剂后溶液呈现红色和Zn In的颜色一致,没有终点颜色的变化,不能指示终点;当溶液的pH<4时加入指示剂后,溶液的颜色虽然能呈现出黄色,但随着Zn2+的逐渐滴入反应生成的H+使溶液的酸度越来越大,Zn2+和指示剂形不成稳定的红色配合物,溶液的颜色会越来越黄,同样指示不出终点.如何调整合适的pH呢?一般是在铝盐溶液中加入盐酸或氨水把其pH调整到4-5后,再加入pH为5-6的缓冲溶液来实现所需的酸度条件.(在实际操作中常常是这一步骤容易出现问题导致实验的失败).那么又如何判断溶液的pH被调整到4-5了呢?即可以用pH试纸来判断;又可以采用甲基橙指示剂来判断;也可以用百里酚蓝和溴酚蓝指示剂来判断.在实际应用中,前三者在指示pH值时要么是比较迟钝指示不准;要么是颜色的变化不够明显不容易判断,使pH调整的不准确导致实验的失败.经过反复实验,采用0.1%溴酚蓝做指示剂效果较好.溶液的pH值由一点多被调整到四点多时,溴酚蓝指示溶液的颜色由红色变为蓝紫色非常明显,指示比较准确.
缓冲溶液的选择
因为在反应过程中会生成少量的H+从而改变溶液的酸度,破坏二甲酚橙变色的条件,要使溶液的酸度维持在5-6,必须加入缓冲溶液来调节.缓冲溶液即可以采用20%的六次甲基四铵-盐酸溶液又可以采用pH=5.7的NaAc-Hac溶液.通过对比,加入10mL的NaAc-Hac缓冲溶液效果较好,终点颜色比较容易观察.
终点的判断
当反应达到第一个终点时,溶液的颜色由黄色变化到红色,颜色的变化非常明显终点很容易判断.而加入氟化铵煮沸后,溶液的颜色变成黄中带红的状态,再判断第二个终点时就不是很容易了.要准确的判断第二个终点的颜色,可以采取两种手段辅助判断.一是再补加两滴指示剂,使溶液的颜色变深;二是在摇动时观察锥形瓶中溶液的中心,当溶液中心的颜色突跃为红色时,终点就达到了.
通过采取以上几种措施就可以很准确的分析出铝盐中的铝含量,给生产和实验教学提供了可靠的实验方法,保证了生产和教学的顺利进行. - 1年前
相关推荐
- 某铅铝合金(实心)903克,体积86cm的立方,求该合金中铝的含量是多少千克
 drexler221年前2
drexler221年前2 -
 bfyc2004 共回答了18个问题
bfyc2004 共回答了18个问题 |采纳率88.9%设合金中铝有X cm平方
2.7x+11.35(86-x)=903
x=8.45
M铝=密度*体积=2.7g/cm平方*8.45=22.81g=0.02281kg1年前查看全部
- 元素周期表中铝元素的部分信息如图所示,下列说法正确的是( )
元素周期表中铝元素的部分信息如图所示,下列说法正确的是( ) 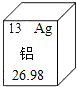
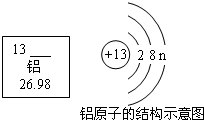
A.铝的元素符号是Ag B.铝的原子序数是26.98 C.铝的核内质子数是13 D.铝在反应中易得到电子  雪孕梅花1年前1
雪孕梅花1年前1 -
 ab9805 共回答了16个问题
ab9805 共回答了16个问题 |采纳率100%A、铝的元素符号是Al,故A错误;
B、铝的原子序数是13,故B错误;
C、根据在原子中,原子序数=质子数=核外电子数,所以铝的核内质子数是13,故C正确;
D、根据金属元素在化学反应中易失去最外层电子;故D错误;
故选C.1年前查看全部
- 符号:2个氮原子~2个钠离子~2个二氧化硫分子~氧化铝中铝元素化合价为+3价~氦气~氧化铜~SO4 2-数字表示的意义~
 fy18181年前1
fy18181年前1 -
 diuliaishanshan 共回答了25个问题
diuliaishanshan 共回答了25个问题 |采纳率84%2N 2Na+ (把+放在Na右上角) 2SO2
氧化铝中铝元素化合价为+3价 Al2O3(在Al正上方写上+3)
氦气(He) 氧化铜(CuO)
SO2中2是指一个二氧化硫分子中含有2个氧原子1年前查看全部
- 某混合金属粉末,除Mg外还含有Al、Zn中的一种或两种,含量都在10%以上.某研究小组设计实验探究该混合金属粉末中铝、锌
某混合金属粉末,除Mg外还含有Al、Zn中的一种或两种,含量都在10%以上.某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在.
所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3•H2O
该小组探究过程如下:
查阅资料:
①镁、铝、锌都点白色金属;
②锌(Zn)可以与NaOH溶液反应生成H2;
③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3•H2O;
④Zn2+易形成络合物[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、N
.H +4
提出假设:
(1)假设1:该混合金属粉末中除镁外还含有______元素;
(2)假设2:该混合金属粉末中除镁外还含有______元素;
(3)假设3:该混合金属粉末中除镁外还含有铝、锌元素.
实验探究:
基于假设3,甲同学设计了如图1所示的实验方案,乙同学设计了如图2所示的实验方案: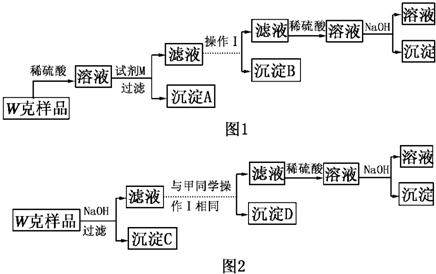
(1)试剂M是______.
(2)写出操作Ⅰ的过程______.
(3)丙同学认为乙同学的方案比甲同学的好,理由是______.
(4)丁同学研究了甲、乙两同学的方案后,用最简便的方法测定了W g样品中金属镁(Mg)的质量分数,他的方法______. 园园的心1年前1
园园的心1年前1 -
 沫偌 共回答了24个问题
沫偌 共回答了24个问题 |采纳率83.3%解题思路:提出假设:实验探究该混合金属粉末中铝、锌元素的存在,可假设只含Al,或假设只含Zn,或二者都有,以此验证;实验探究:(1)(2)根据甲同学基于假设③设计实验方案,样品加入酸之后生成了镁盐、铝盐和锌盐,镁盐加过量的强碱生成了沉淀不溶解,而铝盐和锌盐加过量的强碱先生成了沉淀然后沉淀溶解;而镁盐、铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,锌盐加过量的弱碱先生成了沉淀然后沉淀溶解,由实验方案可知镁盐、铝盐和锌盐形成的沉淀分三次分离,第一次为:Mg(OH)2,试剂M为NaOH溶液,第二次为:Al(OH)3,铝盐和锌盐加过量的强碱先生成了沉淀,然后沉淀溶解,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,又形成了铝盐和锌盐,锌盐加过量的弱碱先生成了沉淀,然后沉淀溶解,铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,这样实现了Al(OH)沉淀的分离;第三次为Zn(OH)2,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,再加入适量的NaOH溶液,形成沉淀;(3)根据对比甲、乙两同学的实验,发现甲比乙多了第一步加稀硫酸;(4)Mg不与碱反应,沉淀C为Mg,以此解答.提出假设:除Mg外,还含有Al、Zn中的一种或两种,因此粉末的组成有三种可能,即除Mg外只含Al、只含Zn、或既含Al又含Zn,
故答案为:Al;Zn;
实验探究:由实验方案可知镁盐、铝盐和锌盐形成的沉淀分三次分离,
第一次为:Mg(OH)2,试剂M为NaOH溶液,
第二次为:Al(OH)3,铝盐和锌盐加过量的强碱先生成了沉淀,然后沉淀溶解,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解又形成了铝盐和锌盐,锌盐加过量的弱碱先生成了沉淀,然后沉淀溶解,铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,实现了Al(OH)3沉淀的分离;
第三次为Zn(OH)2,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,再加入适量的NaOH溶液,形成沉淀,
(1)由上述分析可知,试剂M为NaOH溶液,故答案为:NaOH溶液;
Al(OH)3;
(2)操作I为在滤液中加入稀硫酸,直至生成的沉淀刚好溶解,再加入足量的稀氨水,故答案为:在滤液中加入稀硫酸,直至生成的沉淀刚好溶解,再加入足量的稀氨水;
(3)对比甲、乙两同学的实验,发现甲比乙多了第一步加稀硫酸,其优点为步骤简单,节约试剂,
故答案为:步骤简单,节约试剂;
(4)Mg不与碱反应,图2中沉淀C为Mg,将沉淀C小心洗涤、干燥后称量、计算即可测定了W g样品中金属镁(Mg)的质量分数,故答案为:将沉淀C小心洗涤、干燥后称量、计算即可.点评:
本题考点: 物质的检验和鉴别的实验方案设计;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了金属的性质以及实验方案的设计,题目难度较大,尤其是锌及其化合物性质的运用,注意把握性质的差异分析分离流程为解答的关键.1年前查看全部
- 填表:用有关化学用语表示 序号 化学符号 ① 5个钾原子 ______ ② 4个铵根离子 ______ ③ 氧化铝中铝
填表:用有关化学用语表示
序号 化学符号 ① 5个钾原子 ______ ② 4个铵根离子 ______ ③ 氧化铝中铝的化合价为+3价
2O3+3 Al
2O3+3 Al ④ n个水分子 ______ ⑤ 氖原子结构示意图 ______  一颗朱砂痣1年前1
一颗朱砂痣1年前1 -
 whereto339 共回答了26个问题
whereto339 共回答了26个问题 |采纳率88.5%解题思路:①原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.
②离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字.
③化合价的表示方法,在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后.
④分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字.
⑤①由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,故5个钾原子表示为:5K.
②由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字,故4个铵根离子可表示为:4NH4+.
③由化合价的表示方法,在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,故氧化铝中铝的化合价为+3价可表示为:
+3
Al2O3 .
④由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,则n个水分子可表示为:nH2O.
⑤氖原子中核内质子数为10,核外有2个电子层,第一层上有2个电子,第二层上有8个电子,其原子结构示意图为: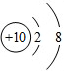 .
.
故答案为:
序号 化学符号
① 5个钾原子 5K
② 4个铵根离子 4NH4+
③ 氧化铝中铝的化合价为+3价
+3
Al2O3
④ n个水分子 nH2O
⑤ 氖原子结构示意图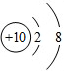
点评:
本题考点: 化学符号及其周围数字的意义;原子结构示意图与离子结构示意图.
考点点评: 本题难度不大,主要考查同学们对常见化学用语(原子符号、分子符号、化合价、离子符号、原子结构示意图等)的书写和理解能力.1年前查看全部
- abaqus中铝的塑性参数设置?
abaqus中铝的塑性参数设置?
例如钢在单向压缩试验中得到的塑性参数:
真实应力(MPa) 塑性应变
418 0
500 0.01581
605 0.02983
695 0.056
780 0.095
829 0.15
882 0.25
908 0.35
921 0.45
932 0.55
955 0.65
988 0.75
1040 0.85 wwwup1年前1
wwwup1年前1 -
 梦梦12 共回答了17个问题
梦梦12 共回答了17个问题 |采纳率76.5%1年前查看全部
- 化学中铝分子经过化学变化不能变成金分子
 射洪aa临济寺1年前5
射洪aa临济寺1年前5 -
 网上种田 共回答了19个问题
网上种田 共回答了19个问题 |采纳率94.7%理论上可以,因为只要能增加核内的质子,中子,增加核外的电子就可以,可惜不是化学反应,而且我也不知道现有技术能不能做到这点.
化学反应的话,没有什么元素可以变成什么元素这种说法,只能说分子的组成发生了变化,或者原子变成离子什么的.但可以说产物中Au,或者按楼上的方程,Al置换出了Au1年前查看全部
- 用化学符号表示:(1)2个镁原子______;(2)1个氢分子______;(3)氧化铝中铝元素显+3价+3Al2O3+
用化学符号表示:
(1)2个镁原子______;
(2)1个氢分子______;
(3)氧化铝中铝元素显+3价
2O3+3 Al ;
2O3+3 Al
(4)锂原子(Li)结构示意图为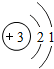 易失去最外层一个电子.则锂的氧化物的化学式为______.
易失去最外层一个电子.则锂的氧化物的化学式为______.  四oo非思1年前1
四oo非思1年前1 -
 jiexiaoz 共回答了17个问题
jiexiaoz 共回答了17个问题 |采纳率94.1%解题思路:(1)根据原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字进行解答;
(2)根据分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字进行解答;
(3)根据元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后进行解答;
(4)根据锂原子(Li)结构示意图为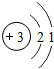 易失去最外层一个电子,可知锂元素的化合价为+1价,而氧元素的化合价为-2价进行解答.
易失去最外层一个电子,可知锂元素的化合价为+1价,而氧元素的化合价为-2价进行解答.
(1)由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字可知,故2个镁原子可表示为2Mg;
故填:2Mg;
(2)由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字可知,1个氢分子可表示为H2;
故填:H2;
(3)元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,氧化铝中铝元素呈正三价可表示为
+3
Al2O3;
故填:
+3
Al2O3;
(4)锂原子(Li)结构示意图为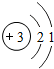 易失去最外层一个电子,可知锂元素的化合价为+1价,而氧元素的化合价为-2价,所以锂的氧化物的化学式为Li2O.
易失去最外层一个电子,可知锂元素的化合价为+1价,而氧元素的化合价为-2价,所以锂的氧化物的化学式为Li2O.
故填:Li2O.点评:
本题考点: 化学符号及其周围数字的意义;原子结构示意图与离子结构示意图;化学式的书写及意义.
考点点评: 本题难度不大,主要考查同学们对常见化学用语(元素符号、原子符号、分子符号、离子符号等)的书写和理解能力.1年前查看全部
- 请用适当的化学用语填空:(1)两个氮原子______(2)氧化铝中铝元素的化合价+3Al2O3+3Al2O3(3)四个铁
请用适当的化学用语填空:
(1)两个氮原子______
(2)氧化铝中铝元素的化合价
O3+3 Al2
O3+3 Al2
(3)四个铁离子______
(4)保持五氧化二磷化学性质的最小微粒______. tansini1年前1
tansini1年前1 -
 香片茶 共回答了20个问题
香片茶 共回答了20个问题 |采纳率90%解题思路:根据原子的表示方法:用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.进行解答;
元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后.
根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字;进行解答;
根据分子的表示方法:正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,进行解答;根据原子的表示方法:用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.因此2个氮原子表示为:2N;
根据元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后.氧化铝中铝元素的化合价可表示为:
+3
Al2O3;
根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字;因此4个铁离子表示为:4Fe3+;
保持五氧化二磷化学性质的最小微粒是五氧化二磷分子,根据分子的表示方法:正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,因此五氧化二磷分子表示为:P2O5;
故答案为:(1)2N;(2)
+3
Al2O3;(3)4Fe3+;(4)P2O5;点评:
本题考点: 化学符号及其周围数字的意义.
考点点评: 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础.1年前查看全部
- 已知在Al2O3中铝元素的质量分数为52.94%,求氧元素的相对原子质量
 晓lily1年前1
晓lily1年前1 -
 黑狼2007 共回答了13个问题
黑狼2007 共回答了13个问题 |采纳率100%2*27/(2 * 27 + 3*x) = 52.94
x = 161年前查看全部
- 铝土矿的主要成分是Al2O3,请计算Al2O3中铝元素和氧元素的原子个数比是多少?
 ww之都1年前3
ww之都1年前3 -
 微风之晨 共回答了12个问题
微风之晨 共回答了12个问题 |采纳率100%解题思路:根据氧化铝化学式的含义进行分析解答即可.由氧化铝的化学式可知,1个氧化铝分子是由2个铝原子和3个氧原子构成的,铝元素和氧元素的原子个数比是2:3.
故答案为:2:3.点评:
本题考点: 化学式的书写及意义.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义进行分析问题、解决问题的能力.1年前查看全部
- 某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、
某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在。所用试剂:样品、pH试纸、稀H 2 SO 4 、NaOH溶液、稀NH 3 ·H 2 O。该小组探究过程如下:
● 查阅资料:
①镁、铝、锌都是银白色的金属
②锌(Zn)可以与NaOH溶液反应生成H 2
③Zn(OH) 2 为白色固体,难溶于水,可溶于强碱及NH 3 ·H 2 O
④Zn 2+ 易形成络合物如Zn(NH 3 ) 4 2+ ,该络合物遇强酸分解生成Zn 2+ 、NH 4 +
● 提出假设:
(1)假设①:该混合金属粉末中除镁外还含有________元素
假设②:该混合金属粉末中除镁外还含有________元素
假设③:该混合金属粉末中除镁外还含有铝、锌元素
● 实验探究:甲同学基于假设③设计实验方案如下: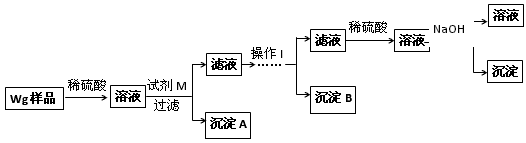
乙同学同样基于假设3设计另一实验方案如下: 
(2)试剂M是________________;沉淀B是__________________。
(3)丙同学认为乙同学的方案比甲同学的好,理由是______________________。
(4)丁同学研究了甲、乙两同学的方案后,在其中一种方案的基础上用最简便方法测定了Wg样品中金属镁(Mg)的质量,他的方法是____________________________。
(5)操作Ⅰ的主要过程是:在滤液中逐滴加入,直至生成的沉淀刚好溶解,再加入足量的_________________。
(6)某溶液中含有Zn 2+ 、Al 3+ 、NH 4 + 和SO 4 2- 等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图像正确的是__________。
A.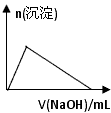
B.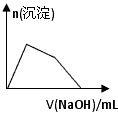
C.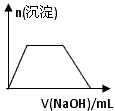
D.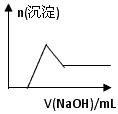
 wkn060651年前1
wkn060651年前1 -
 hsgm80 共回答了8个问题
hsgm80 共回答了8个问题 |采纳率75%(1)假设①:铝(或Al);假设②:锌(或Zn)
(2)NaOH溶液(或氢氧化钠溶液,无“溶液”两字不扣分;Al(OH) 3
(3)步骤简单;节约试剂
(4)将沉淀C洗涤、小心干燥后称量
(5)稀硫酸;稀氨水
(6)B1年前查看全部
- 取100mL的NaOH溶液恰好能于10g某镁铝合金完全反应.求该合金中铝的质量分数
 留缘剑客1年前1
留缘剑客1年前1 -
 深海贝泪 共回答了19个问题
深海贝泪 共回答了19个问题 |采纳率84.2%2Al+2NaOH+2H2O==2NaAlO2+3H2
54g 2mol
M 0.1Xmol
M=2.7X(克)
铝质量分数为100%*2.7X/10=27X%
题目缺NaOH溶液物质的量浓度(设为Xmol/L),自己代入吧.1年前查看全部
- 为什么常温时在空气中铝不易被腐蚀?
 宝宝爱尚三1年前3
宝宝爱尚三1年前3 -
 幻影梦神 共回答了20个问题
幻影梦神 共回答了20个问题 |采纳率90%铝其实常温下很容易被空气中的氧气氧化,但产物会覆盖在铝表面,形成一层致密的保护膜,阻碍铝进一步被氧气氧化,因此表现出Al不易被腐蚀1年前查看全部
- 某研究性学习小组为测定镁和铝的混合物中铝的质量分数,称取该混合物ag
某研究性学习小组为测定镁和铝的混合物中铝的质量分数,称取该混合物ag
某研究性学习小组为测定镁和铝的混合物中铝的质量分数,称取该混合物a g,溶于200 mL 5 moL HCl溶液中,共收集到标准状况下的氢气3.36 L.
(1)a的取值范围是 _______ .
(2)向反应后所得溶液中逐渐加入4 mol/L的NaOH溶液.当沉淀质量达到最大值时,加入的NaOH溶液的体积是 _______ mL,沉淀的最大质量是 _______ g(用含a的代数式表示)
(3)继续加入NaOH溶液至沉淀质量不再发生变化时,过滤、洗涤并灼烧沉淀至恒重,所得残余固体的质量仍为a g,计算原混合物中铝的质量分数(写出计算过程). 祖儿581年前1
祖儿581年前1 -
 bjh017 共回答了20个问题
bjh017 共回答了20个问题 |采纳率90%n(HCl)=0.2*5=1mol 收集到标准状况下的氢气3.36 L n(H2)=3.36/22.4=0.15mol 说明HCl过量
Mg------------H2 2Al-------3H2
24g 1mol 54g 3mol
x=3.6g 0.15mol x=2.7g 0.15mol
a的取值范围是: 2.7g1年前查看全部
- (1)请将下列短文中加点的文字转化为恰当的化学用语,填在后面的横线上:刚玉是宝石的一种,它的主要成分是氧化铝,氧化铝中铝
(1)请将下列短文中加点的文字转化为恰当的化学用语,填在后面的横线上:刚玉是宝石的一种,它的主要成分是氧化铝,氧化铝中铝元素的化合价为+3价 ,而不是氢氧化铝 , 其硬度仅次于金刚石 ,一些刚玉由于混有少量亚铁离子 等杂质而显蓝色,俗称蓝宝石。
(2)随着生活水平的提高,生活中的私家车越来越多。
①制造汽车轮胎的橡胶属于 。
②汽车电路导线大多是铜制的,这是利用金属铜的延展性和 。A.有机合成材料 B.金属材料 C.复合材料 D.无机材料
③今年的3.15给整个汽车行业带来了不小的震荡,很多汽车使用沥青阻尼片,导致车内有异味,沥青是由不同相对分子质量的碳氢化合物及其非金属衍生物组成的,由此推断沥青属于 (“混合物”或“纯净物”)。
④在汽油中加入适量的乙醇就得到乙醇汽油,使用乙醇汽油的优点 (答一点)。
⑤车用铅酸电池充电的反应(条件已省略):2PbSO 4 +2H 2 O =Pb+2H 2 SO 4 + 。 handsome1231231年前0
handsome1231231年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 数学问题.追加10分1.一种由铜和铝组成的合金中铝重7500克,铜和铝质量的比是2 :3,问这种合金中铜重多少克?合金重
数学问题.追加10分
1.一种由铜和铝组成的合金中铝重7500克,铜和铝质量的比是2 :3,问这种合金中铜重多少克?合金重多少克?
2.一种盐水中,盐相当于水的二十分之一,现在有盐水4.2千克,其中含烟多少克?
2.一种盐水中,盐相当于水的二十分之一,现在有盐水4.2千克,其中含盐多少克?
修改下...对了 要过程 jackyluolz1年前3
jackyluolz1年前3 -
 魔狱之主 共回答了23个问题
魔狱之主 共回答了23个问题 |采纳率87%1.7500÷3×2=铜重 7500+铜重=合金重
2.设含盐x克.
1/20×x=4.2
x=4.2÷1/20
x=4.2×20/1
x=盐多少克1年前查看全部
- 按要求用正确的化学符号回答.(1)2个氮原子______;(2)人个硫酸根离子______;(人)氧化铝中铝元素显+人价
按要求用正确的化学符号回答.
(1)2个氮原子______;
(2)人个硫酸根离子______;
(人)氧化铝中铝元素显+人价
2O人+人 Al ;
2O人+人 Al
(4)保持水的化学性质的最x粒子是______;
(1)硝酸银______. 溪音水韵1年前1
溪音水韵1年前1 -
 legend214 共回答了26个问题
legend214 共回答了26个问题 |采纳率88.5%解题思路:(1)根据原子的表示方法:用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.进行解答;
(2)根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字;进行解答;
(3)根据元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,进行解答;
(4)保持水的化学性质的最小粒子是水分子;根据分子的表示方法:正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,进行解答;
(5)根据分子的表示方法,进行解答.(1)根据原子的表示方法:用元素符号来表示一口原子,表示多口该原子,就在其元素符号前加上相应的数字.因此2口氮原子 表示为:2N;故答案为:2N;
(2)根据离子的表示方法:在表示该离子的元素符号7上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1口电荷时,1要省略.若表示多口该离子,就在其元素符号前加上相应的数字;因此3口硫酸根离子表示为:3S三42-;故答案为:3S三42-;
(3)根据元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,因此氧化铝中铝元素显+3价表示为:
+3
Al2三3;故答案为:
+3
Al2三3;
(4)保持水的化学性质的最小粒子是;根据分子的表示方法:正确书写物质的化学式,表示多口该分子,就在其化学式前加上相应的数字,因此水分子表示为:H2三;故答案为:H2三;
(t)根据分子的表示方法,因此硝酸银表示为:AgN三3;故答案为:AgN三3 .点评:
本题考点: 化学符号及其周围数字的意义;化学式的书写及意义;常见元素与常见原子团的化合价.
考点点评: 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础.1年前查看全部
- 明矾中铝元素的质量分数
 tian911ya1年前1
tian911ya1年前1 -
 ruguoai1 共回答了18个问题
ruguoai1 共回答了18个问题 |采纳率77.8%明矾的化学式:KAl(SO4)2.12H2O
Al%= Al/KAl(SO4)2.12H2O= 27/(39+27+86*2+12*18)=27/474=5.7%1年前查看全部
- 等质量的镁和铝铜合金分别与足量的盐酸反应,放出相同量的氢气,则合金中铝与铜的质量比是
等质量的镁和铝铜合金分别与足量的盐酸反应,放出相同量的氢气,则合金中铝与铜的质量比是
A 3:1 B 1:3 C 2:1 D 1:1 qushengjie1986541年前1
qushengjie1986541年前1 -
 小小我的 共回答了21个问题
小小我的 共回答了21个问题 |采纳率85.7%A 3:1
铜不与盐酸反应.
镁和铝与盐酸反应得到相同量的的氢气时,镁与铝的质量比是24/18,现镁与合金的质量比是24/24=24/(18+6)即可知合金中铝与铜的质量比是18/6=3/1.1年前查看全部
- 铝在氧气中燃烧生成氧化铝 反应中铝 氧 氧化铝的质量比是多少?
铝在氧气中燃烧生成氧化铝 反应中铝 氧 氧化铝的质量比是多少?
我计算出的结果是
27:32:102
我感觉肯定是错的,但是不知道哪里错.
还有 氧化铝的化合公式是:AL2O3吗?
我算出来的结果也是 9:8:17 但是书的的题没有答案,看了半天才知道,原来答案没有除以最小公倍数. 182yes1年前1
182yes1年前1 -
 foreveryanan 共回答了21个问题
foreveryanan 共回答了21个问题 |采纳率90.5%氧化铝的化学式是AL2O3
由反应方程式4AL+3O2=2AL2O3
所以他们的质量比为
4*27:3*32:2*102=9:8:171年前查看全部
- 向100ML1MOL/L硫酸铝溶液中加入2.0MOL/LNAOH溶液,得到沉淀中所含铝元素的质量与溶液中铝元素的质量相等
向100ML1MOL/L硫酸铝溶液中加入2.0MOL/LNAOH溶液,得到沉淀中所含铝元素的质量与溶液中铝元素的质量相等,求所加NAOH溶液的体积是多少
 逆天华丽1年前1
逆天华丽1年前1 -
 wjxm 共回答了20个问题
wjxm 共回答了20个问题 |采纳率100%硫酸铝与氢氧化钠反应式:Al2(SO4)3 + 6NaOH = 3Na2SO4 + 2Al(OH)3
所加NAOH溶液的体积是
0.1L * 1mol/L * 6 / 2.0mol/L = 0.3L = 300ml
注:式中6为1摩硫酸铝与6摩氢氧化钠定量反应.1年前查看全部
- 用正确的化学用语填空:(1)保持氧气化学性质微粒______;(2)氧化铝中铝元素显+3价______;(3)硫酸
用正确的化学用语填空:(1)保持氧气化学性质微粒______;(2)氧化铝中铝元素显+3价______;(3)硫酸
用正确的化学用语填空:
(1)保持氧气化学性质微粒______;
(2)氧化铝中铝元素显+3价______;
(3)硫酸铵______;
(4)说出数字的含义:2SO42-______;______;______.
 萧慕唐1年前1
萧慕唐1年前1 -
 manbufengx 共回答了19个问题
manbufengx 共回答了19个问题 |采纳率84.2%(1)保持氧气化学性质微粒是氧分子,由分子的表示方法,氧分子可表示为:O2.
(2)由化合价的表示方法,在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,故氧化铝中铝元素显+3价可表示为:
+3
Al2O3.
(3)硫酸铵中铵根显+1价,硫酸根显-2价,故硝酸铵的化学式为:(NH4)2SO4.
(4)2SO42-中的前面的“2”表示两个硫酸根离子;右上角的“2”表示一个硫酸根离子带有两个单位的负电荷;“4”表示一个硫酸根离子中含有4个氧原子.
故答案为:(1)O2;(2)
+3
Al2O3;(3)(NH4)2SO4;(4)两个硫酸根离子;一个硫酸根离子带有两个单位的负电荷;一个硫酸根离子中含有4个氧原子.1年前查看全部
- 1.为将碱洗槽中铝以沉淀形式回收,最好加入氨气,二氧化碳,氢氧化钠还是硝酸?
1.为将碱洗槽中铝以沉淀形式回收,最好加入氨气,二氧化碳,氢氧化钠还是硝酸?
1.说明为何用二氧化碳,其他为什么不行
2.向氯化钡溶液中加入硝酸银和溴化钾,当两种沉淀共存时,溴离子浓度比氯离子浓度为?这个题为什么算法是用溴化银的K sp比上氯化银的 Ksp?
3.测定水体中氯化物的含量常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是?这个题为何要加Ksp小的? Emos1年前1
Emos1年前1 -
 lg-fly 共回答了15个问题
lg-fly 共回答了15个问题 |采纳率100%1、碱洗槽,其中溶液必然显碱性,这时铝元素以偏铝酸根(AlO2^-)形式存在,需要加酸才能转化为氢氧化铝沉淀,二氧化碳对应碳酸是一种弱酸,不能溶解氢氧化铝,硝酸过量能够继续溶解氢氧化铝,不利于得到沉淀,需要控制硝酸的量,所以选二氧化碳.
2、两种沉淀共存,说明氯化银和溴化银都建立了沉淀溶解平衡,溶液中银离子的浓度乘以氯离子的浓度等于氯化银的 Ksp,银离子的浓度乘以溴离子的浓度等于溴化银的 Ksp,银离子浓度在一个溶液中只能有一个数值,所以根据溴化银的K sp比氯化银的 Ksp小,得出溴离子浓度比氯离子浓度小.
3、我在网上查了一下,是A.KBr B.KI C.K2S D.K2CrO4吗?网上的解释如下:
由[Ag+]大小知,饱和时只有Ag2CrO4中的[Ag+]比AgCl大,在AgCl沉淀完后再产生Ag2CrO4沉淀,其他均在AgCl前沉淀,不能作指示剂,另外这里作指示剂时,生成的沉淀必须有色,以便观察,如Ksp(Ag2SO4)=1.7×10-5,虽然沉淀时[Ag+]较AgCl大,但Ag2SO4是白色沉淀,不能作指示剂.
不知你是否理解?1年前查看全部
- 置换反应中铝的化合价是多少假设用铝来置换硫酸铁中的铁,那么铁是+3价,但老师说置换反应中铁只有+2价,而且为什么铝有三价
置换反应中铝的化合价是多少
假设用铝来置换硫酸铁中的铁,那么铁是+3价,但老师说置换反应中铁只有+2价,而且为什么铝有三价而铁没有呢? 大唐一人1年前1
大唐一人1年前1 -
 好奇女 共回答了19个问题
好奇女 共回答了19个问题 |采纳率89.5%因为Fe3+具有氧化性而不能发生置换反应,Al只有三价1年前查看全部
- 请问氮化铝 中铝化合价是多少?
 不想上岸的小鱼1年前4
不想上岸的小鱼1年前4 -
 拔丝地瓜战烧鸭 共回答了25个问题
拔丝地瓜战烧鸭 共回答了25个问题 |采纳率76%+3价.因为氮是7号元素,它的核外电子为25,最外边电子数为5,超过了4,因为一般最外边电子为8才稳定,因此氮容易得3个电子,然而铝就刚好想反,为283,最外边电子数为3,若象氮一样得电子,那么就要得5个,而其最外边只有3个,因而失电子明显比得电子容易得多,所以铝会失去电子,显现+3的化合价!
希望你化学越来越棒!1年前查看全部
- 为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol•L-1稀硫酸
为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol•L-1稀硫酸,
01,我想知道元素守恒的解法
题目没打完:为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol•L-1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560 mL;再加入0.2 mol•L-1 NaOH溶液至沉淀质量恰好不再变化,用去350 mL NaOH溶液。则所取样品中铝的物质的量为 金华婺剧网1年前1
金华婺剧网1年前1 -
 zhuimengxinghun 共回答了15个问题
zhuimengxinghun 共回答了15个问题 |采纳率86.7%其实这道题只需要求Al的量,并不需要用到生成氢气的体积这一条件.
加硫酸将合金全部溶解,故金属都变为相应的硫酸盐,硫酸被还原生成氢气.Al~1.5 H2,Mg~H2.这里没有提到“恰好完全溶解”,因此硫酸可能过量.
加入氢氧化钠,一方面NaOH与可能多余的硫酸反应,一方面与金属离子反应.这里很巧妙的一点是,若想象氢氧化钠使得所有金属生成对应的氢氧化物沉淀,同时中和多余的硫酸,这时氢氧化钠与硫酸的量是相当的(这里的相当是氢离子、氢氧根离子数相同,二者物质的量比是2:1).
进一步,实际上生成的Al(OH)3会与氢氧化钠进一步反应,Al(OH)3+OH-=AlO2 - +2H2O.正因为这一步反应,使得“沉淀质量恰好不再变化”时,氢氧化钠用量超过了硫酸用量的2倍.根据上述方程,可知多出的氢氧化钠与氢氧化铝按1:1进行反应.
经过分析,求Al的物质的量,思路很明确了.设其物质的量为a.
算得氢氧根离子(来自氢氧化钠)比氢离子(来自硫酸)多出的物质的量,多出的量全部用来和Al(OH)3反应.
有守恒,Al~Al(OH)3~AlO2 OH-(超出量).
因此,OH-超出H+的物质的量等于Al的物质的量
a=0.35L*(0.2 mol•L-1)*1 - 01L*( 0.3 mol•L-1)*2=0.01 mol
上式中,减号后面一项,最后乘以2代表一个硫酸含有两个氢离子1年前查看全部
- 地壳中铝的含量那么大,为什么它的价钱还一路飚升
 8310016661年前1
8310016661年前1 -
 wxj_tf 共回答了16个问题
wxj_tf 共回答了16个问题 |采纳率87.5%铝含量多,但不意味着制备容易,铝要通过电解氧化铝(以冰晶石为溶剂)制备,耗费能量巨大,这些电能是燃煤来的,自然价格不低了.就好像自然界海水中氢元素也很多,但是氢气价格不便宜,是一样的.1年前查看全部
- 偏铝酸根中铝元素几价?
 上世纪1年前3
上世纪1年前3 -
 janehu7608 共回答了24个问题
janehu7608 共回答了24个问题 |采纳率83.3%+3价因为整个偏铝酸根为负一价,两个O为-4加铝为+3,1年前查看全部
- 在硫酸、盐酸溶液中铝片为什么可以把四价钛还原成三价钛?原理和方程式
 ding11441年前2
ding11441年前2 -
 厌京疲久10 共回答了21个问题
厌京疲久10 共回答了21个问题 |采纳率95.2%3Ti4+ +Al =3Ti3+ +Al3+ 很简单的一个氧化还原反应,四价钛具有强氧化性,铝具有还原性,所以理所当然发生了氧化还原反应1年前查看全部
- 将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中铝元素的质量与溶液中所含铝元素的质量相等,则原氯化铝溶液和氢氧化钠溶
将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中铝元素的质量与溶液中所含铝元素的质量相等,则原氯化铝溶液和氢氧化钠溶液的物质的量浓度之比可能是( )
A. 1:3
B. 3:2
C. 1:4
D. 2:7 撩望1年前1
撩望1年前1 -
 xman_go 共回答了13个问题
xman_go 共回答了13个问题 |采纳率100%解题思路:将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,沉淀为Al(OH)3,溶液中的铝可能为AlCl3或NaAlO2,
可分别发生:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,结合反应的离子方程式分为两种情况讨论计算.设AlCl3和NaOH的浓度分别为c1和c2,相同体积为V,
若NaOH过量,生成NaAlO2,此时参加反应的AlCl3的物质的量是c1Vmol,NaOH是3c1Vmol,生成c1V mol 的Al(OH)3,
又因为得到的沉淀物中铝元素的质量和溶液中铝元素的质量相等,则说明第一步反应完后,生成的Al(OH)3有一半([1/2]c1V)发生Al(OH)3+OH-=AlO2-+2H2O,
所以可求的NaOH的物质的量为:3c1V+0.5c1V=3.5c1V=c2V,所以c1:c2=2:7,D选项符合;
当氯化铝过量时,氢氧化钠不足,生成氢氧化铝白色沉淀发生反应:Al3++3OH-═Al(OH)3↓,设反应掉的铝离子物质的量为x,得到的沉淀物中铝元素的质量和溶液中铝元素的质量相等,则c1V-x=x,所以x=0.5c1V,消耗氢氧化钠3x,即1.5c1Vmol,所以1.5c1V=c2V,所以此时c1:c2=2:3,没有选项符合,
故选D.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查了根据方程式进行计算,同时考查学生分析问题、解决问题能力,很多同学往往只考虑溶液中的铝元素为铝离子而漏掉为偏铝酸根离子而导致错误,为易错点,题目难度中等.1年前查看全部
- 为测定某镁铝合金样品 为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol·L
为测定某镁铝合金样品
为测定某镁铝合金样品中铝的含量,进行了下列实验:
取一定量合金,加入100 mL 0.3 mol·L -1 稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560 mL;再加入0.2 mol·L -1 NaOH溶液至沉淀质量恰好不再变化,用去350 mL NaOH溶液.则所取样品中铝的物质的量为[ ] A.0.005 mol
B.0.01 mol
C.0.025 mol
D.0.03 mol xiaxuhui1年前1
xiaxuhui1年前1 -
 巴巴闭查笃撑 共回答了17个问题
巴巴闭查笃撑 共回答了17个问题 |采纳率70.6%B1年前查看全部
- 加氢氧化钠溶液除铁中铝杂志.不是反应生成了偏铝酸钠吗怎么还能除杂它是沉淀吗?
 longbin1年前1
longbin1年前1 -
 ldrjz 共回答了19个问题
ldrjz 共回答了19个问题 |采纳率100%偏铝酸钠是溶液,只要过滤就可以得到纯净的铁1年前查看全部
- Al2Cl6中铝原子和氯原子的成键类型是什么
 WJ2007311年前3
WJ2007311年前3 -
 胜德 共回答了16个问题
胜德 共回答了16个问题 |采纳率93.8%Al2Cl6是共价分子,可以看成两个氯化铝拼成,每个铝和三个氯共用一对电子,此时每个铝差2个电子,和另一个铝的氯成配位键,所以每个铝和四个氯成键,中间的氯分别和两个铝成键1年前查看全部
- 元素周期表是学习化学的重要工具.如图是元素周期表中铝元素的信息,请完成相关的问题:
 元素周期表是学习化学的重要工具.如图是元素周期表中铝元素的信息,请完成相关的问题:
元素周期表是学习化学的重要工具.如图是元素周期表中铝元素的信息,请完成相关的问题:
(1)铝元素的元素符号是______.
(2)在铝原子结构示意图中n是______.
(3)铝原子在化学反应中常容易______(“失去”或“得到”)电子,属于______元素(填金属或非金属).铝离子的符号表示为______.
(4)铝元素形成的氧化物的化学式为______. aoeitlaetjo1年前1
aoeitlaetjo1年前1 -
 小碗儿2004 共回答了15个问题
小碗儿2004 共回答了15个问题 |采纳率93.3%解题思路:元素周期表中的一个小格所提供的信息:原子序数、元素符号、元素名称、相对原子质量,在原子中,原子序数=核电荷数=质子数=核外电子数,最外层电子数小于4个易失去电子.根据化合价书写化学式(1)铝元素的元素符号是Al.
(2)在铝原子中,核电荷数=核外电子数,故13=2+8+n,所以n=3.
(3)铝原子最外层电子数为3,小于4个,易失去3个电子使次外层成为最外层,达到8电子稳定结构,铝带金字旁,属于金属元素,铝离子的符号表示为Al3+.
(4)铝元素形成氧化物中铝元素为+3价,氧元素为-2价,根据正负化合价代数和为零的原则写出化学式为Al2O3.
故答案为:(1)Al.
(2)3.
(3)失去 金属 Al3+.
(4)Al2O3.点评:
本题考点: 元素周期表的特点及其应用;核外电子在化学反应中的作用;原子结构示意图与离子结构示意图.
考点点评: 本题考查了对元素周期表中的一个小格所提供的信息的了解情况,及原子结构示意图所表示出的信息和意义,书写化学式时要注意正价在前,负价在后,正负化合价代数和为零.1年前查看全部
- 氯化铝溶液和氢氧化铝溶液等体积混合得到的沉淀中的铝元素和溶液中铝元素的质量相等,求原两种物质量浓度
 天天09091年前2
天天09091年前2 -
 blackufo 共回答了15个问题
blackufo 共回答了15个问题 |采纳率100%题目没给全,但这种题解题思路比较好把握
AlCl3+3NaoH=Al(oH)3
1 3 1
Al(oH)3+NaoH=NaAlO2+2H2O
0.5 0.5 0.5 则AlCl3:NaoH=1:3.5
设有1mol的AlCl3,先生成1mol的Al(oH)3沉淀,然后拿出0.5mol沉淀和NaoH继续反应生成0.5molNaAlO2溶液,则沉淀中铝和溶液中的一样多,可推出来NaoH有3.5mol.在根据等体积,算浓度.1年前查看全部
- 铝合金中铝的含量一般为多少?
 八运会1年前1
八运会1年前1 -
 yjl16366 共回答了22个问题
yjl16366 共回答了22个问题 |采纳率95.5%铝含量一般在80%以上,但绝大部分在85%-90%之间1年前查看全部
- 氢氧化钠中铝的腐蚀,到底是析氢腐蚀还是吸氧腐蚀,如果是析氢腐蚀,为什么会产氢气
 daoba0081年前3
daoba0081年前3 -
 海棠春睡123 共回答了19个问题
海棠春睡123 共回答了19个问题 |采纳率84.2%别听楼上的= =.
是吸氧腐蚀.因为氢氧化钠是碱性环境.所以发生吸氧腐蚀.如果是析氢腐蚀的话要求是强酸环境下.吸氧腐蚀一般发生在中性和碱性环境中.
而且铝和氢氧化钠会反应.
2Al+2NAOH+2H2O==2NAAlO2+3H2↑1年前查看全部
- 请给出下列化学方程式及现象铝丝浸入硫酸镁溶液中铝丝浸入硫酸铜溶液中铝丝浸入硫酸铝溶液中铝丝浸入硝酸银溶液中
 huangming5211年前1
huangming5211年前1 -
 gg幽竹 共回答了12个问题
gg幽竹 共回答了12个问题 |采纳率75%铝丝浸入硫酸镁溶液中没有明显现象.(无)
铝丝浸入硫酸铜溶液中铝条表面附有一层红铜,直观现象为铝条变红.(化学方程式 2Al+3CuSo4=3Cu+Al2(So4)3 )
铝丝浸入硫酸铝溶液中没有明显现象.
铝丝浸入硝酸银溶液中铝条表面先附有一层白色物质,后迅速变黑.(银被氧化) 化学方程式 Al+3AgNO3=3Ag+Al(NO3)3 ,4Ag+O2=2Ag2O1年前查看全部
- (2013•惠山区一模)图1是元素周期表中铝元素的部分信息,图2是铝原子的结构示意图.下列说法不正确的是( )
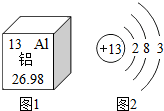 (2013•惠山区一模)图1是元素周期表中铝元素的部分信息,图2是铝原子的结构示意图.下列说法不正确的是( )
(2013•惠山区一模)图1是元素周期表中铝元素的部分信息,图2是铝原子的结构示意图.下列说法不正确的是( )
A.铝元素原子核内的质子数为13
B.铝原子的核外电子分三层排布
C.铝的相对原子质量为26.98g
D.铝元素的化学性质与铝原子的最外层电子数有密切的关系 东邪20071年前1
东邪20071年前1 -
 喝井不忘挖水人 共回答了14个问题
喝井不忘挖水人 共回答了14个问题 |采纳率78.6%解题思路:A、根据在原子中,原子序数=质子数=核外电子数,进行解答;
B、根据铝原子的结构示意图即可解答;
C、根据相对原子质量是有单位的,其单位为“1”,只不过常省略而已,进行解答;
D、根据元素的化学性质由最外层电子数决定,最外层电子数相同的元素化学性质相似,进行解答.A、根据在原子中,原子序数=质子数=核外电子数,元素周期表中铝元素的信息可知:铝原子的质子数为13;故A正确;
B、根据铝原子的结构示意图可知:铝原子的核外电子分三层排布;故B正确;
C、根据相对原子质量是有单位的,其单位为“1”,只不过常省略而已,所以铝的相对原子质量为26.98;故C错误;
D、根据元素的化学性质由最外层电子数决定,所以说铝元素的化学性质与铝原子的最外层电子数有密切的关系;故D正确;
故选C.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查学生对在原子中,原子序数=质子数=核外电子数和元素的化学性质由最外层电子数决定及相对原子质量的单位的知识理解与掌握,并能在解题中灵活应用.1年前查看全部
- 原子吸收光谱法中铝,铁的消解方法
 suncheng1年前1
suncheng1年前1 -
 mingaixin 共回答了12个问题
mingaixin 共回答了12个问题 |采纳率66.7%如果知道样品种类的话,可以根据你的样品去查查药典,一般都有干法,湿法,微波消解法三种,但是样品本身的不同,消解过程中的各阶段反应时间及用其他参数也不同.
最主要的是知道你的样品种类.
铝铁在原子吸收中是比较好做的.1年前查看全部
- 某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验步骤
某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验步骤
1)取样品ag,称取时使用的仪器名称为
(2)将样品溶解于足量的稀盐酸中,过滤,滤液中主要含有
,滤渣中含有 ;在溶解、过滤时使用的仪器有 .
(3)往滤液中加入过量NaOH溶液,过滤.写出该步操作中有关的离子方程式 ,
(4)在第(3)步的滤液中通入足量CO2,过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称重质量为bg.有关的化学方程式为 ,
.
(5)该样品中铝的质量分数的表达式为 .
 隔窗望雪1年前1
隔窗望雪1年前1 -
 头家的形象 共回答了22个问题
头家的形象 共回答了22个问题 |采纳率90.9%1)托盘天平
2)铝离子、镁离子
硅、铜
烧杯、玻璃棒、漏斗、铁架台(铁圈)、滤纸
3)Al3+ + 4OH- === AlO2- +2H2O
Mg2+ +2OH- ===Mg(OH)2↓
4)AlO2- + CO2 + 2H2O ===Al(OH)3↓ + HCO3-
5) 9b/(26a)1年前查看全部
- 化学中铝不是27吗,为什么有些人说铝是18呢
 0703101261年前3
0703101261年前3 -
 啃馍人 共回答了17个问题
啃馍人 共回答了17个问题 |采纳率94.1%Al的相对原子质量是27,
但当它与酸反应产生2 g氢气时,消耗Al的质量就是18
所以有了铝18的说法.
2 Al + 6 HCl = 2 AlCl3 + 3 H2↑
2*27 3*2
x 2
x = 18
所以化学方程式写为 2/3 Al + 2 HCl = 2/3 AlCl3 + H2↑
这样就合二价金属与酸反应的形式相统一.便于计算.1年前查看全部
- (1)用化学用语填空:①三个铁原子______;②两个氢氧根离子______③氧化铝中铝元素的化合价为+3价+3Al2O
 (1)用化学用语填空:
(1)用化学用语填空:
①三个铁原子______;
②两个氢氧根离子______
③氧化铝中铝元素的化合价为+3价
2O3+3 Al ;
2O3+3 Al
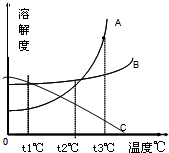
(2)如图所示为A、B、C三种物质的溶解度曲线.
①t1℃时,A、B、C三种物质的溶解度大小依次为S1 g、S2 g、S3 g.则S1、S2、S3这三个数中最大的是______;
②当A中含有少量B 时要提纯得到A,可采用的方法为:______;
③将t3℃时等质量的A、B、C三种物质的饱和溶液降温至t2℃时,所得溶液中溶质的质量分数依次为a%、b%、c%,则a、b、c由大到小的顺序是______. z126211年前1
z126211年前1 -
 dczhang2008 共回答了15个问题
dczhang2008 共回答了15个问题 |采纳率93.3%解题思路:(1)铁元素的元素符号可以表示1个铁原子;
1个氢氧根离子带1个单位负电荷;
元素的化合价应该标在元素符号的正上方;
(2)根据物质的溶解度曲线可以判断某一温度时物质溶解度的大小;
从溶液中结晶的方法有两种:蒸发结晶和降温结晶,物质的溶解度受温度变化影响较小时,应该用蒸发结晶;物质的溶解度受温度变化影响较大时,应该用降温结晶;
饱和溶液的溶质质量分数=[溶解度/100g+溶解度]×100%.(1)①三个铁原子可以表示为3Fe.
故填:3Fe.
②两个氢氧根离子可以表示为2OH-.
故填:2OH-.
③氧化铝中铝元素的化合价为+3价可以表示为
+3
Al2O3.
故填:
+3
Al2O3.
(2)①由图中数据可知,t1℃时,C物质的溶解度最大.
故填:S3.
②A物质的溶解度受温度变化影响较大,B物质的溶解度受温度变化影响较小,当A中含有少量B时要提纯得到A,可采用的方法为降温结晶法.
故填:降温结晶.
③将t3℃时,A、B、C三种物质的溶解度依次减小,所以溶质质量分数也是依次减小,当降温至t2℃时,A、B仍然是饱和溶液,B的溶解度大于A的溶解度,此时B溶液的质量分数大于A溶液的质量分数;
因为A在t2℃时的溶解度大于C在t3℃时的溶解度,所以t2℃时A的质量分数大于C的质量分数,则a、b、c由大到小的顺序是b%>a%>c%.
故填:b%>a%>c%.点评:
本题考点: 化学符号及其周围数字的意义;结晶的原理、方法及其应用;固体溶解度曲线及其作用.
考点点评: 溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同.1年前查看全部
- 把5.1g镁铝合金的粉末放入过量的盐酸中,得到5.6L H2(标准状况下).试计算:(1)该合金中铝的质量分数;(2)该
把5.1g镁铝合金的粉末放入过量的盐酸中,得到5.6L H2(标准状况下).试计算:(1)该合金中铝的质量分数;(2)该合金中铝和镁的物质的量之比.
 yukang861年前1
yukang861年前1 -
 文之大者 共回答了22个问题
文之大者 共回答了22个问题 |采纳率100%设该合金中有铝a mol,有镁b mol.
由合金质量为5.1g可得:27a+24b=5.1【1】
2Al------3H2 Mg--------H2
2mol 3mol 1mol 1mol
amol 3/2amol bmol bmol
氢气的总物质的量为:5.6L/(22.4L/mol)=0.25mol
所以3/2a+b=0.25【2】
由【1】【2】可以解得a=0.1,b=0.1
(1)Al的质量分数=2.7g/5.1g*100%=52.94%
(2)铝的物质的量:镁的物质的量=0.1mol:0.1mol=1:1
希望对你能有所帮助.
另外教你一点小窍门:学会培养自己的数感,看到5.1可以马上想到5.1=2.4+2.7,这样可以加快解题速度,提高准确率.
如有不懂,1年前查看全部
- (2009•山西)元素周期表中铝元素的部分信息如图所示,由此得到的结论不正确的是( )
 (2009•山西)元素周期表中铝元素的部分信息如图所示,由此得到的结论不正确的是( )
(2009•山西)元素周期表中铝元素的部分信息如图所示,由此得到的结论不正确的是( )
A.铝的原子序数是13
B.铝是一种金属
C.铝的相对原子质量为26.98g
D.化学反应中铝失电子变成Al3+ angelzc1年前1
angelzc1年前1 -
 爱笑傻丫头 共回答了20个问题
爱笑傻丫头 共回答了20个问题 |采纳率95%解题思路:根据元素周期表中的一个小格所提供的信息进行分析解答本题,弄清13、铝、26.98的含义是解决题目的关键.A、根据元素周期表中的一个小格所提供的信息可知;铝的原子序数是13,故A正确;
B、根据化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁,可知:铝是一种金属,故B正确;
C、根据相对原子质量是有单位的,其单位为“1”,只不过常省略而已;因此铝的相对原子质量为26.98;故C错误;
D、金属元素在化学反应中易失去最外层电子变成阳离子;故D正确;
故选C.点评:
本题考点: 元素周期表的特点及其应用;原子和离子的相互转化;元素的简单分类.
考点点评: 本题主要考查学生辨别元素的种类的方法,相对原子质量的单位为 1及金属元素在化学反应中易失去最外层电子的知识点的理解与掌握.1年前查看全部
- 某混合物中含有硫酸钠和硫酸铝,经实验测知,硫元素的质量分数为25%,则该混合物中铝元素的的质量分数为?
 sweetttea1年前2
sweetttea1年前2 -
 小小小爱心 共回答了17个问题
小小小爱心 共回答了17个问题 |采纳率94.1%设Na2SO4和Al2(SO4)3物质的量分别是x和y
则有:(32x+96y)/(142x+342y)=25%
得x:y=3:1(142x+342y)
所以Na2SO4和Al2(SO4)3物质的量之比=3:1
所以铝元素的质量分数=2*27/(142*3+342)=7%1年前查看全部
- 氧化铝稳定性Al2O3中铝离子在得失电子后变稳定的原因
 豆啊豆1年前1
豆啊豆1年前1 -
 yuheni 共回答了13个问题
yuheni 共回答了13个问题 |采纳率76.9%Al离子最外层电子数是3 所以它既可以失电子又可以得电子
当Al得失电子后最外层变为8电子的稳定结构这时化学性质就趋于稳定了1年前查看全部
- 小学数学网-一种铜铝合金重 75克 ,其中铜与铝的重量之比为8:7,这种合金中铝有(
 新兴购物商城1年前4
新兴购物商城1年前4 -
 accountin35 共回答了12个问题
accountin35 共回答了12个问题 |采纳率91.7%铜40克,铝35克.
铜的重量=75×8/15
铝的重量=75×7/151年前查看全部
大家在问
- 1让睫毛变长 可以用维生素E 或维生素AD吗?
- 2This is a photo.复数形式
- 3方程:30%x9x+1)=20%(x+1)+0.
- 4有一道判断题是这样的:有一吨沙,运走了七分之四,还剩七分之三吨.
- 5f(x)是定义在实数有R上的奇函数,若x大于或等于0时,f(x)=log3(PS:这个3是小3) (1+x),则f(-2
- 6根据语境,依次填写词语最恰当的一项是(
- 7根据四分之一乘五分之二等于七分之三乘三十分之七写出不同的比例,能写几个就写几个.
- 8公交汽车上的一些设施与物理原理相对应,其中正确的是( )
- 9介绍家庭成员的英语作文12句话
- 10问各位英语好的人士:can,must,need,should,等等
- 11周长是15.7的圆形花坛,外面铺宽为1米的环形小路,小路外周长是多少米
- 122014年匆匆而过,一年不复返了。这一年,有没有你没珍惜的机遇?有没有你没做成功、遗憾的事?是怎样的一件事?请你以《假如
- 13(2010•成都)1997个1除以7的余数______.
- 14照样子做练习例:精彩——非常精彩——我们班的表演非常精彩光芒——( )——( )聪明——( )——( )努力——( )—
- 15online school前面加什么介词