(2014•凉州区一模)如图(a)为某日08时海平面气压分布图(单位:百帕),图(b)显示④地24小时内风的变化.读图回
 sylyukio2022-10-04 11:39:541条回答
sylyukio2022-10-04 11:39:541条回答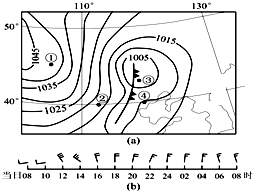
8.图(a)中( )
9.锋通过④地的时间可能为( )
A.上午
B.下午
C.傍晚
D.夜间

已提交,审核后显示!提交回复
共1条回复
 一月就是一天 共回答了11个问题
一月就是一天 共回答了11个问题 |采纳率100%- 解题思路:冷锋是指冷气团势力强大,推动着锋面向暖气团一侧移动所形成的锋面.冷锋过境时多带来大风、降温、雨雪天气,冷锋过境后,冷气团控制该地区,气温下降,气压升高,天气转晴.
a图显示④位于冷锋锋前,b图显示自12时开始出现6级大风,由此判断冷锋过境.
故选:A.点评:
本题考点: 锋面系统与天气.
考点点评: 本题考察锋面系统与天气特征,属于基础题. - 1年前
相关推荐
- (2014•凉州区模拟)如图所示,水平放置的圆筒形气缸与一装有水银的U形管相连,气缸中封闭一定质量的理想气体.开始时U形
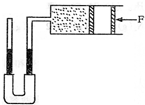 (2014•凉州区模拟)如图所示,水平放置的圆筒形气缸与一装有水银的U形管相连,气缸中封闭一定质量的理想气体.开始时U形管两臂中水银面齐平,活塞处于静止状态,此时气体体积为400mL.若用力F缓慢向左推动活塞,使活塞向左移动一段距离后,U形管两臂中的高度差为25cm,已知外界大气压强为750毫米汞柱,不计活塞与气缸内壁间的摩擦,试回答下列问题:
(2014•凉州区模拟)如图所示,水平放置的圆筒形气缸与一装有水银的U形管相连,气缸中封闭一定质量的理想气体.开始时U形管两臂中水银面齐平,活塞处于静止状态,此时气体体积为400mL.若用力F缓慢向左推动活塞,使活塞向左移动一段距离后,U形管两臂中的高度差为25cm,已知外界大气压强为750毫米汞柱,不计活塞与气缸内壁间的摩擦,试回答下列问题:
①简要说明气缸内气体对活塞的压力是怎样产生的;
②活塞移动过程中,气体内能如何变化?
③求活塞移动后气体的体积. cjdxpjd1年前1
cjdxpjd1年前1 -
 qwtqwegtwerh 共回答了10个问题
qwtqwegtwerh 共回答了10个问题 |采纳率90%解题思路:(1)大量气体分子不断碰撞活塞,从而对活塞产生持续的压力;
(2)气体温度不变,内能不变;
(3)气体做等温变化,根据玻意耳定律列式求解P1V1=P2V2.解;(1)大量气体分子不断碰撞活塞,从而对活塞产生持续的压力
(2)气体做等温变化,内能不变
(3)P1=P0=750mmHg
V1=400mLP2=100mmHg
气体做等温变化,根据玻意耳定律P1V1=P2V2
V2=
P1V1
P2=
750×400
1000mL=300mL
答:①大量气体分子不断碰撞活塞,从而对活塞产生持续的压力;
②活塞移动过程中,气体内能不变;
③活塞移动后气体的体积300mL.点评:
本题考点: 理想气体的状态方程.
考点点评: 此题考查压力压强和气体内能大小因素,需要记忆的知识,再利用气体状态方程时注意分析初末状态的压强、体积和温度.1年前查看全部
- (2014•凉州区模拟)如图所示,足够长的水平传送带以速度v沿逆时针方向转动,传送带的左端与光滑圆弧轨道底部平滑连接,圆
 (2014•凉州区模拟)如图所示,足够长的水平传送带以速度v沿逆时针方向转动,传送带的左端与光滑圆弧轨道底部平滑连接,圆弧轨道上的A点与圆心等高,一小物块从A点静止滑下,再滑上传送带,经过一段时间又返回圆弧轨道,返回圆弧轨道时小物块恰好能到达A点,则下列说法正确的是( )
(2014•凉州区模拟)如图所示,足够长的水平传送带以速度v沿逆时针方向转动,传送带的左端与光滑圆弧轨道底部平滑连接,圆弧轨道上的A点与圆心等高,一小物块从A点静止滑下,再滑上传送带,经过一段时间又返回圆弧轨道,返回圆弧轨道时小物块恰好能到达A点,则下列说法正确的是( )
A.圆弧轨道的半径一定是v2 2g
B.若减小传送带速度,则小物块仍有可能到达A
C.若增加传送带速度,则小物块有可能经过圆弧轨道的最高点
D.不论传送带速度增加到多大,小物块都不可能经过圆弧轨道的最高点 不可以不做吗1年前1
不可以不做吗1年前1 -
 水运天 共回答了18个问题
水运天 共回答了18个问题 |采纳率83.3%解题思路:由于圆轨道是光滑的,物体从A点下滑之后,机械能守恒,物体在传送带上减速运动,减到零之后由开始反向加速,返回圆轨道时速度等于从圆轨道下滑到传送带时的速度大小.根据此时的传送带的速度的不同可以分析得到物体脱离传送带时的速度的大小,与原来下滑时的速度的大小相对比,可以知道物体能不能回到原来的A点.A、物体在圆轨道上下滑的过程中,物体的机械能守恒,
根据机械能守恒可得,mgR=[1/2]mv02,
所以小物块滑上传送带的初速度 v0=
2gR,
物体到达传送带上之后,由于摩擦力的作用开始减速,速度减小为零之后,又在传送带的摩擦力的作用下反向加速,
根据物体的受力可知,物体在减速和加速的过程物体的加速度的大小是相同的,所以物体返回圆轨道时速度大小等于从圆轨道下滑刚到传送带时的速度大小,只要传送带的速度v≥
2gR,物体就能返回到A点.则R≤
v2
2g.故A错误.
B、若减小传送带速度,只要传送带的速度v≥
2gR,物体就能返回到A点.故B正确.
C、D若增大传送带的速度,由于物体返回到圆轨道的速度不变,只能滑到A点,不能滑到圆弧轨道的最高点.故C错误,D正确.
选BD点评:
本题考点: 动量守恒定律;牛顿第二定律;向心力;机械能守恒定律.
考点点评: 本题很好的考查了学生对物体运动状态的分析能力,物体在减速和反向的加速阶段的加速度的大小是相同的,当传送带的速度大小大于或等于物体下滑的速度的时候,物体反向加速的速度的大小才会等于下滑时的速度的大小,才能够返回原来的A点.1年前查看全部
- (2014•凉州区模拟)二十世纪初,为了研究物质内部的结构,物理学家做了大量的实验,揭示了原子内部的结构.发现了电子、中
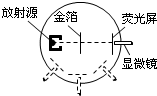 (2014•凉州区模拟)二十世纪初,为了研究物质内部的结构,物理学家做了大量的实验,揭示了原子内部的结构.发现了电子、中子和质子,如图所示是( )
(2014•凉州区模拟)二十世纪初,为了研究物质内部的结构,物理学家做了大量的实验,揭示了原子内部的结构.发现了电子、中子和质子,如图所示是( )
A.卢瑟福的α粒子散射实验装置
B.卢瑟福发现质子的实验装置
C.汤姆逊发现电子的实验装置
D.查德威克发现中子的实验装置 zw011年前1
zw011年前1 -
 等待-风起 共回答了20个问题
等待-风起 共回答了20个问题 |采纳率105%解题思路:放射源放出α粒子,高速运动的α粒子轰击金箔,产生散射现象,这是卢瑟福的α粒子散射实验装置.由图看出,放射源放出α粒子,高速运动的α粒子轰击金箔,产生散射现象,这是卢瑟福的α粒子散射实验装置.
故选A.点评:
本题考点: 物理学史.
考点点评: 对于原子物理发展史上,α粒子散射实验、发现质子、电子、中子的实验装置等都是重要考试的热点,不能张冠李戴.1年前查看全部
- (2014•凉州区二模)已知等差数列{an}的公差为正数,且a3•a7=-12,a4+a6=-4,则S20为( )
(2014•凉州区二模)已知等差数列{an}的公差为正数,且a3•a7=-12,a4+a6=-4,则S20为( )
A. 90
B. -180
C. 180
D. -90 雪山88481年前2
雪山88481年前2 -
 wzhtx 共回答了22个问题
wzhtx 共回答了22个问题 |采纳率81.8%解题思路:由已知得a3,a7是方程x2+4x-12=0的两个根,且a3<a7,解方程x2+4x-12=0,得a3=-6,a7=2,由此能求出S20.∵等差数列{an}的公差为正数,
且a3•a7=-12,a4+a6=a3+a7=-4,
∴a3,a7是方程x2+4x-12=0的两个根,且a3<a7,
解方程x2+4x-12=0,得a3=-6,a7=2,
∴
a1+2d=−6
a1+6d=2,解得a1=-10,d=2,
∴S20=20×(−10)+
20×19
2×2=180.
故选:C.点评:
本题考点: 等差数列的前n项和.
考点点评: 本题考查数列的前20项和的求法,是基础题,解题时要认真审题,注意等差数列的性质的合理运用.1年前查看全部
- (2013•凉州区二模)NA代表阿伏加德罗常数,下列说法正确的是( )
(2013•凉州区二模)NA代表阿伏加德罗常数,下列说法正确的是( )
A.乙烯和丙烯组成的混合气体28g中含有3NA个氢原子
B.22.4L氢气和4g氦气均含有NA个分子
C.23g的钠与氧气完全反应,转移的电子数一定是NA
D.标准状况下,2.24LCl2与稀NaOH溶液反应,转移的电子总数为0.2NA tianruoxuan1年前1
tianruoxuan1年前1 -
 llhh三 共回答了14个问题
llhh三 共回答了14个问题 |采纳率100%解题思路:A.乙烯和丙烯的最简式为CH2,根据最简式计算出混合物中含有氢原子数目;
B.没有告诉在标准状况下,不能使用标况下的气体摩尔体积计算氢气的物质的量;
C.钠为1价金属,23钠的物质的量为1mol,完全反应1mol钠失去1mol电子;
D.氯气与氢氧化钠溶液的反应中,氯气既是氧化剂也是还原剂,0.1mol氯气反应转移0.1mol电子.A.28g乙烯和丙烯的混合物中含有2mol最简式CH2,含有4mol氢原子,含有4NA个氢原子,故A错误;
B.不是标况下,不能使用标况下的气体摩尔体积计算22.4L氢气的物质的量,故B错误;
C.23钠的物质的量为1mol,1mol钠完全反应失去1mol电子,根据电子守恒,转移的电子数一定是NA,故C正确;
D.标准状况下2.24L氯气的物质的量为0.1mol,0.1mol氯气与足量氢氧化钠溶液反应转移了0.1mol电子,转移的电子总数为0.1NA,故D错误;
故选C.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.1年前查看全部
- (2014•凉州区模拟)如图所示,直角三角形ABC中存在一匀强磁场,比荷相同的两个粒子沿AB方向射入磁场,分别从AC边上
 (2014•凉州区模拟)如图所示,直角三角形ABC中存在一匀强磁场,比荷相同的两个粒子沿AB方向射入磁场,分别从AC边上的P、Q两点射出,则( )
(2014•凉州区模拟)如图所示,直角三角形ABC中存在一匀强磁场,比荷相同的两个粒子沿AB方向射入磁场,分别从AC边上的P、Q两点射出,则( )
A.从P射出的粒子速度大
B.从Q射出的粒子速度大
C.从P射出的粒子,在磁场中运动的时间长
D.两粒子在磁场中运动的时间一样长 aa贵性1年前1
aa贵性1年前1 -
 ctt1018 共回答了16个问题
ctt1018 共回答了16个问题 |采纳率93.8%解题思路:粒子在磁场中做圆周运动,根据题设条件作出粒子在磁场中运动的轨迹,根据轨迹分析粒子运动半径和周期的关系,从而分析得出结论.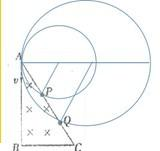 粒子在磁场中做匀速圆周运动,根据几何关系(图示弦切角相等),粒子在磁场中偏转的圆心角相等,根据粒子在磁场中运动的时间:
粒子在磁场中做匀速圆周运动,根据几何关系(图示弦切角相等),粒子在磁场中偏转的圆心角相等,根据粒子在磁场中运动的时间:
t=[θ/2πT,又因为粒子在磁场中圆周运动的周期T=
2πm
qB],可知粒子在磁场中运动的时间相等,故D正确,C错误;
如图,粒子在磁场中做圆周运动,分别从P点和Q点射出,由图知,粒子运动的半径RP<RQ,又粒子在磁场中做圆周运动的半径R=[mv/Bq]知粒子运动速度vP<vQ,故A错误,B正确;
故选BD点评:
本题考点: 带电粒子在匀强磁场中的运动.
考点点评: 粒子在磁场中做圆周运动,洛伦兹力提供向心力,由此根据运动特征作出粒子在磁场中运动的轨迹,掌握粒子圆周运动的周期、半径的关系是解决本题的关键.1年前查看全部
- (2014•凉州区一模)读图,回答:图中( )
(2014•凉州区一模)读图,回答:图中( )
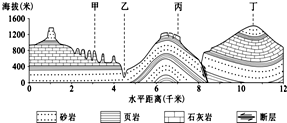
A.甲处侵蚀作用最强烈
B.乙处由内力作用形成
C.丙处易发生滑坡现象
D.丁处是典型的背斜山 sdhisdihfhiosdf1年前1
sdhisdihfhiosdf1年前1 -
 回来宝贝 共回答了13个问题
回来宝贝 共回答了13个问题 |采纳率92.3%解题思路:地球上的地貌是由于内、外力共同作用形成的;向斜槽部因受挤压,岩层变得紧实,不易被侵蚀反而成为山岭.A、甲处为峰林,是流水的溶蚀作用,但不能判断是否最强烈,故不符合题意.
B、图例中可知:乙处是砂岩,砂岩是沉积岩,是外力沉积作用形成的,地势降低说明受到外力的侵蚀作用,故不符合题意.
C、丙处位于背斜顶部,容易受到外力作用的侵蚀,且地势陡峭,坡度大,易发生滑坡现象,故正确.
D、丁处为典型的向斜成山地貌,故不符合题意.
故选:C.点评:
本题考点: 地表形态变化的原因和地质构造.
考点点评: 本题以地质构造示意图为背景,考查了地貌和地质作用,属于基础题.1年前查看全部
- (2013•凉州区二模)将20克NaOH固体溶解于足量水中,并通入足量CO2气体,生成的溶液中各微粒浓度关系正确的是(
(2013•凉州区二模)将20克NaOH固体溶解于足量水中,并通入足量CO2气体,生成的溶液中各微粒浓度关系正确的是( )
A.c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
B.c(Na+)═c(HCO3-)+c(CO32-)
C.c(Na+)+c(H+)═c(HCO3-)+2c(CO32-)+c(OH-)
D.c(OH-)═c(H +)+c(HCO3-)+c(H2CO3) 魂飞夜空1年前1
魂飞夜空1年前1 -
 印江新寨 共回答了22个问题
印江新寨 共回答了22个问题 |采纳率90.9%解题思路:NaOH溶液中通入足量二氧化碳,二氧化碳和NaOH溶液反应生成碳酸氢钠,碳酸氢钠溶液中HCO3-电离程度小于水解程度,导致溶液呈碱性,溶液中存在电荷守恒和物料守恒,据此分析解答.NaOH溶液中通入足量二氧化碳,二氧化碳和NaOH溶液反应生成碳酸氢钠,
A.碳酸氢钠溶液中HCO3-电离程度小于水解程度,导致溶液呈碱性,HCO3-水解和水的电离都生成OH-,只有HCO3-电离生成CO32-,所以存在c(CO32-)<c(OH-),故A错误;
B.溶液中存在物料守恒,根据物料守恒得c(Na+)═c(HCO3-)+c(H2CO3)+c(CO32-),故B错误;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)═c(HCO3-)+2c(CO32-)+c(OH-),故C正确;
D.根据物料守恒得c(Na+)═c(HCO3-)+c(H2CO3)+c(CO32-),根据电荷守恒得c(Na+)+c(H+)═c(HCO3-)+2c(CO32-)+c(OH-),所以得c(H2CO3)+c(H+)═c(CO32-)+c(OH-),故D错误;
故选C.点评:
本题考点: 离子浓度大小的比较.
考点点评: 本题考查离子浓度大小比较,明确溶液中溶质及其性质是解本题关键,灵活运用守恒思想解答问题,易错选项是A,会比较氢氧根离子和碳酸根离子浓度相对大小,为易错点.1年前查看全部
- (2014•凉州区模拟)如图所示,一定质量的理想气体由状态a沿abc变化到状态c,吸收了340J的热量,并对外做功120
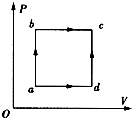 (2014•凉州区模拟)如图所示,一定质量的理想气体由状态a沿abc变化到状态c,吸收了340J的热量,并对外做功120J.若该气体由状态a沿adc变化到状态c时,对外做功40J,则这一过程中气体______(填“吸收”或“放出”)______J热量.
(2014•凉州区模拟)如图所示,一定质量的理想气体由状态a沿abc变化到状态c,吸收了340J的热量,并对外做功120J.若该气体由状态a沿adc变化到状态c时,对外做功40J,则这一过程中气体______(填“吸收”或“放出”)______J热量.  熊市永不再来1年前1
熊市永不再来1年前1 -
 大只累累跌落坑渠 共回答了14个问题
大只累累跌落坑渠 共回答了14个问题 |采纳率92.9%解题思路:气体是由状态a沿abc变化到状态c,还是由状态a沿adc变化到状态c,理想气体增加的内能是一样的,有第一个过程结合热力学第一定律可求出内能的增加量;再由热力学第一定律即可计算出第二个过程需要吸收的热量的多少.一定质量的理想气体由状态a沿abc变化到状态c,吸收了340J的热量,并对外做功120J,由热力学第一定律有:△E=Q+W=340-120=220J,即从a状态到c状态,理想气体的内能增加了220J;若该气体由状态a沿adc变化到状态c时,对外做功40J,此过程理想气体的内能增加还是220J,所以可以判定此过程是吸收热量,由热力学第一定律有:△E=Q+W,得Q=△E-W=220+40=260J.
故答案为:吸收,260点评:
本题考点: 热力学第一定律.
考点点评: 该题考查了热力学第一定律的应用.知道改变物体的内能有两种方式,一是对物体做功,一是热传递;应用热力学第一定律是,吸热Q为正,放热Q为负;对内做功W为正,对外做功W为负.1年前查看全部
- (2013•凉州区二模)七水硫酸镁(MgSO4•7H2O)在印染、造纸和医药等工业上都有广泛的应用.可利用化工厂生产硼砂
(2013•凉州区二模)七水硫酸镁(MgSO4•7H2O)在印染、造纸和医药等工业上都有广泛的应用.可利用化工厂生产硼砂的废渣M(主要成分是MgCO3,还含有MgO、SiO2、Fe2O3、FeO、CaO、Al2O3等杂质)来制取七水硫酸镁.已知:
表1部分阳离子以氢氧化物形式完全沉淀时的pH
表2盐的溶解度(单位为 g/100g水)沉淀 Al(OH)3 Fe(OH)3 Fe(OH)2 Mg(OH)2 pH 5.2 3.2 9.7 11.2
由废渣M制取七水硫酸镁的工艺流程如下:温度 10℃ 30℃ 40℃ 50℃ 60℃ CaSO4 0.19 0.21 0.21 0.20 0.19 MgSO4•7H2O 30.9 35.5 40.8 45.6 -- 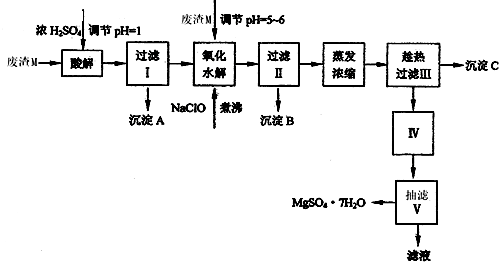
回答下列问题:
(1)过滤I的滤液中加入NaClO溶液的目的是______,写出反应的离子方程式______,需要加热煮沸的目的是______.
(2)操作Ⅱ所用的玻璃仪器是______.
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+,其实验方法是______.(用离子方程式表示).
(4)沉淀C的化学式是______,过滤Ⅲ需趁热过滤的理由是______. 看客在线1年前1
看客在线1年前1 -
 cccc的虫 共回答了13个问题
cccc的虫 共回答了13个问题 |采纳率84.6%解题思路:向废渣M中加硫酸时SiO2不溶解,NaClO具有氧化性,能将Fe2+氧化为Fe3+,PH=5~6时Fe(OH)3、Al(OH)3生成沉淀,加热煮沸的主要目的是促进Al3+、Fe3+水解,由于MgSO4的溶解度不大,温度低时结晶析出,所以过滤II需趁热过滤.(1)根据表中数据可知Fe3+易水解生成Fe(OH)3沉淀,NaClO具有氧化性,能将Fe2+氧化为Fe3+,易于除杂,
反应的方程式为6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-或2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,
盐的水解为吸热过程,加热有利于促进Al3+、Fe3+的水解生成Fe(OH)3、Al(OH)3等沉淀,
故答案为:将Fe2+氧化为Fe3+;6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-或2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;促进Al3+、Fe3+的水解;
(2)过滤用到的仪器或用品有铁架台(带铁圈)、烧杯、玻璃棒、漏斗以及滤纸,其中玻璃仪器有烧杯、漏斗、玻璃棒,故答案为:烧杯、漏斗、玻璃棒;
(3)实验室检验Fe3+离子的方法是在溶液中加入KSCN,溶液变红色,反应的离子方程式为Fe3++3SCN-=Fe(SCN)3,
故答案为:Fe3++3SCN-=Fe(SCN)3;
(4)趁热过滤时,硫酸钙的溶解度较小,而硫酸镁的溶解度较大,易于分离混合物,
此时过滤得到的沉淀为CaSO4•2H2O或CaSO4,如不趁热过滤,冷却后硫酸镁的溶解度减小,会生成硫酸镁晶体,
故答案为:CaSO4•2H2O或CaSO4;防止MgSO4在温度降低时结晶析出.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质;制备实验方案的设计.
考点点评: 本题考查制备实验方案的设计,题目难度中等,注意分析物质的制备的流程,理解反应原理,注重基础知识的积累.1年前查看全部
- (2014•凉州区模拟)如图是利用现代生物技术改良草莓品系的过程:
(2014•凉州区模拟)如图是利用现代生物技术改良草莓品系的过程:
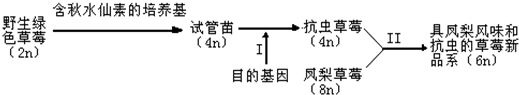
(1)将野生绿草莓的叶片离体组织培养成四倍试管苗的过程,体现了植物细胞的______性,此过程中秋水仙素的作用机理是______.
(2)欲获得抗虫草莓可从蛋白酶抑制剂基因、生长素诱导基因中选择______作为目的基因,要鉴定草莓的抗虫性,从个体水平上可采用______实验.
(3)Ⅱ过程常规方法采用杂交育种,还可先用花药离体培养分别获得抗虫草莓和凤梨草莓的______,再用______技术获得同时具凤梨风味和抗虫特性的六倍体草莓,该技术常用的酶有______.
(4)帮助农民发展经济时,要注意一些实际问题,如草莓新品系应种植在阳光充足,疏水性好的土壤里,这主要体现了生态工程的______.
A.物种多样性原理 B.整体性原理
C.协调与平衡原理 D.物质循环再生原理. 冰清妹子1年前1
冰清妹子1年前1 -
 陵光 共回答了15个问题
陵光 共回答了15个问题 |采纳率100%解题思路:分析题图:图示表示利用现代生物技术改良草莓品系的过程,其中Ⅰ表示采用基因工程技术将目的基因(抗虫基因)导入受体细胞的过程;Ⅱ过程常规方法采用杂交育种,还可先用花药离体培养获得2n和4n的草莓,再用植物体细胞杂交技术获得同时具凤梨风味和抗虫特性的草莓.(1)植物组织培养的原理是植物细胞的全能性;秋水仙素能诱导染色体数目加倍,其作用机理是抑制纺锤体形成,从而引起细胞内染色体数目加倍.
(2)蛋白酶抑制剂基因表达的蛋白酶抑制剂能阻断或降低蛋白酶的活性,使昆虫不能正常消化食物中的蛋白质,还会引起害虫的厌食反应;而生长素诱导基因表达的产物对害虫无作用.所以要获得抗虫草莓可选择蛋白酶抑制剂基因作为目的基因.要鉴定草莓的抗虫性,从个体水平上可采用抗虫接种实验.
(3)Ⅱ过程常规方法采用杂交育种,还可先用花药离体培养获得2n和4n的草莓,再用植物体细胞杂交技术获得同时具凤梨风味和抗虫特性的草莓,但在诱导细胞融合之前,需用纤维素酶和果胶酶去除细胞壁,获得原生质体.
(4)生物只有适应一定的环境才能正常生长,所以草莓新品系应种植在阳光充足,疏水性好的土壤里,这主要体现了生态工程的协调与平衡原理.
故答案为:
(1)全能抑制纺锤体形成(从而引起细胞内染色体数目加倍)
(2)蛋白酶抑制剂基因抗虫接种
(3)单倍体植物体细胞杂交纤维素酶和果胶酶
(4)C点评:
本题考点: 基因工程的原理及技术;植物体细胞杂交的过程.
考点点评: 本题考查基因工程的应用、植物细胞工程的应用和生态工程原理,意在考查考生分析题图提取有效信息的能力;识记能力和能理解所学知识要点,把握知识间内在联系的能力.能理论联系实际,综合运用所学知识解决自然界和社会生活中的一些生物学问题.1年前查看全部
- (2013•凉州区二模)利用右图装置探究铁在海水中的电化学防护,下列说法不正确的是( )
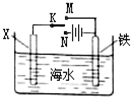 (2013•凉州区二模)利用右图装置探究铁在海水中的电化学防护,下列说法不正确的是( )
(2013•凉州区二模)利用右图装置探究铁在海水中的电化学防护,下列说法不正确的是( )
A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B.若X为锌棒,开关K置于M处,铁电极的反应:Fe-2e-→Fe2+
C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D.若X为碳棒,开关K置于N处,铁电极的反应:2H++2e-→H2↑ sheepherder_w3s1年前1
sheepherder_w3s1年前1 -
 金飞虫 共回答了14个问题
金飞虫 共回答了14个问题 |采纳率85.7%解题思路:根据金属的防护,若K置于N处,必须让被保护的金属接电源负极;若开关K置于M处,形成原电池,锌作负极,金属铁为正极,金属铁被保护.A、若X为锌棒,开关K置于M处,形成原电池,此时金属锌为负极,金属铁为正极,金属铁被保护,可减缓铁的腐蚀,故A正确;
B、若X为锌棒,开关K置于M处,形成原电池,此时金属锌为负极,金属铁为正极,氧气在该极发生还原反应,故B错误;
C、若X为碳棒,开关K置于N处,形成电解池,此时金属铁为阴极,铁被保护,可减缓铁的腐蚀,故C正确;
D、若X为碳棒,开关K置于N处,形成电解池,X极为阳极,发生氧化反应,铁电极为阴极,发生还原反应,故D正确.
故选B.点评:
本题考点: 金属的电化学腐蚀与防护.
考点点评: 本题考查学生原电池和电解池的工作原理以及金属的腐蚀和防护知识,注意知识的梳理和归纳是解题的关键,难度不大.1年前查看全部
- (r0az•凉州区六模)已知函数f(x)=plnx+(p-a)xr+a.
(r0az•凉州区六模)已知函数f(x)=plnx+(p-a)xr+a.
(a)讨论函数f(x)a单调性;
(r)当P=a时,f(x)≤kx恒成立,求实数ka取值范围;
(3)证明:an(n+a)<a+[a/r+
+a 3  youlichen1年前0
youlichen1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2014•凉州区二模)已知等差数列{an}的公差为正数,且a3•a7=-12,a4+a6=-4,则S20为( )
(2014•凉州区二模)已知等差数列{an}的公差为正数,且a3•a7=-12,a4+a6=-4,则S20为( )
A.90
B.-180
C.180
D.-90 影531年前1
影531年前1 -
 akuaku 共回答了13个问题
akuaku 共回答了13个问题 |采纳率100%解题思路:由已知得a3,a7是方程x2+4x-12=0的两个根,且a3<a7,解方程x2+4x-12=0,得a3=-6,a7=2,由此能求出S20.∵等差数列{an}的公差为正数,
且a3•a7=-12,a4+a6=a3+a7=-4,
∴a3,a7是方程x2+4x-12=0的两个根,且a3<a7,
解方程x2+4x-12=0,得a3=-6,a7=2,
∴
a1+2d=−6
a1+6d=2,解得a1=-10,d=2,
∴S20=20×(−10)+
20×19
2×2=180.
故选:C.点评:
本题考点: 等差数列的前n项和.
考点点评: 本题考查数列的前20项和的求法,是基础题,解题时要认真审题,注意等差数列的性质的合理运用.1年前查看全部
- (2014•凉州区模拟)如图生活用品所使用的主要材料,属于天然纤维的是( )
(2014•凉州区模拟)如图生活用品所使用的主要材料,属于天然纤维的是( )
A.
橡胶鞋底
B.
尼龙背包
C.
纯棉T恤
D.
塑料滑板 风筝7803281年前1
风筝7803281年前1 -
 4目 共回答了14个问题
4目 共回答了14个问题 |采纳率92.9%解题思路:根据已有的材料的类别进行分析解答即可.A、橡胶属于合成材料,错误;
B、尼龙属于合成材料,错误;
C、纯棉属于天然纤维,正确;
D、塑料属于合成材料,错误;
故选C.点评:
本题考点: 有机高分子材料的分类及鉴别.
考点点评: 本题考查了常见物质的类别,完成此题,可以依据已有的知识进行.1年前查看全部
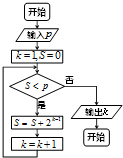
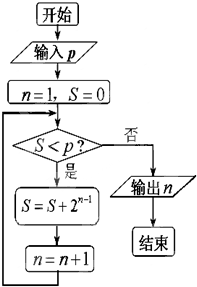
- (2014•凉州区二模)执行如图所示的程序框图,若输出的k=5,则输入的整数p的最大值为( )
(2014•凉州区二模)执行如图所示的程序框图,若输出的k=5,则输入的整数p的最大值为( )
A.7
B.15
C.31
D.63 家在小乡村1年前1
家在小乡村1年前1 -
 didgl 共回答了22个问题
didgl 共回答了22个问题 |采纳率100%解题思路:由框图可知:该程序的作用是利用循环计算变量S的值,并输出满足退出循环条件时的k值,模拟程序的运行,用表格对程序运行过程中各变量的值进行分析,不难得到输出结果.程序在运行过程中各变量的值如下表示:
是否继续循环 S k
循环前/0 1
第一圈 是 1 2
第二圈 是 3 3
第三圈 是 7 4
第四圈 是 15 5
第五圈 是 31 6
第六圈 否
故S=15时,满足条件S<p
S=31时,不满足条件S<p
故p的最大值15.
故选B.点评:
本题考点: 程序框图.
考点点评: 本题考查了程序框图的应用问题,解题时应模拟程序框图的运行过程,即可得出所求问题的结论,是基础题.1年前查看全部
- (2014•凉州区二模)若(2x-3)5=a0+a1x+a2x2+a3x3+a4x4+a5x5,则a1+2a2+3a3+
(2014•凉州区二模)若(2x-3)5=a0+a1x+a2x2+a3x3+a4x4+a5x5,则a1+2a2+3a3+4a4+5a5等于( )
A. -10
B. -5
C. 5
D. 10 zfbb01231年前1
zfbb01231年前1 -
 湖里镜 共回答了16个问题
湖里镜 共回答了16个问题 |采纳率87.5%解题思路:对已知等式求导数,对求导后的等式中的x赋值1,求出a1+2a2+3a3+4a4+5a5的值.对等式两边求导数得
10(2x-3)4=a1+2a2x+3a3x2+4a4x3+5a5x4
令x=1得10=a1+2a2+3a3+4a4+5a5
故选D点评:
本题考点: 二项式定理的应用.
考点点评: 本题考查复合函数的求导法则、考查赋值法求展开式的系数和常用的方法.1年前查看全部
- (2014•凉州区模拟)纯水清澈透明、不含杂质,而硬水含较多可溶性钙和镁的化合物.现有两瓶无色液体,分别为纯水和硬水,请
(2014•凉州区模拟)纯水清澈透明、不含杂质,而硬水含较多可溶性钙和镁的化合物.现有两瓶无色液体,分别为纯水和硬水,请你参与小雯同学对水的探究,并回答有关问题.
(1)区别纯水和硬水的方法有多种.小雯采用的方法是:分别取样于蒸发皿中,加热蒸干,有固体析出的是硬水.请你设计另一种方法(简述实验步骤、现象和结论):
(2)小雯在做实验时,发现硬水在蒸发的过程中,产生了少量气体并得到一种难溶性的固体.实验步骤 实验现象 实验结论 ______ ______ ______
【提出猜想】产生的气体可能是二氧化碳;难溶性的固体可能是碳酸盐.
【设计实验】①将生成的气体通入______中,观察到______的现象,证明产生的气体是二氧化碳.写出有关反应的化学方程式:______.
②向这种难溶性的固体中滴入______,观察到有大量的气泡产生,则这种固体可能是碳酸盐.若这种固体是碳酸钙,写出该反应的化学方程式:______.
【反馈与运用】通过上述实验得到启发,在家里可用______除去热水瓶胆. ilavenderfox1年前1
ilavenderfox1年前1 -
 度阴山 共回答了16个问题
度阴山 共回答了16个问题 |采纳率87.5%解题思路:(1)从可用肥皂水区分硬水和软水去解答:
(2)【设计实验】
①从题目中可知:“证明产生的气体是二氧化碳.”去解答;
②从题目中:“固体可能是碳酸盐去解答;
【反馈与运用】根据(2)【设计实验】②可知水垢可以和酸反应,生成溶于水的物质去解答.(1)硬水中含有较多的钙镁化合物,易生水垢,与肥皂不易起泡沫,易起渣,而软水则与肥皂易起泡沫,所以可用肥皂水区分硬水和软水;故答案为:
实验步骤实验现象实验结论
分别取少量于烧杯中,
加入肥皂水,搅拌其中一个烧杯中产生较多的泡沫,
另一个烧杯中产生的泡沫较少泡沫多的是纯水,
泡沫少的是硬水(2)【设计实验】
①由题目中可知:“证明产生的气体是二氧化碳.”可知前面是二氧化碳的检验方法;通常用石灰水来检验二氧化碳,二氧化碳和石灰水反应生成不溶于水的碳酸钙和水,其化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;故答案为:澄清的石灰水 澄清石灰水变浑浊 CO2+Ca(OH)2=CaCO3+H2O;
②由题目中:“固体可能是碳酸盐”,检验碳酸盐的方法是加稀盐酸,产生二氧化碳气体,碳酸钙和稀盐酸反应生成氯化钙和水和二氧化碳,其化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑; 故答案为:稀盐酸 CaCO3+2HCl=CaCl2+CO2↑+H2O;
【反馈与运用】由(2)【设计实验】②可知水垢可以和酸反应,生成溶于水的物质,可用食醋代替稀盐酸;故答案为:食醋.点评:
本题考点: 硬水与软水;常见气体的检验与除杂方法;证明碳酸盐;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,掌握硬水的成分、硬水与软水的区别、及转化方法是正确解答此类题的关键.1年前查看全部
- (2014•凉州区模拟)下列关于细胞的结构和功能中叙述正确的是( )
(2014•凉州区模拟)下列关于细胞的结构和功能中叙述正确的是( )
A.相对细菌和植物细胞而言,动物细胞离体培养更需关注培养基的渗透压,因为动物细胞没有细胞壁,对培养基的渗透压更敏感
B.高尔基体是细胞内蛋白质合成、加工和运输的场所
C.不直接依赖细胞膜流动性就能完成的是胰岛B细胞分泌胰岛素
D.抑制细胞呼吸对自由扩散和主动运输的转运速率均有影响 风_笑1年前1
风_笑1年前1 -
 silent134 共回答了27个问题
silent134 共回答了27个问题 |采纳率100%解题思路:本题考查了细胞膜的结构特点、功能特点、物质的跨膜运输的方式和高尔基体的功能.
1、细胞膜的特点分为:1、结构特点:流动性.2、功能特点:选择透过性.
2、自由扩散的特点是顺浓度梯度,不需要载体蛋白,不消耗能量;主动运输的特点是逆浓度梯度,需要载体蛋白和消耗能量.
3、高尔基体是单层膜,对来自内质网的蛋白质再加工,分类和包装的“车间”及“发送站”.动植物细胞中都含有高尔基体,但功能不同,在动物细胞中与分泌物的形成有关,在植物细胞中与细胞壁的形成有关.高尔基体在分泌蛋白的合成与运输中起着重要的交通枢纽作用.A、相对细菌和植物细胞而言,动物细胞离体培养更需关注培养基的渗透压,因为动物细胞没有细胞壁,对培养基的渗透压更敏感,A正确;
B、蛋白质的合成在核糖体上,而不是高尔基体,B错误;
C、胰岛B细胞分泌胰岛素中胰岛素是分泌蛋白质,需要由细胞核提供的DNA合成RNA运出细胞核,并和核糖体结合,在核糖体合成肽链、内质网初步加工、高尔基体加工成成熟的蛋白质,再通过小泡运输到细胞膜,分泌出去.这个过程直接依赖细胞膜的流动性就能完成,C错误;
D、抑制细胞呼吸对自由扩散的转运速率没有影响,对主动运输的转运速率有影响,D错误.
故选:A.点评:
本题考点: 动物细胞与组织培养过程;细胞膜的结构特点;细胞器中其他器官的主要功能;物质跨膜运输的方式及其异同.
考点点评: 本题主要考查了学生对知识的理解和记忆能力,运用所学知识分析和解决问题的能力.另外还要掌握,光合作用的场所是叶绿体.叶绿体是半自主性细胞器,有自己的DNA、核糖体,其中少数酶是由叶绿体DNA编码并在叶绿体里翻译成蛋白质的.细胞质基因遗传属于母系遗传,不遵循孟德尔遗传规律.1年前查看全部
- (2014•凉州区模拟)测定透明密闭玻璃罩内某植物在单位时间内CO2的吸收量或O2消耗量(相对值)随温度的变化,结果如图
(2014•凉州区模拟)测定透明密闭玻璃罩内某植物在单位时间内CO2的吸收量或O2消耗量(相对值)随温度的变化,结果如图所示,请分析回答下列问题:
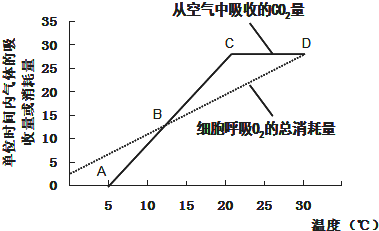
(1)植物光合作用有关的酶分布在叶绿体的______.据图推测,该植物的光合酶对温度的敏感度比呼吸酶对温度的敏感度______(填“高”或“低”).温室栽培该植物,为获得最大经济效益,应控制的最低温度为______℃.
(2)该植物光反应的产物中,被暗反应利用的物质是______.在供给C18O2较长时间后,叶肉细胞线粒体内能够检测出含18O的物质有______(写出两种).
(3)图中B、D点时植物光合作用制造的有机物______(填“大于”、“小于”或“等于”)细胞呼吸消耗的有机物. 北方白蝴蝶1年前1
北方白蝴蝶1年前1 -
 我们的cc 共回答了18个问题
我们的cc 共回答了18个问题 |采纳率100%解题思路:叶绿体是进行光合作用的场所,光合作用分为光反应和暗反应.
联系见下表:
分析题图可知,植物从空气中吸收的二氧化碳的量为净光合作用的量,呼吸作用氧气的消耗量是实际呼吸作用的量,A点从空气中吸收的二氧化碳为0,光合作用小于或等于呼吸作用,光合作用产生的氧气完全被呼吸作用吸收,随着温度的升高,光合作用和呼吸作用都逐渐增强,大于5℃后经光合作用大于0,即光合作用大于呼吸作用,实际光合作用=净光合作用+呼吸作用.项目 光反应 碳反应(暗反应) 实质 光能→化学能,释放O2 同化CO2形成(CH2O)(酶促反应) 时间 短促,以微秒计 较缓慢 条件 需色素、光、ADP、和酶 不需色素和光,需多种酶 场所 在叶绿体内囊状结构薄膜上进行 在叶绿体基质中进行 物质转化 2H2O→4[H]+O2↑(在光和叶绿体中的色素的催化下) ADP+Pi→ATP(在酶的催化下) CO2+C5→2C3(在酶的催化下)C3+【H】→(CH2O)+C5(在ATP供能和酶的催化下) 能量转化 叶绿素把光能先转化为电能再转化为活跃的化学能并储存在ATP中 ATP中活跃的化学能转化变为糖类等有机物中稳定的化学能 (1)与光合作用有关的酶分布在叶绿体的类囊体薄膜(进行光反应)和基质(进行暗反应)上.分析题图可知,净光合作用强度随温度升高而升高更快,因此光合酶对温度的敏感度比呼吸酶对温度的敏感度高,在20℃植物净光合作用最强,此时细胞呼吸作用较弱,是获得最大经济效益的最适宜温度.
(2)光反应的物质变化为:2H2O→4[H]+O2↑(在光和叶绿体中的色素的催化下) ADP+Pi→ATP(在酶的催化下),被暗反应利用的物质是ATP、NADPH.在供给C18O2较长时间后 18O的走向为:C18O2→C3→葡萄糖→丙酮酸→水→氧气,但是葡萄糖在细胞质基质中初步分解为丙酮酸,所以叶肉细胞线粒体内能够检测出含18O的物质有 丙酮酸、水、氧气(写有葡萄糖就不得分,其他合理增加都可).
(3)实际光合作用=净光合作用+呼吸作用大于5℃后经光合作用大于0,即光合作用大于呼吸作用.
故答案为:
(1)类囊体膜(或光合膜)和基质高20
(2)ATP、NADPH丙酮酸、水、氧气(写有葡萄糖就不得分,其他合理增加都可)
(3)大于点评:
本题考点: 光反应、暗反应过程的能量变化和物质变化.
考点点评: 本题的知识点是有氧呼吸的过程,以及有氧呼吸与光合作用的关系,温度对于光合作用和有氧呼吸过程的影响.正确解读题图曲线获取信息是解题的关键,对于光合作用、呼吸作用的综合应用是本题考查的重点.1年前查看全部
- (2014•凉州区模拟)某小组同学为了调查湖水中细菌的污染情况而进行了实验.实验包括制备培养基、灭菌、接种及培养、菌落观
(2014•凉州区模拟)某小组同学为了调查湖水中细菌的污染情况而进行了实验.实验包括制备培养基、灭菌、接种及培养、菌落观察计数.请回答与此实验相关的问题.
(1)培养基中含有蛋白胨、淀粉分别为细菌培养提供了氮源和______.除此之外,培养基还必须含有的基本成分是______和______.
(2)对培养基进行灭菌,应该采用的方法是______.
(3)为了尽快观察到细菌培养的实验结果,应将接种了湖水样品的平板置于______中培养,培养的温度设定在37℃.要使该实验所得结果可靠,还应该同时在另一平板上接种______作为对照进行实验.
(4)培养20小时后,观察到平板上有形态和颜色不同的菌落,这说明湖水样品中有______种细菌.一般说来,菌落总数越多,湖水遭受细菌污染的程度越______.
(5)如果提高培养基中NaCl的浓度,可以用于筛选耐______细菌,这种培养基(按功能分)被称为______. 夏日帅哥男1年前1
夏日帅哥男1年前1 -
 renansese 共回答了15个问题
renansese 共回答了15个问题 |采纳率100%解题思路:本题是以实验为依托考查微生物的培养与应用,梳理相关知识点,结合具体问题进行解答.(1)培养基的基本成分有氮源、碳源、无机盐和水,蛋白胨可提供氮源、碳源和维生素,淀粉可提供碳源.
(2)对培养基灭菌方法是高压蒸汽灭菌.
(3)恒温培养箱可以为细菌的培养提供一个无菌恒温的环境,以接种无菌水的培养基为空白对照,是为排除培养基的污染.
(4)细菌不同形成的菌落形态和颜色不同,平板上出现形态、颜色不同的菌落说明湖水样品中有多种细菌.污染程度越高污染物越多,适合生长的细菌越多.
(5)能够在NaCl的浓度高的培养基上生长的细菌耐盐能力强,而不耐盐的细菌不能在此培养基上生长,该培养基从功能上来分属于选择培养基.
故答案为:
(1)碳源、无机盐、水
(2)高压蒸汽灭菌
(3)恒温培养箱无菌水
(4)多;高
(5)盐(或NaCl) 选择培养基点评:
本题考点: 微生物的分离和培养;培养基对微生物的选择作用.
考点点评: 本题考查了微生物的培养、培养基等相关知识,意在考查考生能理解所学知识的要点,把握知识间的内在联系的能力,以及获取信息和利用信息解决问题的能力.1年前查看全部
- (2014•凉州区模拟)如表实验方案能达到目的是( )
(2014•凉州区模拟)如表实验方案能达到目的是( )
A.探究燃烧条件 B.探究铁生锈的条件 C.探究二氧化锰对反应速率的影响 D.探究溶解性的影响因素 
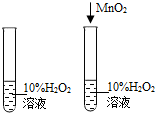
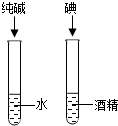
A.A
B.B
C.C
D.D yyafyp1年前1
yyafyp1年前1 -
 orange615 共回答了21个问题
orange615 共回答了21个问题 |采纳率90.5%解题思路:A、根据燃烧的条件来考虑实验是否能达到目的;
B、根据铁生锈的条件来考虑;
C、根据对照试验的设计方法考虑;
D、根据溶解性的影响因素考虑.A、不能验证燃烧的条件中可燃物与氧气接触,还应在水下放上白磷,故A错误;
B、铁生锈的条件是与氧气和水共同接触,该实验缺少将干燥的铁钉放到干燥的试管内,用橡皮塞塞上试管口,验证没有水是否能生锈,故B错误;
C、对照试验,一个放二氧化锰,一个不放二氧化锰,且放二氧化锰的过氧化氢溶液的试管放出氧气的速率快,所以能达到实验目的,故C正确;
D、探究溶解性的影响因素时,两支试管内都应放碘,一支试管内放水,一支试管内放酒精,看溶剂的影响,再通过放入溶剂相同,溶质不同来验证溶质的影响,故D错误.
故选C.点评:
本题考点: 化学实验方案设计与评价;催化剂的特点与催化作用;物质的溶解性及影响溶解性的因素;金属锈蚀的条件及其防护;燃烧与燃烧的条件.
考点点评: 本题难度不大,化学实验方案的设计是考查学生能力的主要类型,同时也是实验教与学难点,在具体设计时要对其原理透彻理解,可根据物质的物理性质和化学性质结合实验目的进行分析判断.1年前查看全部
- (2014•凉州区模拟)如图甲所示,质量为m、通有电流I的导体棒ab置于倾角为θ、宽度为d的光滑平行导轨上,图乙是从b向
 (2014•凉州区模拟)如图甲所示,质量为m、通有电流I的导体棒ab置于倾角为θ、宽度为d的光滑平行导轨上,图乙是从b向a方向观察时的平面视图.欲使导体棒ab能静止在导轨上,可在导轨所在的空间加一个垂直于导体棒ab的匀强磁场,图乙中水平、竖直或平行导轨、垂直导轨的①②③④⑤五个箭头分别表示磁场的可能方向.关于该磁场的大小及方向,下列说法中正确的是( )
(2014•凉州区模拟)如图甲所示,质量为m、通有电流I的导体棒ab置于倾角为θ、宽度为d的光滑平行导轨上,图乙是从b向a方向观察时的平面视图.欲使导体棒ab能静止在导轨上,可在导轨所在的空间加一个垂直于导体棒ab的匀强磁场,图乙中水平、竖直或平行导轨、垂直导轨的①②③④⑤五个箭头分别表示磁场的可能方向.关于该磁场的大小及方向,下列说法中正确的是( )
A.磁场磁感应强度的最小值为[mg/Id]
B.磁场磁感应强度的最小值为[mgsinθ/Id]
C.磁场的方向不可能是方向①②⑤
D.磁场的方向可能是方向③④⑤ liyichao1年前1
liyichao1年前1 -
 8433710 共回答了20个问题
8433710 共回答了20个问题 |采纳率95%解题思路:导体棒受重力、安培力、支持力,根据平衡条件判断可能的安培力方向和对应的磁场方向.对导体棒受力分析,受重力、安培力、支持力(可能为零),如图所示:
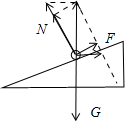
A、B、由图,当安培力与斜面平行时,即磁场方向沿着④的方向时,安培力最小,磁感应强度也最小;
此时安培力:F=mgsinθ,故磁感应强度为:B=[F/Id=
mgsinθ
Id],故A错误,B正确;
C、磁场的方向是方向①时,安培力竖直向下,不可能平衡;
磁场的方向是方向②时,安培力垂直向下,也不可能平衡;
磁场的方向是方向⑤时,安培力竖直向上,当F=mg时,导体棒是平衡的;故C错误;
D、磁场的方向是方向③时,安培力水平向右,可能平衡;
磁场的方向是方向④时,安培力平行斜面向上,也可能平衡;
磁场的方向是方向⑤时,安培力竖直向上,当F=mg时,导体棒是平衡的;故D正确;
故选:BD.点评:
本题考点: 共点力平衡的条件及其应用;力的合成与分解的运用;安培力.
考点点评: 本题关键是明确导体棒的受力情况,然后结合共点力平衡条件确定可能的安培力方向,最后根据左手定则确定对应的磁场方向.1年前查看全部
- (2014•凉州区二模)已知f(x)是定义在R上的奇函数,且当x<0时,f(x)=3x,则f(log32)的值为( )
(2014•凉州区二模)已知f(x)是定义在R上的奇函数,且当x<0时,f(x)=3x,则f(log32)的值为( )
A.-2
B.-[1/2]
C.[1/2]
D.2 乱线的风筝1年前1
乱线的风筝1年前1 -
 傻傻妹 共回答了19个问题
傻傻妹 共回答了19个问题 |采纳率89.5%解题思路:根据函数奇偶性的性质,进行转化即可得到结论.∵log32>0,
∴-log32<0,
∵f(x)是定义在R上的奇函数,且当x<0时,f(x)=3x,
∴f(-log32)=-f(log32),
即f(log32)=-f(-log32)=-3−log32=−3log3
1
2=−
1
2,
故选:B.点评:
本题考点: 函数奇偶性的性质;函数的值.
考点点评: 本题主要考查函数值的计算,利用函数奇偶性的性质以及指数函数的性质是解决本题的关键.1年前查看全部
- (2014•凉州区模拟)不同浓度的生长素影响某植物乙烯生成和成熟叶片脱落的实验结果如图所示.下列叙述错误的是( )
(2014•凉州区模拟)不同浓度的生长素影响某植物乙烯生成和成熟叶片脱落的实验结果如图所示.下列叙述错误的是( )
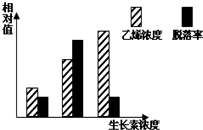
A.乙烯浓度高脱落率不一定高
B.一定浓度的生长素可以促进乙烯的生成
C.生长素和乙烯对叶片脱落的作用是相似的
D.生产上喷施高浓度生长素类似物可提高脱落率 废弃的地球1年前1
废弃的地球1年前1 -
 蓝夜的思念 共回答了15个问题
蓝夜的思念 共回答了15个问题 |采纳率93.3%解题思路:由图可直接看出,随乙烯浓度升,高脱落率先升高后降低.生长素浓度较低时,脱落率随其浓度的增加而逐渐升高,与乙烯的作用效果相同;生长素浓度较高时,脱落率随其浓度的增加而逐渐降低,与乙烯的作用效果相反.拮抗作用是指不同激素对某一生理效应发挥相反的作用.协同作用指起同一作用,并相互促进的两种激素.A、随乙烯浓度升高,成熟叶片脱落率先升高后降低,A正确;
B、生长素浓度较高时,乙烯的含量亦增加,B正确;
C、从图中可知,随生长素浓度的升高,乙烯浓度也升高,故生长素和乙烯对叶片脱落的作用是相似的,C正确;
D、如图,可看出可通过增加生长素的浓度,来降低该植物的脱落率而非提高脱落率,D错误.
故选:D.点评:
本题考点: 植物激素的作用.
考点点评: 本题考察生长素作用的相关知识.意在对考生理解、分析和推理能力的培养.1年前查看全部
- (2014•凉州区模拟)以下关于ATP和酶的说法正确的是( )
(2014•凉州区模拟)以下关于ATP和酶的说法正确的是( )
A.人体成熟的红细胞既能产生酶又能产生ATP
B.ATP含有核糖,酶一定不含核糖
C.叶绿体基质中CO2合成葡萄糖的过程需要酶并消耗ATP
D.酶与ATP均具有高效性与专一性 Angela必胜1年前1
Angela必胜1年前1 -
 shaka7758 共回答了20个问题
shaka7758 共回答了20个问题 |采纳率90%解题思路:酶是由活细胞产生的具有催化活性的有机物,其中大部分是蛋白质、少量是RNA.
特性:1、酶具有高效性 2、酶具有专一性 3、酶的作用条件比较温和
ATP中文名称叫三磷酸腺苷,结构简式A-P~P~P,其中A代表腺苷,P代表磷酸基团,~代表高能磷酸键.
ATP在细胞内含量很少,但在细胞内的转化速度很快,用掉多少马上形成多少,因此是新陈代谢所需能量的直接来源A、人体成熟的红细胞由于没有细胞核和细胞器,故不能产生酶,但无氧呼吸能产生ATP;故A错误.
B、酶的化学本质是有机物,少数是RNA,基本单位核糖核苷酸中含有核糖;故B错误.
C、暗反应过程场所是叶绿体基质,条件需要酶、ATP和[H];故C正确.
D、酶具有高效性与专一性,ATP具有高效性但不具有专一性;故D错误.
故本题选C.点评:
本题考点: ATP在能量代谢中的作用的综合;酶的特性.
考点点评: 本题考查酶与ATP组成及功能的相关知识,难度一般,考查学生理解知识点,能够在试题所给予的相对简单的情境中识别和使用它们.1年前查看全部
- (2014•凉州区二模)已知函数f(x)=2x+alnx−2(a>0).
(2014•凉州区二模)已知函数f(x)=
+alnx−2(a>0).2 x
(Ⅰ)若曲线y=f(x)在点P(1,f(1))处的切线与直线y=x+2垂直,求函数y=f(x)的单调区间;
(Ⅱ)若对于∀x∈(0,+∞)都有f(x)>2(a-1)成立,试求a的取值范围;
(Ⅲ)记g(x)=f(x)+x-b(b∈R).当a=1时,函数g(x)在区间[e-1,e]上有两个零点,求实数b的取值范围. hnww_771年前1
hnww_771年前1 -
 六只青蛙 共回答了14个问题
六只青蛙 共回答了14个问题 |采纳率78.6%解题思路:(Ⅰ) 求出函数的定义域,在定义域内,求出导数大于0的区间,即为函数的增区间,
求出导数小于0的区间即为函数的减区间.
(Ⅱ) 根据函数的单调区间求出函数的最小值,要使f(x)>2(a-1)恒成立,需使函数的最小值大于2(a-1),
从而求得a的取值范围.
(Ⅲ)利用导数的符号求出单调区间,再根据函数g(x)在区间[e-1,e]上有两个零点,得到
,g(e−1)≥0 g(e)≥0 g(1)<0
解出实数b的取值范围.(Ⅰ)直线y=x+2的斜率为1,函数f(x)的定义域为(0,+∞),
因为f′(x)=−
2
x2+
a
x,所以,f′(1)=−
2
12+
a
1=−1,所以,a=1.
所以,f(x)=
2
x+lnx−2,f′(x)=
x−2
x2. 由f'(x)>0解得x>2;由f'(x)<0,解得 0<x<2.
所以f(x)的单调增区间是(2,+∞),单调减区间是(0,2).
(Ⅱ) f′(x)=−
2
x2+
a
x=
ax−2
x2,由f'(x)>0解得 x>
2
a; 由f'(x)<0解得 0<x<
2
a.
所以,f(x)在区间(
2
a,+∞)上单调递增,在区间(0,
2
a)上单调递减.
所以,当x=
2
a时,函数f(x)取得最小值,ymin=f(
2
a).因为对于∀x∈(0,+∞)都有f(x)>2(a-1)成立,
所以,f(
2
a)>2(a−1)即可. 则[2
2/a+aln
2
a−2>2(a−1). 由aln
2
a>a解得 0<a<
2
e].
所以,a的取值范围是 (0,
2
e).
(Ⅲ) 依题得 g(x)=
2
x+lnx+x−2−b,则 g′(x)=
x2+x−2
x2.
由g'(x)>0解得 x>1; 由g'(x)<0解得 0<x<1.
所以函数g(x)在区间(0,1)为减函数,在区间(1,+∞)为增函数.
又因为函数g(x)在区间[e-1,e]上有两个零点,所以点评:
本题考点: 利用导数研究曲线上某点切线方程;函数零点的判定定理;利用导数研究函数的极值;导数在最大值、最小值问题中的应用.
考点点评: 本题考查导数与曲线上某点的切线斜率的关系,利用导数求函数的单调区间以及函数的最值.1年前查看全部
- (2013•凉州区二模)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(2013•凉州区二模)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)⇌2SO3(g),混合体系中SO3的质量分数和温度的关系如图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题: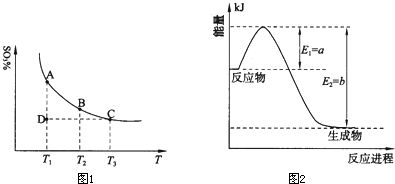
①2SO2(g)+O2(g)⇌2SO3(g)的△H______0(选填“>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡______移动(选填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1______K2;若反应进行到状态D时,v正______v逆(选填“>”、“<”或“=”).
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①图2是一定的温度和压强下N2和H2反应生成1mol NH3过程中能量变化示意图,请写出合成氨的热化学反应方程式:______、______.(△H的数值用含字母a、b的代数式表示,不必注明反应条件)
②氨气溶于水得到氨水.在25℃下,将xmol•L-1的氨水与ymol•L-1的盐酸等体积混合,所得溶液呈中性.则x______y,所得溶液中c(NH4+)______C(Cl-)(选填“>”、“<”或“=”);用含x和y的代数式表示出一水合氨的电离平衡常数
mol/L10−7y x−y .
mol/L10−7y x−y
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在.在25℃下,向0.1mol•L-1的NaCl溶液中逐滴加入适量的0.1mol•L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol•L-1的NaI溶液,看到的现象是______,产生该现象的原因是(用离子方程式表示)______.(已知25℃时Ksp[AgCl]=1.0×10-10 mol2•L-2,Ksp[AgI]=1.5×10-16mol2•L-2) 鸟仁1年前1
鸟仁1年前1 -
 清云水尘 共回答了11个问题
清云水尘 共回答了11个问题 |采纳率100%解题思路:(1)①根据温度对化学平衡的影响结合图象分析该反应是放热反应还是吸热反应;根据压强对反应体系的影响分析;
②根据T1的T2关系结合图象分析平衡的移动,根据反应物和生成物物质的量的改变引起化学平衡常数的改变判断K1、K2的关系;根据图象中曲线及曲线上、下方区域表示的含义分析,曲线表示平衡状态,曲线下方表示向正反应方向进行,曲线上方表示向逆反应方向进行;
(2)①根据热化学反应方程式的书写规则书写,书写时注意表明物质的状态,反应热=反应物吸收的能量-生成物放出的能量,注意反应热与反应方程式有关.
②由氯化铵的性质分析溶液的酸碱性,从而判断酸、碱浓度的相对大小;根据溶液中阴阳离子所带电荷相等分析c(NH4+)、C(Cl-)的相对大小;
(3)根据难溶电解质的溶解平衡常数判断氯离子和碘离子产生沉淀所需银离子的浓度,从而确定反应现象,并写出相应的离子方程式;(1)①该反应是一个气体体积减小的反应,升高温度,平衡向吸热反应方向移动,升高温度时,SO3(g)的含量降低,说明平衡向逆反应方向移动,所以正反应是放热反应,
△H<0;若在恒温、恒压条件下向上述平衡体系中通入氦气,该反应体系的压强减小,平衡向气体体积增大的方向移动,所以平衡向左移动.
故答案为:<;向左;
②该反应是一个放热反应,升高温度,平衡向逆反应方向移动,所以生成物的浓度减小,反应物的浓度增大,平衡常数减小,所以K1>K2;D状态相对于A状态,三氧化硫的含量较小,要使该反应达到平衡状态,该反应必须向正反应方向移动,所以正反应速率大于逆反应速率.
故答案为:>;>;
(2)①氮气和氢气反应生成氨气,反应热=反应物吸收的能量-生成物放出的能量,所以该反应的热化学反应方程式为:N2(g)+3H2(g)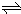 2NH3(g);△H=2(a-b)kJ•mol-1;
2NH3(g);△H=2(a-b)kJ•mol-1;
故答案为:N2(g)+3H2(g) 2NH3(g);△H=2(a-b)kJ•mol-1;
2NH3(g);△H=2(a-b)kJ•mol-1;
②氯化铵是强酸弱碱盐,其水溶液呈酸性,若要使将xmol•L-1的氨水与ymol•L-1的盐酸等体积混合,所得溶液呈中性,应使氨水稍过量,所以x>y;该溶液中阴阳离子所带电荷相等,溶液呈中性,所以氢离子和氢氧根离子的浓度相等,故c(NH4+)=C(Cl-).
该溶液呈中性,所以C(H+)=C(OH-)=10-7mol•L-1;c(NH4+)=C(Cl-)=0.5ymol/L,再根据物料守恒知,c(NH4+)+C(NH3.H2O)=0.5xmol/L,所以平衡常数K=
C(NH4+).C(OH−)
C(NH3.H2O)=
0.5ymol/L×10−7mol•L−1
0.5xmol/L−0.5ymol/L=
10−7y
x−ymol/L,
故答案为:>;=;
10−7y
x−ymol/L;
(3)Ksp[AgCl]=1.0×10-1 mol2•L-2 ,所以生成氯化银沉淀所需的银离子的浓度为
KSP
C(Cl−)=
1.5×10−10mol2•L−2
0.1mol/L=1.5×10-9mol/L,
Ksp[AgI]=1.5×10-16mol2•L-2,所以生成碘化银 沉淀所需的银离子的浓度为
KSP
C(I−)=
1.5×10−16mol2/L2
0.1mol/L=1.5×10-15mol/L,所以氯化银会转化为碘化银,看到的现象为:白色沉淀转化为黄色沉淀,方程式为AgCl(s)+I-(aq)=AgI(s)+Cl-(aq).
故答案为:白色沉淀转化为黄色沉淀;AgCl(s)+I-(aq)=AgI(s)+Cl-(aq).点评:
本题考点: 化学平衡的影响因素;热化学方程式;化学平衡常数的含义;弱电解质在水溶液中的电离平衡;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了外界条件对化学平衡的影响、反应热的计算、难溶电解质的转化等知识点,难度不大,注意化学平衡常数只与温度有关,与其他物理量无关,会运用电荷守恒、物料守恒进行有关计算.1年前查看全部
- (2014•凉州区二模)已知x=log23-log23,y=log0.5π,z=0.9-1.1,则( )
(2014•凉州区二模)已知x=log23-log2
,y=log0.5π,z=0.9-1.1,则( )3
A.x<y<z
B.z<y<x
C.y<z<x
D.y<x<z 650215251年前1
650215251年前1 -
 queennina 共回答了16个问题
queennina 共回答了16个问题 |采纳率87.5%解题思路:利用对数函数和指数函数的单调性即可得出.∵y=log0.5π<log0.51=0,
0<x=log2
3
3=log2
3<1,
z=0.9-1.1>0.90=1.
∴y<x<z.
故选:D.点评:
本题考点: 对数的运算性质;对数值大小的比较.
考点点评: 本题考查了对数函数和指数函数的单调性,属于基础题.1年前查看全部
- (2014•凉州区二模)函数f(x)=Asin(ωx+φ)(A>0,ω>0,0<φ<π)的图象如图所示,则f(0)的值为
 (2014•凉州区二模)函数f(x)=Asin(ωx+φ)(A>0,ω>0,0<φ<π)的图象如图所示,则f(0)的值为( )
(2014•凉州区二模)函数f(x)=Asin(ωx+φ)(A>0,ω>0,0<φ<π)的图象如图所示,则f(0)的值为( )
A.2
B.0
C.1
D.3  ptclink1年前1
ptclink1年前1 -
 KANGAR00 共回答了24个问题
KANGAR00 共回答了24个问题 |采纳率87.5%解题思路:由函数的图象的顶点坐标求出A,由周期求出ω,由五点法作图求出φ的值,可得函数的解析式,从而求得f(0)的值.由函数的图象可得A=2,[3T/4]=[3/4]•[2π/ω]=[11/12]π-[π/6]π=[3π/4],∴ω=2.
在根据五点法作图可得 2×[π/6]+φ=[π/2],∴φ=[π/6],∴f(0)=2sin[π/6]=1,
故选:C.点评:
本题考点: 由y=Asin(ωx+φ)的部分图象确定其解析式.
考点点评: 本题主要考查由函数y=Asin(ωx+φ)的部分图象求解析式,由函数的图象的顶点坐标求出A,由周期求出ω,由五点法作图求出φ的值,属于基础题.1年前查看全部
- (2014•凉州区二模)已知双曲线C:x2a2-y2b2=1(a>0,b>0)的左、右焦点分别是F1、F2过F2垂直x轴
(2014•凉州区二模)已知双曲线C:
-x2 a2
=1(a>0,b>0)的左、右焦点分别是F1、F2过F2垂直x轴的直线与双曲线C的两渐近线的交点分别是M、N,若△MF1N为正三角形,则该双曲线的离心率为( )y2 b2
A.21 3
B.3
C.13
D.2+3  傲帆1年前1
傲帆1年前1 -
 liudi1106 共回答了18个问题
liudi1106 共回答了18个问题 |采纳率100%解题思路:求出双曲线C的两渐近线方程,利用△MF1N为正三角形,建立三角形,即可求出该双曲线的离心率.双曲线C:
x2
a2-
y2
b2=1(a>0,b>0)的渐近线方程为bx±ay=0,
x=c时,y=±[bc/a],
∵△MF1N为正三角形,
∴2c=
3
2×[2bc/a],
∴a=
3
2b,
∴c=
7
2b,
∴e=[c/a]=
21
3.
故选:A.点评:
本题考点: 双曲线的简单性质.
考点点评: 本题考查双曲线的简单性质,考查学生的计算能力,比较基础.1年前查看全部
- (2014•凉州区二模)已知向量a=(sinx,-1),b=(3cosx,-[1/2]),函数f(x)=(a+b)•a-
(2014•凉州区二模)已知向量
=(sinx,-1),a
=(b
cosx,-[1/2]),函数f(x)=(3
+a
)•b
-2.a
(1)求函数f(x)的最小正周期T;
(2)已知a,b,c分别为△ABC内角A,B,C的对边,其中A为锐角,a=2
,c=4,且f(A)=1,求A,b和△ABC的面积S.3  phb0_01年前1
phb0_01年前1 -
 littlepretty 共回答了11个问题
littlepretty 共回答了11个问题 |采纳率100%(Ⅰ)f(x)=(
a+
b)•
a−2=
a2+
a•
b−2=sin2x+1+
3sinxcosx+
1
2−2(2分)
=
1−cos2x
2+
3
2sin2x−
1
2=1年前查看全部
- (2014•凉州区二模)在一次实验中,测得(x,y)的四组值为(1,2),(2,3),(3,4),(4,5),则y与x之
(2014•凉州区二模)在一次实验中,测得(x,y)的四组值为(1,2),(2,3),(3,4),(4,5),则y与x之间的回归直线方程为( )
A.
=x+1
y
B.
=x+2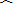
y
C.
=2x+1
y
D.
=x-1
y  玻璃洋葱1年前1
玻璃洋葱1年前1 -
 我漂泊自快乐 共回答了14个问题
我漂泊自快乐 共回答了14个问题 |采纳率100%解题思路:根据所给的这组数据,取出这组数据的样本中心点,把样本中心点代入所给的四个选项中验证,若能够成立的只有一个,这一个就是线性回归方程.∵
.
x=
1+2+3+4
4=2.5
.
y=
2+3+4+5
4=3.5,
∴这组数据的样本中心点是(2.5,3.5)
把样本中心点代入四个选项中,只有y=x+1成立,
故选A点评:
本题考点: 线性回归方程.
考点点评: 本题考查求线性回归方程,一般情况下是一个运算量比较大的问题,解题时注意平均数的运算不要出错,注意系数的求法,运算时要细心,但是对于一个选择题,还有它特殊的加法.1年前查看全部
- (2014•凉州区二模)已知定义在实数集R上的函数f(x)满足f(1)=1,且f(x)的导数f′(x)在R上恒有f′(x
(2014•凉州区二模)已知定义在实数集R上的函数f(x)满足f(1)=1,且f(x)的导数f′(x)在R上恒有f′(x)<
(x∈R),则不等式f(x2)<1 2
+x2 2
的解集为( )1 2
A.(1,+∞)
B.(-∞,-1)
C.(-1,1)
D.(-∞,-1)∪(1,+∞) jerk_0011年前1
jerk_0011年前1 -
 ss521lqm 共回答了19个问题
ss521lqm 共回答了19个问题 |采纳率84.2%解题思路:设出函数f(x)满足f(1)=1,且f(x)的导数f'(x)在R上恒有f′(x)<
(x∈R),然后求出不等式的解集即可.1 2 由题意:定义在实数集R上的函数f(x)满足f(1)=1,且f(x)的导数f'(x)在R上恒有f′(x)<
1
2(x∈R),
不妨设f(x)=1,所以不等式f(x2)<
x2
2+
1
2,化为
x2
2+
1
2>1,即x2>1,解得x∈(-∞,-1)∪(1,+∞).
故选D.点评:
本题考点: 抽象函数及其应用.
考点点评: 本题是选择题,考查选择题的解法,本题就是利用特殊函数解答题目,只要选择适当的函数的表达式即可解答本题,选择不当,解答比较麻烦.1年前查看全部
- (2014•凉州区二模)在等比数列{an}中,已知Sn=3n+b,则b的值为______.
 头发乱蓬蓬1年前1
头发乱蓬蓬1年前1 -
 一切过往 共回答了15个问题
一切过往 共回答了15个问题 |采纳率86.7%∵等比数列{an}中,Sn=3n+b,
∴a1=31+b=3+b,a2=S2-S1=6,a3=S3-S2=18,
∴(3+b)•18=36,∴b=-1.
故答案为:-1.1年前查看全部
- (2014•凉州区二模)下列判断错误的是( )
(2014•凉州区二模)下列判断错误的是( )
A.“am2<bm2”是“a<b”的充分不必要条件
B.命题“∀x∈R,x3-x2-1≤0”的否定是“∃x∈R,x3-x2-1>0”
C.在残差图中,残差点分布的带状区域的宽度越狭窄,其模型拟合的精度越高
D.若pΛq为假命题,则p,q均为假命题 zyq557052321年前1
zyq557052321年前1 -
 漪ss 共回答了24个问题
漪ss 共回答了24个问题 |采纳率91.7%解题思路:通过充要条件的判定方法可判断出A正确;B:所给的命题是一个全称命题,全称命题的否定是特称命题,依据规则写出结论即可;C:一般地,残差点分布的带状区域的宽度越狭窄,其模型拟合的精度越高来判断模型的拟合效果,D:根据复合命题的真值表可对D进行判断.对于A:“当am2<bm2时,有a<b”,反之“若a<b则am2<bm2当m=0时不成立,故“am2<bm2”是“a<b”的充分不必要条件,正确;
B:由于命题“∀x∈R,x3-x2-1≤0”的否定是“∃x∈R,x3-x2-1>0”,故正确;
对于C:一般地,残差点分布的带状区域的宽度越狭窄,其模型拟合的精度越高,故C正确;
D:若pΛq为假命题,则p,q中必有一假,但不一定均为假命题,故D不正确.
故选D.点评:
本题考点: 回归分析;复合命题的真假;全称命题.
考点点评: 本题考查命题的否定、充要条件、全称命题等,解本题的关键是掌握住特称命题的否定是全称命题,书写答案是注意量词的变化.1年前查看全部
- (2014•凉州区模拟)20世纪之前,生物学界普遍认为,人和动物体的一切生理活动都是由神经系统调节的.法国学者沃泰默对胰
(2014•凉州区模拟)20世纪之前,生物学界普遍认为,人和动物体的一切生理活动都是由神经系统调节的.法国学者沃泰默对胰腺分泌胰液的调节做了系列经典实验:①稀盐酸→上段小肠(十二指肠)肠腔→胰腺分泌胰液;②稀盐酸→注射狗的静脉中→胰腺不分泌胰液;③稀盐酸→上段小肠肠腔(切除通向该段小肠的神经,留下血管)→胰腺分泌胰液.请依据上述系列实验,分析并回答下列问题:
(1)神经调节的基本方式是______,其结构基础是______,
(2)在沃泰默的实验设计中,设计试验①的作用是______.比较①和②的实验,说明稀盐酸______才能引起胰腺分泌胰液.比较①和③实验,自变量为______.三组实验中因变量是______.根据实验结果,沃泰默固执地认为,胰腺分泌胰液仍属神经调节.
(3)另有两位科学家重复了沃泰默的实验,他们的假说是:在盐酸的作用下,小肠粘膜可能产生了一种化学物质,该物质被吸收进入血液后,随血液循环到胰腺,引起胰液的分泌.他们设计了严谨的实验检验假说,实验过程是:小肠粘膜+______+沙砾研磨→制成提取液→______→胰腺分泌胰液.他们将这种化学物质命名为促胰液素.这种调节属于______,而不是神经调节.
(4)促胰液素是由小肠分泌的含27个氨基酸的激素,其进出细胞方式的为______.胰液中含有的______,可使组织细胞分散开来,可广泛应用在动物细胞工程中. 你拨打用户已关机1年前1
你拨打用户已关机1年前1 -
 effendy 共回答了18个问题
effendy 共回答了18个问题 |采纳率88.9%解题思路:1、实验过程中可以变化的因素称为变量.人为改变的变量称为自变量,随着自变量的变化而变化的变量称为因变量,实验过程可能还会存在一些可变因素,对实验结果造成影响,这些变量称为无关变量. 除了一个因素以外,其余因素都保持不变的空难叫做对照实验.
2、体液调节指激素等化学物质(除激素以外,还有其他调节因子,如CO2等),通过体液传送的方式对生命活动进行调节.(1)神经调节的基本方式是反射,反射的结构基础是反射弧.
(2)①的作用是对照,通过①②比较说明,胰腺分泌胰液必须用稀盐酸刺激小肠粘膜.比较①③可知,③中切除了通向该段的小肠神经,而①中存在小肠神经,说明自变量是小肠神经的有无,因变量是胰腺是否分泌胰液.
(3)根据假说,在盐酸的作用下,小肠粘膜可能产生了一种化学物质,所以实验过程需要加入稀盐酸,根据该物质被吸收进入血液后,随血液循环到胰腺,所以提取液注射到狗的静脉中,这种调节属于体液调节.
(4)激素进出细胞的方式是胞吐,胰液中含有胰蛋白酶,可使组织细胞分散开来.
故答案为:
(1)反射反射弧
(2)对照必须刺激小肠粘膜小肠神经的有无胰腺是否分泌胰液
(3)稀盐酸注射狗静脉中体液调节(激素调节)
(4)胞吐胰蛋白酶点评:
本题考点: 神经、体液调节在维持稳态中的作用.
考点点评: 本题考查实验设计,具备验证简单生物学事实的能力,并能对实验现象和结果进行解释、分析和处理.1年前查看全部
- (2014•凉州区模拟)甲、乙两车某时刻由同一地点沿同一方向开始做直线运动,若以该时刻作为计时起点,得到两车的位移-时间
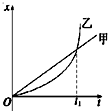 (2014•凉州区模拟)甲、乙两车某时刻由同一地点沿同一方向开始做直线运动,若以该时刻作为计时起点,得到两车的位移-时间图象如图所示,则下列说法正确的是( )
(2014•凉州区模拟)甲、乙两车某时刻由同一地点沿同一方向开始做直线运动,若以该时刻作为计时起点,得到两车的位移-时间图象如图所示,则下列说法正确的是( )
A.t1时刻两车相距最远
B.t1时刻乙车追上甲车
C.t1时刻两车的速度刚好相等
D.0到t1时间内,乙车的平均速度小于甲车的平均速度 cx_hm_st1年前1
cx_hm_st1年前1 -
 newblog 共回答了25个问题
newblog 共回答了25个问题 |采纳率72%解题思路:在位移-时间图象中,倾斜的直线表示物体做匀速直线运动,斜率表示速度;图象的交点表示位移相等,平均速度等于位移除以时间.A、由图象可知,在t1时刻两车位移相等,两车相遇,相距最近,故A错误;
B、两车在同一时刻由同一地点沿同一方向开始做直线运动,经过时间t1位移又相等,在t1时刻乙车刚好从后面追上甲车,故B正确;
C、图象的斜率表示速度,根据图象可知,t1时刻乙的速度大于甲的速度,故C错误;
D、0到t1时间内,甲乙两车位移相等,根据平均速度等于位移除以时间可知,0到t1时间内,乙车的平均速度等于甲车的平均速度,故D错误;
故选:B.点评:
本题考点: 匀变速直线运动的位移与时间的关系;平均速度;匀变速直线运动的图像.
考点点评: 本题考查对位移图象的物理意义的理解,关键抓住纵坐标表示物体的位置,纵坐标的变化量等于物体的位移,斜率等于速度,就能分析两车的运动情况.1年前查看全部
- (2014•凉州区二模)执行如图的程序框图,若输出的n=5,则输入整数p的最大值是( )
(2014•凉州区二模)执行如图的程序框图,若输出的n=5,则输入整数p的最大值是( )
A.15
B.14
C.7
D.6 greeen1年前0
greeen1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2013•凉州区二模)“类推”的思维方式在化学学习与研究中经常采用,但有时会产生错误结论.下列类推结论中,正确的是(
(2013•凉州区二模)“类推”的思维方式在化学学习与研究中经常采用,但有时会产生错误结论.下列类推结论中,正确的是( )
A. 由氢氟酸刻蚀玻璃可推知盐酸也能用来刻蚀玻璃
B. 由Na2O中阴阳离子个数比为1:2,可推出Na2O2中阴阳离子个数比为 1:1
C. 由钠与冷水剧烈反应,可推知钾也能与冷水剧烈反应
D. 由“2Fe+3Br2═2FeBr3”反应可推出“2Fe+3I2═2FeI3”反应也能发生 浪子八1年前1
浪子八1年前1 -
 chl__xab9lx_04b0 共回答了22个问题
chl__xab9lx_04b0 共回答了22个问题 |采纳率100%解题思路:A.盐酸和二氧化硅不反应;
B.Na2O2中阴阳离子个数比为2:1;
C.根据金属元素的金属性比较;
D.Fe和I2反应生成FeI2.A.玻璃的主要成分为二氧化硅,氢氟酸可与二氧化硅反应,但盐酸与二氧化硅不反应,故A错误;
B.Na2O2中阴阳离子分别为Na+、O22-,个数比为2:1,故B错误;
C.K性质比Na活泼,可与冷水剧烈反应,故C正确;
D.I2的氧化性较弱,Fe和I2反应生成FeI2,故D错误.
故选:C.点评:
本题考点: 碱金属的性质;氧化性、还原性强弱的比较;硅和二氧化硅;钠的重要化合物.
考点点评: 本题综合考查元素化合物知识,侧重于基础知识的考查,注意碘与铁反应的性质,为易错点,题目难度不大.1年前查看全部
- (2014•凉州区二模)在一次实验中,测得(x,y)的四组值为(1,2),(2,3),(3,4),(4,5),则y与x之
(2014•凉州区二模)在一次实验中,测得(x,y)的四组值为(1,2),(2,3),(3,4),(4,5),则y与x之间的回归直线方程为( )
A.
=x+1
y
B.
=x+2
y
C.
=2x+1
y
D.
=x-1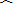
y  佳佳8191年前1
佳佳8191年前1 -
 bluespace 共回答了23个问题
bluespace 共回答了23个问题 |采纳率100%解题思路:根据所给的这组数据,取出这组数据的样本中心点,把样本中心点代入所给的四个选项中验证,若能够成立的只有一个,这一个就是线性回归方程.∵
.
x=
1+2+3+4
4=2.5
.
y=
2+3+4+5
4=3.5,
∴这组数据的样本中心点是(2.5,3.5)
把样本中心点代入四个选项中,只有y=x+1成立,
故选A点评:
本题考点: 线性回归方程.
考点点评: 本题考查求线性回归方程,一般情况下是一个运算量比较大的问题,解题时注意平均数的运算不要出错,注意系数的求法,运算时要细心,但是对于一个选择题,还有它特殊的加法.1年前查看全部
- (2014•凉州区模拟)如图所示,带正电的小球Q固定在倾角为θ的光滑固定绝缘细杆下端,让另一穿在杆上的质量为m、带正电的
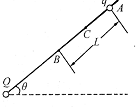 (2014•凉州区模拟)如图所示,带正电的小球Q固定在倾角为θ的光滑固定绝缘细杆下端,让另一穿在杆上的质量为m、带正电的小球q从A点由静止释放,q到达B点时速度恰好为零. 若A、B的长度为L,C为AB的中点,两小球都可视为质点,重力加速度为g则下列判断正确的是( )
(2014•凉州区模拟)如图所示,带正电的小球Q固定在倾角为θ的光滑固定绝缘细杆下端,让另一穿在杆上的质量为m、带正电的小球q从A点由静止释放,q到达B点时速度恰好为零. 若A、B的长度为L,C为AB的中点,两小球都可视为质点,重力加速度为g则下列判断正确的是( )
A.从A至B,q先做加速运动,后做匀减速运动
B.在从A至C和从C至B的过程中,前一过程q电势能的增加量较小
C.q在B点受到的库仑力大小是mgsinθ
D.Q产生的电场中,AB两点的电势差为UBA=[mgLsinθ/q] cwb2013141年前1
cwb2013141年前1 -
 pizazz407 共回答了19个问题
pizazz407 共回答了19个问题 |采纳率100%解题思路:小球q向下运动的过程中,根据两球间的库仑力逐渐增大,再分析小球q的运动情况.根据W=qU分析电场力做功关系,判断电势能减小量的关系.B点不是平衡点.根据动能定理求AB两点的电势差.A、小球q下滑过程中,沿杆的方向受到重力的分力mgsinθ和库仑力,两力方向相反.根据库仑定律知道,库仑力逐渐增大.库仑力先小于mgsinθ,后大于mgsinθ,q先做加速度减小的变加速运动,后做加速度增大的变减速运动,当库仑力与mgsinθ大小相等时速度最大.故A错误.
B、下滑地稆,AC间的场强小,CB间场强大,由U=Ed知,A、C间的电势差值小于C、B间的电势差值,根据电场力做功公式W=qU得知,从A至C电场力做功较小,则电势能的增加量较小.故B正确.
C、q从C到B做减速运动,在B点时加速度沿杆向上,故库仑力大于mgsinθ.故C错误.
D、从A到B,根据动能定理得:mgLsinθ+qUAB=0,又UBA=-UAB,解得UBA=[mgLsinθ/q].故D正确.
故选BD点评:
本题考点: 电势能;牛顿第二定律;电场强度;电势差.
考点点评: 本题是带电体在电场中运动的问题,关键要分析受力情况来确定其运动情况,根据动能定理研究电势差.1年前查看全部
- (2014•凉州区二模)已知集合A={x|x2-x-2≤0},B={x|y=ln(1-x)},则A∩B=( )
(2014•凉州区二模)已知集合A={x|x2-x-2≤0},B={x|y=ln(1-x)},则A∩B=( )
A.(0,2]
B.(-∞,-1)∪(2,+∞)
C.[-1,1)
D.(-1,0)∪(0,2) lastmansmiling1年前1
lastmansmiling1年前1 -
 co89abcd 共回答了16个问题
co89abcd 共回答了16个问题 |采纳率81.3%解题思路:解不等式x2-x-2≤0可得-1≤x≤2,根据对数函数的定义域可得函数y=ln(1-x)的解析式有意义时,1-x>0,x<1,代入集合交集运算公式,可得答案.解x2-x-2≤0可得-1≤x≤2,
∴集合A={x|x2-x-2≤0}=[-1,2]
若使函数y=ln(1-x)的解析式有意义
则1-x>0,即x<1
故B={x|y=ln(1-x)}=(-∞,1)
∴A∩B=[-1,1),
故选C.点评:
本题考点: 交集及其运算.
考点点评: 本题考查的知识点是交集及其运算,熟练掌握二次不等式的解法及对数函数的图象和性质是解答的关键.1年前查看全部
- (2013•凉州区二模)A、B、C、D、E是原子序数依次增大的短周期元素,A、D在周期表中的相对位置如下表,且元素A的最
(2013•凉州区二模)A、B、C、D、E是原子序数依次增大的短周期元素,A、D在周期表中的相对位置如下表,且元素A的最高正化合价与最低负化合价的绝对值相差2,B与D属于同主族元素;元素C是一种银白色金属,放置在空气中会迅速被氧化成白色物质.

(1)D的原子结构示意图为______;
(2)元素E在元素周期表中位于第______族;
(3)C、D、E离子半径的大小关系为______(用离子符号表示);
(4)元素B的单质与元素C的单质可发生化学反应生成化合物甲,则甲的化学式为______,实验证明甲能够与水发生化学反应,试写出甲与水反应的离子方程式______;
(5)若乙是元素A的最简单气态氢化物,丙是元素C的最高价氧化物对应的水化物.
①pH相同的乙丙的水溶液,分别用蒸馏水稀释到原来的x、y倍,稀释后两种溶液的pH仍然相同,则x______y(填写“>”、“<”或“=”=;
②在微电子工业中,乙的水溶液常用作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为______(不需要配平). jdude1年前1
jdude1年前1 -
 lgh520766 共回答了19个问题
lgh520766 共回答了19个问题 |采纳率94.7%解题思路:A、B、C、D、E是原子序数依次增大的短周期主族元素,由A、D在周期表中的相对位置可知,A处于第二周期,D处于第三周期,元素A的最高正化合价与最低负化合价的绝对值相差2,A原子最外层电子数为5,处于ⅤA族,故A为N元素,D为S元素,B与D属于同主族元素,B为O元素,元素C是一种银白色金属,放置在空气中会迅速被氧化成白色物质,C为Na元素,E的原子序数最大,故E为Cl元素,据此解答.A、B、C、D、E是原子序数依次增大的短周期主族元素,由A、D在周期表中的相对位置可知,A处于第二周期,D处于第三周期,元素A的最高正化合价与最低负化合价的绝对值相差2,A原子最外层电子数为5,处于ⅤA族,故A为N元素,D为S元素,B与D属于同主族元素,B为O元素,元素C是一种银白色金属,放置在空气中会迅速被氧化成白色物质,C为Na元素,E的原子序数最大,故E为Cl元素,
(1)D为S元素,原子核外电子数为16,有3个电子层,最外层电子数为6,原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)E为Cl元素,在元素周期表中处于第三周期第ⅦA族,故答案为:ⅦA;
(3)C、D、E离子分别是Na+、S2-、Cl-,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Cl->Na+,故答案为:S2->Cl->Na+;
(4)氧气与钠可发生化学反应生成化合物甲,则甲的化学式为Na2O、Na2O2,甲与水反应的离子方程式为:Na2O+H2O=2Na++2OH-、2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:Na2O、Na2O2;Na2O+H2O=2Na++2OH-、2Na2O2+2H2O=4Na++4OH-+O2↑;
(5)若乙是元素A的最简单气态氢化物,则乙为NH3,丙是元素C的最高价氧化物对应的水化物,则丙为NaOH,
①pH相同的乙、丙的水溶液,分别用蒸馏水稀释到原来的x、y倍,稀释后两种溶液的pH仍然相同,由于一水合氨是弱电解质,稀释会继续电离产生氢氧根离子,故稀释倍数:x>y,故答案为:>;
②在微电子工业中,乙的水溶液常用作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,应生成氮气与水,其化学方程式为:NH3•H2O+H2O2→N2↑+H2O,故答案为:NH3•H2O+H2O2→N2↑+H2O.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查结构性质位置关系、常用化学用语书写、半径比较等,难度不大,推断元素是解题的关键,注意基础知识的掌握.1年前查看全部
- (2014•凉州区二模)对大于或等于2的正整数的幂运算有如下分解方式:
(2014•凉州区二模)对大于或等于2的正整数的幂运算有如下分解方式:
22=1+3 32=1+3+5 42=1+3+5+7…
23=3=5 33=7+9+11 43=13+15+17+19…
根据上述分解规律,若m2=1+3+5+…+11,p3分解中最小正整数是21,则m+p=______. 起个名真难1年前1
起个名真难1年前1 -
 shoushou8010 共回答了12个问题
shoushou8010 共回答了12个问题 |采纳率83.3%解题思路:根据m2=1+3+5+…+11,p3的分解中最小的正整数是21,利用所给的分解规律,求出m、p,即可求得m+p的值.∵m2=1+3+5+…+11=
1+11
2×6=36,
∴m=6
∵23=3+5,33=7+9+11,
43=13+15+17+19,
∴53=21+23+25+27+29,
∵p3的分解中最小的数是21,
∴p3=53,p=5
∴m+p=6+5=11
故答案为:11点评:
本题考点: 归纳推理.
考点点评: 本题考查归纳推理,考查学生的阅读能力,确定m、p的值是解题的关键.1年前查看全部
大家在问
- 1实验室制取氧气时,下列操作错误的是( )
- 2突触小泡的形成与什么细胞器有关?为什么是高尔基体?
- 3Patience is the great virtue!说说啥意思?
- 4小学六年的英语作文,不要太复杂,字数40左右
- 5有两个人造句,一个人造句得了有,另一个得了良,句子是:优的:人类长期生活在一个依赖自然农耕社会.(抄课文的)良的:有些人
- 6水资源透支令人担忧,节约用水迫在眉睫,针对居民用水浪费现象,北京市制定了居民用水标准,规定三口之家楼房每月标准用水量是8
- 7长歌行 应该用怎么样的语气来朗读?
- 8介绍水果的特点作用
- 9(2012•葫芦岛)图中属于势能逐渐变大的一组是( )
- 10自我鉴定800字怎么写
- 11英文翻译:我九岁开始学习英语,并且每天早上都会读一些英语杂
- 12小明步行的速度是60米/分,他家离学校有1220米.小明每天上学从家走到学校大约需要多少时间?你是怎么估计的?说说你的方
- 13This ruler is xxx (she) Here is xxx(Tom)English book
- 14描述每个原子轨道时需要3个量子数这个3个量子数是( )
- 15(2013•孝感)“千里冰封,万里雪飘”这种景象中的“冰”“雪”的形成所对应的主要物态变化是( )
