酸,碱,非含氧酸,含氧酸,金属氧化物,非金属氧化物,有机物,单质,分别存在着哪些作用力?
 zh0326200002022-10-04 11:39:544条回答
zh0326200002022-10-04 11:39:544条回答
酸,碱,非含氧酸,含氧酸,金属氧化物,非金属氧化物,有机物,单质,分别存在着哪些作用力?
有共价键,离子键,分子间作用力.
有共价键,离子键,分子间作用力.

已提交,审核后显示!提交回复
共4条回复
 东山更起 共回答了20个问题
东山更起 共回答了20个问题 |采纳率100%- 含氧酸和非含氧酸:都只有共价键
碱:有共价键和离子键
金属氧化物:都是离子键
非金属氧化物:都是共价键
有机物:分子间作用力和共价键
单质:分子间作用力 - 1年前
 linyongq 共回答了5个问题
linyongq 共回答了5个问题 |采纳率- 酸碱:共价键,有极性的,有非极性的,有的分子都存在
金属有敬书剑,
N O F三种元素与H形成H键
有机物共价键 - 1年前
 咖啡豆儿 共回答了10个问题
咖啡豆儿 共回答了10个问题 |采纳率- 共价键、离子键通过高中的知识马上就得到,除非阁下是个差等生……
至于分子间作用力……
上述每一种都有取向力、诱导力、色散力。
那三种力是分子间作用力的细分。 - 1年前
 媒体头儿 共回答了80个问题
媒体头儿 共回答了80个问题 |采纳率- 金属间有金属键,非金属间可以形成配位键,还有F O N可以和H生成氢键
- 1年前
相关推荐
- 无氧酸的强弱与有氧酸的强弱如何用非金属性进行比较?如H2S,HCl和H3PO4,HSO4
 357388621年前1
357388621年前1 -
 warfarin 共回答了20个问题
warfarin 共回答了20个问题 |采纳率90%你写错了一个:H2SO4,而不是:HSO4
当它们是无氧酸的时候:非金属性越强,酸性越强
当它们是含氧强时:化合价越高,非金属性越强,酸性越强1年前查看全部
- 为什么氟无最高价含氧酸?氟无最高价含氧酸,还有没有其它元素也是没有最高价含氧酸的?还有我想知道为什么它没有最高价含氧酸?
为什么氟无最高价含氧酸?
氟无最高价含氧酸,还有没有其它元素也是没有最高价含氧酸的?还有我想知道为什么它没有最高价含氧酸?是非金属性太强了? Seiyo1年前2
Seiyo1年前2 -
 冲冠一怒为红颜 共回答了25个问题
冲冠一怒为红颜 共回答了25个问题 |采纳率96%是的,因为F没有正价,F跟O相连也是O显正价F负价
非金属元素中,除了稀有气体以外,就是除了F和O以外都有最高价含氧酸1年前查看全部
- 氧、硫的非金属性强弱可通过比较这两种元素(?) A原子得电子能力 B含氧酸的酸性 C气态氢化物的稳
氧、硫的非金属性强弱可通过比较这两种元素(?) A原子得电子能力 B含氧酸的酸性 C气态氢化物的稳
氧、硫的非金属性强弱可通过比较这两种元素(?)
A原子得电子能力
B含氧酸的酸性
C气态氢化物的稳定性
D单质的熔沸点
c,求大神逐一分析每个选项! 我们今夜无眠1年前2
我们今夜无眠1年前2 -
 mhpos 共回答了14个问题
mhpos 共回答了14个问题 |采纳率100%A原子得电子能力
对.得电子能力强的,非金属性强.
B含氧酸的酸性
错.氧不能形成含氧酸,无法比较.
C气态氢化物的稳定性
对.气态氢化物的稳定性越强,其非金属性越强.
D单质的熔沸点
错.不能通过单质的熔沸点高低比较非金属的非金属性的强弱.
选A和C.1年前查看全部
- 多金属氧酸催化丙烯酸十二脂合成
 怪人8751年前1
怪人8751年前1 -
 linlonghua2004 共回答了12个问题
linlonghua2004 共回答了12个问题 |采纳率91.7%原料丙烯酸,十二脂,98%硫酸,对苯二酚,对羟基苯甲醚,吩噻嗪,苯,甲苯,120号溶剂汽油
将适量的丙烯酸,阻聚剂,谐水剂和丙烯酸加入反应容器中,反应容器带搅拌,带冷凝分水器器...用油浴加热到70度,慢慢滴加硫酸.当液相达到90~95度时谐水剂和蒸汽与水蒸汽共沸将生成的水带出.,全部反应在2-3h内完成..
反应完成后加热液相至120-140度.然后减压至5.33KPA,进一步去处携水剂和丙烯酸.之后碱洗,水洗液相即可获得精致的丙烯酸十二脂
如果还需要更具体的实验装置和反应条件的话可以给我短消息..1年前查看全部
- 一元酸 二元酸 无氧酸 含氧酸 什么东西属于上面这4种 举例说明
 sun-of-beach1年前3
sun-of-beach1年前3 -
 我要搞你1314 共回答了15个问题
我要搞你1314 共回答了15个问题 |采纳率100%一元酸 一元酸是一个酸分子只能电离出一个H+离子,如HC lHNO3
二元酸 二元酸:每个分子在水中能够且只能电离出两个氢离子的酸,如亚硫酸(H2SO3)氢硫酸(H2S)、碳酸(H2C03)、偏硅酸(H2Si03)
无氧酸 无氧酸就是这个酸分子没有氧元素 :HCl H2S HBr HF等
含氧酸 酸根中含有氧原子的酸.如亚硫酸(H2SO3)、碳酸(H2C03)、偏硅酸(H2Si03)1年前查看全部
- 部分含氧酸=(条件:加热)酸性氧化物+水 哪部分含氧酸?
部分含氧酸=(条件:加热)酸性氧化物+水 哪部分含氧酸?
顺便附上个例子和其他酸碱盐知识点,谢谢. xue8161年前1
xue8161年前1 -
 gasdgergui 共回答了24个问题
gasdgergui 共回答了24个问题 |采纳率91.7%H2CO3=H2O+CO2
H2SI3=H2O+SIO2
H3BO3=H2O+B2O3
H2SO3=H2O+SO21年前查看全部
- 为什么同一元素含氧酸随元素价态降低氧化性增强,酸性减弱?不是说元素的化学价越高,物质的氧化性越强嘛...
 tt局旱1年前1
tt局旱1年前1 -
 灯都波少 共回答了21个问题
灯都波少 共回答了21个问题 |采纳率85.7%你后面的那句话根本就不绝对,有好多特例,有些元素有好多种价态,学化学不能死机记定义,要根据题目随机应变1年前查看全部
- 酸的分类:比如无氧酸,含氧酸
 xia2003201年前2
xia2003201年前2 -
 heibai5 共回答了13个问题
heibai5 共回答了13个问题 |采纳率100%1.根据是否含有氧元素,分为含氧酸和无氧酸.
2.根据酸分子中所含氢原子的数目分为一元酸(如盐酸、硝酸)、二元酸(如硫酸、氢硫酸)、三元酸(如磷酸)等.1年前查看全部
- 水(H2O)可以叫氧酸吗?过氧化氢(H2O2)呢?
水(H2O)可以叫氧酸吗?过氧化氢(H2O2)呢?
过氧化氢(H2O2)可以叫过氧酸吗? 天堂之鸟881年前5
天堂之鸟881年前5 -
 zxx1119 共回答了20个问题
zxx1119 共回答了20个问题 |采纳率85%水(H2O)一般不叫氧酸,但在布朗斯特酸碱理论中,水就是氢氧根的共轭酸,只不过它的酸性太小Ka1大约15.7,在中学中一般不看作酸.
至于过氧化氢(H2O2)则是一个绝对弱酸(相当弱,略比水强).有兴趣你可以自己查查大学课本中的布朗斯特酸碱理论和路易斯酸碱理论.1年前查看全部
- 在含氧酸中有一种称为原某酸的,一般不稳定,易脱水;它与对应的含氧酸的区别在于H、O原子数目的不同.例如:硅酸的化学式H2
在含氧酸中有一种称为原某酸的,一般不稳定,易脱水;它与对应的含氧酸的区别在于H、O原子数目的不同.例如:硅酸的化学式H2SiO3,原硅酸的化学式为H4SiO4;碳酸的化学式为H2CO3,原碳酸的化学式为H4CO4,据此可推知,下列结构简式中属于原甲酸乙酯的酯类是( )
A. C(COC2H5)4
B. HC(OC2H5)3
C. H2C(COC2H5)2
D. CO(OC2H5)2 人生如戏1231年前4
人生如戏1231年前4 -
 砚仆 共回答了12个问题
砚仆 共回答了12个问题 |采纳率91.7%解题思路:由题中信息可知,含氧酸与对应的原某酸少1个H2O,甲酸的分子式为CH2O2,则原甲酸应为CH4O3,则原甲酸中应含有3个-OH,以此解答该题.由题中信息可知,甲酸的分子式为CH2O2,则原甲酸应为CH4O3,由此原甲酸中应含有3个-OH,1mol原甲酸可与3mol乙酸发生酯化反应,方程式为CH3O3+3CH3COOH→HC(OC2H5)3+3H2O,产物为HC(OC2H5)3,
故选B.点评:
本题考点: 有机物的推断.
考点点评: 本题考查有机物的推断,题目难度中等,解答本题的关键是应注意含氧酸和对应的原酸的分子组成上的规律.1年前查看全部
- 关于氧化还原反应的高中化学题1.【含氧酸能起氧化作用 无氧酸则不能】这句话对么2.元素化合价的数值:在离子化合物里 就是
关于氧化还原反应的高中化学题
1.【含氧酸能起氧化作用 无氧酸则不能】这句话对么
2.元素化合价的数值:在离子化合物里 就是这种元素的一个原子得失电子的数目;在共价化合物里 就是这种元素的一个原子跟其他元素的原子形成的--?--数目
3.到底什么反应算离子反应呢?虽然说是生成物有气体,难溶物或难电离的 但像2cu+o2=2cuo 2H2O=2H2+O2 也生成了气体和难溶物 可它们可写成离子方程式么
4.【把8.5g锌片放入硫酸铜溶液中 片刻后取出覆盖有铜的锌片 洗涤干燥后秤得质量为8.45g 求有多少锌片被氧化了】我算出来有点奇怪 是0.083g
5.5NH4NO3=4N2+2HNO3+9H2O 是归中反应么?N2既是氧化产物又是还原产物 HNO3却不是氧化产物 这是不是就是所谓的【不能交叉?】
6.一个阴离子它的化合价还能再降低吗 举几个例子
7.【含金属元素的离子不一定是阳离子】【金属阳离子被还原不一定得到金属单质】这两句话对么?
8.对于反应H ̄+NH3=H2+NH2 ̄的正确说法是
A.属于置换反应 B.H ̄是还原剂 C.NH3是还原剂 D.H2既是氧化产物又是还原产物 我觉得选BD
9.用下列方法均可制得氧气
(1)2KClO3=2KCl+3O2
(2)2H2O2=2H2O+3O2
(3)2HgO=2Hg+O2
(4)2KMnO4=K2MnO4+MnO2+O2
若要制得相同质量的氧气 反应中电子转移数目之比为
10.对于反应ICI+H2O=HCl+HClO 下列说法正确的是
A.ICI是氧化剂 B.ICI是还原剂 C.ICI既是氧化剂又是还原剂 D.此反应不是氧化还原反应
反应后I去哪了?一般I是几价呢
11.氯气既是氧化剂又是还原剂的反应方程式 losttear1年前1
losttear1年前1 -
 打球怯场 共回答了11个问题
打球怯场 共回答了11个问题 |采纳率90.9%1:含氧酸确实可以起氧化作用,但部分无氧酸应该也可以.(虽然高中阶段没有接触到)氧化作用不是看是否含氧决定的.
2:形成共用电子对的数目.当然仔细点还要追究电子对的偏向.
3:从离子反应最基本的定义去看啊.(这些都可以算离子反应吧,反应都是离子参与的)
4:这道你还是用差量法比较方便,实在不清楚问老师.网上很难说清楚.
5:这里你说对了.生成的硝酸是由前面的硝酸根直接得到的.
6:这个,比方说双氧水中氧是-1价,分解生成的水中氧是-2价.
7:对.最经典的就是高锰酸根离子.(它得电子会生成很多产物,关键是控制反应条件中的酸碱度,但就是不会生成锰单质.要制得锰单质貌似必须用电解法.)
8:我也觉得应该选BD
9:在生成1摩尔氧气的前提下,反应1转移4摩尔电子.反应2转移2摩尔电子(貌似你把反应方程式写错了……).反应3转移4摩尔电子.反应4转移4摩尔电子.所以比例是2:1:2:2
10:我想说……你这个方程式写错了.(为什么生成物中没有碘元素?!)另外分析反应物,ICl,一个碘原子半径比氯原子大,所以共用电子对更靠近氯原子核(正负电荷相互吸引,应该没问题吧?).所以氯原子显-1价,碘原子显+1价.再说生成物,我没猜错的话应该是氯化氢和次碘酸.很明显,价态没变,选D.一般碘是-1、+1价,但是不怎么出现,还是好好研究氯元素吧.
11、最简单的就是氯气通入水中,发生歧化反应:Cl2+H2O===HCl+HClO1年前查看全部
- 我们知道,F没有含氧酸,那么HFO算是什么呢?
 斧头帮总部1年前3
斧头帮总部1年前3 -
 shusheng2 共回答了25个问题
shusheng2 共回答了25个问题 |采纳率72%HFO是存在的 将F2通过细冰粒 可以得到 其中O为零价
其结构为氢和氧共用一对电子,氧再和氟共用一对电子,整个分子形状为“V”形.其中氢氧共价键偏向于氧,偏离于氢,所以氢是+1价,而氧氟共价键偏向于氟,偏离于氧,所以氟是-1价.而氧,可想而知,一对电子偏向于它,一对电子偏离于它,所以综合起来,氧是0价态.1年前查看全部
- 甲同学根据元素非金属性与对应最高价含氧酸之间关系,设计了如图1装置来一次性完成碳,氮,硅三种非金属元素的非金属性强弱比较
甲同学根据元素非金属性与对应最高价含氧酸之间关系,设计了如图1装置来一次性完成碳,氮,硅三种非金属元素的非金属性强弱比较实验研究
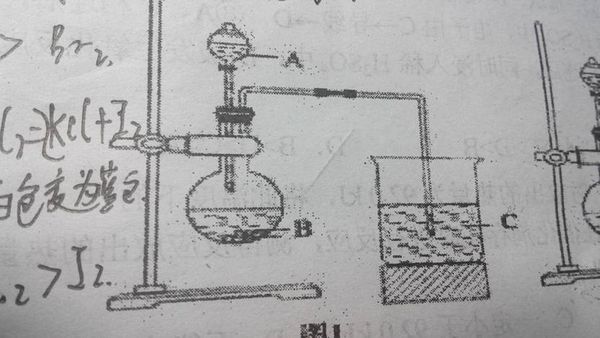
 frog19751年前1
frog19751年前1 -
 温顺小灰狼 共回答了10个问题
温顺小灰狼 共回答了10个问题 |采纳率90%A:稀硝酸
B:碳酸钙
C:硅酸钠溶液
CaCO3+2HNO3===Ca(NO3)2+H2O+CO2
HNO3制出H2CO3(H2O+CO2),HNO3酸性比H2CO3强,N非金属性比C强
Na2SiO3+CO2+H2O===Na2CO3+H2SiO3
H2CO3制出H2SiO3,H2CO3酸性比H2SiO3强,C非金属性比Si强
非金属性N>C>Si1年前查看全部
- 酸性最强的最高价含氧酸是形成化合物种类最多的主族是含元素种类最多的族是现有周期表中含元素种类最多的周期是
 烟行1年前2
烟行1年前2 -
 pp六 共回答了20个问题
pp六 共回答了20个问题 |采纳率80%1.高氯酸HClO4
2.C,因为有机物都含碳,而有机物种类最多
3.ⅢB,含有锕族和镧族
4.第6周期,含有镧族,同时含有锕族的第7周期并不全,所以第6最多1年前查看全部
- 某含氧酸HnRO2n-1的相对分子质量为M,则R元素的相对原子质量是
某含氧酸HnRO2n-1的相对分子质量为M,则R元素的相对原子质量是
1.用200g氯化钠晶体能配制的生理盐水(0.9%)多少g?
2.已知A℃时,硫酸铜的溶解度喂5g/100g水,B℃时硫酸铜的溶解度为50g/100g水。现将150gB℃时硫酸铜的饱和溶液降至A℃,问可析出硫酸铜晶体多少g? 纳达西尔1年前1
纳达西尔1年前1 -
 天崖何处花草 共回答了17个问题
天崖何处花草 共回答了17个问题 |采纳率82.4%HnRO2n-1 =n+ x +32n -16=m
x=m +16-33n1年前查看全部
- 如何比较含氧酸/含氧酸根的稳定性?对于一种含氧酸,是否酸/酸根的稳定性越差,酸性越弱?为什么会这样?有哪些不是如此的?又
如何比较含氧酸/含氧酸根的稳定性?对于一种含氧酸,是否酸/酸根的稳定性越差,酸性越弱?为什么会这样?有哪些不是如此的?又是否其酸性越强则酸/酸根的稳定性越强?为什么?有不是这样的吗?
 fire20471年前1
fire20471年前1 -
 zhoujwly 共回答了9个问题
zhoujwly 共回答了9个问题 |采纳率100%含氧酸的稳定性与中心原子的电负性和化合价有关.同周期元素的含氧酸从左到右随非金属性的递增而增强.同主族元素的含氧酸与电负性中心原子半径有关,电负性越大中心原子半径越小越稳定.同种元素的不同价态含氧酸,化合价越高越稳定,这与酸根阴离子的对称性有关.1年前查看全部
- 过渡元素金属的氢化物(或含氧酸)酸碱性质?
过渡元素金属的氢化物(或含氧酸)酸碱性质?
如铅是两性等等,有界限么 heransb1年前1
heransb1年前1 -
 花茶和绿茶 共回答了11个问题
花茶和绿茶 共回答了11个问题 |采纳率100%过渡金属的氢化物常常是金属型的(也称为填充型),是H2分子填充在金属原子之间的空隙中.其特点是金属和H2通常都能保留大部分单质时的化学性质,且组成不成整数比(如NiH0.3等等).
你所说的“含氧酸”其实应该是过渡金属氧化物的水合物,我简称水合物.过渡金属的水合物,有很多都有一定两性的性质,只是其中一部分有明显的两性(如Zn(OH)2),另一部分虽然有两性,但通常以某一性质为主(如Fe(OH)3以碱性为主,微显两性).一般来说,过渡金属的高价水合物呈现酸性,低价水合物呈现碱性(如Fe(OH)2呈碱性,H2FeO4呈酸性),中间价则有可能是两性的(如上面说的Fe,再如Cr(OH)2是碱性的,Cr(OH)3是两性的,H2CrO4是酸性的).你说的Pb的两性也是指Pb(OH)2,对于Pb(OH)4则是酸性为主的.1年前查看全部
- 卤素含氧酸一定有氧化性吗
 w65642932w1年前1
w65642932w1年前1 -
 li00718 共回答了19个问题
li00718 共回答了19个问题 |采纳率94.7%这种说法是正确的
首先,既然是卤素含氧酸,就说明此时的卤素为正价,例如HClO,HClO3,HClO4等,所有的卤素含氧酸都是一氢含氧酸,也就是说只有一个氢,而氧为-2价,所以卤素此时最低为+1价,而正价的卤族元素都有氧化性,所以可以说卤素含氧酸一定有氧化性,而且含氧数越少其氧化性越高,即HClO大于HClO3大于HClO4.1年前查看全部
- 电解类型如何记忆分类我有 但是记不住 有好办法吗(1)分解水型:含氧酸、强碱、活泼金属的含氧酸盐(如NaOH、H2SO4
电解类型如何记忆
分类我有 但是记不住 有好办法吗
(1)分解水型:含氧酸、强碱、活泼金属的含氧酸盐(如NaOH、H2SO4、K2SO4等)的电解.
阴极:4H++4e-=2H2↑ 阳极:4OH--4e-=O2↑+2H2O
总反应:2H2O 2H2↑+O2↑
阴极产物:H2;阳极产物:O2. 电解质溶液复原加入物质:H2O.
pH变化情况:原来酸性的溶液pH变小,原来碱性的溶液pH变大,强酸(含氧酸)强碱的正盐溶液pH不变.
(2)分解电解质型:无氧酸(除HF外)、不活泼金属的无氧酸盐(氟化物除外)的电解,如HCl、CuCl2等.
阴极:Cu2++2e-=Cu 阳极:2Cl--2e-=Cl2↑
总反应:CuCl2 Cu+Cl2↑
阴极产物:酸为H2,盐为金属;阳极产物:卤素等非金属单质.
电解液复原加入物质为原溶质,如电解CuCl2溶液,需加CuCl2.
pH变化情况:如电解无氧酸溶液pH变大但不会超过7;如为盐溶液的电解则视无氧酸根的情况而定.
(3)放氢生碱型:活泼金属的无氧酸盐(氟化物除外)溶液的电解,如NaCl、MgBr2等.
阴极:2H++2e-=H2↑ 阳极:2Cl--2e-=Cl2↑
总反应:2NaCl+2H2O 2NaOH+H2↑+Cl2↑
阴极产物:碱和H2;阳极产物:卤素等非金属单质.电解饱和食盐水的产物分别为NaOH和H2以及Cl2.
电解液复原加入物质为卤化氢.电解饱和食盐水,要使电解质溶液复原需加入HCl.
pH变化情况:电解液pH显著变大
(4)放氧生酸型:不活泼金属的含氧酸盐溶液的电解,如CuSO4、AgNO3等.
阴极:2Cu2++4e-=Cu 阳极:4OH--4e-=O2↑+2H2O
总反应:2CuSO4+2H2O 2Cu+O2↑+2H2SO4
阴极产物:析出不活泼金属单质;阳极产物是该盐对应的含氧酸和氧气,本例中分别是Cu以及H2SO4、O2.
电解液复原加入物质为不活泼金属的氧化物(金属价态与原盐中相同).如电解CuSO4溶液,复原需加入CuO.
pH变化情况:溶液pH显著变小. 苹果的脸1231年前3
苹果的脸1231年前3 -
 伊谢尔伦 共回答了23个问题
伊谢尔伦 共回答了23个问题 |采纳率95.7%谁让你记这种分类的?
电解关键是离子的放电顺序
(1)阳极:
①惰性电极(如石墨、Pt、Au):
阴离子:S2->I->Br->Cl->OH->含氧酸根(SO42-、NO3-)
②活泼电极(金属活泼性在Ag及Ag之前):
本身失去电子溶解,如Fe —2e— ==Fe2+
(2)阴极:
阳离子:Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Fe2+>Zn2+>H+(水)>Al3+>Na+>K+1年前查看全部
- 酸的分类 除了有氧酸无氧酸 一元酸二元酸三元酸 强酸中强酸弱酸这三种分法 还有没有别的样的分类方法
 tianzuoyun1年前1
tianzuoyun1年前1 -
 金色指甲油 共回答了21个问题
金色指甲油 共回答了21个问题 |采纳率90.5%还可以分为有机酸无机酸1年前查看全部
- 超氧酸的分子结构式?氧酸分子中含有未成对电子,因此具有顺磁性.中心氧原子为sp2杂化,用一个电子与端边氧原子形成σ键,用
超氧酸的分子结构式?
氧酸分子中含有未成对电子,因此具有顺磁性.中心氧原子为sp2杂化,用一个电子与端边氧原子形成σ键,用两个电子与端边氧原子成单电子形成三电子π键.
超氧酸的分子结构lewis式当中(http://baike.baidu.com/view/645111.htm),中心氧原子只有一个单电子,没有孤对电子,可是这样的话不是只有11个电子吗?这个分子不是应该有13个分子吗?
这个分子结构是***高中生化***赛2005年初赛的答案 bjshtjcq1年前1
bjshtjcq1年前1 -
 罐子里的鱼 共回答了16个问题
罐子里的鱼 共回答了16个问题 |采纳率87.5%我参加了2005年初赛的
是中间那个氧原子有一对电子对没有画出来.
我们老师去阅卷的,他说只要不画成直线就得分.1年前查看全部
- 求写出下列非金属元素的最高价氧化物对应的水化物酸,并计算含氧酸中非金属元素的化合价
求写出下列非金属元素的最高价氧化物对应的水化物酸,并计算含氧酸中非金属元素的化合价
VA 最高价氧化物 最高价含氧酸
N ( ) ( )
P ( ) ( )
As ( ) ( )
VI A 最高价氧化物 最高价含氧酸
S ( ) ( )
Se ( ) ( )
VII A 最高价氧化物 最高价含氧酸
C l ( ) ( )
Br ( ) ( ) HUANGSXW1年前3
HUANGSXW1年前3 -
 袁吴伊嘉 共回答了25个问题
袁吴伊嘉 共回答了25个问题 |采纳率84%N2O5 HNO3
P2O5 H3PO4
As2O5 H3AsO4
SO3 H2SO4
SeO3 H2SeO4
Cl2O7 HClO4
Br2O7 HBrO41年前查看全部
- 卤素含氧酸比较每组酸浓度相同时的酸性、氧化性强弱:(1)HCLO,HBRO,HIO(2)HCLO3,HBRO3,HIO3
卤素含氧酸
比较每组酸浓度相同时的酸性、氧化性强弱:
(1)HCLO,HBRO,HIO
(2)HCLO3,HBRO3,HIO3
(3)HCLO4,HBRO4,H5IO6(正高碘酸),HIO4(偏高碘酸) 小小滴5个耳洞1年前1
小小滴5个耳洞1年前1 -
 黑狗坡 共回答了20个问题
黑狗坡 共回答了20个问题 |采纳率90%(1)酸性:HCLO>HBRO>HIO
Ka:2.8*10^-8>2.6*10^-9>2.4*10^-11
三者均有强氧化性,氧化性按HCLO,HBRO,HIO依次降低.
(2)酸性:HCLO3>HBRO3>HIO3
氧化性:HBRO3>HCLO3>HIO3 注意:是溴酸氧化性最强,反映了p区第四周期元素的异样性.
(3)酸性:HCLO4>HIO4>HBRO4>H5IO6 偏高碘酸酸性比硫酸要强.
氧化性:HIO4>HBRO4>HCLO4>H5IO6 理由同二,偏高碘酸氧化性比硝酸要强.1年前查看全部
- 为什么在含氧酸中,如h2so4,hno3中,其中的非金属元素如s、n等都只有一个原子呢?是否有规律或定理呢?
 long5532495711年前5
long5532495711年前5 -
 wurui927 共回答了19个问题
wurui927 共回答了19个问题 |采纳率100%含氧酸概念:酸根中含有氧原子的酸.如 H2SO4硫酸 HNO3硝酸 H3PO4磷酸 H2C2O4草酸等等 你说的非金属元素其实就是它的中心原子
一个含氧酸的化学式中中心原子的个数是取决于他的表观化合价(可以理解为化合价)的.1年前查看全部
- 【急】含氧酸怎么写成氧化物的形式啊?
【急】含氧酸怎么写成氧化物的形式啊?
H2SO4可以写成SO3.H2O
那么像HNO3应该改写成啥? 水果是我的最爱1年前4
水果是我的最爱1年前4 -
 q6832509 共回答了17个问题
q6832509 共回答了17个问题 |采纳率88.2%这个就是酸酐+水的形式了.
所以按照酸中元素的化合价写氧化物就可以了.
HNO3=1/2 N2O5·H2O
H3PO4= 1/2 P2O5·3H2O
等等1年前查看全部
- 有刺激性气味的有毒气体有哪些哪些物质可以称为是白色胶状沉淀?哪种最高价含氧酸是一1mol和3molNaOH反应的?
 幽幽燕1年前1
幽幽燕1年前1 -
 北漂一族 共回答了13个问题
北漂一族 共回答了13个问题 |采纳率76.9%SO2 NO2
硅酸、氢氧化铝
磷酸1年前查看全部
- 现在在学卤族元素~什么是最高价含氧酸啊?是谁的最高价啊?
现在在学卤族元素~什么是最高价含氧酸啊?是谁的最高价啊?
那卤族元素的最高价含氧酸由强到弱的排列顺序是什么?
最高价无氧酸呢?
卤族元素最外层有七个电子..易得电子应是-1价啊?怎么还有+7? 爱她家1年前6
爱她家1年前6 -
 兰蔻X 共回答了14个问题
兰蔻X 共回答了14个问题 |采纳率78.6%是卤族的最高价.
CL,BR,I都是-7
F没有最高价.只有-1价..
以后说到的最高价含氧酸
都不是H,不是O
都是那些非金属1年前查看全部
- (2009•中山模拟)在含氧酸中有一种称为原某酸的,一般不稳定,易脱水;它与对应的含氧酸的区别在于H、O原子数目的不同.
(2009•中山模拟)在含氧酸中有一种称为原某酸的,一般不稳定,易脱水;它与对应的含氧酸的区别在于H、O原子数目的不同.例如:硅酸的化学式H2SiO3,原硅酸的化学式为H4SiO4;碳酸的化学式为H2CO3,原碳酸的化学式为H4CO4,据此可推知,下列结构简式中属于原甲酸乙酯的酯类是( )
A.C(COC2H5)4
B.HC(OC2H5)3
C.H2C(COC2H5)2
D.CO(OC2H5)2 cm12341年前1
cm12341年前1 -
 让生命象一棵树 共回答了19个问题
让生命象一棵树 共回答了19个问题 |采纳率100%解题思路:由题中信息可知,含氧酸与对应的原某酸少1个H2O,甲酸的分子式为CH2O2,则原甲酸应为CH4O3,则原甲酸中应含有3个-OH,以此解答该题.由题中信息可知,甲酸的分子式为CH2O2,则原甲酸应为CH4O3,由此原甲酸中应含有3个-OH,1mol原甲酸可与3mol乙酸发生酯化反应,方程式为CH3O3+3CH3COOH→HC(OC2H5)3+3H2O,产物为HC(OC2H5)3,
故选B.点评:
本题考点: 有机物的推断.
考点点评: 本题考查有机物的推断,题目难度中等,解答本题的关键是应注意含氧酸和对应的原酸的分子组成上的规律.1年前查看全部
- 电解含氧酸,阴极电解的是酸里的H离子,为什么反应只有水参加了?
 点睛761年前1
点睛761年前1 -
 yqx98351 共回答了14个问题
yqx98351 共回答了14个问题 |采纳率100%因为阳极电解的是氢氧根,而水每提供一个氢氧根必然提供一个氢离子,所以可以认为只有水参加反应.
而像电解HCl这种,跟上面情况不一样,酸中的H离子浓度大得多,所以认为是电解酸1年前查看全部
- 什么元素的氢化物可与其最高价含氧酸生成离子化合物
什么元素的氢化物可与其最高价含氧酸生成离子化合物
如题 积佳1年前2
积佳1年前2 -
 yongqi45 共回答了12个问题
yongqi45 共回答了12个问题 |采纳率83.3%N元素,NH3+HNO3=NH4NO31年前查看全部
- 氮和碳的最高价含氧酸是?
 雅典娜之吻1年前1
雅典娜之吻1年前1 -
 donner30 共回答了17个问题
donner30 共回答了17个问题 |采纳率94.1%氮:HNO3
碳:H2CO31年前查看全部
- 最高价氧化物含氧酸有哪些是强酸
 忧愁男人1年前3
忧愁男人1年前3 -
 layol 共回答了26个问题
layol 共回答了26个问题 |采纳率100%高氯酸(HClO4),硫酸(H2SO4),硝酸(HNO3),次氯酸(HClO )1年前查看全部
- 最高价含氧酸和最高价氧化物水化物的酸性有什么区别啊?急
 emmawang061年前2
emmawang061年前2 -
 tyliuyi 共回答了17个问题
tyliuyi 共回答了17个问题 |采纳率94.1%非金属元素的最高价氧化物对应的水化物就是其最高价含氧酸,个别也有不同如硅最高价氧化物对应的水化物是原硅酸,最高价含氧酸有原硅酸和硅酸两种
金属元素的最高价氧化物对应的水化物是其最高价氢氧化物1年前查看全部
- 氮的最高价含氧酸都是一元强酸is it correct?why
 luckyun06031年前2
luckyun06031年前2 -
 幸福我的幸福 共回答了18个问题
幸福我的幸福 共回答了18个问题 |采纳率88.9%LZ你是说氮族元素吧?
如果你想说氮族元素,那这句话是不对的,因为磷的最高价含氧酸就不是一元的,而且也不是强酸
如果你说的是氮,那这句话就是对的1年前查看全部
- 下列化合物中.酸性最强的是:丙酸 油酸 丙氧酸 乳酸
 疯周一1年前1
疯周一1年前1 -
 xll814 共回答了22个问题
xll814 共回答了22个问题 |采纳率86.4%丙氧酸1年前查看全部
- 氧化性酸都是有氧酸吗
 黑衣刀客1年前1
黑衣刀客1年前1 -
 qq6322123 共回答了22个问题
qq6322123 共回答了22个问题 |采纳率81.8%是的.所谓氧化性的酸,与酸具有氧化性还是有一点区别的.酸都有氧化性,如活泼金属与酸反应产生氢气,酸中氢的化合价降低,表现氧化性,所以酸都有氧化性,是氢离子表现的,氢离子为+1价,最高价,可以降为0价.
氧化性酸是指成酸的元素具有氧化性,成酸元素如H2SO4的成酸元素就是硫.常见的氧化性的酸有浓硫酸、浓硝酸、稀硝酸、次氯酸等.由于是成酸元素的作用,所以必然是含氧酸.无氧酸的非金属均为负价,不可能有氧化性了.如HCl、HBr等.1年前查看全部
- 磷元素最高价含氧酸是什么
 qxshower1年前1
qxshower1年前1 -
 梦吉 共回答了26个问题
梦吉 共回答了26个问题 |采纳率92.3%磷酸分子式:H3PO4
磷的最高价是+5价 所以磷元素含氧酸是H3PO41年前查看全部
- 什么是有氧酸啊,为什么说浓硫酸是有氧酸,稀硫酸是无氧酸?
 太阳落了月亮出来1年前3
太阳落了月亮出来1年前3 -
 晨曦中浮舞的羽毛 共回答了23个问题
晨曦中浮舞的羽毛 共回答了23个问题 |采纳率95.7%酸的分类,根据分类的依据不同,结论不同.
按是否含氧元素分为:含氧酸、无氧酸
按电离出的氢离子个数分为:一元酸、二元酸、三元酸
按挥发性分为:易挥发性酸、难挥发性酸
按稳定性分为:稳定性酸、不稳定性酸
按酸性强弱分为:强酸、弱酸
你的提问:什么是有氧酸,什么是无氧酸,
其实就是按是否含氧元素分为:含氧酸、无氧酸
含氧酸:含有氧元素的酸.
无氧酸:不含氧元素的酸.
由于阳离子全部都是氢离子,所以,是否含有氧元素肯定表现在酸根离子中是否含有氧元素了.
含氧酸如:HNO3硝酸,H2SO4硫酸,H2CO3碳酸,H3PO4磷酸(这前面是初中要求掌握的,后面是做题时可能遇到的)HClO4高氯酸,H2SiO3硅酸,H2SO3亚硫酸等.
无氧酸如:HCl盐酸,H2S氢硫酸等.初中一般只要求掌握盐酸HCl.1年前查看全部
- 某含氧酸化学式为HnROn+1,式量为M,则该含氧酸中R的化合价?酸根的化合价?R的相对原子质量?
 小小沈山1年前2
小小沈山1年前2 -
 城市的浮云 共回答了18个问题
城市的浮云 共回答了18个问题 |采纳率94.4%H是+1价,O是—2价,设R化合价为X,由化合物的化合价的代数和为0可得,n+x-2(n+1)=0,计算可得x=n+2因此R的化合价为+(n+2)价.酸根的化合价为-n价.R的相对原子质量为M-n*1-16*(n+1)=M-17n-161年前查看全部
- Al2O3•2SiO2•2H2O是什么?A混合物B含氧酸C硅酸盐D铝酸盐 为什么?
Al2O3•2SiO2•2H2O是什么?A混合物B含氧酸C硅酸盐D铝酸盐 为什么?
 玉米脆1年前2
玉米脆1年前2 -
 敏崽 共回答了14个问题
敏崽 共回答了14个问题 |采纳率100%硅酸盐1年前查看全部
- 书上说大多数酸都是分子晶体 而其列举的全部是含氧酸 那么是否所有含氧酸都为分子晶体
书上说大多数酸都是分子晶体 而其列举的全部是含氧酸 那么是否所有含氧酸都为分子晶体
请举出是酸却不是含氧酸的分子晶体 若不是请举出不是晶体的含氧酸
和状态有关吗 如液态与气态的HCl sclswdr1年前2
sclswdr1年前2 -
 洋洋溢溢 共回答了17个问题
洋洋溢溢 共回答了17个问题 |采纳率94.1%在高中课本中,常见的酸要么是含氧酸,要么是不含氧的,在水溶液中电离出H+的酸.
帖主在题目中问的“是否所有含氧酸都为分子晶体 ”,可以考虑硫酸氢钠.它是离子晶体,高中是把它当作一元强酸来处理的.
一般来说,一个含氧酸,如果分子中不含有金属或铵根离子,都是分子晶体的.
再者,是酸却不是含氧酸的分子晶体太多了,只不过相当一部分应该说在高中比较生僻的.你举的那个HCl,勉强算一个吧.1年前查看全部
大家在问
- 1这段英文有什么问题么 为什么我看着这么别扭
- 2用卑微,一丝不苟,宽恕造句这三个词扩写成意思相连的一段话
- 3康康语文和数学两门功课的平均分是95分.数学比语文多考了八分康康语文和数学各考了多少分?用方程解答.
- 41)sin5π/12sinπ/12的值是
- 5a sliver spoon
- 6如图所示,站在汽车上的人用手推车的力为F,脚对车向后的摩擦力为f,以下说法中正确的是( )
- 7It's twelv o' clock.Let' s have [ ] 括号里应该填什么
- 8近义词:注视( ),从容( ),敬仰( ),
- 9求函数f(x)=∫x21(x2−t)e−t2dt的单调区间与极值.
- 10八年级语文上册第1-4单元重点阅读训练复习题 谁有答案是(7)到(11)的,为什么网上的都却这一块的答案啊
- 11先天是指宇宙的本体,万物的本原,那么后天是什么?
- 12是么叫做共价化合物啊?
- 13英语单词chase的现在分词
- 14十五分之十一乘以7乘以3等于多少
- 15太阳与士兵写了几个方面的内容,表达了士兵怎样的思想感情,求学霸解答
