用1L1.0mol•L-1NaOH溶液吸收17.92LCO 2 (标准状况)后溶液体积不变.求所得溶液中的CO 3 2-
 游荡的秋千2022-10-04 11:39:541条回答
游荡的秋千2022-10-04 11:39:541条回答| 用1L1.0mol•L-1NaOH溶液吸收17.92LCO 2 (标准状况)后溶液体积不变.求所得溶液中的CO 3 2- 和HCO 3 - 的物质的量浓度. (已知可能的反应为:2NaOH+CO 2 ═Na 2 CO 3 +H 2 O,Na 2 CO 3 +H 2 O+CO 2 ═2NaHCO 3 ) |

已提交,审核后显示!提交回复
共1条回复
 成为家明 共回答了15个问题
成为家明 共回答了15个问题 |采纳率93.3%- 1L1.0mol/LNaOH溶液中氢氧化钠的物质的量为1L×1.0mol/L=1mol,17.92LCO 2 (标准状况)的物质的量为 17.92L 22.4L/mol =0.8mol,令溶液中Na 2 CO 3 、NaHCO 3 的物质的量分别为xmol、ymol,根据钠离...
- 1年前
相关推荐
- 已知NaNO2的化学式量为69,则500mL 1.0mol•L-1 NaNO2溶液含有溶质质量为( )
已知NaNO2的化学式量为69,则500mL 1.0mol•L-1 NaNO2溶液含有溶质质量为( )
A. 13.8g
B. 69g
C. 34.5g
D. 138g 雪落有泪1年前1
雪落有泪1年前1 -
 小鸟会咬人 共回答了18个问题
小鸟会咬人 共回答了18个问题 |采纳率88.9%解题思路:根据n=cM计算NaNO2的物质的量,再根据m=nM计算NaNO2的质量.溶液中NaNO2的物质的量=0.5L×1mol/L=0.5mol,
故NaNO2的质量=0.5mol×69g/mol=34.5g,
故选C.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查物质的量浓度有关计算,比较基础,注意对公式的理解与灵活应用.1年前查看全部
- 将体积为100mL浓度为2.0mol•L-1的CuSO4溶液和体积为300mL浓度为1.0mol•L-1的H2SO4溶液
将体积为100mL浓度为2.0mol•L-1的CuSO4溶液和体积为300mL浓度为1.0mol•L-1的H2SO4溶液混合,假定混合后溶液体积为400mL.计算:
(1)混合液中CuSO4的物质的量浓度是0.5mol/L0.5mol/L,H2SO4的物质的量浓度是0.75mol/L0.75mol/L.
(2)往混合液中加水稀释至Cu2+浓度为0.2mol•L-1,则稀释后溶液的体积为1000mL1000mL.
(3)稀释后溶液中H+的物质的量浓度是0.6mol/L0.6mol/L,S
的物质的量浓度是0.5mol/L0.5mol/L.O 2−4  两只老鼠的故事1年前1
两只老鼠的故事1年前1 -
 skygrass13 共回答了24个问题
skygrass13 共回答了24个问题 |采纳率87.5%混合前:n(CuSO4)=2.0mol/L×0.1L=0.2mol,n(H2SO4)=1.0mol/L×0.3L=0.3mol,
(1)混合后溶液的体积为0.4L,混合后溶液中c(CuSO4)=
0.2mol
0.4L=0.5mol/L,c(H2SO4)=
0.3mol
0.4L=0.75mol/L,
故答案为:0.5mol/L;0.75mol/L;
(2)混合后溶液中c(Cu2+)=c(CuSO4)=0.5mol/L,加水稀释至Cu2+浓度为0.2mol/L,根据稀释定律,稀释后溶液的体积为
0.5mol/L×400mL
0.2mol/L=1000mL,
故答案为:1000mL;
(3)混合后溶液中n(H+)=2n(H2SO4)=2×0.3mol=0.6mol,n(SO42-)=n(CuSO4)+n(H2SO4)=0.2mol+0.3mol=0.5mol,溶液稀释前后溶质的物质的量不变,
故稀释后c(H+)=
0.6mol
1L=0.6mol/L,
c(SO42-)=
0.5mol
1L=0.5mol/L,
故答案为:0.6mol/L;0.5mol/L.1年前查看全部
- 实验室配制250mL 1.0mol•L-1 H2SO4溶液,回答下列问题:
实验室配制250mL 1.0mol•L-1 H2SO4溶液,回答下列问题:
(1)需要18mol•L-1 H2SO4溶液(密度为1.84g∕cm3)的体积是______mL.
(2)应选用下列______规格的量筒量取浓硫酸.
A.10mLB.25mLC.50mLD.100mL
(3)某同学用容量瓶配制溶液,加水时不慎超过了刻度线,他(她)把水倒出一些,重新加水至刻度线.这样做会使配制溶液的浓度______(填“偏高”、“偏低”或“无影响”).
(4)某同学在向容量瓶中转移液体时,未用蒸馏水洗涤烧杯.这样做会使配制溶液的浓度______(填“偏高”、“偏低”或“无影响”). 能饮1杯无1年前1
能饮1杯无1年前1 -
 shunjianningmou 共回答了16个问题
shunjianningmou 共回答了16个问题 |采纳率87.5%解题思路:(1)根据溶液稀释前后溶液中溶质的质量或是物质的量保持不变来计算回答;
(2)根据溶液的体积来选择合适的量筒;
(3)根据加水量过多会将溶液稀释来回答;
(4)移液后,未用蒸馏水洗涤烧杯,相当于一部分溶质被浪费掉.(1)溶液稀释前后溶液中溶质的物质的量保持不变,设需要18mol•L-1 H2SO4溶液(密度为1.84g∕cm3)的体积是V,则18mol•L-1•VL=0.25L•1.0mol•L-1,解得V≈0.0139L=13.9mL,故答案为:13.9;
(2)溶液的体积为13.9mL,选择体积接近的量筒,即25mL的,故选B;
(3)加水时不慎超过了刻度线,会将溶液稀释,这样做会使配制溶液的浓度偏低,故答案为:偏低;
(4)向容量瓶中转移液体时,未用蒸馏水洗涤烧杯,即一部分溶质会沾在烧杯上,所得溶液的浓度减小,
故答案为:偏低.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查物质的量浓度的简单计算,溶液稀释前后溶液中溶质的质量或是物质的量保持不变可以计算浓溶液的体积,难度不大.1年前查看全部
- 配制100mL 1.0mol•L -1 的Na 2 CO 3 溶液,下列情况会导致溶液浓度偏高的是( ) A
配制100mL 1.0mol•L -1 的Na 2 CO 3 溶液,下列情况会导致溶液浓度偏高的是( ) A.容量瓶使用前用1.0 mol•L -1 的Na 2 CO 3 溶液润洗 B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 C.仰视确定凹液面与刻度线相切 D.用敞口容器称量Na 2 CO 3 且时间过长  庄稼一支花1年前1
庄稼一支花1年前1 -
 ECHO2384 共回答了9个问题
ECHO2384 共回答了9个问题 |采纳率100%A.容量瓶使用前用1.0 mol•L -1 的Na 2 CO 3 溶液润洗,溶质的物质的量偏大,配制溶液浓度偏高,故A正确;
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒,溶质的物质的量偏小,配制溶液浓度偏低,故B错误;
C.仰视确定凹液面与刻度线相切,溶液的体积偏大,配制溶液浓度偏低,故C错误;
D.用敞口容器称量Na 2 CO 3 且时间过长,溶质的物质的量偏小,配制溶液浓度偏低,故D错误;
故选A.1年前查看全部
- 实验室欲用NaOH固体配制1.0mol•L -1 的NaOH溶液240mL:
实验室欲用NaOH固体配制1.0mol•L -1 的NaOH溶液240mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为______.本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、还有______.
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图. 烧杯的实际质量为______g,要完成本实验该同学应称出______g NaOH.
(3)使用容量瓶前必须进行的一步操作是______.
(4)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是______.
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线.
 金融llff1年前1
金融llff1年前1 -
 dong000 共回答了16个问题
dong000 共回答了16个问题 |采纳率100%(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,
故答案为:②①③⑧⑤⑥⑦④;250mL容量瓶;
(2)因天平的称量原理:左盘物体的质量=右盘物体的质量+游码的读数,所以烧杯的实际质量为27.4g,
因配制溶液的体积为240ml,而容量瓶的规格没有240ml,只能选用250ml,NaOH的质量m=cvM=1.0mol•L -1 ×0.25L×40g/mol=10.0g,
故答案为:27.4;10.0;
(3)因使用容量瓶前必须进行的一步操作是检查容量瓶是否漏水,故答案为:检查容量瓶是否漏水;
(4)①没有洗涤烧杯和玻璃棒,溶质的质量减少,浓度偏小,故①错误;
②转移溶液时不慎有少量洒到容量瓶外面,溶质的质量减少,浓度偏小,故②错误;
③容量瓶不干燥,含有少量蒸馏水,溶液的体积不变,浓度不变,故③错误;
④定容时俯视刻度线,溶液的体积偏小,浓度偏高,故④正确;
⑤未冷却到室温就将溶液转移到容量瓶并定容,冷却下来溶液的体积偏小,浓度偏高,故⑤正确;
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,溶液的体积偏大,浓度偏小,故⑥错误;
故答案为:④⑤.1年前查看全部
- 实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液250mL:
实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液250mL:
(1)配制溶液时,一般可以分为以下几个步骤:(完成下列空格)
A.计算 B.称量 C.______ D.______E.______F.定容 G.摇匀、装瓶
(2)本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、量筒、还有______使用容量瓶前必须进行的一步操作是______.
(3)需称量______g烧碱固体,固体应该放在______中称量.
(4)定容时的操作应为用玻璃棒引流加入蒸馏水,至液面离刻度线约______,改用______滴加至凹液面下沿与刻度线相平.
(5)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是______.(双选)
A.没有洗涤烧杯和玻璃棒
B.转移溶液时不慎有少量洒到容量瓶外面
C.容量瓶不干燥,含有少量蒸馏水
D.定容时俯视刻度线
E.未冷却到室温就将溶液转移到容量瓶并定容
(6)若从所配制溶液取出100mL,则这100mL溶液的物质的量浓度为______,若再将这100mL溶液加水稀释成1L的溶液,则稀释后所得溶液的物质的量浓度为______. 杨自林1年前1
杨自林1年前1 -
 mdhe 共回答了19个问题
mdhe 共回答了19个问题 |采纳率100%解题思路:(1)根据配制250mL 1.0mol•L-1 NaOH溶液的步骤进行解答;
(2)根据配制250mL 1.0mol•L-1 NaOH溶液的步骤选用仪器;根据容量瓶的构造判断正确使用容量瓶的方法;
(3)根据m=nM=cVM计算出250mL 1.0mol•L-1 NaOH溶液需要氢氧化钠的质量;氢氧化钠具有腐蚀性,容易潮解,应该烧杯中快速称量;
(4)根据配制溶液的过程中正确的定容方法进行解答;
(5)根据c=[n/V]可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大;
(6)根据溶液的物质的量浓度与溶液的体积无关进行判断;根据溶液稀释过程中溶质的物质的量不变计算出稀释后溶液的浓度.(1)配制250mL 1.0mol•L-1 NaOH溶液的操作步骤为:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,
故答案为:溶解;转移; 洗涤;
(2)根据配制过程可知,必须用到的仪器有:天平、药匙、玻璃棒、烧杯、胶头滴管、量筒、250mL容量瓶,还缺少250mL容量瓶;
容量瓶也有瓶塞,配制过程中需要摇匀,避免容量瓶漏液影响配制结果,在配制前需要检查容量瓶是否漏水,
故答案为:250mL容量瓶;查漏;
(3)配制250mL 1.0mol•L-1 NaOH溶液需要氢氧化钠的质量为:m(NaOH)=40g/mol×1.0mol/L×0.25L=10.0g;
氢氧化钠具有腐蚀性,应该放在小烧杯中称量,
故答案为:10.0;小烧杯;
(4)定容时的操作应为用玻璃棒引流加入蒸馏水,至液面离刻度线约1~2cm,改用胶头滴管滴加至凹液面下沿与刻度线相平,
故答案为:1~2cm;胶头滴管;
(5)A.没有洗涤烧杯和玻璃棒,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故A错误;
B.转移溶液时不慎有少量洒到容量瓶外面,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故B错误;
C.容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量及最终溶液的体积都没有影响,所以不影响配制结果,故C错误;
D.定容时俯视刻度线,导致加入的蒸馏水体积偏小,配制的溶液体积偏小,溶液浓度偏高,故D正确;
E.未冷却到室温就将溶液转移到容量瓶并定容,溶液冷却后体积偏小,配制的溶液浓度偏高,故E族去;
故答案为:DE;
(6)若从所配制溶液取出100mL,溶液的浓度与溶液的体积大小无关,所以这100mL溶液的物质的量浓度为1.0mol/L;若再将这100mL溶液加水稀释成1L的溶液,溶液体积扩大10倍,则稀释后所得溶液的物质的量浓度变为原先的0.1倍,稀释后溶液浓度为0.1mol/L,
故答案为:1.0 mol/L; 0.1mol/L.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,试题基础性强,贴近高考;该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,注意明确误差分析的方法.1年前查看全部
- 用量筒量取10.0ml1.0molL的盐酸于100ml的容量瓶中,加水稀释到刻度线,可得到0.1molL的盐酸 请问哪里
用量筒量取10.0ml1.0molL的盐酸于100ml的容量瓶中,加水稀释到刻度线,可得到0.1molL的盐酸 请问哪里错了
 媚视而行1年前1
媚视而行1年前1 -
 gi41929 共回答了14个问题
gi41929 共回答了14个问题 |采纳率85.7%错在“加水稀释到刻度线”.
注意,容量瓶只是储存用的.稀释过程应在烧杯中进行.1年前查看全部
- 1.0mol•L-1的NaCl溶液表示( )
1.0mol•L-1的NaCl溶液表示( )
A. 溶液中含有1mol NaCl
B. 1mol NaCl 溶于1L水中
C. 58.5g NaCl溶于941.5g水中
D. 1L溶液里含有NaCl 58.5g hnnysh1年前2
hnnysh1年前2 -
 谈笑风生0518 共回答了15个问题
谈笑风生0518 共回答了15个问题 |采纳率86.7%解题思路:1mol/L NaCl溶液表示每升溶液中溶有1mol氯化钠.即1mol氯化钠溶于水配成1L溶液氯化钠浓度为1mol/L.根据c=[n/V]进行分析判断.A.溶质的物质的量与溶液体积、溶液浓度有关,溶液体积未告诉,无法计算氯化钠的物质的量,故A错误;
B.1mol氯化钠溶于1L水中,溶液的体积不是1L,无法计算物质的量浓度,故B错误;
C.58.5gNaCl的物质的量为1mol,58.5gNaCl溶于941.5g水中溶液的质量为1000g,溶液密度比水大,所以溶液体积小于1L,浓度大于1mol/L,故C错误;
D.58.5gNaCl的物质的量为1mol,溶液体积为1L,氯化钠溶液浓度为1mol/L,故D正确;
故选D.点评:
本题考点: 物质的量浓度.
考点点评: 本题主要考查学生对物质的量浓度的理解,难度较小,注意溶质的物质的量与溶液体积、溶液浓度有关.加强基础知识的掌握理解.1年前查看全部
- 某实验需要用1.0mol•L-1 NaOH 溶液450mL.配制实验操作步骤有:a.在天平上称量__
某实验需要用1.0mol•L-1 NaOH 溶液450mL.配制实验操作步骤有:a.在天平上称量______g NaOH固体放入烧杯中,加水溶解,冷却至室温.b.把制得的溶液小心地注入______ml容量瓶中.c.继续向容器中加水至距刻度线1cm~2cm处,改用______加水至刻度线.d.用少量水洗涤烧杯和玻璃棒2~3次并转移入容量瓶中.e.将瓶塞塞紧,充分摇匀.填写下列空白:
①操作步骤和正确顺序为______.
②该配制过程中两次用到玻璃棒,其作用分别是______、______.
③在进行b步操作时,不慎有液体溅出,下列处理措施正确的是______
A.继续进行实验B.添加部分NaOH溶液
C.倒掉溶液,重新配制D.倒掉溶液,洗净容量瓶后重新配制. jingjing85131年前1
jingjing85131年前1 -
 sheep120 共回答了18个问题
sheep120 共回答了18个问题 |采纳率88.9%解题思路:根据配制一定物质的量浓度的溶液正确操作方法完成空白部分;
①根据配制一定浓度的溶液的操作步骤进行排序;
②根据玻璃棒在溶解和转移溶液时的作用解答;
③配制溶液时,不慎有液体溅出,导致配制的溶液浓度偏小,此次配制失败.配制1.0mol•L-1 NaOH 溶液450mL,实验室没有450mL容量瓶,应该选用500mL容量瓶进行配制,需要氢氧化钠的物质的量为:1.0mol•L-1×0.5L=0.5mol,需要氢氧化钠的质量为:40g/mol×0.5mol=20.0g;b.冷却后的氢氧化钠溶液转移到500mL容量瓶中;c.继续向容器中加水至距刻度线1cm~2cm处,需要改用胶头滴管定容,
故答案为:20.0;500mL容量瓶;胶头滴管;
①配制一定物质的量浓度的溶液的配制步骤有:计算、称量、溶解、转移、洗涤、定容、摇匀等,所以正确配制顺序为:abdce,
故答案为:abdce;
②该配制过程中两次用到玻璃棒,第一次在溶解氢氧化钠时,使用玻璃棒搅拌,加速溶解;第二次转移溶液时需要使用玻璃棒引流,防止溶液流到容量瓶外边,
故答案为:搅拌加速溶解;引流;
③向容量瓶移液时,不慎有液体溅出,移入容量瓶中氢氧化钠的物质的量偏小,应倒掉溶液,洗净容量瓶后重新配制,
故答案为:D.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,试题基础性强,贴近高考;该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,注意掌握分析误差的方法和技巧.1年前查看全部
- 配制100mL 1.0mol•L-1的Na2CO3溶液,下列情况会导致溶液浓度偏高的是( )
配制100mL 1.0mol•L-1的Na2CO3溶液,下列情况会导致溶液浓度偏高的是( )
A.容量瓶使用前用1.0 mol•L-1的Na2CO3溶液润洗
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C.仰视确定滴定终点
D.用敞开容器称量Na2CO3且时间过长 npu-ian1年前1
npu-ian1年前1 -
 来自地狱的精灵 共回答了17个问题
来自地狱的精灵 共回答了17个问题 |采纳率82.4%解题思路:根据c=[n/V]分析判断误差,如果n偏大或V偏小则配制溶液浓度偏高.A、容量瓶使用前用1.0 mol•L-1的Na2CO3溶液润洗,溶质的物质的量偏大,配制溶液浓度偏高,故A正确;
B、配制过程中,未用蒸馏水洗涤烧杯和玻璃棒,溶质的物质的量偏小,配制溶液浓度偏低,故B错误;
C、仰视确定凹液面与刻度线相切,溶液的体积偏大,配制溶液浓度偏低,故C错误;
D、用敞口容器称量Na2CO3且时间过长,溶质的物质的量偏小,配制溶液浓度偏低,故D错误;
故选A.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题主要考查的是一定物质的量浓度溶液配制过程中的误差分析,正确理解c=[n/V]是解本题关键,难度不大.1年前查看全部
- 配制250mL 1.0mol•L-1H2SO4溶液,需用98%的浓硫酸溶液(ρ=1.84g/cm3)体积为多少
配制250mL 1.0mol•L-1H2SO4溶液,需用98%的浓硫酸溶液(ρ=1.84g/cm3)体积为多少?取25mL 1.0mol•L-1H2SO4溶液与足量的锌反应,在标准状况下产生多少升H2?求硫酸锌的物质的量?
 cocoajunjun1年前1
cocoajunjun1年前1 -
 cowclarke 共回答了23个问题
cowclarke 共回答了23个问题 |采纳率95.7%解题思路:根据c=[1000ρω/M]计算98%的浓硫酸溶液的物质的量浓度,再利用稀释定律计算需要浓硫酸的体积;
根据氢元素守恒可知n(H2)=n(H2SO4),再根据V=nVm计算氢气的体积.n(ZnSO4)=n(H2).质量分数98%,密度1.84g/mL的浓硫酸溶液的物质的量浓度为1000×1.84×98%98mol/L=18.4mol/L,令配制250mL1.0mol/LH2SO4溶液,需用98%的浓硫酸体积为V,根据稀释定律,稀释前后溶质的物质的量不变,则18.4mol/L×V=25...
点评:
本题考点: 物质的量浓度的相关计算;化学方程式的有关计算.
考点点评: 考查物质的量浓度与质量分数的关系、溶液配制、根据方程式的计算等,难度中等,注意基础知识的理解与掌握.1年前查看全部
- 在298K、1.01×105Pa,将22gCO2通入1.0mol•L-1NaOH溶液0.75L中充分反应,测得反应放出热
在298K、1.01×105Pa,将22gCO2通入1.0mol•L-1NaOH溶液0.75L中充分反应,测得反应放出热量为akJ.已知该条件下1molCO2通入2.0mol•L-1NaOH溶液1L中充分反应放出的热量为bkJ.则CO2与NaOH反应生成NaHCO3的热化学方程式正确的是( )
A.CO2(g)+NaOH(aq)=NaHCO3(aq)H=-(2b-a)kJ•mol-1
B.CO2(g)+NaOH(aq)=NaHCO3(aq)H=+(4a-b)kJ•mol-1
C.CO2(g)+NaOH(aq)=NaHCO3(aq)H=-(4a-b)kJ•mol-1
D.2CO2(g)+2NaOH(aq)=2NaHCO3(aq)H=-(8a-2b)kJ•mol-1 拼命的ww1年前1
拼命的ww1年前1 -
 tongxs 共回答了19个问题
tongxs 共回答了19个问题 |采纳率84.2%解题思路:根据题意可知,22gCO2通入1mol•L-1NaOH溶液750mL中充分反应,测得反应放出akJ的热量,写出热化学反应方程式,再利用1mol CO2通入2mol•L-1NaOH溶液1L中充分反应放出b kJ的热量写出热化学反应方程式,最后利用盖斯定律来书写CO2与NaOH溶液反应生成NaHCO3的热化学方程式.根据题意,22gCO2通入1mol•L-1NaOH溶液750mL中充分反应,n(CO2)=[22g/44g/mol]=0.5mol,n(NaOH)=1mol•L-1×0.75L=0.75mol,
该反应既生成碳酸钠又生成碳酸氢钠,方程式为2CO2+3NaOH═NaHCO3+Na2CO3+H2O,
由0.5molCO2反应放出热量为aKJ,则2molCO2反应放出热量为4aKJ,即热化学反应方程式为
2CO2(g)+3NaOH(aq)═NaHCO3 (aq)+Na2CO3(aq)+H2O(l)△H=-4aKJ/mol①,
又1mol CO2通入2mol•L-1NaOH溶液1L中充分反应放出bkJ的热量,则热化学方程式为
2NaOH(aq)+CO2(g)═Na2CO3(aq)+H2O(l)△H=-bKJ/mol②,
由盖斯定律可知,①-②可得,NaOH(aq)+CO2(g)═NaHCO3(aq)△H=-(4a-b)KJ/mol,
故选C.点评:
本题考点: 热化学方程式;有关反应热的计算.
考点点评: 本题考查热化学方程式的书写和计算,是高考中常见题型,计算中涉及到化学方程式的有关计算问题和盖斯定律的有关应用,是一重点题型,学生还应注意在书写热化学方程式时标明各物质的状态.1年前查看全部
- 某同学进行试验探究时,欲配制1.0mol•L-1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2•8H2O试
某同学进行试验探究时,欲配制1.0mol•L-1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2•8H2O试剂(化学式量:315).在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物.为探究原因,该同学查得Ba(OH)2•8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6.
(1)烧杯中未溶物仅为BaCO3,理由是 ___ .
(2)假设试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,设计试验方案,进行成分检验,在答题卡上写出实验步骤、预期现象和结论.(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
(3)将试剂初步提纯后,准确测定其中Ba(OH)2•8H2O的含量.实验如下:实验步骤 预期现象和结论 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. 步骤2:取适量滤液于试管中,滴加稀硫酸. 步骤3:取适量步骤1中的沉淀于是试管中, ___ 步骤4:
①配制250ml 约0.1mol•L-1Ba(OH)2•8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水, ___ ,将溶液转入 ___ ,洗涤,定容,摇匀.
②滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将 ___ (填“0.020”、“0.05”、“0.1980”或“1.5”)mol•L-1盐酸装入50ml酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗盐酸Vml.
③计算Ba(OH)2•8H2O的质量分数= ___ (只列出算式,不做运算)
(4)室温下, ___ (填“能”或“不能”) 配制1.0mol•L-1Ba(OH)2溶液.
 狮子座ONE1年前1
狮子座ONE1年前1 -
 wenskie 共回答了17个问题
wenskie 共回答了17个问题 |采纳率82.4%解题思路:(1)Ba(OH)2•8H2O与CO2作用转化为BaCO3;
(2)步骤2:预期现象和结论:有白色沉淀生成,说明有Ba2+;
步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中.
预期现象和结论:试管中有气泡生成,烧杯中的澄清石灰水变浑浊,结合步骤2说明沉淀是BaCO3;
步骤4:取适量滤液于烧杯中,用pH计测其pH值;
预期现象和结论:pH>9.6,说明有大量的OH-,综合上面步骤可知试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,假设成立,
(3)①将样品在烧杯中溶解后,过滤,将滤液移入250mL容量瓶中,洗涤将洗涤液移入容量瓶,定容、摇匀;
②盐酸体积最多不能多于50ml,根据50mL计算盐酸的最小浓度,应该是选大于最小浓度而且接近的;
③令250mL溶液中氢氧化钡的浓度为cmol/L,根据消耗的盐酸列方程计算c的值,进而计算250mL溶液中氢氧化钡的物质的量,据此计算样品中Ba(OH)2•8H2O的质量分数.
(4)根据氢氧化钡的溶解度估算饱和溶液的物质的量浓度,据此判断.(1)烧杯中未溶物仅为BaCO3,则由于Ba(OH)2•8H2O与CO2作用转化为BaCO3,
故答案为:Ba(OH)2•8H2O与CO2作用转化为BaCO3;
(2)步骤2:预期现象和结论:有白色沉淀生成,说明有Ba2+;
步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中,
预期现象和结论:试管中有气泡生成,烧杯中的澄清石灰水变浑浊,结合步骤2说明沉淀是BaCO3;
步骤4:取适量滤液于烧杯中,用pH计测其pH值.预期现象和结论:pH>9.6,说明有大量的OH-,综合上面步骤可知试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,假设成立,
故答案为:步骤2:预期现象和结论:有白色沉淀生成,说明有Ba2+;
步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中;
预期现象和结论:试管中有气泡生成,烧杯中的澄清石灰水变浑浊,结合步骤2说明沉淀是BaCO3;
步骤4:取适量滤液于烧杯中,用pH计测其pH值;
预期现象和结论:pH>9.6,说明有大量的OH-,综合上面步骤可知试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,假设成立;
(3)①将样品在烧杯中溶解后,将溶液移入250mL容量瓶中,洗涤将洗涤液移入容量瓶,定容、摇匀,
故答案为:溶解;250ml的容量瓶中;
②盐酸体积最多不能多于50ml,根据50mL计算盐酸的最小浓度,令盐酸的最小浓度为amol/L,则:
0.025L×0.1mol/L×2=amol/L×0.05L,解得a=0.1mol/L,应该是选大于最小浓度而且接近的,故选择0.1980mol/L的盐酸,
故答案为:0.1980;
③令250mL溶液中氢氧化钡的浓度为cmol/L,则:
0.025L×cmol/L×2=0.1980mol/L×V×10-3L,解得c=[0.198V/50],
故Ba(OH)2•8H2O的质量分数=
0.25L×
0.198V
50mol×315g/mol
wg×100%,
故答案为:
0.25L×
0.198V
50mol×315g/mol
wg×100%;
(4)室温下,氢氧化钡的溶解度为3.9g,溶液的物质的量浓度约是
3.9g
171g/mol
0.1L=0.23mol/L,故室温下,不能配制1.0mol•L-1Ba(OH)2溶液,
故答案为:不能.点评:
本题考点: 探究物质的组成或测量物质的含量;溶解度、饱和溶液的概念;配制一定物质的量浓度的溶液.
考点点评: 本题考查物质成分与含量测定、对实验方案的理解与设计、溶液配制、中和滴定、化学计算等,题目综合性较大,难度中等,侧重对实验方案设计与化学计算,是对学生综合能力的考查.1年前查看全部
- 用18.4mol•L-1的浓硫酸,配制 100ml 1.0mol•L-1的稀硫酸,请回答以下问题:
用18.4mol•L-1的浓硫酸,配制 100ml 1.0mol•L-1的稀硫酸,请回答以下问题:
(1)需要18.4mol•L-1的浓硫酸______mL.
(2)下列哪组仪器在配制时不需要用到______
①托盘天平②分液漏斗③250ml容量瓶④烧杯⑤胶头滴管 ⑥量筒⑦玻璃棒⑧铁架台(带铁夹)⑨100ml容量瓶
A.③④⑤⑦⑨B.①②⑤⑥⑧C.①②③⑧D.③④⑤⑥
(3)下列实验步骤中,正确的操作顺序应该是:______
A.用量筒量取浓硫酸,缓缓倒入装有约50ml蒸馏水的烧杯里,并用玻璃棒搅拌.
B.用约30ml蒸馏水,分出三次洗涤烧杯和玻璃棒,将每次洗涤液都倒入容量瓶中;
C.将稀释后的硫酸小心地倒入容量瓶中;
D.检查100ml容量瓶瓶口是否有漏液现象;
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1--2cm处;
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液;
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,至液面最低点与刻度线相切;
(4)进行A步骤操作的时候,应该选用______
①10ml量筒②50ml量筒③5000ml量筒④1000ml量筒
(5)进行A步操作后,必须______后,才能进行C步操作. snow2401年前1
snow2401年前1 -
 眉兰 共回答了15个问题
眉兰 共回答了15个问题 |采纳率93.3%解题思路:(1)根据溶液稀释定律C浓V浓=C稀V稀来计算;
(2)根据操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作来选择仪器;
(3)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序; (4)根据“大而近”的原则,根据需要量取的浓硫酸的体积来选择合适的量筒;
(5)浓硫酸稀释放热,故必须冷却后再移液.(1)设需要的浓硫酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:18.4mol/L×VmL=100ml×1.0mol/L,解得V=5.4mL,故答案为:5.4;
(2)操作步骤有计算、量取、稀释、洗涤、定容、摇匀等操作,一般用10mL的量筒量取浓硫酸5.4ml,在烧杯中稀释(可用量筒量取水加入烧杯),并用玻璃棒搅拌.冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有10mL量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,故不需要的仪器为:①②③⑧,故选C;
(3)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知正确的操作顺序是:DACBEGF;故答案为:DACBEGF;
(4)由于需要量取的浓硫酸的体积为5.4ml,根据“大而近”的原则,故选择10ml的量筒,故答案为:①;
(5)浓硫酸稀释放热,故必须冷却至室温后再移液,故答案为:冷却至室温.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.1年前查看全部
- 实验室用氯化钠固体配制100mL 1.0mol•L-1的NaCl溶液,有如下操作步骤:
实验室用氯化钠固体配制100mL 1.0mol•L-1的NaCl溶液,有如下操作步骤:
①用托盘天平称量______g NaCl晶体放入小烧杯中,加适量蒸馏水溶解;
②继续向容量瓶中加蒸馏水至液面距刻度线1-2cm处,改用______小心滴加蒸馏水至溶液凹液面的最低处与刻度线相切;
③把①中所得溶液小心地转入______中;
④将容量瓶塞紧,充分摇匀;
⑤用少量蒸馏水洗涤烧杯与玻璃棒2-3次,洗涤液一并转移到容量瓶中.
(1)将上述步骤的空白处填空;
(2)本实验操作步骤的正确顺序是(填序号,不能重复)______;
(3)试分析下列操作对所配得溶液的浓度有何影响(填:“偏高”、“偏低”、或“无影响”)
①容量瓶用蒸馏水洗净后没有干燥就直接用来配溶液,所配得溶液的浓度______;
②定容时,仰视刻度线,所配得溶液的浓度______;
③定容后,加盖倒转摇匀后,发现液面低于刻度线,所配得溶液的浓度______. kky41291年前1
kky41291年前1 -
 yjh0000 共回答了20个问题
yjh0000 共回答了20个问题 |采纳率90%解题思路:(1)①、根据n=cV计算氯化钠的物质的量,再根据m=nM计算氯化钠的质量,注意天平的精确度为0.1;
②、当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切;
③、一定容量的容量瓶只能配制需要体积的溶液,将溶解后的氯化钠溶液移入100mL容量瓶内;
(2)根据溶液配制实验操作的步骤进行排序;
(3)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=[n/V]判断对所配溶液浓度影响.(1)①、NaCl的物质的量n=cV=0.1L×1mol•L-1=0.1mol,NaCl的质量为0.1mol×58.5g/mol=5.85g≈5.9g,
故答案为:5.9;
②、当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,
故答案为:胶头滴管;
③、一定容量的容量瓶只能配制需要体积的溶液,将溶解后的氯化钠溶液移入100mL容量瓶内,
故答案为:100mL容量瓶;
(2)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2~3次,并将洗涤液移入容量瓶,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞,反复颠倒摇匀,故正确操作顺序为①③⑤②④,
故答案为:①③⑤②④;
(3)①溶液配制需加水定容,容量瓶中原有少量蒸馏水,对所配溶液浓度无影响,
故答案为:无影响;
②定容时仰视容量瓶刻度线,溶液的液面超过刻度线,所配溶液体积偏大,故溶液浓度偏低,
故答案为:偏低;
③定容后,把容量瓶倒置摇匀后发现液面低于刻度线,少量溶液残留在瓶口与瓶塞之间,对所配溶液无影响,
故答案为:无影响.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制,难度不大,注意根据c=[n/V]理解溶液配制与误差分析.1年前查看全部
- 在一体积为2L的密闭容器中加入反应物A、B,发生如下反应:A+2B⇌3C.经2min后,A的浓度从开始的1.0mol•L
在一体积为2L的密闭容器中加入反应物A、B,发生如下反应:A+2B⇌3C.经2min后,A的浓度从开始的1.0mol•L-1降到0.8mol•L-1.已知反应开始时B的浓度是1.2mol•L-1.则2min末C物质的量浓度、2min内B平均反应速率分别是( )
A.0.6mol•L-1、0.2mol•(L•min)-1
B.0.4mol•L-1、0.1mol•(L•min)-1
C.0.6mol•L-1、0.1mol•(L•min)-1
D.0.2mol•L-1、0.2mol•(L•min)-1 饭兜1年前1
饭兜1年前1 -
 saving_lizi 共回答了12个问题
saving_lizi 共回答了12个问题 |采纳率100%解题思路:A+2B⇌3C反应经2min后,A的浓度从开始时的1.0mol・L-1 下降到0.8mol・L-1,则
A+2B⇌3C
开始 1.0 1.2 0
转化 0.2 0.4 0.6
2min末 0.8 0.8 0.6
以此解答该题.由信息可知,A+2B⇌3C反应经2min后,A的浓度从开始时的1.0mol・L-1 下降到0.8mol・L-1,则
A+2B⇌3C
开始 1.0 1.2 0
转化 0.2 0.4 0.6
2min末 0.8 0.8 0.6
C的浓度为0.6mol/L,
2min内该反应的平均速率v(B)=[0.4mol/L/2min]=0.2mol/(L.min),
故选A.点评:
本题考点: 反应速率的定量表示方法.
考点点评: 本题考查化学平衡的计算,明确化学平衡三段法计算格式清晰直观,注重基础知识的考查,题目难度不大.1年前查看全部
- 某化学实验需要1.0mol•L-1的NaCl溶液80mL,而实验室中并没有该浓度的溶液,只有一些粗盐可供使用.某化学兴趣
某化学实验需要1.0mol•L-1的NaCl溶液80mL,而实验室中并没有该浓度的溶液,只有一些粗盐可供使用.某化学兴趣小组经过分析考虑可以通过粗盐提纯后进行配制.
(一)粗盐的提纯.已知粗盐中含有Ca2+,SO42-和泥沙等杂质,1提纯粗盐的操作步骤如下:
(1)将粗盐研细,加水使其充分溶解,然后过滤得到滤液.粗盐研细的目的是______,过滤是为了除去______.
(2)向上述滤液中加入过量的BaCl2溶液,直至沉淀不再产生,则加入过量的BaCl2溶液的目的是______,判断BaCl2溶液过量的方法______.
(3)继续加入过量的Na2CO3溶液,直至沉淀不再产生,然后过滤,得到滤液和沉淀,沉淀的成分是______(填化学式).
(4)向(3)的滤液中加入过量______溶液,目的是______.
(5)将上述溶液蒸发结晶,得到精盐.蒸发时玻璃棒要不断搅拌,直到蒸发皿中出现大量晶体时,停止加热;利用余热使其蒸干.
(2)(3)步骤的操作能否颠倒______,原因是______
(二)1.0mol•L-1的NaCl溶液的配制.
1.配制步骤
①根据计算,需要用托盘天平称量______克的NaCl固体,
②把称量好的NaCl固体放入到烧杯中,加入约25mL左右的蒸馏水,搅拌使其溶解,溶解后立即用玻璃棒引流至______(填写仪器名称,下同).然后加水至离刻度线1~2cm处,改用______加水______.
③塞上容量瓶塞,左手食指摁住瓶塞,右手托住瓶体,反复上下颠倒,摇匀.
④写出一个标有“1.0mol•L-1的NaCl溶液”的标签,贴在容量瓶瓶体上,密封保存.
2.指出上述操作中的几处错误(有几处,写几处)
①______;②______;
③______;④______.
3.指出下列实验操作对结果对所配制溶液浓度的影响,填写偏大、偏小或者无影响
①称量NaCl的时候,所用的砝码生的铁锈;______.
②转移溶液时容量瓶中有少量的蒸馏水;______.
③定容时俯视刻度线;______.
④定容时超过刻度线,吸出一部分水;______.
⑤定容后摇匀,发现液面略低于刻度线,并没有往里再添加蒸馏水______. ff0011年前1
ff0011年前1 -
 BBBQ07 共回答了17个问题
BBBQ07 共回答了17个问题 |采纳率94.1%解题思路:(一)(1)粗盐溶解,需要将粗盐研细加速粗盐溶解,加水使其充分溶解,然后过滤得到滤液,除去不溶性杂质;
(2)向上述滤液中加入过量的BaCl2溶液,直至沉淀不再产生除去粗盐中的硫酸根离子;依据溶液上层清液中是否存在硫酸根离子设计实验验证;
(3)分析粗盐提纯步骤,过滤得到沉淀为硫酸钡、碳酸钙,碳酸钡;
(4)过量的碳酸钠通过加入盐酸到不再生成气体除去;
(2)(3)步骤颠倒,会使得到的氯化钠中含有过量的氯化钡;
(二)1、①1.0mol•L-1的NaCl溶液的配制需要配制100ml溶液,托盘天平精确到0.1g,计算需要氯化钠质量=1.0mol/L×0.1L×58.5g=5.85g=5.9g
②依据溶液配制步骤分析判断,需要把溶解的氯化钠溶液沿玻璃棒转移到100ml的容量瓶中,最后用胶头滴管滴加到刻度;
2、①操作中溶解后溶液未冷却直接转移到容量瓶;
②烧杯和玻璃棒未洗涤;
③配制好的溶液不能长期存放在容量瓶;
3、依据配制溶液过程中溶质的变化,分析判断误差.(一)(1)粗盐溶解,需要将粗盐研细加速粗盐溶解,加水使其充分溶解,然后过滤得到滤液,除去不溶性杂质,粗盐研细的目的是加快粗盐溶解,过滤是为了除去粗盐中的不溶性泥沙,
故答案为:加快粗盐溶解,过滤是为了除去;
(2)向上述滤液中加入过量的BaCl2溶液,直至沉淀不再产生除去粗盐中的硫酸根离子;依据溶液上层清液中是否存在硫酸根离子设计实验验证,加入过量的BaCl2溶液的目的是完全除去硫酸根离子,判断BaCl2溶液过量的方法:静置向上层清液中继续加入BaCl2溶液,若无白色沉淀,证明BaCl2溶已过量,
故答案为:完全除去硫酸根离子,静置向上层清液中继续加入BaCl2溶液,若无白色沉淀,证明BaCl2溶已过量;
(3)分析粗盐提纯步骤,粗盐中含有Ca2+,SO42-和泥沙等杂质,溶解过滤后加入过量氯化钡溶液沉淀硫酸根离子生成硫酸钡沉淀,再加入过量碳酸钠溶液沉淀钙离子、过量的钡离子,生成碳酸钙沉淀恒容碳酸钡沉淀,所以过滤得到沉淀为硫酸钡、碳酸钙,碳酸钡,
故答案为:BaSO4、BaCO3、CaCO3;
(4)滤液中加入过量的碳酸钠,用盐酸除去,滴加盐酸到不再生成气体,可以除去过量的碳酸钠,
故答案为:盐酸;除去过量的碳酸钠溶液;
(5)若(2)(3)步骤颠倒,先加入过量碳酸钠溶液,在加入过量氯化钡溶液,过量的氯化钡不能除去,会使得到的氯化钠中含有过量的氯化钡杂质,
故答案为:否;若颠倒后,则在最后制取的食盐中引入较多量的BaCl2 ;
(二)1、①配制1.0mol•L-1的NaCl溶液80ml,容量瓶无此规格,需要配制100ml溶液,从中取出80ml溶液实现配制目的,托盘天平精确到0.1g,计算需要氯化钠质量=1.0mol/L×0.1L×58.5g=5.85g≈5.9g,
故答案为:5.9;
②溶液配制步骤分析判断,氯化钠溶液溶解后,需要把溶解的氯化钠溶液沿玻璃棒慢慢转移到100ml的容量瓶中,洗涤烧杯和玻璃棒一并转入,加水到离刻度2-3cm处改用用胶头滴管滴加到刻度,液体凹液面的最低处与刻度线相平,
故答案为:100ml容量瓶;胶头滴管;液体凹液面的最低处与刻度线相平;
2、依据配配制溶液的步骤为计算、称量、溶解、冷却、转移、洗涤转移、定容、摇匀、装试剂瓶铁标签,上述操作步骤中存在的问题是
①操作中溶解后溶液未冷却直接转移到容量瓶;
②烧杯和玻璃棒未洗涤;
③配置好的溶液不能长期存放在容量瓶,
故答案为:操作中溶解后溶液未冷却直接转移到容量瓶;烧杯和玻璃棒未洗涤;配制好的溶液不能长期存放在容量瓶;
3、依据配制溶液过程中溶质的变化,分析判断误差;
①称量NaCl的时候,所用的砝码生的铁锈,称量出的氯化钠质量增大,配制溶液浓度偏大,故答案为:偏大;
②转移溶液时容量瓶中有少量的蒸馏水,溶质不变,配制溶液浓度不变,有蒸馏水无影响,故答案为:无影响;
③定容时俯视刻度线,导致加入的蒸馏水体积偏小,根据c=[n/V]可得,加入水使溶液体积低于刻度线,配制溶液浓度增大,故答案为:偏大;
④定容时超过刻度线,溶液浓度变稀,吸出一部分水,配制的溶液浓度偏小,需要重新配制,故答案为:偏小;
⑤定容后摇匀,发现液面略低于刻度线,并没有往里再添加蒸馏水,对溶液浓度无影响,故答案为:无影响.点评:
本题考点: 粗盐提纯;配制一定物质的量浓度的溶液.
考点点评: 本题考查了粗盐提纯的实验设计、过程分析和试剂选择,溶液配制步骤和误差分析的方法,掌握基础,依据所学解答,熟练掌握分离方法和溶液配制步骤是关键,题目难度中等.1年前查看全部
- 欲配制100mL 1.0mol•L-1Na2SO4溶液,正确的方法是( )
欲配制100mL 1.0mol•L-1Na2SO4溶液,正确的方法是( )
①将14.2g Na2SO4溶于100mL水中
②将32.2g Na2SO4•10H2O溶于少量水中,再用水稀释至100mL
③将20mL 5.0mol•L-1Na2SO4溶液用水稀释至100mL
④将20mL 5.0mol•L-1Na2SO4溶液加80mL水.
A. ②④
B. ②③
C. ①③
D. ①②③ gstsxx1年前1
gstsxx1年前1 -
 谁来教教我 共回答了18个问题
谁来教教我 共回答了18个问题 |采纳率77.8%解题思路:①14.2gNa2SO4的物质的量为[14.2g/142g/mol]=0.1mol,根据c=[n/V]以及溶液的体积不等于溶剂的体积来分析;
②32.2gNa2SO4•10H2O物质的量为[32.2g/322g/mol]=0.1mol,硫酸钠的物质的量等于硫酸钠晶体的物质的量,根据c=[n/V]计算判断;
③根据稀释定律,稀释前后溶质硫酸钠的物质的量不变,据此计算稀释后浓度,进行判断;
④溶液密度不同时,不能直接相加.①14.2gNa2SO4的物质的量为[14.2g/142g/mol]=0.1mol,溶剂为100ml,则溶液的体积大于100ml,所以无法计算出物质的量浓度,故①错误;
②32.2gNa2SO4•10H2O物质的量为[32.2g/322g/mol]=0.1mol,硫酸钠的物质的量等于硫酸钠晶体的物质的量,硫酸钠的物质的量浓度c=[0.1mol/0.1L]=1.0mol•L-1,故②正确;
③根据稀释定律,稀释前后溶质硫酸钠的物质的量不变,则20ml×5mol/L=100ml×c(硫酸钠),则c(硫酸钠)=1mol/L,故③正确.
④溶液密度不同时,不能直接相加,故加80ml水后,溶液体积不是100ml,故无法计算出稀释后的溶液的浓度,故④错误;
故选B.点评:
本题考点: 溶液的配制.
考点点评: 本题主要考查配制一定物质的量浓度的溶液的配制及对物质的量浓度的理解、计算,难度不大,注意配制中物质溶于水溶质发生变化的情况以及稀释前后溶质的物质的量不变.1年前查看全部
- 向100mL 1.0mol•L-1的AlCl3溶液中逐滴加入0.5mol•L-1的NaOH溶液至过量,生成沉淀
向100mL 1.0mol•L-1的AlCl3溶液中逐滴加入0.5mol•L-1的NaOH溶液至过量,生成沉淀的物质的量与加入NaOH的量的理论曲线图正确的是( )
A.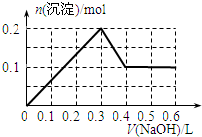
B.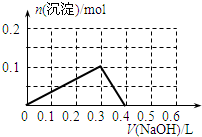
C.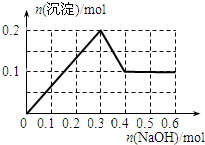
D.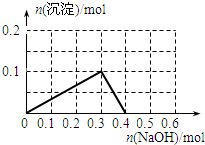
 猫儿木木1年前1
猫儿木木1年前1 -
 qq孤旅KING 共回答了24个问题
qq孤旅KING 共回答了24个问题 |采纳率87.5%解题思路:向氯化铝溶液中加入氢氧化钠溶液发生的化学反应为:AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O,当铝离子恰好和氢氧化钠完全反应生成氢氧化铝时,沉淀的物质的量最大,当氢氧化铝完全转化为偏铝酸钠时,沉淀完全消失,根据方程式及原子守恒进行解答.向氯化铝溶液中加入氢氧化钠溶液发生的化学反应为:AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O,当铝离子恰好和氢氧化钠完全反应生成氢氧化铝时,沉淀的物质的量最大,当氢氧化铝完全转化为偏铝酸钠时,沉淀完全消失;
根据方程式AlCl3+3NaOH=Al(OH)3↓+3NaCl、Al(OH)3+NaOH=NaAlO2+2H2O知,铝离子完全转化为沉淀和沉淀完全消失需要氢氧化钠的物质的量之比为3:1,n(AlCl3)=1.0mol/L×0.1L=0.1mol,完全沉淀时需要氢氧化钠溶液的体积=[0.1mol×3/0.5mol/L]=600mL,根据原子守恒得n(Al(OH)3)=n(AlCl3)=0.1mol,
故选D.点评:
本题考点: 镁、铝的重要化合物;化学方程式的有关计算.
考点点评: 本题以铝的化合物之间的转化为载体考查图象分析,明确物质之间发生的反应及物质之间的关系是解本题关键,再结合原子守恒分析解答,难度中等.1年前查看全部
- 某化学实验需要1.0mol•L -1 的NaCl溶液80mL,而实验室中并没有该浓度的溶液,只有一些粗盐可供使用.某化学
某化学实验需要1.0mol•L -1 的NaCl溶液80mL,而实验室中并没有该浓度的溶液,只有一些粗盐可供使用.某化学兴趣小组经过分析考虑可以通过粗盐提纯后进行配制.
(一)粗盐的提纯.已知粗盐中含有Ca 2+ ,SO 4 2- 和泥沙等杂质,1提纯粗盐的操作步骤如下:
(1)将粗盐研细,加水使其充分溶解,然后过滤得到滤液.粗盐研细的目的是______,过滤是为了除去______.
(2)向上述滤液中加入过量的BaCl 2 溶液,直至沉淀不再产生,则加入过量的BaCl 2 溶液的目的是______,判断BaCl 2 溶液过量的方法______.
(3)继续加入过量的Na 2 CO 3 溶液,直至沉淀不再产生,然后过滤,得到滤液和沉淀,沉淀的成分是______(填化学式).
(4)向(3)的滤液中加入过量______溶液,目的是______.
(5)将上述溶液蒸发结晶,得到精盐.蒸发时玻璃棒要不断搅拌,直到蒸发皿中出现大量晶体时,停止加热;利用余热使其蒸干.
(2)(3)步骤的操作能否颠倒______,原因是______
(二)1.0mol•L -1 的NaCl溶液的配制.
1.配制步骤
①根据计算,需要用托盘天平称量______克的NaCl固体,
②把称量好的NaCl固体放入到烧杯中,加入约25mL左右的蒸馏水,搅拌使其溶解,溶解后立即用玻璃棒引流至______(填写仪器名称,下同).然后加水至离刻度线1~2cm处,改用______加水______.
③塞上容量瓶塞,左手食指摁住瓶塞,右手托住瓶体,反复上下颠倒,摇匀.
④写出一个标有“1.0mol•L -1 的NaCl溶液”的标签,贴在容量瓶瓶体上,密封保存.
2.指出上述操作中的几处错误(有几处,写几处)
①______;②______;
③______;④______.
3.指出下列实验操作对结果对所配制溶液浓度的影响,填写偏大、偏小或者无影响
①称量NaCl的时候,所用的砝码生的铁锈;______.
②转移溶液时容量瓶中有少量的蒸馏水;______.
③定容时俯视刻度线;______.
④定容时超过刻度线,吸出一部分水;______.
⑤定容后摇匀,发现液面略低于刻度线,并没有往里再添加蒸馏水______. 88682061年前1
88682061年前1 -
 喜欢苏醒的路人丙 共回答了12个问题
喜欢苏醒的路人丙 共回答了12个问题 |采纳率83.3%(一)(1)粗盐溶解,需要将粗盐研细加速粗盐溶解,加水使其充分溶解,然后过滤得到滤液,除去不溶性杂质,粗盐研细的目的是加快粗盐溶解,过滤是为了除去粗盐中的不溶性泥沙,
故答案为:加快粗盐溶解,过滤是为了除去;
(2)向上述滤液中加入过量的BaCl 2 溶液,直至沉淀不再产生除去粗盐中的硫酸根离子;依据溶液上层清液中是否存在硫酸根离子设计实验验证,加入过量的BaCl 2 溶液的目的是完全除去硫酸根离子,判断BaCl 2 溶液过量的方法:静置向上层清液中继续加入BaCl 2 溶液,若无白色沉淀,证明BaCl 2 溶已过量,
故答案为:完全除去硫酸根离子,静置向上层清液中继续加入BaCl 2 溶液,若无白色沉淀,证明BaCl 2 溶已过量;
(3)分析粗盐提纯步骤,粗盐中含有Ca 2+ ,SO 4 2- 和泥沙等杂质,溶解过滤后加入过量氯化钡溶液沉淀硫酸根离子生成硫酸钡沉淀,再加入过量碳酸钠溶液沉淀钙离子、过量的钡离子,生成碳酸钙沉淀恒容碳酸钡沉淀,所以过滤得到沉淀为硫酸钡、碳酸钙,碳酸钡,
故答案为:BaSO 4 、BaCO 3 、CaCO 3 ;
(4)滤液中加入过量的碳酸钠,用盐酸除去,滴加盐酸到不再生成气体,可以除去过量的碳酸钠,
故答案为:盐酸;除去过量的碳酸钠溶液;
(5)若(2)(3)步骤颠倒,先加入过量碳酸钠溶液,在加入过量氯化钡溶液,过量的氯化钡不能除去,会使得到的氯化钠中含有过量的氯化钡杂质,
故答案为:否;若颠倒后,则在最后制取的食盐中引入较多量的BaCl 2 ;
(二)1、①配制1.0mol•L -1 的NaCl溶液80ml,容量瓶无此规格,需要配制100ml溶液,从中取出80ml溶液实现配制目的,托盘天平精确到0.1g,计算需要氯化钠质量=1.0mol/L×0.1L×58.5g=5.85g≈5.9g,
故答案为:5.9;
②溶液配制步骤分析判断,氯化钠溶液溶解后,需要把溶解的氯化钠溶液沿玻璃棒慢慢转移到100ml的容量瓶中,洗涤烧杯和玻璃棒一并转入,加水到离刻度2-3cm处改用用胶头滴管滴加到刻度,液体凹液面的最低处与刻度线相平,
故答案为:100ml容量瓶;胶头滴管;液体凹液面的最低处与刻度线相平;
2、依据配配制溶液的步骤为计算、称量、溶解、冷却、转移、洗涤转移、定容、摇匀、装试剂瓶铁标签,上述操作步骤中存在的问题是
①操作中溶解后溶液未冷却直接转移到容量瓶;
②烧杯和玻璃棒未洗涤;
③配置好的溶液不能长期存放在容量瓶,
故答案为:操作中溶解后溶液未冷却直接转移到容量瓶;烧杯和玻璃棒未洗涤;配制好的溶液不能长期存放在容量瓶;
3、依据配制溶液过程中溶质的变化,分析判断误差;
①称量NaCl的时候,所用的砝码生的铁锈,称量出的氯化钠质量增大,配制溶液浓度偏大,故答案为:偏大;
②转移溶液时容量瓶中有少量的蒸馏水,溶质不变,配制溶液浓度不变,有蒸馏水无影响,故答案为:无影响;
③定容时俯视刻度线,导致加入的蒸馏水体积偏小,根据c=
n
V 可得,加入水使溶液体积低于刻度线,配制溶液浓度增大,故答案为:偏大;
④定容时超过刻度线,溶液浓度变稀,吸出一部分水,配制的溶液浓度偏小,需要重新配制,故答案为:偏小;
⑤定容后摇匀,发现液面略低于刻度线,并没有往里再添加蒸馏水,对溶液浓度无影响,故答案为:无影响.1年前查看全部
- 有100mL 溶质为MgCl2和AlCl3的混合溶液,c(Cl-)=1.0mol•L-1,c(Mg2+)=0.
有100mL 溶质为MgCl2和AlCl3的混合溶液,c(Cl-)=1.0mol•L-1,c(Mg2+)=0.2mol•L-1.若不考虑水解因素,则要使其中的Mg2+全部转化为Mg(OH)2沉淀而分离出来,至少需要4mol•L-1的NaOH溶液的体积是( )
A. 25mL
B. 5mL
C. 30mL
D. 100mL 亚麻哈1年前1
亚麻哈1年前1 -
 baobeidelaoda 共回答了17个问题
baobeidelaoda 共回答了17个问题 |采纳率76.5%解题思路:操作的目的是氢氧化镁形成沉淀从溶液中分离出来,需要加入过量的碱把生成的氢氧化铝沉淀恰好全部溶解,利用MgCl2和AlCl3与NaOH反应方程式进行计算,然后利用电荷守恒、离子守恒计算.发生反应为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O;
将Mg2+恰好转化为沉淀分离,需要把Al3+全部转化为AlO2-;观察反应方程式可知,此时,溶液恰好为NaCl和NaAlO2溶液,所以,n(Na+)=n(Cl-)+n(Al3+),
Na+来源于4mol/LNaOH溶液,Al3+、Cl-来源于100mLMgCl2和AlCl3混合液溶液,不考虑水解因素,原溶液中根据电荷守恒2[Mg2+]+3[Al3+]=[Cl-]计算得到[Al3+]=0.2mol/L
由离子守恒知:n(Na+)=n(Cl-)+n(Al3+)=0.1L×1mol/L+0.1L×0.2mol/L=0.12mol,所以,需加4mol/LNaOH溶液体积为:[0.12mol/4mol/L]=0.03L=30ml;
故选C.点评:
本题考点: 镁、铝的重要化合物;化学方程式的有关计算.
考点点评: 本题考查了镁离子铝离子混合溶液中分离镁离子的方法应用,主要考查氢氧化铝能溶于强碱中,结合电荷收和离子守恒进行计算,关键是反应过程的分析判断.1年前查看全部
- 用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0mol•L-1稀硫酸,
用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0mol•L-1稀硫酸,
(1)经计算,应用______(填仪器名称及规格,下同)取浓硫酸______.
(2)配制操作可分解成如下几步,以下正确的操作顺序是______
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C.用已冷却的稀硫酸注入已检查不漏水的容量瓶中D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1~2cm
(3)所需仪器除烧杯、玻璃棒、量筒外还需______、______.
(4)玻璃棒在整个实验中的作用是______.
(5)由于错误操作,使得到的浓度数据比正确的偏大的是______(填写序号).
A.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度
B.没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中
C.容量瓶用蒸馏水洗净,没有烘干
D.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
E.把配好的溶液倒入用蒸馏水洗净而末干的试剂瓶中备用. 红袖添香_01年前1
红袖添香_01年前1 -
 果园老农 共回答了17个问题
果园老农 共回答了17个问题 |采纳率94.1%解题思路:(1)根据浓硫酸在稀释前后溶质的物质的量保持不变来计算回答;
(2)根据配制一定物质的量浓度溶液的步骤来回答;
(3)根据配制一定物质的量浓度的溶液的使用仪器:烧杯、玻璃棒、量筒、100mL容量瓶、胶头滴管来回答;
(4)根据玻璃棒在溶解(稀释)以及移液操作中的作用来回答;
(5)根据公式c=[n/V]中的n和V的操作不当会给实验带来误差分析.(1)浓硫酸在稀释前后溶质的物质的量保持不变,设需要溶液的体积是V,则98%×1.84g/cm3×V=0.100L×1.0mol•L-1×98g/mol,解得V=5.4mL,量取该体积的浓硫酸要用体积接近的量筒,即为用10mL的,故答案为:10 mL量筒;5.4 mL;
(2)配制一定物质的量浓的溶液的步骤:查漏、计算、量取、稀释、移液、定容、摇匀可知正确的操作顺序为:ADECBHGFD;
(3)配制一定物质的量浓度的溶液的使用仪器:烧杯、玻璃棒、量筒、容量瓶(规格据所需的体积来定)、胶头滴管,故答案为:100mL容量瓶、胶头滴管;
(4)在稀释操作中用玻璃棒来搅拌,加速热量的散失,在移液操作中,用玻璃棒来引流,防止液体外溅,故答案为:搅拌、引流.
(5)A.使用容量瓶配制溶液时,俯视液面定容会使得所加入水的体积小于容量瓶的规格,这样所得溶液的浓度偏大,故A正确;
B.没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中.相当于一部分溶质没有转移到容量瓶中,这样导致结果偏低,故B错误;
C.容量瓶用蒸馏水洗净,没有烘干,不影响实验结果,故C错误;
D.定容时,滴加蒸馏水,先使液面略高于刻度线,相当于把溶液稀释,再吸出少量水使液面凹面与刻度线相切,浓度时稀释后的浓度,结果偏小,故D错误;
E.把配好的溶液倒入用蒸馏水洗净而末干的试剂瓶中备用,相当于把溶液稀释,故E错误.
故选A.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制的误差分析,注意从c=[n/v]分析操作对溶质的物质的量或对溶液的体积的影响判断.1年前查看全部
- 实验室用氢氧化钠固体配制1.0mol•L-1的NaOH溶液460mL,回答下列问题:
实验室用氢氧化钠固体配制1.0mol•L-1的NaOH溶液460mL,回答下列问题:
(1)所需仪器为:托盘天平、量筒、烧杯、玻璃棒、药匙,还需要哪些实验仪器才能完成该实验,请写出:______.
(2)需称量NaOH的质量为______g.
(3)下列操作对所配溶液的浓度有何影响?(填写字母)偏大的有______;无影响的有______.
A.将NaOH放在纸张上称量;
B.称量时使用了生锈并脱落的砝码;
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中;
D.往容量瓶中移液时,有少量液体溅出;
E.未洗涤溶解NaOH的烧杯;
F.容量瓶未干燥即用来配制溶液;
G.定容时俯视刻度线;
H.定容后反复摇匀,静置后,发现液面不到刻度线,再加水至刻度线.
(4)下列操作中,容量瓶所不具备的功能有______.
A.配制一定体积准确浓度的标准溶液;
B.贮存溶液;
C.测量容量瓶规格以下的任意体积的液体;
D.用来加热溶解固体溶质.
(5)用18mol/L的浓硫酸配制1mol/L的稀硫酸,操作可分解成如下几步,以下正确的操作顺序是______.
A.向容量瓶中注入少量蒸馏水,检查是否漏水;
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次,振荡;
C.用已冷却的稀硫酸注入已检查不漏水的容量瓶中;
D.根据计算,用量筒量取一定体积的浓硫酸;
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌;
F.盖上容量瓶塞子,摇匀;
G.用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切;
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1~2cm. 吃柚子的鱼儿1年前1
吃柚子的鱼儿1年前1 -
 qazxcdewsx 共回答了17个问题
qazxcdewsx 共回答了17个问题 |采纳率100%解题思路:(1)根据配制一定物质的量浓度的溶液的操作步骤选择使用的仪器;
(2)根据n=CV和m=nM来计算;
(3)根据C=[n/V],通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差;
(4)容量瓶是配制一定体积准确浓度的标准溶液的定容仪器,不能用于稀释溶液、溶解固体、作反应;
(5)根据操作过程是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶等步骤来排序.(1)配制溶液的操作步骤:首先计算出需要的药品的质量,然后用托盘天平称量,后放入烧杯中溶解,同时用玻璃棒搅拌,待溶液冷却至室温后,用玻璃杯引流移液至500ml容量瓶,然后洗涤烧杯和玻璃棒2至3次,将洗涤液也注入容量瓶,然后向容量瓶中注水,至液面离刻度线1至2CM时,改用胶头滴管逐滴加入,至凹液面与刻度线相切,然后摇匀、装瓶.用到的仪器有:托盘天平、药匙、量筒、烧杯、玻璃棒、500ml容量瓶、胶头滴管,根据题目提供的可知,还需要的实验仪器是:500ml容量瓶、胶头滴管,
故答案为:500ml容量瓶、胶头滴管;
(2)配制1.0mol•L-1的NaOH溶液460mL,由于无460ml的容量瓶,故选用500ml容量瓶,则配制的是1.0mol/L的NaOH溶液500ml.
需要的NaOH的物质的量n=CV=1.0mol/L×0.5L=0.5mol,质量m=nM=0.5mol×40g/mol=20.0g,故答案为:20.0;
(3)A.NaOH固体容易潮解,故放在纸张上称量会导致其真实质量偏小,所配溶液浓度偏小;
B.砝码生锈并脱落后质量变小,而m物=m砝+m游,故称量出的药品的质量偏小,则配制出的溶液的浓度偏小;
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中并定容,待溶液冷却后体积偏小,则浓度偏大;
D.往容量瓶中移液时,有少量液体溅出,会导致溶质的损失,则溶液浓度偏小;
E.未洗涤溶解NaOH的烧杯,会导致溶质的损失,则溶液浓度偏小;
F.只要最后定容时凹液面与刻度线相切即可,至于水是事先就有的还是后来加入的,对浓度无影响,;
G.定容时俯视刻度线,会导致溶液体积偏小,则浓度偏大;
H.定容后反复摇匀,静置后,发现液面不到刻度线是正常的,再加水至刻度线会导致浓度偏小.
故浓度偏大的有:CG,对浓度无影响的有:F,
故答案为:CG;F;
(4)容量瓶是配制一定体积准确浓度的标准溶液的定容仪器,不能用于稀释溶液、溶解固体、作反应容器和储存溶液,由于只有一条刻度线,也不能配制除其规格以外容积的液体,故答案为:BCD;
(5)操作过程是查漏、量取、溶解、移液、洗涤、定容、摇匀、装瓶,故可知正确的操作顺序是:ADECBHGF,故答案为:ADECBHGF.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制过程中涉及到的仪器的选择、计算、误差分析等问题,难度不大.1年前查看全部
- 将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验
将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
 A. 做该实验时环境温度为20℃
A. 做该实验时环境温度为20℃
B. 该实验表明化学能可能转化为热能
C. NaOH溶液的浓度约为1.0mol/L•L-1
D. 该实验表明有水生成的反应都是放热反应 蓝色四1年前1
蓝色四1年前1 -
 sars927 共回答了19个问题
sars927 共回答了19个问题 |采纳率100%解题思路:A、从图示观察起始温度即为实验时环境温度;
B、根据图示所测溶液温度变化进行分析;
C、根据氢氧化钠溶液与盐酸溶液反应方程式进行计算;
D、根据一个反应无法得出此结论.A、该实验开始温度是21℃,故A错误;
B、由图示可以看出该反应过程放出热量,表明化学能可能转化为热能,故B正确;
C、恰好反应时参加反应的盐酸溶液的体积是30mL,由V1+V2=50Ml可知,消耗的氢氧化钠溶液的体积为20mL.
设恰好反应时氢氧化钠溶液中溶质的物质的量是n.
HCl+NaOH=NaCl+H 2O
11
1.0mol•L-1×0.03L n
则n=1.0mol•L-1×0.03L=0.03mol,所以浓度是:[0.03mol/0.02L]=1.5mol/L,故C错误;
D、只是该反应放热,其他有水生成的反应不一定,所以D错误.
故选B.点评:
本题考点: 中和热的测定;吸热反应和放热反应.
考点点评: 本题结合中和反应考查了同学们观察分析问题的能力,以及利用化学方程式计算的能力,比较综合,要认真分析解答.1年前查看全部
- 配制100mL 1.0mol•L-1的Na2CO3溶液,下列情况会导致溶液浓度偏高的是( )
配制100mL 1.0mol•L-1的Na2CO3溶液,下列情况会导致溶液浓度偏高的是( )
A.容量瓶使用前用1.0 mol•L-1的Na2CO3溶液润洗
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C.仰视确定凹液面与刻度线相切
D.用敞口容器称量Na2CO3且时间过长 乖乖456693641年前1
乖乖456693641年前1 -
 320902 共回答了19个问题
320902 共回答了19个问题 |采纳率84.2%解题思路:根据c=[n/V]分析判断误差,如果n偏大或V偏小则配制溶液浓度偏高.A.容量瓶使用前用1.0 mol•L-1的Na2CO3溶液润洗,溶质的物质的量偏大,配制溶液浓度偏高,故A正确;B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒,溶质的物质的量偏小,配制溶液浓度偏低,故B错误;C.仰视确定...
点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查误差分析,正确理解c=[n/V]是解本题关键,难度不大.1年前查看全部
- 用1L 1.0mol•L-1的NaOH溶液吸收0.6mol CO2,所得溶液中的CO32-和HCO3-的物质的量浓度之比
用1L 1.0mol•L-1的NaOH溶液吸收0.6mol CO2,所得溶液中的CO32-和HCO3-的物质的量浓度之比约是( )
A.1:3
B.2:1
C.2:3
D.3:2 东西221年前1
东西221年前1 -
 豌豆尖女孩 共回答了25个问题
豌豆尖女孩 共回答了25个问题 |采纳率100%解题思路:用1L 1mol•L-1NaOH溶液吸收0.9molCO2,所得产物有Na2CO3和NaHCO3,根据Na元素和C元素守恒列式计算.用1L 1mol•L-1NaOH溶液吸收0.9molCO2,所得产物有Na2CO3和NaHCO3,设CO32-和HCO3-的物质的量分别为x、y,则
x+y=0.6mol
2x+y=1L×1.0mol/L
解得x=0.4mol,y=0.2mol,
同一溶液中浓度之比等于物质的量之比,
则所得溶液中的CO32-和HCO3-的物质的量浓度之比约是0.4mol:0.2mol=2:1,
故选B.点评:
本题考点: 离子方程式的有关计算.
考点点评: 本题考查离子反应的计算,为高频考点,题目难度不大,注意从原子守恒的角度分析.1年前查看全部
- (2012•宁德模拟)(1)①用1.0mol•L-1盐酸配制100mL 0.10mol•L-1盐酸,所需的玻璃
 (2012•宁德模拟)(1)①用1.0mol•L-1盐酸配制100mL 0.10mol•L-1盐酸,所需的玻璃仪器有量筒、100mL容量瓶、烧杯、______、______.
(2012•宁德模拟)(1)①用1.0mol•L-1盐酸配制100mL 0.10mol•L-1盐酸,所需的玻璃仪器有量筒、100mL容量瓶、烧杯、______、______.
②用0.10mol•L-1标准盐酸滴定未知浓度的烧碱溶液时,酸式滴定管初读教为0.10mL,终读数如图1所示,则滴定所用盐酸体积为______.
(2)如图2所示,集气瓶内充满某混合气体,置于光亮处一段时间,将滴管内的水挤入集气瓶,再打开止水夹,烧杯中的水会进入集气瓶.该集气瓶中的气体可能是______.
A.CO、O2B.Cl2、CH4
C.NO2、O2D.N2、H2. pack45871年前1
pack45871年前1 -
 ruhua123 共回答了21个问题
ruhua123 共回答了21个问题 |采纳率95.2%解题思路:(1)①根据配制一定物质的量浓度的溶液的步骤选择使用的玻璃仪器;
②根据滴定管的构造及图1中滴定管中的液面读出终读数,再计算出滴定所用盐酸的体积;
(2)集气瓶中挤入水后,若导管中的水进入集气瓶,必须满足集气瓶中气体体积减小,集气瓶中压强减小.(1)①用1.0mol•L-1盐酸配制100mL 0.10mol•L-1盐酸的步骤为:计算、量取、稀释、转移、洗涤、定容、摇匀等,用到的仪器有:量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,题中还缺少的玻璃仪器有:胶头滴管和玻璃棒,
故答案为:胶头滴管;玻璃棒;
②滴定管读数读到0.01mL,图1中液面在刻度线20以下的一个小刻度,所以读数为20.10mL,滴定所用盐酸体积为:20.10mL-0.10mL=20.00mL,
故答案为:20.00mL;
(2)集气瓶内充满某混合气体,置于光亮处一段时间,将滴管内的水挤入集气瓶,再打开止水夹,烧杯中的水会进入集气瓶,说明集气瓶中挤入水后,导致集气瓶中的气体体积减小,集气瓶中压强减小,
A、一氧化碳与氧气在光照下不反应,二者也不容易水,所以将滴管内的水挤入集气瓶,再打开止水夹,烧杯中的水不会进入集气瓶,故A错误;
B、甲烷与氯气在光照下反应生成了氯化氢和氯代甲烷,将滴管内的水挤入集气瓶,由于氯化氢极易溶于水,集气瓶中气体体积减小,导致集气瓶中压强减小,再打开止水夹,烧杯中的水会进入集气瓶,故B正确;
C、由于二氧化氮能够与水反应生成一氧化氮,而一氧化氮能够与氧气反应生成二氧化氮;将滴管内的水挤入集气瓶,导致集气瓶中气体的体积减小,集气瓶中压强减小,烧杯中的水会进入集气瓶,故C正确;
D、氮气和氢气在光照下不反应,二者也不溶于水,所以将滴管内的水挤入集气瓶,再打开止水夹,烧杯中的水不会进入集气瓶,故D错误;
故答案为:BC.点评:
本题考点: 配制一定物质的量浓度的溶液;常见气体的检验;中和滴定.
考点点评: 本题考查了配制一定物质的量浓度的溶液需要的仪器、中和滴定中滴定管读数等知识,题目难度中等,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力.1年前查看全部
- (1)配制250mL 1.0mol•L-1H2SO4溶液,需用98%的浓硫酸溶液(ρ=1.84g/cm3)体积
(1)配制250mL 1.0mol•L-1H2SO4溶液,需用98%的浓硫酸溶液(ρ=1.84g/cm3)体积为多少?
(2)某10% NaOH溶液,加热蒸发掉100g水后得到80mL20%的溶液,则该20% NaOH溶液的物质的量浓度为多少? ddmmbj1年前1
ddmmbj1年前1 -
 空中大石 共回答了17个问题
空中大石 共回答了17个问题 |采纳率76.5%解题思路:(1)根据c=[1000ρω/M]计算浓硫酸的物质的量浓度,再根据稀释定律计算需要浓硫酸的体积;
(2)令80mL 20%的NaOH溶液的质量为mg,根据氢氧化钠的质量不变计算m的值,进而计算氢氧化钠的质量,再根据n=[m/M]计算氢氧化钠的物质的量,根据c=[n/V]计算氢氧化钠的物质的量浓度.(1)ρ=1.84g/cm3、98%的浓硫酸溶液的物质的量浓度=[1000ρω/M]=[1000×1.84×98%/98]mol/L=18.4mol/L,令需要浓硫酸的体积为V,根据稀释定律,稀释前后溶质硫酸的物质的量不变,则:250mL×1mol/L=V×18.4mol/L,解得V=13.9mL,
答:需要浓硫酸的体积为13.9mL.
(2)令80mL 20%的NaOH溶液的质量为mg,蒸发前后氢氧化钠的质量不变,则:(mg+100g)×10%=mg×20%,解得m=100,故氢氧化钠的质量=100g×20%=20g,NaOH物质的量=[20g/40g/mol]=0.5mol,故该20% NaOH溶液的物质的量浓度为=[0.5mol/0.08L]=6.25mol/L,
答:该20% NaOH溶液的物质的量浓度为6.25mol/L.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查溶液浓度有关计算,涉及物质的量浓度、质量分数计算,难度不大,注意对公式的理解与灵活应用.1年前查看全部
- 有100mL 溶质为MgCl2和AlCl3的混合溶液,c(Cl-)=1.0mol•L-1,c(Mg2+)=0.
有100mL 溶质为MgCl2和AlCl3的混合溶液,c(Cl-)=1.0mol•L-1,c(Mg2+)=0.2mol•L-1.若不考虑水解因素,则要使其中的Mg2+全部转化为Mg(OH)2沉淀而分离出来,至少需要4mol•L-1的NaOH溶液的体积是( )
A. 25mL
B. 5mL
C. 30mL
D. 100mL 从外星看地球11年前1
从外星看地球11年前1 -
 zhd_blank 共回答了14个问题
zhd_blank 共回答了14个问题 |采纳率85.7%解题思路:操作的目的是氢氧化镁形成沉淀从溶液中分离出来,需要加入过量的碱把生成的氢氧化铝沉淀恰好全部溶解,利用MgCl2和AlCl3与NaOH反应方程式进行计算,然后利用电荷守恒、离子守恒计算.发生反应为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O;
将Mg2+恰好转化为沉淀分离,需要把Al3+全部转化为AlO2-;观察反应方程式可知,此时,溶液恰好为NaCl和NaAlO2溶液,所以,n(Na+)=n(Cl-)+n(Al3+),
Na+来源于4mol/LNaOH溶液,Al3+、Cl-来源于100mLMgCl2和AlCl3混合液溶液,不考虑水解因素,原溶液中根据电荷守恒2[Mg2+]+3[Al3+]=[Cl-]计算得到[Al3+]=0.2mol/L
由离子守恒知:n(Na+)=n(Cl-)+n(Al3+)=0.1L×1mol/L+0.1L×0.2mol/L=0.12mol,所以,需加4mol/LNaOH溶液体积为:[0.12mol/4mol/L]=0.03L=30ml;
故选C.点评:
本题考点: 镁、铝的重要化合物;化学方程式的有关计算.
考点点评: 本题考查了镁离子铝离子混合溶液中分离镁离子的方法应用,主要考查氢氧化铝能溶于强碱中,结合电荷收和离子守恒进行计算,关键是反应过程的分析判断.1年前查看全部
- 实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是
实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是( )(填序号)
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线.
A.③⑥
B.②④
C.④⑤
D.①⑤ makio_kiss1年前1
makio_kiss1年前1 -
 muhongling 共回答了17个问题
muhongling 共回答了17个问题 |采纳率82.4%解题思路:根据c=[n/V]可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.①没有洗涤烧杯和玻璃棒,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故①错误;
②转移溶液时不慎有少量洒到容量瓶外面,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故②错误;
③容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量及最终溶液的体积都没有影响,所以不影响配制结果,故③错误;
④定容时俯视刻度线,导致加入的蒸馏水体积偏小,配制的溶液体积偏小,溶液浓度偏高,故④正确;
⑤未冷却到室温就将溶液转移到容量瓶并定容,溶液冷却后体积偏小,配制的溶液浓度偏高,故⑤正确;
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线是正常的,若再加水至刻度线,则配制的溶液浓度偏低,故⑥错误.
故选C.点评:
本题考点: 溶液的配制.
考点点评: 本题考查了配制一定浓度的溶液的操作步骤和注意问题,主要把握分析误差产生的原因和结果.1年前查看全部
- 用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0mol•L-1稀硫酸,若实验仪器有:
用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0mol•L-1稀硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯H.100mL容量瓶
(1)需量取浓硫酸的体积为______mL.
(2)实验时选用的仪器有(填序号)______
(3)在容量瓶使用方法中,下列操作不正确的是(填序号)______
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将浓硫酸稀释后,立即注入容量瓶中
D.将准确量取的18.4mol•L-1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(4)配制过程中,下列情况会使配制结果偏高的是(填序号)______
①定容时俯视刻度线观察液面
②容量瓶使用前未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线. 艾滋1年前1
艾滋1年前1 -
 落魄戏子 共回答了17个问题
落魄戏子 共回答了17个问题 |采纳率88.2%解题思路:(1)根据c=[1000ρw/M]计算出浓硫酸的物质的量浓度,然后根据溶液稀释过程中溶质的物质的量不变计算出需要浓硫酸的体积;
(2)根据配制100mL 1.0mol•L-1稀硫酸的步骤选择使用的仪器,然后选出需要使用的仪器序号;
(3)根据容量瓶的构造及容量瓶的正确使用方法进行解答;
(4)根据实验操作对c=[n/V]的影响判断配制过程中产生的误差情况.(1)98%的浓硫酸(其密度为1.84g/cm3)的物质的量浓度为:c=[1000×1.84×98%/98]mol/L=18.4mol/L,配制100mL 1.0mol•L-1稀硫酸,需要浓硫酸的体积为:[1.0mol/L×0.1L/18.4mol/L]≈0.0054L=5.4mL,
故答案为:5.4;
(2)配制100mL 1.0mol•L-1稀硫酸需要使用的仪器有:10mL量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,所以需要选用的仪器的为:CEFGH,
故答案为:CEFGH;
(3)A.容量瓶有瓶塞,配制过程中需要摇匀,所以使用容量瓶前检查它是否漏水,避免影响配制结果,故A正确;
B.容量瓶用蒸馏水洗净后,再用待配液润洗,会导致配制的溶液中溶质的物质的量偏大,配制的溶液浓度偏高,故B错误;
C.将浓硫酸稀释后,立即注入容量瓶中,会导致配制的溶液体积偏小,溶液浓度偏高,故C错误;
D.容量瓶为定容仪器,不能用于溶解或者稀释溶质,只能用于配制溶液,故D错误;
E.定容后需要进行摇匀,方法为:塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀,故E正确;
故答案为:BCD;
(4)①定容时俯视刻度线观察液面,导致加入的蒸馏水体积偏小,配制的溶液浓度偏高,故①正确;
②容量瓶使用前未干燥,对溶质的物质的量和溶液最终体积都没有影响,所以不影响配制结果,故②错误;
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线,会导致加入的蒸馏水体积偏大,配制的溶液浓度偏低,故③错误;
故答案为:①.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了配制一定物质的量浓度的溶液方法,题目难度不大,注意掌握配制一定浓度溶液步骤及误差分析方法,明确容量瓶的正确使用方法.1年前查看全部
- 把2.0mol•L -1 CuSO 4 和1.0mol•L -1 H 2 SO 4 溶液等体积混合(假设混合后的溶液的体
把2.0mol•L -1 CuSO 4 和1.0mol•L -1 H 2 SO 4 溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:
(1)混合溶液中CuSO 4 和H 2 SO 4 的物质的量浓度c(CuSO 4 )=______;c(H 2 SO 4 )=______.
(2)混合液中H + 和SO 4 2- 的物质的量浓度c(H + )=______;c(SO 4 2- )=______.
(3)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余.此时溶液中Fe 2+ 的物质的量浓度,c(Fe 2+ )=______. 天下地狱1年前1
天下地狱1年前1 -
 hero2003237 共回答了20个问题
hero2003237 共回答了20个问题 |采纳率90%(1)把2.0mol•L -1 CuSO 4 和1.0mol•L -1 H 2 SO 4 溶液等体积混合,根据稀释定律,稀释前后溶质的物质的量不变,则混合后溶液中c(CuSO 4 )=
1
2 ×1.0mol/L=1.0mol/L,c(H 2 SO 4 )=
1
2 ×1.0mol/L=0.5mol/L,
故答案为:1.0mol/L;0.5mol/L;
(2)混合后溶液中c(H + )=2c(H 2 SO 4 )=2×0.5mol/L=1mol/L,
溶液中硫酸根来源于硫酸铜与硫酸电离,故c(SO 4 2- )═c(CuSO 4 )+c(H 2 SO 4 )=1mol/L+0.5mol/L=1.5mol/L,
故答案为:1mol/L;1.5mol/L;
(3)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铜、硫酸都完全反应,此时溶液中溶质为FeSO 4 ,故c(Fe 2+ )=c(SO 4 2- )=1.5mol/L,
故答案为:1.5mol/L.1年前查看全部
- 有100mL 溶质为MgCl2和AlCl3的混合溶液,c(Cl-)=1.0mol•L-1,c(Mg2+)=0.
有100mL 溶质为MgCl2和AlCl3的混合溶液,c(Cl-)=1.0mol•L-1,c(Mg2+)=0.2mol•L-1.若不考虑水解因素,则要使其中的Mg2+全部转化为Mg(OH)2沉淀而分离出来,至少需要4mol•L-1的NaOH溶液的体积是( )
A. 25mL
B. 5mL
C. 30mL
D. 100mL wangrui161231年前1
wangrui161231年前1 -
 rikimimi 共回答了17个问题
rikimimi 共回答了17个问题 |采纳率94.1%解题思路:操作的目的是氢氧化镁形成沉淀从溶液中分离出来,需要加入过量的碱把生成的氢氧化铝沉淀恰好全部溶解,利用MgCl2和AlCl3与NaOH反应方程式进行计算,然后利用电荷守恒、离子守恒计算.发生反应为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O;
将Mg2+恰好转化为沉淀分离,需要把Al3+全部转化为AlO2-;观察反应方程式可知,此时,溶液恰好为NaCl和NaAlO2溶液,所以,n(Na+)=n(Cl-)+n(Al3+),
Na+来源于4mol/LNaOH溶液,Al3+、Cl-来源于100mLMgCl2和AlCl3混合液溶液,不考虑水解因素,原溶液中根据电荷守恒2[Mg2+]+3[Al3+]=[Cl-]计算得到[Al3+]=0.2mol/L
由离子守恒知:n(Na+)=n(Cl-)+n(Al3+)=0.1L×1mol/L+0.1L×0.2mol/L=0.12mol,所以,需加4mol/LNaOH溶液体积为:[0.12mol/4mol/L]=0.03L=30ml;
故选C.点评:
本题考点: 镁、铝的重要化合物;化学方程式的有关计算.
考点点评: 本题考查了镁离子铝离子混合溶液中分离镁离子的方法应用,主要考查氢氧化铝能溶于强碱中,结合电荷收和离子守恒进行计算,关键是反应过程的分析判断.1年前查看全部
- (2011•广东)某同学进行试验探究时,欲配制1.0mol•L-1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(O
(2011•广东)某同学进行试验探究时,欲配制1.0mol•L-1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2•8H2O试剂(化学式量:315).在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物.为探究原因,该同学查得Ba(OH)2•8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6.
(1)烧杯中未溶物仅为BaCO3,理由是______.
(2)假设试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,设计试验方案,进行成分检验,在答题卡上写出实验步骤、预期现象和结论.(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
(3)将试剂初步提纯后,准确测定其中Ba(OH)2•8H2O的含量.实验如下:实验步骤 预期现象和结论 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. 步骤2:取适量滤液于试管中,滴加稀硫酸. 步骤3:取适量步骤1中的沉淀于是试管中,______ 步骤4:
①配制250ml 约0.1mol•L-1Ba(OH)2•8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,______,将溶液转入______,洗涤,定容,摇匀.
②滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将______ (填“0.020”、“0.05”、“0.1980”或“1.5”)mol•L-1盐酸装入50ml酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗盐酸Vml.
③计算Ba(OH)2•8H2O的质量分数=
×100%0.25L×
mol×315g/mol0.198V 50 wg (只列出算式,不做运算)
×100%0.25L×
mol×315g/mol0.198V 50 wg
(4)室温下,______(填“能”或“不能”) 配制1.0mol•L-1Ba(OH)2溶液. mf5021年前1
mf5021年前1 -
 水88 共回答了17个问题
水88 共回答了17个问题 |采纳率88.2%解题思路:(1)Ba(OH)2•8H2O与CO2作用转化为BaCO3;
(2)步骤2:预期现象和结论:有白色沉淀生成,说明有Ba2+;
步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中.
预期现象和结论:试管中有气泡生成,烧杯中的澄清石灰水变浑浊,结合步骤2说明沉淀是BaCO3;
步骤4:取适量滤液于烧杯中,用pH计测其pH值;
预期现象和结论:pH>9.6,说明有大量的OH-,综合上面步骤可知试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,假设成立,
(3)①将样品在烧杯中溶解后,过滤,将滤液移入250mL容量瓶中,洗涤将洗涤液移入容量瓶,定容、摇匀;
②盐酸体积最多不能多于50ml,根据50mL计算盐酸的最小浓度,应该是选大于最小浓度而且接近的;
③令250mL溶液中氢氧化钡的浓度为cmol/L,根据消耗的盐酸列方程计算c的值,进而计算250mL溶液中氢氧化钡的物质的量,据此计算样品中Ba(OH)2•8H2O的质量分数.
(4)根据氢氧化钡的溶解度估算饱和溶液的物质的量浓度,据此判断.(1)烧杯中未溶物仅为BaCO3,则由于Ba(OH)2•8H2O与CO2作用转化为BaCO3,
故答案为:Ba(OH)2•8H2O与CO2作用转化为BaCO3;
(2)步骤2:预期现象和结论:有白色沉淀生成,说明有Ba2+;
步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中,
预期现象和结论:试管中有气泡生成,烧杯中的澄清石灰水变浑浊,结合步骤2说明沉淀是BaCO3;
步骤4:取适量滤液于烧杯中,用pH计测其pH值.预期现象和结论:pH>9.6,说明有大量的OH-,综合上面步骤可知试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,假设成立,
故答案为:步骤2:预期现象和结论:有白色沉淀生成,说明有Ba2+;
步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中;
预期现象和结论:试管中有气泡生成,烧杯中的澄清石灰水变浑浊,结合步骤2说明沉淀是BaCO3;
步骤4:取适量滤液于烧杯中,用pH计测其pH值;
预期现象和结论:pH>9.6,说明有大量的OH-,综合上面步骤可知试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,假设成立;
(3)①将样品在烧杯中溶解后,过滤,将滤液移入250mL容量瓶中,洗涤将洗涤液移入容量瓶,定容、摇匀,
故答案为:溶解、过滤;250ml的容量瓶中;
②盐酸体积最多不能多于50ml,根据50mL计算盐酸的最小浓度,令盐酸的最小浓度为amol/L,则:
0.025L×0.1mol/L×2=amol/L×0.05L,解得a=0.1mol/L,应该是选大于最小浓度而且接近的,故选择0.1980mol/L的盐酸,
故答案为:0.1980;
③令250mL溶液中氢氧化钡的浓度为cmol/L,则:
0.025L×cmol/L×2=0.1980mol/L×V×10-3L,解得c=[0.198V/50],
故Ba(OH)2•8H2O的质量分数=
0.25L×
0.198V
50mol×315g/mol
wg×100%,
故答案为:
0.25L×
0.198V
50mol×315g/mol
wg×100%;
(4)室温下,氢氧化钡的溶解度为3.9g,溶液的物质的量浓度约是
3.9g
171g/mol
0.1L=0.23mol/L,故室温下,不能配制1.0mol•L-1Ba(OH)2溶液,
故答案为:不能.点评:
本题考点: 探究物质的组成或测量物质的含量;溶解度、饱和溶液的概念;配制一定物质的量浓度的溶液.
考点点评: 本题考查物质成分与含量测定、对实验方案的理解与设计、溶液配制、中和滴定、化学计算等,题目综合性较大,难度中等,侧重对实验方案设计与化学计算,是对学生综合能力的考查.1年前查看全部
- 某实验需要用1.0mol•L -1 NaOH溶液450mL.配制实验操作步骤有:a.在天平上称量______gNaOH固
某实验需要用1.0mol•L -1 NaOH溶液450mL.配制实验操作步骤有:a.在天平上称量______gNaOH固体放入烧杯中,加水溶解,冷却至室温.b.把制得的溶液小心地注入______ml容量瓶中.c.继续向容器中加水至距刻度线1cm~2cm处,改用______加水至刻度线.d.用少量水洗涤烧杯和玻璃棒2~3次并转移入容量瓶中.e.将瓶塞塞紧,充分摇匀.填写下列空白:
①操作步骤和正确顺序为______.
②该配制过程中两次用到玻璃棒,其作用分别是______、______.
③在进行b步操作时,不慎有液体溅出,下列处理措施正确的是______
A.继续进行实验B.添加部分NaOH溶液
C.倒掉溶液,重新配制D.倒掉溶液,洗净容量瓶后重新配制. xiongsong20041年前1
xiongsong20041年前1 -
 qfly161616 共回答了19个问题
qfly161616 共回答了19个问题 |采纳率89.5%配制1.0mol•L -1 NaOH 溶液450mL,实验室没有450mL容量瓶,应该选用500mL容量瓶进行配制,需要氢氧化钠的物质的量为:1.0mol•L -1 ×0.5L=0.5mol,需要氢氧化钠的质量为:40g/mol×0.5mol=20.0g;b.冷却后的氢氧化钠溶液转移到500mL容量瓶中;c.继续向容器中加水至距刻度线1cm~2cm处,需要改用胶头滴管定容,
故答案为:20.0;500mL容量瓶;胶头滴管;
①配制一定物质的量浓度的溶液的配制步骤有:计算、称量、溶解、转移、洗涤、定容、摇匀等,所以正确配制顺序为:abdce,
故答案为:abdce;
②该配制过程中两次用到玻璃棒,第一次在溶解氢氧化钠时,使用玻璃棒搅拌,加速溶解;第二次转移溶液时需要使用玻璃棒引流,防止溶液流到容量瓶外边,
故答案为:搅拌加速溶解;引流;
③向容量瓶移液时,不慎有液体溅出,移入容量瓶中氢氧化钠的物质的量偏小,应倒掉溶液,洗净容量瓶后重新配制,
故答案为:D.1年前查看全部
大家在问
- 1数学 小海在参观工厂是看到工人把一些梯形模具加工成等腰梯形,检测时小明发现,每个检测员根据产品及工具的
- 2稚子弄冰中稚字和磐字的意思和读音,这首诗描写哪个季节,孩子们( )的快乐场面
- 3如果一个多项式的次数是4,那么这个多项式的任何一项的次数( )
- 4在空白处填上合适的语言从前,一个村子里有4个能说会道的人,他们分别是裁缝,车夫,船夫和厨师.一次村里哥俩分家,请这4个人
- 5摘抄笔记是啥子东东哦!摘抄笔记是怎样的格式,内容应该怎么安排!)知道的告诉一声,
- 6若f(x)是以4为周期的奇函数,且0小于x小于等于2时,f(x)=2x-1,则f(7)=什么
- 7让座 作文
- 8在回归分析中,代表了数据点和它在回归直线上相应位置的差异的是( ) A.总偏差平方和 B.残差平方和 C.回归平方和
- 9380÷7.6竖式计算
- 10被动语态问题比如i pick up some flowers .被动语态时候是主语当做复数么?The flowers a
- 111.(x-5)的3次方+729=0
- 12x4+5x3+5x2+5x-6=0
- 13初一线段题.在线等.帮帮忙!平面上有3个点A.B.C问:1.过两点画一条直线,共可画多少条?2.以一点为端点且经过另一点
- 14为了判断高中三年级学生是否选修文科与性别的关系,现随机抽取50名学生,得到如下2×2列联表:
- 15【急】英语同义句转换They made friends four years ago1.Four years ____
