甲基橙,酚酞的变色范围我要正确并详细的,左右都要.
 lccdz2022-10-04 11:39:543条回答
lccdz2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 凉风的味道 共回答了30个问题
凉风的味道 共回答了30个问题 |采纳率86.7%- 甲基橙:小于3.1红色,3.1~4.4橙色,大于4.4黄色
酚酞是一种弱有机酸,在pH8.2时为红色的醌式结构. - 1年前
 啊妖 共回答了1个问题
啊妖 共回答了1个问题 |采纳率- 甲基橙 3.1~4.4 黄色 酚酞8.2~10.0红色
- 1年前
 ADSL2006 共回答了1个问题
ADSL2006 共回答了1个问题 |采纳率- 甲基橙 3.1~4.4 酚酞8.2~10.0
- 1年前
相关推荐
- 甲基橙和酚酞在水中的溶解度哪个大
 xwer45321年前1
xwer45321年前1 -
 zhang2103878 共回答了22个问题
zhang2103878 共回答了22个问题 |采纳率90.9%甲基橙微溶于水,较易溶于热水
酚酞在水中几乎不溶.
甲基橙在水中的溶解度大.1年前查看全部
- 高中化学有关指示剂的问题用盐酸滴氢氧化钠: 甲基橙和酚酞都可以(最好选甲基橙,滴在氢氧化钠中,颜色由黄变橙,).我想问的
高中化学有关指示剂的问题
用盐酸滴氢氧化钠: 甲基橙和酚酞都可以(最好选甲基橙,滴在氢氧化钠中,颜色由黄变橙,).我想问的是,甲基橙的变色范围(PH)为3.1-4.4,如果变为橙色了,那溶液启不是显酸性?那不是盐酸“显然”滴定过量了吗?我们要的不是刚好滴定中和的效果吗?这样所测量的待测溶液的浓度不是有误差?求详解,答的好加分 superzxm1年前5
superzxm1年前5 -
 鲜奶蛋糕 共回答了22个问题
鲜奶蛋糕 共回答了22个问题 |采纳率86.4%你是一个比较善于思考,没错.
用盐酸滴氢氧化钠,恰好完全反应溶液是中性,但是,我们没有一种指示剂恰好中性变色的,所以虽然有误差,但我们也不得不接受1年前查看全部
- 甲基橙作指示剂时,如何判断
 希儿_L81年前1
希儿_L81年前1 -
 硫酸分你 共回答了13个问题
硫酸分你 共回答了13个问题 |采纳率92.3%甲基橙的变色范围:PH3.1以下红色,PH3.4--4.4橙色,PH4.4以上黄色1年前查看全部
- 中和滴定时 什么时候选甲基橙 什么时候选酚酞
 风流野玫瑰1年前2
风流野玫瑰1年前2 -
 欧阳小蓝 共回答了18个问题
欧阳小蓝 共回答了18个问题 |采纳率94.4%甲基橙 滴定后 锥形瓶中的溶液呈弱酸性时使用.
酚酞 碱性.
指示剂的使用最关键是 变色明显.1年前查看全部
- 下列中和滴定操作会导致测量结果明显偏高的是( ) A.用甲基橙作指示剂,标准盐酸滴定待测氢氧化钠溶液至溶液由黄色刚好变
下列中和滴定操作会导致测量结果明显偏高的是( ) A.用甲基橙作指示剂,标准盐酸滴定待测氢氧化钠溶液至溶液由黄色刚好变橙色 B.用酚酞作指示剂,标准盐酸滴定待测氢氧化钠溶液至终点时,酸式滴定管尖出现气泡 C.用甲基橙作指示剂,标准氢氧化钠溶液滴定待测醋酸溶液至溶液由红色刚好变橙色 D.用酚酞作指示剂,标准盐酸滴定待测氨水溶液至溶液由红色刚好变无色  rreew21年前1
rreew21年前1 -
 日万秒 共回答了24个问题
日万秒 共回答了24个问题 |采纳率87.5%A.酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化;滴定终点时溶液颜色由黄色突变为橙色,且半分钟内不复原,结果偏低,故A错误;
B.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=
c(标准)×V(标准)
V(待测) ,可知c(标准)偏大,故B正确;
C.溶液由红色刚好变橙色,仍显酸性,应由橙色刚好变黄色,结果偏低,故C错误;
D.用酚酞作指示剂,标准盐酸滴定待测氨水溶液至溶液由粉红色刚好变无色,且半分钟内不复原,结果偏低,故D错误.
故选B.1年前查看全部
- 下列说法正确的是 A.只有酸碱中和反应才可使用滴定法测物质浓度 B.只要是酸碱中和反应,无论使用酚酞还是甲基橙,误差都非
下列说法正确的是
A.只有酸碱中和反应才可使用滴定法测物质浓度 B.只要是酸碱中和反应,无论使用酚酞还是甲基橙,误差都非常小,但不能使用变色不明显的石蕊作指示剂 C.通过酸碱滴定曲线的绘制可知,酸溶液pH的增加与加入NaOH溶液的体积成正比 D.分光光度计可用于某些无色物质的比色测定  婚后的女人1年前1
婚后的女人1年前1 -
 x_164 共回答了15个问题
x_164 共回答了15个问题 |采纳率93.3%D
分光光度计可以检测到近紫外、近红外光区的信号,可以检测在此范围内有特征吸收光谱的无色物质。1年前查看全部
- 混合酸的计算题,今有一个由硫酸和磷酸组成的混合酸,拟定采用甲基橙和酚酞双指示剂法测定各自含量,用氢氧化钠标准溶液进行滴定
混合酸的计算题,
今有一个由硫酸和磷酸组成的混合酸,拟定采用甲基橙和酚酞双指示剂法测定各自含量,用氢氧化钠标准溶液进行滴定,标准溶液浓度为0.5000molL-1,用甲基橙作指示剂,滴定至终点消耗氢氧化钠25.00mL,用酚酞作指示剂滴定至终点时消耗氢氧化钠15.00mL,若该混合酸的总体积为25.00mL,试计算混合酸中各组分的含量(以gL-1表示).已知M(H2SO4)=98.0gmol-1,M(1/2H3PO4)=49.0gmol-1.[T/] desay1年前1
desay1年前1 -
 tomatoduan 共回答了12个问题
tomatoduan 共回答了12个问题 |采纳率91.7%硫酸为0.1mol/L磷酸为0.3mol/L1年前查看全部
- 甲基橙+酸=红,+碱=黄 石蕊+酸=红,+碱=蓝 酚酞+酸=无,+碱=红
甲基橙+酸=红,+碱=黄 石蕊+酸=红,+碱=蓝 酚酞+酸=无,+碱=红
甲基橙+酸=红,+碱=黄
石蕊+酸=红,+碱=蓝
酚酞+酸=无,+碱=红
怎么记忆
帮忙编个口诀或者故事 涧岩1年前1
涧岩1年前1 -
 寒芸 共回答了15个问题
寒芸 共回答了15个问题 |采纳率100%甲基橙就记红橙黄,分别对应酸中碱
石蕊和酚酞就反着记
打字不易,1年前查看全部
- 甲基紫的吸光度标准曲线是怎样的 和甲基橙一样吗
甲基紫的吸光度标准曲线是怎样的 和甲基橙一样吗
,急用! jeffrey3071年前2
jeffrey3071年前2 -
 martin015 共回答了29个问题
martin015 共回答了29个问题 |采纳率96.6%不一样,得实验去做工作曲线.1年前查看全部
- 称取在270-300摄氏度干燥至恒温的基准无水碳酸钠0.1110g,置锥形瓶中,加水约40ml,加甲基橙指示剂1-2滴,
称取在270-300摄氏度干燥至恒温的基准无水碳酸钠0.1110g,置锥形瓶中,加水约40ml,加甲基橙指示剂1-2滴,
用代标定的盐酸溶液滴定至溶液由黄色转变为橙色即为终点,用去盐酸溶液20.60ml.计算盐酸溶液的量浓度为每升多少摩尔?用什么精度天平称取,水40ML用什么量器量取 花生米291年前0
花生米291年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 常温下,向10mL pH=12的NaOH溶液中加入10mL某酸,再滴入几滴甲基橙,则溶液呈红色.这种酸可能是( )
常温下,向10mL pH=12的NaOH溶液中加入10mL某酸,再滴入几滴甲基橙,则溶液呈红色.这种酸可能是( )
A. pH=2的硫酸
B. pH=2的醋酸
C. 0.01mol/L甲酸
D. 0.01mol/L硝酸 cnlamar1年前1
cnlamar1年前1 -
 bearcn123 共回答了24个问题
bearcn123 共回答了24个问题 |采纳率83.3%解题思路:常温下pH=12的NaOH溶液浓度为0.01mol/L,NaOH和酸等体积混合后,再滴入几滴甲基橙,则溶液呈红色,溶液呈酸性,说明酸有剩余,据此分析解答.常温下pH=12的NaOH溶液浓度为0.01mol/L,
A.pH=2的硫酸中c(H+)=0.01mol/L,硫酸中c(H+)等于NaOH溶液中c(OH-),等体积混合时,二者恰好反应生成强酸强碱盐,溶液呈中性,故A错误;
B.pH=2的醋酸浓度大于0.01mol/L,等体积混合时醋酸有剩余,溶液呈酸性,故B正确;
C.等浓度、等体积的甲酸和NaOH恰好反应生成甲酸钠,甲酸钠为强碱弱酸盐,其溶液呈碱性,故C错误;
D.等浓度、等体积的硝酸和NaOH恰好反应生成硝酸钠,硝酸钠为强酸强碱盐,其溶液呈中性,故D错误;
故选B.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;弱电解质在水溶液中的电离平衡.
考点点评: 本题考查酸碱混合溶液定性判断,同时考查学生分析问题、解决问题能力,正确判断混合溶液中的溶质及其性质是解本题关键,题目难度不大.1年前查看全部
- 甲基橙的变色范围是3.1到4.4 是不是3.1之前就是酸色 4.4之后就是减色啊谢谢了,
 湿透了的伟1年前1
湿透了的伟1年前1 -
 狂风2002 共回答了13个问题
狂风2002 共回答了13个问题 |采纳率92.3%没有酸碱色的说法,而是小于3.1的时候是红色,3.1-4.4是橙色,大于4.4是黄色.至于酸碱,凡是小于7都是酸性,大于7就是碱性1年前查看全部
- 滴定中和时,怎样判断指示剂是甲基橙还是酚酞?
 撒撒爱布1年前3
撒撒爱布1年前3 -
 mudan 共回答了20个问题
mudan 共回答了20个问题 |采纳率85%① 准确测定参加反应的两溶液V标和V待的体积; ② 准确判断中和反应是否恰好完全进行,可借助于酸碱指示剂来判断滴定终点;其中强酸与强碱互滴时,可选用酚酞(变色范围8—10)或甲基橙(变色范围3.1—4.4)作指示剂.如果用已知浓度的盐酸去滴定未知浓度的氢氧化钠溶液,选用1—2滴酚酞作指示剂和氢氧化钠溶液一起放入锥形瓶中,可以观察到红色现象,在盐酸滴定过程中若刚由粉红色变为无色,恰30秒内不褪色为滴定终点.如果用已知浓度的盐酸去滴定未知浓度的氢氧化钠溶液,选用1—2滴甲基橙作指示剂和氢氧化钠溶液一起放入锥形瓶中,可以观察到黄色现象,在盐酸滴定过程中若刚由黄色变为橙色,恰30秒内不褪色为滴定终点.
把石蕊放进酸性溶液(比如米醋) 会显现红色
然后你往里面放碱性物质(比如碳酸钠 碳酸氢钠)
注意观察 石蕊的变色时渐渐变色的 从红色 变成紫色 再变成蓝色
这种渐变 有点像水彩调颜色
人类的眼睛对于这种渐变的效果是没有办法精确定位的
如果是酚酞 从完全无色变为明显的红色 只需要一滴比较稀(0.01左右)的氢氧化钠
甲基橙也是 从明显的红色到明显的黄色 没有渐变的 一滴稀盐酸就够用了
实验室里面做强酸强碱滴定 甲基橙用的不是很多 因为变色范围太偏1年前查看全部
- 用于测定盐酸浓度的甲基橙指示液可以用乙醇配制吗
 幽11年前1
幽11年前1 -
 骗你呢 共回答了19个问题
骗你呢 共回答了19个问题 |采纳率89.5%甲基橙是偶氮类的磺酸盐,可以直接溶于水,虽然溶解度不高,但0.1%的浓度还是足够用的了.
这个东西不溶于乙醇,所以不能用乙醇配制.1年前查看全部
- 使甲基橙变红的溶液中:Ag(NH3)2+,H+,Na+,NO3-可以共存么
 芊芊紫陌1年前2
芊芊紫陌1年前2 -
 hnsl82 共回答了13个问题
hnsl82 共回答了13个问题 |采纳率100%如果没给ksp,就不能共存,因为甲基橙变红为酸性,银氨络离子不能在酸性条件下存在.给了ksp需要进行一下计算确认1年前查看全部
- 碳酸钠标定盐酸必须加热吗甲基橙做指示剂,如果不加热误差会很大吗?我们过两天就要考核这个实验了,急求做过这个实验的人回答一
碳酸钠标定盐酸必须加热吗
甲基橙做指示剂,如果不加热误差会很大吗?我们过两天就要考核这个实验了,急求做过这个实验的人回答一下, 学习计算机1年前3
学习计算机1年前3 -
 台球情缘 共回答了20个问题
台球情缘 共回答了20个问题 |采纳率100%加热是为了将生成的二氧化碳除去,因为二氧化碳和水生成碳酸也是有一定的酸性的,而甲基橙的指示终点是3.2到4.4,而饱和碳酸的ph是3.87左右,所以不剧烈摇晃或者加热会使指示终点提前.1年前查看全部
- 7.某碱液25.00 mL,以0.1000 mol/L HCl标准溶液滴定至酚酞褪色,用去15.28 mL,再加甲基橙继
7.某碱液25.00 mL,以0.1000 mol/L HCl标准溶液滴定至酚酞褪色,用去15.28 mL,再加甲基橙继续滴定,又消
HCl6.50 mL,此碱液的组成是( )
A.NaOH+NaHCO3 B.NaOH+Na2CO3 C.NaHCO3 D.Na2CO3 JasonPiao1年前1
JasonPiao1年前1 -
 大白鲨一号 共回答了13个问题
大白鲨一号 共回答了13个问题 |采纳率84.6%答案 B1年前查看全部
- 用氢氧化钠滴定盐酸时能用什么指示剂?甲基橙行不行?
 qqbabysme1年前1
qqbabysme1年前1 -
 dandanzhuo 共回答了15个问题
dandanzhuo 共回答了15个问题 |采纳率86.7%用酚酞.滴定终点为浅红色,非常浅的红色.边振荡边滴加,开始氢氧化钠滴入时没有颜色变化,快到终点时,由于酸浓度低碱且扩散较慢,会在滴入处有红色,但振荡后立刻消失,注意缓慢滴加.变色后停止滴加,放置30秒钟不变色即为终点.若变回无色,再滴加至恰好变色.酚酞遇酸不变色,遇碱变红色,强碱则为无色,变色范围为8到10 ,ph在8到10之间为粉红.1年前查看全部
- 在以hcl溶液滴定时,怎样使甲基橙及酚酞两种指示剂来判别试样是由naoh-na2co3或na2
 姬生1年前1
姬生1年前1 -
 卖红薯8 共回答了18个问题
卖红薯8 共回答了18个问题 |采纳率88.9%甲基橙变色范围是3.3—4(具体的记不太清了),苯酚是8.3—10(也记不清了),盐酸过量了甲基橙变色,至变量就那么一滴,所以应该用甲基橙做指示剂1年前查看全部
- 问一条大学无机化学的一条题目,称取碳酸钠和碳酸氢钠的混合实际0.6850g,溶于适量的水中,以甲基橙作为指示剂,用0.2
问一条大学无机化学的一条题目,
称取碳酸钠和碳酸氢钠的混合实际0.6850g,溶于适量的水中,以甲基橙作为指示剂,用0.200mol/l的盐酸滴定到终点时,消耗50.0ml ,如果改用酚酞作为指示剂,用上述盐酸滴定到终点时候,需要消耗多少ML? tzcf8881年前2
tzcf8881年前2 -
 8s3g 共回答了16个问题
8s3g 共回答了16个问题 |采纳率87.5%设Xmol,Ymol..106x+84y=0.685.2x+y=0.200*0.0500...计算出x...y
x/0.200*1000=就是答案,看懂没1年前查看全部
- 为什么强酸滴定弱碱必须用甲基橙?
 智慧闲人1年前1
智慧闲人1年前1 -
 a8efq9jge 共回答了13个问题
a8efq9jge 共回答了13个问题 |采纳率76.9%甲基橙的变色范围:pH > 4.4呈黄色,pH < 3.1呈红色.中间呈橙色酚酞变色范围8到10,10以上就不明显了石蕊的变色范围是5-8,小于5的时候是红色,大于8的时候是蓝色,5-8的时候是紫色,而紫色与蓝色之间不好判断弱碱是甲基橙...1年前查看全部
- 实验标定盐酸浓度时,常称量一定量的无水Na2CO3用盐酸来滴定,甲基橙做指示剂.若使用的Na2CO3中有少量的NaHCO
实验标定盐酸浓度时,常称量一定量的无水Na2CO3用盐酸来滴定,甲基橙做指示剂.若使用的Na2CO3中有少量的NaHCO3(其他操作无误),则标定结果
A,偏低
B,偏高
C,无影响
D,也可能偏高,也可能偏低 西龙之龙1年前1
西龙之龙1年前1 -
 无奈芳菲 共回答了17个问题
无奈芳菲 共回答了17个问题 |采纳率82.4%1/2Na2CO3~HCl
53 36.5
NaHCO3~HCl
84 36.5
Na2CO3中有少量的NaHCO3 消耗的盐酸体积偏少,浓度偏大
答案选 B1年前查看全部
- 酸碱中和滴定为什么不能用石蕊先写下几种指示剂变色的范围.酚酞 8.0----10.0 甲基橙 3.1----4.4 石蕊
酸碱中和滴定为什么不能用石蕊
先写下几种指示剂变色的范围.酚酞 8.0----10.0 甲基橙 3.1----4.4 石蕊 好像是5.0----8.0 不明白为什么石蕊不能作酸碱中和滴定的指示剂.老师说是变色范围 但是如果是碱滴定酸,与酚酞对比,酚酞变色,石蕊也会变为蓝色,并且是从红色变为蓝色.如果是酸滴定碱,与甲基橙对比,石蕊还先变为红色,并且从蓝色变为红色.从变色情况来看,也不应该是颜色变化不明显啊!为什么网上都说是变化范围大所以不行?理解不了. 小张ll1年前1
小张ll1年前1 -
 lhyw1 共回答了17个问题
lhyw1 共回答了17个问题 |采纳率82.4%如果有兴趣 有条件 你可以试试 把石蕊放进酸性溶液(比如米醋) 会显现红色 然后你往里面放碱性物质(比如碳酸钠 碳酸氢钠) 注意观察 石蕊的变色时渐渐变色的 从红色 变成紫色 再变成蓝色 这种渐变 有点像水彩调颜色 人类的眼睛对于这种渐变的效果是没有办法精确定位的 如果是酚酞 从完全无色变为明显的红色 只需要一滴比较稀(0.01左右)的氢氧化钠 甲基橙也是 从明显的红色到明显的黄色 没有渐变的 一滴稀盐酸就够用了 实验室里面做强酸强碱滴定 甲基橙用的不是很多 因为变色范围太偏1年前查看全部
- 在甲基橙为黄色的溶液中,这些离子能够大量共存吗?碘离子,氯离子,硝酸根离子,钾离子.
 wzcpj1年前1
wzcpj1年前1 -
 minsan1 共回答了24个问题
minsan1 共回答了24个问题 |采纳率100%甲基橙为黄色时,溶液显酸性,与硝酸根离子结合那么相当于有了硝酸,硝酸是有强氧化性的,碘离子和氯离子会被氧化成
单质,故这些离子不能大量共存1年前查看全部
- 用标准盐酸滴定未知浓度的氨水时,用甲基橙作指示剂?
用标准盐酸滴定未知浓度的氨水时,用甲基橙作指示剂?
甲基橙的变色范围是3.1-4.甲基橙怎样做指示剂? bigsea6326321年前1
bigsea6326321年前1 -
 ximhbk025 共回答了21个问题
ximhbk025 共回答了21个问题 |采纳率95.2%滴定终点的NH4Cl是酸性的呀...1年前查看全部
- 铁矿石中铁含量的测定中甲基橙起什么作用?
 海角1191年前2
海角1191年前2 -
 adba3448 共回答了19个问题
adba3448 共回答了19个问题 |采纳率89.5%甲基橙是指示剂 它是检测溶液中的三价铁是否都转变成了二价铁 还原剂优先还原三价铁 如三价铁都被还原 就会还原指示剂 溶液就有红色变为无色 还原剂的选择有很多 氯化亚锡比较常用1年前查看全部
- 常温下,下列各组离子在指定溶液中可能大量共存的是: A.滴入甲基橙显红色的溶液中: Na + 、NO 3 ˉ、 Fe 2
常温下,下列各组离子在指定溶液中可能大量共存的是:
A.滴入甲基橙显红色的溶液中: Na + 、NO 3 ˉ、 Fe 2+ 、SO 3 2 ˉ B.水电离出的 c ( H + ) = 10ˉ 12 mol/L 的溶液中:K + 、 AlO 2 ˉ、 CH 3 COOˉ、 Clˉ C. 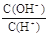 =10ˉ 12 的溶液中: K + 、ClOˉ、S 2 ˉ、 Clˉ
=10ˉ 12 的溶液中: K + 、ClOˉ、S 2 ˉ、 ClˉD.c ( Fe 3+ ) =" 0" .1 mol/L 的溶液中: K + 、Clˉ 、SO 4 2ˉ 、 SCNˉ  祈丰1年前1
祈丰1年前1 -
 穿裤子洗澡 共回答了19个问题
穿裤子洗澡 共回答了19个问题 |采纳率94.7%B
1年前查看全部
- 25℃下,向10mL pH=12的NaOH溶液中加入10mL某酸,再滴入几滴甲基橙,溶液呈红色,则这种酸可能是
25℃下,向10mL pH=12的NaOH溶液中加入10mL某酸,再滴入几滴甲基橙,溶液呈红色,则这种酸可能是( )
A.pH=2的硫酸
B.0.01 mol•L-1的甲酸
C.pH=2的醋酸
D.0.01 mol•L-1的硝酸 左岸独舞1年前1
左岸独舞1年前1 -
 小葳 共回答了20个问题
小葳 共回答了20个问题 |采纳率95%解题思路:向10mL pH=12的NaOH溶液中加入10mL某酸,再滴入几滴甲基橙,溶液呈红色,说明溶液呈酸性,反应后酸过量,以此解答该题.A.加入10mL pH=2的硫酸,恰好反应生成硫酸钠,溶液呈中性,故A错误;
B.加入0.01 mol•L-1的甲酸,生成甲酸钠,为强碱弱酸盐,水解呈碱性,故B错误;
C.pH=2的醋酸浓度比pH=12的NaOH溶液大,反应后醋酸过量,溶液呈酸性,故C正确;
D.加入0.01 mol•L-1的硝酸,恰好反应生成硝酸钠,溶液呈中性,故D错误.
故选:C.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查酸碱混合的定性判断和计算,为高考常见题型,侧重于学生的分析能力和计算能力的考查,难度不大,注意酸碱物质的量的关系的确定以及电解质强弱的判断.1年前查看全部
- 有一混和液可能由NaOH、NaHCO3、Na2CO3中的一种或两种组成.现取等体积的两份上述溶液分别以酚酞和甲基橙为指示
有一混和液可能由NaOH、NaHCO3、Na2CO3中的一种或两种组成.现取等体积的两份上述溶液分别以酚酞和甲基橙为指示剂,用同样浓度的盐酸进行滴定,当达到滴定终点时,消耗盐酸的体积分别为V1mL和V2mL,如,V1<V2<2V1,则上述溶液中的溶质是( )
A. NaHCO3
B. Na2CO3
C. NaHCO3、Na2CO3
D. Na2CO3、NaOH 3高高1年前2
3高高1年前2 -
 假如我是百万富翁 共回答了20个问题
假如我是百万富翁 共回答了20个问题 |采纳率95%解题思路:酚酞作指示剂时NaHCO3不会被滴定,只有NaOH被滴为氯化钠,Na2CO3变为NaHCO3
而甲基橙时所有都会被滴成氯化钠,只有一种物质时,V1和V2关系如下
V1=V2; Na2CO3时2V1=V2; NaHCO3时V1=0,V2>0;
已知V1<V2<2V1;所以是Na2CO3、NaOH酚酞作指示剂时NaHCO3不会被滴定,只有NaOH被滴为氯化钠,Na2CO3变为NaHCO3
而甲基橙时所有都会被滴成氯化钠,只有一种物质时,V1和V2关系如下
NaOH时V1=V2; Na2CO3时2V1=V2; NaHCO3时V1=0,V2>0
已知V1<V2<2V1;所以是Na2CO3、NaOH;故D正确;
故选D.点评:
本题考点: 几组未知物的检验.
考点点评: 本题考查了NaOH、NaHCO3、Na2CO3与HCl反应,要注意酚酞和甲基橙为指示剂时变色范围,题目难度不大.1年前查看全部
- 15摄氏度下的饱和二氧化碳溶液能否使甲基橙变红?
 走过那间咖啡屋1年前1
走过那间咖啡屋1年前1 -
 wmht2004 共回答了24个问题
wmht2004 共回答了24个问题 |采纳率91.7%不能的,甲基橙的变色范围:pH > 4.4呈黄色,pH < 3.1呈红色,而在常温(20度)常压下二氧化碳的饱和水溶液的PH值约等于5.6,即使温度降低5度,二氧化碳的溶解度也不会增大近20倍的,因此不能使甲级橙变红.1年前查看全部
- 用NaOH标准溶液滴定H3PO4至甲基橙变色.计算溶液ph应该用哪个公式?
用NaOH标准溶液滴定H3PO4至甲基橙变色.计算溶液ph应该用哪个公式?
用NaOH标准溶液滴定H3PO4至甲基橙变色.
计算溶液ph应该用哪个公式? 林挺1年前1
林挺1年前1 -
 心儿云 共回答了12个问题
心儿云 共回答了12个问题 |采纳率100%H3PO4 + NaOH = NaH2PO4 + H2O
甲基橙变色,生成物是:NaH2PO4
按酸式盐缓冲溶液计算
pH =(pKa1 + pKa2)/21年前查看全部
- 能使甲基橙呈红色的溶液指含什么离子.硫化钠溶液中能否使硫酸根离子钾离子氯离子铜离子共存
 冷面兰心1年前2
冷面兰心1年前2 -
 天空永远的灰 共回答了25个问题
天空永远的灰 共回答了25个问题 |采纳率88%甲基橙是酸碱指示剂 ,变红则是酸性溶液,即H+离子使得它变红
Na2S中S2-不和Cu2+共存,因为 S2- +Cu2+===CuS 黑色沉淀1年前查看全部
- 下列溶液中,可使酚酞显无色,甲基橙显黄色,石蕊显红色的是()
下列溶液中,可使酚酞显无色,甲基橙显黄色,石蕊显红色的是()
A.pH=4.5 B.pH=8 C.c(OH-)=10^-8mol/L D.c(H+)=10^-4mol/L jack33081年前2
jack33081年前2 -
 wengxj 共回答了17个问题
wengxj 共回答了17个问题 |采纳率94.1%酸色 中 碱色
甲基橙 3.1-4.4 红 橙 黄
酚酞 8.2-10.0 无色 浅红 红
石蕊 5.0-8.0 红 紫 蓝
所以A 是答案1年前查看全部
- 用naoh标准溶液滴定草酸时,为什么使用甲基橙试剂不合适
 wo52082421年前1
wo52082421年前1 -
 黑猫猪脚 共回答了27个问题
黑猫猪脚 共回答了27个问题 |采纳率96.3%终点产物是草酸钠,强大弱酸盐,显碱性,要求在碱性范围内变色,
而甲基橙的变色范围是 3.1----4.4,是酸性的,不合适.1年前查看全部
- 为什么能用甲基橙,酚酞等作酸碱中和滴定的指示剂?如甲基橙的变色范围是3.1-4.4,那么滴定终点时溶液的PH就是3.1或
为什么能用甲基橙,酚酞等作酸碱中和滴定的指示剂?如甲基橙的变色范围是3.1-4.4,那么滴定终点时溶液的PH就是3.1或4.4,根本就不能达到pH=7,这产生的误差不是极大吗?
这个问题困扰我几年了,希望大家不吝赐教!... zxc110011年前8
zxc110011年前8 -
 曹子烈 共回答了18个问题
曹子烈 共回答了18个问题 |采纳率83.3%碱指示剂在实际的中和反应不可能让溶液ph完全等于7,必然会有一个误差,
因为 [PH=4.4与PH=7只是使氢离子的浓度相差了差不多0.001mol/L]
而这个误差反应在ph上,但在溶液浓度计算中,这种误差是可以忽略的,因为一般的计算不需要精确的小数后3位.1年前查看全部
- 一定大量共存的?A.常温下pH=7的溶液 :Fe3+.Na+.Cl-.NO3- B.滴入甲基橙显红色的溶液Na+.Al3
一定大量共存的?A.常温下pH=7的溶液 :Fe3+.Na+.Cl-.NO3- B.滴入甲基橙显红色的溶液Na+.Al3+.Cl-.SO4 2-
 googlehaha1年前2
googlehaha1年前2 -
 vshowyy 共回答了23个问题
vshowyy 共回答了23个问题 |采纳率82.6%选 B
要注意Fe3+在pH=3的时候就开始沉淀,所以pH=7的溶液中不可能有Fe3+,Fe3+此时已完全沉淀生成Fe(OH)3
B是可以的,溶液显酸性,离子能共存.1年前查看全部
- 为什么酸滴碱甲基橙识黄到橙而不是黄到红 滴到橙色是3.1-4.4 滴到红色不是更接近7吗
为什么酸滴碱甲基橙识黄到橙而不是黄到红 滴到橙色是3.1-4.4 滴到红色不是更接近7吗
为什么碱滴酸就是红到黄而不是红到橙 AVON10091年前1
AVON10091年前1 -
 X_MAN 共回答了25个问题
X_MAN 共回答了25个问题 |采纳率92%3.1-4.4 之间是橙色,3.1以下是红色,超过4.4是黄色,滴到红色酸滴加过量了,ph是小于3.1,而不是更接近于7.
碱滴酸时候,刚好到黄色时ph超过4.4,如果到橙色ph才达到3.1,前者更准确.
敬请关注新浪微博@化学那些事,1年前查看全部
- 下列离子组一定能大量共存的是 A.甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ B.石蕊呈蓝色的溶液中:Na+
下列离子组一定能大量共存的是 A.甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ B.石蕊呈蓝色的溶液中:Na+
下列离子组一定能大量共存的是
A.甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+
B.石蕊呈蓝色的溶液中:Na+、AlO2-、NO3-、HCO3-
C.含大量Al3+的溶液中:K+、Na+、NO3-、ClO-
D.含大量OH一的溶液中:CO32-、Cl-、F-、K+ 古物ww1年前10
古物ww1年前10 -
 northlion 共回答了16个问题
northlion 共回答了16个问题 |采纳率93.8%甲基橙呈黄色pH大于4.4是黄色,而题目说一定能大量共存,A中酸性时就不能(NO3-与I-不能在酸性下共存)、B中石蕊呈蓝色的溶液中表明溶液呈碱性Na+可以存在.好像还有下文哟
期待你的下文呀!1年前查看全部
- 甲基橙的制备思考题 为什么说溶液PH值是偶联反应重要条件
 iamjyy1年前1
iamjyy1年前1 -
 228311 共回答了13个问题
228311 共回答了13个问题 |采纳率84.6%此反应一般要求在弱酸性条件下进行,因为此时重氮正离子的浓度大,且芳胺呈游离态,有利于偶联.1年前查看全部
- NaOH溶液滴定到CH3COOH溶液中为什么不能用甲基橙来作酸碱指示剂?
 骆雄信1年前1
骆雄信1年前1 -
 过程与结果 共回答了17个问题
过程与结果 共回答了17个问题 |采纳率88.2%因为这样滴定不完全,我是从以下两个方面考虑的:
1 从反应是否完全考虑:甲基橙的变色范围是3.1-4.4 也就是说在酸性的条件下就可以变色了,假设部分醋酸和氢氧化钠反应了 从而使其变了色 但是在这个酸性范围内仍然可以有醋酸的存在 即可能还有未反应的醋酸呢
2 共存性考虑:甲基橙的变色溶液是酸性的 而假设反应完全了 生成了醋酸钠 那这个时候 醋酸钠的溶液是呈碱性的 酸碱是不会同时出现在一个溶液中的 所以这是行不通的 故甲基橙不能用作指示剂 显而易见酚酞就可以了1年前查看全部
- 甲基橙作为酸碱指示剂的变色现象
 朱烨181年前1
朱烨181年前1 -
 屁憝 共回答了23个问题
屁憝 共回答了23个问题 |采纳率91.3%甲基橙是有一定的变色范围的.PH1年前查看全部
- 柱色谱实验中 甲基橙和亚甲基蓝哪个先洗脱下来?为什么?
 海陆空人1年前1
海陆空人1年前1 -
 首席小密 共回答了22个问题
首席小密 共回答了22个问题 |采纳率90.9%看你先用什么做洗脱剂了.如果用乙醇就是先亚甲基蓝,如果是氨水或者水(也就是极性比较大的溶剂)那就是甲基橙先下来.因为它们极性不同.洗脱剂不同就顺序不同了1年前查看全部
- 用碳酸钠作基准物标定盐酸时,为什么用甲基橙作指示剂?能用酚酞作指示剂吗?为什么?
 wjj_wjj1年前1
wjj_wjj1年前1 -
 常德 共回答了15个问题
常德 共回答了15个问题 |采纳率100%甲基橙遇酸变红,遇碱变黄,滴定到终点时变成橙色.不过标定盐酸时,用碳酸钠做基准物质,但用的指示剂一般是 甲基红—溴甲酚绿 做指示剂,这个现象比较好观察,滴定到玫瑰红的时候应该进行加热煮沸,赶出二氧化碳,冷却,然后接着滴定,你们用甲基橙,应该方法相似吧,肯定是滴定到橙色再加热煮沸,然后再接着滴定吧,用甲基橙就是用来指示滴定终点的.
根据酸碱质子理论,碳酸钠是碱,甲基橙在碱性条件下 是黄色,用盐酸滴定时,溶液逐渐由碱性过度到酸性,颜色由黄色过度到红色,而人眼对红色比敏感,易于观察.2、甲基橙的变色范围在3.4.4,在反应突越范围之内
碳酸钠以及碳酸氢钠是一个会水解的盐,酚酞的变色区域应该貌似在ph=8-10左右,也就是碱性的时候酚酞就变色了,甲基橙的变色区域大概为3.1,总之就是在酸性时候变色.
根据反应方程:Na2CO3+HCl=NaHCO3+NaCl,由于NaHCO3的水解能力比Na2CO3弱,ph值逐步向酸性移动,但如果刚刚移到8,这时,酚酞变色了,但实际上反应没有结束.而这个滴定所需要的反应是:Na2CO3+2HCl=2NaCl+CO2+H2O,滴定的最终溶液是呈酸性的.所以只能用在酸性时候变色的指示计即甲基橙或红.1年前查看全部
- 孔雀石绿、甲基橙、亚甲基蓝染料分别是阴离子染料还是阳离子染料?
 海浪w1年前1
海浪w1年前1 -
 倚风流云 共回答了17个问题
倚风流云 共回答了17个问题 |采纳率70.6%孔雀石绿是带有阳电子的阴离子染料,其余两个是阳离子染料.1年前查看全部
- 滴定终点甲基橙怎么变色
 Y2KJACKCO1年前2
Y2KJACKCO1年前2 -
 yuyanqiu 共回答了16个问题
yuyanqiu 共回答了16个问题 |采纳率93.8%ph3.1以下,红色.3.1到4.4橙色.4.4以上,黄色.
滴定酸液,由公红变到黄色的时候停止.滴定碱液,由黄变橙的时候停止.
明白了吗?
望采纳1年前查看全部
- 盐酸滴定碱液,判断碱液组成以hcl滴定一碱溶液,先用酚酞作指示剂,滴定至终点时体积为V1,加入甲基橙后继续滴定,至变橙色
盐酸滴定碱液,判断碱液组成
以hcl滴定一碱溶液,先用酚酞作指示剂,滴定至终点时体积为V1,加入甲基橙后继续滴定,至变橙色时体积为V2,结果是v1=v2不等于0,所以碱液组成为( )
A,NaOH+Na2CO3
B.纯Na2CO3
C.NaHCO3+Na2CO3
D.纯NaHCO3
试给出简要说明。 gto9911年前1
gto9911年前1 -
 uioo9158 共回答了21个问题
uioo9158 共回答了21个问题 |采纳率95.2%我认为选择A,首先LZ要知道酚酞的变色范围是pH=8左右的,甲基橙的变色范围是pH=3.9;其次碳酸氢钠溶液一般pH=8左右,碳酸钠pH=10.6,pH=8到3.9区间盐酸不与碳酸氢钠反应,pH=8到10的时候,盐酸不与碳酸钠反应.由题意,盐酸应先跟氢氧化钠反应,再和碳酸钠反应升成碳酸氢钠.1年前查看全部
- 在指定环境中,下列各组离子一定可以大量共存的是( ) A.使甲基橙变红的溶液中:Cr 2 O 7 2- 、Fe 2
在指定环境中,下列各组离子一定可以大量共存的是()
A.使甲基橙变红的溶液中:Cr 2 O 7 2- 、Fe 2+ 、SO 4 2- 、K + B.无色强酸性溶液中:Na + 、Cl - 、SO 4 2- 、[Cu(NH 3 ) 4 ] 2+ C.加入过量氨水溶液仍然澄清的溶液中:Cu 2+ 、Ag + 、NO 3 - 、NH 4 + D.能使碘化钾淀粉试纸变蓝的溶液中: Na + 、NH 4 + 、S 2 - 、Br -  cavehicle1年前1
cavehicle1年前1 -
 小木屋里的温暖 共回答了14个问题
小木屋里的温暖 共回答了14个问题 |采纳率92.9%C
使甲基橙变红的溶液显酸性,Cr 2 O 7 2- 和Fe 2+ 发生氧化还原反应,A不正确。[Cu(NH 3 ) 4 ] 2+ 在溶液中显蓝色,B不正确。C正确,因为能形成配合物。能使碘化钾淀粉试纸变蓝的溶液,说明溶液具有氧化性,硫离子不能大量共存,答案选C。1年前查看全部
- 酸碱指示剂问题为什么强碱滴定弱酸时常用酚酞作指示剂,强酸滴定强碱时常用甲基橙作指示剂?
 玉米粥1年前1
玉米粥1年前1 -
 哨兵的爱 共回答了17个问题
哨兵的爱 共回答了17个问题 |采纳率94.1%强碱滴定弱酸等当点时,溶液相当于强碱弱酸盐溶液,由于水解略显碱性,故应用酚酞(变色范围8-10).
强酸滴定弱碱等当点时,溶液相当于弱碱强酸盐溶液,由于水解略显酸性,故应用甲基橙(变色范围3.1-4.4).1年前查看全部
- 甲基橙可以用来做滴定什么的指示剂?
 csj003311年前1
csj003311年前1 -
 ots14 共回答了19个问题
ots14 共回答了19个问题 |采纳率89.5%用作酸碱中和滴定的指示剂1年前查看全部
大家在问
- 1(2012•丹东)除去括号中的杂质所用的试剂或方法正确的是( )
- 2温暖的麦兜-观麦兜响当当有感 作文
- 3用不仅、而且和既然、就这两个关联词造句
- 4坚强的同义词
- 50pen up your heart and let me
- 6新概念英语~就画线部分提问(下横线我打不出来了,就用括号括起来了,).1、They are [Waiting for t
- 7下表中左起第1列的第18个数是______,A处应填______,B处应填______.
- 8读图,回答1—2题。 1、20世纪60年代后 ①全球大气中二氧化碳体积分数持续增加
- 9什么样的斜面最省功比如说斜面的坡度大小是多少省功,你看着回答
- 1048A12V的电瓶带36W的灯泡可以亮多长时间.有这个公式吗?
- 11语文问题一、应和的和的读音是() A、he(/) B、he(、)二、脑筋急转弯 语文课上,刘老师提问:“上节课我们学了三
- 12为啥选B 而不选C呢?76.The decision _____the next problem was how to
- 13能表示“一去不复返”这一意思的成语是( )先回答的先采纳哦!
- 14谁有小学六年级英语荣德基好卷一单元A卷答案哪,我是课代表,答案却忘记带了,老师说必须一天之内批完,又不是能去取,
- 15下面句子该用什么样的语气读,请选择。
