[分析化学]Na2C2O4能否作为滴定酸的基准物?为什么?
 藕叫狗狗2022-10-04 11:39:541条回答
藕叫狗狗2022-10-04 11:39:541条回答
[分析化学]Na2C2O4能否作为滴定酸的基准物?为什么?
大学分析化学实验,酸碱滴定
大学分析化学实验,酸碱滴定

已提交,审核后显示!提交回复
共1条回复
 人情冷暖63 共回答了16个问题
人情冷暖63 共回答了16个问题 |采纳率93.8%- Na2C2O4晶体可以作为滴定酸的基准物.
它比较稳定,是一种碱性物质. - 1年前
相关推荐
- 分析化学,滴定这块的一道题求助一道分析化学,酸碱滴定这的!某混合碱式样0.3010g,用酚酞指示剂,用0.1060mol
分析化学,滴定这块的一道题
求助一道分析化学,酸碱滴定这的!
某混合碱式样0.3010g,用酚酞指示剂,用0.1060mol~L的HCL滴定到终点,消耗HCL25.50ml,然后用甲基橙滴定到终点,共消耗盐酸47.70ml,判断此混合液的组成,和各个组分的质量分数.我就想知道这个混合碱的组成是怎么判断的,后面的不用算,还有就是类似不知道组成的溶液都怎么判断组成呢?上面写的是书上原题,弄不明白了,答案好可以追分!小弟在此万分感谢!
 紫路1年前1
紫路1年前1 -
 天行健59 共回答了22个问题
天行健59 共回答了22个问题 |采纳率90.9%因为是混盐,所以考虑有正盐和酸式盐.用酚酞作指示剂,滴定时用去 HCl 溶液体积为 V1=20.10mL;用甲基橙作指示剂,滴定时用去 HCl 溶液体积为 V2=27.60mL;V11年前查看全部
- 分析化学试验中 胆矾实验中铜的测定 如何计算胆矾式样称量范围
 ajdynioaw1年前1
ajdynioaw1年前1 -
 gbxh888 共回答了14个问题
gbxh888 共回答了14个问题 |采纳率85.7%下限是大于0.2g上限你给的条件是不是不够1年前查看全部
- 分析化学中差减法称量适合什么样的粉末样品?
 云yun1年前3
云yun1年前3 -
 tuchunqiu 共回答了21个问题
tuchunqiu 共回答了21个问题 |采纳率85.7%称量方法分为:直接称量法,增量法和减量法.
直接法最简单方便.
增量法适合称取特定质量,吸湿性不大,粉末状试样.
减量法适合称取多份在一定质量范围的试样,而且试样又较易吸湿,易氧化或易挥发.1年前查看全部
- 分析化学中判断能否分步滴定cka>10-8时,在求多元酸和混合酸的c的时候有什么不同.如用0.1mol/L的NaOH滴定
分析化学中判断能否分步滴定cka>10-8时,在求多元酸和混合酸的c的时候有什么不同.如用0.1mol/L的NaOH滴定
0.1mol/LH2B是为什么Cka1>10-8中C是0.050.而用0.1mol/LNaOH滴定0.1mol/L的甲酸和等浓度的氯化铵的混合溶液时,ck甲酸>10-8,c为0.1,为什么不像多元酸一样为0.05. 野蛮部落1年前1
野蛮部落1年前1 -
 张之恒 共回答了15个问题
张之恒 共回答了15个问题 |采纳率80%这种判别本身就是粗略估计,所以浓度不会很强调,有时考虑稀释引起的浓度变化,有时还用0.1M.1年前查看全部
- (大学分析化学)用银量法测定下列试样(1)氯化钡 (2)氯化钾 (3)氯化氨(4)KSCN
(大学分析化学)用银量法测定下列试样(1)氯化钡 (2)氯化钾 (3)氯化氨(4)KSCN
还有(5)碳酸钠+氯化钠(6)NaBr
各 应选择何种方法确定终点 为什么 顶yy1年前1
顶yy1年前1 -
 兄弟有烟不 共回答了17个问题
兄弟有烟不 共回答了17个问题 |采纳率76.5%莫尔法钡离子和碳酸根有干扰,富哈弗的发用铁铁铵矾做指示剂,1.氯化钡只能用法扬司法2.绿化钾,3.绿化铵和6溴化钠三种任选,4用佛哈弗德返定法,5先用福哈弗的测氯化钠后过滤再1年前查看全部
- 一道分析化学题,应该不是很难,我没学好o(╯□╰)o
一道分析化学题,应该不是很难,我没学好o(╯□╰)o
下列物质必须用间接法配制成标准溶液的是
①HCl,②NaOH,③H2C2O4•2H2O,④KMnO4,⑤K2Cr2O7,⑥NaCl,⑦EDTA,⑧AgNO3 zenithmayor1年前1
zenithmayor1年前1 -
 ojustonly 共回答了14个问题
ojustonly 共回答了14个问题 |采纳率100%1245781年前查看全部
- 这道分析化学题怎么做已经高锰酸钾的摩尔质量为158g/mol,在波长λ=545nm时,其水溶液的摩尔吸收系数ε=2200
这道分析化学题怎么做
已经高锰酸钾的摩尔质量为158g/mol,在波长λ=545nm时,其水溶液的摩尔吸收系数ε=2200L/mol/cm,求此波长下质量分数为0.0020%的高锰酸钾溶液在3.0cm比色皿中的透射比为( )
 浓浓_爱意1年前1
浓浓_爱意1年前1 -
 千铃 共回答了16个问题
千铃 共回答了16个问题 |采纳率81.3%直接求吸光度A=εbc,代入数据即可。然后由A和T的关系式即可求透射比T1年前查看全部
- 一道分析化学题.下列物质必须用间接法配制成标准溶液的是 .①HCl,②NaOH,③H2C2O4•2H2O,④
一道分析化学题.
下列物质必须用间接法配制成标准溶液的是 .
①HCl,②NaOH,③H2C2O4•2H2O,④KMnO4,⑤K2Cr2O7,⑥NaCl,⑦EDTA,⑧AgNO3 猪头吴小球1年前4
猪头吴小球1年前4 -
 真加使徒 共回答了16个问题
真加使徒 共回答了16个问题 |采纳率100%1,HCL易挥发,没有基准物质,要标定.
2,NaOH要潮解,和CO2反应,没有基准物质,要标定.
3,草酸,易分解,没有基准物质,要标定.
4,高锰酸钾固体易分解,而且配成溶液后缓慢分解成MnO2,没有基准物质,要标定.
5,重铬酸钾,很稳定,有基准物质,可直接配.
6,NaCl,很稳定,有基准物质,可直接配.
7,EDTA,很稳定,有基准物质,可直接配.
8,AgNO3,较稳定,避光保存即可,买得到基准物质,可直接配制.
所以要间接配制的是1,2,3,4
还有什么不明白的可以追问我.1年前查看全部
- 在分析化学中醋酸钠是否能用盐酸标准溶液直接滴定?
 谎话连篇不是好人1年前1
谎话连篇不是好人1年前1 -
 河边漫步 共回答了22个问题
河边漫步 共回答了22个问题 |采纳率86.4%可以滴定,但不能通过人眼观察指示剂的方式确定终点,由于人眼观察指示剂变色需要在一滴内溶液有0.2-0.3的pH变化,计算可知需要c×K大于10^(-8).K为酸或碱的解离常数,c为浓度.醋酸钠为弱碱,pKb大于9,这就需要c大于10mol/L,显然是不现实的.但可以采用分光光度滴定或电导滴定,这些仪器的灵敏度比人眼大多了.1年前查看全部
- 分析化学中的那个分配系数所要的那个状态是什么?
分析化学中的那个分配系数所要的那个状态是什么?
组分在固定相和流动相之间分配达平衡时的浓度之比,那个平衡时组分在两相中的状态是怎样一个状态? Pwken1年前1
Pwken1年前1 -
 kwcgtb 共回答了15个问题
kwcgtb 共回答了15个问题 |采纳率86.7%你的问题中已经说明了是平衡态,所谓平衡是指热动平衡、力学平衡、相平衡、化学平衡.而这里的分配系数是一个经典热力学常数,必须在平衡态下才能成立,从推导上看,只需要各相中该组分的化学势相同即可.至于浓度,通常是不变的,但是不能作为判断平衡的依据.1年前查看全部
- 在分析化学中,酸碱滴定液的选择,指示剂的选择原理
在分析化学中,酸碱滴定液的选择,指示剂的选择原理
这是分析化学中,药物分析中的,怎样去选择酸碱滴定液,还有指示剂及其选择原因也就跟原理差不多意思 vv何时醒来1年前1
vv何时醒来1年前1 -
 tazqa 共回答了13个问题
tazqa 共回答了13个问题 |采纳率84.6%根据被滴定物的酸碱性选择滴定剂;根据计量点pH选择相对应的指示剂.1年前查看全部
- 一道分析化学关于酸碱滴定法的题目
一道分析化学关于酸碱滴定法的题目
用草酸作基准物质标定NaOH溶液的浓度,以酚酞为指示剂,称取纯草酸(H2C2O4•2H2O)0.1600g用去NaOH溶液20.00ml,求此NaOH溶液的浓度.0.1269)望有详细步骤 ioioppp1年前1
ioioppp1年前1 -
 870728 共回答了22个问题
870728 共回答了22个问题 |采纳率86.4%H2C2O4 + 2NaOH = Na2C2O4 + 2 H2O
1 2
0.1600/126.07 C*20.00/1000
C=0.1269mol/L1年前查看全部
- 看看下面一道化学问题,硫酸亚铁铵[(NH4)2Fe(SO4)2*6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中
看看下面一道化学问题,硫酸亚铁铵[(NH4)2Fe(SO4)2*6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中
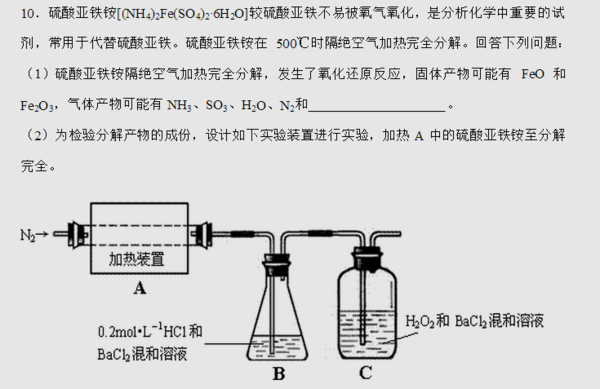
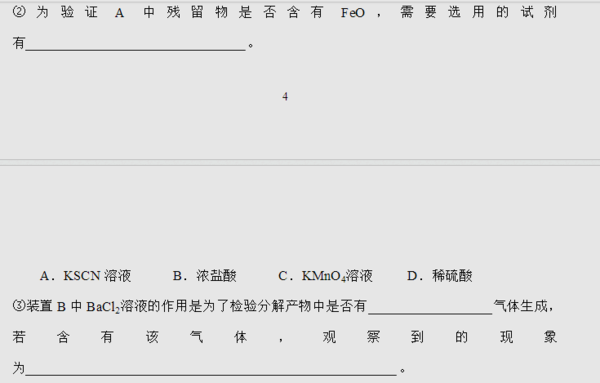
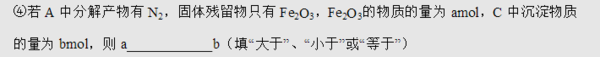
为什么2中浓盐酸不行?3中为什么不是检验产物中是否有SO2,而是检验是否有SO3?SO2溶于水不是会生成H2SO3,从产生BaSO3沉淀吗?
4中为什么会是“小于”? carolxlao1年前3
carolxlao1年前3 -
 ABZONE 共回答了18个问题
ABZONE 共回答了18个问题 |采纳率100%1.你要检验FeO首先要让它溶解,所以需要酸.而因为可能有Fe3+把Fe2+的颜色掩盖住,所以需要用KMnO4的退色来证明.浓盐酸连MnO2都可以还原的,何况是酸性KMnO4?你们老师难道没教过?
2.先不说B中有HCl,就算只有BaCl2,SO2会和它反应?如果反应,请你告诉我所有的产物.
3.因为有N2产生,说明发生了氧化还原反应,而Fe没有被还原所以是S被还原,产物是SO2.化学式告诉你原来Fe:S=1:2,现在Fe2O3=amol,即Fe=2a,所以S=4a.元素守恒,所有的S最终都生成BaSO4,所以BaSO4=4a,不就是b=4a么?a和b哪个大还不懂?1年前查看全部
- 分析化学凯氏定氮法蒸馏过程中以硼酸为吸收液,在滴定分析的过程中,可能引入的误差是多少
分析化学凯氏定氮法蒸馏过程中以硼酸为吸收液,在滴定分析的过程中,可能引入的误差是多少
若用醋酸为吸收液,可能引入的误差是多少? YK天生天养1年前1
YK天生天养1年前1 -
 小狼一匹 共回答了23个问题
小狼一匹 共回答了23个问题 |采纳率78.3%其实用硼酸或者硫酸都是可以的,至于误差有多少,要看你操作过程中是不是有其他损失,蒸馏是不是彻底;误差是一定会存在的、避免不了的,只能尽量较小误差~具体数字的话,没有计算过~1年前查看全部
- 在分析化学中,氨气或其水溶液是一种沉淀剂,用于物质的分离与提纯.向体积为1升、浓度为0.0002摩尔每升的氯化镁溶液中通
在分析化学中,氨气或其水溶液是一种沉淀剂,用于物质的分离与提纯.向体积为1升、浓度为0.0002摩尔每升的氯化镁溶液中通入氨气,当反应开始有白色沉淀出现时,通入的氨气体积为______毫升.(已知实验条件下氨气与水形成的弱电解质的电离常数为0.000018,氢氧化镁的电离常数为0.000000000018.解题时不考虑溶液体积的变化)
 道道道1231年前1
道道道1231年前1 -
 东莲之恋 共回答了18个问题
东莲之恋 共回答了18个问题 |采纳率94.4%解,有沉淀开始时OH-=0.000000000018*2/0.0002=0.00000018=氨水的浓度*0.000018
氨水浓度=0.01mol/L,氨气的量=0.01mol,标准状况下为0.01*22.4=0.224L=22.4ml1年前查看全部
- 一道分析化学考研题在氨性缓冲液中用EDTA滴定Zn2+至化学计量点时,以下关系正确的是( )(A) [Zn2+] = [
一道分析化学考研题
在氨性缓冲液中用EDTA滴定Zn2+至化学计量点时,以下关系正确的是( )
(A) [Zn2+] = [Y4-] (B) c(Zn2+) = c(Y) (C) [Zn2+]2= [ZnY]/K(ZnY) (D) [Zn2+]2= [ZnY]/K'(ZnY)
 187524631年前2
187524631年前2 -
 jioner 共回答了17个问题
jioner 共回答了17个问题 |采纳率88.2%嗯,我做过,答案是 B . 谢谢采纳1年前查看全部
- 一道分析化学的题目!急!已知酸性溶液准哦年个,高锰酸钾与二价铁反应时,1.00ml高锰酸钾溶液相当于0.1117g1Fe
一道分析化学的题目!急!
已知酸性溶液准哦年个,高锰酸钾与二价铁反应时,1.00ml高锰酸钾溶液相当于0.1117g1Fe,这句话是什么意思? cyf20081年前2
cyf20081年前2 -
 鉺釘恋ル 共回答了11个问题
鉺釘恋ル 共回答了11个问题 |采纳率90.9%指1ml高锰酸钾可以和0.1117gFe完全反应1年前查看全部
- 急问大学分析化学:用NaOH溶液滴定H3PO4溶液至pH = 4.7时,溶液的简化质子条件为 (
急问大学分析化学:用NaOH溶液滴定H3PO4溶液至pH = 4.7时,溶液的简化质子条件为 (
(H3PO4的pKa1~pKa3分别是2.12、7.20、12.36)
(A) [H3PO4] = [H2PO4-] (B) [H2PO4-] = [HPO42-]
(C) [H3PO4] = [HPO42-] (D) [H3PO4] = 2[PO43-]
选哪个?为什么? whitman07231年前1
whitman07231年前1 -
 zhangwenmao 共回答了20个问题
zhangwenmao 共回答了20个问题 |采纳率90%感觉应该选C
PH=4.7时 溶液中H3PO4主要存在形式是H2PO4-
以H2PO4-和H2O为零水准 写质子守恒式:
[H3PO4]+[H+]=[HPO42-]+[OH-]+2[PO43-]
忽略[H+]和[OH-]和[PO43-](该PH下此形式几乎不存在)的话
答案就是C了1年前查看全部
- 谁能帮誐把这些分析化学的题都干了,求救阿,
谁能帮誐把这些分析化学的题都干了,求救阿,
1、酸碱指示剂的选择原则是什么?2、用基准Na2C2O4标定KMnO4滴定液时,为什么要加热?是否温度越高越好?为什么?3、间接碘量法中,滴至终点的溶液放置5分钟后变蓝的原因是什么?对测定结果有无影响?4、滴定管,移液管在装入溶液前为何要用少量待装溶液淌洗2-3次?用于滴定的锥瓶是否需要干燥?是否需要用少量待装溶液淌洗?为什么?5、使用铬黑T指示剂指示终点时,为什么要控制溶液的pH=10?6、间接碘量法中,为什么不能过早加入淀粉溶液?7、KMnO4溶液能否装在碱式滴定管中?为什么?8、测定水硬度时,何种情况下需加三乙醇胺溶液和Na2S溶液,起何作用?为什么? 没力打字了1年前1
没力打字了1年前1 -
 逸伦 共回答了19个问题
逸伦 共回答了19个问题 |采纳率94.7%1.强酸弱碱:甲基橙强碱弱酸:酚酞强酸强碱:酚酞或甲基橙皆可2.KMnO4滴定 时,升温以加快滴定反应速率 ,但温度不能超过85℃,否则草酸易分解3.在弱酸性溶液中,Cu2 可被KI还原为CuI,2Cu2 4I- == 2CuI I2这是一个可逆反应,由于CuI溶解度比较小,在有过量的KI存在时,反应定量地向右进行,析出的I2用Na2S2O3标准溶液滴定以淀粉为指示剂,间接测得铜的含量.
I2 2S2O32- == 2I- S4O62-
由于CuI沉淀表面会吸附一些I2使滴定终点不明显,并影响准确度故在接近化学计量点时,加入少量KSCN,使CuI沉淀转变成CuSCN,因CuSCN的溶解度比CuI小得多(Ksp,CuI = 1.1×10-10,Ksp,CuSCN = 1.1×10-14)能使被吸附的I2从沉淀表面置换出来,
CuI SCN- == CuSCN I-
使终点明显,提高测定结果的准确度.且此反应产生的I-离子可继续与Cu2 作用,节省了价格较贵的KI.4.要用少量要移取的溶液润洗2-3次,以保证所移溶液的浓度不变.不需要,是5.(1)MIn与In的颜色应有明显区别
金属指示剂多为有机弱酸,颜色还随pH而变化,因此需要控制适当pH范围
例:铬黑T
HIn HIn In
紫红 蓝 橙
为使终点颜色变化明显,铬黑T使用的酸度范围应在pH6.11.6之间.
(2)/>10
根据指示剂作用原理,欲使终点的竞争反应能够发生,必须>,EDTA才能取MIn中的M,使In游离而变色,定量的要求就是/>10.
(3)指示剂与金属离子反应迅速可逆.(1)MIn与In的颜色应有明显区别
金属指示剂多为有机弱酸,颜色还随pH而变化,因此需要控制适当pH范围
例:铬黑T
HIn HIn In
紫红 蓝 橙
为使终点颜色变化明显,铬黑T使用的酸度范围应在pH6.11.6之间.
(2)/>10
根据指示剂作用原理,欲使终点的竞争反应能够发生,必须>,EDTA才能取MIn中的M,使In游离而变色,定量的要求就是/>10.
(3)指示剂与金属离子反应迅速可逆.6.加淀粉不能太早,因滴定反应中产
生大量CuI沉淀,若淀粉与I2 过早形
成兰色络物,大量I3-被CuI沉淀吸附
终点呈较深的灰色,不好观察 7.不能,因为高锰酸钾一般要在酸性条件下与其他物质反应8.1年前查看全部
- 一道分析化学题计算滴定PH突越范围求解
一道分析化学题计算滴定PH突越范围求解
用0.1mol/L NaoH滴定0.1mol/L HAc(PKa=4.7)时的PH突越范围为7.9.7,由此可以推断用 0.1mol/LNaoH滴定PKa为 3.7的0.1mol/L某一元酸HR的PH突越范围
或者解题思路能不能讲下?9.7 ii的朵朵1年前5
ii的朵朵1年前5 -
 vika 共回答了15个问题
vika 共回答了15个问题 |采纳率100%“用0.1mol/L NaoH滴定0.1mol/L HAc(PKa=4.7【Ka=2×10的-5次方】)时的PH突越范围为7.7--9.7”是这样计算的:【体积按照20.00mL计算】化学计量点(旧称等当点)时,恰好反应生成NaAc,浓度为0.05mol/L,氢氧根离子浓度=二次根号下(0.05Kw/Ka )=5×10的-6次方 mol/L,pOH=5.3 ,pH=8.7 ,当滴入量在化学计量点前的0.1%时,体系是HAc和Ac-形成的缓冲溶液,此时HAc浓度=5×10的-5次方mol/L,Ac-浓度=5×10的-2次方mol/L,pH=pKa+lg(Ac-浓度/HAc浓度)=7.7,当滴入量在化学计量点后的0.1%时,体系是NaOH和NaAc的混合溶液,pH主要由氢氧化钠决定,此时氢氧根离子浓度=5×10的-5次方mol/L,pOH=4.3,pH=9.7,所以突跃范围为7.7--9.7.
仿上:PKa为 3.7,Ka=2×10的-4次方,化学计量点时,氢氧根离子浓度=二次根号下(0.05Kw/Ka )=5×10的-7方 mol/L,pOH=6.3 ,pH=7.7 ,当滴入量在化学计量点前的0.1%时,pH=pKa+lg(R-浓度/HR浓度)=6.7,当滴入量在化学计量点后的0.1%时,体系是NaOH和NaR的混合溶液,pH主要由氢氧化钠决定,此时氢氧根离子浓度=5×10的-5次方mol/L,pOH=4.3,pH=9.7,所以突跃范围为6.7--9.7 .1年前查看全部
- 大学分析化学rf值分别为0.37和0.65的硅胶板哪个活性大?为什么?
 quesy1年前1
quesy1年前1 -
 奔跑的荔枝 共回答了15个问题
奔跑的荔枝 共回答了15个问题 |采纳率100%比移值为0.37的活性大,物质之所以可以在有吸附剂的薄层上分离,是因为其表面及孔隙的表面存在许多活性点,被吸附物质的量以及被吸附的牢度在恒定条件下取决去活性点的强度以及数目.活性点的强度及数目越大,吸附剂的活度就越高,吸附剂的保留能力就越强,被吸附物质的RF值就越小,不同物质在吸附剂上被吸附的能力不同,所以才可以彼此分离;1年前查看全部
- 大学无机及其分析化学的电势问题下列电对中标准电极电势值最大的是………………………………………………………… ( A) &
大学无机及其分析化学的电势问题
下列电对中标准电极电势值最大的是………………………………………………………… ( A) (A) (Ag+/Ag) (B)(Ag(NH3)/Ag) (C)(Ag(CN)/Ag) (D)(AgI/Ag) 小鸟八哥1年前2
小鸟八哥1年前2 -
 淡藍的星星 共回答了19个问题
淡藍的星星 共回答了19个问题 |采纳率84.2%答案是A.
原因是,B、C、D中的+1价银以配合物或沉淀的形式存在,这降低了银离子的浓度,使得这些电对的电极电势与Ag+/Ag相比要低.1年前查看全部
- 请教学分析化学的人士:anal bioanal chem 是哪国杂志?还有这些词是英语缩写么?还是别的语种?
 jztyw20061年前1
jztyw20061年前1 -
 无限风光在双峰 共回答了18个问题
无限风光在双峰 共回答了18个问题 |采纳率83.3%是缩写 ANALYTICAL AND BIOANALYTICAL CHEMISTRY
Analytical and Bioanalytical Chemistry (formerly Fresenius' Journal of Analytical Chemistry) 《分析化学和生物分析化学》德国
ISSN:1618-2642,1862年创刊,全年24期,Springer-Verlag出版社,SCI收录期刊.历史悠久的专业性学术期刊,刊载分析化学方面的研究论文、文摘、简讯、书评以及会议与展览消息等.每年文摘量约6000条.1年前查看全部
- 分析化学习题称取铁矿试样0.5000g,将其溶解,使全部铁还原为亚铁离子,用0.01500mol/L重铬酸钾标准溶液滴定
分析化学习题
称取铁矿试样0.5000g,将其溶解,使全部铁还原为亚铁离子,用0.01500mol/L重铬酸钾标准溶液滴定至化学计量点时,用去重铬酸钾标准溶液33.45mL,求试样中铁和三氧化二铁的质量分数.
求详细过程,谢谢!
 vivizhao821年前1
vivizhao821年前1 -
 秦紫箫 共回答了16个问题
秦紫箫 共回答了16个问题 |采纳率93.8%写出反应方程式,根据方程式计算就行了.
利用氧化还原反应的得失电子守恒,有Fe2+和Cr2O72-关系是:
6Fe2+ ----1 Cr2O72-
6 1
---- = -----
x 0.01500X33.45/1000
解出x,就得出了原样品中铁元素的物质的量.1年前查看全部
- 求高人指点分析化学酸碱滴定法习题
求高人指点分析化学酸碱滴定法习题
用NaOH液(0.20mol/L)滴定一氯乙酸(0.20mol/L)至甲基橙变黄(pH4.4)时,还有百分之几的一氯乙酸未被滴定? 我不想伤害任何人1年前1
我不想伤害任何人1年前1 -
 寂静如风 共回答了11个问题
寂静如风 共回答了11个问题 |采纳率72.7%pH = pKa + log(氯乙酸根摩尔/氯乙酸摩尔)
4.4 = 2.87 + log(氯乙酸根摩尔/氯乙酸摩尔)
氯乙酸根摩尔/氯乙酸摩尔= 33.88 = (0.20 - X)/X
X=0.0057 摩尔
0.0057/0.2=0.0287 =2.87%1年前查看全部
- 分析化学复习题 谁给做做,做得好追加分啊 试样溶解方法:如测定矿石中的P, 用____溶解; 用络合滴定法测定铜矿石中的
分析化学复习题 谁给做做,做得好追加分啊 试样溶解方法:如测定矿石中的P, 用____溶解; 用络合滴定法测定铜矿石中的锌, 用____溶解试样.
4. 滴定度:如0.01522mol•L-1的K2Cr2O7对 Fe2O3 的滴定度为 _________ g•mL-1;0.0100mol•L-1的HCI对 CaO的滴定度为 _________ g•mL-1
5. 在定量分析中,精密度与准确度之间的关系是——
6. 提高分析结果准确度的方法:减小随机误差-增加平行测定次数;减小系统误差-进行仪器校正,做对照试验,做空白试验
如(1):用某种方法测定组分A的质量分数,共测定9次,得A的平均值 =60.68%,标准偏差s=0.042%.已知=60.66%, t0.05,8=2.31 , 则 与之间________显著性差异(指有或无).
(2):用邻苯二甲酸氢钾标定NaOH溶液的浓度时,会造成系统误差的是——( )
(A) 用酚酞作指示剂 (B) NaOH溶液吸收了空气中的CO2
(C) 每份邻苯二甲酸氢钾质量不同 (D) 每份加入的指示剂量不同
(3).测定某合金中铁的质量分数,结果为(%):0.1034, 0.1031, 0.1036, 0.1046,0.1035.(1)试问用格鲁布斯法检验0.1046这个值是否应舍掉(显著水平0.05)?(2)计算95%置信度时平均值的置信区间.
n45f34
T0.051.461.67t0.053.182.78
7.欲取100 mL试液作滴定(相对误差≤ 0.1%),选用的仪器是——(移液管还是量筒?容量瓶?)
8. 用KMnO4标准溶液测定H2C2O4.2H2O试剂的纯度,有时会出现含量超过100%的情况,其原因是_________
9.用重量法测定莫尔盐(NH4)2SO4•FeSO4•6H2O的纯度,若天平称量误差为0.2mg,为了使灼烧后Fe2O3的称量误差不大于0.1%,应最少称取样品多少克?
10. 用邻苯二甲酸氢钾为基准物标定0.1 mol/L NaOH溶液,每份基准物的称取量宜为_________
11. 某铁矿试样含铁约50%左右,现以0.01667mol/L K2Cr2O7溶液滴定,欲使滴定时标准溶液消耗的体积在20 mL至30 mL,应称取试样的质量范围是[Ar(Fe)=55.847]——克
12.当一溶液可用多种标准物质及指示剂进行标定时,原则上应使标定的实验条件与______________相同或相近,以消除可能产生的_________误差.
配制缓冲溶液时, pH应与pKa接近.如pH=5,可选HAC-NaAC,或六次甲基四胺(pKb = 8.85)-HCI
下列盐的水溶液缓冲作用最强的是-----------------------------------------------------( )
(A) Na2B4O7•10H2O (B) Na2CO3 (C) NaAc (D) Na2HPO4
13. 已知 HF的pKa=3.2, Fe3+-F- 络合物的lg1~lg3分别为5.3,9.3, 12.1.现将2×10-2mol/L 的NaF溶液与2×10-4mol/L Fe3+的强酸性溶液等体积混合后,溶液的pH=1.0.此时铁络合物的主要存在形式是——
14. 现有50mL 0.1000mol/L的某二元酸H2X,用0.1000mol/L NaOH 滴定.在加入25mL NaOH时,pH = 4.80;加入50mL NaOH时pH = 7.15,达第一化学计量点,则Ka2值为——
15. 已知pKa(HAc) = 4.74, pKa(NH4+) = 9.26, (a) 0.10 mol/L HCl-0.20 mol/L NaAc溶液 (b) 0.20 mol/L HAc-0.10 mol/L NaOH溶液 (c) 0.10 mol/L HAc-0.10 mol/L NH4Ac溶液. 则以上三种溶液pH的大小关系是——
16. 磷以MgNH4PO4•6H2O形式沉淀,经过滤、洗涤后用适量HCl标准溶液溶解,再以——为指示剂,用 NaOH标准溶液返滴定,这时磷与HCl的物质的量比n(P):n(HCl)为——
17. 用0.2 mol/L NaOH滴定等浓度的 HCl和0.2 mol/L柠檬酸(H3A)的混合液(H3A的Ka1 = 7.4×10-4, Ka2 = 1.7×10-5, Ka3 = 4.0×10-7), 如果允许滴定误差为0.2%,则终点时溶液组成应为——
18. pH突跃范围:如(1)用0.1 mol/L HCl滴定0.1 mol/L NH3水(pKb = 4.7)的pH突跃范围为6.3~4.3, 若 骑着驴子进了城1年前1
骑着驴子进了城1年前1 -
 htmlzz 共回答了13个问题
htmlzz 共回答了13个问题 |采纳率92.3%硝酸;盐酸.1年前查看全部
- 求解答!分析化学复习题!46、直接碘量法中加入淀粉指示剂的适宜时间是( )A.滴定开始时 B.滴定至近终点时 C.滴定至
求解答!分析化学复习题!
46、直接碘量法中加入淀粉指示剂的适宜时间是( )
A.滴定开始时 B.滴定至近终点时 C.滴定至溶液呈蓝色时 D.在标准溶液滴定了50%后
47、间接碘量法中加入淀粉指示剂的适宜时间是( )
A.滴定开始时 B.滴定至近终点时 C.滴定至溶液呈无色时 D.在标准溶液滴定了50%后
48、高锰酸钾法确定滴定终点时依靠( )
A.酸碱指示剂 B.吸附指示剂 C.金属指示剂 D.自身指示剂
49、高锰酸钾法滴定应在下列( )溶液中进行
A.强酸性 B. 弱酸性 C.中性 D.弱碱性
50、标定碘标准溶液常用的基准物质是( )
A.As2O3 B.KMnO4 C.Na2S2O3 D.K2Cr2O7
51、标定0.02mol/LKMnO4溶液反应由慢而快是由于( )
A.反应物浓度不断增加 B.反应温度降低 C.反应中有Mn2+生成 D.反应中有[H+]增加
52、测定维生素C含量所用的适宜方法是( )
A.高锰酸钾法 B. 直接碘量法 C. 亚硝酸钠法 D.重铬酸钾法
53、用配位滴定法测定金属离子含量时,滴定终点的颜色是( )的颜色.
A.EDTA B.In C.M-In D.M-EDTA E.M
54、在直接碘量法中,以淀粉为指示剂,其终点颜色变化是( )
A.蓝色至无色 B.无色至蓝色 C.红色至无色 D.无色至红色
55、 在间接碘量法中,以淀粉为指示剂,其终点颜色变化是( )
A.蓝色至无色 B. 无色至红色 C.红色至无色 D. 无色至蓝色
56、高锰酸钾法滴定中,其终点颜色变化是( )
A.蓝色至无色 B. 无色至红色 C.红色至无色 D. 无色至蓝色
57、可见光的波长的范围是( )
A.100~200nm B.200~400nm C.400~760nm D.760~1000nm
58、单色光是指( )
A.同种颜色的光 B.颜色单纯的光 C.单一波长的光 D.波长很短的光
59、光谱曲线上最大吸收峰所对应的波长称为( )
A.最小吸收波长 B.最大吸收波长 C.中等吸收波长 D.综合吸收波长
60、标准曲线法中的标准曲线是指( )
A.A—λ曲线 B. A—c曲线 C. pH—V曲线 D. E—V曲线
61、分光光度法中常用的空白溶液为( )
A.样品溶液 B.标准溶液 C.蒸馏水 D.显色剂
62、朗伯—比尔定律的数学表达式是( )
A.A=cL B.A=KcL C.A=KL D.A=cd
63、右图是高锰酸钾溶液的吸收光谱曲线,对高锰酸钾溶液进行
定量分析时,应选用哪个作为吸收波长( )
A.500nm B.525nm C.600nm D.700nm
64. 根据色谱过程的机制不同,纸色谱属于下列哪一类色谱( )
A.吸附色谱 B.分配色谱 C.离子交换色谱 D.凝胶色谱 E.液—固色谱
65. 碱性氧化铝为吸附剂时,适用于分离( )
A. 任何物质 B.酸性物质 C. 酸性或中性化合物 D.酸性或碱性化合物 E.碱性或中性化合物
66.已知三种氨基酸a、b、c,其中Rf值分别0.17、0.26、0.50,斑点在色谱纸上距原点由近到远的顺序是( )
A.a、b、c B.c、b、a C.a、c、b D.c、a、b E.b、c、a、
67.吸附柱色谱和分配柱色谱的根本区别是( )
A.所用的洗脱剂不同 B.溶剂不同 C.被分离的物质不同 D.色谱原理不同 E.操作方法大不相同
68、在薄层色谱法中,薄层分离中的各斑点的Rf值要求在( )范围内.
A.0.2~0.7 B. 0.3~0.7 C. 0.2~0.8 D.0.3~0.8 E.0.3~0.9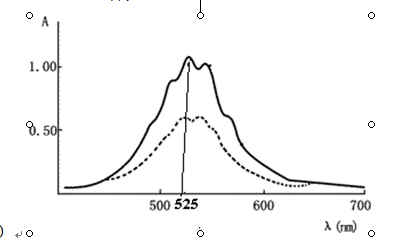
此为63题图
 LUOJIFENG051年前1
LUOJIFENG051年前1 -
 一毛五 共回答了23个问题
一毛五 共回答了23个问题 |采纳率95.7%46A 47B 48D 49A 50A 51C 52B 53B 54B 55A 56B 57C 58C 59B 60B 62B 63没看见图
64A 65E 66A 67D 681年前查看全部
- 怎样复习有机化学,分析化学,生物化学?
 g9kq1年前1
g9kq1年前1 -
 桨声灯影里的鱼 共回答了20个问题
桨声灯影里的鱼 共回答了20个问题 |采纳率70%先看课本,对照大纲,把书上的知识点掌握熟练,然后做做复习题,最后做真题,你会发现很简单的!祝你考试顺利!1年前查看全部
- 一道分析化学的题目0.4mol/l的NH3`H2O 50ml与0.2mol/L HCL 50ml混合,求溶液的PH? 求
一道分析化学的题目
0.4mol/l的NH3`H2O 50ml与0.2mol/L HCL 50ml混合,求溶液的PH? 求详细点的答案 天高地同样1年前1
天高地同样1年前1 -
 spray 共回答了19个问题
spray 共回答了19个问题 |采纳率89.5%pH=pKa(NH4+)1年前查看全部
- 一道分析化学题下列物质必须用间接法配制成标准溶液的是 .①HCl,②NaOH,③H2C2O4•2H2O,④KMnO4,⑤
一道分析化学题
下列物质必须用间接法配制成标准溶液的是 .
①HCl,②NaOH,③H2C2O4•2H2O,④KMnO4,⑤K2Cr2O7,⑥NaCl,⑦EDTA,⑧AgNO3 梦逸飞天1年前2
梦逸飞天1年前2 -
 dd大平 共回答了18个问题
dd大平 共回答了18个问题 |采纳率77.8%⑥NaCl1年前查看全部
- 分析化学中怎么计算ph值的有效数字 例如ph=3.46 ph=9.66 ph=8.22
 奉劝大家1年前1
奉劝大家1年前1 -
 永远对我称赞 共回答了21个问题
永远对我称赞 共回答了21个问题 |采纳率81%PH值的有效数字位数,取决于小数部分的数字位数,整数部分只说明该数是10的多少次方,只起定位作用.比如,3.46,9.66和8.22,都是两位有效数字.对数或反对数计算时,所取对数的小数点后的位数(不包括首数)应与真数的有效数字位数相同.
如:1、求【H+】为7.98*10-2次方的溶液的ph值,pH=-lg【H+】=1.098.
2、求pH=3.2溶液的【H+】.则【H+】=6.3*10-4mol/L1年前查看全部
- 如何用分析化学的方法测定氢氧化钠和碳酸钠混合液的总碱度
 柳暗花明19991年前1
柳暗花明19991年前1 -
 终极兵器 共回答了16个问题
终极兵器 共回答了16个问题 |采纳率93.8%以甲基橙为指示剂,以盐酸或硫酸的标准溶液滴定,直到pH值4.5的化学计量点a点,溶液由黄色变为橙红色,停止滴定所得的结果称为总碱度,又称甲基橙碱度.
详见《水和废水监测分析方法》(第四版).1年前查看全部
- 在分析化学中,为什么要进行分离富集
 yanghuifen1年前1
yanghuifen1年前1 -
 lulovebaobao 共回答了21个问题
lulovebaobao 共回答了21个问题 |采纳率90.5%因为好多情况下,所要得到的东西含量过少,需要从大量杂质中分离出来,然后再收集起来1年前查看全部
- 跪求分析化学,物理化学,化工原理,生物化学类2000字读后感,十分感谢!
 老虎与小猫1年前1
老虎与小猫1年前1 -
 wappp77 共回答了17个问题
wappp77 共回答了17个问题 |采纳率94.1%think about what you had for breakfast today. the packaging on any processed food you ate, including cereal, milk,bread and yogurt, has a label that provides you with nutrition information so you can make healthy diet choice. this imformation comes from chemical analysis.
suppose you ate a boiled egg and a banana instead of the cereal and milk. there is no label with nutrition information there, but analytical chemists have rested a sample of eggs and bananas for residues of harmful chemicals so you can be confident that your breakfast is safe to eat.
your toothpaste, too, will have a label that says something like 'active ingredient 0.7% w/w sodium monofluorophosphate'. an analytical chemist would have checked that this amount of active ingredient was correct.
analytical chemists are employed in a range of industries, from food manufacturing to environmental monitoring and foerensic sciences and many more. they use a range of techniques and technologies to determine the identity, quality, and quantity of the chemicals that make up our world.
the composition of consumer goods is of great importance. for example, residues such as dieldrin and DDT have been detected in meat. nutrionists urge us to eat fish on a regular basis to take advantage of the beneficial fatty scids that many fish contain. but fish can also contain heavy metals, such as mercury. goernments have placed restrictions on the amount of pesticides and heavy metals allowed in foods. for example, the acceptable daily intake of DDT is 0.002 milligram per kilogram of body weight per day(0.002mg/kg/day) while that of dieldrin is 0.0001mg/kg/day1年前查看全部
- 分析化学课后习题及答案酸碱滴定法计算0.1摩尔每升醋酸钠水溶液的PH值
 曹hh宝1年前2
曹hh宝1年前2 -
 liujun_0407 共回答了16个问题
liujun_0407 共回答了16个问题 |采纳率100%HAc Ac- + H+
因为Ka=1.8X10-5
Ka=[H+][Ac-]/(0.1-[H+])=[H+]^2/(0.1-[H+])=1.8x10^-5
[H+]=0.00133 mol/L
pH=2.881年前查看全部
- 如何鉴别铝离子和锌离子在两种离子物质的量未知的情况下用分析化学的只是可不可以解释?请问使用硫化钠能不能鉴别那两位,锌离子
如何鉴别铝离子和锌离子
在两种离子物质的量未知的情况下
用分析化学的只是可不可以解释?
请问使用硫化钠能不能鉴别
那两位,锌离子和铝离子再过量的强碱下都会溶解 1178142861年前1
1178142861年前1 -
 拉祜族鸡 共回答了21个问题
拉祜族鸡 共回答了21个问题 |采纳率90.5%可以从下列反应中区别:Al(3+)(上标,下同)+3OH(-)===Al(OH)3(3为下标,下同)
Al(3+)+3NH3*H2O====Al(OH)3+3NH4(+)
Zn(2+)+4NH3*H2O===(2+)
锌离子溶液中加浓氨水起初有白色沉淀,若继续加氨水白色沉淀消失,变成溶液.
铝离子溶液中加氨水起初有白色沉淀,继续加氨水,白色沉淀不溶解.
这是最好的监别方法!1年前查看全部
- 大学分析化学,哪个电池可以测水的离子积常数
大学分析化学,哪个电池可以测水的离子积常数
(-)pt,H2/HCL//NAOH/H2,pt(+)
为什么啊,这是个什么电池啊,跟离子积常数有什么关系啊 今夜我会来1年前1
今夜我会来1年前1 -
 ken_apple 共回答了14个问题
ken_apple 共回答了14个问题 |采纳率92.9%(-)pt,H2/HCL//NAOH/O2,pt(+)
4H+ + 4OH- == O2 + 2H2O
E = E0 + 0.059/4LOG(1/[H+][OH-])
=EO - 0.059/4LOG([H+][OH-])
[H+][OH-] = Kow1年前查看全部
- 分析化学中的“施放剂”名词解释
 孙颖1年前1
孙颖1年前1 -
 cmh0572 共回答了13个问题
cmh0572 共回答了13个问题 |采纳率84.6%释放剂(解蔽剂)吧
在EDTA多种金属离子滴定中,为了防止另一种金属离子的干扰,一般先加入掩蔽剂,将另一种离子掩蔽起来,等到这种离子滴定完成时,再加入解蔽剂,将掩蔽起来的金属离子释放出来,继续滴定.1年前查看全部
- 英语翻译离子液体作为一种相对常规溶剂具有诸多优点的重要溶剂,应用已经越来越广泛.它在有机反应、材料化学、分析化学等领域已
英语翻译
离子液体作为一种相对常规溶剂具有诸多优点的重要溶剂,应用已经越来越广泛.它在有机反应、材料化学、分析化学等领域已经拥有了不可取代的地位.本文用密度泛函理论(DFT) B3LYP方法,在6-31+G(d,p)基组水平下,研究了溴化二甲基鸟嘌呤离子对的几何构型和相对稳定性.分析各构形的质子化学位移跟红外振动频率,通过理论研究计算,解释化学结构对质子化学位移的影响.
关键词:离子液鸟嘌呤密度泛函理论 天地一苇1年前1
天地一苇1年前1 -
 heresy 共回答了19个问题
heresy 共回答了19个问题 |采纳率89.5%翻译成英语吗?1年前查看全部
- 化学书上有句话看不懂.下面的二段的第一句话不明白.这是分析化学书上的.希望懂的人能解释下为什么滴强酸时没误差.
 wendyxia1年前5
wendyxia1年前5 -
 云梦-sxjzyc 共回答了18个问题
云梦-sxjzyc 共回答了18个问题 |采纳率94.4%因为甲基橙的变色范围是pH4.4时变黄,3.1-~4.4时呈橙色,变色时尚呈弱酸性,而酚酞的变色范围是8.10.0,变色时已呈弱碱性1年前查看全部
- 一道分析化学关于酸碱滴定法的题目
一道分析化学关于酸碱滴定法的题目
食品中蛋白质百分含量的测定,是将按下法测得的N含量乘以因数6.25所得结果,称2.000g的蛋白质样品,用浓硫酸(以汞为催化剂)煮解,使有机氮转化为NH4HSO4,再用过量的NaOH处理,挥发出的NH3吸收于50.00ml0.3350mol/L HSO4溶液中.过量的酸需要30.10ml0.6520mol/L NaOH返滴定,计算样品中蛋白质的质量分数.60. qintianxur1年前1
qintianxur1年前1 -
 ljlynwe 共回答了24个问题
ljlynwe 共回答了24个问题 |采纳率91.7%H2SO4 + 2NaOH = Na2SO4 + 2H2O1 20.3350*V 0.6520*30.10V=29.29ml2NH3 + H2SO4 =( NH4)2SO4 + H2O2 1X (50.00-29.29)*0.3350/1000X=0.01388mol(0.01388*14*6.25/2.000)*100%=60.73%1年前查看全部
- 物理受理分析化学推理方法,数学压轴题的思路,
 我rr1年前1
我rr1年前1 -
 sdusdusdu 共回答了18个问题
sdusdusdu 共回答了18个问题 |采纳率83.3%一、关于受力分析:
(1)选取研究对象:对象可以是单个物体也可以是系统;(2)隔离:把研究对象从周围的物体中隔离出来.(3)画受力图:按照一定顺序进行受力分析.一般先整体后部分,先分析重力;然后环绕物体一周,找出跟研究对象接触的物体,并逐个分析弹力和摩擦力;最后再分析其它场力.在受力分析的过程中,要边分析边画受力图(养成画受力图的好习惯),只画性质力,不画效果力.(4)检查:受力分析完后,应仔细检查分析结果与物体所处状态是否相符.注意事项:①只分析研究对象所受的力,不分析对其它物体所施加的力.切记不要把作用在其它物体上的力错误的认为“力的传递”作用在研究对象上. ②只分析按性质命名的力,不分析按效果命名的力(下滑力、向心力、回复力).③每分析一个力,都应找出施力物体,以防多分析出某些不存在的力.④合力和分力不能同时作为物体所受的力.
二、关于化学推断:
(1)推断题的常见突破口
1.物质特征
⑴ 固体颜色:Fe、C、CuO、MnO2、Fe3O4(黑色);Cu、Fe2O3(红色);Cu2(OH)2CO3(绿色);CuSO4·5H2O(蓝色)、S(黄色).
⑵ 溶液颜色:含有Cu2+(蓝色);含有Fe2+(浅绿色);含有Fe3+(黄色).
⑶常见固体单质有Fe、Cu、C、S;气体单质有H2、N2、O2;无色气体有H2、N2、O2、CO、CO2、CH4、SO2;常温下呈液态的物质有H2O.
2.现象特征
⑴ 火焰颜色:S在O2中燃烧(蓝紫色);S、H2在空气中燃烧(淡蓝色);CO、CH4在空气中燃烧(蓝色).
⑵沉淀颜色:BaSO4、AgCl、CaCO3、BaCO3(白色);Cu(OH)2(蓝色);Fe(OH)3(红褐色).
⑶ 能使燃烧着的木条正常燃烧的气体是空气,燃烧得更旺的气体是O2,熄灭的气体是CO2或N2;能使带火星的木条复燃的气体是O2.
⑷ 能使白色无水CuSO4粉末变蓝的气体是水蒸气.
3.反应特征
⑴ 能使澄清石灰水变浑浊的无色无味气体是CO2.
⑵ 能使黑色CuO变红(或红色Fe2O3变黑)的气体是H2或CO,固体是C.
⑶ 在O2中燃烧火星四射的物质是Fe.
⑷ 在空气中燃烧生成CO2和H2O的物质是有机物,如CH4、C2H5OH等.
⑸ 能溶于盐酸或稀HNO3的白色沉淀有CaCO3、BaCO3;不溶于稀HNO3的白色沉淀有AgCl、BaSO4.
(2)推断题解题的常用方法
1.一点击破,顺藤摸瓜
有些推断题,涉及曲折迂回的转化历程,同学们总觉得无从下手,只要抓住题目的明显条件(即“突破口”)得出直接结论.常用顺推的方法,沿正向思路分析推理,顺藤摸瓜逐步得出结论.
2.逆向思维,反向推断
有些推断题,利用题给条件(即“果”)探求未知(即“因”).同学们可以运用物质相互反应规律由因究果的思维方法进行逆向推理,得出结论.
3.提出假设 逐一论证
有些推断题,可以根据题给条件,提出假设,然后归纳推敲筛选,得出合理的假设范围,最后验证得出的结论.
4.发散思维各个击破
有些推断题,可以根据各部分的已知条件,分别得出相应的结论,各个击破,然后综合推断,得出相应结论.
5.多练
适当找一些典型的化学推断题进行练习,可以帮助增强自身的理解能力,更好的拓展开思维.
三、关于数学压轴题
压轴题一般都是综合性强的题,一般都有三小题,第一小题最容易(这是必拿的分数),后一题需要前一题的答案解答,这是思维的问题,你没有想到就会觉得很难,这不表示你不会,当然有时其实也没必要会,只有在基础知识非常扎实的情况下才可能拿下压轴题.所以不如把精力放在中档题上,事半功倍.1年前查看全部
- 白云石元素含量的测定用分析化学方法来做,究竟用什么方案啊如题
白云石元素含量的测定用分析化学方法来做,究竟用什么方案啊如题
白云石中的钙镁铁铝都怎末滴定啊?如何计算啊 樱粟1年前1
樱粟1年前1 -
 剑舞清影 共回答了21个问题
剑舞清影 共回答了21个问题 |采纳率81%一、实验目的 1.学习酸溶法的溶样方法.2.掌握配位滴定法测定石灰石中钙、镁含量的方法和原理.3.学习采用掩蔽剂消除共存离子的干扰.二、实验原理 石灰石、白云石的主要成分是caco3 和mgco3 以及少量fe、al、si等杂质,采用掩蔽剂即可消除共存离子的干扰,故通常不需分离直接滴定.试样用hcl溶解后,钙镁等以ca2+、mg2+离子进入溶液,试样中含有少量铁铝等干扰杂质,滴定前在酸性条件下加入三乙醇胺掩蔽.调节试液ph=10,用铬黑t作指示剂,用edta标准溶液滴定试液中ca、mg总量;于另一份试液中,调节ph≥12,mg2+生成mg(oh)2 沉淀,用钙指示剂作指示剂,用edta标准溶液单独滴定ca2+.三、仪器、药品 edta标准溶液、1:1hcl溶液、nh3—nh4cl缓冲溶液、10%naoh 1:1 三乙醇胺、钙指示剂、铬黑t指示剂;fa/ja1004型电子天平.四、实验步骤 1、试液的制备:准确称取0.35~0.45g 试样于烧杯中,加水数滴润湿,盖以表面皿,从烧杯嘴慢慢加入1:1hcl 5ml,加热使之溶解.反应停止后用1:1hcl检验试样溶解是否完全.将试样全溶后,冷却、定量转移入250ml容量瓶中,用纯水稀至刻度后摇匀.2、钙含量的测定:用移液管吸取试液25.00ml于锥形瓶中,加1:1 三乙醇胺3ml,加水25ml,加10%naoh 4ml调节试液ph≥12,加米粒大小(0.01g)钙指示剂.摇匀后用edta标准溶液滴定,溶液由红色变为纯蓝色即为终点.平行测定三次.3、钙、镁总量测定:另外吸取25.00ml试样溶液于锥形瓶中,加1:1 三乙醇胺5ml,水25ml稀释,摇匀后加入nh3—nh4cl缓冲溶液5ml调节试液ph为10,加入米粒大小(0.01g)的铬黑t,用edta 标准溶液滴定,溶液由紫红色转变为纯蓝色即为终点.平行测定三次.1年前查看全部
- 有没有沉淀法定量检验硝酸根离子的方法?求分析化学的人才
 r1ain1年前1
r1ain1年前1 -
 阳光果冻CY 共回答了20个问题
阳光果冻CY 共回答了20个问题 |采纳率85%楼主叙述有误吧?
在分析化学中利用沉淀做定量分析的方法有“沉淀容量法”和“重量法”两种.
从未听说过有“沉淀法”.
我们再来看,“沉淀容量法”又叫“沉淀滴定法”,是基于反应生成物中产生沉淀的容量分析法;“重量法”是待测组分定量参与产生沉淀生成物的方法.两者都有沉淀生成.
而硝酸盐都是溶解于水的,一般不产生沉淀.测定硝酸根最不可能的是“重量法”,根据硝酸盐的特点,即使产生了沉淀,它也是不太稳定的,不符合重量分析法对沉淀的要求.
所以,硝酸根离子不能使用“沉淀容量法”和“重量法”分析.1年前查看全部
- 问一道分析化学题,配合物的稳定常数与条件稳定常数有什么不同?为什么要引用条件稳定常数
 morning31年前1
morning31年前1 -
 石頭de君君 共回答了20个问题
石頭de君君 共回答了20个问题 |采纳率85%条件稳定常数,它是将副反应的影响考虑进去后的实际稳定常数.1年前查看全部
- 一道分析化学的判断题EDTA滴定某金属离子有一允许的最高酸度(PH值),溶液的PH再增大就不能准确滴定该金属离子了.讲讲
一道分析化学的判断题
EDTA滴定某金属离子有一允许的最高酸度(PH值),溶液的PH再增大就不能准确滴定该金属离子了.讲讲原因 aszz321年前1
aszz321年前1 -
 JMGB 共回答了12个问题
JMGB 共回答了12个问题 |采纳率100%PH太大金属离子水解,太小EDTA酸效应.具体的话自己翻一下分析化学的书把1年前查看全部
- 关于分析化学的一些问题6、间接碘量法应用过程中必须注意哪三个反应条件?7、简述受到不同形式沾污的沉淀应分别采取哪些措施进
关于分析化学的一些问题
6、间接碘量法应用过程中必须注意哪三个反应条件?
7、简述受到不同形式沾污的沉淀应分别采取哪些措施进行纯净?
8、试推导分析浓度为C,解离常数为Ka1、Ka2的二元弱酸H2A溶液中型体A2-的分布系数表达式δA2-(要有推导过程).
9、比较高锰钾法和重铬酸钾法各自的优缺点.
10、为什么莫尔法的酸度范围应控制在pH=6.10.
11、简述法扬司法中吸附指示剂HFI的变色原理.
只要有答案正确,就可以加满200分 liliang_xiaolei1年前2
liliang_xiaolei1年前2 -
 营销赢霄 共回答了13个问题
营销赢霄 共回答了13个问题 |采纳率92.3%6.向标定Na2S2O3溶液浓度;操作迅速防止I-和Na2S2O3被O2氧化;保证中性和弱酸性条件
7.共沉淀:采用分布沉淀方法
后沉淀:使用掩蔽剂
这两种玷污都可以用二次沉淀处理
8.δA2-=Ka1*Ka2/([H+]^2+Ka1[H+]+Ka1*Ka2)
推导:δA2-=[H2A]/c=[H2A]/([H2A]+[HA-]+[A2-]),同时除以[H2A]代入Ka1 Ka2就可以得到
9.KMnO4 氧化能力强,反应物很多,但是干扰比较严重.KMnO4杂质多,标准溶液不稳定
K2cr2O7 氧化性较强,反应物较少,但容易提纯,而且溶液稳定,但是有毒
10.指示剂CrO42-在这个pH,比较稳定.如果太酸CrO42- 转化为Cr2O7 2-,Ag2Cr2O7可溶于水.如果过碱,Ag+生成AgOH(很不稳定),最后生成Ag2O
11.胶体沉淀AgCl带有Ag+
AgCl·Ag+ +FI-==AgCl·(Ag+FI-)(一个化合物)
黄绿色 淡红色1年前查看全部
- 关于分析化学中重量分析法和常量组合分析法的区别!
关于分析化学中重量分析法和常量组合分析法的区别!
重量分析法说是用于待测组分的质量分数在1%以上的,而常量组合分析法说是根据试样中被分析的组分在试样中的相对含量大于1%,这不是一样的么?还是我看不出两种分析法有什么不同? a830772281年前1
a830772281年前1 -
 hy962464 共回答了19个问题
hy962464 共回答了19个问题 |采纳率89.5%不是专业 仅供参考
我感觉重量分析法是以质量为计算标准的 而常量组分分析法可以以很多方法计算比如分子量 体积 等等
还是找个专业老师请教一下吧1年前查看全部
- 分析化学中的有效数字计算题如果是混合运算像 A*B+C-D 这种乘除法和加减法的结果是不是要先分开修约再计算是不是每运算
分析化学中的有效数字计算题
如果是混合运算像 A*B+C-D 这种乘除法和加减法的结果是不是要先分开修约再计算是不是每运算一步都要修约一次结果,还是算完后再修约
 空气中不能呼吸1年前2
空气中不能呼吸1年前2 -
 江南伍次熊 共回答了24个问题
江南伍次熊 共回答了24个问题 |采纳率83.3%乘除按有效数字位数最少的数据为依据,加减以小数点后位数最少的为依据,都是先修约后计算1年前查看全部
大家在问
- 1请问wood veneer和wood finish有什么区别?
- 2麻烦请解释一下为什么不选其他的 1.The general manager would like to see the
- 3中国男孩,翻译成英文是什么?
- 4化简;根号下[1+sina/1-sina]- 根号下[ 1-sina/1+sina ] a为第二象限角
- 5在Word中,目前在打印预览状态下若要编辑文档 A. 必须先退出预览状态后才可以编辑 B. 只能在打印与预览状
- 6读《爱的教育》和《鲁滨逊漂流记》的读后感
- 7怎样快速提高英语阅读和完形填空拜托各位了 3Q
- 8一公倾等于多少平方千米
- 9下列生活实例中,属于减小摩擦的是( )
- 10有理数运算.求下列各数的值:-(|-3|×|4/3|) 怎么算.
- 11(2011•唐山二模)配电变压器指配电系统中变换交流电压和电流的一种电器,如图为某理想变压器示意图,原副线圈匝数比为25
- 12越南语 the ban có biet nói tieng viet nam ko 求翻译
- 13文具店,小明家和书店依次坐落在一条东西走向的大街上.已知文具店位于小明家西边200米处,书店位于小明家东边100米处.一
- 14六、解答题(每小题6分,共12分) 29、树的高度与树生长的年数有关,测得某棵树的有关数据如下表(树苗原
- 15二次函数y=ax^2十bx十c的图象向左平移3个单位,在向下平移3个单位,得到二次函数y=(x-
