叶脉书签的制作思考
 穆雪风2022-10-04 11:39:541条回答
穆雪风2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 swb688 共回答了21个问题
swb688 共回答了21个问题 |采纳率90.5%- 在强沸溶液中,如果加了沸石或用筷子搅动可以防止爆沸导致液体飞溅
避免用手直接接触,不小心溅上,应先用大量清水冲洗,在上医院.
秋季落叶是为了降低植物的新陈代谢,相当于动物的冬眠.如果又叶片会加强蒸腾作用,不利于保水,也会加速有机物质的消耗.所以在这个时候,叶片反而是种负累,丢了更好.而移植工作也主要选在秋末进行也是这个道理,植物在休眠的时候,代谢率最低,移植对它的伤害也就最小. 不会永不脱 常绿植物的叶片往往比落叶植物的叶片厚一点,而且表面通常是具有蜡质的保护膜落 - 1年前
相关推荐
- 华雪同学想制取“叶脉书签”,需要50g溶质质量分数为10%的氢氧化钠溶液,她若用25%的氢氧化钠溶液配制,则需要25%的
华雪同学想制取“叶脉书签”,需要50g溶质质量分数为10%的氢氧化钠溶液,她若用25%的氢氧化钠溶液配制,则需要25%的氢氧化钠溶液______g;蒸馏水______g.
 rayspecter1年前1
rayspecter1年前1 -
 uu5213sx4 共回答了28个问题
uu5213sx4 共回答了28个问题 |采纳率78.6%解题思路:利用溶质质量=溶液质量×溶质的质量分数,根据溶液稀释前后,溶质的质量不变,结合题意进行分析解答.需要50g溶质质量分数为10%的氢氧化钠溶液,她若用25%的氢氧化钠溶液配制,设需要25%的氢氧化钠溶液的质量为x,溶液稀释前后,溶质的质量不变,则50g×10%=25%x,x=20g;需要蒸馏水的质量为50g-20g=30g.
故答案为:20;30.点评:
本题考点: 有关溶质质量分数的简单计算.
考点点评: 本题难度不大,掌握溶液稀释前后溶质的质量不变、溶质质量分数的有关计算并能灵活运用是正确解答本题的关键.1年前查看全部
- 为什么制作叶脉书签时只能用氢氧化钠?
为什么制作叶脉书签时只能用氢氧化钠?
盐酸和硫酸也具有腐蚀性,为什么制作叶脉书签只能用强碱性的物质,而不能用强酸性的? 五阿哥1年前1
五阿哥1年前1 -
 nmfdgjn 共回答了12个问题
nmfdgjn 共回答了12个问题 |采纳率100%叶脉中大部分为蛋白质,强酸对蛋白质类的物质有更大的腐蚀性,而氢氧化钠对叶脉的腐蚀性较小,而且能可以使叶细胞死亡停止代谢而保持原有的颜色.这是某位高手说的!1年前查看全部
- 制作叶脉书签需要100mL溶液浓度为百分之10的氢氧化钠溶液.配置时需要氢氧化钠固体的质量
制作叶脉书签需要100mL溶液浓度为百分之10的氢氧化钠溶液.配置时需要氢氧化钠固体的质量
制作叶脉书签需要100mL溶液浓度为百分之10的氢氧化钠溶液.配置时需要氢氧化钠固体的质量是多少!水的质量是多少?
 F飘飘1年前1
F飘飘1年前1 -
 世界真乱了 共回答了14个问题
世界真乱了 共回答了14个问题 |采纳率92.9%(1)总质量m=ρ·v=1.1g/ml X100ml=110g;10%为质量分数,也即需要氢氧化钠固体m=110g X 10%=11g.水的质量m=110g-11g=99g.(2)由于用20%氢氧化钠溶液配制,但需要氢氧化钠的含量是不变的,设需要20%氢氧化钠溶液质量为m;20...1年前查看全部
- 制作叶脉书签能不能小苏打溶液?浓度该多少?
制作叶脉书签能不能小苏打溶液?浓度该多少?
如题 开始想爱你1年前1
开始想爱你1年前1 -
 22694587 共回答了17个问题
22694587 共回答了17个问题 |采纳率76.5%浓度尽量高一些,如果用小苏打,可能要浸泡好几天 用纯碱是可以的,不过也要浸泡好几天,大约十天左右,纯碱可以由小苏打加热制得 或者电解饱和食盐水,制得氢氧化钠,只要煮十几分钟就能腐蚀叶肉~(电解请在室外进行)1年前查看全部
- 1、蝴蝶标本2、鹦鹉螺的贝壳3、正在捕食的猪笼草4、叶脉书签
1、蝴蝶标本2、鹦鹉螺的贝壳3、正在捕食的猪笼草4、叶脉书签
(1)其中属于生物的是___,理由是___.
(2)其中不属于生物的是___,理由是___. 习惯的力量1年前5
习惯的力量1年前5 -
 玉女花 共回答了7个问题
玉女花 共回答了7个问题 |采纳率14.3%3 生物是有生命的物体,能够自己自足,1 2 4 它们没有生命1年前查看全部
- 没有氢氧化钠怎么做叶脉书签
 三亚001年前1
三亚001年前1 -
 winsaki 共回答了12个问题
winsaki 共回答了12个问题 |采纳率91.7%用可乐瓶装一些洗米的水,将叶子放进去,盖紧盖子,摆到阳台上.一两个星期左右后.打开瓶子(味道有点难闻~),把水倒掉,拿出叶子,垫着一张纸板放到桌上,开始小心地用牙刷去刷叶子,待叶肉被刷掉后,就只剩叶脉了~如果发现刷起来很困难,说明叶子泡的时间不够,再用点洗米水泡泡吧~1年前查看全部
- 小香同学为了测定一瓶用于制作"叶脉书签"的氢氧化钠溶液的溶质的质量分数,进行如下实验.
小香同学为了测定一瓶用于制作"叶脉书签"的氢氧化钠溶液的溶质的质量分数,进行如下实验.
在烧杯中加入80G待测的氢氧化钙溶液,滴入几滴酚酞,再用滴管慢慢滴入百分之10的盐酸溶液,边滴边搅拌至溶液颜色恰好变成无色为止,共消耗盐酸溶液146G.1.146G盐酸溶液中溶质的质量. 2.待测氢氧化钠溶液的溶质的质量分数
帮忙写清楚点过程
谢谢;了饿
 lijie01年前1
lijie01年前1 -
 gprs727 共回答了13个问题
gprs727 共回答了13个问题 |采纳率84.6%1.m=146*10%
=14.6g
2.nHCl=m/M
=14.6/(35.5+1)
=0.4mol
nHCl=nNaOH
0.4=x/40
x=16g
C=(mNaOH/m总)*100%=20%1年前查看全部
- 某同学为了测定一瓶用于制作“叶脉书签”的氢氧化钠溶液的溶质质量分数,进行如下实验:先在烧杯中加入50g待测的氢氧化钠溶液
某同学为了测定一瓶用于制作“叶脉书签”的氢氧化钠溶液的溶质质量分数,进行如下实验:先在烧杯中加入50g待测的氢氧化钠溶液,滴入几滴酚酞溶液,再用滴管慢慢滴入25%的硫酸溶液,边滴边搅拌至溶液颜色恰好变成无色为止,共消耗硫酸溶液49g.(氢氧化钠与硫酸反应生成硫酸钠和水)
请你计算:
(1)49g25%的硫酸溶液中溶质的质量.
(2)待测氢氧化钠溶液的溶质质量分数. 情ren剑1年前1
情ren剑1年前1 -
 思绕故乡 共回答了22个问题
思绕故乡 共回答了22个问题 |采纳率86.4%解;(1)溶质的质量等于溶液的质量乘以溶质的质量分数.
则硫酸的质量是49g×25%=12.25g
答:49g25%的硫酸溶液中溶质的质量是12.25g
根据酸的质量求氢氧化钠的质量,再利用氢氧化钠溶液的质量求溶液的溶质质量分数.
设反应消耗NaOH的质量为x
2NaOH+H 2 SO 4 =Na 2 SO 4 +2H 2 O
2×40 98
x 12.25g
x=
2×40
98×12.25g =10g
待测氢氧化钠溶液的溶质质量分数为:
10g
50g ×100%=20%
答:待测氢氧化钠溶液的溶质质量分数时20%1年前查看全部
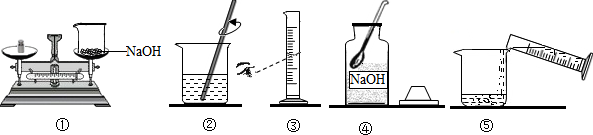
- 小明要用100g质量分数为10%的氢氧化钠溶液来制作“叶脉书签”。下图是他配制氢氧化钠溶液的实验操作示意图。 (1)量取
小明要用100g质量分数为10%的氢氧化钠溶液来制作“叶脉书签”。下图是他配制氢氧化钠溶液的实验操作示意图。 
(1)量取所需要的水应选择_______(选填“10mL”、“50mL”或“100mL”)量筒。
(2)指出图中的一处操作错误__________________。
(3)用上述图示的序号表示配制溶液的操作顺序___________。
(4)配制好的氢氧化钠溶液要密封保存,其原因是______________________。 djenen1年前1
djenen1年前1 -
 我的mp3 共回答了13个问题
我的mp3 共回答了13个问题 |采纳率92.3%(1)100mL
(2)称量时药品和砝码颠倒(或量水时仰视读数)
(3)④①③⑤②(或③④①⑤②)
(4)氢氧化钠溶液与二氧化碳反应变质(或防止氢氧化钠溶液与二氧化碳反应)1年前查看全部
- 制作“叶脉书签”需要200g溶质质量分数为10%的氢氧化钠溶液.请问:
制作“叶脉书签”需要200g溶质质量分数为10%的氢氧化钠溶液.请问:
(1)配制时需要氢氧化钠固体的质量是 g,水的质量是 g;
(2)若用30%的氢氧化钠溶液和水配制,需要30%的氢氧化钠溶液质量是 g.
 吾爱吾木1年前1
吾爱吾木1年前1 -
 312112976 共回答了17个问题
312112976 共回答了17个问题 |采纳率70.6%(1)配制时需要氢氧化钠固体的质量= 200g*10%=20g,
需要水的质量是200g-20g=180g;
(2)设需要30%的氢氧化钠溶液的质量为X
X*30%=200g*10%
X=66.7g1年前查看全部
- 华雪同学想制取“叶脉书签”,需要50g质量分数为10%的氢氧化钠溶液.请回答下列问题:
华雪同学想制取“叶脉书签”,需要50g质量分数为10%的氢氧化钠溶液.请回答下列问题:
(1)若用氢氧化钠固体配制,需称取氢氧化钠______g.
(2)若用25%的氢氧化钠溶液配制,需25%的氢氧化钠溶液______g;蒸馏水______g;配制时应选用______mL(选填“10”、“20”、“50”、“100”)的量筒量取蒸馏水.
(3)下列操作正确的是______.
A.在托盘天平的左右托盘上垫滤纸称取氢氧化钠固体
B.将准确称取的氢氧化钠固体直接倒入装有水的量筒中溶解
C.将配制好的NaOH溶液装入玻璃试剂瓶中,塞好橡胶塞并贴上标签
(4)在实验室配制氢氧化钠溶液时,______(填“要”或“不要”)用到玻璃棒.
(5)用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应______.
A.增加适量氢氧化钠固体 B.减少适量氢氧化钠固体 C.调节游码D.添加砝码
(6)(2)会导致所得溶液溶质质量分数偏小的选项有哪些?______
A.氢氧化钠中有杂质 B.称量时使用了生锈的砝码
C.用量筒量取水时,仰视读数 D.配制完成后移取液体时有部分溅出. 朱朱bu哭1年前1
朱朱bu哭1年前1 -
 云淡风清8513 共回答了16个问题
云淡风清8513 共回答了16个问题 |采纳率93.8%解题思路:(1)根据溶质质量=溶液质量×溶质质量分数计算;
(2)根据溶液质量=溶质质量÷溶质质量分数、要配制的溶液的质量减去需要的溶液的质量就是所需水的质量和量筒规格的选择依据解答;
(3)A、根据氢氧化钠具有强烈的腐蚀性,必须放在玻璃器皿中称量解答;
B、根据溶解不能在量筒中进行,一般在烧杯中进行解答;
C、根据配制好的溶液要装瓶并贴好标签以备使用解答.
(4)配制溶液要用玻璃棒搅拌以加快溶解的速度解答;
(5)根据称量时左物右码,指针指向的那边质量大解答;
(6)根据溶质质量分数=[溶质质量/溶液质量]×100%解答.(1)所需溶质的质量50g×10%=5g;
(2)需要25%的溶液的质量为[5g/25%]=20g,需要水的质量为50g-20g=30g;30g水合30ml和50mL的量筒最接近,所以选择50mL的量筒;
(3)A、氢氧化钠具有强烈的腐蚀性,必须放在玻璃器皿中称量;
B、溶解不能在量筒中进行,一般在烧杯中进行;
C、配制好的溶液要装瓶并贴好标签以备使用.
(4)配制溶液要用玻璃棒搅拌以加快溶解的速度;
(5)称量时左物右码,指针指向的那边质量大,指针指向左边说明氢氧化钠加多了;
(6)A、氢氧化钠中含有杂质,则取用的氢氧化钠中氢氧化钠的量小于所需的氢氧化钠单质溶液中溶质质量偏小,溶质质量分数偏小;
B、砝码生锈则称量出的氢氧化钠的质量大于所需的质量,溶质质量分数偏大;
C、仰视读数取用的水的体积大于所需的水的体积,溶质质量分数偏小;
D、配制好的溶液有部分液体溅出后,溶液是均一稳定的,不会影响溶液的溶质质量分数.
故答案:(1)5;(2)20;30;50;(3)C;(4)要;(5)B;(6)AC.点评:
本题考点: 一定溶质质量分数的溶液的配制;称量器-托盘天平.
考点点评: 熟练掌握溶质质量分数的计算公式和公式变形及配制溶液的基本操作是解答该题的关键.1年前查看全部
- 制作“叶脉书签”需要50g质量分数为10%的氢氧化钠溶液,请求出:
制作“叶脉书签”需要50g质量分数为10%的氢氧化钠溶液,请求出:
(1)配制时需要氢氧化钠固体的质量是______________g。
(2)若用20%的氢氧化钠溶液和水配制,需要20%的氢氧化钠溶液的质量是_____________g。 小珍珍妹1年前1
小珍珍妹1年前1 -
 weixia520 共回答了19个问题
weixia520 共回答了19个问题 |采纳率84.2%(1)5
(2)251年前查看全部
- 氢氧化钠制作叶脉书签的发生了什么反应
 很是不巧1年前1
很是不巧1年前1 -
 关中一匹夫 共回答了20个问题
关中一匹夫 共回答了20个问题 |采纳率95%对不起 这个问题我不能肯定的帮助你 个人观点 反应方程式是不可能知道的或写出 但是根据经验应该是填反应类型 若如此 貌似 水解反应 因为叶子中的一些色素使其不能轻易转化 只能让其变成更稳定的物质 水解反应在这时可能会发生1年前查看全部
- (2010•洛江区质检)制作“叶脉书签”需要50g质量分数为10%的氢氧化钠溶液,请求出:
(2010•洛江区质检)制作“叶脉书签”需要50g质量分数为10%的氢氧化钠溶液,请求出:
(1)配制时需要氢氧化钠固体的质量是______g.
(2)若用20%的氢氧化钠溶液和水配制,需要20%的氢氧化钠溶液的质量是______g. 票数低我不在乎1年前1
票数低我不在乎1年前1 -
 过江小船 共回答了25个问题
过江小船 共回答了25个问题 |采纳率88%解题思路:(1)求氢氧化钠固体的质量,就是求溶质的质量,根据溶质质量=溶液质量×溶质的质量分数公式即可求出溶质质量;
(2)欲求需要20%的氢氧化钠溶液的质量,根据溶液质量=[溶质质量/溶质的质量分数],可求出需要20%的氢氧化钠溶液的质量(1)根据溶质质量=溶液质量×溶质的质量分数=50g×10%=5g,
故答案为:5g;
(2)由题意可知,溶质质量不变
则[5/20%]=25g
答:若用20%的氢氧化钠溶液和水配制,需要20%的氢氧化钠溶液的质量是25g.点评:
本题考点: 有关溶质质量分数的简单计算;用水稀释改变浓度的方法.
考点点评: 本题主要考查学生灵活运用溶质质量分数进行计算的能力.1年前查看全部
- 求叶脉书签简单的做法啊= =没有那些化学用品
求叶脉书签简单的做法啊= =没有那些化学用品
有什么可以替代那些化学品吗?
要普通家里有的那种……
 玲玲l1年前1
玲玲l1年前1 -
 Donal 共回答了23个问题
Donal 共回答了23个问题 |采纳率82.6%叶脉书签应当选择有明显叶脉的老叶,先用家用碱饱和水溶液煮,见叶肉已烂,取出放在平板上,用小牙刷上下点击,不时用水冲洗,渐渐就可把叶肉去掉了,冲洗干净夹在厚书中,干透既可,当然你也可用颜色染制成五颜六色的,这样彩色的叶脉书签就制作好了.1年前查看全部
- 制作“叶脉书签”需要100g溶质质量分数为10%的氢氧化钠溶液.请问:
制作“叶脉书签”需要100g溶质质量分数为10%的氢氧化钠溶液.请问:
(1)配制时需要氢氧化钠固体的质量是______g,水的质量是______g;
(2)若用20%的氢氧化钠溶液和水配制,需要20%的氢氧化钠溶液质量是______g. trash_xp1年前1
trash_xp1年前1 -
 老蝎子 共回答了13个问题
老蝎子 共回答了13个问题 |采纳率84.6%(1)由 溶质的质量分数=
溶质的质量
溶液的质量 ×100%
得 溶质的质量=溶液的质量×溶质的质量分数
=100×10%
=10(克)
溶剂的质量=溶液的质量-溶质的质量
=100-10
=90(克)
故答案为:10克、90克
(2)由 溶质的质量分数=
溶质的质量
溶液的质量 ×100%
得 溶液的质量=
溶质的质量
溶质的质量分数
=
10
20%
=50(克)
故答案为:50克1年前查看全部
- 氢氧化钠,石灰水等的腐蚀性比较强,在制作叶脉书签的过程中,如何避免伤害到自己或他人?
 梧桐21年前1
梧桐21年前1 -
 8868802 共回答了20个问题
8868802 共回答了20个问题 |采纳率90%1,去超市买个手套(橡胶的、PVC的、PP的、PE的都行)
2,使用塑料杯子或盆子(氢氧化钠会腐蚀玻璃)
3,准备一双竹筷子或塑料筷子夹叶子
4,叶片腐蚀完成用大量的清水稀释冲洗后再把叶脉夹出来(注意不要把叶脉给冲坏了)1年前查看全部
- 小青同学为了制作叶脉书签,打算配制125g 10%的NaOH溶液.
小青同学为了制作叶脉书签,打算配制125g 10%的NaOH溶液.
(1)计算小青需要称取NaOH的质量______.
(2)小青取上述适量溶液,将洗净的树叶放在溶液中煮沸后取出,清洗烘干.为了测定剩下的100gNaOH溶液中的溶质NaOH的质量分数,小青向该溶液中逐渐加入7.3%的稀盐酸,当溶液pH=7时,消耗盐酸50g.计算剩下的100gNaOH溶液中NaOH的质量分数. dd88915201年前1
dd88915201年前1 -
 e-blue 共回答了9个问题
e-blue 共回答了9个问题 |采纳率88.9%(1)配制125g10%的NaOH溶液,需要称取NaOH的质量为125g×10%=12.5g.
(2)设参加反应的氢氧化钠的质量为x
NaOH+HCl═H 2 O+NaCl
40 36.5
x 50g×7.3%
40
36.5 =
x
50g×7.3% x=4g
剩下的100gNaOH溶液中NaOH的质量分数为
4g
100g × 100%=4%.
答:(l)12.5g;(2)剩下的100gNaOH溶液中NaOH的质量分数为4%.1年前查看全部
- (2011•阜新)小红用100g质量分数为10的氢氧化钠溶液来制“叶脉书签”,下图是他配制氢氧化钠溶液的实验操作示意图.
(2011•阜新)小红用100g质量分数为10的氢氧化钠溶液来制“叶脉书签”,下图是他配制氢氧化钠溶液的实验操作示意图.

(1)指出图中的两个操作上的错误瓶塞正置在实验台上瓶塞正置在实验台上;称量物放右盘,砝码放左盘了称量物放右盘,砝码放左盘了.
(2)量取实验所需水时,应选择100ml100ml(填“10ml”、“50ml”或“100ml”)量筒.
(3)错误操作改正后,用上述图示的序号表示配制溶液的操作顺序①③⑤②④①③⑤②④.
(4)配制好的氢氧化钠溶液要密封保存,其原因是氢氧化钠与空气中的二氧化碳反应,使其变质氢氧化钠与空气中的二氧化碳反应,使其变质. painended1年前1
painended1年前1 -
 yff5201314 共回答了12个问题
yff5201314 共回答了12个问题 |采纳率100%(1)用天平称量固体的质量时要注意是“左物右码”故本题中物品和砝码的质量放反了,而为了防止试剂被污染,瓶塞要倒放在试验台上,本题中的瓶塞正放在实验台上了;
(2)本题中需要水的质量为:100g×(1-10%)=90g,所以应该选择100mL的量筒来量取水的体积;
(3)在实验室中配制溶液的一般步骤为:计算、称溶质、量取溶剂、溶解;故正确的顺序为:①③⑤②④;
(4)氢氧化钠溶液容易和空气中的二氧化碳发生反应而变质,所以应该密封保存.
故答案为:(1)瓶塞正置在实验台上;称量物放右盘,砝码放左盘了;
(2)100ml;
(3)①③⑤②④;
(4)氢氧化钠与空气中的二氧化碳反应,使其变质.1年前查看全部
- 溶液质量分数计算制作“叶脉书签”需要500mL质量分数为10%的氢氧化钠溶液(密度为1.1g/ml),问1、配制时需要氢
溶液质量分数计算
制作“叶脉书签”需要500mL质量分数为10%的氢氧化钠溶液(密度为1.1g/ml),问
1、配制时需要氢氧化钠固体的质量是 g ,水的质量是 g.(这步知道求,得出为55g和495g)
2、若用1%的氢氧化钠溶液与氢氧化钠固体配制,需要1%的氢氧化钠溶液质量是 g
假设需要1%的氢氧化钠溶液质量为Xg,列式子(1%X+55/X+55)*100%=10%.得X=550g.怎么答案就是500? 羽羽_ff1年前1
羽羽_ff1年前1 -
 zq574222990 共回答了22个问题
zq574222990 共回答了22个问题 |采纳率95.5%2.10%的氢氧化钠溶液中的水(495g)全来自1%的氢氧化钠溶液,
1%的氢氧化钠溶液质量:495/(1-1%) = 500g1年前查看全部
- (2008•荔湾区二模)某同学为了测定一瓶用于制作“叶脉书签”的氢氧化钠溶液的质量分数,进行如下实验:先在烧杯中加入50
(2008•荔湾区二模)某同学为了测定一瓶用于制作“叶脉书签”的氢氧化钠溶液的质量分数,进行如下实验:先在烧杯中加入50g待测的氢氧化钠溶液,滴入几滴酚酞溶液,再用滴管慢慢滴入25%的硫酸溶液,边滴边搅拌至溶液颜色恰好变为无色(完全反应)为止,共消耗硫酸溶液49g.
(1)写出反应的化学方程式:______.
通过计算回答下列问题:
(2)硫酸的相对分子质量为:______.
(3)49g 25%的硫酸溶液中溶质的质量为:______.
(4)50g待测氢氧化钠溶液中溶质的质量为:______.
(5)待测氢氧化钠溶液的溶质质量分数为:______. ufoufoufo1年前1
ufoufoufo1年前1 -
 yanstill 共回答了19个问题
yanstill 共回答了19个问题 |采纳率84.2%解题思路:(1)依据反应事实结合方程式的书写要求完成即可;
(2)依据相对分子质量等于各元素相对原子质量之和完成;
(3)利用溶质的质量等于溶液的质量乘以溶质的质量分数解决.
(4)利用硫酸的质量通过方程式求氢氧化钠的质量;
(5)利用溶质质量分数的计算要求求溶质的质量分数.解;(1)氢氧化钠与硫酸的反应方程式是:2NaOH+H2SO4=Na2SO4+2H2O
(2)相对分子质量等于各元素相对原子质量之和,所以硫酸的相对分子质量为:1×2+32+16×4=98;
(3)溶质的质量等于溶液的质量乘以溶质的质量分数,则硫酸的质量是49g×25%=12.25g
(4)根据酸的质量求氢氧化钠的质量,再利用氢氧化钠溶液的质量求溶液的溶质质量分数.
设反应消耗NaOH的质量为x
2NaOH+H2SO4=Na2SO4+2H2O
2×40 98
x 12.25g
x=[2×40/98×12.25g]=10g
(5)待测氢氧化钠溶液的溶质质量分数为:
10g
50g×100%=20%
故答案为:(1)2NaOH+H2SO4=Na2SO4+2H2O(2)98(3)12.25g(4)10g(5)20%点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;有关溶质质量分数的简单计算;相对分子质量的概念及其计算.
考点点评: 此题是对溶液进行的综合计算,涉及到溶质质量的计算、方程式的计算,解决此题对学生计算能力的提高有一定好处.1年前查看全部
- 晓晓同学需配制100g12﹪的NaOH溶液来制作“叶脉书签”。在配制溶液过程中,下列做法正确的是 [
晓晓同学需配制100g12﹪的NaOH溶液来制作“叶脉书签”。在配制溶液过程中,下列做法正确的是 [ ]A.在托盘上垫纸称量12gNaOH固体
B.称量时发现指针向右偏转,应调节游码使天平平衡
C.用100mL量筒量取88mL水
D.用药匙搅拌,加速NaOH溶解 chase4_11年前1
chase4_11年前1 -
 大白狐 共回答了19个问题
大白狐 共回答了19个问题 |采纳率68.4%C1年前查看全部
- 丹丹同学需配制100g11%的NaOH溶液来制作“叶脉书签”。下列做法正确的是
丹丹同学需配制100g11%的NaOH溶液来制作“叶脉书签”。下列做法正确的是
A.在托盘上垫上纸片称量11gNaOH固体 B.称量11gNaOH固体时发现指针向左偏转,应调节游码使天平平衡 C.用100ml量筒量取89ml水 D.用药匙搅拌,加速NaOH溶解  wyl381182321年前1
wyl381182321年前1 -
 vencenrock 共回答了18个问题
vencenrock 共回答了18个问题 |采纳率77.8%C
1年前查看全部
- 制作叶脉书签是化学变化吗?
 andy_liang1年前3
andy_liang1年前3 -
 四季鲜蔬1 共回答了10个问题
四季鲜蔬1 共回答了10个问题 |采纳率100%主体应该是物理,但脱脂,叶绿素等杂七杂八是化学反应,就是把叶肉去除,剩叶脉,叶脉还脱脂了,剩纤维素,整体很多变化,但主体应该是物理1年前查看全部
- 小雪同学想制作“叶脉书签”,需要50g质量分数为10%的氢氧化钠溶液.请回答下列问题:
 小雪同学想制作“叶脉书签”,需要50g质量分数为10%的氢氧化钠溶液.请回答下列问题:
小雪同学想制作“叶脉书签”,需要50g质量分数为10%的氢氧化钠溶液.请回答下列问题:
①若用氢氧化钠固体配制,需称取氢氧化钠______g.
②配制溶液时,下列说法不正确的是______.
A.实验步骤是计算、称量(量取)、溶解、装瓶
B.用10mL量筒量取所需水的体积
C.用玻璃棒搅拌,加快固体溶解的速度
D.实验中用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管
③在用量筒量取所需水的过程中,小明俯视读数,这样配得的
溶液浓度会______(填“偏低”、“偏高”或“无所谓”).
④配制好溶液后要装瓶贴标签,请填写图标签. panyungao1年前1
panyungao1年前1 -
 zwt19810715 共回答了18个问题
zwt19810715 共回答了18个问题 |采纳率94.4%解题思路:①溶质的质量=溶液的质量×溶质的质量分数;
②A、根据溶液配置步骤分析;
B、根据误差最小化的原则来选择合适的量筒;
C、根据玻璃棒的作用来分析并作出判断;
D、根据配制溶液的各步骤所需的仪器来解答.
③根据公式:溶质质量分数=
×100%,进行分析.溶质质量 溶液质量
④由题意,填写出其标签即可.①配制50g质量分数为10%的氢氧化钠溶液,若用氢氧化钠固体配制,需称取氢氧化钠50g×10%=5g;
②A、实验室中配制一定质量分数溶液的实验步骤是计算、称量(量取)、溶解、装瓶,故A说法正确;
B、根据配制溶液的一般步骤可以知道:配制100g10%的氢氧化钠溶液需溶质:50g×10%=5g,需水的质量为50g-5g=45g,而水的密度为1g/mL,即需水的体积为45mL,为了减小误差,选取量筒时要选择比所量液体体积大且最接近的,所以选用50mL量筒量取45mL的水是正确的,故B说法错误;
C、通过玻璃棒的搅拌可以加速氢氧化钠的溶解速度,故C说法正确;
D、配制溶液所需要的仪器有:托盘天平、胶头滴管、烧杯、量筒和玻璃棒,故D说法正确.
③利用量筒读数时,俯视会使量取的液体体积偏少,所以造成配制的溶液溶质质量分数偏高;
④由题意,所配制的为质量分数为10%的氢氧化钠溶液,其标签为;
故答案为:①5
②B
③偏高
④
点评:
本题考点: 一定溶质质量分数的溶液的配制;测量容器-量筒.
考点点评: 掌握溶质的质量分数的计算式并会进行应用解决相关问题,了解溶液配制的注意事项等是解决此题的关键因素1年前查看全部
- (2012•吉首市模拟)小青同学为了制作叶脉书签,打算配制125g10%的NaOH溶液.
(2012•吉首市模拟)小青同学为了制作叶脉书签,打算配制125g10%的NaOH溶液.
(l)小青需要称取NaOH的质量是多少克?
(2)小青同学将洗净的树叶放在配制好的溶液中煮沸后取出,溶液的质量减少了25g,溶质质量分数也有所减小.为了测定剩下溶液中NaOH的质量分数,小青同学向溶液中逐渐加入7.3%的稀盐酸,当溶液PH=7时,消耗盐酸100g.计算:
①生成NaCl的质量是多少克?
②剩下溶液中NaOH的质量分数是多少? 啊戍1年前1
啊戍1年前1 -
 catonair 共回答了20个问题
catonair 共回答了20个问题 |采纳率75%解题思路:(1)利用溶液中溶质质量=溶液质量×溶液的溶质质量分数,计算125g10%的NaOH溶液中所含溶质氢氧化钠的质量;
(2)根据氢氧化钠与盐酸反应的化学方程式,由加入盐酸中HCl的质量计算消耗氢氧化钠的质量和生成氯化钠的质量,氢氧化钠与剩下溶液的质量比可计算剩下溶液中NaOH的质量分数.(1)125g10%的NaOH溶液中所含溶质氢氧化钠的质量=125g×10%=12.5g.
(2)设生成氯化钠的质量为x,参加反应的氢氧化钠的质量为y.
NaOH+HCl═H2O+NaCl
40 36.558.5
y100g×7.3% x
[40/y=
36.5
100g×7.3%]
y=8g
[36.5/100g×7.3%=
58.5
x]
x=11.7g
氢氧化钠的质量分数=[8g/125g−25g]×100%=8%
答:(1)小青需要称取NaOH的质量12.5g;(2)①生成NaCl的质量11.7g;②剩下溶液中NaOH的质量分数为8%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 根据化学方程式进行计算时,所使用的均为纯净物的质量,不要把稀盐酸质量100g当作HCl质量代入计算.1年前查看全部
- (2011•黑龙江)彤彤同学需配制100g,12%的NaOH溶液来制作“叶脉书签”.在配制过程中,下列做法正确的是(
(2011•黑龙江)彤彤同学需配制100g,12%的NaOH溶液来制作“叶脉书签”.在配制过程中,下列做法正确的是( )
A.在托盘上垫上纸片称量12gNaOH固体
B.称量时发现指针向右偏转,应调节游码使天平平衡
C.用100mL量筒量取88mL水
D.用药匙搅拌,加速NaOH溶解 gaoi1年前1
gaoi1年前1 -
 zhujiezhangjie 共回答了11个问题
zhujiezhangjie 共回答了11个问题 |采纳率90.9%A、氢氧化钠有极强的腐蚀性,在称取时应放在玻璃容器内进行称取,防止腐蚀托盘;故A不正确;
B、称量时发现指针向右偏转,说明左侧所加药品质量未达到所需称取量,应再向左侧加入药品,在称量过程中不能再调节游码使天平平衡;故B不正确;
C、根据量筒选用原则:一次性量取且量筒量程略大于所量取体积,因此量取88ml水应选用100ml量筒;故C正确;
D、在溶解过程中,为加快固体氢氧化钠的溶解,应使用玻璃棒进行搅拌,不能图省事而用药匙进行搅拌;故D不正确;
故选C.1年前查看全部
- 某同学制取“叶脉书签”,需要50g质量分数为10%的氢氧化钠溶液.若用25%的氢氧化钠溶液配制,需25%的氢氧化钠溶液_
某同学制取“叶脉书签”,需要50g质量分数为10%的氢氧化钠溶液.若用25%的氢氧化钠溶液配制,需25%的氢氧化钠溶液______g;蒸馏水______g;配制时应选用______mL(选填“10”、“20”、“50”、“100”)的量筒量取蒸馏水.
 湖北加湖南1年前1
湖北加湖南1年前1 -
 肖心 共回答了18个问题
肖心 共回答了18个问题 |采纳率83.3%解题思路:根据溶液稀释前后,溶质的质量不变,从减小实验误差的角度去选择量筒的量程,结合题意进行分析解答.若用25%的氢氧化钠溶液配制,设需要25%的氢氧化钠溶液的质量为x,则x×25%=50g×10%,x=20g;
需要蒸馏水的质量为50g-20g=30g(合30mL);选取量筒时,尽量选用能一次量取的最小规格的量筒,量取30mL水需用50mL的量筒.
故答案为:20;30;50.点评:
本题考点: 一定溶质质量分数的溶液的配制.
考点点评: 解答此类试题时,熟练掌握配制溶液的步骤,仪器,溶质的质量分数计算是解答此题的基础和关键.1年前查看全部
- 制作“叶脉书签”需要100g溶质质量分数为10%的氢氧化钠溶液.请问:
制作“叶脉书签”需要100g溶质质量分数为10%的氢氧化钠溶液.请问:
(1)配制时需要氢氧化钠固体 _________ g,需要水 _________ mL.(水的密度1g/cm 3 )
(2)配制该溶液时,需要用到的仪器有 _________ (填序号).
①托盘天平 ②烧杯 ③量筒 ④漏斗 ⑤玻璃棒 ⑥酒精灯 ⑦胶头滴管 ⑧药匙
(3)若用20%的氢氧化钠溶液和水配制,需要20%的氢氧化钠溶液 _________ g,此20%的氢氧化钠溶液 _________ mL,(填正整数)(20%的氢氧化钠溶液密度1.22g/mL). 射日之弓1年前1
射日之弓1年前1 -
 金小庸 共回答了19个问题
金小庸 共回答了19个问题 |采纳率84.2%(1)10 90 (2)①②③⑤⑦⑧ (3)50 41
1年前查看全部
- (2006•青岛)制作叶脉书签使用的碱液是12%的氢氧化钠溶液,现配制200g这样的溶液,需称取氢氧化钠固体的质量为(
(2006•青岛)制作叶脉书签使用的碱液是12%的氢氧化钠溶液,现配制200g这样的溶液,需称取氢氧化钠固体的质量为( )
A.12g
B.24g
C.36g
D.48g nana_9711年前1
nana_9711年前1 -
 dsz79 共回答了17个问题
dsz79 共回答了17个问题 |采纳率94.1%解题思路:溶质质量=溶液质量×溶质质量分数氢氧化钠质量:200g×12%=24g.
故选B.点评:
本题考点: 一定溶质质量分数的溶液的配制.
考点点评: 通过回答本题知道了溶质质量的计算方法,要分清所给数据中是溶质还是溶剂还是溶液质量.1年前查看全部
- 小雨要用100 g质量分数为10%的氢氧化钠溶液来制作“叶脉书签”.下图是她配制氢氧化钠溶液的实验操作示意图.
小雨要用100 g质量分数为10%的氢氧化钠溶液来制作“叶脉书签”.下图是她配制氢氧化钠溶液的实验操作示意图.

(1)写出图中两种玻璃仪器的名称:______、______.
(2)量取所需要的水应选择______(选填“10 mL”、“50 mL”或“100 mL”)量筒.
(3)指出图中的一处操作错误:______.按上述操作配制的溶液溶质质量分数将______(填“偏大”或“偏小”或“不变”).
(4)用上述图示的序号表示配制溶液的操作顺序:______.
(5)配好的氢氧化钠溶液由于没有及时装入试剂瓶,造成变质,此反应的化学方程式为______. 蔷薇微1年前1
蔷薇微1年前1 -
 pure218 共回答了22个问题
pure218 共回答了22个问题 |采纳率86.4%解题思路:(1)根据常用仪器回答;
(2)配制100g质量分数为10%的氢氧化钠溶液,要确定所选的量筒,首先必须知道所要取水的体积,再根据“一次相近”的原则选取量筒;
(2)使用天平时,要遵循左物右码的原则;使用量筒读数时,要使视线与液体凹液面的最低处保持水平,仰视或俯视都会造成读数不准确,仔细观察图,不难确定本题的答案(3)配制溶液的一般步骤为计算、称量、溶解、装瓶贴签存放等,所以本题的答案很容易做出选择.(1)图中属于玻璃仪器的有烧杯、玻璃棒、量筒;
故答案为:烧杯、量筒(合理均可);
(2)配制100g质量分数为10%的氢氧化钠溶液,所需氢氧化钠的质量为100g×10%=10g,需要水的质量为100g-10g=90g,而水一般采用量体积的方法,所以水的体积为90mL,选择量筒时,应该选取能一次量取且与所取液体的体积数接近;
故答案为:100mL;
(3)用固体溶质配制溶液的一般步骤为计算、称量、溶解、装瓶贴签存放;
故答案为:④①③⑤②;
(4)使用天平时,要遵循左物右码的原则;使用量筒读数时,要使视线与液体凹液面的最低处保持水平,仰视会使量取的水的量偏大,使所配溶液溶质的质量分数偏小;
故答案为:称量时药品和砝码颠倒(或量水时仰视读数);偏小;
(5)氢氧化钠易与二氧化碳发生化学反应生成碳酸钠和水而变质;
故答案为:2NaOH+CO2=Na2CO3+H2O.点评:
本题考点: 一定溶质质量分数的溶液的配制;常用仪器的名称和选用;空气中常见酸碱盐的质量或性质变化及贮存法;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查了配制一定溶质质量分数的溶液的相关问题,掌握天平和量筒的正确使用方法及误差分析是正确解答的基础和关键,二氧化碳易与氢氧化钠溶液反应发生变质.1年前查看全部
- 李华同学为测定一瓶用于制作“叶脉书签”的氢氧化钠溶液的溶质质量分数,进行如下实验,先在烧杯中加入50g待测氢氧化钠溶液,
李华同学为测定一瓶用于制作“叶脉书签”的氢氧化钠溶液的溶质质量分数,进行如下实验,先在烧杯中加入50g待测氢氧化钠溶液,滴入酚酞试液,再用滴管慢慢滴入25%的硫酸溶液,至溶液颜色恰好变成无色,共消耗硫酸溶液49g,计算:待测氢氧化钠溶液的溶质质量分数。  夏威夷的娱蚣1年前1
夏威夷的娱蚣1年前1 -
 makeyjw 共回答了25个问题
makeyjw 共回答了25个问题 |采纳率88%设NaOH的质量分数为x,则有 2NaOH+H 2 SO 4 =Na 2 SO 4 +2H 2 O...1年前查看全部
- 食用碱能代替氢氧化钠吗做叶脉书签的
 塌塌米11年前1
塌塌米11年前1 -
 想往向往 共回答了18个问题
想往向往 共回答了18个问题 |采纳率94.4%食用碱是小苏打(碳酸氢钠)(化学式NaHCO3),跟NaOH不是一种物质,而且碱性也相差很多,不能等同,最好找NaOH来做,或者石灰水也可以1年前查看全部
- 小宁需要配制80g质量分数为10%的氢氧化钠溶液来制作“叶脉书签”.如图是配制该氢氧化钠溶液的实验操作示意图.
小宁需要配制80g质量分数为10%的氢氧化钠溶液来制作“叶脉书签”.如图是配制该氢氧化钠溶液的实验操作示意图.

【实验步骤】
(1)计算:需要氢氧化钠固体 g,水 mL(水的密度以1.0g/cm 3 计)
(2)称量:用托盘天平称取氢氧化钠固体,用规格为 (填“10mL”、“50mL”或“100mL”)的量筒取所需要的水,倒入盛有氢氧化钠的烧杯中.
(3)溶解:用玻璃棒搅拌,使氢氧化钠固体完全溶解.
【拓展思维】
假如小宁想用上述配制的氢氧化钠溶液完全中和溶质质量分数为10%的盐酸,至少消耗盐酸的质量是多少?(反应的化学方程式为:NaOH+HCl=NaCl+H 2 O) gelunmu1年前1
gelunmu1年前1 -
 jvsee 共回答了15个问题
jvsee 共回答了15个问题 |采纳率100%(1)8;72;(2)100mL;(3)至少消耗盐酸的质量是73g.
1年前查看全部
- 下列家庭小实验中不涉及化学变化的是 A.世博会开幕燃放烟花 B.用糯米、酒曲和水制甜酒酿 C.用NaOH溶液制作叶脉书签
下列家庭小实验中不涉及化学变化的是
A.世博会开幕燃放烟花 B.用糯米、酒曲和水制甜酒酿 C.用NaOH溶液制作叶脉书签 D.用明矾溶液制明矾晶体  shuihu7891年前1
shuihu7891年前1 -
 myxia 共回答了20个问题
myxia 共回答了20个问题 |采纳率80%D
A、燃放烟花,发生了可燃物的燃烧,有新物质生成,属于化学变化;
B、用糯米、酒曲和水制甜酒酿,有新物质生成,属于化学变化;
C、用NaOH溶液制作叶脉书签,叶片受药品的腐蚀,柔软的部分就易被除去而留下叶脉,有新物质生成,属于化学变化;
D、用明矾溶液制明矾晶体,没有新物质生成,属于物理变化.
故选D.1年前查看全部
- 小青同学为了制作叶脉书签,打算配制125克百分之10的氢氧化钠溶液.记算小青需要称量氢氧化钠的质量 .小青将洗净的数叶放
小青同学为了制作叶脉书签,打算配制125克百分之10的氢氧化钠溶液.记算小青需要称量氢氧化钠的质量 .小青将洗净的数叶放在配制好的溶液中煮沸后取出,溶液的质量减少了5克,溶质质量分数也有所减小.为了测定剩下溶液中氢氧化钠的质量分数,小青向溶液中逐渐加入百分之7.3的稀盐酸,当溶液ph等于7时,消耗盐酸50克,记算 1、剩下溶液中氢氧化钠的质量分数
小青需要称量氢氧化钠的质量为125× 10% = 12.5 g .
NaOH + HCl=NaCl + H2O ,pH=7表明正好完全反应.
X =50 ×7.3% × 40 ÷ 36.5 =4 g
所以剩下NaOH的质量分数为 4 /(12.5 -5)× 100%=3.3%
为什么要用“4“/(12.5-5)?
"(12.5-5)"是什么? 活在当下3031年前1
活在当下3031年前1 -
 zhangjian-02 共回答了20个问题
zhangjian-02 共回答了20个问题 |采纳率100%4g是求出的溶液中NaOH的质量
12.5是原有的NaOH溶液质量,减少了5g,所以剩下的溶液质量应为(12.5-5)g
求质量分数就用4/(12.5-5)1年前查看全部
- 小张同学为了制作叶脉书签,打算配制125g10%的NaOH溶液.
小张同学为了制作叶脉书签,打算配制125g10%的NaOH溶液.
(1)计算小青需要称取NaOH的质量.
(2)小张将洗净的树叶放在配制好的溶液中煮沸后取出,溶液的质量减少了5g,溶质质量分数也有所减小.为了侧定剩下溶液中NaOH的质量分数,小青向溶液中逐渐加入7.3%的稀盐酸,当溶液PH=7时,消耗盐酸50g.计算:
①生成NaCl的质量.
②与盐酸反应的NaOH质量
③剩下溶液中NaOH的质量分数. tongyi19691年前1
tongyi19691年前1 -
 vanx135 共回答了14个问题
vanx135 共回答了14个问题 |采纳率100%解题思路:(1)利用溶液中溶质质量=溶液质量×溶液的溶质质量分数,计算125g10%的NaOH溶液中所含溶质氢氧化钠的质量;
(2)根据氢氧化钠与盐酸反应的化学方程式,由加入盐酸中HCl的质量计算消耗氢氧化钠的质量和生成氯化钠的质量,氢氧化钠与剩下溶液120g的质量比可计算剩下溶液中NaOH的质量分数.(1)125g10%的NaOH溶液中所含溶质氢氧化钠的质量=125g×10%=12.5g
(2)设生成氯化钠的质量为x,参加反应的氢氧化钠的质量为y
NaOH+HCl═H2O+NaCl
40 36.558.5
y 50g×7.3% x
根据:[40/36.5=
y
50g×7.3%]解得y=4g,根据[36.5/58.5=
50g×7.3%
x]解得 x=5.85g
氢氧化钠的质量分数=[4g/120g]×100%=3.3%
故答案为:(1)需要称取NaOH的质量12.5g;(2)①生成NaCl的质量5.85g;②与盐酸反应的NaOH质量是4g;③剩下溶液中NaOH的质量分数为3.3%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 根据化学方程式进行计算时,所使用的均为纯净物的质量,不要把稀盐酸质量50g当作HCl质量代入计算.1年前查看全部
- 叶脉书签既别致又实用,颇受同学们的喜爱.小芳和小丽为给同学们制作一些叶脉书签,各需配制200g12%的氢氧化钠溶液.小芳
叶脉书签既别致又实用,颇受同学们的喜爱.小芳和小丽为给同学们制作一些叶脉书签,各需配制200g12%的氢氧化钠溶液.小芳用固体氢氧化钠和水配制,操作步骤为:________、________、_________.因为氢氧化钠有________性,称量时必须放在_________中.小芳应称量固体氢氧化钠________g,量取水_________mL.小丽用20%的氢氧化钠溶液、蒸馏水配制,需20%的氢氧化钠溶液__________g,水________g.
 达能王子1年前4
达能王子1年前4 -
 挖坑大师 共回答了22个问题
挖坑大师 共回答了22个问题 |采纳率86.4%叶脉书签既别致又实用,颇受同学们的喜爱.小芳和小丽为给同学们制作一些叶脉书签,各需配制200g12%的氢氧化钠溶液.小芳用固体氢氧化钠和水配制,操作步骤为:_计算_、__称 量__、__溶解__.因为氢氧化钠有__腐蚀__性,称量时必须放在__玻璃器皿__中.小芳应称量固体氢氧化钠_24__g,量取水__176___mL.小丽用20%的氢氧化钠溶液、蒸馏水配制,需20%的氢氧化钠溶液___120___g,水__80___g.1年前查看全部
- 大华要用100g质量分数为10%的氢氧化钠溶液来制作“叶脉书签”.如下图是他配制该氢氧化钠溶液的实验操作示意图.回答下列
大华要用100g质量分数为10%的氢氧化钠溶液来制作“叶脉书签”.如下图是他配制该氢氧化钠溶液的实验操作示意图.回答下列问题:
(1)需要称取______g氢氧化钠固体.
①称量时如果用质量为23.1g的烧杯盛放固体,在托盘天平上已放30g的砝码,则天平上的游码位置应是图中的______(填字母).
②下列仪器中,量取水时需要用到d和______仪器(填序号),溶解时需要用到e和______仪器(填序号),其中e的作用是______.
a.烧杯、b.10mL量筒、c.100mL量筒、d.滴管、e.玻璃棒、f.药匙、g.蒸发皿.
下面是配制过程
(2)指出图中的一处操作错误:______.
(3)在配制该溶液时,结果发现所得溶液的质量分数小于10%,请你帮助分析造成这一结果的可能的因素有哪些?______(答出一点即可). 明若_晓溪1年前1
明若_晓溪1年前1 -
 52ppp 共回答了20个问题
52ppp 共回答了20个问题 |采纳率90%解题思路:(1)①根据溶质质量=溶液质量×溶质质量分数计算;
②利用固体溶质配制溶液,基本步骤为计算-称量-溶解和每一步骤需要的仪器进行分析解答即可.
(2)根据托盘天平的使用要遵循“左物右码”的原则、量筒读数时视线要与凹液面的最低处保持水平进行分析解答.
(3)一是溶质氯化钠少了,二是溶剂水多了.抓住这两个方面,很容易找出问题的原因.(1)①要用100g质量分数为10%的氢氧化钠溶液,则所需溶质的质量100g×10%=10g;
②一定质量分数溶液的配制的步骤:计算、称量、量取、溶解、装瓶.称量时用药匙取氯化钠固体,用托盘天平称量氯化钠固体;用量筒、胶头滴管取所需水的体积;用烧杯溶解氯化钠,并用玻璃棒搅拌.故答案为:c;a;加快溶解速度.
(2)托盘天平的使用要遵循“左物右码”的原则,图①中氢氧化钠与砝码的位置颠倒.量取液体时,视线与液体的凹液面最低处保持水平,图中仰视刻度,操作错误.
(3)造成溶质氯化钠少了的可能性比较多,如:称量时药品与砝码放反了、称后倒入烧杯时撒落、称取纸片上药品没倒完、搅拌时没完全溶解等等;
造成溶剂水多了的原因较少,主要可能是在量取液体时仰视读数等.
故答案为:
(1)10; ①B; ②c; a; 加快溶解速度
(2)①处砝码与烧杯放反了(或③处视线没有与凹液面最低处平行)
(3)称量时左物右砝(或量筒用水洗后未干燥)(合理即可)点评:
本题考点: 一定溶质质量分数的溶液的配制;测量容器-量筒;称量器-托盘天平.
考点点评: 本题难度不大,明确配制一定溶质质量分数的溶液实验步骤、熟练掌握溶质质量分数的计算公式是正确解答本题的关键.1年前查看全部
- 某同学为了测定一瓶用于制作“叶脉书签”的氢氧化钠溶液的溶质质量分数,进行如下实验:先在烧杯中加入50g待测的氢氧化钠溶液
某同学为了测定一瓶用于制作“叶脉书签”的氢氧化钠溶液的溶质质量分数,进行如下实验:先在烧杯中加入50g待测的氢氧化钠溶液,滴入几滴酚酞溶液,再用滴管慢慢滴入25%的硫酸溶液,边滴边搅拌至溶液颜色恰好变成无色为止,共消耗硫酸溶液49g.(氢氧化钠与硫酸反应生成硫酸钠和水)
请你计算:
(1)49g25%的硫酸溶液中溶质的质量.
(2)待测氢氧化钠溶液的溶质质量分数. wq_123451年前1
wq_123451年前1 -
 快乐小卷毛 共回答了18个问题
快乐小卷毛 共回答了18个问题 |采纳率100%解题思路:(1)利用溶质的质量等于溶液的质量乘以溶质的质量分数解决.
(2)利用硫酸的质量通过方程式求氢氧化钠的质量,再利用溶质质量分数的计算要求求溶质的质量分数.解;(1)溶质的质量等于溶液的质量乘以溶质的质量分数.
则硫酸的质量是49g×25%=12.25g
答:49g25%的硫酸溶液中溶质的质量是12.25g
根据酸的质量求氢氧化钠的质量,再利用氢氧化钠溶液的质量求溶液的溶质质量分数.
设反应消耗NaOH的质量为x
2NaOH+H2SO4=Na2SO4+2H2O
2×40 98
x 12.25g
x=[2×40/98×12.25g]=10g
待测氢氧化钠溶液的溶质质量分数为:
10g
50g×100%=20%
答:待测氢氧化钠溶液的溶质质量分数时20%点评:
本题考点: 有关溶质质量分数的简单计算;中和反应及其应用;根据化学反应方程式的计算.
考点点评: 此题是对溶液进行的综合计算,涉及到溶质质量的计算、方程式的计算,解决此题对学生计算能力的提高有一定好处.1年前查看全部
- 叶脉书签制作是 利用氢氧化钠 还是
叶脉书签制作是 利用氢氧化钠 还是
是利用氢氧化钠 还是 和 化学变化还是物理变化变化 要是两者都有的话哪个占的多一些 Chris_xy1年前1
Chris_xy1年前1 -
 咪杨 共回答了18个问题
咪杨 共回答了18个问题 |采纳率83.3%利用氢氧化钠 化学性质,化学变化 因为是利用它的腐蚀性,和叶肉的物质成分反应生成可以溶于水的物质.请采纳回答!受系统故障影响,不能回答追问,抱歉1年前查看全部
- 叶脉书签制作是 利用氢氧化钠 还是
叶脉书签制作是 利用氢氧化钠 还是
是利用氢氧化钠 还是 和 化学变化还是物理变化变化 要是两者都有的话哪个占的多一些 zimengyuner1年前1
zimengyuner1年前1 -
 海边有我的梦 共回答了14个问题
海边有我的梦 共回答了14个问题 |采纳率92.9%利用氢氧化钠 化学性质,化学变化 因为是利用它的腐蚀性,和叶肉的物质成分反应生成可以溶于水的物质. 请采纳回答!受系统故障影响,不能回答追问,抱歉
采纳哦1年前查看全部
- (2014•红桥区二模)(1)小明要用100g质量分数为10%的氢氧化钠溶液来制作“叶脉书签”,如图是他配制氢氧化钠溶液
(2014•红桥区二模)(1)小明要用100g质量分数为10%的氢氧化钠溶液来制作“叶脉书签”,如图是他配制氢氧化钠溶液的实验操作示意图.

①量取所需要的水应选择______(选填“10mL”、“50mL”或“100mL”)量筒.
②指出图中的2处操作错误,请写出其中的一处错误:______
③用上述图示的序号表示配制溶液的操作顺序:______.
④配置100g质量分数为10%的氢氧化钠溶液,需要氢氧化钠______g.如果按图中③量取水的质量______(填“偏小”或“偏大”或“不变”)
(2)现用质量分数为12%的氢氧化钠溶液(密度约为1.09g/cm3)配置20g质量分数为6%的氢氧化钠溶液,需要质量分数为12%的氢氧化钠溶液______mL(计算结果精确到0.1),需要水______mL(水的密度为1g/cm3) 名扬臭豆腐1年前1
名扬臭豆腐1年前1 -
 apple120ren 共回答了24个问题
apple120ren 共回答了24个问题 |采纳率100%解题思路:(1)①根据所量取水的体积确定所用量筒的量程.
②根据托盘天平的使用要遵循“左物右码”的原则、量筒读数时视线要与凹液面的最低处保持水平进行分析解答.
③根据配制溶质质量分数一定的溶液的基本步骤进行分析解答.
④利用溶质质量=溶液质量×溶质的质量分数,可根据溶液的质量和溶质的质量分数计算配制溶液所需要的溶质的质量;再根据溶剂质量=溶液质量-溶质质量即可求得水的质量.
(2)根据溶液稀释前后,溶质的质量不变,结合题意进行分析解答.(1)①溶质质量=溶液质量×溶质的质量分数,100g质量分数为10%的氢氧化钠溶液,需氢氧化钠的质量=100g×10%=10g;溶剂质量=溶液质量-溶质质量,则所需水的质量=100g-10g=90g(合90mL);选取量筒时,尽量选用能一次量取的最小规格的量筒,应用用100mL量筒量取90mL水.
②托盘天平的使用要遵循“左物右码”的原则,图①中氢氧化钠与砝码的位置颠倒.
量取液体时,视线与液体的凹液面最低处保持水平,图中仰视刻度,操作错误.
③配制100g质量分数为10%的氢氧化钠溶液的步骤:计算、称量(量取)、溶解、装瓶贴签,用图示的序号表示为:④①③⑤②.
④溶质质量=溶液质量×溶质的质量分数,100g质量分数为10%的氢氧化钠溶液,需氢氧化钠的质量=100g×10%=10g;按图中③量取水,仰视液面,读数比实际液体体积小,会造成实际量取的水的体积偏大.
(2)用质量分数为12%的氢氧化钠溶液(密度约为1.09g/cm3)配置20g质量分数为6%的氢氧化钠溶液,设需要质量分数为12%的氢氧化钠溶液的体积为x,溶液稀释前后,溶质的质量不变,则1.09g/cm3×x×12%=20g×6%,x≈9.2cm3(即9.2mL).
需要水的质量为20g-1.09g/cm3×9.2cm3≈10g(合10mL).
故答案为:(1)①100mL;②图①中氢氧化钠与砝码的位置颠倒等;③④①③⑤②;④10;偏大;(2)9.2;10.点评:
本题考点: 一定溶质质量分数的溶液的配制;测量容器-量筒;称量器-托盘天平.
考点点评: 本题难度不大,明确配制一定溶质质量分数的溶液实验步骤、溶液稀释前后溶质的质量不变等是正确解答本题的关键.1年前查看全部
- 我要做化学书里的叶脉书签,一定要用NAOH?要用什么容器装它的溶液?做完后怎样残液要怎么处理?潮州哪里有卖NAOH?
 daocaoren1991年前3
daocaoren1991年前3 -
 huangwei69 共回答了19个问题
huangwei69 共回答了19个问题 |采纳率89.5%氢氧化钠是腐蚀性很强的化学药品,使用时一定要注意安全.
一定要用NaOH.
固体的现在都盛装在塑料瓶内,你可以将它装在玻璃瓶内.
它的溶液要在玻璃容器内盛装.
做完后将残液保存在玻璃容器内贴上标签,还可已在使用.
要处理的话,向里边加入食醋让其变成中性后,再倒掉即可.
一般的化工商店有卖的.你可以问一下你们的化学老师.1年前查看全部
- (2011•黑龙江)彤彤同学需配制100g,12%的NaOH溶液来制作“叶脉书签”.在配制过程中,下列做法正确的是(
(2011•黑龙江)彤彤同学需配制100g,12%的NaOH溶液来制作“叶脉书签”.在配制过程中,下列做法正确的是( )
A.在托盘上垫上纸片称量12gNaOH固体
B.称量时发现指针向右偏转,应调节游码使天平平衡
C.用100mL量筒量取88mL水
D.用药匙搅拌,加速NaOH溶解 倒霉的一年1年前1
倒霉的一年1年前1 -
 ivnana79 共回答了15个问题
ivnana79 共回答了15个问题 |采纳率86.7%解题思路:使用氢氧化钠配制100g12%的NaOH溶液需要经过计算-称量-溶解的过程,根据称量、溶解所涉及基本操作的要求,分析在配制过程中的做法,判断做法的正误.A、氢氧化钠有极强的腐蚀性,在称取时应放在玻璃容器内进行称取,防止腐蚀托盘;故A不正确;
B、称量时发现指针向右偏转,说明左侧所加药品质量未达到所需称取量,应再向左侧加入药品,在称量过程中不能再调节游码使天平平衡;故B不正确;
C、根据量筒选用原则:一次性量取且量筒量程略大于所量取体积,因此量取88ml水应选用100ml量筒;故C正确;
D、在溶解过程中,为加快固体氢氧化钠的溶解,应使用玻璃棒进行搅拌,不能图省事而用药匙进行搅拌;故D不正确;
故选C.点评:
本题考点: 一定溶质质量分数的溶液的配制.
考点点评: 使用天平称量一定量药品的操作:根据左物右码的使用方法,在调节天平平衡后,在右盘放入所需要质量的砝码(必要时需移动游码),然后逐渐向左盘加入所需称取的固体药品至天平平衡.注意:称量过程中不能再调节平衡螺母.1年前查看全部
- 如何加快叶子腐烂速度我做叶脉书签,用水泡的办法让叶子腐烂,可是太慢有什么办法加快腐烂呢?(不要氢氧化钠(火碱NaOH)的
如何加快叶子腐烂速度
我做叶脉书签,用水泡的办法让叶子腐烂,可是太慢有什么办法加快腐烂呢?(不要氢氧化钠(火碱NaOH)的方法) humin12341年前1
humin12341年前1 -
 三弦饺子 共回答了22个问题
三弦饺子 共回答了22个问题 |采纳率86.4%用肥皂水煮1年前查看全部
- 制作“叶脉书签”需要lOOg溶质质量分数为10%的氢氧化钠溶液.请问:
制作“叶脉书签”需要lOOg溶质质量分数为10%的氢氧化钠溶液.请问:
(1)配制时需要氢氧化钠固体的质量和水的质量分别是多少?
(2)若用20%的氢氧化钠溶液配制lOOg溶质质量分数为10%的氢氧化钠溶液,需要20%的氢氧化钠溶液质量是多少? 2ii21年前1
2ii21年前1 -
 zhou1979_99 共回答了14个问题
zhou1979_99 共回答了14个问题 |采纳率100%解题思路:(1)利用溶质质量=溶液质量×溶质的质量分数,可根据溶液的质量和溶质的质量分数计算配制溶液所需要的溶质的质量;再根据溶剂质量=溶液质量-溶质质量即可求得水的质量.
(2)根据溶液稀释前后,溶质的质量不变,结合题意进行分析解答.(1)溶质质量=溶液质量×溶质的质量分数,配制lOOg溶质质量分数为10%的氢氧化钠溶液,需氢氧化钠的质量=100g×10%=10g;溶剂质量=溶液质量-溶质质量,则所需水的质量=100g-10g=90g.
(2)设需要20%的氢氧化钠溶液质量为x,根据溶液稀释前后,溶质的质量不变,
则100g×10%=x×20% x=50g.
答:(1)配制时需要氢氧化钠固体的质量和水的质量分别是10g、90g;(2)需要20%的氢氧化钠溶液质量是50g.点评:
本题考点: 有关溶质质量分数的简单计算.
考点点评: 本题难度不大,掌握溶质质量分数的有关解释、溶液稀释前后溶质的质量不变是正确解答此类题的关键所在.1年前查看全部
- 小王同学需配制100g12%的NaOH溶液来制作“叶脉书签”.在配制溶液过程中,下列做法正确的是( )
小王同学需配制100g12%的NaOH溶液来制作“叶脉书签”.在配制溶液过程中,下列做法正确的是( )
A.在托盘上垫上纸并称取12gNaOH固体
B.称量时发现指针向右偏转,应调节游码使天平平衡
C.用100mL量筒量取88mL水
D.把称取的NaOH固体直接倒人装有88mL水的量筒中溶解 leefeey1年前1
leefeey1年前1 -
 长路向西 共回答了16个问题
长路向西 共回答了16个问题 |采纳率93.8%A、一般药品称量时要在托盘上垫一张纸,但氢氧化钠易潮解、有腐蚀性,若也垫上纸,氢氧化钠潮解后会将纸润湿而进一步腐蚀托盘,所以像氢氧化钠这种易潮解及腐蚀性的药品要放在玻璃器皿里进行称量,如用小烧杯,A错误;
B、该题为定量称取,即要求称量12g固体,先在右盘放砝码或拨动游码,使其和为12g,在称量过程中不再改变,向左盘中加药品至天平平衡,完成称量.正确操作应为继续添加药品直至天平平衡,B错误;
C、量取液体时使用量筒,选取的量程要大于所测液体体积且最接近,以减小误差.大于88mL的量筒最小为100mL,C正确;
D、量筒是用来量取一定体积的液体,不能作为溶解仪器,应该在烧杯中溶解,并用玻璃棒加速溶解,D错误.
故选C.1年前查看全部
- 别致又实用的叶脉书签的制作方法是:将树叶放在烧杯中,加入200g12%的氢氧化钠溶液,加热煮沸10-15分钟,取出冲洗刷
别致又实用的叶脉书签的制作方法是:将树叶放在烧杯中,加入200g12%的氢氧化钠溶液,加热煮沸10-15分钟,取出冲洗刷去叶肉后进行染色,压平,最后系上丝带.在制作过程中:(1)需称取______gNaOH,称取时,要将其放在小烧杯中,因为它易______,称量时若发现天平指针向右偏转,则应该加NaOH直至天平平衡.(2)指出图中两处错误是:______,______.  xurui881年前1
xurui881年前1 -
 sjq3305 共回答了16个问题
sjq3305 共回答了16个问题 |采纳率87.5%(1)200g12%的氢氧化钠溶液,则氢氧化钠为:200×12%=24克,天平指针向右偏转,说明砝码重,氢氧化钠太少,则应该加NaOH直至天平平衡.
(2)由图可知,酒精灯内的酒精太多;加热烧杯,没垫石棉网.
故答为:(1)24克 潮解,
(2)灯内酒精太满,没垫石棉网(提示:天平规则:“左物右码”.)1年前查看全部
大家在问
- 1已知f(x)=log1/2(x)+3
- 2What would you most like___(own),a dog,a cat or a rabbit.
- 3用计算器算,结果保留3个有效数字
- 4遗失的翅膀(2) 作文
- 5101+102+103+104+105+106+107+108=( )*( )=( )求简式
- 6I'd like watching TV now错在哪?
- 7在一块豆腐上切4刀,切出14小块,怎么切?
- 8形容美丽的二字词形容鸟的美丽,二字词
- 9(2012•枣庄)枣庄市实验学校引种了一种能开多种颜色花的月季,能达到上述目的技术是( )
- 10翻译:他总是竭尽全力把工作做好. He always ___ ___ ___ ___ do the work well/
- 11在△ABC中,已知(a2+b2)sin(A-B)=(a2-b2)sin(A+B)
- 12关于健康人体中尿的形成及其成分的变化的叙述正确的是
- 13对下列诗句和谚语的理解,正确的一项是( ) A.“北风卷地白草折,胡天八月即飞雪”反映的是北方地区受冬季风的影响 B.
- 14问一道数学应用题某人连续打工,共赚190元(日工资10元,星期六半天工资5天,星期日休息无工资),已知他打工是从1月下旬
- 150<X<1且X+X分之一=根号8,求X-X分之一的值 对不起,有些符号我不会打,
