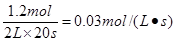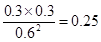若反应2A(l)+ B(g)==== 2C(g)的平衡常数为K=0.123,则上述反应的逆反应平衡常数为________
 与自己赛跑2022-10-04 11:39:541条回答
与自己赛跑2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 避孕光环 共回答了20个问题
避孕光环 共回答了20个问题 |采纳率85%- 逆反应平衡常数就是正反应平衡常数的倒数啊
反应物反过来了,分子分母自然也就倒过来了
K也就=1/0.123
=8.130 - 1年前
相关推荐
- 容积固定的密闭容器中,达平衡的可逆反应2A(g)===(可逆反应)2B+C(△H>0),若随着温度升高,气体平均相对分子
容积固定的密闭容器中,达平衡的可逆反应2A(g)===(可逆反应)2B+C(△H>0),若随着温度升高,气体平均相对分子质量减小,则下列判断正确的是( ).
若B为固体,则C一定是气体.) 李白江91年前1
李白江91年前1 -
 luohao133 共回答了17个问题
luohao133 共回答了17个问题 |采纳率88.2%对
△H>0,升温,平衡正移.又:气体平均相对分子质量减小,所以反应后气体分子量减小.若B为固体,则C一定是气体,C的分子量肯定1年前查看全部
- 如图的曲线是在其他条件不变时,反应2A(g)+B(g)⇌2C(g)(正反应吸热)中A在平衡状态下的转化率与温(t)的关系
 如图的曲线是在其他条件不变时,反应2A(g)+B(g)⇌2C(g)(正反应吸热)中A在平衡状态下的转化率与温(t)的关系,图中标有X、Y、Z、R、W 5点,其中表示反应正在向正反应方向进行的是( )
如图的曲线是在其他条件不变时,反应2A(g)+B(g)⇌2C(g)(正反应吸热)中A在平衡状态下的转化率与温(t)的关系,图中标有X、Y、Z、R、W 5点,其中表示反应正在向正反应方向进行的是( )
A.X、W
B.Y、R
C.X、Z
D.W xjz1371371年前1
xjz1371371年前1 -
 灰hui 共回答了20个问题
灰hui 共回答了20个问题 |采纳率90%解题思路:温度升高,A的转化率增大,说明正反应为吸热反应,图象中,位于曲线上的点为不同温度下的平衡状态,表示反应正在向正反应方向进行的,正反应速率大于逆反应速率,以此解答该题.由图象可知看出,X、R位于曲线上,应为平衡状态,Z、Y在曲线之上,反应的趋势应为A的转化率减小,则平衡应向逆反应方向移动,则逆反应速率大于正反应速率,W位于曲线之下,反应趋势应是A的转化率增大,则反应应向正反应方向移动,正反应速率大于逆反应速率,
故选D.点评:
本题考点: 转化率随温度、压强的变化曲线;化学平衡建立的过程.
考点点评: 本题考查化学平衡与图象问题,侧重于学生的分析能力的考查,为高考常见题型,难度中等,注意把握图象曲线的变化趋势,为解答该题的关键.1年前查看全部
- 某温度下,在一容积可变的容器中,反应2A(g)+B(g)2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mo
某温度下,在一容积可变的容器中,反应2A(g)+B(g)2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是……( )
A、均减半 B、均加倍 C、均增加1mol D、均减少1mol
.
均增加1mol 5.3.5.表示在原平衡上增加了0.5的B 所以平衡右移、
但是 如果用这种思路想为什么 C不对:
等压增加了B,可以将B的浓度近似看为不变,而 A、C浓度均减小.但是因为K 不变,而 A和C浓度减小的程度相等.所以平衡不右移.
我想说不是针对这道题,判断 N2+3H2==2NH3 等压增加N2 左移 等压增加H2 右移 就是用第二种思路.我的想法 天使欣1年前4
天使欣1年前4 -
 qaz17174 共回答了11个问题
qaz17174 共回答了11个问题 |采纳率90.9%为什么是等压增加B呢?这是平衡移动的问题,平衡时是424假设再加1mol的A和0.5MOL的B和1mol的C,则平衡不移动.那再加0.5MOLB,增加反应物,平衡右移.我感觉你叙述的有问题,你所说的等压增加B有问题,平衡移动有变量控制的PV=nRT1年前查看全部
- 容积固定的密闭容器中,达平衡的可逆反应2A(g)⇌2B+C (△H>0),若随着温度升高,气体平均相对分子质量
容积固定的密闭容器中,达平衡的可逆反应2A(g)⇌2B+C (△H>0),若随着温度升高,气体平均相对分子质量减小,则下列判断正确的是( )
A.B和C可能都是液体
B.B和C肯定都是气体
C.B和C可能都是固体
D.若C为固体,则B一定是气体 bjilvy1年前1
bjilvy1年前1 -
 42523499 共回答了21个问题
42523499 共回答了21个问题 |采纳率95.2%解题思路:反应是吸热反应,升温平衡正向进行,气体平均相对分子质量=[气体总质量/总物质的量];依据概念中的气体质量、气体物质的量分析判断.3A(g)⇌3B(?)+C(?)(△H>0),该正反应吸热,温度升高,平衡右移,
.
M变小,依据反应的系数关系,气体平衡体系的质量守恒,平均摩尔质量的变化,由反应前后气体物质的量变化、混合气体的质量变化决定;
A、B和C肯定不会都是液体,若都是液体,气体物质的量减小,质量减小,这里面的气体就只有A,所以气体的平均相对分子质量就是A的相对分子质量,所以气体平均相对分子质量
.
M不会发生变化,不变,故A错误;
B、若都是气体,反应前后气体物质的量一定增大,质量不变,
.
M减小,但若B为气体,C为固体,反应前后气体物质的量不变,气体质量减小,
.
M减小,故B错误;
C、B和C肯定不会都是固体,若都是固体,气体物质的量减小,质量减小,这里面的气体就只有A,所以气体的平均相对分子质量就是A的相对分子质量,所以气体平均相对分子质量
.
M不会发生变化,不变,故C错误;
D、C为固体,B一定为气体,反应前后气体物质的量不变,气体质量减小,
.
M减小,故D正确;
故选D.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查了化学平衡的影响因素的分析判断,主要考查气体摩尔质量的变化与物质状态的关系,气体质量变化、气体物质的量变化是解题关键,题目难度中等.1年前查看全部
- 对于一个可逆反应2a(g)<-->4b(g)+c(g) 恒温恒压下充入反应物气体 那么正逆反应怎样变大神们帮帮忙
 youkoyang1年前1
youkoyang1年前1 -
 shiweihua 共回答了9个问题
shiweihua 共回答了9个问题 |采纳率77.8%速率都不变 因为反应物只有一种 只加反应物相当于加一个平衡 因为衡压 体积可变 两个平衡加一起平衡不移动 高中老师应该总结过恒温容压的规律 有固定模式可遵循1年前查看全部
- 某温度下,在一容积可变的容器中,反应2A(g)+B(g)==2C(g)达到平衡时,A,B和C的物质的量分别为4mol,2
某温度下,在一容积可变的容器中,反应2A(g)+B(g)==2C(g)达到平衡时,A,B和C的物质的量分别为4mol,2mol和4mol,保持温度和压强不变,增加0.5molB,能否使平衡向右移动?各物质均增加1mol呢?(==表示可逆符号)请解释!谢谢~!
 致远高1年前1
致远高1年前1 -
 fth1688 共回答了21个问题
fth1688 共回答了21个问题 |采纳率95.2%当加入0.5molB时平衡肯定向右移动,因为增加反应物的浓度平衡正向移动.
个物质均增加1mol时平衡仍向右移动,因为此时反应体系与A,B和C的物质的量分别为5mol,3mol和5mol,而当A,B和C的物质的量分别为5mol,2.5mol和5mol是与最初的平衡态的A,B和C的物质的量分别为4mol,2mol和4mol是等效平衡.也就是说此时反应体系相当于在平衡态下的A,B和C的物质的量分别为5mol,2.5mol和5mol中加入0.5 molB,平衡肯定向右移动.1年前查看全部
- 将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应2A(g)+B(g)⇌2C(g),若经2
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应2A(g)+B(g)⇌2C(g),若经2s后测得C的浓度为0.6mol•L-1,现有下列几种说法,其中正确的是( )
A.用物质A表示的反应的平均速率为0.3 mol•L-1•s-1
B.用物质B表示的反应的平均速率为0.6 mol•L-1•s-1
C.2s时物质A的转化率为70%
D.2s时物质B的体积分数为40% zeng1081年前0
zeng1081年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在一定条件下,反应2A(g)+2B(g)⇌3C(g)+D(g)在恒容容器中进行,达到化学平衡的标志是( )
在一定条件下,反应2A(g)+2B(g)⇌3C(g)+D(g)在恒容容器中进行,达到化学平衡的标志是( )
A.单位时间内生成2n molB,同时消耗3n molC
B.容器内压强不随时间变化
C.混合气体的密度不随时间变化
D.B物质的百分含量不变 44lala1631年前1
44lala1631年前1 -
 迅速合上 共回答了14个问题
迅速合上 共回答了14个问题 |采纳率85.7%解题思路:根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.A、单位时间里生成2n molB,同时消耗3n molC,都表示逆反应速率,反应始终二者都按2:3进行,所以不能判读平衡,故A错误;
B、该反应前后气体的物质的量不变,压强始终不变,压强不随时间改变,不能说明到达平衡状态,故B错误;
C、混合气体的总质量不变,容器的体积不变,混合气体的密度始终不变,气体的密度不随时间改变,不能说明到达平衡状态,故C错误;
D、化学反应达到平衡状态时,各物质的物质的量不变,百分含量不变,故D正确;
故选D.点评:
本题考点: 化学平衡状态的判断.
考点点评: 本题考查化学平衡状态的判断,题目难度不大,本题注意反应可逆的特点,注意正逆反应速率是否相等的判断.1年前查看全部
- 某温度下,在一容积可变的容器中,反应2A(g)+B(g)==2C(g)达到平衡时,A
某温度下,在一容积可变的容器中,反应2A(g)+B(g)==2C(g)达到平衡时,A
某温度下,在一容积可变的容器中,反应2A(g)+B(g) 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
(A)均减半 (B)均加倍 (C)均增加1mol (D)均减小1mol
起始是4 2 4 均增加1mol 则是5 3 5
据等效平衡 则是8 4 0 和10 5.5 0
在把8 4 0 按比例与10 5.5 进行比较 则是A:10 5 0或者B:11 5.5 0
对于A 5.5比5多了 确实是向右移动 但与B比较10又比11少了1 那不是向左移动吗? lanhan81031年前4
lanhan81031年前4 -
 有点凌乱 共回答了13个问题
有点凌乱 共回答了13个问题 |采纳率76.9%这个问题不是这样看的.它(11)确实多了而且是平横的.反应比例2:1,刚好平衡了
而10和5.5 比例是100:55,不是二比一,是B多了0.5mol不是么?所以向右移
你的误区是没看明白等效平衡怎么比,不能看多少,要看比例,再看谁多了,谁少了
15mol 和7.5mol 都比11大,可是还是平衡的
加油吧!
此题答案
等效平衡看比例
A比例不变
B比例不变
C5 3 5 平衡应该5 2.5 5 B物资多了0.5,反应物增加,平衡右移
D减少 3 1 3 平衡应该3 1.5 3; B物资少0.5,反应物减少,平衡左移1年前查看全部
- 一定条件下,反应2A(g)+3B(g)=C(g)+mD(g)达到平衡状态,此时容器内压强为p1,c(D)为0.3mol/
一定条件下,反应2A(g)+3B(g)=C(g)+mD(g)达到平衡状态,此时容器内压强为p1,c(D)为0.3mol/L.其他条件不变时,将容器体积缩小为原来一半,建立新的平衡后压强变为P2 ,c(D)为0.4mol/L ,下列说法正确的是
A.P2=2P1 B.平衡向正反向移动 C.A的转化率见效 D.m〈4
为什么选C? fanjie77582581年前1
fanjie77582581年前1 -
 xdiz 共回答了20个问题
xdiz 共回答了20个问题 |采纳率90%A错,因为体积缩小一半,反应后C(D)的浓度没变,所以加压后反应向体积减小的方向进行移动了,压力不会是原来的2倍,而是小于2倍
B选项写错了吧,是向正向还是反向啊,事实上应该是反应向反(逆)方向移动
D错,反应向逆方向移动,M值应该是大于4,所以体积减小后,反应向体积减小的方向移动,A,B是2加3,C,D是1加M,C,D应该大于A,B,所以M大于4
C是对的,估计你打错字了,A的转化率减少,因为反应向逆方向移动了1年前查看全部
- 对于可逆反应2A(g)+3B(g)=XC(g)+D(g) 已知A和B的起始浓度分别为5和3 从反应开始至到达平衡的时间是
对于可逆反应2A(g)+3B(g)=XC(g)+D(g) 已知A和B的起始浓度分别为5和3 从反应开始至到达平衡的时间是2分钟 C的反应速率为0.5 平衡时D的浓度为0.5.求平衡常数K
 ponltao61年前1
ponltao61年前1 -
 啮齿目 共回答了15个问题
啮齿目 共回答了15个问题 |采纳率86.7%C平衡时的浓度为:0.5*2=1
2A(g) + 3B(g) = XC(g) + D(g)
C起 5 3 0 0
C变 1 1.5 1 0.5
C平 5-1=4 3-1.5=1.5 1 0.5
所以X=2
平衡常数K=(0.5*1^2)/(4^2 *1.5^3) =0.0091年前查看全部
- 某温度下,在一容积可变的容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2m
某温度下,在一容积可变的容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol,在保持温度不变的条件时下列操作不会使平衡右移的是( )
A.压强不变时,A、B和C均增加lmol
B.压强不变时,充入少量不参与反应的氖气
C.容积不变时,A、B和C均增加1mol
D.容积不变时,充入物质的量之比为2:1的A和B selina王悦1年前1
selina王悦1年前1 -
 tjhan 共回答了28个问题
tjhan 共回答了28个问题 |采纳率96.4%解题思路:A、从等效平衡的角度思考,加入A、B、C分别为1mol、0.5mol、1mol,则平衡不移动,现充入A、B、C各1mol,相当于在加入A、B、C分别为1mol、0.5mol、1mol的基础上加入0.5molB,则平衡向正反应方向移动;
B、压强不变时,充入少量不参与反应的氖气,体积增大,反应混合物各组分的浓度减小,压强减小,平衡向体积增大的方向移动;
C、从等效平衡的角度思考,加入A、B、C分别为1mol、0.5mol、1mol,压强增大平衡向正反应移动,现充入A、B、C各1mol,相当于在加入A、B、C分别为1mol、0.5mol、1mol的基础上加入0.5molB,则平衡正反应方向移动;
D、容积不变时,充入物质的量之比为2:1的A和B,等效为增大压强.A、从等效平衡的角度思考,加入A、B、C分别为1mol、0.5mol、1mol,则平衡不移动,现充入A、B、C各1mol,相当于在加入A、B、C分别为1mol、0.5mol、1mol的基础上加入0.5molB,则平衡向正反应方向移动,故A不选;
B、压强不变时,充入少量不参与反应的氖气,体积增大,压强减小,平衡向逆反应移动,故B选;
C、从等效平衡的角度思考,加入A、B、C分别为1mol、0.5mol、1mol,压强增大平衡向正反应移动,现充入A、B、C各1mol,相当于在加入A、B、C分别为1mol、0.5mol、1mol的基础上加入0.5molB,则平衡正反应方向移动,故C不选;
D、容积不变时,充入物质的量之比为2:1的A和B,等效为增大压强,平衡向正反应移动,故D不选;
故选B.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查化学平衡移动,注意从等效平衡的角度分析,进行思维转化设计平衡建立的途径,运用平衡移动原理解答,是解答该题的关键.1年前查看全部
- 下列能说明可逆反应2A(g)+B(g)⇌2C(g)+D(g)在一定条件下已达到化学平衡状态的事实是( )
下列能说明可逆反应2A(g)+B(g)⇌2C(g)+D(g)在一定条件下已达到化学平衡状态的事实是( )
A.容器内压强不随时间的变化而变化
B.容器内A、B、C、D四者共存
C.C的生成速率是D的生成速率的两倍
D.A的消耗速率是D的消耗速率的两倍 pink19841年前1
pink19841年前1 -
 保蓓蓓 共回答了20个问题
保蓓蓓 共回答了20个问题 |采纳率90%解题思路:根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.A、两边气体化学计量数相等,容器内压强始终不随时间的变化而变化,故A错误;
B、可逆反应始终是反应物和生成共存的状态,故B错误;
C、只体现正向,没有体现正逆的关系,故C错误;
D、A的消耗速率等效于D的生成速率,与D的消耗速率相等,反应达到平衡状态,故D正确;
故选D.点评:
本题考点: 化学平衡状态的判断.
考点点评: 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.1年前查看全部
- 化学平衡中增大反应物的体积或减少体积是什么意思?又如:例3、反应2A(气) 2B(气)+ C(气)—Q ,在未
化学平衡中增大反应物的体积或减少体积是什么意思?又如:例3、反应2A(气) 2B(气)+ C(气)—Q ,在未
化学平衡中有增大什么什么的体积,请问增大体积在不同条件下有多少意思?如题,又如:例3、反应2A(气) 2B(气)+ C(气)—Q ,在未用催化剂的条件下,已达平衡,现要使正反应速率降低、[B] 减小,应采用的措施是 ( )(A)升温 (B)增大反应器的体积 (C)增大[A] (D)降温( D ) 在海那边1年前2
在海那边1年前2 -
 jia357 共回答了20个问题
jia357 共回答了20个问题 |采纳率90%根据勒夏特勒原理,其它条件不变的情况下,改变影响平衡的一个条件(如浓度,压强或温度),平衡就能够朝削弱这种改变的方向移动.那么对于这个反应正方向为吸热和气体体积增大方向.
1,增大反应器体积,导致压强减小,必朝正方向,B的量增大,但是由于体积增大导致浓度减小,假设体积增大为原来的2倍,平衡不移动,那么B的浓度应为原来的1/2,这是平衡不移动的情况,但是事实是平衡会向正向移动导致笨的量增大,但是不可能增大到2倍,因为只能削弱改变,而不能完全抵消.
2,如果降温,平衡朝逆方向进行,B的量减小,同时体积也减小,但是也不能抵消这种改变,所以B的浓度仍减小.1年前查看全部
- 将4 mol A气体和2 mol B气体在2 L的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g) 2C(g
将4 mol A气体和2 mol B气体在2 L的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g)
 2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol·L -1 。下列说法中正确的是 ( )。
2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol·L -1 。下列说法中正确的是 ( )。
A.当A、B、C物质的量浓度之比为2∶1∶2时,反应即达到平衡状态
B.4 s内用物质B表示的反应速率为0.075 mol·L -1 ·s -1
C.达平衡后若通入一定量氦气,A的转化率降低
D.达平衡后若升高温度,C的浓度将增大 米拉05261年前1
米拉05261年前1 -
 李小龙2 共回答了20个问题
李小龙2 共回答了20个问题 |采纳率95%B
各物质浓度是否满足化学方程式化学计量数之比,与反应是否平衡无关,A项错;4 s内消耗c(B)=0.3 mol·L -1 ,则v(B)=0.075 mol·L -1 ·s -1 ,B项正确;加入一定量氦气,虽压强增大,但各组分的浓度都不变,平衡不移动,A的转化率不变,C项错误;平衡后,升温,平衡逆向移动,C的浓度减小,D项错误。1年前查看全部
- 对于可逆反应2A(g)+2B(g)=C(g)+3D(g),有下列两种反应途径……
对于可逆反应2A(g)+2B(g)=C(g)+3D(g),有下列两种反应途径……
1.n(A)=2mol n(B)=2mol n(C)=n(D)=0mol
2.n(A)=n(B)=0mol n(C)=2mol n(D)=6mol
请问这两种反应途径最终达到平衡时,所用的时间相同吗?为什么? lsy887yy11年前1
lsy887yy11年前1 -
 3526025 共回答了14个问题
3526025 共回答了14个问题 |采纳率92.9%所用的时间不一定相等
时间存在于反应速率mol/(L*min)
正逆反应速率视浓度的变化而变化,而平衡点是未知的.
我们可以用极限法
假设平衡点无限趋于于正反应完全进行
这时候1需要一段时间而2不用时间就可以达到平衡点了
所以所用的时间不是一定相同的……1年前查看全部
- 某温度下,在一容积可变的容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2m
某温度下,在一容积可变的容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A. 均减半
B. 均加倍
C. 均增加1mol
D. 均减少1mol yadong27921年前2
yadong27921年前2 -
 20041111abc 共回答了16个问题
20041111abc 共回答了16个问题 |采纳率100%解题思路:在容积可变的情况下,从对平衡混合物中三者的物质的量对各物质的量的浓度影响角度思考.在“均减半”或“均加培”时,相当于A、B、C三物质的浓度都没有改变,“均增加1mol”时相当于A、C物质的浓度减小,B物质的浓度增大,“均减小1mol”时相当于A、C物质的浓度增大,B物质的浓度减小.A、由于是在容积可变的容器中,则在“均减半”相当于A、B、C三物质的浓度都没有改变,平衡不会移动,故A、错误;
B、由于是在容积可变的容器中,则在“均加培”相当于A、B、C三物质的浓度都没有改变,平衡不会移动,故B错误;
C、同样由于容积可变,“均增加1mol”时相当于A、C物质的浓度减小,B物质的浓度增大,平衡向右移动,故C正确;
D、“均减小1mol”时相当于A、C物质的浓度增大,B物质的浓度减小,平衡向左移动,故D错误;
故选:C.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查化学平衡移动,要注意的是基本概念、基础理论是高考中不变的一个重点.这道题的设问别具一格,解答时既要定性判断、又要定量分析,多次灵活转换,都值得大家研究,思维转化是解答该题的关键.1年前查看全部
- (2013•蚌埠一模)可逆反应2A(g)+B(g)⇌2C(g),根据下表中的数据判断下列图象错误的是( )
(2013•蚌埠一模)可逆反应2A(g)+B(g)⇌2C(g),根据下表中的数据判断下列图象错误的是( )
压强A转化率温度 p1(MPa) p2(MPa) 400℃ 99.6 99.7 500℃ 96.9 97.8
A.
B.
C.
D.
 Inzaghi131年前1
Inzaghi131年前1 -
 jean0214 共回答了22个问题
jean0214 共回答了22个问题 |采纳率81.8%解题思路:由表中数据可知,在相同压强下,升高温度,A的转化率降低,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,在相同温度下,增大压强,A的转化率增大,说明平衡向正反应方向移动,对比图象可解答该题.由表中数据可知,在相同压强下,升高温度,A的转化率降低,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,在相同温度下,增大压强,A的转化率增大,说明平衡向正反应方向移动,则
A.升高温度,A的转化率降低,与表中数据吻合,故A正确;
B.升高温度,平衡向逆反应方向移动,C的百分含量降低,增大压强,平衡向正反应方向移动,C的百分含量增大,与表中数据吻合,故B正确;
C.升高,反应速率增大,平衡向逆反应方向移动,逆反应速率大于正反应速率,与表中数据吻合,故C正确;
D.增大压强,反应速率增大,正反应速率大于逆反应速率平衡向正反应方向移动,图象与表中数据不吻合,故D错误.
故选D.点评:
本题考点: 转化率随温度、压强的变化曲线;体积百分含量随温度、压强变化曲线;化学反应速率与化学平衡图象的综合应用.
考点点评: 本题考查温度温度、压强对平衡移动的影响,题目难度中等,注意分析表中数据以及图象的曲线的变化,学习中注意加强该方面能力的培养.1年前查看全部
- 对于可逆反应2A(g)=2B(g)+C(g)升高温度增大压强等A的反应速率怎么变化?
 红尘有我a1年前1
红尘有我a1年前1 -
 雨巷流红 共回答了21个问题
雨巷流红 共回答了21个问题 |采纳率100%切记,升高温度,增大压强,速率一定是增大的
只是正速率和逆速率增大的幅度不一样,造成了正速率与逆速率不等,使得平衡发生了移动.1年前查看全部
- 将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生如下反应2A(g)+B(g)⇌2C(g),若经2s后
将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生如下反应2A(g)+B(g)⇌2C(g),若经2s后测得 C的浓度为0.6mol/L,计算:2s时B的浓度,A的速率,A的转化率?
 qqme20021年前4
qqme20021年前4 -
 yanhaiit 共回答了18个问题
yanhaiit 共回答了18个问题 |采纳率88.9%解题思路:利用三段式计算各组分浓度变化量、2s时浓度,根据v=[△c/△t]计算v(A),A的转化率=[A的浓度变化量/A的起始浓度]×100%.A的起始浓度=[4mol/2L]=2mol/L,B的起始浓度=[2mol/2L]=1mol/L,2s后测得 C的浓度为0.6mol/L,则:
2A(g)+B(g)⇌2C(g)
开始(mol/L):2 1 0
转化(mol/L):0.6 0.3 0.6
2s(mol/L):1.4 0.7 0.6
故2s时B的浓度=0.7mol/L,
v(A)=[0.6mol/L/2S]=0.3mol/(L.S),
A的转化率=[0.6mol/L/2mol/L]×100%=30%,
答:2s时B的浓度为0.7mol/L,用A表示的速率为0.3mol/(L.S),A的转化率为30%.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学反应速率、化学平衡有关计算,题目比较简单,侧重对基础知识的巩固.1年前查看全部
- 高二化学平衡问题某温度下,在一容积可变的容器中,反应2A(g)+B(g)2C(g)达到平衡时,A,B和C的物质的量分别为
高二化学平衡问题
某温度下,在一容积可变的容器中,反应2A(g)+B(g)2C(g)达到平衡时,A,B和C的物质的量分别为4mol,2mol,和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,可使平衡右移的是
A.均加倍 B.均减半 C.均减少1mol D.均增加1mol
晕啊~学了溶液和原电池之后前面的平衡忘得一干二净.
答案是选D,
不是很明白怎么看成A,B,C分别增加1mol,0.5mol,1mol,B再增加0.5mol??有区别的吗? 发米来多1年前1
发米来多1年前1 -
 283649163 共回答了21个问题
283649163 共回答了21个问题 |采纳率95.2%2楼的说别人瞎扯,我怎么感觉你比别人还能扯啊.不知道就不要害人啊!
因为是可变容器,所以只要加入或减少2:1:2的量平衡都是不变的,所以D就相当与多家了0.5mol的B,平衡右移.1年前查看全部
- 在可逆反应2A(g)+3B(g) xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L
在可逆反应2A(g)+3B(g)
 xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L -1 ,B为3 mol·L -1 ,前2 min C的平均反应速率为0.5 mol·L -1 ·min -1 。2 min后,测得D的浓度为0.5 mol·L -1 。则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L -1 ,B为3 mol·L -1 ,前2 min C的平均反应速率为0.5 mol·L -1 ·min -1 。2 min后,测得D的浓度为0.5 mol·L -1 。则关于此反应的下列说法中正确的是( )
A.2 min末时A和B的浓度之比为5∶3
B.x=1
C.2 min末时B的浓度为1.5 mol·L -1
D.2 min末时A的消耗浓度为0.5 mol·L -1 dear_hot_human1年前1
dear_hot_human1年前1 -
 吸血僵尸仔 共回答了18个问题
吸血僵尸仔 共回答了18个问题 |采纳率83.3%1年前查看全部
- 某温度下,在一容积可变的容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2m
某温度下,在一容积可变的容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A. 均减半
B. 均加倍
C. 均增加1mol
D. 均减少1mol 小轻风1年前1
小轻风1年前1 -
 cecily1127 共回答了22个问题
cecily1127 共回答了22个问题 |采纳率90.9%解题思路:在容积可变的情况下,从对平衡混合物中三者的物质的量对各物质的量的浓度影响角度思考.在“均减半”或“均加培”时,相当于A、B、C三物质的浓度都没有改变,“均增加1mol”时相当于A、C物质的浓度减小,B物质的浓度增大,“均减小1mol”时相当于A、C物质的浓度增大,B物质的浓度减小.A、由于是在容积可变的容器中,则在“均减半”相当于A、B、C三物质的浓度都没有改变,平衡不会移动,故A、错误;
B、由于是在容积可变的容器中,则在“均加培”相当于A、B、C三物质的浓度都没有改变,平衡不会移动,故B错误;
C、同样由于容积可变,“均增加1mol”时相当于A、C物质的浓度减小,B物质的浓度增大,平衡向右移动,故C正确;
D、“均减小1mol”时相当于A、C物质的浓度增大,B物质的浓度减小,平衡向左移动,故D错误;
故选:C.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查化学平衡移动,要注意的是基本概念、基础理论是高考中不变的一个重点.这道题的设问别具一格,解答时既要定性判断、又要定量分析,多次灵活转换,都值得大家研究,思维转化是解答该题的关键.1年前查看全部
- 某温度下的密闭容器中,反应2A(g)⇌B(g)△H<0 达到平衡后,c(A)/c(B)=a,若改变
某温度下的密闭容器中,反应2A(g)⇌B(g)△H<0达到平衡后,c(A)/c(B)=a,若改变某一条件,反应再次平衡,此时c(A)/c(B)=b,下列叙述正确的是( )
A.在该温度下,保持容积固定不变,向容器内补充B气体,则a>b
B.保持温度、压强不变,充入惰性气体,则有a=b
C.若其他条件不变,升高温度,则有a>b
D.若a=b,容器中一定使用了催化剂 cyy1146841年前1
cyy1146841年前1 -
 010109128 共回答了16个问题
010109128 共回答了16个问题 |采纳率81.3%解题思路:如a=b,说明平衡状态相同,如a>b,说明平衡向正反应方向移动,反之向逆反应方向移动,结合温度、压强对平衡移动的影响解答该题.A.在该温度下,保持容积固定不变,向容器内补充了B气体,B的浓度增大,虽然平衡向逆反应方向移动,但B转化的比增加的幅度小,则a>b,故A正确;
B.保持温度、压强不变,充入惰性气体,应增大容器体积,则反应气体的分压减小,平衡向逆反应方向移动,则a<b,故B错误;
C.升高温度,平衡向逆反应方向移动,则a<b,故C错误;
D.如在恒压条件下加入等配比数的A和B,则仍达到同一平衡状态,或在恒容条件下加入惰性气体,平衡不移动,则a、b相等,不一定为加入催化剂,故D错误.
故选A.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查化学平衡的影响因素,侧重于学生的分析能力的考查,为高考常见题型和高频考点,注意外界条件对平衡移动的影响,难度不大,易错点为D.1年前查看全部
- 对於反应2A(g)+3B(g)=xC(g)+3D(g),在容积为2L的密闭容器中,将2mol气体A和3mol气体B混合
对於反应2A(g)+3B(g)=xC(g)+3D(g),在容积为2L的密闭容器中,将2mol气体A和3mol气体B混合
当反应经2min後达平衡时生成2.4mol气体D,并测得C的浓度为0.4mol/L.求x的值和A的转化率以下为我个人做法,2A(g)+3B(g)=xC(g)+3D(g)开始浓度(mol/L) 1 1.5 0 0变化浓度(mol/L) 0.8 1.2 0.4 1.2平衡浓度(mol/L) 0.8 1.2 0.4 1.2C和D的比例为1:3 所以x=1因为,某种指定物反应的转化率=[指定物反应物的起始浓度-指定物反应物的平衡浓度]/[指定物反应物的起始浓度]*100%A的转化率为[1-0.8]/[1]*100%=20%正确的答案是80% 落日看红尘1年前1
落日看红尘1年前1 -
 请叫我008 共回答了13个问题
请叫我008 共回答了13个问题 |采纳率84.6%A的“平衡浓度”不是0.8mol/L,而是0.2mol/L.
0.8mol/L是A的变化浓度.
转化率 = 0.8mol/L / 1mol/L *100% = 80%
你自己在解答过程中都写得很对:变化浓度:0.8 1.2 ……
但到计算转化率时,却用错了数据了.1年前查看全部
- 某温度下,在一容积可变的容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2m
某温度下,在一容积可变的容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A. 均减半
B. 均加倍
C. 均增加1mol
D. 均减少1mol 王广民1年前2
王广民1年前2 -
 tock48682 共回答了17个问题
tock48682 共回答了17个问题 |采纳率94.1%解题思路:在容积可变的情况下,从对平衡混合物中三者的物质的量对各物质的量的浓度影响角度思考.在“均减半”或“均加培”时,相当于A、B、C三物质的浓度都没有改变,“均增加1mol”时相当于A、C物质的浓度减小,B物质的浓度增大,“均减小1mol”时相当于A、C物质的浓度增大,B物质的浓度减小.A、由于是在容积可变的容器中,则在“均减半”相当于A、B、C三物质的浓度都没有改变,平衡不会移动,故A、错误;
B、由于是在容积可变的容器中,则在“均加培”相当于A、B、C三物质的浓度都没有改变,平衡不会移动,故B错误;
C、同样由于容积可变,“均增加1mol”时相当于A、C物质的浓度减小,B物质的浓度增大,平衡向右移动,故C正确;
D、“均减小1mol”时相当于A、C物质的浓度增大,B物质的浓度减小,平衡向左移动,故D错误;
故选:C.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查化学平衡移动,要注意的是基本概念、基础理论是高考中不变的一个重点.这道题的设问别具一格,解答时既要定性判断、又要定量分析,多次灵活转换,都值得大家研究,思维转化是解答该题的关键.1年前查看全部
- 在一定条件下,反应2A(g)+2B(g)可逆3C(g)+D(g)达到平衡状态的标志是
在一定条件下,反应2A(g)+2B(g)可逆3C(g)+D(g)达到平衡状态的标志是
容器内混合气体密度不随时间而变化.选不选? 曾义1年前1
曾义1年前1 -
 jackok39 共回答了13个问题
jackok39 共回答了13个问题 |采纳率76.9%不选,质量不变,体积不变(因为生成物与反应物系数和一样)1年前查看全部
- 在可逆反应2A(g)+3B(g)⇌xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5mol•L-
在可逆反应2A(g)+3B(g)⇌xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5mol•L-1,B为3mol•L-1,前2min内C的平均反应速率为0.5mol•L-1•min-1.2min后,测得D的浓度为0.5mol•L-1.则关于此反应的下列说法中正确的是( )
A.2 min末时A和B的浓度之比为5:3
B.x=2
C.2 min末时B的浓度为1.5 mol•L-1
D.2 min末时A的消耗浓度为0.5 mol•L-1 无敌小青蛙21年前1
无敌小青蛙21年前1 -
 robinford 共回答了17个问题
robinford 共回答了17个问题 |采纳率94.1%解题思路:根据化学反应速率之比等于系数之比,结合化学反应的三段式计算:
A(g)+3B(g)⇌xC(g)+D(g)
初始浓度(mol/L) 5 3 0 0
转化浓度(mol/L) 1 1.50.5x 0.5
2min浓度(mol/L) 4 1.5 0.5x 0.5
结合初始浓度、变化浓度、末态浓度进行计算即可,化学反应速率v=[△c/△t].2A(g)+3B(g)⇌xC(g)+D(g) 初始浓度(mol/L) 5 3 0 0转化浓度(mol/L) 1 &nbs...
点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查学生有关化学平衡和化学反应速率的有关计算知识,属于考查的重点内容,注意三行式在解题中的灵活应用,难度不大.1年前查看全部
- 有一可逆反应2A(g)+3B(g)⇌4C(g)+D(g),已知起始浓度c(A)=2mol/L,c(B)=3mol/L,c
有一可逆反应2A(g)+3B(g)⇌4C(g)+D(g),已知起始浓度c(A)=2mol/L,c(B)=3mol/L,c(C)=c(D)=0,反应开始20min后达到平衡状态,此时D的平衡浓度为0.5mol/L,则下列说法不正确的是( )
A.前20 min的平均反应速率v(C)=0.1 mol/(L•min)
B.A的转化率为50%
C.C的平衡浓度c(C)=4 mol/L
D.B的平衡浓度c(B)=1.5 mol/L cyz1993641年前1
cyz1993641年前1 -
 左案晴天 共回答了20个问题
左案晴天 共回答了20个问题 |采纳率95%解题思路:利用三段式法计算:
2A(g)+3B(g)⇌4C(g)+D(g),
起始(mol/l) 2 3 0 0
转化(mol/l) 1 1.5 2 0.5
平衡(mol/l) 11.5 2 0.5
结合对应的数据计算各物理量及转化率.利用三段式法计算:
2A(g)+3B(g)⇌4C(g)+D(g),
起始(mol/l) 2 3 0 0
转化(mol/l) 1 1.5 2 0.5
平衡(mol/l) 1 1.5 2 0.5
A.前20 min的平均反应速率v(C)=[2mol/L/20min]=0.1mol/(L.min),故A正确;
B.A的转化率为[1/2]×100%=50%,故B正确;
C.C的平衡为浓度为2mol/L,故C错误;
D.B的平衡浓度为1.5mol/L,故D正确.
故选C.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的计算,难度不大,注意利用三段式法计算出平衡浓度为解答该题的关键,答题时注意体会.1年前查看全部
- 一定条件下,可逆反应2A(g)+B(s)可逆2C(g)△H<0达到平衡状态,如果改变某个条件
一定条件下,可逆反应2A(g)+B(s)可逆2C(g)△H<0达到平衡状态,如果改变某个条件
使反应物A的浓度增大,则下列说法不正确的是 A.平衡可能向正反应方向移动.B.平衡可能向逆反应方向移动.C.生成物C的浓度相应减小.C.平衡可能移动也可能不移动. ff浪子dyl1年前1
ff浪子dyl1年前1 -
 顽强的钢铁女mm 共回答了12个问题
顽强的钢铁女mm 共回答了12个问题 |采纳率75%影响平衡的因素有,浓度,压强,温度.对云A选项,其他条件不变,只使A浓度增加,平衡正反方向移动.对于C选项,其他条件不变,使V=2V0(增大体积),C浓度减小.对于D选项,其他条件不变,时V=0.5V0(体积减小),平衡不移动.B选项是不可能的,A的浓度增大,有两种可能,一种是其他物质浓度都不变,A增大.这种情况下平衡一定会正移动.第二种是A,C都增大,平衡不移动.
所以B不可能.1年前查看全部
- 某温度下,反应2A(g) B(g)+C(g)的平衡常数为1,在溶积为2L的密闭容器中
某温度下,反应2A(g) B(g)+C(g)的平衡常数为1,在溶积为2L的密闭容器中加入A(g),20s时测得各组分的物质的量如下表
下列说法正确的是物质 A(g) B(g) C(g) 物质的量/mo1 1.2 0.6 0.6
A.反应前20s的平均速率为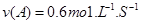
B.20s时,正反应速率等于逆反应速率
C.达平衡时,A(g)的转化率为100%
D.若升高温度,平衡常数将变为0.5,则反应的△H<0 tongjilm1年前1
tongjilm1年前1 -
 以大本营基 共回答了23个问题
以大本营基 共回答了23个问题 |采纳率91.3%1年前查看全部
- 某温度下,在一容积可变的容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2m
某温度下,在一容积可变的容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A. 均减半
B. 均加倍
C. 均增加1mol
D. 均减少1mol cottoncandance1年前2
cottoncandance1年前2 -
 wayin_jwy 共回答了21个问题
wayin_jwy 共回答了21个问题 |采纳率85.7%解题思路:在容积可变的情况下,从对平衡混合物中三者的物质的量对各物质的量的浓度影响角度思考.在“均减半”或“均加培”时,相当于A、B、C三物质的浓度都没有改变,“均增加1mol”时相当于A、C物质的浓度减小,B物质的浓度增大,“均减小1mol”时相当于A、C物质的浓度增大,B物质的浓度减小.A、由于是在容积可变的容器中,则在“均减半”相当于A、B、C三物质的浓度都没有改变,平衡不会移动,故A、错误;
B、由于是在容积可变的容器中,则在“均加培”相当于A、B、C三物质的浓度都没有改变,平衡不会移动,故B错误;
C、同样由于容积可变,“均增加1mol”时相当于A、C物质的浓度减小,B物质的浓度增大,平衡向右移动,故C正确;
D、“均减小1mol”时相当于A、C物质的浓度增大,B物质的浓度减小,平衡向左移动,故D错误;
故选:C.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查化学平衡移动,要注意的是基本概念、基础理论是高考中不变的一个重点.这道题的设问别具一格,解答时既要定性判断、又要定量分析,多次灵活转换,都值得大家研究,思维转化是解答该题的关键.1年前查看全部
- 某温度下,在一容积可变的容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2m
某温度下,在一容积可变的容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A. 均减半
B. 均加倍
C. 均增加1mol
D. 均减少1mol 伍员外1年前2
伍员外1年前2 -
 mnyx879 共回答了17个问题
mnyx879 共回答了17个问题 |采纳率94.1%解题思路:在容积可变的情况下,从对平衡混合物中三者的物质的量对各物质的量的浓度影响角度思考.在“均减半”或“均加培”时,相当于A、B、C三物质的浓度都没有改变,“均增加1mol”时相当于A、C物质的浓度减小,B物质的浓度增大,“均减小1mol”时相当于A、C物质的浓度增大,B物质的浓度减小.A、由于是在容积可变的容器中,则在“均减半”相当于A、B、C三物质的浓度都没有改变,平衡不会移动,故A、错误;
B、由于是在容积可变的容器中,则在“均加培”相当于A、B、C三物质的浓度都没有改变,平衡不会移动,故B错误;
C、同样由于容积可变,“均增加1mol”时相当于A、C物质的浓度减小,B物质的浓度增大,平衡向右移动,故C正确;
D、“均减小1mol”时相当于A、C物质的浓度增大,B物质的浓度减小,平衡向左移动,故D错误;
故选:C.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查化学平衡移动,要注意的是基本概念、基础理论是高考中不变的一个重点.这道题的设问别具一格,解答时既要定性判断、又要定量分析,多次灵活转换,都值得大家研究,思维转化是解答该题的关键.1年前查看全部
- 有一可逆反应2A(g)+3B(g)→←xC(g)+4D(g),若被下列两种
有一可逆反应2A(g)+3B(g)→←xC(g)+4D(g),若被下列两种
配比在同温同体积的密闭容器中发生反应①0.4molA 1.2molB 1.2molC 2.4molD②1.0molA 2.1molB 0.6molC 1.2molD
达到平衡后C的质量分数相等.求x的值
有点晕
我不要这样一个一个的排除 上帝的表姐1年前1
上帝的表姐1年前1 -
 排骨牛 共回答了15个问题
排骨牛 共回答了15个问题 |采纳率100%达到平衡后C的质量分数相等--即是等效平衡或者是等同平衡
对反应,2A(g)+3B(g)→←xC(g)+4D(g),
若x=1,即前后气体体积不变,那么只要符合倒向一方,成比例,即为等效平衡
①0.4molA 1.2molB 1.2molC 2.4molD
倒向左边,即是1.6molA 3molB 0.6molC 0molD
②1.0molA 2.1molB 0.6molC 1.2molD
倒向左边,即是1.6molA 3molB 0.3molC 0molD
可见,不完全成比例,所以不符合
若x不等于1,即前后气体体积变化了,那么就要符合倒向一方,完全想通过,即为等同平衡
①0.4molA 1.2molB 1.2molC 2.4molD
②1.0molA 2.1molB 0.6molC 1.2molD
变化:0.6molA 0.9molB 0.6molC 1.2molD
即为,2:3:2:4
所以x=21年前查看全部
- 某温度下,在一容积可变的容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2m
某温度下,在一容积可变的容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A. 均减半
B. 均加倍
C. 均增加1mol
D. 均减少1mol xiaoxiao851年前1
xiaoxiao851年前1 -
 youngniu 共回答了18个问题
youngniu 共回答了18个问题 |采纳率94.4%解题思路:在容积可变的情况下,从对平衡混合物中三者的物质的量对各物质的量的浓度影响角度思考.在“均减半”或“均加培”时,相当于A、B、C三物质的浓度都没有改变,“均增加1mol”时相当于A、C物质的浓度减小,B物质的浓度增大,“均减小1mol”时相当于A、C物质的浓度增大,B物质的浓度减小.A、由于是在容积可变的容器中,则在“均减半”相当于A、B、C三物质的浓度都没有改变,平衡不会移动,故A、错误;
B、由于是在容积可变的容器中,则在“均加培”相当于A、B、C三物质的浓度都没有改变,平衡不会移动,故B错误;
C、同样由于容积可变,“均增加1mol”时相当于A、C物质的浓度减小,B物质的浓度增大,平衡向右移动,故C正确;
D、“均减小1mol”时相当于A、C物质的浓度增大,B物质的浓度减小,平衡向左移动,故D错误;
故选:C.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查化学平衡移动,要注意的是基本概念、基础理论是高考中不变的一个重点.这道题的设问别具一格,解答时既要定性判断、又要定量分析,多次灵活转换,都值得大家研究,思维转化是解答该题的关键.1年前查看全部
- 将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(
将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g)⇌2C(g)△H<0,4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L,下列说法中正确的是( )
A.反应过程中,当A、B、C的物质的量浓度之比为2:1:2时,反应即达到平衡状态
B.达平衡后若升高温度,C的浓度将增大
C.达平衡后若增大压强,A的转化率降低
D.4 s内用物质B表示的反应速率为0.075 mol/(L•s) vv261年前1
vv261年前1 -
 水柔心 共回答了24个问题
水柔心 共回答了24个问题 |采纳率87.5%解题思路:A、当同一物质的正逆反应速率相等时,该反应达到平衡状态.
B、升高温度平衡向吸热方向移动,从而确定C的浓度变化;
C、增大压强平衡向气体体积减小的方向移动,从而确定A的转化率变化.
D、先计算C的反应速率,再根据同一化学反应中同一时间段内各物质的反应速率之比等于计量数之比计算B的反应速率.A、反应过程中,当A、B、C的物质的量浓度之比为 2:1:2时,反应不一定达到平衡状态,这与反应物的浓度及其转化率有关,故A错误.
B、该反应是一个正反应是放热的反应,升高温度平衡向逆反应方向移动,所以C的浓度将减小,故B错误;
C、该反应是一个反应前后气体体积减小的化学反应,增大压强平衡向正反应方向移动,导致A的转化率增大,故C错误.
D、C的浓度为0.6mol•L-1,则C的反应速率是0.15mol/L.s,同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以B的反应速率是0.075 mol•L-1•S-1,故D正确.
故选D.点评:
本题考点: 化学平衡的影响因素;化学平衡建立的过程.
考点点评: 本题考查了化学平衡状态的判断及外界条件对化学平衡的影响,难度不大,注意反应达到平衡状态时,正逆反应速率相等但不等于0.1年前查看全部
- 将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(
将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g)⇌2C(g)△H<0,4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L,下列说法中正确的是( )
A.反应过程中,当A、B、C的物质的量浓度之比为2:1:2时,反应即达到平衡状态
B.4 s内用物质B表示的反应速率为0.075 mol/(L•s)
C.达平衡后若增大压强,A的转化率增大
D.达平衡后若升高温度,C的浓度将增大 pyzl20051年前1
pyzl20051年前1 -
 zxq8425 共回答了18个问题
zxq8425 共回答了18个问题 |采纳率83.3%解题思路:A、当同一物质的正逆反应速率相等时,该反应达到平衡状态.
B、先计算C的反应速率,再根据同一化学反应中同一时间段内各物质的反应速率之比等于计量数之比计算B的反应速率.
C、增大压强平衡向气体体积减小的方向移动,从而确定A的转化率变化.
D、升高温度平衡向吸热方向移动,从而确定C的浓度变化.A、反应过程中,当A、B、C的物质的量浓度之比为 2:1:2时,反应不一定达到平衡状态,这与反应物的浓度及其转化率有关,故A错误.
B、C的浓度为0.6mol•L-1,则C的反应速率是0.15mol/L.s,同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以B的反应速率是0.075 mol•L-1•S-1,故B正确.
C、该反应是一个反应前后气体体积减小的化学反应,增大压强平衡向正反应方向移动,导致A的转化率增大,故C正确.
D、该反应是一个正反应是放热的反应,升高温度平衡向逆反应方向移动,所以C的浓度将减小,故D错误.
故选BC.点评:
本题考点: 化学平衡的影响因素;化学平衡建立的过程.
考点点评: 本题考查了化学平衡状态的判断及外界条件对化学平衡的影响,难度不大,注意反应达到平衡状态时,正逆反应速率相等但不等于0.1年前查看全部
- 某温度下,在一容积可变的容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2m
某温度下,在一容积可变的容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A. 均减半
B. 均加倍
C. 均增加1mol
D. 均减少1mol 天香文化局1年前1
天香文化局1年前1 -
 爱的清风 共回答了23个问题
爱的清风 共回答了23个问题 |采纳率82.6%解题思路:在容积可变的情况下,从对平衡混合物中三者的物质的量对各物质的量的浓度影响角度思考.在“均减半”或“均加培”时,相当于A、B、C三物质的浓度都没有改变,“均增加1mol”时相当于A、C物质的浓度减小,B物质的浓度增大,“均减小1mol”时相当于A、C物质的浓度增大,B物质的浓度减小.A、由于是在容积可变的容器中,则在“均减半”相当于A、B、C三物质的浓度都没有改变,平衡不会移动,故A、错误;
B、由于是在容积可变的容器中,则在“均加培”相当于A、B、C三物质的浓度都没有改变,平衡不会移动,故B错误;
C、同样由于容积可变,“均增加1mol”时相当于A、C物质的浓度减小,B物质的浓度增大,平衡向右移动,故C正确;
D、“均减小1mol”时相当于A、C物质的浓度增大,B物质的浓度减小,平衡向左移动,故D错误;
故选:C.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查化学平衡移动,要注意的是基本概念、基础理论是高考中不变的一个重点.这道题的设问别具一格,解答时既要定性判断、又要定量分析,多次灵活转换,都值得大家研究,思维转化是解答该题的关键.1年前查看全部
- 某温度下,在一容积可变的容器中,反应2A(g)+B(g)2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2
某温度下,在一容积可变的容器中,反应2a(g)+b(g)2c(g)达到平衡时,a、b和c的物质的量分别为4 mol、2 mol、和4 mol.保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,可使平衡右移的是:
a、均减半 b、均加倍 c、均增加1 mol d、均减少1 mol
关于这道题我有个疑问
对于c选项 ,加入一摩以后 为 5 3 5 ,如果用***则是10 5.5 0 平衡时是 8 4 0 ,为什么考虑b增多了0.5 而不考虑a减少了0.5 还有,为什么要用*** 而不直接用 5 3 5比较呢?比较时为甚么不考虑a c减少,而考虑b增多呢? 一不留神啊1年前1
一不留神啊1年前1 -
 小香米1207 共回答了18个问题
小香米1207 共回答了18个问题 |采纳率72.2%选C.
这道题目中A和B里面的均减半和均加倍其实还是保持相对的平衡状态,所以AB就不用考虑了.C和D里面一个是均增加1 mol,一个是均减少1 mol,平衡状态下是2:1:2,即1:0.5:1,这样子C和D就打破了平衡状态了,有一个是向平衡左移另一个则是向平衡右移的.C里面均增加1 mol,则左边的还有多余的物质的量就会继续向右进行化学反应,即向平衡右移最后达到另一个相对的量.反之亦然,D里面均减少1 mol,最后也会继续向左进行化学反应,即向平衡左移最后达到另一个相对的量.1年前查看全部
- 某温度下,在一容积可变的容器中,反应2A(g)+B(g)2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mo
某温度下,在一容积可变的容器中,反应2A(g)+B(g)2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是……( )
A、均减半 B、均加倍 C、均增加1mol D、均减少1mol
容积可变说明压强不变,只要比例不变,平衡位置不变比如
A、均减半 B、均加倍
平衡都为移动
C、均增加1mol
(相当于都变为1.25倍时没影响的基础上,再加入0.5molB,可使平衡右移)
D、均减少1mol
(相当于都变为0.75倍时没影响的基础上,再减少0.5molB,可使平衡左移)
选:C
恒温恒压下,反应平衡时,C选项 增加1mol后 物质的量分别 5:3:5 ,我把生成物都推回反应物 就是10:5.5:0 原平衡起始投料相当于 8:4:0 尽管达不到原平衡,但明显B多了 应该平衡向右移动,同样分析D选项,减少1mol,3:1:3
生成物推回反应物 6:2.5:0 也应该向右移动啊.我的想法哪里出错了呢?
还有一个问题 恒温恒压 对于反应2SO32SO2+O2 达平衡时,多加入SO3,SO3物质的量增加,总体积也在增加,那怎么判断SO3 的浓度到底是增大还是减小呢?平衡向哪儿移动呢? qhhwh1年前4
qhhwh1年前4 -
 baitiandeai 共回答了21个问题
baitiandeai 共回答了21个问题 |采纳率90.5%楼主,你D的想法错在全反推为反应物,这样导致的结果就是反应物肯定有过量的,看上去平衡就该右移.
实际上这类题目应该看物质增减后实际上平衡左右两边那边过量(或缺少).本题中D均减少1mol后,按照系数比例是物质B被取走过多而影响平衡所以为了缓解物质B的缺失平衡要向左移动.
加入SO3平衡向右是肯定的了.SO3的浓度也是在增大的,化学反应的平衡可以理解为就是缓解物质浓度的变化,不可能消除,所以SO3浓度还是增加的.
不是教师,表达能力有限,敲字慢,又不好表达.见谅!
不懂继续追问.1年前查看全部
- 在可逆反应2A(g)+3B(g)⇌xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率
在可逆反应2A(g)+3B(g)⇌xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L•min),2min后,测得D的浓度为0.5mol/L.则关于此反应的下列说法中正确的是( )
A.2min末时,A和B的浓度之比为5:3
B.x=1
C.2min末时,B的浓度为1.5mol/L
D.2min末时,A的消耗浓度为0.5mol/L 爱玩火的木头1年前1
爱玩火的木头1年前1 -
 亚伯拉罕 共回答了25个问题
亚伯拉罕 共回答了25个问题 |采纳率96%解题思路:根据化学反应速率之比等于系数之比,结合化学反应的三行式:初始浓度、变化浓度、末态浓度进行计算即可,化学反应速率v=[△c/△t].2A(g)+3B(g)⇌xC(g)+D(g)
初始浓度(mol/L) 5 3 0 0
转化浓度(mol/L) 1 1.50.5x 0.5
2min浓度(mol/L) 4 1.5 0.5x 0.5
A、2min末时,A和B的浓度之比为4:1.5=8:3,故A错误;
B、C的反应速率为[0.5x/2min]mol/L=0.5mol/(L•min),解得x=2,故B错误;
C、2min末时,B的浓度为1.5mol/L,故C正确;
D、2min末时,A的消耗浓度为1mol/L,故D错误.
故选C.点评:
本题考点: 化学平衡建立的过程.
考点点评: 本题考查学生有关化学平衡和化学反应速率的有关计算知识,属于考查的重点内容,注意三行式在解题中的灵活应用,难度不大.1年前查看全部
- 容积固定的密闭容器中,达平衡的可逆反应2A(g)⇌2B+C (△H>0),若随着温度升高,气体平均相对分子质量
容积固定的密闭容器中,达平衡的可逆反应2A(g)⇌2B+C (△H>0),若随着温度升高,气体平均相对分子质量减小,则下列判断正确的是( )
A. B和C可能都是液体
B. B和C肯定都是气体
C. B和C可能都是固体
D. 若C为固体,则B一定是气体 青鸟雨1年前3
青鸟雨1年前3 -
 990420 共回答了21个问题
990420 共回答了21个问题 |采纳率81%解题思路:反应是吸热反应,升温平衡正向进行,气体平均相对分子质量=[气体总质量/总物质的量];依据概念中的气体质量、气体物质的量分析判断.3A(g)⇌3B(?)+C(?)(△H>0),该正反应吸热,温度升高,平衡右移,
.
M变小,依据反应的系数关系,气体平衡体系的质量守恒,平均摩尔质量的变化,由反应前后气体物质的量变化、混合气体的质量变化决定;
A、B和C肯定不会都是液体,若都是液体,气体物质的量减小,质量减小,这里面的气体就只有A,所以气体的平均相对分子质量就是A的相对分子质量,所以气体平均相对分子质量
.
M不会发生变化,不变,故A错误;
B、若都是气体,反应前后气体物质的量一定增大,质量不变,
.
M减小,但若B为气体,C为固体,反应前后气体物质的量不变,气体质量减小,
.
M减小,故B错误;
C、B和C肯定不会都是固体,若都是固体,气体物质的量减小,质量减小,这里面的气体就只有A,所以气体的平均相对分子质量就是A的相对分子质量,所以气体平均相对分子质量
.
M不会发生变化,不变,故C错误;
D、C为固体,B一定为气体,反应前后气体物质的量不变,气体质量减小,
.
M减小,故D正确;
故选D.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查了化学平衡的影响因素的分析判断,主要考查气体摩尔质量的变化与物质状态的关系,气体质量变化、气体物质的量变化是解题关键,题目难度中等.1年前查看全部
- 已知反应2A-+C2==2C-+A2,2C-+B2==2B-+C2,2D-+C2==2C-+D2,由此可以推断反应物D2
已知反应2A-+C2==2C-+A2,2C-+B2==2B-+C2,2D-+C2==2C-+D2,由此可以推断反应物D2 和B2的关系正确的是()
A.B-能被D2置换成B2 B.D-不能被
B2 氧化
C.氧化性B2>D2 D.还原性B- >D-
请问为什么选C? 风间火舞1年前1
风间火舞1年前1 -
 卞老二 共回答了19个问题
卞老二 共回答了19个问题 |采纳率100%2A-+C2==2C-+A2,氧化性C2>A2,还原性A->C-,A-可以被C2氧化成A2
2C-+B2==2B-+C2,氧化性B2>C2,还原性C->B-,C-可以被B2氧化成C2
2D-+C2==2C-+D2,氧化性C2>D2,还原性D->C-,D-可以被C2氧化成D2
所以:
D-能被B2置换成D2 ,还原性D->B-,
C.氧化性B2>D21年前查看全部
- 相同容积的四个密闭容器中,进行同样的可逆反应2A(g)+B(g)=3C(g)+2D(g) 相同容积的四个密闭容器中,进行
相同容积的四个密闭容器中,进行同样的可逆反应2A(g)+B(g)=3C(g)+2D(g) 相同容积的四个密闭容器中,进行同样的可逆反应:
2A(g)+B(g)=3C(g)+2D(g).起始时四个容器所装A,B的物质的量分别为下所示,
甲 乙 丙 丁
A 2 1 2 1
B 1 1 2 2
则A,B转化率由小到大分别是什么
解析:
此题考查的知识点是反应物的数值对转化率大小的影响.我们可以以乙、丙为基准,先比较它们两组A、B转化率的大小,再与甲、乙两组比较.丙组的A、B都为乙组的两倍,两容器的容积相同,所以丙容器的压强比乙容器的压强大,此反应正方向为气体体积增大的反应,压强大则化学平衡向逆反应方向移动,所以丙组的A、B的转化率都比乙组的小.
将甲组和乙组相比,B相同,A物质甲组比乙组多1mol,可看作甲组为在乙组的基础上增加了1molA,我们知道:增加A物质的量,其他反应物如B的转化率增大,A本身的转化率减小.所以A的转化率甲乙 .
同理,丙组与甲组相比,A相同,B物质丙组比甲组多1mol,所以A的转化率甲丙.乙组与丁组相比,A相同,B物质丁组比乙组要多1mol,所以A的转化率乙丁.丙组与丁组相比,B相同,A物质丙组比丁组多1mol,所以A的转化率丙丁.
通过以上比较可得出结论:A的转化率甲丁.
比较乙丙我能看懂 但是比较甲乙的时候 为什么不考虑压强影响了呢?求解…… oye781年前1
oye781年前1 -
 halfmoon0802 共回答了21个问题
halfmoon0802 共回答了21个问题 |采纳率81%外界变化大 平衡移动小1年前查看全部
- 将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应2A(气)+B(气)
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应2A(气)+B(气)⇌2C(气),若经2秒后测得C的浓度为0.6mol•L-1,现有下列几种说法:
①用物质A表示反应的平均速率为0.3mol•L-1•s-1
②用物质B表示的反应的平均速率为0.6mol•L-1•s-1
③2s时物质A的转化率为30%
④2s时物质B的浓度为1.4mol•L-1,其中正确的是( )
A.①④
B.①③
C.②③
D.③④ 绿茶香香1年前1
绿茶香香1年前1 -
 卿狂为我 共回答了8个问题
卿狂为我 共回答了8个问题 |采纳率87.5%解题思路:①根据v=[△c/△t]计算v(C),再根据速率之比等于化学计量数之比计算v(A);
②根据v=[△c/△t]计算v(C),再根据速率之比等于化学计量数之比计算v(B);
③根据浓度变化量之比等于化学计量数之比计算△n(A),进而计算△n(A),根据转化率定义计算;
④根据浓度变化量之比等于化学计量数之比计算△c(B),2s时物质B的浓度=B的起始浓度-△c(B).①v(C)=[0.6mol/L/2s]=0.3mol•L-1•s-1,速率之比等于化学计量数之比,故v(A)=v(C)=0.3mol•L-1•s-1,故①正确;
②v(C)=[0.6mol/L/2s]=0.3mol•L-1•s-1,速率之比等于化学计量数之比,故v(B)=[1/2]v(C)=[1/2]×0.3mol•L-1•s-1=0.15mol•L-1•s-1,故②错误;
③根据方程式可知,△c(A)=△n(C)=0.6mol•L-1,故△n(A)=0.6mol•L-1×2L=1.2mol,故A的转化率=[1.2mol/4mol]×100%=30%,故③正确;
④根据浓度变化量之比等于化学计量数之比计算△c(B)=[1/2]△c(A)=[1/2]×0.6mol•L-1=0.3mol•L-1,2s时物质B的浓度=[2mol/2L]-0.3mol•L-1=0.7mol•L-1,故④错误;
故选B.点评:
本题考点: 化学平衡建立的过程;化学反应速率和化学计量数的关系.
考点点评: 本题考查化学反应速率及化学平衡的有关计算,比较基础,注意对基础知识的理解掌握.1年前查看全部
- 在恒温恒容下发生如下反应2A(g)+2B(g)可逆C(g)+2D(g),现从两条途径分别建立平衡.途径1;A ,B的起始
在恒温恒容下发生如下反应2A(g)+2B(g)可逆C(g)+2D(g),现从两条途径分别建立平衡.途径1;A ,B的起始浓度
2mol/L ; 途径2; C,D 的起始浓度分别为2mol/L和6mol/L 现在请问 两条途径最终达到平衡时 ,体系内各组分的百分含量相同 这句话对吗
这句话 为什么对 小羊cutesheep1年前4
小羊cutesheep1年前4 -
 wbabaa 共回答了19个问题
wbabaa 共回答了19个问题 |采纳率89.5%不对.
假设途径1完全反应,则为C:1mol/LD:2mol/L和途径2不相同1年前查看全部
- 已知反应2A(g)+B(g)2C(g)现将6mol/L的A与一定量的b加入某固定容器中,经过2s后测得容器中含B 2mo
已知反应2A(g)+B(g)2C(g)现将6mol/L的A与一定量的b加入某固定容器中,经过2s后测得容器中含B 2mol/L含c 1mol,求V(A);反应后A的浓度
 寻找CC1年前1
寻找CC1年前1 -
 柔少爷 共回答了23个问题
柔少爷 共回答了23个问题 |采纳率95.7%2A(g)+B(g)= 2C(g)
起始 6 2.5 0
转化 1 0.5 1
2s后 5 2 1
V(A)=1/2=0.5mol/(L.s);
反应后A的浓度=6-1=5mol/L.
1年前查看全部
- 某温度下,在一容积可变的容器中,反应2A(g)+B(g)2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mo
某温度下,在一容积可变的容器中,反应2A(g)+B(g)<==>2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是……( )
A、均减半 B、均加倍 C、均增加1mol D、均减少1mol 落花飞烟1年前3
落花飞烟1年前3 -
 谢毓祯 共回答了19个问题
谢毓祯 共回答了19个问题 |采纳率100%由于是在容积可变的容器中,所以在“均减半”或“均加培”时,相当于A、B、C三物质的浓度都没有改变,平衡不会移动.同样由于容积可变,“均增加1mol”时相当于A、C物质的浓度减小,B物质的浓度增大,平衡向右移动;“均减小1mol”时相当于A、C物质的浓度增大,B物质的浓度减小,平衡向左移动.答案选C.
要注意的是,基本概念、基础理论是高考中不变的一个重点.这道题的设问别具一格,解答时既要定性判断、又要定量分析,多次灵活转换,都值得大家研究.1年前查看全部
- 某温度下,在一容积可变的容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2m
某温度下,在一容积可变的容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A. 均减半
B. 均加倍
C. 均增加1mol
D. 均减少1mol 我CJ的飘过1年前1
我CJ的飘过1年前1 -
 浪漫的鞋拔子 共回答了19个问题
浪漫的鞋拔子 共回答了19个问题 |采纳率73.7%解题思路:在容积可变的情况下,从对平衡混合物中三者的物质的量对各物质的量的浓度影响角度思考.在“均减半”或“均加培”时,相当于A、B、C三物质的浓度都没有改变,“均增加1mol”时相当于A、C物质的浓度减小,B物质的浓度增大,“均减小1mol”时相当于A、C物质的浓度增大,B物质的浓度减小.A、由于是在容积可变的容器中,则在“均减半”相当于A、B、C三物质的浓度都没有改变,平衡不会移动,故A、错误;
B、由于是在容积可变的容器中,则在“均加培”相当于A、B、C三物质的浓度都没有改变,平衡不会移动,故B错误;
C、同样由于容积可变,“均增加1mol”时相当于A、C物质的浓度减小,B物质的浓度增大,平衡向右移动,故C正确;
D、“均减小1mol”时相当于A、C物质的浓度增大,B物质的浓度减小,平衡向左移动,故D错误;
故选:C.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查化学平衡移动,要注意的是基本概念、基础理论是高考中不变的一个重点.这道题的设问别具一格,解答时既要定性判断、又要定量分析,多次灵活转换,都值得大家研究,思维转化是解答该题的关键.1年前查看全部
大家在问
- 1由铜、锌和稀硫酸组成的原电池中,
- 2甲、乙两车间人数的比是7:4.现在甲车间调15人到乙车间,两车间人数相等.甲、乙两车间原来各有多少
- 3(2014•威海)将下列多项式分解因式,结果中不含因式x-1的是( )
- 4用塑料代替木头有什么优点?有什么不足?
- 5brother's 与brothers' 的区别
- 6越国以鄙远的 鄙和远 的用法
- 7他们说上山容易下山难对吗?
- 8Mr.Brown is buys.He wors very long h___ every day.根据首字母填空
- 9俄罗斯地跨亚欧两大洲,回答26~33题.
- 10如图,A、E是半圆周上的两个三等分点,直径Bc=3,AD垂直BC,垂足为D,BE与AD相交于F,则AF的长为_
- 11"好大的雨啊." 英语怎么说?1.好的的雨啊...2.别忘记带伞/ 出门别忘记带伞3.我会成功/ 你会失败
- 12一.已知f(1-x/1+x)=1-x²/1+x²,则f(x)的解析式为?
- 13a的负二次方等于多少?那4的负一次方呢?
- 14她在我心中是最美的 翻译英文
- 15英语翻译在你们学校举行什么活动?What ( ) do you ( ) in your school?