Na+,Cl-,Mg2+,Ca2+,SO4 2- 除杂 剩Na+ Cl-
 碧月羞花2022-10-04 11:39:541条回答
碧月羞花2022-10-04 11:39:541条回答
Na+,Cl-,Mg2+,Ca2+,SO4 2- 除杂 剩Na+ Cl-
加4次溶液,标明适量过量,多1个方案加十分
加4次溶液,标明适量过量,多1个方案加十分

已提交,审核后显示!提交回复
共1条回复
 luotaosky 共回答了14个问题
luotaosky 共回答了14个问题 |采纳率100%- 第一加过量的氯化钡,沉淀硫酸根离子.第二步加氢氧化钠,沉淀镁离子.第三加过量的碳酸钠溶液,沉淀多余的钡离子和已经存在的钙离子.第四次加适量的盐酸,出去多余的碳酸钠.
只要记住出去离子的顺序是:先硫酸根离子(一般用钡盐),然后除去多余的钡离子,最后是除去镁离子,钙离子(这两者可以颠倒顺序的,出去镁离子用碱比较好,也还是可以用碳酸钠的),最后除去添加多余的离子.你按照这个方案去思考问题吧,可以弄出几套方案的. - 1年前
相关推荐
- SiO32-,Na+,NO3-,K+
SiO32-,Na+,NO3-,K+
Na+,SO42-,SiO32-,H+
这两组离子哪一组可以大量共存 梦里有她的1年前3
梦里有她的1年前3 -
 snki314 共回答了17个问题
snki314 共回答了17个问题 |采纳率100%上面的 下面的SiO32-,H+会生成H2SiO31年前查看全部
- (2009•珠海二模)江苏有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-
(2009•珠海二模)江苏有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子.合理利用资源和保护环境是我省可持续发展的重要保证.
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料.试写出由无水氯化镁制取金属镁的化学反应方程式MgCl2
Mg+Cl2↑电解 MgCl2.
Mg+Cl2↑电解
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水.排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入______(选填“Na2S”或“NaOH”)效果更好.
(3)火力发电在江苏的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图:难溶电解质 Cu(OH)2 CuS Pb(OH)2 PbS Ksp 4.8×10-20 6.3×10-36 1.2×10-15 1.0×10-28 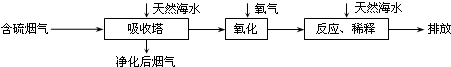
①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因______(任写一个).
②某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图.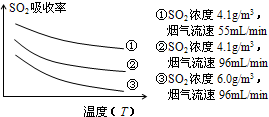
请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议:______.
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是______(任写一个化学方程式或离子方程式).氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是______. luchengbo1年前1
luchengbo1年前1 -
 幸运红星 共回答了15个问题
幸运红星 共回答了15个问题 |采纳率80%解题思路:(1)由无水氯化镁制取金属镁的化学反应方程式 MgCl2
Mg+Cl2↑;通电 .
(2)根据题目中所给难溶电解质的Ksp,可知Cu2+和Pb2+的硫化物Ksp更小,更难溶;
(3)①考察了强碱弱酸盐的水解反应的方程式的书写;
②根据图示可知:SO2的吸收效率随着温度的升高而降低,随流速的增大而降低,
③H2SO3或HSO3-中的S显+4价,均可被O2氧化生成H++SO42-,酸性会大大增强,氧化后的“海水”需要引入大量的显碱性的海水与之混合后才能排放,主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+).(1)由无水氯化镁制取金属镁的化学反应方程式 MgCl2
通电
.
Mg+Cl2↑,
故答案为:MgCl2
通电
.
Mg+Cl2↑;
(2)根据题目中所给难溶电解质的Ksp,可知Cu2+和Pb2+的硫化物Ksp更小,更难溶;所以用Na2S除去污水中的Cu2+和Pb2+效果更好,
故答案为:Na2S;
(3)①天然海水的pH≈8,是因为海水中有CO32-或HCO3-+它们水解使海水呈弱碱性,其离子方程式为CO32-+H2O⇌HCO3-+OH-或 HCO3-+H2O⇌H2CO3+OH-,故答案为:CO32-+H2O⇌HCO3-+OH-或 HCO3-+H2O⇌H2CO3+OH-;
②根据图示可知:SO2的吸收效率随着温度的升高而降低,随流速的增大而降低,所以要提高含硫烟气中SO2的吸收效率,可以降低含硫烟气温度(或流速),
故答案为:降低含硫烟气温度(或流速);
③H2SO3或HSO3-中的S显+4价,均可被O2氧化生成H++SO42-,酸性会大大增强,氧化后的“海水”需要引入大量的显碱性的海水与之混合后才能排放,主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+),
故答案为:2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42-;中和、稀释经氧气氧化后海水中生成的酸(H+).点评:
本题考点: 海水资源及其综合利用;难溶电解质的溶解平衡及沉淀转化的本质;二氧化硫的污染及治理;物质的分离、提纯和除杂.
考点点评: 本题考查了方程式的书写,氧化还原反应,沉淀溶解平衡,盐类水解等,难度不大,但综合性较强.1年前查看全部
- Zn+H2SO4=== Na+HCL==== AL+HCL=== Fe+H2SO4===== Mg
Zn+H2SO4=== Na+HCL==== AL+HCL=== Fe+H2SO4===== Mg
Zn+H2SO4=== Na+HCL==== AL+HCL=== Fe+H2SO4 thng1年前1
thng1年前1 -
 我爱罗爱孔雀 共回答了28个问题
我爱罗爱孔雀 共回答了28个问题 |采纳率96.4%Zn+H2SO4→ZnSO4+H2↑
2Na+2HCl→2NaCl+H2↑
2Al+6HCl→2AlCl3+3H2↑
Fe+H2SO4→FeSO4+H2↑
Mg+H2SO4→MgSO4+H2↑
Fe+CuSO4→FeSO4+Cu↓
Cu+2AgNO3→Cu(NO3)2+2Ag↓
2Al+3CuSO4→Al2(SO4)3+3Cu↓1年前查看全部
- Na+CuSO4+H2O=?
 panziyu1年前3
panziyu1年前3 -
 bqss30abm0_f_d2 共回答了13个问题
bqss30abm0_f_d2 共回答了13个问题 |采纳率76.9%分步反应式为
2Na+2H2O=2NaOH+H2[气体]
2NaOH+CuSO4=Cu(OH)2[沉淀]+Na2SO4
总反应式为
2Na+2H2O+CuSO4=H2[气体]+Cu(OH)2[沉淀]+Na2SO41年前查看全部
- Na+,K-,cl-,CO32-,SO32-,SO42-,HCO3-
Na+,K-,cl-,CO32-,SO32-,SO42-,HCO3-
加入一下试剂,浓度减小的有?
稀HCl ——
稀NaOH ——
HCl,BaCl——
AgNO3—— 470488821年前1
470488821年前1 -
 pqxzl 共回答了22个问题
pqxzl 共回答了22个问题 |采纳率90.9%稀HCl CO32- SO32- HCO3- 均变成气体
稀NaOH HCO3- 生成水
HCl,BaCl2 CO32- SO32- HCO3- 生成气体 SO42- 生成沉淀
AgNO3 Cl- CO32- SO32- SO42- HCO3- 均生成沉淀1年前查看全部
- Na+)=2(CO3-)+2(HCO3)+2(H2CO3)
Na+)=2(CO3-)+2(HCO3)+2(H2CO3)
为什么2(HCO3)+2(H2CO3)系数都要二呢 不是只有CO3系数才2吗/ 和碳酸氢钠不一样 vetayyy1年前1
vetayyy1年前1 -
 120515892 共回答了18个问题
120515892 共回答了18个问题 |采纳率88.9%这个是元素守恒,原来溶质是Na2CO3吧,物质的量比Na:C=2:1,等式左边是Na的物质的量,右边是C的物质的量1年前查看全部
- A、K+、Na+、AlO2-、NO3- B、Na+、K+、NO3-、HSO4-
A、K+、Na+、AlO2-、NO3- B、Na+、K+、NO3-、HSO4-
选什么?要满足能在强碱中大量共存,幷是无色透明的.简要分析一下, 亲爱的吃饭了没有1年前3
亲爱的吃饭了没有1年前3 -
 ltman2002 共回答了18个问题
ltman2002 共回答了18个问题 |采纳率88.9%A.
B选项中的硫酸氢根离子会与碱反应,所有不能大量存在于强碱种.两种都是无色透明的.1年前查看全部
大家在问
- 1水蒸气通过灼热的焦炭所产生的CO和H的混合气体叫水煤气.所制得的水煤气中还含有CO2和水蒸气.请请选择以下装置设计实验,
- 2.我国交流电的频率为50Hz,因此,打点计时器每隔0.02s打一个点.如下图所示为某次实验时打出的一条纸带.其中1,2,
- 3“电脑白痴”怎么说 用英语
- 4超然台记中心词苏轼《超然台记》的中心词是什么?“乐”还是“超然”?
- 5狼体内有A种蛋白质,20种氨基酸;兔体内有B种蛋白质,20种氨基酸.狼捕食兔后,狼体内的一个细胞中含有蛋白质种类和氨基酸
- 6建筑中“外窗有线角和无线角”是什么意思?线角是什么东西?
- 7Mike went back home (for) his wallet ,but he couldn't find i
- 8补画左视图和俯视图
- 9I suggestthat you shoot listen to English you songs more ___
- 10十七大报告指出“创新是一个民族进步的灵魂,是一个国家兴旺发达的不竭动力,也是一个政党永葆生机的源泉。”据此回
- 11有一个长方体,若用三种不同的方法切成两个完全一样的长方体,它们的表面积分别增加30平方厘米、20平方厘米、12平方厘米.
- 12如图两个斜面的倾角分别为37°和53°,在斜面顶点把两个小球以同样大小的初速度分别向左、向右水平抛出,小球都落在斜面上.
- 13提几个汉译英:1一个矮个子的售货员 2来学校/来上学 3 到这儿来4去那儿
- 14窗前遐想 作文
- 15我离亲朋好友太远了,她们帮助过我很多,想在朋友圈里说几句感谢的话可是写不出生动的词语来
