现用18.4mol•L-1的浓硫酸来配制500mL 0.2mol•L-1的稀硫酸,可供选择的仪器有:
 jfhk-20022022-10-04 11:39:541条回答
jfhk-20022022-10-04 11:39:541条回答①玻璃棒 ②烧杯 ③胶头滴管 ④量筒 ⑤托盘天平
(1)上述仪器在配制过程中不需要用到的是______.(填序号)除上述仪器外,尚缺最重要的仪器是______.
(2)计算所需浓硫酸的体积为______m L(保留1位小数).
(3)实验中用到玻璃棒,其作用分别是:______、______.
(4)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却.
其正确的操作顺序为:②→①→③→______→______→______→______→④(填序号)
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有______(填序号)
①定容时,仰视刻度线.
②未冷却至室温就转移到容量瓶中.
③容量瓶中含有少量蒸馏水.
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒.
⑤定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线.

已提交,审核后显示!提交回复
共1条回复
 云极 共回答了25个问题
云极 共回答了25个问题 |采纳率92%- 解题思路:(1)根据配制500mL 0.2mol•L-1的稀硫酸的仪器选择使用仪器,然后判断不需要的仪器及还缺少的仪器;
(2)根据溶液稀释过程中溶质读到物质的量不变计算出需要浓硫酸的体积;
(3)根据配制过程中玻璃棒的作用进行解答;
(4)根据配制一定物质的量浓度的溶液的步骤进行排序;
(5)根据c=[n/V]可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.(1)配制500mL 0.2mol•L-1的稀硫酸使用的仪器有:量筒、玻璃棒、烧杯、500mL容量瓶、胶头滴管,所以不需要的仪器为⑤托盘天平;还缺少的仪器为:
故答案为:⑤;500mL容量瓶;
(2)500mL 0.2mol•L-1的稀硫酸中含有溶质硫酸的物质的量为:0.2mol•L-1×0.5L=0.1mol,需要18.4mol•L-1的浓硫酸的体积为:[0.1mol/18.4mol/L]≈0.054L=5.4mL,
故答案为:5.4;
(3)配制一定物质的量浓度的溶液过程中,稀释浓硫酸时使用玻璃棒搅拌,加速稀释过程;转移溶液时使用玻璃棒引流,避免液体流到容量瓶外面,
故答案为:搅拌;引流;
(4)配制一定物质的量浓度的溶液步骤为:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,所以正确顺序为:②①③⑧⑤⑥⑦④,
故答案为:⑧;⑤;⑥;⑦;
(5)①定容时,仰视刻度线,导致加入的蒸馏水体积偏大,根据c=[n/V]可得,配制的溶液浓度偏低,故①正确;
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中,热的溶液体积偏大,冷却后溶液体积偏小,根据c=[n/V]可得,配制的溶液浓度偏高,故②错误;
③转移前,容量瓶中含有少量蒸馏水,对溶质的物质的量及溶液的体积没有影响,根据c=[n/V]可得,不影响配制结果,故③错误;
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒,导致配制的溶液中溶质的物质的量偏小,根据c=[n/V]可得,配制的溶液浓度偏低,故④正确;
⑤定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线,导致配制溶液的体积偏大,根据c=[n/V]可得,配制的溶液浓度偏低,故⑤正确;
故答案为:①④⑤.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了配制一定物质的量浓度的溶液的方法及完成分析,题目难度不大,要求学生熟练掌握配制一定物质的量浓度的方法,该题的难点在于误差分析,注意明确误差分析的方法,试题基础性强,贴近高考,该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力. - 1年前
相关推荐
- 用18.4mol•L -1 H 2 SO 4 配制成500mL 1mol•L -1 H 2 SO
用18.4mol•L -1 H 2 SO 4 配制成500mL 1mol•L -1 H 2 SO 4 溶液时,不需要用到的仪器是( ) A.玻璃棒 B.胶头滴管 C.托盘天平 D.500mL容量瓶  anleiy1年前1
anleiy1年前1 -
 海格斯 共回答了24个问题
海格斯 共回答了24个问题 |采纳率75%在用浓硫酸配制1mol/L硫酸溶液的实验中,一般用量筒量取浓硫酸,浓硫酸在烧杯中稀释并用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以使用的仪器有量筒、烧杯、玻璃棒、容量瓶、胶头滴管,不需要的仪器是托盘天平.
故选C.1年前查看全部
- 硫酸是一重要化学试剂.(1)实验时用18.4mol•L-1的浓硫酸,配制100mL 1mol•L-1
硫酸是一重要化学试剂.
(1)实验时用18.4mol•L-1的浓硫酸,配制100mL 1mol•L-1 H2SO4溶液,所需浓硫酸的体积为______.(计算结果精确到小数点后一位).
(2)下列操作中,容量瓶所具备的功能有______(填序号).
A.配制一定体积准确浓度的标准溶液
B.长期贮存溶液
C.用来溶解固体溶质
D.常用来代替量筒量取一定体积的液体
(3)在下列配制过程示意图中,有错误的是(填写序号)______.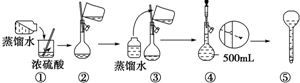
(4)下列说法正确的______.
A.洗涤烧杯2~3次,并将洗涤液移入容量瓶以减少误差
B.某同学将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低
C.定容时仰视观察,所配溶液浓度会偏低
D.容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液即可. xiayu60611年前1
xiayu60611年前1 -
 hzxy25 共回答了14个问题
hzxy25 共回答了14个问题 |采纳率100%解题思路:(1)根据浓硫酸在稀释前后,溶质的物质的量保持不变;
(2)容量瓶是配制一定体积准确浓度的标准溶液的定容仪器;
(3)稀释浓硫酸时是将浓硫酸倒入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散;读数时应平视;
(4)根据公式c=[n/V],可以根据影响n和V的因素来分析回答.(1)浓硫酸在稀释前后,溶质的物质的量保持不变,设所需浓硫酸最小体积为V,则100mL×10-3×1mol/L=18.4mol/L×V,解得V=5.4mL,故答案为:5.4 mL;
(2)容量瓶作为精密仪器不可用于储存和溶解,也不能测量除其规格以外容积的液体体积,故答案为:A;
(3)稀释浓硫酸时是将浓硫酸沿器壁倒入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散;读数时应平视,不能仰视和俯视,故答案为:①④;
(4)A.洗涤烧杯2~3次,并将洗涤液移入容量瓶,否则浓度偏小,故A正确;
B.未冷却体积偏小,浓度偏大,故B错误;
C.定容时仰视,体积偏大,浓度偏小,故C正确;
D.在瓶中放水到标线附近,塞紧瓶塞,使其倒立2min,用干滤纸片沿瓶口缝处检查,看有无水珠渗出.如果不漏,再把塞子旋转180°,塞紧,倒置,试验这个方向有无渗漏,故D错误.
故答案为:AC.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.1年前查看全部
- 4.已知98%的浓H2SO4的浓度为18.4mol•L—1,则49%的硫酸溶液的浓度为( )
4.已知98%的浓H2SO4的浓度为18.4mol•L—1,则49%的硫酸溶液的浓度为( )
A.9.2mol•L—1
B.大于9.2mol•L—1
C.小于9.2mol•L—1
D.不能确定
解析没看懂
解析:设98%硫酸的密度为d1g/cm3,49%硫酸的密度为d2g/cm3,则d1>d2,由溶液质量分数与物质的量溶度的换算关系式可知:18.4=1000×d1×98%/98,c=1000×d2×49%/98,则c=9.2× ,由d1>d2,得c Rainbow_0_01年前1
Rainbow_0_01年前1 -
 Anne831012 共回答了19个问题
Anne831012 共回答了19个问题 |采纳率89.5%我们从另一个角度来解析.如果把98%的浓硫酸稀释到50%那就是要加等质量的水,但是水的密度远小于浓硫酸,所以水的体积就需要很多,所以要稀释到原来的一半那溶液体积就是原来的两倍多.现物质的量不变体积变为原来的两倍多,自然物质的量浓度要小于9.2mol•L—1.1年前查看全部
- 为探究足量锌与18.4mol•L-1浓硫酸的反应,某研究小组进行如下实验.
为探究足量锌与18.4mol•L-1浓硫酸的反应,某研究小组进行如下实验.
反应生成物成分的定性探究
取65.0g锌粒与98%的浓H2SO4(ρ=1.84g•mL-1)110mL充分反应锌全部溶解,对于制得的气体,有同学认为可能混有杂质.
(1)研究小组所制得的气体中混有的主要杂质气体可能是______(填分子式).产生这种结果的主要原因是______(用化学方程式和必要的文字加以说明).
(2)为证实相关分析,化学小组的同学设计实验,组装了如下装置,对所制取的气体进行探究.
①装置C中加入的试剂______.装置D加入的试剂______.
②装置F加入的试剂______.U型管G的作用为______.
③有同学认为A、B间应增加图中的甲装置,该装置的作用为______.
④证明反应生成SO2和H2的实验现象是______. gudujianxjl1年前1
gudujianxjl1年前1 -
 明夜月光 共回答了17个问题
明夜月光 共回答了17个问题 |采纳率82.4%解题思路:(1)随着硫酸浓度降低,稀硫酸与锌反应生成氢气;
(2)A是制取气体的装置,制备的气体中有二氧化硫、氢气、水蒸汽,B装置是除去二氧化硫,可以用氢氧化钠等碱液吸收;C装置是检验二氧化硫是否除尽,D装置是浓硫酸,吸水干燥作用;E装置是用还原性气体还原氧化铜,F装置无水硫酸铜,检验是否有水生成;G是防止空气中H2O进入干燥管而影响杂质气体的检验.(1)随着硫酸浓度降低,稀硫酸与锌反应生成氢气,所以化学小组所制得的气体中混有的主要杂质气体可能是氢气,
故答案为:H2;随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2:Zn+H2SO4═ZnSO4+H2↑;
(2)①B装置是除去二氧化硫,可以用氢氧化钠等碱液吸收,也可以通过高锰酸钾溶液氧化除去;D装置是浓硫酸,吸水干燥作用,
故答案为:NaOH溶液(或KMnO4);浓硫酸;
②F装置无水硫酸铜,检验是否有水生成;G是防止空气中H2O进入干燥管而影响杂质气体的检验,
故答案为:无水硫酸铜;防止空气中H2O进入系统,干扰实验;
③A、B间应增加图中的甲装置,是为了防止B装置中的液体倒吸,
故答案为:防倒吸;
④C装置是检验二氧化硫,C中品红褪色,证明反应生成SO2;E装置是用还原性气体还原氧化铜,F装置无水硫酸铜,检验是否有水生成,只要黑色变红色,无水硫酸铜变蓝色,证明反应生成氢气;
故答案为:C中品红褪色,证明反应生成SO2;F中有红色物质生成且G中的无水硫酸铜变蓝,证明反应生成氢气.点评:
本题考点: 浓硫酸的性质实验.
考点点评: 本题是实验探究题,既有气体的制取又有气体的除杂和气体的吸收,还有气体的检验,综合性比较强,注意实验原理的掌握,难度中等.1年前查看全部
- 市售浓硫酸中H2SO4的物质的量浓度为18.4mol•L-1,H2SO4的质量分数为98%.计算该浓硫酸的密度.
 lijun01041年前1
lijun01041年前1 -
 蓝蓝的天啊 共回答了17个问题
蓝蓝的天啊 共回答了17个问题 |采纳率94.1%解题思路:根据c=[1000ρw/M]可知,该硫酸的密度ρ=[cM/1000w],据此计算.市售浓硫酸中H2SO4的物质的量浓度为18.4mol•L-1,H2SO4的质量分数为98%,根据c=[1000ρw/M]可知,该硫酸的密度ρ=[cM/1000w]=[18.4×98/1000×98%]g/mL=1.84g/mL,
答:该市售硫酸的密度为1.84g/L.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题以密度计算为载体,考查物质的量浓度的有关计算,可以利用定义法计算密度,但过程比较繁琐,注意掌握物质的量浓度与质量分数的关系.1年前查看全部
- 用18.4mol•L-1的浓硫酸,配制 100ml 1.0mol•L-1的稀硫酸,请回答以下问题:
用18.4mol•L-1的浓硫酸,配制 100ml 1.0mol•L-1的稀硫酸,请回答以下问题:
(1)需要18.4mol•L-1的浓硫酸______mL.
(2)下列哪组仪器在配制时不需要用到______
①托盘天平②分液漏斗③250ml容量瓶④烧杯⑤胶头滴管 ⑥量筒⑦玻璃棒⑧铁架台(带铁夹)⑨100ml容量瓶
A.③④⑤⑦⑨B.①②⑤⑥⑧C.①②③⑧D.③④⑤⑥
(3)下列实验步骤中,正确的操作顺序应该是:______
A.用量筒量取浓硫酸,缓缓倒入装有约50ml蒸馏水的烧杯里,并用玻璃棒搅拌.
B.用约30ml蒸馏水,分出三次洗涤烧杯和玻璃棒,将每次洗涤液都倒入容量瓶中;
C.将稀释后的硫酸小心地倒入容量瓶中;
D.检查100ml容量瓶瓶口是否有漏液现象;
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1--2cm处;
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液;
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,至液面最低点与刻度线相切;
(4)进行A步骤操作的时候,应该选用______
①10ml量筒②50ml量筒③5000ml量筒④1000ml量筒
(5)进行A步操作后,必须______后,才能进行C步操作. snow2401年前1
snow2401年前1 -
 眉兰 共回答了15个问题
眉兰 共回答了15个问题 |采纳率93.3%解题思路:(1)根据溶液稀释定律C浓V浓=C稀V稀来计算;
(2)根据操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作来选择仪器;
(3)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序; (4)根据“大而近”的原则,根据需要量取的浓硫酸的体积来选择合适的量筒;
(5)浓硫酸稀释放热,故必须冷却后再移液.(1)设需要的浓硫酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:18.4mol/L×VmL=100ml×1.0mol/L,解得V=5.4mL,故答案为:5.4;
(2)操作步骤有计算、量取、稀释、洗涤、定容、摇匀等操作,一般用10mL的量筒量取浓硫酸5.4ml,在烧杯中稀释(可用量筒量取水加入烧杯),并用玻璃棒搅拌.冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有10mL量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,故不需要的仪器为:①②③⑧,故选C;
(3)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知正确的操作顺序是:DACBEGF;故答案为:DACBEGF;
(4)由于需要量取的浓硫酸的体积为5.4ml,根据“大而近”的原则,故选择10ml的量筒,故答案为:①;
(5)浓硫酸稀释放热,故必须冷却至室温后再移液,故答案为:冷却至室温.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.1年前查看全部
- 市售浓硫酸中H2SO4的物质的量浓度为18.4mol•L-1,H2SO4的质量分数为98%.计算该浓硫酸的密度.
 秋意瑟瑟1年前1
秋意瑟瑟1年前1 -
 九方节度使 共回答了15个问题
九方节度使 共回答了15个问题 |采纳率100%解题思路:根据c=[1000ρw/M]可知,该硫酸的密度ρ=[cM/1000w],据此计算.市售浓硫酸中H2SO4的物质的量浓度为18.4mol•L-1,H2SO4的质量分数为98%,根据c=[1000ρw/M]可知,该硫酸的密度ρ=[cM/1000w]=[18.4×98/1000×98%]g/mL=1.84g/mL,
答:该市售硫酸的密度为1.84g/L.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题以密度计算为载体,考查物质的量浓度的有关计算,可以利用定义法计算密度,但过程比较繁琐,注意掌握物质的量浓度与质量分数的关系.1年前查看全部
- 现用18.4mol•L-1的浓硫酸来配制500mL 0.2mol•L-1的稀硫酸,可供选择的仪器有:①玻璃棒&
现用18.4mol•L-1的浓硫酸来配制500mL 0.2mol•L-1的稀硫酸,可供选择的仪器有:①玻璃棒 ②烧杯 ③胶头滴管 ④量筒 ⑤容量瓶 ⑥托盘天平⑦药匙
(1)上述仪器在配制过程中不需要用到的是______.(填序号)
(2)计算所需浓硫酸的体积为______.现有①10mL ②50mL ③100mL三种规格的量筒,应当选用______.(填序号)
(3)实验中两次用到玻璃棒,其作用分别是:______、______.
(4)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却.其正确的操作顺序为______.(填序号)
(5)在配制过程中,下列操作可引起所配溶液浓度偏高的有______.(填序号)
①洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中.
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中.
③转移前,容量瓶中含有少量蒸馏水.
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒.
⑤定容时,俯视刻度线. 这老A的ii1年前1
这老A的ii1年前1 -
 拥竹已足 共回答了22个问题
拥竹已足 共回答了22个问题 |采纳率95.5%解题思路:(1)根据配制500mL 0.2mol•L-1的稀硫酸的仪器选择使用仪器,然后判断不需要的仪器;
(2)根据溶液稀释过程中溶质读到物质的量不变计算出需要浓硫酸的体积,根据计算结果判断量筒规格;
(3)根据配制过程中玻璃棒的作用进行解答;
(4)根据配制一定物质的量浓度的溶液的步骤进行排序;
(5)根据c=[n/V]可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.(1)配制500mL 0.2mol•L-1的稀硫酸使用的仪器有:量筒、玻璃棒、烧杯、500mL容量瓶、胶头滴管,所以不需要的仪器为:⑥托盘天平⑦药匙,
故答案为:⑥⑦;
(2)500mL 0.2mol•L-1的稀硫酸中含有溶质硫酸的物质的量为:0.2mol•L-1×0.5L=0.1mol,需要18.4mol•L-1的浓硫酸的体积为:[0.1mol/18.4mol/L]≈0.054L=5.4mL,应该选用10mL量筒,
故答案为:5.4mL; ①;
(3)配制一定物质的量浓度的溶液过程中,稀释浓硫酸时使用玻璃棒搅拌,加速稀释过程;转移溶液时使用玻璃棒引流,避免液体流到容量瓶外面,
故答案为:搅拌;引流;
(4)配制一定物质的量浓度的溶液步骤为:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,所以正确顺序为:②①③⑧⑤⑥⑦④,
故答案为:②①③⑧⑤⑥⑦④;
(5)①洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中,用于量取溶液的量筒不能洗涤,否则导致量取的液体体积偏大,根据c=[n/V]可得,配制的溶液浓度偏高,故①正确;
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中,热的溶液体积偏大,冷却后溶液体积偏小,根据c=[n/V]可得,配制的溶液浓度偏高,故②正确;
③转移前,容量瓶中含有少量蒸馏水,对溶质的物质的量及溶液的体积没有影响,根据c=[n/V]可得,不影响配制结果,故③错误;
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒,导致配制的溶液中溶质的物质的量偏小,根据c=[n/V]可得,配制的溶液浓度偏低,故④错误;
⑤定容时,俯视刻度线,导致加入的蒸馏水体积偏小,根据c=[n/V]可得,配制的溶液浓度偏高,故⑤正确;
故答案为:①②⑤.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,试题基础性强,贴近高考,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,注意明确误差分析的方法.1年前查看全部
- 为探究足量锌与18.4mol•L-1浓硫酸的反应,某研究小组进行如下实验.
为探究足量锌与18.4mol•L-1浓硫酸的反应,某研究小组进行如下实验.
[实验I]反应生成物成分的定性探究
取65.0g锌粒与98%的浓H2SO4(ρ=1.84g•mL-1)110m充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质.
(1)研究小组所制得的气体中混有的主要杂质气体可能是:______(填分子式).产生这种结果的主要原因是:______(用化学方程式和必要的文字加以说明)
(2)为证实相关分析,该化学小组的同学设计实验,组装了图1装置,对所制了的气体进行探究.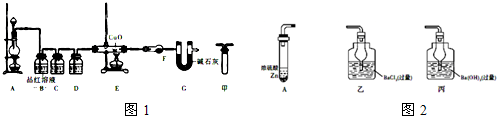
①装置C中加入的试剂是:______;装置D中加入的试剂是:______.
②装置F中加入的试剂是:______;U型管G的作用为:______.
③有同学认为A、B间应增加图中的甲装置,该装置的作用为:______.
[实验II]硫酸浓度与生成气体成分的定量探究
为了定量测定浓硫酸具有强氧化性的最低浓度,设计的实验方案为:取18.4mol•L-1浓硫酸aml与足量的锌于A中反应,将生成的气体通入某溶液并测 定生成沉淀的质量.
(1)A中产生的气体应通入图2中的______(填“乙”或“丙”)装置.
(2)有同学认为要减小实验误差,需要增加一个将反应生成的SO2全部排出的操作.但也有同学认为没有必要,其理由是:______. 狂踩韩美美的脸1年前1
狂踩韩美美的脸1年前1 -
 zhangyanbo2006 共回答了17个问题
zhangyanbo2006 共回答了17个问题 |采纳率82.4%解题思路:实验Ⅰ、(1)足量锌与18.4mol•L-1浓硫酸的反应,随反应进行浓硫酸变稀后,锌和稀硫酸反应生成氢气;
(2)A是制取气体的装置,制备的气体中有二氧化硫、氢气、水蒸汽,B装置是除去二氧化硫,可以用氢氧化钠等碱液吸收;C装置是检验二氧化硫是否除尽,D装置是浓硫酸,吸水干燥作用;E装置是用还原性气体还原氧化铜,F装置无水硫酸铜,检验是否有水生成;G是防止空气中H2O进入干燥管而影响杂质气体的检验;A、B间应增加图中的甲装置是安全装置防止倒吸的作用;
实验Ⅱ、(1)A产生的气体为二氧化硫和氢气,通入某溶液并测 定生成沉淀的质量,需要和二氧化碳反应生成沉淀,乙不与二氧化硫反应,丙和二氧化硫反应生成亚硫酸钡沉淀;
(2)锌过量,随反应进行,浓硫酸浓度减小变为稀硫酸后和锌反应生成的气体为氢气,可以利用氢气把二氧化硫全部排出;实验I、(1)随着硫酸浓度降低,锌与稀硫酸反应生成氢气,所以化学小组所制得的气体中混有的主要杂质气体可能是氢气,故答案为:H2;随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2:Zn+H2SO4═ZnSO4+H2↑...
点评:
本题考点: 浓硫酸的性质实验.
考点点评: 本题考查了浓硫酸的性质分析和实验验证方法,过量锌和浓硫酸反应生成的气体是二氧化硫和氢气是分析关键,题目难度中等.1年前查看全部
- 用18.4mol•L-1 H2SO4配制成500mL 1mol•L-1 H2SO4溶液时,不需要用到
用18.4mol•L-1 H2SO4配制成500mL 1mol•L-1 H2SO4溶液时,不需要用到的仪器是( )
A.玻璃棒
B.胶头滴管
C.托盘天平
D.500mL容量瓶 langdeyouhuo3301年前1
langdeyouhuo3301年前1 -
 俏货 共回答了22个问题
俏货 共回答了22个问题 |采纳率72.7%解题思路:根据操作步骤选取实验仪器,浓硫酸稀释配制步骤有计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等操作.在用浓硫酸配制1mol/L硫酸溶液的实验中,一般用量筒量取浓硫酸,浓硫酸在烧杯中稀释并用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以使用的仪器有量筒、烧杯、玻璃棒、容量瓶、胶头滴管,不需要的仪器是托盘天平.
故选C.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了配制一定物质的量浓度溶液所需仪器的选择,难度不大,注意根据实验步骤选取实验仪器这样既不漏、也不重.1年前查看全部
- 用18.4mol•L-1的浓硫酸配制100mL浓度为1mol•L-1的稀硫酸,其操作步骤可分解为以下几步:
用18.4mol•L-1的浓硫酸配制100mL浓度为1mol•L-1的稀硫酸,其操作步骤可分解为以下几步:
A.用量筒量取5.4mL的浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌.
B.用约30mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将每次洗涤液都倒入容量瓶里.
C.将稀释后的硫酸小心地用玻璃棒引流入容量瓶.
D.检查100mL 容量瓶口是否发生滴漏.
E.将蒸馏水直接加入容量瓶,至液面接近刻度线2cm至3cm处.
F.盖紧瓶塞,反复倾倒振荡,摇匀溶液.
G.用胶头滴管向容量瓶里逐滴滴入蒸馏水,至液面最低点恰好与环形刻度线相切.
据此填写:
(1)正确的操作顺序是______.
(2)进行A步操作时,选用量筒的规格是(填序号)______.
A.10mLB.50mL C.100mL D.1000mL
(3)如果对装有浓硫酸的量筒仰视读数为5.4mL,配制的稀硫酸的浓度将______
(填“偏高”“偏低”或“无影响”).
(4)进行A步骤操作时,必须______后,才能进行后面的操作.
(5)配制上述溶液时,下列操作会导致所配溶液的浓度偏高的是______.
A.洗涤烧杯和玻璃棒的溶液未转入容量瓶
B.定容时,眼睛俯视溶液将凹液面最低点与容量瓶刻度线相切
C.容量瓶中原残留少量蒸馏水
D.定容后容量瓶液面低于刻度线,又加水定容到刻度线. iamcaoli1年前1
iamcaoli1年前1 -
 我真是太cj了 共回答了17个问题
我真是太cj了 共回答了17个问题 |采纳率100%解题思路:(1)根据用浓溶液配置稀溶液的一般操作步骤分析;(2)量筒的选择规格遵循“大而近”的原则;(3)量筒仰视读数,量取的液体体积偏大,溶质的质量偏多;(4)转移溶液时应将溶液的温度恢复至室温;(5)根据c=nV计算不当操作对n或V的影响,如果n偏大或V偏小,则所配制溶液浓度偏高;(1)配制顺序是:计算→量取→稀释、冷却→移液→定容→摇匀→装瓶→贴签;
故答案为:DACBEGF;
(2)量取5.4ml溶液应选择10ml的量筒;
故选:A;
(3)因量筒仰视读数,量取的液体体积偏大,溶质的质量偏多,浓度偏大;
故答案为:偏高;
(4)因转移溶液时应将溶液的温度恢复至室温;
故答案为:冷却到室温;
(5)A.洗涤烧杯和玻璃棒的溶液未转入容量瓶,溶质的物质的量偏小,溶液的浓度偏小,故A错误;
B.定容时,眼睛俯视溶液将凹液面最低点与容量瓶刻度线相切,溶液的体积偏小,溶液的浓度偏高,故B正确;
C.容量瓶中原残留少量蒸馏水,对溶质的物质的量和溶液的体积都不会产生影响,溶液的浓度不变,故C错误;
D.定容后容量瓶液面低于刻度线,又加水定容到刻度线,导致溶液的体积偏大,溶液的浓度偏小,故D错误;
故选:B.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制的计算、步骤以及误差分析,难度不大,注意实验的基本操作方法和注意事项,误差分析是易错点.1年前查看全部
- 用18.4mol•L-1的浓硫酸配制100mL1.0mol•L-1稀硫酸,
用18.4mol•L-1的浓硫酸配制100mL1.0mol•L-1稀硫酸,
(A)用量筒取______mL浓H2SO4缓缓注入装有约50mL蒸馏水的烧杯中,并用玻璃棒不断搅拌
(B)用约30mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将每次洗液都倒入100mL容量瓶里
(C)将稀释后H2SO4小心倒入100mL容量瓶里
(D)检查100mL容量瓶口部是否会发生滴漏
(E)将蒸馏水直接加入容量瓶,至液面接近刻度线______处
(F)盖紧瓶塞,反复颠倒振荡,摇匀溶液
(G)用______向容量瓶里逐滴滴入蒸馏水,至液面最低点恰好和环形刻度线相切
据此填写:(1)填写上述各步的空白处.
(2)正确的操作顺序是(字母填写)______.
(3)实验时选用的仪器有(填序号)______.
A.100mL量筒B.托盘天平C.玻璃棒D.50mL容量瓶
E.10mL量筒F.胶头滴管G.50mL烧杯H.100mL容量瓶
(4)配制过程中,下列情况会使配制结果偏高的是______(填序号)
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线. laotu19761年前1
laotu19761年前1 -
 双飞-客 共回答了15个问题
双飞-客 共回答了15个问题 |采纳率100%解题思路:(1)依据稀释前后溶液的物质的量不变计算需要浓硫酸的体积;
依据定容的正确操作解答E、G;
(2)依据配置一定物质的量浓度溶液的一般步骤解答;
(3)根据配制100mL 1.0mol•L-1稀硫酸的步骤选择使用的仪器,然后选出需要使用的仪器序号;
(4)根据实验操作对溶质的物质的量和溶液的体积的影响,依据c=[n/V]判断配制过程中产生的误差情况.(1)设需要浓硫酸体积为V,依据稀释前后溶液的物质的量不变得V×18.4mol•L-1=100mL×1.0mol•L-1,解得V=5.4ml;
定容时,将蒸馏水直接加入容量瓶,到离刻度线1-2cm时,为防止加水过多,应改用胶头滴管逐滴滴加到凹液面最低处与刻度线相切;
故答案为:5.4;1-2cm;胶头滴管;
(2)用浓溶液配置稀溶液的一般步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,
故答案为:ADCBEF;
(3)依据配置一定物质的量浓度溶液的一般步骤计算、量取、稀释、冷却、移液、洗涤、定容、摇匀,可知用到的仪器有:A.100mL量筒、C.玻璃棒、E.10mL量筒、F.胶头滴管、G.50mL烧杯、H.100mL容量瓶;
故答案为:ACEFGH;
(4)①定容时俯视刻度线观察液面,导致溶液的体积偏小,溶液的浓度偏大,故①正确;
②容量瓶使用时未干燥,对溶质的物质的量和溶液的体积都不会产生影响,故②错误;
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线,导致溶液的体积偏大,溶液的浓度偏低,故③错误;
故选:①.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了配制一定物质的量浓度的溶液方法,题目难度不大,熟悉配置原理和过程是解题关键,注意掌握配制一定浓度溶液步骤及误差分析方法.1年前查看全部
- 现用18.4mol•L -1 的浓硫酸来配制500mL0.2mol•L -1 的稀硫酸,可供选择的仪器有:
现用18.4mol•L -1 的浓硫酸来配制500mL0.2mol•L -1 的稀硫酸,可供选择的仪器有:
①玻璃棒 ②烧杯 ③胶头滴管 ④量筒 ⑤托盘天平
(1)上述仪器在配制过程中不需要用到的是______.(填序号)除上述仪器外,尚缺最重要的仪器是______.
(2)计算所需浓硫酸的体积为______mL(保留1位小数).
(3)实验中用到玻璃棒,其作用分别是:______、______.
(4)配制时,一般可分为以下几个步骤:
①量取②计算③稀释④摇匀⑤转移⑥洗涤⑦定容⑧冷却.
其正确的操作顺序为:②→①→③→______→______→______→______→④(填序号)
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有______(填序号)
①定容时,仰视刻度线.
②未冷却至室温就转移到容量瓶中.
③容量瓶中含有少量蒸馏水.
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒.
⑤定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线. 乖狼儿1年前1
乖狼儿1年前1 -
 还有鱼999 共回答了16个问题
还有鱼999 共回答了16个问题 |采纳率81.3%(1)配制500mL0.2mol•L -1 的稀硫酸使用的仪器有:量筒、玻璃棒、烧杯、500mL容量瓶、胶头滴管,所以不需要的仪器为⑤托盘天平;还缺少的仪器为:故答案为:⑤;500mL容量瓶;(2)500mL0.2mol•L -1 的稀硫酸...1年前查看全部
- (2013•宜宾模拟)将Cu与CuO的混合物20.8g加入到50mL 18.4mol•L-1浓H2SO4中,加
(2013•宜宾模拟)将Cu与CuO的混合物20.8g加入到50mL 18.4mol•L-1浓H2SO4中,加热充分反应至固体物质完全溶解(产生气体全部逸出),冷却后将溶液稀释至1000ml,测得c(H+)=0.84mol•L-1.若要使稀释后溶液中的Cu2+沉淀完全,应加入6.0mol•L-1的NaOH溶液的体积为( )
A.1OOmL
B.160mL
C.240mL
D.307mL dr40081年前1
dr40081年前1 -
 comb_hunter 共回答了23个问题
comb_hunter 共回答了23个问题 |采纳率82.6%解题思路:由题意可知,Cu与CuO的混合物与硫酸反应硫酸有剩余,溶液中氢离子来源于剩余的硫酸,则n剩余(H2SO4)=[1/2]n(H+),设混合物中含铜、氧化铜的物质的量分别为x、y,表示出二者反应消耗的硫酸及生成的二氧化硫,根据二者质量与消耗的硫酸列方程计算,Cu2+刚好沉淀完全,此时溶液中溶质为Na2SO4,根据钠离子守恒n(NaOH)=2n(Na2SO4),根据硫原子守恒可得n(Na2SO4)=n原来(H2SO4)-n(SO2),据此计算解答.反应剩余硫酸的物质的量为:[1/2]×0.84 mol/L×1 L=0.42 mol,
设混合物中含铜、氧化铜的物质的量分别为x、y,则:
Cu+2H2SO4(浓)
△
.
CuSO4+SO2↑+2H2O
12 1
x2x x
CuO+H2SO4═CuSO4+H2O
11
yy
所以,2x+y=18.4 mol/L×0.05 L-0.42 mol=0.5 mol
64g/mol•x+80g/mol•y=20.8g
解得:x=0.2 mol,y=0.1 mol
n(SO2)=0.2 mol,
1000 mL溶液中SO42-的总量为18.4 mol/L×0.05 L-0.2 mol=0.72 mol,Cu2+刚好沉淀完全,此时溶液中溶质为Na2SO4,根据钠离子守恒n(NaOH)=2n(Na2SO4),故需要n(NaOH)=2n(Na2SO4)=0.72mol×2=1.44mol,所以沉淀Cu2+所需氢氧化钠的体积=[1.44mol/6mol/L]=0.24 L=240mL,
故选C.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的有关计算,难度中等,注意利用守恒法进行计算,侧重对学生思维能力、分析解决问题能力的考查.1年前查看全部
大家在问
- 1运油的油罐车一次能最多满21t密度0.8x10的3次方kg/立方米的90#汽油.90#汽油的价格为4元/升.(1升=10
- 2四季 作文
- 3英语翻译At the 1996 Olympic Games,he won the Men's Table Tennis
- 4默写。(5分)小题1:复行数十步,
- 5对于函数y=(m-4)x+(m2-16),当m=______时,它是正比例函数;当m______时,它是一次函数.
- 6设函数f(x)=分段函数①2^x+a(x大于2)②x+a^2(x小于等于2) 若f(x)的值域为R,则常数a的取值范围是
- 7一质量为M的探空气球在匀速下降,若气球所受浮力F始终保持不变,气球在运动过程中所受阻力仅与速率有关,重力加速度为g.现欲
- 8译in some cases,deserts are the creation of destruction
- 9用下列简单机械,使重量同为G的物体都处于静止状态,不计摩擦、机械自重及绳的重量,其中用力最小的是 [
- 10参照物是以什么标准确定的,怎样才能又快又准的找到参照物?
- 11用指定方法解方程:用指定方法解方程:(1)(x-1²=4)【直接开平方法】;(2)x²+5x+3=0
- 12口腔 胃 小肠主要消化什么物质?胃 小肠 大肠主要吸收什么营养成分
- 13一座游泳池长50米,宽20米,深1.6米,在这座游泳池里贴瓷砖,瓷砖的表面积是多少平方米?如果瓷砖是边长
- 14初二数学 全等三角形 角平分线
- 15a little造句a little n.&adj.的句子 a little bit 的句子通俗易懂,初一能接受的
